БИОФИЗИКА, 2020, том 65, № 5, с. 872-877
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 543.645.9
НАНОКАПСУЛА НА ОСНОВЕ ПРИРОДНОГО МИНЕРАЛА
КЛИНОПТИЛОЛИТА С ОБОЛОЧКОЙ ИЗ ЛЕЦИТИНА
© 2020 г. А.Г. Погорелов*, Т.А. Степанова*, А.И. Панаит*, В.А. Балашов*,
А.А. Гулин**, ***, В.Н. Погорелова*
*Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, ул. Институтская, 3
**Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН,
119334, Москва, ул. Косыгина, 4
***Химический факультет Московского государственного университета имени М.В. Ломоносова,
119991 Москва, Ленинские горы, 1/3
E-mail: agpogorelov@rambler.ru
Поступила в редакцию 22.01.2020 г.
После доработки 19.05.2020 г.
Принята к публикации 04.06.2020 г.
Разработана технология получения в лабораторных условиях наночастиц природного клиноптило-
лита - минерала из семейства цеолитов. Размер цеолитовых частиц определяли методом сканиру-
ющей электронной микроскопии, а нанокапсул - посредством динамического рассеяния света.
Предложена методика нанесения на поверхность наночастицы слоя спирторастворимого фосфати-
дилхолина (лецитина). Адсорбцию лецитина частицами клиноптилолита изучали методом ультра-
фиолетовой спектрофотометрии. Показано, что образование комплекса фосфолипида и цеолита в
этиловом спирте имеет сложную кинетику, причем в начальной фазе регистрируется адсорбция ле-
цитина с последующей его десорбцией в растворитель.
Ключевые слова: нанокапсула, фосфатидилхолин (лецитин), клиноптилолит (цеолит), УФ-спектро-
метрия, сканирующая электронная микроскопия, динамическое рассеяние света.
DOI: 10.31857/S000630292005004X
тов в биомедицинских целях наиболее широко
Наиболее естественным способом введения в
используют клиноптилолит [13]. Пористая струк-
организм нерастворимых в воде соединений яв-
тура значительно увеличивает площадь внешней
ляется их потребление через желудочно-кишеч-
поверхности частиц данного цеолита, доступной
ный тракт. Данный прием особенно предпочти-
для адсорбции. Показан ряд положительных ка-
телен в случае необходимости непосредственной
честв этого минерала - действие его как антиок-
доставки веществ в область гастроэнтерального
сиданта [14], противовоспалительного агента [15]
эпителия [1]. Однако ожидаемый эффект может
или детоксиканта [16]. Отработан метод получе-
быть менее значимым, что обусловлено действи-
ния синтетических наночастиц цеолита в лабора-
ем ферментов (пептидазы, протеазы, амилазы,
липазы, нуклеазы) и кислотности (рН ~ 2÷8).
торных условиях [17-22], но их производство
ограничено малыми объемами, стоимостью ко-
Чтобы сохранить специфическую активность в
нечного продукта и необходимостью его очистки
условиях агрессивной среды желудка и просвета
от исходных ингредиентов, участвующих в реак-
кишечника, вводимые вещества преобразуют в
ции. Альтернативой синтетическому продукту
коллоид или суспензию наночастиц [2-6].
может быть природный цеолит, который добыва-
В качестве перспективных материалов при
ют в промышленных масштабах [12, 23].
создании капсулы, которая может служить плат-
формой для наноконтейнера, рассматривают
Поверхность наночастицы модифицируют с
неорганические вещества [7-9]. В их ряду нахо-
тем, чтобы обеспечить биосовместимость нано-
дятся цеолиты - алюмосиликаты, которыe при-
системы из твердого неорганического материала
меняются в пищевом производстве и в агротехно-
[24-26] или нерастворимого в воде плотного ве-
логиях [10-12]. Из семейства природных цеоли-
щества [27, 28] с мишенью. В случае слизистого
эпителия предъявляют требование сродства на-
Сокращениe: К/Ц - клиноптилолит/лецитиновый.
ночастицы и мукусного слоя, что способствует
872
НАНОКАПСУЛА НА ОСНОВЕ ПРИРОДНОГО МИНЕРАЛА КЛИНОПТИЛОЛИТА
873
ее закреплению на его поверхности. Мукоадге-
пользуя установку JFC-1600 (JEOL, Япония).
зивность обеспечивает покрытие частицы фос-
Условия режима напыления были подобраны эм-
фолипидом [29, 30], в частности фосфатидилхо-
пирически, но, в соответствии с калибровочной
лином - основным компонентом клеточной мем-
кривой, которая прилагается к руководству по
браны. Фосфолипидное покрытие также
эксплуатации прибора, при заданных параметрах
выполняет функцию поверхностно активного ве-
напыления формируется пленка толщиной 10 нм.
щества, что стабилизирует суспензию. Поэтому
Пленка тяжелого металла на поверхности препа-
капсулу, состоящую из цеолита (ядро) и фосфо-
рата значительно усиливает сигнал вторичных
липида (оболочка), рассматривают в качестве
электронов, снимает электростатический заряд и
многофункциональной платформы для последу-
предохраняет образец от нагрева, который может
ющего создания специализированного нанокон-
служит причиной его механического разрушения.
тейнера.
Тонкую структуру рельефа объекта изучали в ска-
Примером успешного использования алюмо-
нирующем электронном микроскопе JSM-6390A
(JEOL, Япония), при ускоряющем напряжении
силиката может быть исследование, в котором
25 кВ в режиме вторичных электронов.
изучали кристалл синтетического цеолита как ос-
нову транспортера для доставки нуклеиновых
Экстракция фосфатидилхолина. Для получения
кислот и органических молекул [24]. В цитируе-
экстракта фосфатидилхолина использовали пи-
мой работе применили покрытие из поли-L-ли-
щевую добавку Е322 марки «ADLEC» (Lecigran
зина, что сделало более эффективным транспорт
1000P, производитель - Cargill, Германия), кото-
наночастицы в культивируемую HeLa-клетку.
рая представляет собой смесь полярных фосфо-
Однако обзор доступной литературы показывает
липидов. Навеску препарата (600 мг) тщательно
отсутствие работ по созданию наноплатформы на
размешивали в 6 мл этилового спирта до состоя-
основе природного цеолита. Кроме того, нет дан-
ния однородной суспензии. Экстракцию лецити-
ных о том, как поведет себя фосфолипид при вза-
на проводили в этиловом спирте при комнатной
имодействии с наночастицами этого минерала.
температуре в течение суток, после чего нераство-
Таким образом, цель данной работы состояла в
ренный компонент отделяли центрифугировани-
том, чтобы разработать методику получения на-
ем при 600 g в течение 10 мин. Полученный ма-
норазмерных частиц природного клиноптилоли-
точный экстракт отбирали в чистую стеклянную
та и изучить сорбцию фосфатидилхолина полу-
герметичную пробирку, которую хранили при
ченными частицами.
4°С в темноте. Для экспериментов использовали
рабочий раствор, который представляет собой
маточный экстракт, разбавленный в 30 раз этило-
МЕТОДИКА ИССЛЕДОВАНИЯ
вым спиртом.
Предподготовка клиноптилолита. В работе ис-
УФ-спектрометрия. В ультрафиолетовой обла-
пользовали коммерческий препарат «Литовит М»
сти спектра поглощения фосфатидилхолина ре-
(НПФ «Новь», Новосибирск), который произве-
гистрируют три максимума:
200-210,
235 и
ден из природного минерала, добытого на Холин-
280 нм. Для измерений мы использовали пик по-
ском месторождении (Бурятия). Каскадная меха-
глощения карбонильными группами на длине
ническая активация позволяет промышленным
волны 235 нм. Выбор был обусловлен нестабиль-
способом очистить природный цеолит от приме-
ностью сигнала на длине волны 200-210 нм, а
сей и получить образец со 100%-м содержанием
также относительно низким уровнем пика на
активного компонента - клиноптилолита. На на-
280 нм. Оптическая плотность рабочего раствора
чальном этапе подготовки исходный препарат
лецитина на характерной длине волны (235 нм)
тщательно растирали в фарфоровой ступке при
составляет 0.76 единицы, что соответствует опти-
комнатной температуре. В результате получали
мальным условиям для аналитических измерений
пудру клиноптилолита, состоящую из частиц
на спектрофотометре Specord M40 (Carl Zeiss,
микронного размера.
Германия).
Сканирующая электронная микроскопия. Об-
разцы визуализировали посредством сканирую-
щей электронной микроскопии. Для этого сус-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
пензию частиц клиноптилолита в дистиллиро-
ванной воде
(30 мг/100 мл) обрабатывали
Наноядро из природного клиноптилолита. В ре-
предварительно ультразвуком в течение 40 с.
зультате предварительной подготовки препарата
Каплю суспензии (~2 мкл) наносили на поверх-
«Литовит М» получили образец, состоящий из ча-
ность держателя образцов электронного микро-
стиц микронного размера. В основу дальнейшей
скопа. Затем воду испаряли при комнатной тем-
процедуры положена низкотемпературная обра-
пературе в струе чистого воздуха, после чего на
ботка, для чего порошок микронных частиц кли-
поверхность образца наносили слой платины.
ноптилолита тщательно растирали в агатовой
Металл распыляли в среде аргоновой плазмы, ис-
ступке при температуре -35°С. Схематично по-
БИОФИЗИКА том 65
№ 5
2020
874
ПОГОРЕЛОВ и др.
комнатной температуры. Такой прием позволяет
исключить конденсацию на поверхность холод-
ного образца микрокапель воды из атмосферы,
что вызывает агрегацию наночастиц. Частицы
клиноптилолита визуализировали методом ска-
нирующей электронной микроскопии (рис. 2).
На рис. 2 приведены микрофотографии, де-
монстрирующие внешний вид препарата клиноп-
тилолита на разных этапах предложенной техно-
логии. Видно, что предобработка исходного пре-
парата (рис.
2а) дает частицы микронного
размера (рис. 2б). После низкотемпературной об-
работки следует избегать контакта холодного об-
Рис. 1. Последовательность получения нанораз-
разца с комнатной атмосферой, что вызывает аг-
мерных частиц клиноптилолита. В эксперименте
регацию наночастиц в субмикронные кластеры
использовали коммерческий препарат
«Литовит
(рис. 2в). При условии выполнения данного тре-
М» (НПФ «Новь», Новосибирск), который произ-
бования получаем готовый препарат частиц,
вели из природного минерала, добытого на Холин-
ском месторождении (Бурятия).
размер которых визуально можно оценить в
несколько десятков нанометров (рис. 2г). Ука-
занная величина соответствует размеру синтети-
следовательность получения наноразмерных ча-
ческого нанокристалла L-цеолита, что показано
стиц клиноптилолита приведена на рис. 1.
методом просвечивающей электронной микро-
скопии [24].
Полученную при низкой температуре пудру
переносили в парах жидкого азота в вакуумную
Клиноптилолит/лецитиновый комплекс. Исход-
камеру, где образец постепенно нагревали до но был определен интервал времени, необходи-
Рис. 2. Микрофотографии частиц клиноптилолита: (а) - исходный препарат «Литовит М»; (б) - порошок, полу-
ченный после размола препарата в фарфоровой ступке при комнатной температуре; (в) - микронные агрегаты
наночастиц, которые образуются после контакта пудры холодного препарата с атмосферными парами воды; (г) -
наноразмерные частицы, полученные после размельчения пудры в агатовой ступке при низкой температуре
(-35°С) с последующим плавным нагреванием препарата до комнатной температуры в вакууме.
БИОФИЗИКА том 65
№ 5
2020
НАНОКАПСУЛА НА ОСНОВЕ ПРИРОДНОГО МИНЕРАЛА КЛИНОПТИЛОЛИТА
875
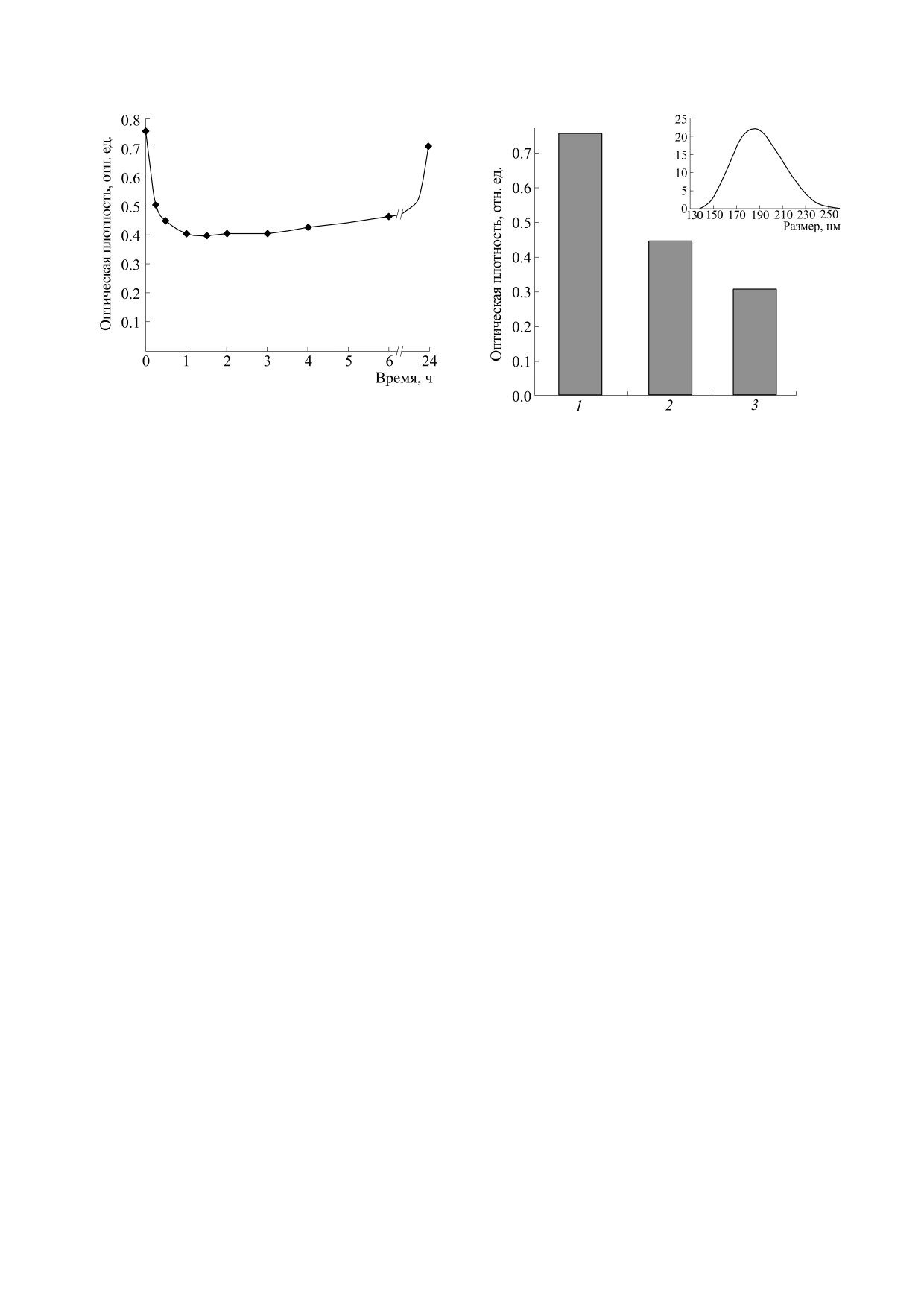
Рис. 3. Изменение со временем оптической плот-
ности на длине волны 235 нм в спектре поглощения
рабочего раствора лецитина в этиловом спирте при
Рис. 4. Изменение оптической плотности на длине
инкубации в нем наночастиц клиноптилолита.
волны 235 нм в спектре поглощения раствора леци-
тина в этиловом спирте: 1 - исходный рабочий рас-
твор лецитина, 2 - рабочий раствор лецитина после
1.5 ч инкубации в нем 20 мг наночастиц клинопти-
мый для завершения связывания лецитина кли-
лолита, 3 - раствор этилового спирта после 24 ч ин-
ноптилолитовым ядром. Исследование проводи-
кубации в нем капсул клиноптилолита, покрытых
ли следующим образом. Порцию наночастиц
лецитином. На врезке: распределение размера на-
нокапсул с ядром из клиноптилолита и лецитино-
клиноптилолита (20 мг) инкубировали при ком-
вой оболочкой, данные получены методом динами-
натной температуре в течение разного временно-
ческого светорассеяния.
го интервала (1/4 ч, 1/2 ч, 1 ч, 1.5 ч, 2 ч, 3 ч, 4 ч или
6 ч) в 4 мл рабочего раствора лецитина, переме-
шивая горизонтальным встряхиванием. Полу-
Клиноптилолит/лецитиновая капсула. Рассмат-
ченную суспензию центрифугировали при 600 g в
риваемая кинетика (рис. 3) достаточно медлен-
течение 10 мин. Затем в кварцевую кювету отби-
ная, с пролонгированным во времени выражен-
рали 3 мл надосадочной жидкости, которую ис-
ным экстремумом, что позволяет сепарировать
следовали методом УФ-спектрометрии. Связы-
К/Ц-комплекс. После образования комплекса
вание лецитина сопровождается уменьшением
(1.5 ч инкубации наночестиц в рабочем растворе)
его содержания в растворе, чему соответствует
К/Ц-суспензию центрифугировали
(600 g,
снижение оптической плотности на длине волны
10 мин). Осадок переносили в 15 мл бидистилли-
235 нм. На рис. 3 показана кривая изменения ве-
рованной воды с тем, чтобы за счет гидрофобных
личины данного параметра со временем при ин-
взаимодействий стабилизировать лецитиновую
кубации наночастиц клиноптилолита в рабочем
оболочку, а также отмыть несвязанный фосфати-
растворе лецитина.
дилхолин. В результате получили водную сус-
пензию капсул с клиноптилолитовым ядром и
Кинетика сорбции лецитина имеет сложный
лецитиновым покрытием. Наличие оболочки
характер (рис. 3). В интервале 1.5 ч оптическая
проверяли следующим образом. Полученную
плотность достигает минимального значения
суспензию центрифугировали (600 g, 10 мин), от-
(~0.4), что означает максимальный уровень свя-
бирали слой воды, а к осадку, содержащему К/Ц-
зывания фосфатидилхолина. Образование кли-
капсулы, добавляли 3 мл этилового спирта. В те-
ноптилолит/лецитинового (К/Ц) комплекса реа-
чение последующих 24 ч лецитин полностью вы-
лизуется через адсорбцию, так как размер
ходит в раствор (рис. 3), что оценивали по увели-
(~0,2 нм) пор цеолита не позволяет молекулам
чению оптической плотности раствора на длине
фосфолипида диффундировать внутрь частицы.
волны 235 нм (рис. 4).
Отметим, что адсорбция обратима, так как со вре-
менем оптическая плотность раствора восстанав-
На диаграмме (рис. 4) приведены сравнитель-
ливается до начального уровня (рис. 3). Данный
ные данные. Можно видеть, что формирование
факт свидетельствует о десорбции лецитина с по-
К/Ц-комплекса (рис. 4, 2) снижает оптическую
верхности клиноптилолитового ядра. Неустойчи-
плотность исходного рабочего раствора лецитина
вость К/Ц-комплекса, возможно, обусловлена
(рис. 4, 1). В результате добавления к осадку К/Ц-
двумя разнонаправленными процессами: сорб-
капсул этилового спирта наблюдается десорбция
цией фосфолипида на поверхности частицы и его
лецитина (рис. 4, 3), что свидетельствует о нали-
последующим растворением в этиловом спирте.
чии оболочки. Отметим, что количество лецити-
БИОФИЗИКА том 65
№ 5
2020
876
ПОГОРЕЛОВ и др.
на, потраченного на формирование К/Ц-ком-
ФИНАНСИРОВАНИЕ РАБОТЫ
плекса (разница между значениями 1 и 2 на
Работу проводили в рамках Государственного
рис. 4), практически совпадает с его количеством,
задания ИТЭБ РАН № 075-00845-20-00. Развитие
выделенным при растворении оболочки К/Ц-
методов визуализации микрообъектов и подходов
капсулы (рис. 4, 3).
для УФ-спектрометрии фосфолипидов выполне-
Важным критерием является размер частиц
но при финансовой поддержке Российского на-
конечного продукта. К сожалению, трудно разра-
учного фонда (проект № 20-16-00019).
ботать адекватную методику подготовки препара-
та для визуализации К/Ц-комплекса методом
КОНФЛИКТ ИНТЕРЕСОВ
сканирующей электронной микроскопии. Пре-
пятствием служит лецитин оболочки, который
Авторы заявляют об отсутствии конфликта
разрушается в вакуумной камере прибора под
интересов.
пучком ускоренных электронов. Поэтому линей-
ный размер капсулы оценивали в водной суспен-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
зии методом динамического светорассеяния.
Видно (рис. 4, врезка), что исследуемый параметр
Настоящая работа не содержит описания ис-
варьирует в диапазоне 140-260 нм с максимумом
следований с использованием людей и животных
распределения в области 190 нм. Указанная вели-
в качестве объектов.
чина близка по значению размеру синтетического
нанокристалла L-цеолита после нанесения на его
СПИСОК ЛИТЕРАТУРЫ
поверхность оболочки из поли-L-лизина, что
также показано методом динамического свето-
1. M. Simonoska-Crcarevska, M. Glavas Dodov, and
рассеяния [24].
K. Goracinova, Eur. J. Pharmaceutics and Biopharma-
ceutics 68, 565 (2008).
Сочетание наноразмера и фосфолипидного
2. D. Render, T. Samuel, H. King, et al., J. Nanomaterials
покрытия является обязательным условием
2016, 1 (2016).
успешной диффузии частицы через барьерный
3. E. Allemann, J.-C. Leroux, and R. Gurny, Adv. Drug
слой слизи энтерального эпителия [31, 32]. Ука-
Delivery Rev. 34, 171 (1998).
занные критерии соблюдены при создании К/Ц-
4. Y. Hu, X. Jiang, Y. Ding, et al., Biomaterials 23, 3193
капсулы, которая может служить многофункцио-
(2002).
нальной платформой при создании нанотранс-
5. A. Jintapattanakit, V.B. Junyaprasert, S. Maob, et al.,
портера. Для этого можно использовать электро-
Int. J. Pharmaceutics 342, 240 (2007).
статическое взаимодействие лецитина оболочки
6. J. Zhu and R.C. Hayward, Angew. Chem. Int. Ed. 47,
с молекулой активного вещества или ее раствори-
2113 (2008).
мость в фосфолипиде. Однако следует учитывать
7. X. Yu, A. Khalil, P.N. Dang, et al., Adv. Funct. Mater.
не только свойства лецитинового покрытия, но и
24, 3082 (2014).
положительные качества клиноптололитового
8. S. Kar, J. Biotechnol. Biomater. 6, 3 (2016).
ядра К/Ц-капсулы, например, антиоксидантную
9. A. Stefanache, M. Ignat, C.A. Peptu, et al., Appl. Sci.
активность цеолита [14], его противовоспали-
7, 237 (2017).
тельное действие [15] или ионообменные харак-
10. D. Kojića, S. Pajevića, J A. Jovanović-Galovića, et al.,
теристики, что используют при детоксикации
J. Soil Sci. and Plant Nutrition 12, 113 (2012).
[16].
11. R.Y. Yada, N. Buck, R. Canady, et al., Food Science
Завершая обсуждение результатов, можно сде-
and Food Safety 13, 730 (2014).
лать следующие выводы. В лабораторных услови-
12. K. Bohacs, J. Faitli, L. Bokanyi, and G. Mucsi, Metall.
ях нами получены наночастицы природного кли-
Mater. 62 (2B), 1399 (2017).
ноптилолита. Предложенная процедура не требу-
13. A. Mastinu, A. Kumar, G. Maccarinelli, et al., Mole-
ет привлечения сложных технологий и больших
cules, 24, 1517 (2019).
затрат энергии. Однако обязательным условием
14. P. Pellegrino, B. Mallet, S. Delliaux, et al., Biochem.
является низкотемпературная обработка на за-
Biophys Res. Commun. 410, 478.
вершающих стадиях подготовки препарата нано-
15. L. Bacakova, M. Vandrovcova, I. Kopova, and I. Jirka,
частиц. Нами разработан метод формирования
Biomaterials Sci. 6, 974 (2018).
наноразмерной капсулы с цеолитовым ядром и
16. M. M. Selim, D. M. El-Mekkawi, R. M. M. Aboelenin,
оболочкой из лецитина с использованием экс-
et al., J. of Association of Arab Universities for Basic
тракта фосфатидилхолина в этиловом спирте.
and Applied Sciences 24, 19 (2017).
Учитывая физико-химические свойства струк-
17. E. B. G. Johnson and S. E. Arshad, Appl. Clay Sci. 98,
турных элементов капсулы, данная конструкция
215 (2014).
может быть использована в качестве многофунк-
18. M. A. Severance, Dissertation for the Degree of Doctor
циональной платформы при создании нанокон-
of Philosophy (Graduate School of The Ohio State
тейнера.
University, 2014).
БИОФИЗИКА том 65
№ 5
2020
НАНОКАПСУЛА НА ОСНОВЕ ПРИРОДНОГО МИНЕРАЛА КЛИНОПТИЛОЛИТА
877
19. Y. Tian, Thesis for the Degree of PhD (University of
26. L. E. Euliss, J. A. DuPont, S. Gratton, and J. DeSim-
St. Andrews, 2014).
one, Chem. Soc. Rev. 35, 1095 (2006).
27. A. Grenha, C. Remunan-Lopez, E. L. S. Carvalho,
20. S. Mintova, J. Grand, and V. Valtchev, Comptes Ren-
and B. Seijo, Eur. J. Pharmaceutics and Biopharma-
dus Chimie 19, 183 (2016).
ceutics 69, 83 (2008).
21. E. K. Tiburu, A. Salifu, E. O. Aidoo, et al., J. Nano
28. E. M. Shchukina and D. G. Shchukin, Curr. Opin.
Res. 48, 156 (2016).
Colloid Interface Sci. 17, 281 (2012).
22. L. Tosheva, S. Belkhair, M. Gackowski, et al., Colloids
29. G. Fricker, T. Kromp, A. Wendel, et al., Pharm. Res.
and Surfaces B: Biointerfaces 157, 254 (2017).
27, 1469 (2010).
30. F. Baldassarre, C. Allegretti, D. Tessaro, et al., Chem-
23. A. M. Elhassan, Int. J. Cur. Adv. Res. 5, 1304 (2016).
istry Select 1, 6507 (2016).
24. A. Bertucci, H. Lülf, D. Septiadi, et al., Adv. Health-
31. L. M. Ensign, R. Cone, and J. Hanes, Adv. Drug De-
care Mater. 3, 1812 (2014).
livery Rev. 64, 557 (2012).
25. L.-L. Li, R. Zhang, L. Yin, et al., Angew Chem. Int.
32. S. Kotta, A. W. Khan, K. Pramod, et al., Expert Opin.
Ed. Engl. 51, 6121 (2012).
Drug Deliv. 9, 585.
A Clinoptilolite Natural Mineral-Based Nanocapsule Surrounded
by a Shell Composed of Lecithin
A.G. Pogorelov*, T.A. Stepanova*, A.I. Panait*, V.A. Balashov*,
A.A. Gulin**, ***, and V.N. Pogorelova*
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
ul. Institutskaya 3, Pushchino, Moscow Region, 142290 Russia
**Semenov Federal Research Center of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
***Department of Chemistry, Lomonosov Moscow State University, Leninskye Gory 1/3, Moscow, 119991 Russia
We propose a paper on the preparation procedure of zeolite clinoptilolite natural mineral-based nanocapsules
in laboratory seting. The zeolite particle size distribution was determined in scanning electron microscopy
images and the nanocapsule size distribution was measured by dynamic light scattering. The method for coat-
ing of the nanoparticle surface with alcohol soluble phosphatidylcholine (lecithin) is presented. UV spec-
trometry was used to study the adsorption of lecithin on clinoptilolite nanoparticles. The kinetics of clinop-
tilolite/ lecithin complex was shown to exhibit intricate behavior, when phospholipids adsorption is followed
by its gradual desorption in ethanol solution.
Keywords: nanocapsule, phosphatidylcholine (lecithin), clinoptilolite (zeolite), UV spectrometry, scanning electron
microscopy, dynamic light scattering
БИОФИЗИКА том 65
№ 5
2020