БИОФИЗИКА, 2020, том 65, № 5, с. 886-902
БИОФИЗИКА КЛЕТКИ
УДК 577.3
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
© 2020 г. Г.Ю. Ризниченко, Н.Е. Беляева, А.Н. Дьяконова, И.Б. Коваленко, А.С. Маслаков,
Т.К. Антал, С.Н. Горячев, Т.Ю. Плюснина, В.А. Федоров, С.С. Хрущев, А.Б. Рубин
Биологический факультет Московского государственного университета имени М.В. Ломоносова»,
119991, Москва, Ленинские горы, 1/12
E-mail: riznich@biophys.msu.ru
Поступила в редакцию 05.02.2020 г.
После доработки 05.02.2020 г.
Принята к публикации 15.06.2020 г.
Процессы в энергопреобразующей фотосинтетической мембране осуществляют первичный этап
запасания солнечной энергии для дальнейшего использования в биосинтезе и других процессах в
живых системах. Представлен обзор последних работ по моделированию фотосинтетического элек-
тронного транспорта, выполненных на кафедре биофизики биологического факультета МГУ имени
М.В. Ломоносова. Для моделирования процессов на уровне макромолекул, их комплексов, молеку-
лярных ансамблей, на субклеточном и клеточном уровне используются модели различного типа.
Детальные кинетические модели путем фитирования модельных кривых по экспериментальным
данным позволяют оценивать вклад отдельных процессов в наблюдаемые процессы и идентифици-
ровать параметры системы. Метод Монте-Карло дает возможность имитировать процессы в ансам-
блях, состоящих из миллионов фотосинтетических цепей. Для исследования процесса образования
электрон-транспортных белок-белковых комплексов использованы методы броуновской и молеку-
лярной динамики. Совокупность используемых методов позволяет изучать принципы организации
мультимасштабной энергопреобразующей системы, каковой является система первичных процес-
сов фотосинтеза.
Ключевые слова: фотосинтез, электронный транспорт, кинетические модели, броуновская динамика,
молекулярная динамика, метод Монте-Карло.
DOI: 10.31857/S0006302920050063
происходят во встроенных в мембрану мульти-
Математические и компьютерные модели да-
ферментных комплексах фотосинтетических ре-
ют возможность интегрировать знания об отдель-
акционных центров (РЦ) фотосистемы I (ФС I) и
ных компонентах системы, оценивать значения
фотосистемы II (ФС II) [1-4]. Эксперименты на
параметров по данным экспериментов и изучать
разных типах фотосинтетических РЦ свидетель-
механизмы регуляции процессов трансформации
ствуют, что эти оптимизированные в процессе
вещества и энергии при фотосинтезе. Возмож-
ность прямой регистрации кинетики редокс-пре-
эволюции системы сохраняют постоянство своей
функциональной и структурной организации при
вращений отдельных компонентов системы в от-
разных способах выделения в широком диапазо-
вет на короткие вспышки света позволяет
не внешних воздействий. Выделенные из хлоро-
корректно ставить задачу идентификации пара-
пластов комплексы переносчиков и частицы с
метров модели по данным кинетических экспе-
риментов. В этом состоит основное преимуще-
фотосинтетическими РЦ сохраняют свои функ-
циональные и кинетические характеристики, в
ство моделей фотосинтетической системы по
том числе способность к разделению и стабилиза-
сравнению с большинством феноменологиче-
ции зарядов и к фотоиндуцированным конфор-
ских моделей метаболических сетей, где отсут-
мационным переходам.
ствует возможность непосредственно следить за
изменениями концентраций отдельных внутрен-
Перенос электрона между мультиферментны-
них метаболитов системы в реальном времени.
ми комплексами осуществляется подвижными
Процессы поглощения света, первичного раз-
переносчиками. Сопряженный перенос электро-
деления зарядов и стабилизации этих зарядов
нов и протонов от акцепторной части ФС II к ци-
тохромному комплексу осуществляют молекулы
Сокращения: ФС I - фотосистема I, ФС II - фотосистема II,
пластохинонов (PQ), способные в электрически
РЦ - реакционный центр, PQ - пластохинон, Рс - пла-
стоцианин, Fd - ферредоксин.
нейтральном состоянии (PQ или PQH2) диффун-
886
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
887
дировать в липидной мембране. Посредниками
гда скорость реакции можно считать пропорцио-
между цитохромным комплексом и ФС I являют-
нальной вероятности столкновений двух молекул
ся молекулы белка пластоцианина (Рс), диффун-
разного типа.
дирующие в люмене. Связь первичных процессов
В результате многочисленных эксперимен-
фотосинтеза с биохимическими процессами в
тальных исследований формировались представ-
строме хлоропласта осуществляют молекулы не-
ления о структуре фотосинтетической мембраны
большого белка ферредоксина (Fd), принимаю-
[1-3]. В конце 60-х годов XX века пришло пони-
щие электрон с ФС I. За счет получаемых от Fd
мание того факта, что компоненты фотосинтети-
электронов белок ферредоксин:НАДФ-редуктаза
ческой цепи не плавают свободно в цитоплазме.
восстанавливает молекулы НАДФ, необходимые
Фотосинтетические РЦ представляют собой
в цикле фиксации углерода. Формирующийся на
мультиферментные комплексы, встроенные в
тилакоидной мембране протонный градиент
мембрану, а взаимодействие фотосистем I и II
(ΔpH) используется АТФ-синтазой для синтеза
осуществляют подвижные переносчики. Эти зна-
АТФ из АДФ и неорганического фосфата. Регу-
ния вызвали к жизни появление моделей, где фо-
ляция соотношения синтезируемых восстанови-
тосинтетический РЦ рассматривается как единое
тельных эквивалентов НАДФ∙H и АТФ осуществ-
целое. В первых таких моделях [7, 8] перенос
ляется за счет активации или дезактивации цик-
электрона в пределах фотосинтетического реак-
лического электронного транспорта вокруг ФС I,
ционного центра ФС II рассматривался как стро-
в котором электрон с акцепторной части ФС I
го упорядоченный переход между состояниями
возвращается на цитохромный комплекс.
комплекса, отличающимися зарядами на отдель-
Кинетические параметры взаимодействия
ных компонентах этого комплекса, при этом
комплексов с подвижными переносчиками опре-
переход электрона с донорной на акцепторную
деляются как диффузией подвижного переносчи-
сторону комплекса инициируется светом. В
ка к соответствующему комплексу, так и вероят-
монографии [9] изложены математическое обос-
ностью «правильной» посадки (докинга) подвиж-
нование и методы анализа переноса электрона в
ного переносчика на соответствующий сайт на
мультиферментных комплексах. Применение
донорной или акцепторной стороне комплекса.
этого метода для описания процессов в выделен-
Важную роль здесь играют размеры, форма и
ных комплексах РЦ бактерий и фотосистем I и II
электростатические свойства переносчика, по-
описано в работах [10-15].
движного в соответствующем компартменте
(PQ - внутри мембраны, Рс - в люмене, Fd - в
В основу большинства современных моделей
стромальном пространстве), а также геометрия
переноса электрона в пределах ФС II положена
реакционного объема. Именно эти участки, где
модель обратимой радикальной пары [16-19], в
которой предполагается, что при освещении мо-
скорость переноса электрона зависит от про-
лекула хлорофилла фотосинтетического реакци-
странственной организации мембраны и характе-
ра диффузии переносчиков, могут быть объектом
онного центра Р680 находится в экситонном рав-
регуляции со стороны целой клетки. Эффектив-
новесии с молекулами хлорофилла антенны. В
ность взаимодействия в большой мере определя-
качестве переменных рассматриваются концен-
трации ФС II с уникальной комбинацией со-
ется электростатическими взаимодействиями ло-
стояний отдельных сайтов [20-26]. Сравнение с
кальных зарядов атомных групп на поверхности
донора и акцептора.
экспериментом, как правило, проводится по ин-
дукционным кривым флуоресценции, регистри-
Моделирование процессов различной приро-
руемым при разных режимах освещения. В рабо-
ды в единой системе первичных процессов фото-
тах последних лет [27-33] моделируются процес-
синтеза требует разных математических и ком-
сы не только в ФС II, но и дальнейший путь
пьютерных подходов.
электрона через ФС I, и сравниваются с экспери-
ментом также кинетические кривые окислитель-
КИНЕТИЧЕСКИЕ МОДЕЛИ
но-восстановительных превращений Р700 (по-
ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО
глощение в области 820 нм).
ТРАНСПОРТА
В работах [30, 31, 34-39] при описании процес-
Первые кинетические модели фотосинтеза [5,
сов переноса электрона в пределах мультифер-
6], как и модели других биохимических процес-
ментных комплексов, встроенных в фотосинте-
сов, были основаны на законе действующих масс,
тическую мембрану, используются обыкновен-
который гласит, что скорость взаимодействия
ные дифференциальные уравнения для
двух веществ пропорциональна произведению
вероятностей состояний этих комплексов. Состо-
концентраций этих веществ. Этот закон справед-
яния комплекса отличаются редокс-состояниями
лив только в случае полного перемешивания, ко-
отдельных его компонентов, а также наличием
гда достаточно большое число молекул каждого
пустых или заполненных сайтов, в которых могут
вещества свободно диффундируют в объеме. То-
«заякориваться» подвижные переносчики элек-
БИОФИЗИКА том 65
№ 5
2020
888
РИЗНИЧЕНКО и др.
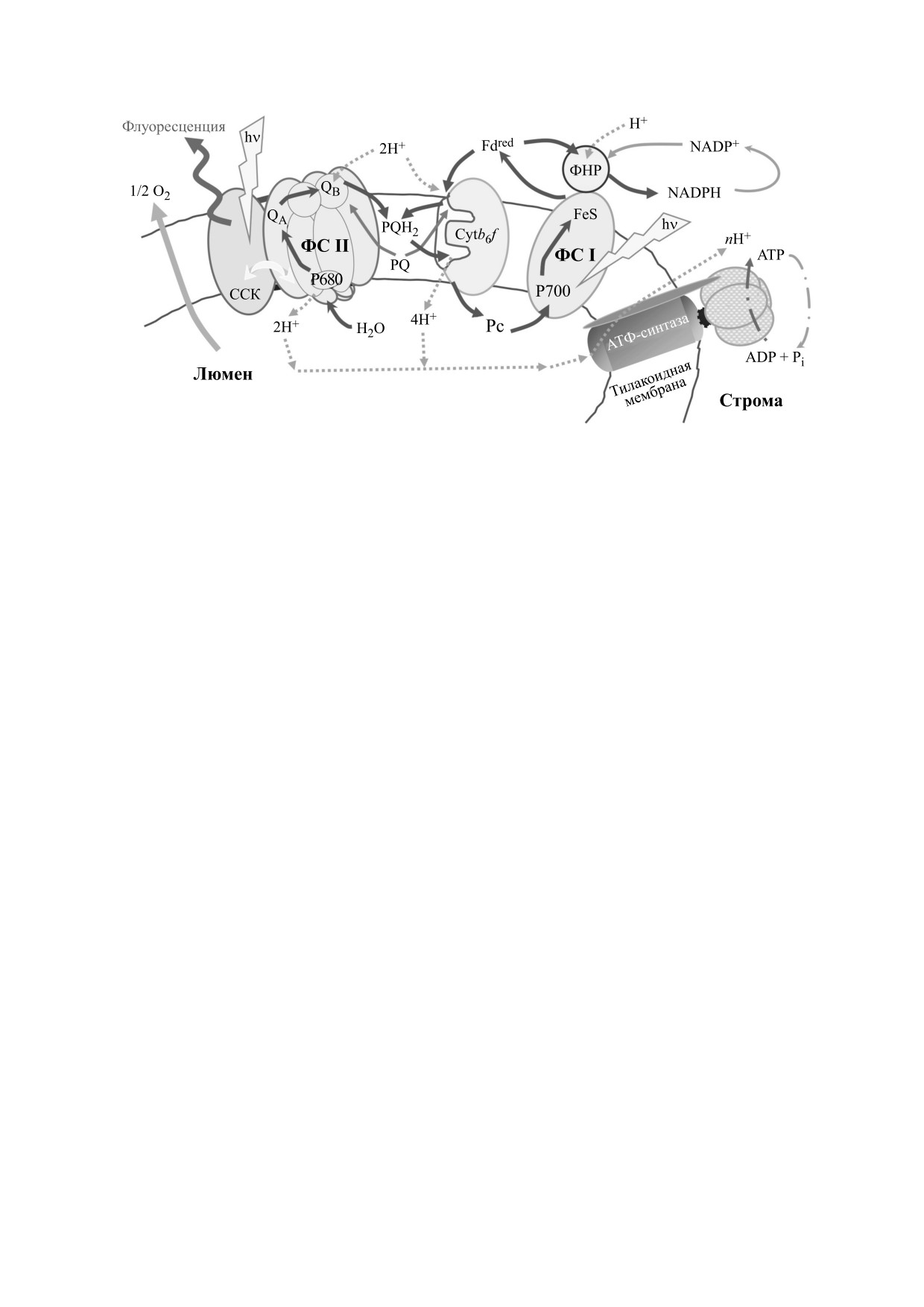
Рис. 1. Общая схема первичных процессов фотосинтеза. ССК - светособирающий комплекс, P680 и P700 - пигменты
реакционных центров фотосистем II и I, Cytb6f - цитохромный b6f-комплекс, ФНР - ферредоксин:НАДФ+-редукта-
за, QA и QB - первичный и вторичный хинонные акцепторы электронов ФС II, FeS - акцепторный комплекс ФС I,
PQ - пластохинон; PQH2 - пластохинол; Fd - ферредоксин, Pс - пластоцианин. Сплошными темными стрелками
показан перенос электронов по цепи электронного транспорта, пунктирными - потоки ионов H+.
трона (как в случае QB сайта ФС II), и наличием
ного донора Р680 через феофитин. Общеприня-
протонированных групп. Переходы между состо-
тая гипотеза, согласно которой интенсивность
яниями системы характеризует ориентирован-
флуоресценции полагали пропорциональной
ный граф переходов между состояниями, для ве-
концентрации QA-, была предложена в работе
роятностей которых записываются управляющие
[40], QA (quencher) исторически называли «туши-
уравнения (master equation), линейные относи-
телем» флуоресценции. Однако такой подход, да-
тельно вероятности нахождения комплекса в
вая в целом правильное феноменологическое
каждом из состояний. При этом константы ско-
описание, игнорирует физику моделируемых
ростей переходов между состояниями комплекса
процессов. Физический процесс флуоресценции
могут быть различны для комплексов в различ-
представляет собой испускание квантов соответ-
ных конформационных состояниях, для ком-
ствующей длины волны молекулами хлорофилла
плексов, локализованных в гранальной или стро-
антенны. Поэтому в наших работах мы полагаем
мальной частях тилакоида, а также могут зависеть
выход флуоресценции пропорциональным кон-
от других переменных и параметров системы:
центрации молекул хлорофилла антенны в воз-
концентрации протонов в люмене и строме, кон-
бужденном состоянии и сравниваем эксперимен-
центрации подвижных переносчиков (молекул
тальные кривые индукции флуоресценции с ди-
пула PQ на акцепторной стороне ФС II, Рс на лю-
намикой суммы концентраций тех состояний
минальной стороне ФС I и Fd на стромальной
комплекса ФС II, в которых хлорофилл антенны
стороне ФС I), температуры, трансмембранного
и реакционного центра находится в возбужден-
электрического потенциала и т.д. Поэтому в об-
ном состоянии. В ряде работ также учитывают
щем случае уравнения, описывающие переходы
флуоресценцию, исходящую от ФС I [27, 30,
между состояниями фотосинтетических мульти-
31, 42].
ферментных комплексов, являются нелинейны-
ми. Концентрация каждого состояния мульти-
ферментного комплекса равна произведению ве-
МОДЕЛЬ ПРОЦЕССОВ В ФОТОСИСТЕМЕ II
роятности этого состояния на концентрацию
Основную информацию о процессах в фото-
комплекса.
синтетической цепи представляет индукционная
Для сопоставления результатов моделирова-
кривая флуоресценции, источником которой яв-
ния с экспериментальными кривыми индукции
ляется фотосистема II. Индукционную кривую
флуоресценции традиционно интенсивность
флуоресценции остроумно назвали «подписью»
флуоресценции полагают пропорциональной
(signature) фотосинтеза [43].
концентрации «закрытых» РЦ. «Закрытым» на-
На рис. 1 дана схема состояний комплекса
зывают РЦ, имеющий электрон на QA и потому
ФС II, которая была использована для моделиро-
не способный принимать электроны от первич- вания процессов как в микроводорослях [37, 38],
БИОФИЗИКА том 65
№ 5
2020
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
889
так и в хлоропластах высших растений [30, 31, 39].
метров по экспериментальным данным не пред-
Подробное описание переходов между состояни-
ставляется возможным. Однако задача упрощает-
ями схемы ФС II дано в работе [39].
ся при некоторых специальных условиях
Формирование возбужденного состояния
эксперимента.
хлорофилла в модели определяется «световы-
Применение ингибиторов позволяет блокиро-
ми» константами kL = ki, i = 1, 5, 8, 12, 15, 19,
вать некоторые процессы (переходы между состо-
28, 32, пропорциональными интенсивности
яниями в системе). Другой путь - задать освеще-
действующего света. Интенсивность флуо-
ние в виде короткой вспышки, однократно при-
ресценции в модели задается константой
водящей систему в возбужденное состояние, и
kF = k-i. Выход флуоресценции рассчитыва-
затем наблюдать только процессы релаксации.
При освещении объекта короткой лазерной
ется как произведение отношения kF/kL на
вспышкой большая часть РЦ оказывается в воз-
сумму флуоресцирующих состояний:
бужденном состоянии, после чего происходит пе-
рераспределение зарядов в ФС II, сопровождаю-
k
F
F
=
⋅ (x
+
y
+
z
+
g
+
x
+
y
+
z
+
g
).
2
2
2
2
6
6
6
6
щееся изменением интенсивности флуоресцен-
k
L
ции. В лаборатории проф. Г. Ренгера (Берлин,
Важной особенностью разрабатываемых нами
Германия) разработана установка, использующая
моделей является учет влияния электрического и
освещение образца насыщающим импульсом
электрохимического потенциалов на мембране и
длительностью 10 нс. Импульс создает неравно-
процессов переноса электронов и ионов через
весное состояние в образце, после его окончания
мембрану [30].
измеряют сигнал флуоресценции в диапазоне
времени от 100 нс до 10 с. Таким образом, реги-
МОДЕЛИРОВАНИЕ КИНЕТИЧЕСКОЙ
стрируются кинетические кривые выхода флуо-
КРИВОЙ ИНДУКЦИИ ФЛУОРЕСЦЕНЦИИ
ресценции, вызываемые однократным импуль-
ПОСЛЕ ОСВЕЩЕНИЯ НАСЫЩАЮЩИМ
сом (Single flash induced transient of fluorescence
ЛАЗЕРНЫМ ИМПУЛЬСОМ
yield, SFITFY) [42].
Модель процессов в реакционном центре
C помощью кинетической модели изолиро-
ФС II (схема представлена на рис. 2) содержит
ванной ФС II выполнено фитирование данных
большое число параметров (констант скоростей
измерений на препаратах термофильного штамма
переходов между состояниями), многие из кото-
одноклеточной зеленой водоросли Chlorella
рых известны из независимых экспериментов на
pyrenoidosa Chick [37, 44], а также листьях Arabi-
выделенных фрагментах фотосистем. Часть пара-
dopsis thaliana [38] и шпината [39, 44]. Для каждого
метров, например скорость туннелирования
вида с помощью модели была проведена оценка
электрона между переносчиками, входящими в
констант скоростей отдельных реакций переноса
состав белковых комплексов, мало зависит от
электрона и энергетических потерь при безызлу-
внешних условий и определяется в основном
чательной рекомбинации разделенных зарядов в
структурой этих комплексов. Эти параметры
реакционном центре ФС II в зависимости от ин-
можно считать неизменными. Величины других,
тенсивности светового импульса.
например, константы скоростей безызлучатель-
На рис. 3 представлены экспериментальные
ной рекомбинации, не удается напрямую опреде-
данные, полученные в работе [42] на листьях Ara-
лить в эксперименте, однако имеются данные,
bidopsis thaliana (точки), и результаты фитирова-
что эти величины зависят от интенсивности осве-
ния (линии) для четырех различных интенсивно-
щения. В эксперименте не удается также одно-
стей лазерного импульса.
значно оценить константы взаимодействия ак-
В кинетических моделях Н.Е. Беляевой с соав-
цепторных компонентов ФС II с молекулами
торами количественно воспроизводится кинети-
пластохинонного пула, которые могут суще-
ка процессов в ФС II микроводорослей [37, 38, 44]
ственно зависеть от условий эксперимента, так
и высших растений [39, 44] после освещения на-
как на этих участках перенос электрона сопряжен
носекундной вспышкой и включения постоянно-
с переносом протонов и подвижностью молекул.
го освещения. Фитирование позволило оценить
Кроме того, параметрами модели являются на-
параметры системы, недоступные оценке непо-
чальные значения переменных, т. е. состояние
средственно из эксперимента. Параметры модели
электрон-транспортной цепи в начале экспери-
были разделены на две группы. Величины
мента, которое не всегда известно. Учитывая
констант скоростей электронного транспорта в
большое число уравнений в системе, строго и од-
мультиферментном комплексе ФС II в модели
нозначно решить задачу идентификации пара-
оставались неизменными для всех четырех вели-
БИОФИЗИКА том 65
№ 5
2020
890
РИЗНИЧЕНКО и др.
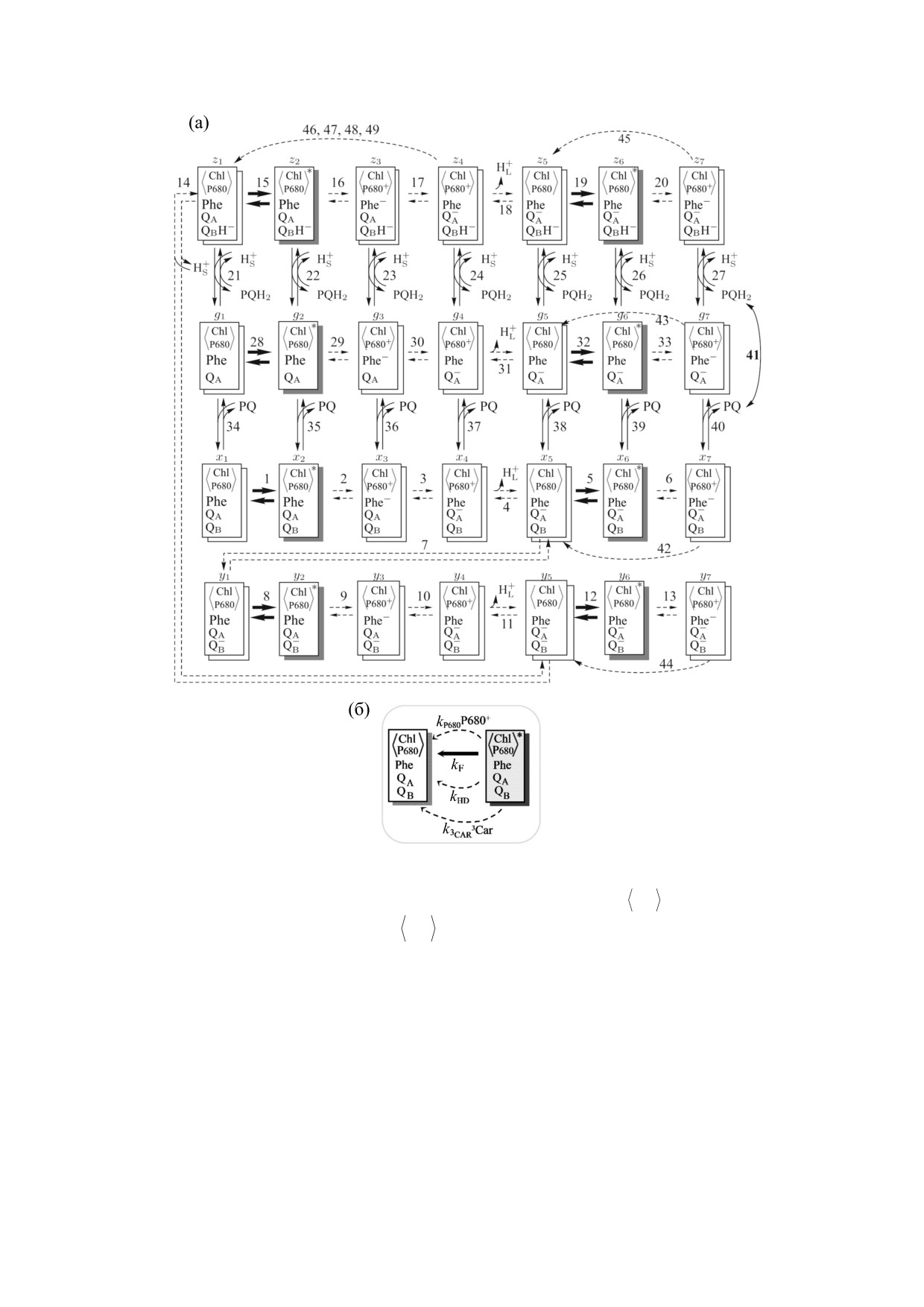
Рис. 2. (а) - Схема каталитического цикла ФС II. Каждый прямоугольник - кинетическое состояние ФС II,
Chl
определяемое редокс-состониями включенных в ФС II переносчиков электрона.
- весь хлорофилл ФС II,
P680
Chl
*
включая пигменты антенны и РЦ Р680;
P680
обозначает синглетные возбужденные состояния
1Chl*,
делокализованные на всех пигментах антенны и РЦ. Phe - первичный акцептор электронов феофитин; QA и QB -
первичный и вторичный хинонные акцепторы. PQ - пластохинон; PQH2 - пластохинол; HL+ - протоны в люмене, а
HS+ - протоны в строме тилакоида. Над прямоугольниками обозначены переменные модели (xi, yi, zi, gi, i = 1, ..., 7).
Затенены состояния, способные испускать квант флуоресценции. Пунктирными стрелками показаны быстрые (менее
1 мс) стадии цикла, жирными - световые стадии. Цифры над стрелками соответствуют номерам реакций.
Пунктирные дуги показывают необратимые реакции безизлучательной рекомбинации Phe- с P680+ (42-45), Q– с
P680+ (46-49) [37]. (б) - Переход 1Chl* в основное состояние: i) испускание флуоресценции (kF); ii) безызлучательная
диссипация синглетно возбужденных молекул хлорофилла посредством тушения, обусловленного катион-радикалом
P680+ и/или триплетными состояниями каротиноидов с константами скоростей kP680+ и k3Car соответственно; iii)
безызлучательная диссипация возбуждения в тепло (kHD) [37].
БИОФИЗИКА том 65
№ 5
2020
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
891
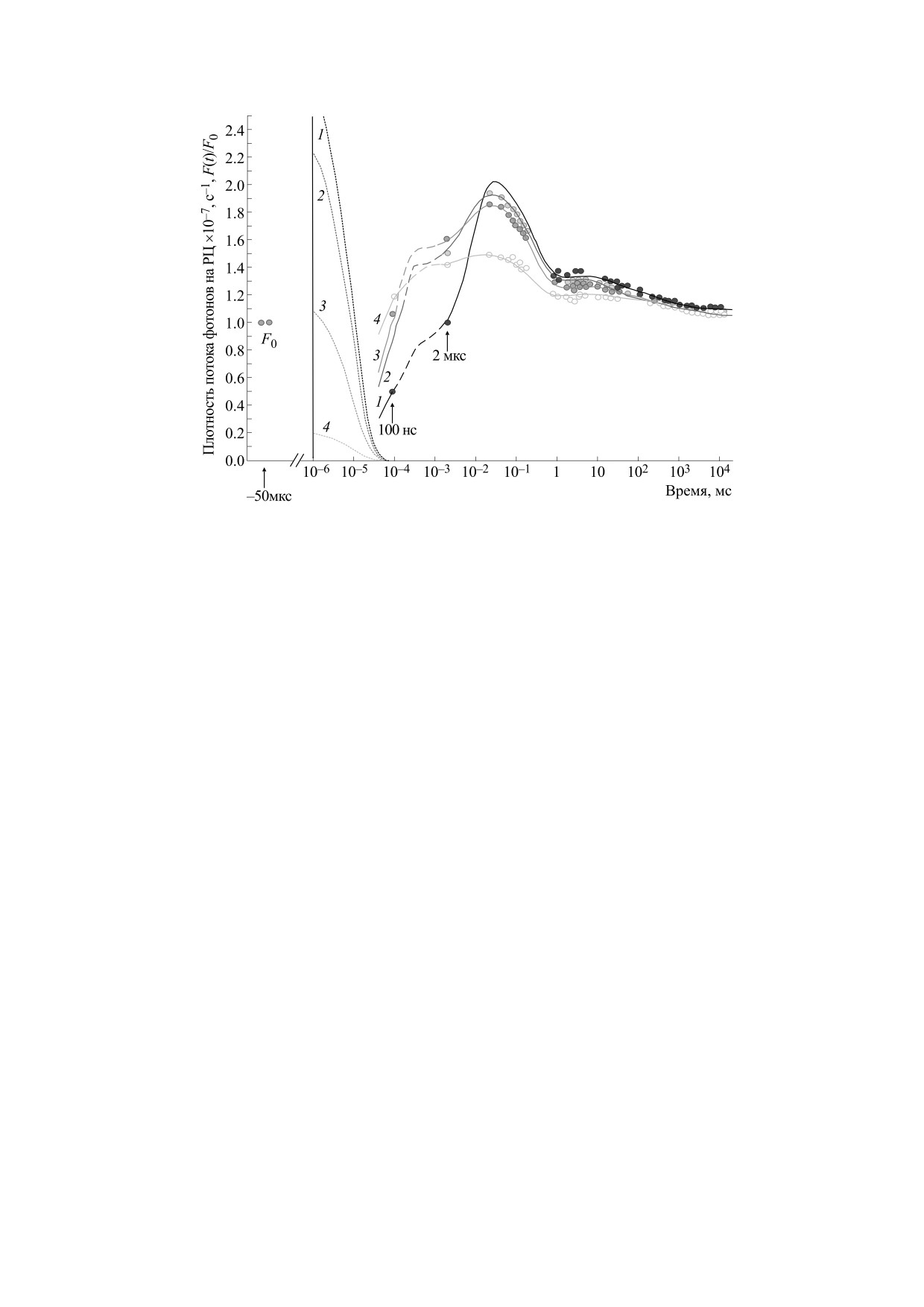
Рис. 3. Фитирование экспериментальных результатов выхода флуоресценции с помощью модели ФС II, представлен-
ной на рис. 2. Лазерная вспышка (10 нс) индуцирует изменения выхода флуоресценции в целых листьях дикого типа
растений Arabidopsis thaliana. Результаты измерений показаны символами (кружки) для различных величин энергии
вспышки лазера: 7.5 ⋅ 1016 фотон/(см2 импульс) - черный, 6.2 ⋅ 1015 фотон/(см2 импульс) - темно-серый, 3.0 ⋅ 1015 фо-
тон/(см2 импульс) - серый и 5.4 ⋅ 1014 фотон/(см2 импульс) - светло-серый. Результаты численного моделирования
представлены сплошными и пунктирными линиями, рассчитанными для величин констант скорости kL-Max: 7.2 ⋅109 с-1 -
черный (1), 6.0 ⋅ 108 с-1 - темно-серый (2), 2.9 ⋅ 108 с-1 - серый (3), 5.2 ⋅ 107 с-1 - светло-серый (4). Точечные линии
показывают ход во времени функции, определяющей константу скорости световой реакции kL(t), для соответствую-
щих значений kL-Max и нормализованной с коэффициентом 10-7. Измерительный свет низкой интенсивности исполь-
зовали для регистрации величины F0 перед началом (-50 мкс) насыщающей вспышки и затем в интервале времени
100 нс - 10 с для регистрации изменений выхода флуоресценции кривых, задавая в модели ФС II световую константу
kL-Min = 0.2 с-1 [38].
чин интенсивности действующего импульса, их
ДЕТАЛЬНЫЕ КИНЕТИЧЕСКИЕ МОДЕЛИ
задавали в соответствии с литературными дан-
ПРОЦЕССОВ В ФОТОСИНТЕТИЧЕСКОЙ
ными.
МЕМБРАНЕ
Другую группу параметров варьировали для
Модель процессов в ФС II позволяет описать
наилучшего соответствия модельных кривых экс-
только нарастающий участок кривой индукции
периментальным данным. Наиболее критиче-
флуоресценции длительностью до 1 с. Для интер-
ским образом от интенсивности лазерного им-
претации изменений выхода флуоресценции на
пульса зависят величины констант скоростей,
больших временах необходим учет и других про-
определяющих процессы безызлучательного ту-
цессов в фотосинтетической мембране. Схема
процессов, учтенных в обобщенной кинетиче-
шения, в частности тушения синглетного хлоро-
ской модели [30, 31], приведена на рис. 4. В работе
филла триплетами каротиноидов [38]. Модель
[31] для идентификации параметров модели на-
позволяет изучать вклад отдельных флуоресциру-
ряду с кривыми индукции флуоресценции ис-
ющих состояний в общий уровень регистрируе-
пользованы экспериментальные кривые редокс-
мой флуоресценции, этот вклад существенно за-
превращений пигмента реакционного центра
висит от энергии возбуждающего импульса. Так
ФС I Р700 на временах от единиц миллисекунд до
были оценены константы скоростей безызлуча-
30 секунд (рис. 5).
тельной релаксации в реакционном центре ФС II,
которые существенно зависят от интенсивности
Помимо детального описания процессов пере-
освещения. При больших интенсивностях поток
ходов между состояниями ФС II (рис. 2) в модель
энергии в тепло может составлять до 30% погло-
включены блоки, описывающие взаимодействие
щенной фотосинтетических объектом энергии.
пула PQ с акцепторной частью ФС II и цитохром-
БИОФИЗИКА том 65
№ 5
2020
892
РИЗНИЧЕНКО и др.
Рис. 4. Схема процессов, рассматриваемых в обобщенной кинетической модели первичных процессов фотосинтеза
[30, 31]. b6f - Цитохромный b6f-комплекс, Chl - хлорофилл антенны, P680 и P700 - пигменты реакционных центров
фотосистем II и I. QA - первичный хинонный акцептор электронов ФС II, bL и bH - низко- и высокопотенциальный
гемы цитохрома b, FeSR - железо-серный центр Риске, f - цитохром f, FeSI - акцепторный комплекс ФС I, PQ -
пластохинон; PQH2 - пластохинол; Fd - ферредоксин, Pc - пластоцианин. R-COO- - буферные группы. Знаки «+»
и «-» показывают, что в результате светоиндуцированных процессов люмен тилакоида заряжается положительно, а
строма хлоропласта - отрицательно. Жирные стрелки обозначают потоки квантов падающего света и флуоресценции.
Тонкими стрелками показан перенос электронов по цепи электронного транспорта и потоки ионов H+, K+ и Cl- после
включения освещения.
Рис. 5. Экспериментальные кривые индукции флуоресценции и поглощения в полосе А810 (кружки) и модельные
кривые выхода флуоресценции и редокс-превращений Р700 (линии) во временном диапазоне до 20 с. Ось времени
представлена в логарифмическом масштабе [31].
БИОФИЗИКА том 65
№ 5
2020
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
893
ным комплексом, переходы между состояниями
В модели воспроизводится работа нескольких
ФС I и цитохромного комплекса, реакции взаи-
миллионов фотосинтетических единиц, что срав-
модействия ФС I с акцептором Fd, циклический
нимо с их количеством в клетке микроводоросли.
транспорт электронов вокруг ФС I, процессы не-
Перенос электрона между компонентами, прото-
фотохимического тушения.
нирование, испускание кванта флуоресценции
на каждом временном шаге расчета происходит с
вероятностью, заданной в соответствии с экспе-
ВЕРОЯТНОСТНЫЕ МОДЕЛИ
риментальными данными о скоростях происхо-
ТИПА МОНТЕ-КАРЛО
дящих процессов, с использованием генератора
случайных чисел. Количество однородных собы-
В эксперименте сигнал регистрируется от со-
тий (испусканий кванта флуоресценции, или ак-
вокупности процессов, происходящих в большом
тов окисления фотоактивного пигмента) в опре-
количестве клеток, каждая из которых содержит
деленном интервале времени суммируется. Та-
миллионы мультиферментных белковых ком-
ким образом, мы получаем кинетическую кривую
плексов и подвижных молекул, участвующих в
для ансамбля фотосинтетических единиц (макро-
электронном транспорте. Диффузия мобильных
системы), закладывая в модель данные о взаимо-
переносчиков электрона существенно ограниче-
действии компонентов отдельных представите-
на сложной геометрией тилакоидных мембран,
лей этого ансамбля. Модельная кинетическая
поэтому при описании функционирования фото-
кривая соответствует кривой, наблюдаемой в
синтететического аппарата его можно предста-
эксперименте.
вить в виде ансамбля отдельных слабо связанных
друг с другом фотосинтетических единиц. В каж-
На рис. 6 представлена схема процессов, про-
дой из этих фотосинтетических единиц происхо-
исходящих в каждой из фотосинтетических еди-
дит перенос электрона между соответствующими
ниц, моделируемых в работе [33]. Пояснения да-
переносчиками, высвечивание квантов флуорес-
ны в подписи к рисунку. Полученные на модели
ценции, захват протонов. Для каждого из процес-
индукционные кривые флуоресценции для ан-
сов можно определить вероятность, с которой он
самбля фотосинтетических единиц при разных
произойдет в каждой фотосинтетической едини-
интенсивностях света представлены на рис. 7.
це за заданный промежуток времени. Моделиро-
вание процессов, происходящих в состоящих из
сотен тысяч и миллионов фотосинтетических
МОДЕЛИ БРОУНОВСКОЙ ДИНАМИКИ
единиц ансамблях, стало возможным благодаря
Как отмечалось выше, сложное устройство
использованию мощностей современной вычис-
фотосинтетической мембраны (рис. 1) приводит
лительной техники. Суммарный сигнал от моде-
к тому, что на участках, где электронный транс-
лируемого ансамбля имитирует сигнал, получае-
мый в эксперименте на суспензии клеток (хлоро-
порт осуществляется подвижными переносчика-
пластов) или от листа высших растений методами
ми (молекулы пула PQ, Рс в люмене, Fd на стро-
флуориметрии и спектрометрии. Метод построе-
мальной стороне ФС I), их взаимодействие с
мультиферментными комплексами не соответ-
ния модели позволяет легко модифицировать
ствует представлениям о свободной диффузии и
структуру моделируемых цепей переноса элек-
трона, учитывать гетерогенность фотосинтетиче-
случайных соударениях. Например, в узком лю-
ских единиц и объединение реакционных цен-
минальном пространстве молекулы пластоциа-
тров ФС II в группы (энергетический обмен). От-
нина, размеры которых сравнимы с шириной лю-
минального пространства, не могут свободно пе-
метим, что при моделировании такого
ремещаться [45], их общее количество в объеме
объединения традиционным способом с помо-
щью систем дифференциальных уравнений для
люмена одной граны и число фиксированных в
вероятностей (концентраций) возможных состо-
мембране РЦ составляет десятки-сотни, что зна-
чительно меньше необходимого количества для
яний системы требуется многократное увеличе-
реализации представлений о свободных соударе-
ние числа уравнений системы.
в мембране
ниях. Движение молекул PQ/PQH2
Стохастический метод Монте-Карло, осно-
также далеко от свободной диффузии [46].
ванный на задании отдельных реакций в виде
«правил» (rule-based modeling), использовали для
Для выяснения механизмов взаимодействия
описания процессов переноса электрона в ансам-
подвижных переносчиков с мультиферментными
блях фотосинтетических электронных цепей в ра-
комплексами на кафедре биофизики биологиче-
ботах [26, 29, 33]. В работе [33] сравнение с экспе-
ского факультета МГУ имени М.В. Ломоносова
риментом проводили по кривым индукции флуо-
при участии кафедры компьютерных методов в
ресценции и кинетике редокс-превращений Р700
физике физического ф-та МГУ имени М.В. Ло-
после включения света и кинетике релаксации
моносова разработан метод «прямого многоча-
флуоресценции после выключения света.
стичного моделирования». Основы этого подхода
БИОФИЗИКА том 65
№ 5
2020
894
РИЗНИЧЕНКО и др.
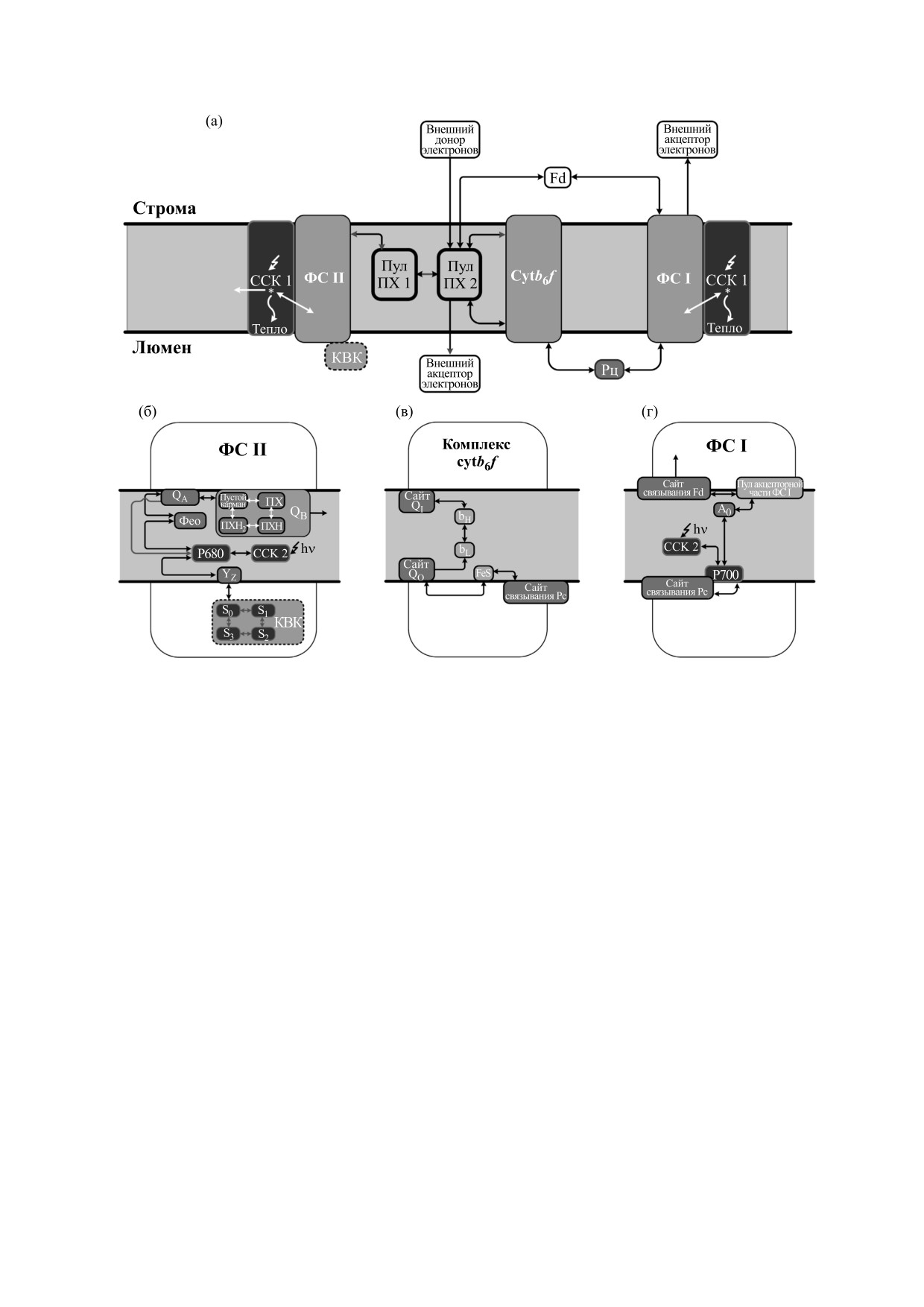
Рис. 6. Общая схема фотосинтетической цепи (а), реакций в фотосистеме II (б), цитохромном комплексе cyt b6f (в) и
фотосистеме I (г), рассмотренных в модели типа Монте Карло [33]. В антенне ФС II возбуждение может
дезактивироваться либо в фотохимических реакциях, либо путем тепловой диссипации или флуоресцентного
излучения. Возбуждение P680 дает начало электронному транспорту, при этом сначала восстанавливается феофитин
(Фео), а затем первичный хинонный акцептор QA. Окисленный P680+ восстанавливается тирозином Z (YZ), который
получает электрон с марганецсодержащего водоразлагающего комплекса (OEC - oxygen evolving complex). Последний
разлагает воду, проходя последовательно через четыре промежуточных состояния (S states). В ФС I возбуждение
передается с антенны на P700, который восстанавливает A0, затем электрон переходит через обобщенный
акцепторный пул на ферредоксин (Fd), в случае, если имеется молекула Fd, связанная в Fd-связывающем сайте. P700+
восстанавливается от пластоцианина (Pc). Дважды восстановленный и протонированный QB (QBH2) покидает ФС II,
а PQ в окисленной форме связывается в QB-сайте ФС II. PQH2 окисляется цитохромным комплексом cyt b6f в сайте
Q0. Один из электронов идет через железо-серный центр белка Риске на Рс, в случае, если молекула Рс связана в Рс-
связывающем сайте cyt b6f (C). Затем восстановленный Рс связывается в Рс-связывающем сайте ФС I и передает
электрон на P700+. Второй электрон переходит на гемы типа b (bH и bL), которые восстанавливают молекулу PQ на
QI-стороне cytb6f-комплекса. Пул PQ представлен двумя суб-пулами, один из которых взаимодействует с ФС II, а
второй - с cytb6f. Субпул 2 может взаимодействовать с внешними донорами и акцепторами (пути хлородыхания) и с
пулом Fd через реакции циклического транспорта вокруг ФС I. Кроме того, акцепторная часть ФС I может быть
окислена молекулярным кислородом в ходе реакции Меллера.
и полученные результаты изложены в работах
ра и акцептора способны образовывать окисли-
[47-60].
тельно-восстановительный комплекс, в результа-
те конформационных изменений которого
Молекулы белков-переносчиков электронов
образуется электронная тропа, обеспечивающая
осуществляют броуновское движение в среде и
испытывают электростатические взаимодействия
туннельный перенос электрона с молекулы-до-
друг с другом и с поверхностью фотосинтетиче-
нора на молекулу-акцептор. Для описания кон-
ской мембраны. При сближении молекулы доно-
формационных движений в таком реакционном
БИОФИЗИКА том 65
№ 5
2020
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
895
Рис. 7. Модельные кривые индукции флуоресценции для разных интенсивностей действующего света - 120, 1000,
2000, 6000, и 12000 М фотон·м-2 с-1 (кривые 1, 2, 3, 4 и 5 соответственно). На врезке показаны соответствующие
светоиндуцированные изменения P680 - фотоактивного пигмента ФС II [33].
комплексе необходимо применение методов мо-
60], взаимодействия Fd с акцепторной частью ФС
лекулярной динамики, а для описания собствен-
I и дальнейшими акцепторами электронов - фер-
но переноса электрона с реакционного центра
редоксин:НАДФ-редуктазой и гидрогеназой [52,
молекулы-донора на реакционный центр молеку-
58, 59].
лы-акцептора - применение методов квантовой
Наряду с кинетическими характеристиками,
химии.
которые можно получить на традиционной кине-
В обзоре [57] обсуждаются существующие мо-
тической модели, прямая модель дает трехмерное
дели броуновской динамики, в которых рассмат-
визуальное представление динамики процессов в
риваются диффузия и взаимная ориентация бел-
системе на разных пространственных и времен-
ковых молекул при образовании диффузионно-
ных масштабах, дает возможность наблюдать за
столкновительного комплекса. Отличие наших
поведением индивидуальных компонентов и по-
моделей от классических моделей броуновской
лучать статистические сведения о системе.
динамики [61-63] состоит в том, что они являют-
ся многочастичными и позволяют моделировать
не только процессы взаимодействия белков в рас-
ПРОДУКТИВНЫЕ И НЕПРОДУКТИВНЫЕ
творе, но и рассматривать поведение ансамблей
СТОЛКНОВИТЕЛЬНЫЕ КОМПЛЕКСЫ
взаимодействующих макромолекул в сложном
Образованию финального реакционного ком-
интерьере фотосинтетической мембраны с уче-
плекса предшествует сложная последователь-
том структурных особенностей организации мем-
ность процессов, обеспечивающих конформаци-
браны [50, 53, 60].
онное соответствие молекул донора и акцептора.
С помощью метода многочастичной броунов-
Для создания условий туннелирования электрона
ской динамики нами были воспроизведены про-
с молекулы-донора на молекулу-акцептор взаи-
цессы взаимодействия молекулы Рс с кофакто-
модействующие белки, обладающие сложной
ром цитохромного комплекса цитохромом f в рас-
пространственной структурой, должны правиль-
творе [47], взаимодействия Рс с цитохромом f и с
но сориентироваться друг относительно друга,
донорной частью ФС I в люмене тилакоида [60,
как бы «притереться» друг к другу. Наличие зави-
БИОФИЗИКА том 65
№ 5
2020
896
РИЗНИЧЕНКО и др.
Рис. 8. Структура комплекса Рс-Сyt f по данным ЯМР (PDB ID: 2PCF) (слева) и кластеров, полученных в ходе
вычислительных экспериментов броуновской динамики. В центре - кластер продуктивных комплексов, справа -
кластер непродуктивных комплексов [56]. На графике показано расстояние доступности для отдельных структур,
вычисленное с помощью основанного на частоте встречаемости похожих структур метода иерархического
кластерного анализа.
симости скорости реакции от ионной силы сви-
ция белка Рс состоит в челночном переносе элек-
детельствует о важной роли электростатических
трона между субъединицей f цитохромного ком-
взаимодействий в образовании такого предвари-
плекса b6f и фотосистемой I у вcеx выcшиx pаcте-
тельного диффузионно-столкновительного ком-
ний и некотоpыx водоpоcлей. Цитоxpом f - cамая
плекса (preliminary, encounter complex).
кpупная cубъединица цитоxpомного b6f-ком-
В работах [56, 64] были изучены конформации
плекcа, cодеpжащая cайт cвязывания плаcтоциа-
образующихся в процессе сближения и взаимной
нина. Белки Рс и цитохром f являются окисли-
ориентации продуктивных (в которых возможен
тельно-восстановительными партнерами с четко
перенос электрона) и непродуктивных (в которых
локализованными реакционными центрами -
перенос электрона невозможен) комплексов мо-
атомами меди и железа соответственно. Эта пара
лекул донора и акцептора электронов. Для де-
белков является классическим объектом экспе-
тального изучения роли электростатических вза-
риментального исследования (обзор [65]) и изу-
имодействий использовали классический подход
чения методом броуновской динамики [61-64,
броуновской динамики - многократные вычис-
66, 67]. Для анализа взаимного расположения
лительные эксперименты по сближению двух мо-
макромолекул в ансамбле финальных конфигу-
лекул. Анализ траекторий движения молекул в та-
раций, полученных методом броуновской дина-
ких экспериментах позволяет выявить наиболее
мики, использовали метод кластерного анализа
часто возникающие при сближении молекул в
[56].
процессе диффузии варианты их взаимного рас-
Анализ нескольких тысяч структур показал,
положения, оценить энергию взаимодействия
что в процессе диффузии образуются два типа
между молекулами и сделать оценку константы
столкновительных комплексов (рис. 8). В класте-
скорости реакции ассоциации белков.
ре «правильных» конфигураций (рис. 8, в центре)
Вопрос о роли электростатических взаимодей-
взаимная ориентация молекул Рс и цитохрома f в
ствий в образовании окислительно-восстанови-
целом соответствует ориентации в функциональ-
тельного комплекса двух белков исследовали на
но активном комплексе (данные ЯМР, PDB ID:
модели взаимодействия наиболее хорошо изу-
2PCF [63]), и электростатические взаимодей-
ченной пары фотосинтетических белков-пере-
ствия не препятствуют такому повороту молекул
носчиков электрона
- пластоцианина и
друг относительно друга, при котором осуществ-
цитохрома f [47, 56, 64]. Физиологическая функ-
ляется дальнейшее сближение их активных цен-
БИОФИЗИКА том 65
№ 5
2020
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
897
тров. В кластере «неправильных» конфигураций
за цитохрома f были сближены до расстояний, на
(слева) взаимная ориентация молекул Рс развер-
которых возможен туннельный перенос электро-
нут наоборот по сравнению с его ориентацией в
на, либо отдаляясь друг от друга. Сам процесс пе-
функционально активном комплексе, и сближе-
реноса электрона с атома железа цитохрома на
ние РЦ молекул оказывается возможным только
атом меди пластоцианина в данной работе не мо-
за счет разрыва существующих в этом комплексе
делировали, однако предлагаемый подход позво-
электростатических связей.
ляет это сделать, введя дополнительные стадии,
использующие методы квантовой химии.
ГИБРИДНЫЕ
Исследование [68] показало, что роль электро-
БРОУНОВСКИЕ/МОЛЕКУЛЯРНЫЕ МОДЕЛИ
статических взаимодействий и конформацион-
ВЗАИМОДЕЙСТВИЯ
ных изменений при формировании комплексов
ФОТОСИНТЕТИЧЕСКИХ БЕЛКОВ
белков Рс и цитохрома f у организмов, принадле-
жащих к далеко отстоящим друг от друга система-
Во многих случаях образование диффузионно-
тическим группам, может существенно разли-
столкновительного комплекса, которое мы моде-
чаться, несмотря на то, что трехмерная организа-
лируем с помощью броуновской динамики, пред-
ставляет собой необходимое, но не достаточное
ция этих белков весьма схожа у всех
условие окислительно-восстановительной реак-
исследованных организмов. В высших растениях
ции. Для сближения РЦ белков до расстояния,
и зеленой водоросли Chlamydomonas reinhardtii
достаточно близкого для туннельного переноса
электростатические взаимодействия способству-
электрона с молекулы-донора на молекулу-ак-
ют занятию молекулой Рс положения вблизи гема
цептор, необходимо, чтобы в процессе конфор-
цитохрома f, при этом ориентация пластоциани-
мационных изменений образовался финальный
на оказывается практически случайной. После
комплекс. Средства для моделирования конфор-
такого «диффузионного захвата» электростатиче-
мационных движений молекул предоставляет мо-
ские взаимодействия не препятствуют вращению
лекулярная динамика.
молекулы Рс вокруг ее центра масс, и дальнейшее
сближение кофакторов белков и формирование
Современные методы молекулярной динами-
финального комплекса происходит в результате
ки являются достаточно ресурсоемкими, это на-
такого вращения без существенных конформаци-
кладывает ограничения на размер моделируемой
онных изменений молекул белков. На рис. 9в
системы и время расчета. Поэтому последова-
тельные процессы диффузионного сближения
приведен график изменения расстояния между
белков, их взаимную ориентацию и дальнейшую
реакционными центрами пластоцианина и
цитохрома f в ходе трансформации предваритель-
конформационнонную «подстройку», приводя-
щую к образованию финального комплекса, це-
ного комплекса в финальный. Видно, что за
лесообразно моделировать поэтапно. В работе
150 нс происходит сближение РЦ до расстояния
[68] мы провели компьютерное моделирование
1,5 нм, после чего комплекс остается стабильным
поэтапного процесса образования комплекса фо-
в течение всего времени моделирования (900 нс).
тосинтезирующих белков Рс и цитохрома f для
Центральная структура
«непродуктивного»
разных видов организмов: высших растений, зе-
кластера (рис. 9б) в ходе молекулярной динамики
леных микроводорослей и циановых бактерий.
также приводит к довольно стабильной структуре
Методом броуновской динамики мы промодели-
комплекса с расстоянием между кофакторами
ровали процессы сближения и взаимной ориен-
около 3.7 нм. В полученной структуре пластоциа-
тации молекул, аналогично описанному в разделе
нин находится в перевернутом положении отно-
«Продуктивные и непродуктивные столкнови-
сительно ориентации, которую он имеет в ком-
тельные комплексы». Кластерный анализ боль-
плексах, полученных при помощи ЯМР. Очевид-
шого ансамбля из десятков тысяч траекторий
броуновского движения позволил выявить раз-
но, что структуры этого кластера являются
непродуктивными метастабильными состояния-
личные энергетически выгодные метастабильные
состояния в процессе формирования комплекса
ми, которые нельзя легко разрушить действием
белков Рс и цитохрома f. Центральные структуры
случайной броуновской силы. В условиях низкой
кластеров, соответствующие наиболее часто об-
ионной силы, где имеет место слабое экраниро-
разующимся при сближении молекул взаимным
вание электрических зарядов на поверхностях
ориентациям, были использованы в качестве на-
белков, стабильность таких непродуктивных со-
чальных конфигураций для молекулярной дина-
стояний возрастает. Существование таких неак-
мики. В ходе молекулярно-динамической симу-
тивных состояний может быть основной причи-
ляции молекулы донора и акцептора претерпева-
ной снижения скорости образования активных
ли конформационные изменения, либо
белок-белковых комплексов, наблюдаемого в
сближаясь своими РЦ и образуя финальный ком-
экспериментах [69, 50] при низких значениях
плекс, где атом меди пластоцианина и атом желе-
ионной силы.
БИОФИЗИКА том 65
№ 5
2020
898
РИЗНИЧЕНКО и др.
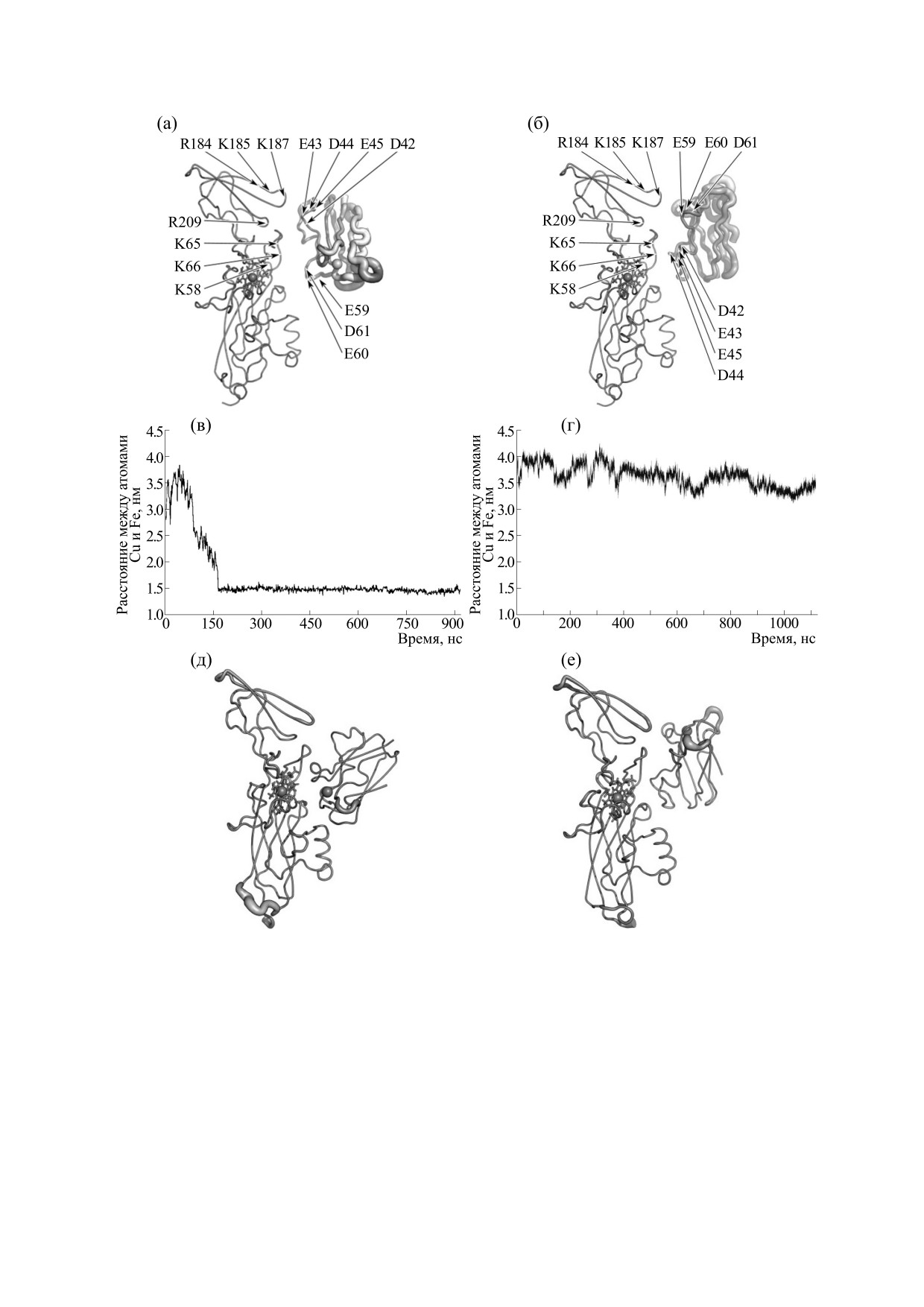
Рис.
9. Центральные структуры
«продуктивного» (а) и
«непродуктивного» (б) кластеров диффузионно-
столкновительных комплексов пластоцианина и цитохрома f из высших растений с энергией электростатического
притяжения более 8 кТл. Расстояние между атомами меди и железа пластоцианина и цитохрома f, полученное из
расчетов молекулярной динамики, имеющих в качестве начальных центральную структуру кластеров (в) и (г).
Структуры «продуктивного» (д) и «непродуктивного» (е) финальных комплексов, полученных из молекулярно-
динамических расчетов. Толщина линий белковых структур пропорциональна значению B-фактора [68].
Сценарий образования функционально актив-
пластоцианин уже на ранних стадиях сближения
ного комплекса значительно отличается у гетеро-
с цитохромом f ориентируется атомом меди в на-
цистной цианобактерии Nostoc sp. За счет другого
правлении своего реакционного партнера. Благо-
распределения зарядов на поверхности белков
даря этому все образующиеся предварительные
БИОФИЗИКА том 65
№ 5
2020
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
899
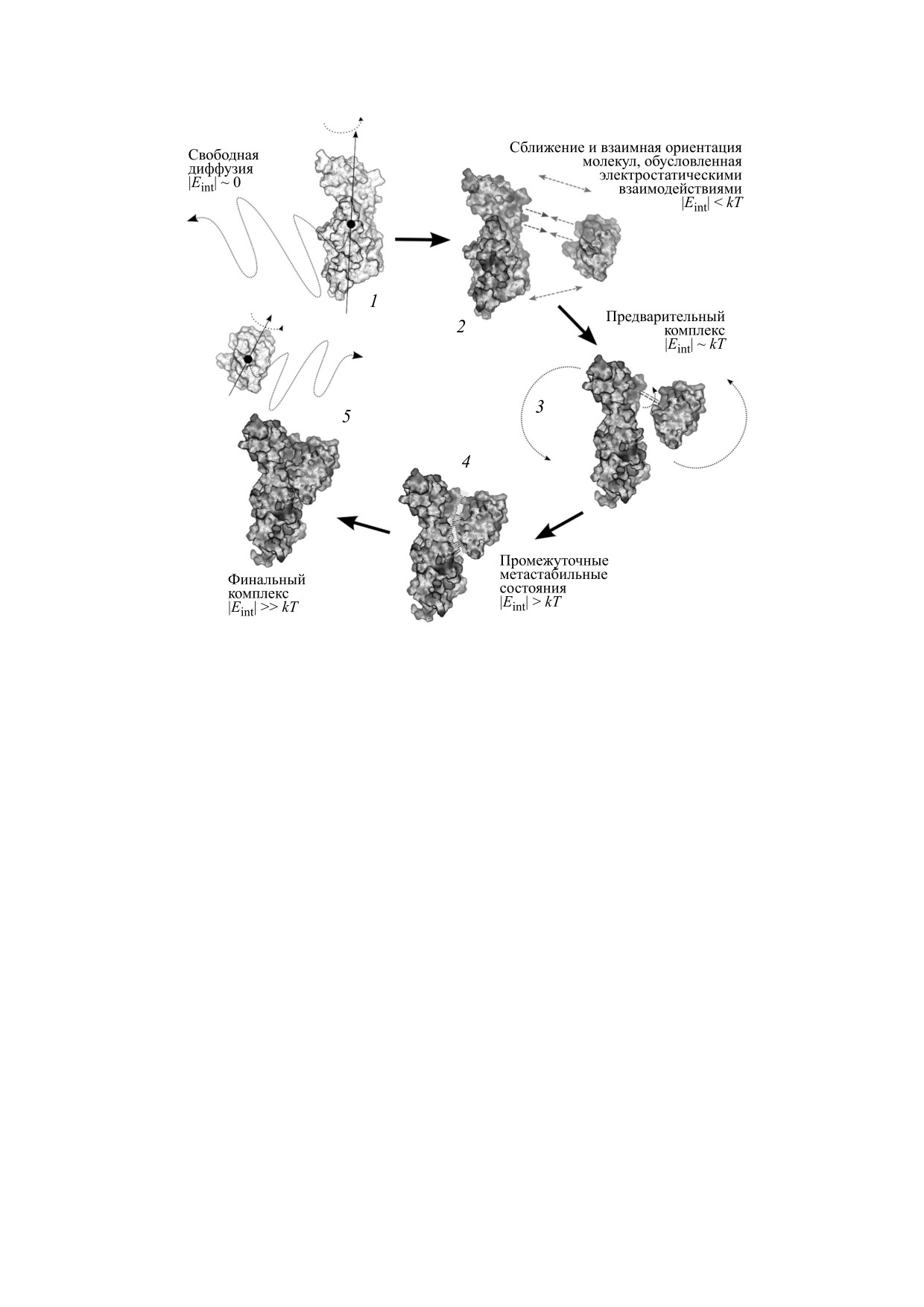
Рис. 10. Схема образования белок-белкового комплекса для электрон-транспортных белков пластоцианина и цито-
хрома f на примере белков из высших растений [68]: 1 - свободная диффузия молекул; 2 - взаимная ориентация, обу-
словленная электростатическими взаимодействиями; 3 - формирование энергетически-выгодных конформаций; 4 -
трансформация дифузионно-столкновительного комплекса в метастабильное энергетически выгодное состояние;
5 - формирование финального комплекса (функционально активная конфигурация) путем конформационных изме-
нений в рамках белок-белкового интерфейса.
комплексы имеют возможность перейти в состо-
действиями. Это согласуется с эксперименталь-
яние с тесно сближенными кофакторами, что
ными данными о слабой зависимости константы
позволяет охарактеризовать их как продуктив-
скорости ассоциации этих белков от ионной силы
ные. Моделирование методом молекулярной ди-
раствора [70]. Вследствие этого мы полагаем, что
намики показало, что в отличие от белка высших
в данном случае образование комплекса происхо-
растений и зеленой водоросли цитохром f ци-
дит по «столкновительному» типу без предвари-
анобактерии Nostoc sp. имеет заметную подвиж-
тельной взаимной ориентации молекул.
ность малого домена относительного большого.
Последовательность стадий образования белок-
В процессе стыковки с пластоцианином ампли-
белкового электрон-транспортного комплекса в
туда колебаний малого домена существенно
растворе для белков пластоцианина и цитохромом
уменьшается, и он сдвигается по сравнению с его
f из высших растений и зеленых водорослей схема-
положением в свободном белке. Мы полагаем,
тически представлена на рис. 10.
что такие конформационные изменения способ-
ствуют стабилизации образующегося финального
комплекса.
ЗАКЛЮЧЕНИЕ
Исследование взаимодействия белков цито-
Первичные процессы фотосинтеза представля-
хрома f и пластоцианина безгетероцистной ци-
ют собой базовую систему запасания энергии све-
анобактерии Phormidium laminosum не выявило
та, создания органического вещества и обеспече-
каких-либо энергетически выгодных взаимных
ния энергией жизнедеятельности живых систем. В
расположений этих белков, обусловленных даль-
ходе процессов в фотосинтетических мембране за-
нодействующими электростатическими взаимо-
пасаются молекулы АТФ - энергетической валю-
БИОФИЗИКА том 65
№ 5
2020
900
РИЗНИЧЕНКО и др.
ты клетки - и создаются востановительные экви-
ческие модели разной степени детализации, а
валенты, используемые в цикле фиксации СО2 и
также потоковые модели для описания сопряже-
других метаболических циклах. Методы математи-
ния процессов фотосинтеза и процессов в мета-
ческого моделирования дополняют эксперимен-
болических сетях [74].
тальные исследования по нескольким направле-
ниям.
БЛАГОДАРНОСТИ
Модели квантовой химии позволяют воспроиз-
Работа выполнена с использованием оборудо-
водить акты переноса электрона между атомами и
вания Центра коллективного пользования сверх-
движения протона внутри макромолекул. Молеку-
высокопроизводительными вычислительными
лярная динамика имитирует конформационные
ресурсами МГУ имени М.В. Ломоносова.
движения молекул и молекулярных комплексов в
акте взаимодействия, броуновская динамика поз-
воляет изучать динамику образования комплекса
ФИНАНСИРОВАНИЕ РАБОТЫ
между компонентами фотосинтетической цепи,
Работа выполнена при частичной финансовой
когда один из них, или оба, являются подвижными
поддержке Российского фонда фундаментальных
переносчиками. Комплексные модели броунов-
исследований (гранты №№ 17-04-00-676, 18-07-
ской/молекулярной динамики позволяют наряду с
01219, 18-34-00406, 19-04-00999, 20-54-44004), а
процессами сближения и взаимной ориентации
также Российского научного фонда (проект
молекул описать конформационные изменения в
№ 20-64-46018).
реакционном комплексе, подготавливающие усло-
вия для осуществления самого акта передачи элек-
трона с активного центра молекулы-донора на ак-
КОНФЛИКТ ИНТЕРЕСОВ
тивный центр молекулы-акцептора.
Авторы заявляют об отсутствии конфликта
Очевидно, что для понимания механизмов
интересов.
функционирования сложной многоуровневой
системы, каковой является система первичных
процессов фотосинтеза, необходимо использова-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ние как системно-динамических (кинетических)
Настоящая работа не содержит описания ис-
моделей разной степени сложности, так и агент-
следований с использованием людей и животных
ных моделей. При этом в роли «агентов» на раз-
в качестве объектов.
ных временных и пространственных масштабах
выступают электроны и протоны (модели кванто-
вой химии), атомы (модели классической моле-
СПИСОК ЛИТЕРАТУРЫ
кулярной динамики), аминокислоты или другие
1. Современные проблемы фотосинтеза (изд-во ИКИ,
агрегаты атомов (крупнозернистые (course-grain
М-Ижевск, 2014), т. 1-2.
модели), белковые молекулы (броуновская мно-
2. D. Shevela, L. O. Bjorn, and Govindjee, Photosynthe-
гочастичная динамика), отдельные фотосинтети-
sis: Solar Energy for Life (World Scientific, 2019).
ческие цепи (вероятностные rule-based Монте
3. R. E. Blenkenship. Molecular Mechanisms of Photosyn-
Карло модели). Включение знаний, получаемых
thesis, 2nd ed. (John Wiley and Sons, 2014).
при исследовании моделей систем более низкого
4. А. Б. Рубин. Биофизика (изд-во ИКИ, М-Ижевск,
уровня организации в более агрегированные мо-
2014), т. 3.
дели, представляет особую проблему.
5. C. Holzapfel and R. Z. Bauer, Z. Naturforsch. 30, 489
Данные флуоресценции и других методов ре-
(1975).
гистрации изменений в фотосинтетическом ап-
6. А. К. Кукушкин, А. Н. Тихонов, Л. А. Блюмен-
парате могут быть эффективно использованы для
фельд и Э. К. Рууге, Физиология растений 22, 241
экспресс-оценки изменений в метаболизме фо-
(1975).
тосинтезирующих организмов, в частности мик-
7. S. Malkin, Biochim. Biophys. Acta 234, 425 (1971).
роводорослей, для получения целевого продукта
8. Е. М. Сорокин, Физиология растений 20 (4), 733
(молекулярного водорода, обогащенной липида-
(1972).
ми биомассы и др.). Методы автоматической
9. А. Б. Рубин и В. П. Шинкарев, Транспорт электро-
регистрации и обработки с помощью математи-
нов в биологических системах (М., Наука, 1984).
ческих моделей больших массивов экспери-
10. Г. Ю. Ризниченко Т. Н. Воробьева, Е. Н. Храброва,
ментальных данных позволяют определять изме-
и А. Б. Рубин, Биофизика 31 (1), 793 (1986).
нения в фотосинтетическом аппарате фотосинте-
11. G. Yu. Riznichenko, T. N. Vorobjeva, E. N. Khrabrova,
зирующих организмов в процессе роста, при
and A. B. Rubin, Photosynthetica 24, 37 (1990).
воздействии стресса и др. для целей биотехноло-
12. Г. Ю. Ризниченко, Математические модели пер-
гического производства и экологического мони-
вичных процессов фотосинтеза, Успехи науки и тех-
торинга [71-73]. Для этого используются кинети-
ники. Сер. биофизика (ВИНИТИ, М., 1991), т. 31.
БИОФИЗИКА том 65
№ 5
2020
МОДЕЛИ ФОТОСИНТЕТИЧЕСКОГО ЭЛЕКТРОННОГО ТРАНСПОРТА
901
13. Г. Ю. Ризниченко, Лекции по математическим мо-
41. A. Штирбет, Г. Ю. Ризниченко, A. Б. Рубин и Го-
делям в биологии (РХД, М-Ижевск, 2011).
винджи, Биохимия 79 (4), 379 (2014).
14. A. B. Rubin, G. Yu. Riznichenko, In Photosynthesis in
42. R. Steffen, H.-J. Eckert, A. A. Kelly, et al., Biochemis-
silico: Understanding Complexity from Molecules to Eco-
try 44, 3123 (2005).
systems. Advances in Photosynthesis and Respiration, Ed.
43. Chlorophyll a Fluorescence: A Signature of Photosynthe-
by A. Laisk, L. Nedbal, and Govindjee (Springer, Dor-
sis, Ed. by G. C. Papageorgiou and Govindjee (Spring-
drecht, 2009), v. 29, pp. 151-176.
er, 2004).
15. A. B. Rubin and G. Yu. Riznichenko. Mathematical
biophysics (Springer, New York, 2014).
44. N. E. Belyaeva, F.-J. Schmitt, V. Z. Paschenko, et al.,
Plant Physiol. Biochem. 77, 49 (2014).
16. G. H. Schatz, H. Brock, and A. R. Holzwarth, Biophys.
J. 54, 397 (1988).
45. W. Haehnel, R. Ratajczak, and H. Robenek, J. Cell
17. T. A. Roelofs, C. H. Lee, and A. R. Holzwarth, Bio-
Biol. 108, 1397 (1989).
phys. J. 61, 1147 (1992).
46. H. Kirchhoff, U. Mukherjee, and H.-J. Galla, Bio-
18. E. Baake, J. P. Schloder, Bull. Math. Biol. 54, 999
chemistry 41, 4872 (2002).
(1992).
47. I. B. Kovalenko, A. M. Abaturova, P. A. Gromov, et al.,
19. H. Dau, Photochem. Photobiol. 60, 1 (1994).
Phys. Biol. 3, 121 (2006).
20. A. Stirbet, Govindjee, B. J. Strasser, and R. J. Strasser,
48. I. B. Kovalenko, A. N. Diakonova, A. M. Abaturova,
J. Theor. Biol. 193, 131 (1998).
et al., Phys. Biol.
7
(2),
026001
(2010). DOI:
21. A. D. Stirbet, Ph. Rosenau, A. C. Ströder, and
10/1088/1478-3975/7/2/026001
R. J. Strasser, Math. Comp. Sim. 56, 443 (2001).
49. G. Yu. Riznichenko, I. B. Kovalenko, A. M. Abaturova,
22. R. J. Strasser and A. D. Stirbet, Math. Comp. Sim. 56,
et al., Biophys. Rev. 2 (3), 101 (2010)
451 (2001).
50. О. С. Князева, И. Б. Коваленко, А. М. Абатурова
23. D. Lazár, J. Theor. Biol. 220, 469 (2003).
и др., Биофизика 55 (2), 259 (2010).
24. D. Lazár, Photosynthetica 47(4), 483 (2009).
51. I. B. Kovalenko, A. M. Abaturova, A. N. Diakonova,
25. X-G. Zhu, Govindjee, N. R. Baker, et al., Planta 223,
et al., Math. Model. Nat. Phenom. 6, 39-54 (2011).
114 (2005).
26. C.-P. Xin, J. Yang, and X-G. Zhu, Photosynth. Res
52. I. B. Kovalenko, A. N. Diakonova, A. M. Riznichenko,
117, 339 (2013).
and A. B. Rubin, BioSystems 103, 180 (2011).
27.
27. D. Lazár, J. Theor. Biol. 335, 249 (2013).
53. Д. М. Устинин, И. Б. Коваленко, Г. Ю. Ризничен-
28. O. Ebenhöh, G. Fucile, G. Finazzi, J. D. Rochaix,
ко и А. Б. Рубин, Компьютерные исследования и
M. Goldschmidt-Clermont, Philos. Trans. R. Soc. B.
моделирование 5 (1), 65 (2013).
369, 20130223 (2014).
54. С. С. Хрущев, А. М. Абатурова, А. Н. Дьяконова
29. А. С. Маслаков, Т. К. Антал, Г. Ю. Ризниченко и
и др., Компьютерные исследования и моделирова-
А. Б. Рубин, Биофизика, 61(3), 464 (2016).
ние 5 (1) 47 (2013).
30. N. E. Belyaeva, A. A. Bulychev, G. Yu. Riznichenko,
55. И. Б. Коваленко, О. С. Князева, Г. Ю. Ризниченко
and A. B. Rubin, Photosynth. Res. 130, 491 (2016).
и А. Б. Рубин, Биофизика 59 (1), 5 (2014).
31. N. E. Belyaeva, A. A. Bulychev, G. Yu. Riznichenko,
56. С. С. Хрущев, А. М. Абатурова, А. Н. Дьяконова
and A. B. Rubin, Photosynth. Res. 140 (1), 1 (2019).
и др., Биофизика 60, 270 (2015).
32. A. Stirbet and Govindjee, Photosynth. Res. 130, 193
57. С. С. Хрущев, А. М. Абатурова, В. А. Федоров и др.,
(2016).
Биофизика 60, 629 (2015).
33. T. K. Antal, A. Maslakov, O. V. Yakovleva, T. E. Kren-
deleva, G. Yu. Riznichenko, A. B. Rubin, Photosynth.
58. А. Н. Дьяконова, С. С. Хрущев, И. Б. Коваленко
Res. 138(2), 191-206 (2018).
и др., Биофизика 61 (4), 677 (2016).
34. G. Yu. Riznichenko, G. V. Lebedeva, O. V. Demin, and
59. A. N. Diakonova, S. S. Khrushchev, I. B. Kovalenko,
A. B. Rubin, J. Biol. Phys. 25, 177 (1999).
et al., Phys. Biol. 13 (5), 056004 (2016).
35. Г. В. Лебедева, Н. Е. Беляева, Г. Ю. Ризниченко
60. I. B. Kovalenko, O. S. Knyaseva, T. K. Antal, et al.,
и др., Журн. физ. химии 74, 1874 (2000).
Physiol. Plantarum 161, 88 (2017).
36. Г. В. Лебедева, Н. Е. Беляева, О. В. Демин и др.,
61. D. C. Pearson and E. L. Gross, Bioph. J. 75, 2698
Биофизика 47, 1044 (2002).
(1998).
37. N. E. Belyaeva, F.-J. Schmitt, R. Steffen, et al., Photo-
62. E. L. Gross and D. C. Pearson, Biophys. J. 85, 2055
synth. Res. 98, 105 (2008).
(2003).
38. N. E. Belyaeva, F.-J. Schmitt, V. Z. Paschenko, et al.,
63. E. L. Gross and I. Rosenberg, Biophys. J. 90, 366
BioSystems 103 (2), 188 (2011).
(2006).
39. Н. Е. Беляева, А. А Булычев, Г. Ю. Ризниченко и
64. И. Б. Коваленко, С. С. Хрущев, В. А. Федоров
А. Б. Рубин, Биофизика 56 (3), 489 (2011).
и др., Докл. РАН 468 (2), 220 (2016).
40. L. M. N. Duysens and H. E. Sweers, In Studies on Mi-
65. I. Cruz-Gallardo, I. Díaz-Moreno, A. Díaz-Quintana,
croalgae and Photosynthetic Bacteria, Ed. by A. Taka-
and M. A. De la Rosa, FEBS Lett. 586 (5), 646 (2012).
mia and K. Shobata (University of Tokyo Press, Tokyo,
66. M. Ubbink, M. Ejdebeck, B. G. Karlsson, and
1963), pp. 353-372.
D. S. Bendall, Structure 6, 323 (1998).
БИОФИЗИКА том 65
№ 5
2020
902
РИЗНИЧЕНКО и др.
67. G. M. Ullmann, E. -W. Knapp, and N. M. Kostic, J.
71. Т. Ю. Плюснина, С. С. Хрущев, Г. Ю. Ризниченко
Am. Chem. Soc. 119, 42 (1997).
и А. Б. Рубин, Биофизика 60 (3) 487 (2015).
68. V. A. Fedorov, I. B. Kovalenko, S. S. Khruschev, et al.,
72. Т. Ю. Плюснина, С. С. Хрущев, А. Е. Фролов и др.,
Physiol. Plantarum 166 (1), 320 (2019).
Биофизика 64 (3), 468 (2019).
69. T. E. Meyer Z. G. Zhao, M. A. Cusanovich, and
73. T. Antal, I. Konyukhov, A. Volgusheva, et al., Physiol.
G. Tollin, Biochemistry 32, 4552 (1993).
Plantarum 165 (3), 476 (2019).
70. B. G. Schlarb-Ridley, D. S. Bendall, and C. J. Howe,
74. Т. Ю. Плюснина, Г. Ю. Ризниченко и А. Б. Рубин,
Biochemistry 41 (10), 3279 (2002).
Биофизика 62 (3), 485 (2017).
Models of Photosynthetic Electron Transport
G.Yu. Riznichenko, N.E. Belyaeva, A.N. Diakonova, I.B. Kovalenko, A.S. Maslakov, T.K. Antal,
S.N. Goryachev, T.Yu. Plyusnina, V.A. Fedorov, S.S. Khruschev, and A.B. Rubin
Faculty of Biology, Lomonosov Moscow State University, Leninskye Gory 1/12, Moscow, 119991 Russia
Energy transduction reactions in the photosynthetic membrane perform a primary step in storage of solar en-
ergy that can be used later in biosynthesis and other reactions in the living systems. This paper presents a re-
view of recent research in modeling of photosynthetic electron transport which was undertaken at the Depart-
ment of Biophysics, Faculty of Biology, Lomonosov Moscow State University. Various types of mathematical
models are used to simulate processes at the level of macromolecules, their complexes, molecular ensembles,
at the subcellular and cellular levels. Detailed kinetic models allow for the estimation of the contribution of
individual processes to the observed processes identifying system parameters. With the use of the Monte Car-
lo method it is possible to simulate processes in ensembles consisting of millions of photosynthetic chains.
Brownian and molecular dynamics have been used to study the formation of electron-transport protein-pro-
tein complexes. The combination of the mentioned methods provides the possibility of studying the basic
mechanisms of energy conversion in a multiscale system of primary photosynthesis processes.
Keywords: photosynthesis, electron transport, kinetic models, Brownian dynamics, molecular dynamics, Monte
Carlo method
БИОФИЗИКА том 65
№ 5
2020