БИОФИЗИКА, 2020, том 65, № 5, с. 903-909
БИОФИЗИКА КЛЕТКИ
УДК 581.132:576.311.348.7
ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ФОТОСИНТЕТИЧЕСКОГО
АППАРАТА РАСТЕНИЙ КАРТОФЕЛЯ В УСЛОВИЯХ ДЕСТРУКЦИИ
ТУБУЛИНОВОГО ЦИТОСКЕЛЕТА
© 2020 г. И.Ю. Макеева, Т.И. Пузина
Орловский государственный университет имени И.С. Тургенева, 302026, Орел, ул.Комсомольская, 95
E-mail: makeevainna@inbox.ru
Поступила в редакцию 29.11.2019 г.
После доработки 28.05.2020 г.
Принята к публикации 02.06.2020 г.
Изучено влияние колхицина - деструктурирующего агента тубулинового цитоскелета - на пара-
метры флуоресценции хлорофилла, реакцию Хилла, нециклическое фотофосфорилирование и ре-
акцию перекисного окисления липидов у Solanum tuberosum, выращенных в почвенной культуре в
условиях вегетационного домика. Деструкция микротрубочек увеличила содержание гидропереки-
сей жирных кислот липидов - первичного продукта перекисного окисления липидов, изменила па-
раметры флуоресценции: увеличила F0, снизила Fm и максимальную квантовую эффективность
ФС II (Fv/Fm), повысила диссипацию энергии электронного возбуждения в тепло. Одновременно
выявлено уменьшение скорости реакции Хилла и интенсивности процесса нециклического фото-
фосфорилирования. Полученные в работе результаты обсуждаются в связи с нарушением целостно-
сти мембран хлоропластов, изменением параметров флуоресценции хлорофилла при действии кол-
хицина, а также с ранее полученными нами данными по изменению содержания и соотношения
фитогормонов в листьях картофеля в условиях деструкции микротрубочек.
Ключевые слова: флуоресценция хлорофилла, фотохимическая активность хлоропластов, нециклическое
фотофосфорилирование, перекисное окисление липидов, тубулиновый цитоскелет, колхицин, карто-
фель.
DOI: 10.31857/S0006302920050075
процесс фотофосфорилирования. Это позволит
Одним из направлений современной фото-
расширить наши знания о фотосинтетических
биологии является изучение состояния фотосин-
тетического аппарата растений в стрессовых
процессах в условиях стресса, изучаемых
как на уровне целого листа, так и на уровне хло-
условиях [1-4]. При этом основное внимание ис-
следователи уделяют изменению фотохимиче-
ропластов.
ских реакций в процессе фотосинтеза в ответ на
Мишенью стрессовых воздействий наряду с
действие неблагоприятных факторов. Однако
белками и нуклеиновыми кислотами являются
любой ответ растения на стресс начинается с фи-
клеточные мембраны. Известно, что элементы
зико-химических реакций [5]. Поэтому при оцен-
цитоскелета образуют с мембранами цитоскелет-
ке физиологического состояния растений важно
мембранный континуум [7]. Поэтому их струк-
использовать биофизические методы. Одним из
турное состояние, по-видимому, является важ-
таких методов является индукция флуоресцен-
ным условием, необходимым для протекания
ции. Ее параметры все чаще применяются при
мембранных процессов. Так, в работе [8] было
мониторинге действия стрессовых условий на
показано, что деструкция микротрубочек ориза-
растительный организм [2, 6].
лином или колхицином нарушала транспорт ак-
Для объективного анализа работы фотосинте-
вапоринсодержащих везикул, изменяла структу-
тического аппарата растений и его реакции на
ру аквапоринов - водных каналов, регулирую-
стрессовое воздействие необходимо сопоставлять
щих трансмембранный поток воды, а также
параметры флуоресценции с интенсивностью
снижала водоудерживающую способность, явля-
энергии квантов света, которые были использо-
ющуюся показателем термодинамического со-
ваны на фотохимическую работу, в частности на
стояния воды в клетке. Было выявлено, что инги-
Сокращения: ПОЛ
- перекисное окисление липидов,
биторы тубулинового цитоскелета препятствуют
ФС II - фотосистема II.
открытию устьиц на свету у Vicia faba, что может
903
904
МАКЕЕВА, ПУЗИНА
затруднять поступление СО2 [9]. В работе [10] по-
тения выращивали в почвенной культуре в усло-
казано значительное снижение общего дыхания и
виях вегетационного домика на агробиостанции
активности цитохромного пути транспорта элек-
Орловского государственного университета име-
тронов, но увеличение цианидрезистентного пу-
ни И.С. Тургенева. Для почвенной культуры ис-
ти при обработке проростков пшеницы колхици-
пользовали серую лесную среднесуглинистую
ном. Другой антимикротрубочковый агент - ори-
почву. В сосуде с 10 кг почвы выращивали одно
залин
- изменял форму и ультраструктуру
растение, поддерживая влажность почвы на уров-
митохондрий, они становились округлыми и
не 60% от полной влагоемкости. В период заклад-
имели меньшее количество крист. Деполимери-
ки опытов в почву вносили оптимальные количе-
зация микротрубочек нарушала белоксинтезиру-
ства азота, фосфора и калия в количестве соответ-
ющий аппарат в клетках мезофилла листьев и в
ственно 230, 70, 310 мг элемента на 1 кг почвы.
корнях пшеницы, а именно, вызывала распад по-
Деструкцию тубулинового цитоскелета прово-
лисом, что приводило к снижению содержания
дили через 15 сут после появления всходов путем
растворимых белков [11]. По данным работы [12],
двукратного опрыскивания растения (с интерва-
амипрофосметил - специфический деструктор
лом 6 ч) раствором алкалоида трополонового ряда
микротрубочек - останавливал митоз у каллуса
колхицина (Fluka, Швейцария) в концентрации
корней гусиной травки. Нарушение тубулиново-
1 мМ. Известно, что в этой концентрации колхи-
го цитоскелета динитроанилиновыми деструкто-
цин связывается с гетеродимером тубулина и
рами вызывало увеличение диаметра кончиков
предотвращает его полимеризацию, а также вы-
корней пшеницы из-за появления луковицеоб-
зывает быструю разборку микротрубочек
[7].
разных утолщений - свэллингов [13]. По мнению
Контрольные растения опрыскивали водой.
авторов работы [14], дезорганизация кортикаль-
Регистрацию параметров флуоресценции ли-
ных микротрубочек приводит к «расшатыванию»
стьев седьмого яруса срединной формации у ин-
рецепторной системы плазмалеммы и измене-
нию эффективности гормонального сигнала с
тактных растений проводили по методике, опи-
санной в работе [19], с использованием портатив-
участием Ca2+-сигнальной системы. Имеются
ного прибора MINI-PAM (Walz, Германия).
сведения, что от структурного состояния микро-
Перед измерением листья были адаптированы к
трубочек зависит как транспорт белка-рецептора
темноте. Математическую обработку данных осу-
ауксина (ABP1), так и латеральный транспорт
ществляли с помощью приложения CXSTAT к
данных фитогормонов [15]. Информация о зави-
компьютерной программе Excel.
симости фотосинтетической деятельности расте-
ний от целостности элементов цитоскелета
Фотохимическую активность изолированных
крайне ограничена. Ранее мы показали, что цито-
хлоропластов определяли по количеству восста-
халазин Б - деполимеризатор актинового цитос-
новленного на свету феррицианида калия [20].
келета
- оказывает негативное воздействие
Среда выделения хлоропластов содержала 0.35 М
на процесс фотофосфорилирования у Solanum
NaCl и 0.05 М трис-HCl-буфер (pН 8.0). Гомоге-
tuberosum [16]. Сведений о зависимости световых
нат фильтровали и дважды центрифугировали
реакций фотосинтеза от структурного состояния
при 2000 и 8000 об/мин. Хлоропласты, получен-
тубулинового цитоскелета в литературе не найде-
ные по данной методике, по степени интактности
но. Имеются лишь указания [17, 18] о действии
относятся к классу С. После ресуспендирования в
деструкторов микротрубочек амипрофосметила и
0.035 М NaCl с 0.05М трис-HCl-буфером (pН 8.0)
колхицина на движение и ориентацию хлоропла-
суспензию хлоропластов с 0.002М К3[Fe(CN)6]
стов у водорослей Dichotomosiphon tuberosus и
помещали в бюксы. Суспензия хлоропластов бы-
Vaucheria terrestris, что может иметь значение для
ла эквивалентна
0.05-0.10 мг хлорофилла.
регуляции процесса фотосинтеза.
Часть бюксов выставляли на свет (белый свет,
интенсивность освещения 340 мкмоль фотонов
Целью нашей работы было исследование не-
которых параметров флуоресценции хлорофил-
м-2 с-1) в специально смонтированную установ-
ла, реакции Хилла, интенсивности процесса фо-
ку с охлаждением (18°С), другую часть бюксов
тофосфорилирования, реакции перекисного
держали в темноте. Экспозиция составляла
окисления липидов (ПОЛ) в условиях деструкции
10 мин. Реакцию гасили 5%-й трихлоруксусной
микротрубочек колхицином.
кислотой. Оптическую плотность измеряли на
фотометре КФК-3-01 (ЗОМЗ, Россия) при длине
волны 420 нм.
МАТЕРИАЛЫ И МЕТОДЫ
Интенсивность нециклического фотофосфо-
Объектом исследований были растения карто-
рилирования изолированных хлоропластов опре-
феля (Solanum tuberosum L.) сорта «Жуковский
деляли по убыли неорганического фосфата [20].
ранний» селекции ФИЦ картофеля имени
Среда инкубации содержала: 12.5 мкмоль трис-
А.Г. Лорха (Коренёво Московской области). Рас-
НCl-буфер (рН 7.8), 3.5 мкмоль K3[Fe(CN)6],
БИОФИЗИКА том 65
№ 5
2020
ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА
905
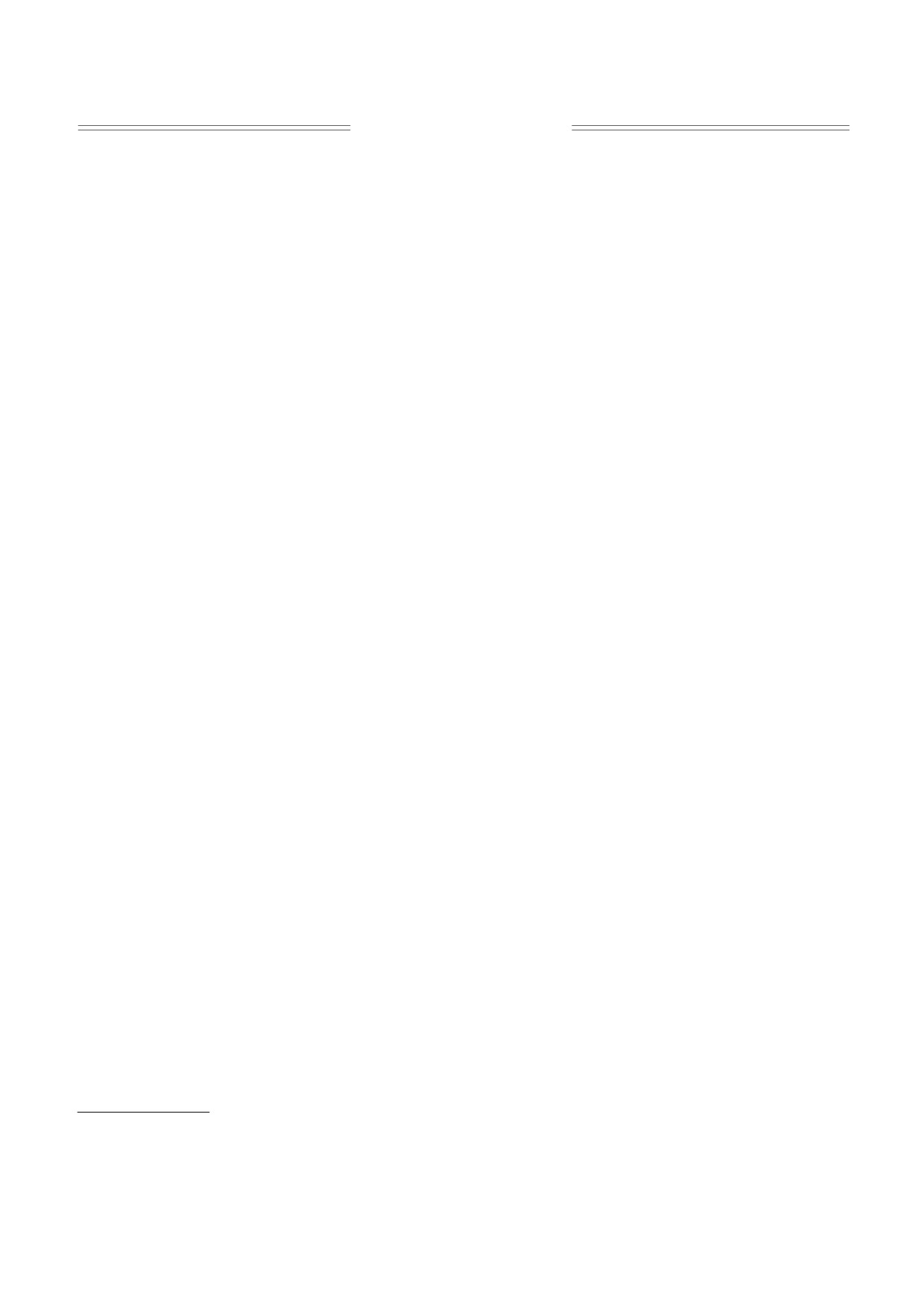
Рис. 1. Влияние колхицина на начальную (а) и максимальную (б) флуоресценцию.
3.5 мкмоль NaCl, 5 мкмоль KH2PO4, 5 мкмоль
при уровне доверительной вероятности
АДФ, 2.5 мкмоль MgCl2. Суспензия хлоропластов
выше 0.95.
была эквивалентна
0.07-0.14 мг хлорофилла.
Инкубацию начинали путем включения света
РЕЗУЛЬТАТЫ
(интенсивность освещения 340 мкмоль фотонов
Обработка растений картофеля 1 мМ раство-
м-2 с-1), она проходила в течение 10 мин на рас-
ром колхицина на 20% повысила начальную флу-
стоянии 20 см от лампы, при температуре 18-
оресценцию F0 (рис. 1), которая характеризует
20°С. Реакцию гасили 5%-й трихлоруксусной
уровень флуоресценции хлорофилла в условиях,
кислотой.
когда все реакционные центры фотосистемы II
Содержание фосфора определяли на полуав-
находятся в «открытом» рабочем состоянии, и яв-
томатическом мультикюветном спектрофотомет-
ляется индикатором энергетических потерь при
ре Clima MC-15 (RAL, Испания) при λ = 340 нм
переходе энергии возбуждения в антенне и от ан-
по реакции с молибдатом в кислой среде с образо-
тенны к реакционному центру фотосистемы II
ванием фосфомолибдатного комплекса. Исполь-
(ФС II) [3, 22]. Максимальная флуоресценция
зовали реактивы фирмы BioSistems (Испания)
хлорофилла Fm несколько снизилась (на 16%).
Содержание гидроперекисей жирных кислот
Это означает, что не все акцепторы электронов
липидов оценивали по реакции их взаимодей-
ФС II полностью восстановлены, и растение на-
ствия с роданистым аммонием [21]. Навеску ли-
ходится в состоянии стресса [3].
стьев растирали в 0.1 М буферном растворе трис-
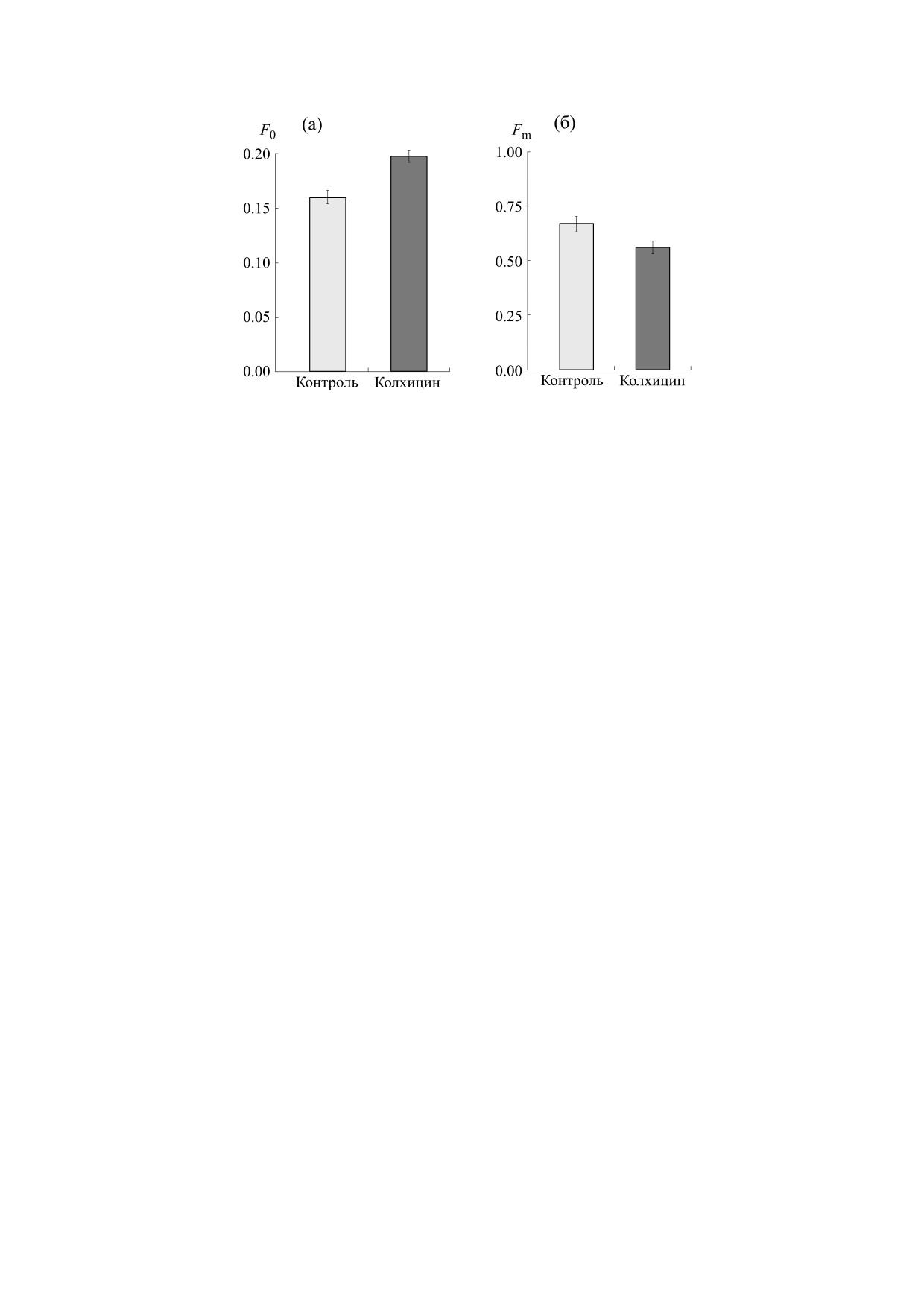
Расчет максимальной квантовой эффективно-
HCl (рН 7.6), содержащем 0.35 М NaCl, затем в
сти ФС II (Fv/Fm) показал уменьшение данного
течение
1
мин центрифугировали при
параметра флуоресценции на 23% в варианте с
2000 об/мин. К осажденному белку добавляли
колхицином (рис. 2). Одновременно отмечено
0.4 мл 50%-го раствора трихлоруксусной кисло-
ты, фильтровали и доводили объем экстракта до
увеличение на 25% нефотохимического тушения
флуоресценции, связанного с тепловыми потеря-
10 мл этанолом. Затем добавляли концентриро-
ми в фотосинтезе.
ванную HCl и 5%-й раствор соли Мора в 3%-й
HCl. Пробу интенсивно встряхивали и приливали
Фотосинтетическую активность растений оце-
20%-й раствор роданистого аммония. Через
нивают не только по параметрам флуоресценции
10 мин определяли оптическую плотность рас-
хлорофилла на уровне целого листа, но и по ин-
твора при λ = 480 нм.
тенсивности фотохимических реакций, в частно-
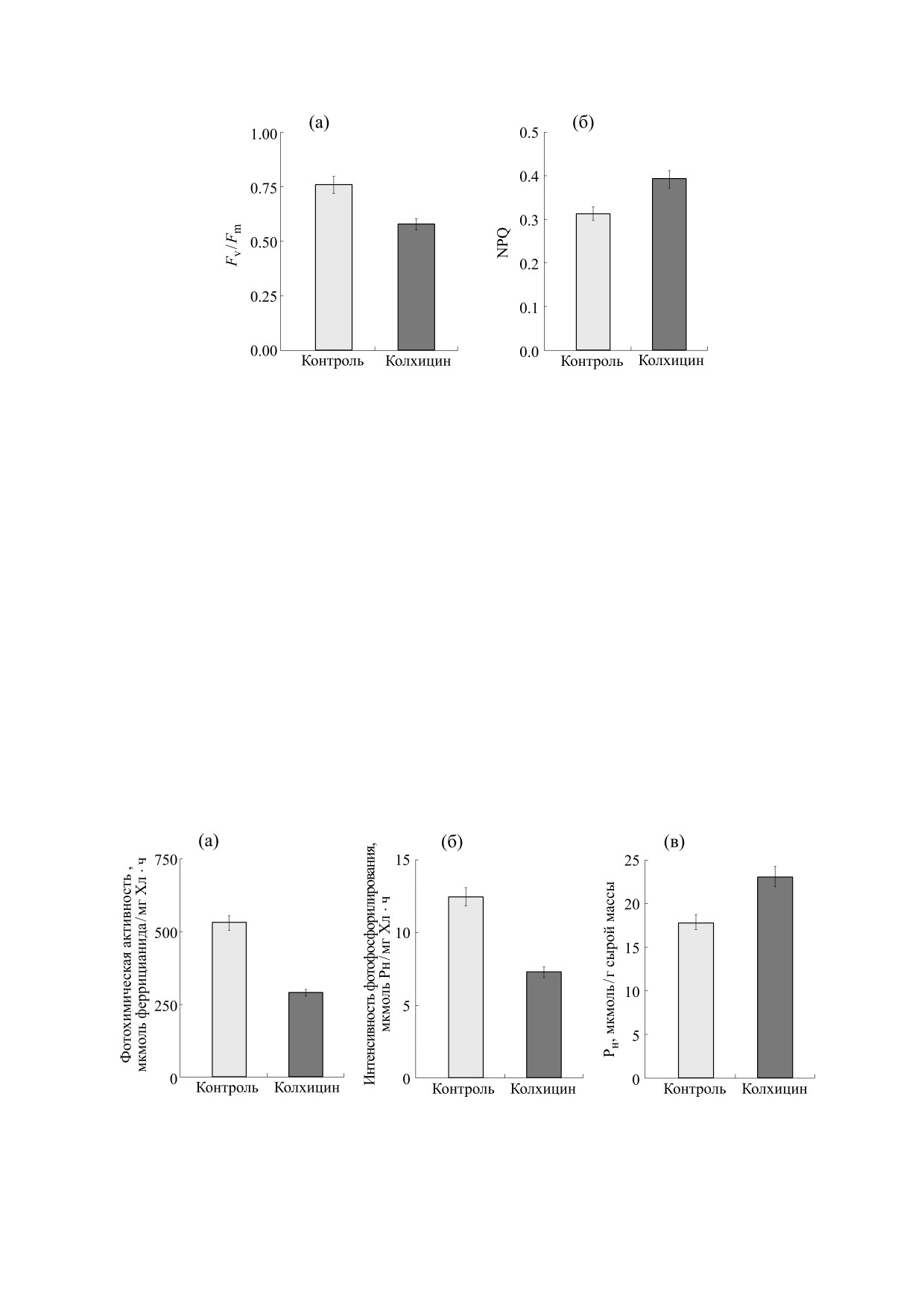
сти реакции Хилла. Так, полученные результаты
Для анализов отбирали листья растений сре-
(рис. 3) свидетельствуют о существенном сниже-
динной формации через 7 сут после обработки
нии (в 1.8 раза) под влиянием колхицина скоро-
колхицином. На рисунках представлены средние
сти восстановления акцептора электронов фер-
арифметические из пяти-десяти биологических
рицианида калия.
повторностей и их стандартные ошибки. Анали-
тическая повторность пятикратная. Достовер-
Процесс переноса электронов по электрон-
ность результатов оценивали с помощью крите-
транспортной цепи хлоропластов обычно сопря-
рия Стьюдента, считая достоверными различия
жен с синтезом АТФ. Определение интенсивно-
БИОФИЗИКА том 65
№ 5
2020
906
МАКЕЕВА, ПУЗИНА
Рис. 2. Влияние колхицина на максимальную квантовую эффективность ФС II (а) и нефотохимическое тушение
флуоресценции (б).
сти процесса фотофосфорилирования в нецикли-
ПОЛ. Как известно, активизация реакций ПОЛ
ческом потоке электронов выявило уменьшение
связана с нарушением в работе антиоксидантной
в 1.7 раза утилизации неорганического фосфата
системы. Вместе с тем практически отсутствуют
при деструкции микротрубочек колхицином
экспериментальные доказательства взаимосвязи
(рис. 3). Это сопровождалось повышением содер-
активности антиоксидантной системы и состоя-
жания фосфора в листьях на 28%.
ния цитоскелета. Ранее нами выяснено, что
деструкция микротрубочек снижает активность
Определение целостности мембран по первич-
пероксидазы на фоне резкого падения уровня
ным продуктам ПОЛ свидетельствует о накопле-
фитогормонов ауксинов и соотношения индоли-
нии гидроперекисей жирных кислот липидов под
луксусной и абсцизовой кислот в листьях карто-
влиянием колхицина. Их содержание в листьях
феля [23]. Отметим, что в литературе имеются
увеличилось на 27% (рис. 4).
сведения, касающиеся действия отдельных групп
экзогенных фитогормонов на экспрессию генов
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
антиоксидантных ферментов [24].
Проведенное исследование показало, что дей-
Следует заметить, что фитогормоны влияют не
ствие колхицина на тубулиновый цитоскелет яв-
только на работу антиоксидантной системы и ре-
ляется фармакологическим стрессом, о чем сви-
акции ПОЛ, но и на процесс фотосинтеза. В лите-
детельствует накопление гидроперекисей жир-
ратуре накоплен большой экспериментальный
ных кислот липидов - первичных продуктов
материал, касающийся стимулирующего влияния
Рис. 3. Влияние колхицина на фотохимическую активность хлоропластов (а), нециклическое фотофосфорилиро-
вание (б) и содержание фосфора в листьях растений картофеля (в).
БИОФИЗИКА том 65
№ 5
2020
ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА
907
цитокининов на содержание основного фотосин-
тетического пигмента - хлорофилла [25]. Cведе-
ния о влиянии ауксинов на содержание хлоро-
филла противоречивы и весьма малочисленны
[26]. При определении потенциальных возмож-
ностей фотосинтетического аппарата все чаще
прибегают к характеристике функциональной
активности хлоропластов на уровне световых ре-
акций и их регуляции [5]. Имеются данные, пока-
зывающие влияние экзогенных фитогормонов на
реакцию Хилла. При этом отмечается неодно-
значное действие цитокининов, стимулирование
под влиянием ауксинов и отсутствие эффекта при
обработке абсцизовой кислотой [27, 28]. Наши
предыдущие исследования свидетельствуют о за-
висимости нециклического фотофосфорилиро-
Рис. 4. Влияние колхицина на содержание гидропере-
вания от эндогенного содержания ауксинов в ли-
кисей жирных кислот липидов в листьях растений кар-
стьях картофеля [29]. Ингибирование синтеза
тофеля.
АТФ в хлоропластах отмечено при действии абс-
цизовой кислоты [27].
означает, что перед измерением растение было
Интегральным показателем фотосинтетиче-
подвергнуто влиянию стресса [3]. В исследовани-
ской деятельности растений является интенсив-
ях, проведенных на растениях картофеля в усло-
ность ассимиляции СО2. В большинстве работ
виях засухи [38], также отмечено снижение дан-
отмечается стимулирующее действие ауксинов,
ного параметра. На других видах растений в усло-
гиббереллинов, цитокининов и ингибирующее -
виях действия абиотических и биотических
абсцизовой кислоты на усвоение растениями СО2
стрессоров выявлены аналогичные изменения в
[25, 30]. В наших ранних исследованиях [31] вы-
максимальной квантовой эффективности ФС II
явлено, что максимальная ассимиляция 14СО2 в
[39, 40].
фазе бутонизации растений картофеля соответ-
Изменения показателей флуоресценции хло-
ствовала наибольшему содержанию индолилук-
рофилла происходили в условиях нарушения це-
сусной кислоты. Ряд авторов связывает действие
лостности мембран хлоропластов, о чем свиде-
фитогормонов на усвоение СО2 с регуляцией ра-
тельствует накопление первичных продуктов
боты устьичного аппарата, а также с активностью
ПОЛ (рис. 4). Как уже отмечалось, деструктури-
ключевого фермента цикла Кальвина - рибулоз-
рующие агенты микротрубочек существенно из-
обисфосфаткарбоксилазы [25, 30, 32].
меняют процессы, происходящие на мембранах,
в том числе и связанные с транспортом электро-
В литературе имеются некоторые сведения о
нов. Нарушение целостности тубулинового ци-
влиянии экзогенных фитогормонов на парамет-
тоскелета негативно сказалось на фотохимиче-
ры флуоресценции хлорофилла. В частности, по-
ской активности изолированных хлоропластов и
казано, что обработка проростков ячменя абсци-
на процессе нециклического фотофосфорилиро-
зовой кислотой в условиях гипертермии увеличи-
вания (рис. 3). Это может быть следствием дегра-
вала F0 [33], но снижала Fv/Fm у Ceratotheca triloba
дации мембран хлоропластов, изменения флуо-
в условиях засухи [34]. Вместе с тем в условиях за-
риметрических показателей хлорофилла, а также
сухи абсцизовая кислота повышала Fv/Fm в ли-
нарушений в фитогормональной системе. Из-
стьях батата [35]. Увеличение Fv/Fm выявлено при
вестно, что фитогормоны, как эндогенные регу-
обогащении проростков томатов гиббереллином
ляторы роста и развития растений, во многом
в условиях дефицита света [36]. Экзогенное при-
определяют интенсивность реакций световой фа-
менение 24-эпибрассинолида увеличивало ско-
зы фотосинтеза [27-29].
рость потока электронов у сои в условиях водного
Вопрос участия элементов цитоскелета в фор-
дефицита [37].
мировании гормонального статуса растений оста-
Полученные в настоящей работе результаты
ется до сих пор открытым. Имеющиеся в литера-
по параметрам флуоресценции хлорофилла в ва-
туре сведения не позволяют объяснить механизм
рианте с деструктурированным тубулиновым ци-
действия элементов цитоскелета на содержание
тоскелетом, в частности, снижение Fm и Fv/Fm, а
фитогормонов. Можно лишь отметить, что сни-
также увеличение нефотохимического тушения
жение уровня ауксинов в листьях, возможно, свя-
флуоресценции (рис. 1 и 2) свидетельствуют об
зано с нарушением транспорта данного фитогор-
изменении функциональной активности фото-
мона и его рецепторов [15]. Показано также, что
синтетического аппарата. Уменьшение Fv/Fm
разборка тубулинового цитоскелета влияет на
БИОФИЗИКА том 65
№ 5
2020
908
МАКЕЕВА, ПУЗИНА
экспрессию генов биосинтеза гиббереллина и
7. А. Фултон, Цитоскелет. Архитектура и хореогра-
абсцизовой кислоты [41]. Ранее опубликованные
фия клетки (Мир, М., 1987).
данные наших исследований [23] показывают су-
8. Л. П. Хохлова, Э. Палих и О. В. Олиневич, Цито-
щественное изменение содержания и соотноше-
логия 39 (4-5), 294 (1997).
ния фитогормонов в листьях картофеля при де-
9. M. Fukuda, S. Hasezawa, N. Asai, et al., Plant Cell
Physiol. 39, 80 (1998).
струкции микротрубочек колхицином, а именно
снижение количества индолилуксусной кислоты
10. Й. Р. Абдрахимова, Ф. А. Абдрахимов, А. Ф. Абд-
рахманова и др., Физиология растений 50 (5), 653
и зеатина, увеличение содержания абсцизовой
(2003).
кислоты и неизменный уровень гибберелловой
11. О. А. Тимофеева, Л. Д. Гараева, Ю. Ю. Чулкова и
кислоты.
др., Физиология растений 55 (3), 368 (2008).
Полученные в работе результаты позволяют
12. А. Ю. Ныпорко, А. И. Емец, Л. А. Климкина и др.,
заключить, что деструкция тубулинового цитос-
Физиология растений 49 (3), 459 (2002).
келета колхицином способствует накоплению
13. Л. П. Хохлова и М. В. Макарова, Ученые записки
гидроперекисей жирных кислот липидов - пер-
Казанского государственного университета. Есте-
вичных продуктов ПОЛ, изменяет параметры
ственные науки 148 (3), 65 (2004).
флуоресценции хлорофилла - уменьшает Fv/Fm и
14. Л. П. Хохлова и Ю. Ю. Невмержицкая, Ученые за-
увеличивает нефотохимическое тушение флуо-
писки Казанского государственного университета.
ресценции, что указывает на нарушение функци-
Естественные науки 153 (2), 147 (2011).
онирования электрон-транспортной цепи хлоро-
15. R. Godbole, W. Michalke, P. Nick, et al., Plant Biol. 2,
176 (2000).
пластов. Полученные нами ранее эксперимен-
тальные данные по изменению гормонального
16. Т. И. Пузина, В. Л. Ланцев и Н. С. Власова, Ученые
записки Орловского государственного универси-
статуса листьев растений картофеля в условиях
тета. Серия: Естественные, технические и меди-
деструктурированных микротрубочек [23] позво-
цинские науки 5, 228 (2011).
ляют полагать, что снижение интенсивности фо-
17. T. Maekawa, I. Tsutsui, and R. Nagai, Plant Cell Physi-
тохимической активности хлоропластов и про-
ol. 27 (5), 837 (1986).
цесса нециклического фотофосфорилирования в
18. F. Takahashi, T. Hishinuma, and H. Kataoka, Plant
варианте с колхицином может быть связано не
Cell Physiol. 42 (3), 274 (2001).
только с нарушением целостности мембран и из-
19. W. Bilger, U. Schreiber, M. Bock, Oecologia 102, 425
менением параметров флуоресценции хлорофил-
(1995).
ла, но и с изменением содержания и соотноше-
20. В. Ф. Гавриленко и Т. В. Жигалова, Большой прак-
ния фитогормонов.
тикум по фотосинтезу (Академия, М., 2003).
21. Л. А. Романова и И. Д. Стальная, Современные ме-
тоды в биохимии (Медицина, М., 1977).
КОНФЛИКТ ИНТЕРЕСОВ
22. N. R. Baker and E. Rosenquist, J. Exp. Bot. 55, 1607
Авторы заявляют об отсутствии конфликта
(2004).
интересов.
23. Т. И. Пузина, Н. С. Власова, И. Ю. Макеева и др.,
Цитология 58 (7), 555 (2016).
24. L. M. Guan and J. G. Scandalios, Physiol. Plantarum
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
114, 288 (2002).
Настоящая работа не содержит описания ка-
25. И. И. Чернядьев, Прикладная биохимия и микро-
биология 29 (5), 644 (1993).
ких-либо исследований с использованием людей
и животных в качестве объектов.
26. Л. П. Жданова и Т. Б. Корягина, Физиология рас-
тений 44 (2), 242 (1997).
27. Т. Е. Кренделева, А. В. Макеев и А. Т. Мокроно-
СПИСОК ЛИТЕРАТУРЫ
сов, Физиология растений 34 (5), 988 (1987).
28. J. Catsky, J. Pospisilova, I. Machackova, et al., Biol.
1. N. R. Baker, Annu. Rev. Plant Biol. 59, 89 (2008).
Plantarum 35, 393 (1993).
2. В. С. Лысенко, Т. В. Вардуни, В. Г. Сойер и В. П.
29. Т. И. Пузина, И. Г. Кириллова и Н. И. Якушкина,
Краснов, Фундаментальные исследования 4, 112
Докл. РАСХН 6, 29 (1998).
(2013).
30. Р. А. Борзенкова и М. В. Зорина, Физиология рас-
3. В. Н. Гольцев, Х. М. Каладжи, М. Пауновa и др.,
тений 37 (3), 546 (1990).
Физиология растений 63 (6), 881 (2016).
31. Т. И. Пузина, И. Г. Кириллова и Н. И. Якушкина,
4. В. Н. Попов, О. В. Антипина, А. А.Селиванов и др.,
Изв. РАН. Сер. биол. 2, 170 (2000).
Физиология растений 66 (1), 73 (2019).
32. T. Taybi, R. Sotta, H. Gehrig, et al., Bot. Acta 108 (3),
5. А. Б. Рубин, Принципы организации и регуляции пер-
240 (1995).
вичных процессов фотосинтеза. LV Тимирязевские
33. A. G. Ivanov, M. I. Kitcheva, A. M. Christov, et al.,
чтения (ОНТИ ПНЦ РАН, Пущино, 1995).
Plant Physiol. 98, 1228 (1992).
6. J. Flexas, J. M. Escalona, S. Evain, et al., Physiol. Plan-
34. N. A. Masondo, A. D. Aremu, M. G. Kulkarni, et al.,
tarum 114 (2), 231 (2002).
J. Plant Growth Regulation 38 (2), 385 (2019).
БИОФИЗИКА том 65
№ 5
2020
ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА
909
35. 35. J. Q. Wang, H. Li, Q. Liu, et al., J. Appl. Ecol. 31
38. P. S. Basu, A. Sharma, and N. P. Sukumaran, Photo-
(1), 189 (2020).
syntetica 35, 13 (1998).
39. O. H. Sayed, Photosynthetica 41 (3), 321 (2003).
36. L. Tao, Y. Hongjun, L. Qiang, C. Lin, et al., Frontiers
40. О. В. Яковлева, Е. В. Талипова, Г. П. Кукарских
in Plant 10, 490 (2019).
и др., Биофизика 50 (6), 1112 (2005).
37. Y. C. Pereira, W. S. Rodrigues, E. J. A. Lima, et al.,
41. M. Komorisono, M. Ueguchi-Tanaka, I. Aichi, et al.,
Photosynthetica 57 (1), 11(2019).
Plant Physiol. 138 (4), 1982 (2005).
The Functional State of the Photosynthetic Apparatus of Potato Plants
upon Destruction of the Tubulin Cytoskeleton
I.Yu. Makeevа and T.I. Puzina
Turgenev Orel State University, Komsomolskaya ul. 95, Orel, 302026 Russia
In our research we have investigated the effect of colchicine, a disrupting agent of the tubulin cytoskeleton,
on chlorophyll fluorescence parameters, Hill reaction, non-cyclic photophosphorylation and lipid peroxida-
tion reaction in Solanum tuberosum grown in soil in a greenhouse environment. The destruction of microtu-
bules caused an increase in the content of lipid fatty acid hydroperoxides, the primary product of lipid perox-
idation, led to changes in fluorescence parameters: F0 increased, Fm and the maximum quantum efficiency
of PSII (Fv/Fm) decreased, the dissipation of electronic excitation energy as heat enhanced. Simultaneously,
it was found that the Hill reaction rate and the intensity of the process of non-cyclic photophosphorylation
decreased. The results obtained in this work are discussed in view of destruction of chloroplast membrane in-
tegrity, changes in chlorophyll fluorescence parameters due to colchicine application as well as in light of our
previously obtained data on the change in the content of phytohormones and their concentration ratios in po-
tato leaves when microtubules are destroyed.
Keywords: chlorophyll fluorescence, chloroplast photochemical activity, non-cyclic photophosphorylation, lipid
peroxidation, tubulin cytoskeleton, colchicine, potato
БИОФИЗИКА том 65
№ 5
2020