БИОФИЗИКА, 2020, том 65, № 5, с. 924-931
БИОФИЗИКА КЛЕТКИ
УДК 557.18.04:34.17.23
ЭФФЕКТИВНОСТЬ КОНСЕРВАЦИИ В ЖИДКОМ АЗОТЕ МИКРОБИОТЫ
КИШЕЧНИКА ЧЕЛОВЕКА В ЗАВИСИМОСТИ ОТ СОСТАВА
КРИОЗАЩИТНОЙ СРЕДЫ
© 2020 г. Л.В. Заломова*, Д.А. Решетников*, С.В. Уграицкая*, Л.М. Межевикина*,
А.В. Загайнова**, В.В. Макаров**, С.М. Юдин**, Е.Е. Фесенко (мл.)*
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
**Центр стратегического планирования и управления медико-биологическими рисками здоровью МЗ РФ,
119435, Москва, ул. Погодинская, 10/1
E-mail: zalomova.91@mail.ru
Поступила в редакцию 30.06.2020 г.
После доработки 23.07.2020 г.
Принята к публикации 24.07.2020 г.
Проведен сравнительный анализ выживаемости микробиоты кишечника человека после низкотем-
пературной консервации под защитой проникающих (диметилсульфоксида и глицерина), непро-
никающих (желатин) и газовых (гелий) протекторов. Выявлена повышенная устойчивость кишеч-
ных бактерий к действию низких температур. Значительная часть бактерий (50.0 ± 3.0%) сохраняет
жизнеспособность после замораживания в жидком азоте без криопротектора(ов). Наибольшая со-
хранность достигается под защитой 5% диметилсульфоксида (86.0 ± 4.0%), 5% глицерина
(82.0 ± 5.2%) или 10% желатина (75.0 ± 5.0%). Сочетание проникающих в клетку (диметилсульфок-
сид, глицерин) и непроникающего (желатин) протекторов не приводит к синергическому эффекту.
Применение атмосферного гелия для криозащиты гетерогенной микробиоты кишечника человека
не повышает ее сохранность даже в сочетании с такими мощными протекторами, как диметилсуль-
фоксид и глицерин, что указывает на необходимость оптимизации криозащитных сред, в частно-
сти, для строгих анаэробов.
Ключевые слова: микробиота кишечника, криоконсервация, криопротекторы, жизнеспособность мик-
робных клеток, флуоресцентный анализ.
DOI: 10.31857/S0006302920050117
В этой связи особую актуальность приобретает
Кишечная микробиота как сложное симбио-
возможность сохранения микробиоты кишечни-
тическое сообщество имеет важное значение для
ка человека на длительное время (годы, десятиле-
здоровья, продолжительности и качества жизни
тия), что достижимо только при температуре
человека. Многие болезни тесно связаны с изме-
жидкого азота (-196°С). Подробные сведения о
нением баланса микробиоты кишечника [1, 2].
потенциальном применении микробиоты ки-
Современный образ жизни включает развитие
шечника в медицине и биотехнологии, а также
урбанизации, стрессы, изменение качества про-
анализ используемых методов консервации мик-
дуктов питания, прием антибиотиков и многое
робиоты были представлены в нашей обзорной
другое, что оказывает негативное влияние на бак-
работе [7]. На сегодняшний день проблема долго-
териальные сообщества, заставляя их изменять
временного хранения сложных микробных сооб-
свою численность, состав, биохимические свой-
ществ, населяющих желудочно-кишечный тракт
ства в организме человека [3, 4]. В настоящее вре-
человека, еще не решена.
мя встает вопрос о необходимости сохранения
Исследования проводятся в основном на мик-
эволюционно сложившихся представителей ки-
робиоте кишечника человека, замороженной до
шечной микрофлоры для восстановления состава
температуры -20°С и/или -80°С [8-13]. Срок
и функций микробиоты путем ауто- либо аллопе-
хранения биоматериала при таких температурах
ресадок [5, 6].
ограничен несколькими месяцами, в течение ко-
торых осуществляется мониторинг генотипиче-
Сокращениe: ДМСО - диметилсульфоксид.
ской и фенотипической изменчивости микроор-
924
ЭФФЕКТИВНОСТЬ КОНСЕРВАЦИИ В ЖИДКОМ АЗОТЕ МИКРОБИОТЫ
925
ганизмов. Очевидно, что для более пролонгиро-
ческих протекторов в составе криозащитной сре-
ванного хранения кишечной микрофлоры
ды [23].
требуется температура жидкого азота [5, 13, 14].
Исследований по низкотемпературной консерва-
МАТЕРИАЛЫ И МЕТОДЫ
ции сложных бактериальных сообществ не так
много. Тем не менее есть сообщение о сохранно-
Объект исследования - микробиота кишечни-
сти анаэробных и аэробных представителей мик-
ка человека в виде бактериальной суспензии. В
рофлоры кишечника человека после криоконсер-
экспериментах использованы образцы микро-
вации в жидком азоте [15]. Для защиты микроб-
биоты (просветная микробиота) от взрослых до-
ных клеток были использованы такие природные
норов.
вещества, как желатин, муцин, леван или агароза.
Выделение бактериальных клеток. Клеточную
Для индивидуальных штаммов бактерий приме-
суспензию готовили из расчета 0.1 г фекальной
няют в основном проникающие (диметилсуль-
массы в 0.9 мл стерильного солевого изотониче-
фоксид (ДМСО), глицерин, этиленгликоль и др.)
ского раствора 0.9% NaCl (1 мл), тщательно пере-
и/или не проникающие (сахароза, желатин, тре-
мешивали до гомогенной консистенции. Для от-
галоза, инулин, полиэтиленгликоль и др.) про-
деления бактерий от посторонних примесей ис-
текторы [12, 13, 16, 17].
пользовали двукратное центрифугирование:
Наибольшее распространение получили про-
сначала в 0.9% NaCl при 1200 об/мин в течение
токолы консервации для большинства бактерий с
5 мин, затем в 0.9% NaCl при 10000 об/мин в тече-
использованием 10-15% ДМСО или глицерина
ние 10 мин; далее подсчитывали общее количе-
[18, 19]. Непроникающие высокомолекулярные
ство клеток в суспензии для каждого образца
полимеры природного и синтетического проис-
микробиоты.
хождения (сахара, полиэлектролиты, мукополи-
Определение количества бактериальных клеток
сахариды) считаются менее эффективными и
в суспензии. Подсчет клеток проводили по методу
реже используются для криозащиты микроорга-
Виноградского-Брида для определения числен-
низмов. Однако недавно в исследовании, прове-
ности микроорганизмов в естественных микро-
денном с целью разработки метода сохранения
биоценозах [24]. Общее количество клеток под-
кишечной микробиоты, было установлено, что
считывали в 1 мл бактериальной суспензии под
наибольшая выживаемость бактериальных кле-
микроскопом с иммерсионным объективом
ток достигается при совместном использовании
(Axioscop 40, Carl Zeiss, Германия) при увеличении
полиэтиленгликоля и поливинилового спирта
объектива 40×.
[20]. Важными факторами помимо подбора крио-
В экспериментах использовали клеточные
протекторов, которые необходимо учитывать при
суспензии в концентрации (2.0-2.5) ⋅ 108 клеток в
разработке протоколов криоконсервации, явля-
1 мл среды. Образцы индивидуальной микробио-
ются скорости замораживания и оттаивания, со-
ты человека различались между собой по общему
став базовых растворов, используемых в криоза-
щитных средах, индивидуальные морфологиче-
содержанию клеток в пределах от 0 до 2 ⋅ 108 кле-
ские и физиологические свойства самих клеток
ток в 1 мл.
[17, 21, 22].
Криоконсервация микробиоты в жидком азоте.
Целью данного исследования была оценка эф-
Бактериальные суспензии переносили в крио-
фективности криоконсервации микробиоты ки-
пробирки в объеме 1 мл среды с добавлением
шечника человека в жидком азоте под защитой
криопротектора(ов), после чего образцы замора-
живали путем прямого погружения криопроби-
универсальных проникающих протекторов
ДМСО и глицерина, непроникающего протекто-
рок в жидкий азот. Охлаждение суспензии в таких
ра желатина, а также газовой атмосферы гелия.
условиях происходит со средней скоростью
Исследуемые протекторы использовали в разных
88 ± 1.5°С/мин. Время между добавлением крио-
концентрациях и сочетаниях, полагая, что сим-
протекторов в пробирки и их погружением в жид-
кий азот составляло примерно 5-10 мин. Дли-
биотические бактерии желудочно-кишечного
тракта могут существенно различаться по чув-
тельность хранения образцов в жидком азоте про-
ствительности/устойчивости к действию низких
должалась от двух до семи суток. По истечении
температур и молекулярным механизмам крио-
этого времени образцы размораживали на водя-
протекции. Выбор гелия в качестве защитного
ной бане 37°С. После размораживания клетки
бактерий осаждали путем центрифугирования
агента для микробиоты человека был обусловлен
тем, что этот газ, во-первых, не оказывает цито-
при 10000 об/мин в течение 10 мин, затем ресус-
токсических эффектов [23], что актуально для
пендировали в 0.9% NaCl для определения их
любого биоматериала медицинского назначения.
жизнеспособности.
Во-вторых, потенциальное преимущество при-
Криопротекторы. Для криопротекции исполь-
менения гелия заключается в снижении концен-
зовали 5% и 10% растворы ДМСО, глицерина
трации (и, следовательно, токсичности) класси-
(Sigma, США) и желатина (PanReac AppliChem,
БИОФИЗИКА том 65
№ 5
2020
926
ЗАЛОМОВА и др.
Китай), как по отдельности, так и в различных со-
ресценции при разных разведениях бактериаль-
четаниях. Криозащитные среды готовили на 0.9%
ных суспензий по соотношению живых и мерт-
NaCl. Этот же раствор применяли для приготов-
вых бактерий: 0:100, 10:90, 50:50, 90:10 и 100:0. Для
ления бактериальных суспензий и для их замора-
получения суспензии мертвых клеток использо-
живания (отрицательный контроль без использо-
вали 96% этиловый спирт (30-40 мин экспозиции
вания криопротекторов). Для изучения влияния
при комнатной температуре). Все варианты раз-
газовой атмосферы на выживаемость микробио-
ведений раскапывали по 100 мкл на 96-луночный
ты кишечника в процессе замораживания-оттаи-
планшет, затем в каждую заполненную лунку до-
вания использовали гелий. Бактериальные сус-
бавляли по 100 мкл флуоресцентных красителей
пензии, содержащие классические протекторы, а
LIVE/DEAD BacLight и через 15 мин измеряли
также контрольные образцы выдерживали в ат-
интенсивность флуоресценции на фотометре
мосфере гелия в специальных пластиковых
FilterМax F5 для построения калибровочной кри-
шприцах на шейкере при температуре 20°С, как
вой с целью определения процента живых бакте-
это описано в нашей работе [23]. В первой серии
рий по следующей формуле:
экспериментов образцы микробиоты насыщали в
Fcell,em
1
атмосфере воздуха и гелия в течение 1 ч. Во вто-
Ratio
=
(1)
G/R
рой серии экспериментов продолжительность на-
Fcell,em
2
сыщения в газах при постоянном покачивании
Это соотношение отражает зависимость ин-
составила 3 ч.
тенсивности флуоресцентного излучения от со-
держания активного флуоресцентного красителя
Исследование токсических эффектов криопро-
в бактериальных клетках и позволяет определить
текторов. Исследование цитотоксичности защит-
процент жизнеспособных бактерий до и после
ных агентов (ДМСО и глицерин) проводили при
криоконсервации.
помощи эквилибрации бактериальных суспензий
с 5% и 10% ДМСО и глицерина без заморажива-
Статистическая обработка результатов. Стати-
ния в жидком азоте. Экспозиция образцов дли-
стическую обработку экспериментальных дан-
лась от 30 до 60 мин. После этого определяли ко-
ных осуществляли при помощи программы
личество живых клеток с помощью флуоресцент-
SigmaPlot 14.0, вычисляя общее значение флуо-
ного теста.
ресценции клеток, среднее значение и стандарт-
ную ошибку. Достоверность различий между раз-
Оценка жизнеспособности микробиоты. Срав-
ными группами сравнения проводили с примене-
нительный анализ жизнеспособности бактерий
нием непараметрического критерия Манна-
до и после криоконсервации проводили флуорес-
Уитни.
центным методом с использованием LIVE/DEAD
BacLight Bacterial Viability Kit 7007 (Molecular
Probe, США), обеспечивающим высокий уровень
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
корреляции результатов с данными микробиоло-
Сохранность микробных сообществ при низко-
гического культивирования [15, 25, 26]. Оценку
температурной консервации под защитой классиче-
проводили по соотношению живых и мертвых
ских криопротекторов. Исследование цитотоксиче-
клеток по интенсивности флуоресценции краси-
ских эффектов диметилсульфоксида и глицерина на
телей SITO9 и пропидиум йодида, дающих зеле-
бактериальные клетки. В ходе проведения экспе-
ный и красный спектры при длине волны 480-
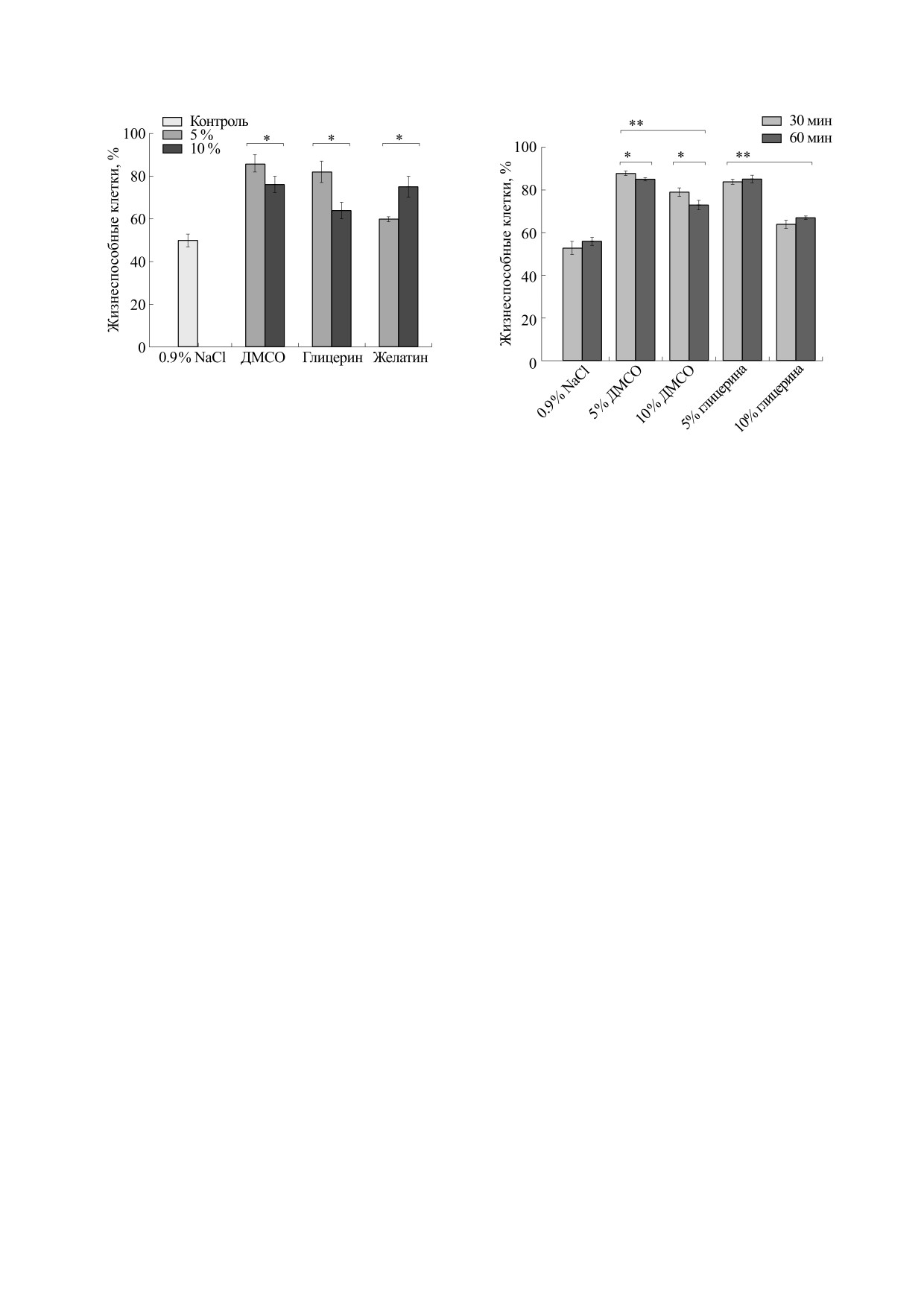
риментов было показано (рис. 1), что 50.0 ± 3.0%
500 и 490-635 нм соответственно. Бактериальные
бактерий, составляющих микробиоту кишечника
суспензии перед анализом центрифугировали
человека, сохраняют жизнеспособность при
при 10000 об/мин в течение 15 мин для удаления
быстром замораживании в растворе 0.9% NaCl
белков и нуклеиновых кислот, которые могут
без добавления каких-либо криопротекторов при
связывать флуоресцентные красители SYTO9 и
сроках хранения образцов до семи суток.
пропидиум йодид и влиять на результаты тести-
Сравнительный анализ результатов флуорес-
рования. После центрифугирования супернатант
центного тестирования на жизнеспособность об-
сливали, а осадок ресуспендировали в 1 мл 0.9%
разцов микробиоты, замороженных в растворах
NaCl. Перед тестированием бактериальные клет-
проникающих (ДМСО и глицерин) и непроника-
ки инкубировали с флуоресцентными красителя-
ющих (желатин) криопротекторов показал, что
ми при комнатной температуре 20°С в течение
максимальный процент жизнеспособных клеток
15 мин, затем анализировали с помощью микро-
кишечной микрофлоры достигается в случае ис-
планшетного фотометра FilterMax F5 (Molecular
пользования 5% и 10% растворов ДМСО, 5% рас-
Devices, США).
твора глицерина или 10% раствора желатина
Количественное определение живых и мертвых
(рис. 1). Данные протекторы обеспечивали со-
бактерий по интенсивности флуоресценции. Перед
хранность бактериальных клеток после замора-
проведением флуоресцентного анализа снимали
живания и трехсуточного хранения в жидком азо-
контрольные показатели интенсивности флуо-
те на уровне 86.0 ± 4.0, 76.0 ± 4.0%, 82.0 ± 5.2 и
БИОФИЗИКА том 65
№ 5
2020
ЭФФЕКТИВНОСТЬ КОНСЕРВАЦИИ В ЖИДКОМ АЗОТЕ МИКРОБИОТЫ
927
Рис. 1. Жизнеспособность микробиоты кишечника
человека после криоконсервации в жидком азоте
(температура -196°С, срок хранения 72 ч) в 0.9%
NaCl (отрицательный контроль), 5% и 10% криоза-
щитных растворах ДМСО, глицерина и желатина
(n = 25). * - Достоверность различий жизнеспособ-
Рис. 2. Жизнеспособность микробиоты кишечника че-
ности (Р < 0.05) микробиоты кишечника при ис-
ловека после эквилибрации в 5% и 10% растворах
пользовании криозащитных растворов в различных
ДМСО, глицерина в течение 30 и 60 мин (n = 20). * - До-
концентрациях согласно непараметрическому кри-
стоверность различий жизнеспособности кишечных
терию оценки достоверности результатов Манна-
бактерий (Р ≤ 0.05) по времени экспозиции в ДМСО со-
Уитни.
гласно критерию Манна-Уитни; ** - достоверность
различий жизнеспособности кишечных бактерий
(Р ≤ 0.05) после эквилибрации при сравнении разных
75.0 ± 5.0% соответственно. При этом исходный
концентраций растворов ДМСО и глицерина согласно
уровень сохранности бактериальных клеток в
критерию Манна-Уитни.
образцах кишечной микробиоты до криоконсер-
вации составлял 82-90% жизнеспособных бак-
терий.
щих протекторов для некоторых кишечных мик-
роорганизмов.
Исследование уровня выживаемости клеток в
зависимости от использования 5%-х или 10%-х
Исследование зависимости цитотоксического
растворов проникающих и непроникающих
эффекта от концентрации криопротекторов и
криопротекторов показал различную картину.
времени эквилибрации приведены на рис. 2. По-
Так, увеличение концентрации желатина с 5 до
вышение концентрации криопротекторов с 5% до
10% повышало процент жизнеспособных клеток
10% в условиях эквилибрации с бактериями при
с 60.0 ± 0.8 до 75.0 ± 5.0%. В отличие от желатина,
температуре 20°С достоверно снижало процент
ДМСО и глицерин в более низкой концентрации,
жизнеспособных бактериальных клеток с
напротив, оказывали более выраженный криоза-
88.0 ± 1.0% и
84.0
± 1.0% до 79.0 ± 2.0% и
щитный эффект (рис. 1). Повышение концентра-
64.0 ± 2.0% для ДМСО и глицерина соответ-
ции этих криопротекторов с 5% до 10% достовер-
ственно. Кроме того, увеличение времени экспо-
но снижало процент жизнеспособных клеток по-
зиции с 30 до 60 мин также снижало выживае-
сле размораживания с 86.0 ± 4.0 до 76.0 ± 4.0% и с
мость бактериальных клеток как для 5%-го, так и
82.0 ± 5.0 до 64.0 ± 4.0% для ДМСО и глицерина
соответственно.
для 10%-го ДМСО. Однако при использовании
глицерина увеличение времени экспозиции при
Данные различия можно объяснить разным
комнатной температуре не приводило к сниже-
механизмом действия рассматриваемых криоза-
нию процента живых клеток: 84.0 ± 1.0% и
щитных агентов. Желатин относится к числу сла-
85.0 ± 2.0% для 5%-го глицерина и 64.0 ± 2.0 и
бых по своим свойствам непроникаюших крио-
67.0 ± 1.0% для 10%-го глицерина. Как 30-, так и
протекторов [11]. Повышение его концентрации
60-минутная экспозиция в 10%-м растворе глице-
в среде замораживания до 10% положительно
рина при комнатной температуре снижали долю
влияет на общую сохранность микробных клеток.
Более низкие показатели жизнеспособности
живых микробных клеток до 60%. Сравнение
микробиоты в 10%-х растворах ДМСО и глицери-
ДМСО и глицерина продемонстрировало боль-
на по сравнению с 5%-ми растворами, как мы по-
шую токсичность последнего при увеличении
лагаем, связаны с токсичностью этих проникаю-
концентрации до 10%.
БИОФИЗИКА том 65
№ 5
2020
928
ЗАЛОМОВА и др.
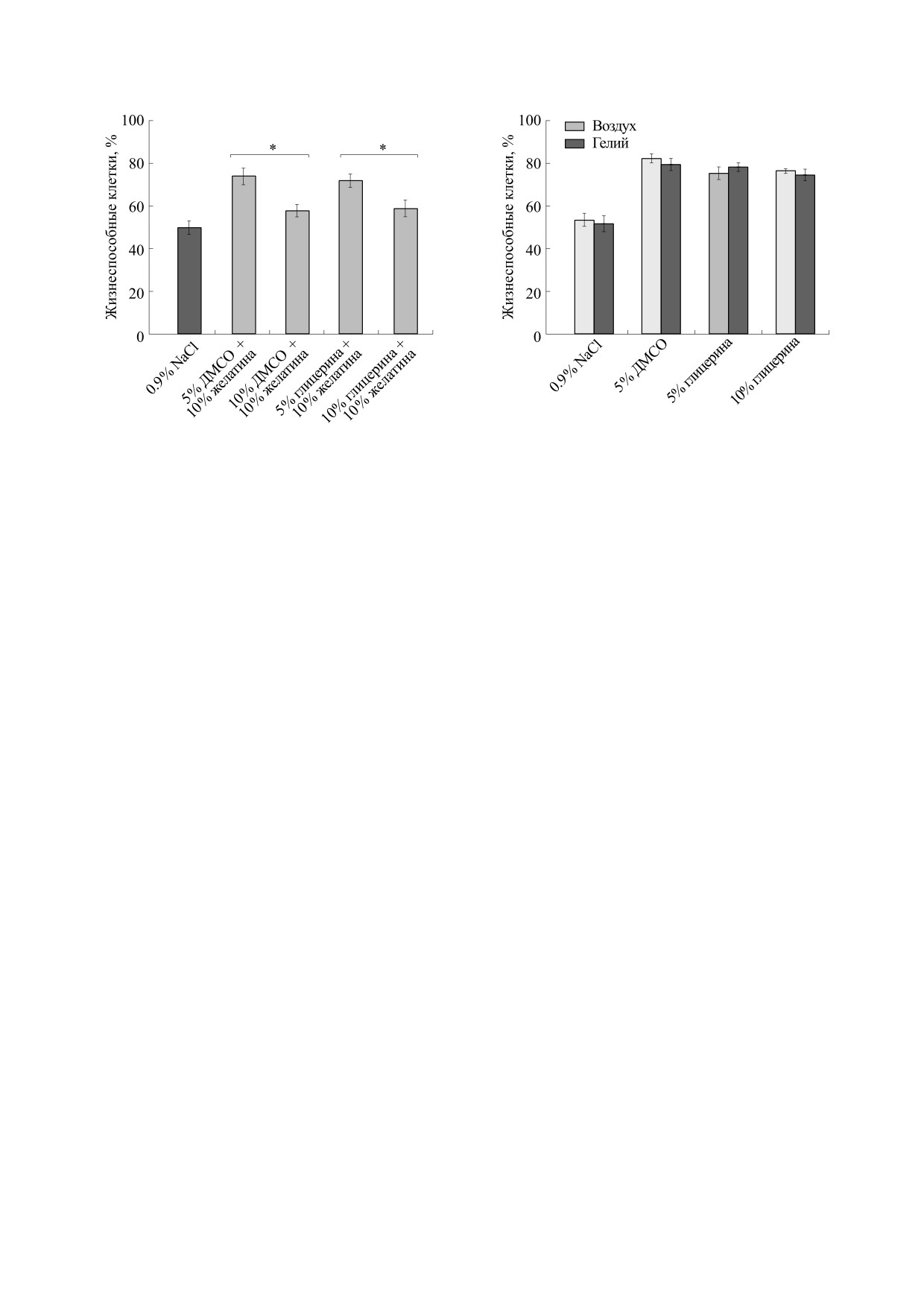
Рис. 4. Жизнеспособность микробиоты кишечника
Рис. 3. Жизнеспособность микробиоты кишечника
человека после криоконсервации в жидком азоте
человека после криоконсервации в жидком азоте
(температура -196° С, срок хранения 72 ч) в 0.9% Na-
(температура -196°С, срок хранения 72 ч) в 0.9% NaCl
Cl (отрицательный контроль), 5% растворах ДМСО и
(отрицательный контроль),
5% и 10% растворах
глицерина и 10% растворе желатина, насыщенной в
ДМСО, глицерина в комбинации с 10%-м желатином
атмосфере воздуха и гелия (n = 13).
(n = 15). * - Достоверное повышение жизнеспособ-
ности микробных сообществ (Р ≤ 0.05) после крио-
консервации с 5% ДМСО и 10% желатина, а также с
ровали более слабые криозащитные эффекты -
5% глицерина и 10% желатина по сравнению с замо-
58.0 ± 3.0% и 59.0 ± 4.0% живых клеток соответ-
раживанием в 10% ДМСО и 10% желатина, а также в
ственно, соизмеримые с показателями жизнеспо-
10%-м глицерине и 10%-м желатине.
собности бактерий после криоконсервации в
0.9% растворе NaCl без протекторов. Таким обра-
Сохранность микробных сообществ при низко-
зом, ожидаемый синергический эффект не на-
температурной консервации под защитой комбина-
блюдался.
ции проникающих и непроникающих криопротекто-
Сохранность микробных сообществ при низко-
ров. Для надежного сохранения микробного
сообщества кишечника человека, характеризую-
температурной консервации под защитой гелия.
щегося широким спектром разных типов бакте-
Проведенные эксперименты по исследованию
рий в своем составе, перспективным представля-
влияния газовой атмосферы гелия на сохран-
ется использование криозащитных смесей, со-
ность бактериальных клеток микробиоты кишеч-
стоящих из нескольких защитных агентов
ника человека в процессе криоконсервации
разного механизма действия. В поисках синерги-
выявили отсутствие положительного криозащит-
ческого эффекта мы оценили эффективность
ного эффекта инертного газа. Процесс криокон-
криоконсервации микробиоты кишечника чело-
сервации в данных экспериментах предусматри-
века при совместном использовании ДМСО с же-
вал эквилибрацию в атмосфере гелия или воздуха
латином и глицерина с желатином, рассчитывая
в течение 1 ч перед погружением в жидкий азот.
достигнуть значимого подавления как внеклеточ-
Ввиду того, что половина бактерий микрофлоры
ной, так и внутриклеточной кристаллизации. Ре-
кишечника остается жизнеспособной после
зультаты этих исследований представлены на
криоконсервации в 0.9% NaCl, контролем в дан-
рис. 3.
ном эксперименте была атмосфера воздуха, не-
смотря на преобладание анаэробных представи-
Как следует из рис. 3, показатели сохранности
бактериальных клеток при использовании ком-
телей в кишечнике человека. На рис. 4 приведены
бинации 5% ДМСО с 10%-м желатином, а также
усредненные данные количества живых клеток
5% глицерина с 10%-м желатином составили
после размораживания: 54.0 ± 3.0% и 52.0 ± 4.0%
74.0 ± 4.0 и 72.0 ± 3.0% соответственно и тем са-
для отрицательного контроля,
83.0
± 2.0 и
мым не превысили уровень жизнеспособных кле-
80.0 ± 3% - для ДМСО, 76.0 ± 3.0% и 79.0 ± 2% -
ток, достигнутый при использовании этих же
для глицерина, 77.0 ± 1.0% и 75.0 ± 3.0% - для же-
криопротекторов в монорежиме: 86.0 ± 4.0% в 5%
латина в среде воздуха и гелия соответственно.
ДМСО, 82.0 ± 5.2% в 5% глицерине, 75.0 ± 5.0 - в
Увеличение времени эквилибрации в газовой
10% желатине. При этом 10% ДМСО и 10% глице-
среде с 1 до 3 ч также не выявило криозащитного
рин в сочетании с 10% желатином продемонстри-
эффекта гелия (данные не приведены).
БИОФИЗИКА том 65
№ 5
2020
ЭФФЕКТИВНОСТЬ КОНСЕРВАЦИИ В ЖИДКОМ АЗОТЕ МИКРОБИОТЫ
929
В процессе работы основной целью ставился
убывания следующим образом: Pseudomonas aeru-
поиск криозащитных составов, обеспечивающих
ginosa, Escherichia coli, Bacillus cereus, Staphylococcus
оптимальные условия для замораживания, под-
aureus, Lactobacillus casei, Klebsiella pneumonie и Sal-
ходящие для большинства представителей мик-
monella enterica [17]. Данная концентрация рас-
рофлоры кишечника человека.
твора ДМСО может снижать пролиферативную
Весьма интересные результаты были получены
активность некоторых видов аэробных бактерий
[18, 22]. В случае с глицерином наиболее чувстви-
при исследовании выживаемости клеток с помо-
тельными к его 10%-й концентрации являются
щью флуоресцентного анализа LIVE/DEAD Ba-
Chlamydia spp. [30], Staphylococcus, Micrococcus,
cLight. Они показывают, что в процессе криокон-
Lactococcus, Streptococcus, Pseudomonas и E. coli [31].
сервации микробиоты человека половина общего
числа симбиотических микроорганизмов выжи-
К тому же показано, что глицерин в концентра-
ции 10-25% токсичен для грамотрицательных
вает без использования криопротекторов (рис. 1).
(Escherichia coli) и грамположительных (Bacillus
Скорее всего, такая криоустойчивость бактерий
subtilis) бактерий и микобактерий (Mycobacterium
связана с различиями в строении клеток по срав-
smegmatis), входящих в состав микробиоты ки-
нению с эукариотами, а именно наличием особой
клеточной стенки у бактерий. Известно, что в со-
шечника человека [15]. В отличие от ДМСО, гли-
церин медленно проникает через клеточные
став микробиоты кишечника входят как грампо-
стенки и плазматические мембраны бактерий при
ложительные, так и грамотрицательные виды
низких значениях температур, и это также может
микрорганизмов. Грамотрицательные бактерии с
влиять на результаты более слабого криозащит-
непроницаемой клеточной стенкой имеют мень-
шую устойчивость к низкотемпературной крио-
ного действия глицерина по сравнению с ДМСО
для некоторых видов микроорганизмов [14].
консервации и лиофилизации, чем грамположи-
тельные микроорганизмы [27]. В результате этого
Желатин как непроникающий протектор име-
они погибают из-за повреждения плазматических
ет другой механизм криозащитного действия, на-
мембран. По отношению к кислороду примерно
правленный на стабилизацию клеточных мем-
95% приходится на анаэробную составляющую
бран и предотвращение образования внеклеточ-
микрофлоры кишечника человека. Следователь-
ного льда [32, 33]. Он совершенно нетоксичен для
но, эта группа бактерий является особо уязвимой
бактериальных клеток, что позволяет использо-
при криоконсервации микробиоты. Это служит
вать его в концентрации 10%. Однако сочетание
важным доводом для обязательного использова-
5%-го и 10%-го ДМСО или глицерина с 10% же-
ния в низкотемпературном замораживании мик-
латина не дает заметного преимущества в сохран-
робиоты криопротекторов с целью сохранения
ности бактериальных сообществ после криокон-
количественного и видового разнообразия ки-
сервации. Комбинация
10% желатина с
10%
шечной микрофлоры при температуре жидкого
ДМСО или глицерина приводит к нивелирова-
азота в течение длительного периода времени.
нию криозащитных свойств проникающих про-
текторов, хотя каждый из этих по отдельности
К настоящему времени известно, что прони-
кающие протекторы действуют на клеточные
обеспечивает хорошую и надежную криозащиту
мембраны бактерий. Они способны связывать
как симбиотических микробных сообществ ки-
шечника (рис. 1), так и коллекций микробиоло-
внутриклеточную воду, защищая клетки от обра-
гических культур [14, 22]. По-видимому, это свя-
зующихся во время криоконсервации кристаллов
зано с инактивацией белковых молекул желатина
льда [28, 29]. Анализ многих публикаций, касаю-
щихся криоконсервации микроорганизмов, по-
в результате взаимодействия с ДМСО и глице-
рином.
казывает, что наиболее эффективными для крио-
защиты бактериальных клеток являются раство-
Таким образом, несмотря на различия между
ры ДМСО и глицерина [23, 28]. В основном их
ДМСО, глицерином и желатином по механизмам
используют в высоких концентрациях - 10-15%.
криозащитного действия, при совместном их ис-
Однако главным недостатком этих криопротек-
пользовании в концентрациях 5-10% они обес-
торов при таких концентрациях является их ток-
печивают примерно одинаковый уровень сохран-
сичность по отношению к клеткам. Это подтвер-
ности кишечной микрофлоры после криоконсер-
ждают наши экспериментальные данные флуо-
вации в жидком азоте (60-75%). Использование
ресцентного тестирования и исследования
газовой атмосферы гелия, как показали наши ис-
цитотоксичности, из которых следует, что под за-
следования, оказалось не эффективным. Об этом
щитой 5% ДМСО и глицерина бактериальные
свидетельствуют результаты, полученные при на-
клетки сохранялись на уровне интактных образ-
сыщении бактериальных суспензий гелием в те-
цов. В ряде других исследований также было об-
чение 1 ч (рис. 4). Аналогичная картина наблюда-
наружено, что после замораживания микробиоты
лась при обработке клеточных суспензий гелием
кишечника человека до криогенных температур
в течение 3 ч. Вероятно, при криоконсервации
(-80°С и -196°С) в растворах 10% ДМСО жизне-
бактериальных клеток гелий не оказывает замет-
способность бактерий распределяется в порядке
ного влияния, подобного наблюдаемому при
БИОФИЗИКА том 65
№ 5
2020
930
ЗАЛОМОВА и др.
криоконсервации клеточных культур Hela и L929,
6. D. P. Bojanova and S. R. Bardenstein, PLoS Biol. 14,
в связи с различием в механизме криоповрежде-
e1002503 (2016).
ний эукариотических и прокариотических кле-
7. D. V. Smirnova, L. V. Zalomova, A. V. Zagainova, et al,
ток. На клеточных культурах теплокровных жи-
Int. J. Med. Microbiol. 309, 259 (2019).
вотных такой прием, наоборот, приводит к улуч-
8. C. L. Lauber, N. Zhou, J. I. Gordon, et al., FEMS
Microbiol. Lett. 307 (1), 80 (2010).
шению сохранности биоматериала после
криоконсервации в жидком азоте [23]. Молеку-
9. M. I. Bahl, A. Bergstrom, and T. R. Licht, FEMS
Microbiol. Lett. 329, 193 (2012).
лярные механизмы криозащитного действия га-
зов на сегодняшний день еще малоизучены и тре-
10. I. M. Carroll, T. Ringel-Kulka, J. P. Siddle, et al., PLoS
One 7 (10), e46953 (2012).
буют дальнейших разработок.
11. F. Fouhy, J. Deane, M. C. Rea., et al., PLoS One 10
(3), e0119355 (2015).
ЗАКЛЮЧЕНИЕ
12. N. Gaci, P. P. Chaudhary, W. Tottey, et al., Microb.
Ecol. Health and Disease 28, 1308070 (2017). DOI:
В заключение хотелось еще раз отметить высо-
10.1080/16512235.2017.1308070.
кие криозащитные свойства
5%-х растворов
13. L. Bircher, C. Schwab, A. Geirnaert, and C. Ch. Lac-
ДМСО и глицерина, а также 10%-го желатина.
roix, Microb. Biotechnol. 11 (1), 163 (2018).
Наши исследования оценивали жизнеспособ-
14. O. Plakash, Y. Nimonkar, and Y. Shouche, FEMS Mi-
ность микробиоты кишечника человека в целом
crobiol. Lett. 339, 1 (2013).
после криоконсервации в жидком азоте наряду со
15. Б. А. Шендеров, Э. Н. Гахова, М. А. Манвелова
скринингом протекторов. При таком подходе не-
и др., Патент RU 2123044 (1998).
избежны преимущественные потери определен-
16. F.-M. Kerckhof, E. N. P. Courtens, A. A. Geirnaert,
ных типов бактерий. Поэтому в дальнейших экс-
et al., PLoS One 9 (6), e99517 (2014).
периментах планируется провести дополнитель-
17. A. Criste, M. Giuburuncă, O. Negrea, et al., Animal
ные исследования по выживаемости наиболее
Sci. Biotechnol. 47 (2), 73 (2014).
представительных видов микрофлоры кишечни-
18. B. J. Fuller, CryoLetters 25, 375 (2004).
ка, в частности строгих анаэробов, с использова-
19. R. C. Chian, in Fertility Cryopreservation, Ed. by
нием других методов.
R.-C. Chian and R. Quinn (Cambridge University
Press, Cambridge, 2010), pp. 1-9.
20. M. Hasan, A. E. R. Fayter, and M. I. Gibson, Biomac-
ФИНАНСИРОВАНИЕ РАБОТЫ
romolecules 19 (8), 3371 (2018). DOI: 10.1021/acs.bio-
mac.8b00660.
Исследование выполнено при финансовой под-
21. Z. Hubalek, Cryobiology 46, 205 (2003).
держке РФФИ в рамках научного проекта № 19-34-
22. D. Smith, M. J. Ryan, and E. Stackebrandt, in Encyclo-
90187, а также договора № 0373100122118000037.
pedia of Life Support Systems. Biotechnology, Ed. by
H. W. Doelle and E. J. DaSilva (EOLSS Publisher, Ox-
ford, UK, 2012).
КОНФЛИКТ ИНТЕРЕСОВ
23. С. В. Уграицкая, Н. В. Шишова, Е. Л. Гагаринский
Авторы заявляют об отсутствии конфликта
и др., Биофизика 63 (3), 510 (2018).
интересов.
24. А. И. Нетрусов, М. А. Егорова, Л. М. Захарчук
и. др., Практикум по микробиологии (Академия,
М., 2005), сс. 103-104.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
25. D. B. Roszak and R. R. Colwell, Microbiol. Rev. 51
Настоящая работа не содержит описания ис-
(3), 365 (1987).
следований с использованием людей и животных
26. V. A. Gant, G. Warres, I. Philips, and G. F. Savidge, J.
Med. Microbiol. 39 (2), 147 (1993).
в качестве объектов.
27. T. Chen, A. Fowler, and M. Toner, Cryobiology 40, 277
(2000).
СПИСОК ЛИТЕРАТУРЫ
28. F. W. Kleinhans, Cryobiology 37, 271 (1989).
29. T. Nei., T. Araki, and T. Matsusaka, in Freezing and
1. S. Possemiers, C. Grootaert, J. Vermeiren, et al., Cur.
Drying of Microorganisms, Ed. by T. Nei (Tokyo: Uni-
Pharmaceut. Design 15, 2051 (2009).
versity of Tokyo Press, 1969).
2. Y. A. Poluektova, O. S. Lyashenko, O. S. Shifrin, et al.,
30. H. T. Meryman, R. J. Williams, and M. S. J. Douglas,
Rus. J. Gastroenterology, Hepatology, Coloproctology
Cryobiology 14, 287 (1977).
24, 85 (2014).
31. P. Mazur, in Principles of cryobiology in Life in the Fro-
3. M. J. Blaser and S.Falkow, Nature Rev. Microbiol. 7,
zen State, Ed. by B. J. Fuller, N. J. Lane and E. E. Ben-
887 (2009).
son (CRC Press, Boca Raton, FL, 2004), pp. 3-65.
4. A. Barzegari, S. Eslami, Gh. Elham, and O. Yadollah,
32. M. J. Prentice and J. Farrant, J. Clin. Microbiol. 6, 4
Front. Microbiol.
31
(5),
393
(2014). DOI:
(1977).
10.3389/fmicb.2014.00393
5. A. Barzegari, N. Saeedi, and A. Saei, Future Microbiol.
33. H. T. Meryman, Annu. Rev. Bioph. Bioeng. 3, 341
9 (5), 639 (2014).
(1974).
БИОФИЗИКА том 65
№ 5
2020
ЭФФЕКТИВНОСТЬ КОНСЕРВАЦИИ В ЖИДКОМ АЗОТЕ МИКРОБИОТЫ
931
Efficiency of Preservation of Human Gut Microbiota in Liquid Nitrogen Depending
on the Composition of the Cryoprotective Medium
L.V. Zalomova*, D.A. Reshetnikov*, S.V. Ugraitskaya*, L.M. Mezhevikina*, A.V. Zagainova**,
V.V. Makarov**, S.M. Yudin**, and E.E. Fesenko (Jr)*
*Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Center for Strategic Planning and Management of Medical and Biological Health Risks, Ministry of Health of the Russian
Federation, Pogodinskaya ul. 10/1, Moscow, 119435 Russia
This paper presents a comparative analysis of the survival of the human intestinal microbiota after low-tem-
perature conservation under protection of penetrating (dimethyl sulfoxide, glycerol), non-penetrating (gela-
tin) and gas (helium) cryprotectants. Increased resistance of intestinal bacteria was revealed in response to
low temperatures. A considerable part of bacteria (50.0 ± 3.0%) remain viable after freezing of liquid nitrogen
temperature without cryoprotectant (s). 5% dimethyl sulfoxide (86.0 ± 4.0%), 5% glycerol (82.0 ± 5.2%), or
10% gelatin (75/0 ± 5.0%) showed highest viability of gut microbiota. No synergistic effect was observed in
the cryopreservation medium combining cell-penetrating (dimethyl sulfoxide, glycerol) and non-penetrating
(gelatin) protectants. Use of atmospheric helium even in combination with powerful cryoprotectants such as
dimethyl sulfoxide and glycerol for protecting heterogeneous human gut microbiota did not improve cryo-
preservation, indicating that there is a need to optimize cryoprotective media, especially, for obligate anaer-
obes.
Keywords: intestinal microbiota, cryopreservation, cryoprotectants, microbial cell viability, fluorescence analysis
БИОФИЗИКА том 65
№ 5
2020