БИОФИЗИКА, 2020, том 65, № 5, с. 1003-1008
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
ВЛИЯНИЕ ГИПОТЕРМИИ НА ПУРИНЕРГИЧЕСКУЮ
СИНАПТИЧЕСКУЮ МОДУЛЯЦИЮ В ДИАФРАГМЕ КРЫСЫ
© 2020 г. А.Е. Хайруллин, А.У. Зиганшин, С.Н. Гришин
Казанский государственный медицинский университет, 420012, Казань, ул. Бутлерова, 49
E-mail: khajrulli@yandex.ru
Поступила в редакцию 04.05.2020 г.
После доработки 13.05.2020 г.
Принята к публикации 16.06.2020 г.
Исследована термочувствительность пре- и постсинаптических эффектов АТФ в диафрагме крысы.
Установлено, что снижение температуры окружающей среды с 37°С до 22°С вызывает уменьшение
силы сокращений m. Diafragma, вызванных как электрической стимуляцией, так и карбахолином.
При 37°С введение АТФ в инкубационную среду повышает сократительную активность диафраг-
мы, вызванную как электрической стимуляцией, так и карбахолином. Эти эффекты АТФ сохраня-
ются и при снижении температуры, но в большей степени проявляются при карбахолин-вызванных
сокращениях. Предположено, что в диафрагме крысы термочувствительное звено пуриновой моду-
ляции расположено преимущественно постсинаптически.
Ключевые слова: гипотермия, ATФ, P2-рецепторы, диафрагма, синапс, сурамин.
DOI: 10.31857/S000630292005018X
АТФ наряду с другими внутриклеточными
новным медиатором ацетилхолином, действует
нуклеотидами участвует в синтезе нуклеиновых
через пресинаптические Р2-рецепторы, осу-
кислот, аккумулирует энергию и играет важную
ществляющие регуляцию экзоцитоза по принци-
роль в регуляции функции ферментов и ионных
пу отрицательной обратной связи [8, 9]. Установ-
каналов. Кроме того, АТФ (и некоторые другие
лено, что АТФ угнетает квантовую [8] и некванто-
нуклеотиды) может высвобождаться из нервных
вую [10, 11] секрецию нейромедиатора, действуя
окончаний и секреторных клеток во внеклеточ-
на P2-рецепторы. Продукт ее метаболизма - аде-
ное пространство путем экзоцитоза или иными
нозин - оказывает действие на квантовую секре-
механизмами, играя роль нейромедиатора или
цию через аденозиновые рецепторы. Пресинап-
нейромодулятора в периферических возбудимых
тический ингибиторный эффект АТФ и аденози-
тканях, вегетативных ганглиях и центральной
на в мионевральном синапсе вначале был описан
нервной системе [1]. Известно, что в физиологи-
на препаратах пойкилотермных животных [12-
ческих условиях пуриновые нуклеотиды обычно
14]. Однако наши результаты последних лет сви-
являются лишь модуляторами функций клеток и
детельствовали о возможных постсинаптических
систем, однако их роль значительно возрастает
эффектах АТФ и в мионевральных синапсах теп-
при определенных патологических условиях (ги-
локровных [15].
потермия, гипоксия, стресс), когда они начинают
В настоящей работе мы исследовали особен-
играть главенствующую роль в качестве сигналь-
ности пуриновой модуляции синаптических про-
ной молекулы [2-5].
цессов на изолированных препаратах диафрагмы,
Установлено, что физиологические эффекты
которая является «смешанной» по типу волокон,
внеклеточной АТФ реализуются посредством
при нормальной и пониженной температуре.
специфических рецепторов, получивших в насто-
ящее время название Р2-рецепторы. Р2-рецепто-
МЕТОДЫ
ры делятся на два больших семейства - Р2Х и
Р2Y. На сегодняшний день в номенклатуру ре-
Подготовительные процедуры. Исследования
цепторов внесено семь подтипов Р2Х-рецепторов
проводили на нервно-мышечных препаратах бе-
и восемь подтипов Р2Y-рецепторов [6]. Р2-рецеп-
лых лабораторных крыс-самцов массой
130-
торы широко распространены, в том числе в ске-
190 г, которых содержали в группах по пять осо-
летной мускулатуре [7]. Известно, что АТФ, вы-
бей с водой и кормом ad libitum. Животных пред-
деляясь в нервно-мышечном синапсе вместе с ос-
варительно наркотизировали, вводя внутрибрю-
1003
1004
ХАЙРУЛЛИН и др.
шинно раствор этаминала натрия в дозе 40 мг/кг,
регистрировали сократительные ответы мышц,
обескровливали и выделяли m. Diafragma.
возникающие в ответ на стимуляцию электриче-
ским током.
Условия проведения экспериментов по регистра-
ции параметров сокращения. Выделенные фраг-
Температурная зависимость. Оценку влияния
менты мышцы фиксировали одним сухожиль-
АТФ и сурамина на сократительную активность
ным концом к неподвижному штативу, второй
m. Diafragma, инициированную как электриче-
конец прикрепляли лигатурой к датчику механи-
ским током, так и аппликацией карбахолина,
ческой активности и погружали в резервуары
проводили вначале при температуре 37°С. Далее
объемом 10 мл, наполненные раствором Кребса
температуру снижали до 22°С. При этой темпера-
следующего состава (в мМ): NaCl - 118.0, KCl -
туре подавали раствор АТФ в концентрации
4.75, CaCl2 - 2.5, NaHCO3 - 24.8, KH2PO4 - 1.18,
100 мкМ и оценивали силу сократительных отве-
тов мышцы через 10 мин аппликации. Далее в
MgSO4 ⋅ 7H2O - 1.18, глюкоза - 11, рН 7.4, t =
ванночки добавляли раствор сурамина в концен-
= 37.0 ± 0.5°C. Заданное значение температуры
трации 100 мкМ и оценивали силу сократитель-
поддерживали с помощью термостата. На мышцы
ных ответов мышцы через 20 мин аппликации.
изначально подавали нагрузку в 1 г, затем остав-
После этого оценивали эффект АТФ на фоне ан-
ляли в покое на полчаса для адаптации к среде.
тагониста. Температуру раствора регулировали
Электростимуляцию проводили с помощью
водяным насосом TE-8A (Techne, Великобрита-
сакшн-электрода оригинальной конструкции, в
ния), быстрое снижение температуры жидкости в
который помещали культю нерва выделенной
водяном насосе осуществляли добавлением льда.
мышцы. Для раздражения использовали электро-
стимулятор D330 MultiStim System (Digitimer, Ве-
ликобритания). Мышцы стимулировали в тече-
РЕЗУЛЬТАТЫ
ние 2 мин прямоугольными импульсами ампли-
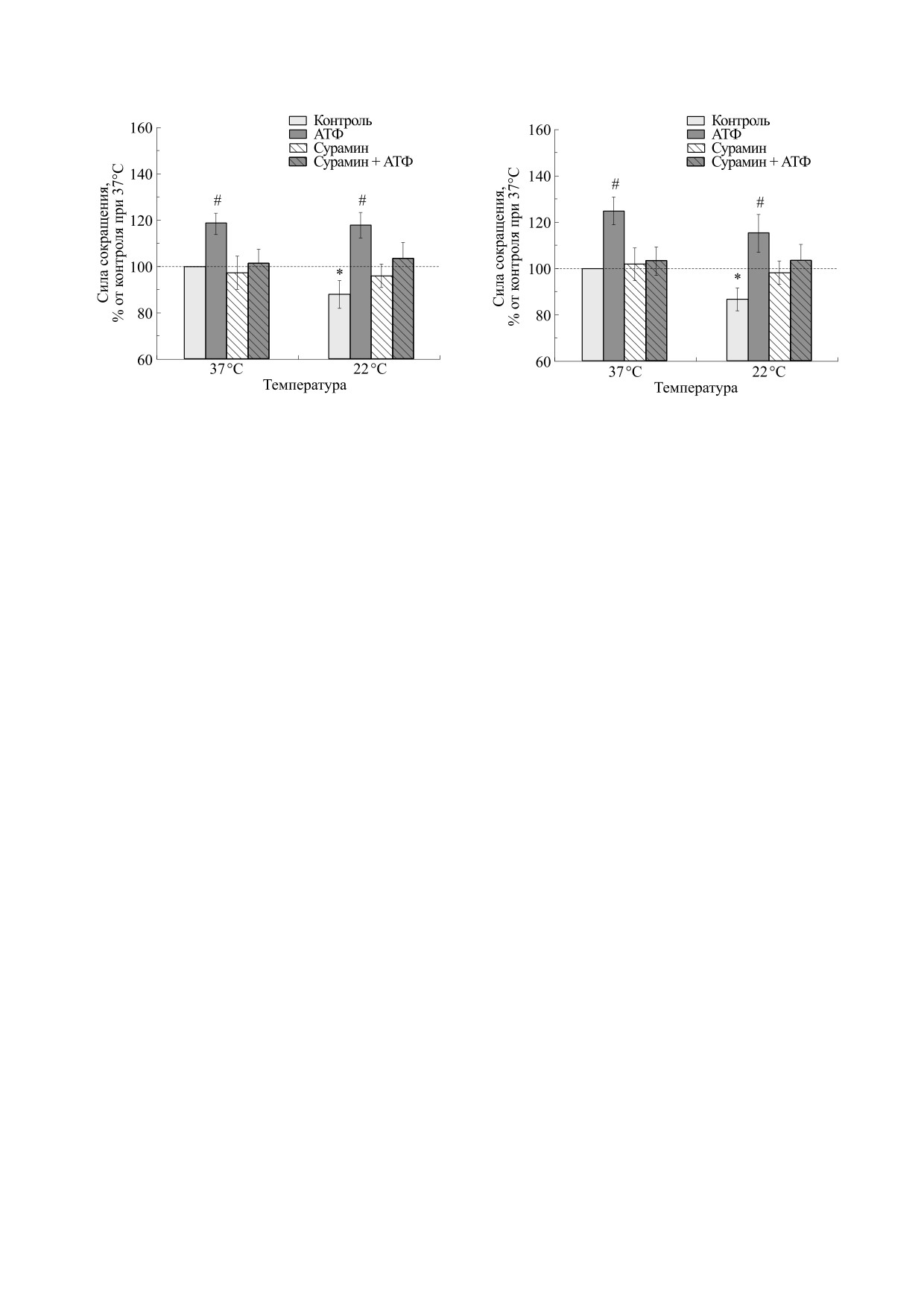
Сокращения, вызванные электрической стиму-
тудой 3 В и продолжительностью 0.5 мс при
ляцией. При физиологической температуре
частоте 0.1 Гц. Силу сокращений мышц регистри-
(37°С) сила сокращения m. Diafragma составила
ровали датчиком двигательной активности FСG-
1.510 ± 0.075 г (n = 12). При понижении темпера-
01 (Linton, Великобритания), аналоговый сигнал
туры окружающей среды сила сокращений мыш-
преобразовывали с помощью системы сбора дан-
цы снижалась, достигая 1.320 ± 0.081 г (n = 12) при
ных MP100МSW (Biopack, США). Все получен-
22°С (рис. 1). При температуре 37°С АТФ в кон-
ные ответы в течение 2 мин (12 сократительных
центрации 100 мкМ вызывала достоверное увели-
ответов) усредняли и обрабатывали как один ре-
чение силы сокращения m. Diafragma, которая
зультат, величину которого рассчитывали в про-
становилась равной 118.3 ± 4.6% (n = 12) от сокра-
центах относительно исходного значения, полу-
щений мышцы при этой же температуре в кон-
ченного в начале эксперимента. Через полчаса
троле.
после фиксирования нервно-мышечной ткани
При понижении температуры до 22°С сила со-
проводили контрольную электрическую стиму-
кращений мышцы в присутствии АТФ составила
ляцию мышц дважды с интервалом в 5 мин и,
117.8 ± 5.5% (n = 12) от величины контрольных со-
удостоверившись в стабильности сократительных
кращений при 37°С, что достоверно отличается
ответов, начинали экспериментальные проце-
от контрольных значений при 22°С, но не от эф-
дуры.
фекта АТФ при 37°С (рис. 1).
Силу сокращений, вызванных карбахолином в
Инкубация мышцы с сурамином (100 мкМ)
концентрации 20 мкМ, оценивали как разницу в
нивелировала влияние АТФ на силу сокращений
амплитуде сократительных реакций до и после
при всех температурах (рис. 1).
добавления карбахолина. Было показано, что при
двадцатиминутных интервалах между сокраще-
Сокращения, вызванные карбахолином. При
ниями карбахолин в концентрации 20 мкМ спо-
температуре 37°С сила сокращения m. Diafragma,
собен в течение всего времени эксперимента
вызванная карбахолином в концентрации
20 мкМ, составила 676.4 ± 33.8 мг (n = 12). При
(два-четыре часа) развивать стабильные воспро-
изводимые сокращения m. Diafragma крысы.
понижении температуры сила сокращения m. Di-
afragma снижалась и составила 586.3 ± 29.2 мг
Эффекты пуринергических агентов. В ванночку
(n = 12) при 22°С (рис. 2).
добавляли 100 мкМ АТФ и через 10 мин оценива-
АТФ в концентрации 100 мкМ при температу-
ли механические ответы мышцы. Затем ткань ин-
ре
37°С вызывала достоверное увеличение
кубировали с сурамином в концентрации
силы карбахолин-индуцированного сокращения
100 мкМ в течение
20 мин, вновь добавляли
m. Diafragma до 124.7 ± 6.0% (n = 12) от исходных
100 мкМ АТФ и опять регистрировали механиче-
ские ответы мышц. В контрольных эксперимен-
сокращений в контроле.
тах нервно-мышечную ткань инкубировали с су-
При снижении температуры потенцирующее
рамином в концентрации 100 мкМ, через 20 мин
действие АТФ сохранялось и при 22°С составило
БИОФИЗИКА том 65
№ 5
2020
ВЛИЯНИЕ ГИПОТЕРМИИ НА ПУРИНЕРГИЧЕСКУЮ СИНАПТИЧЕСКУЮ МОДУЛЯЦИЮ
1005
Рис. 1. Влияние температуры на силу сокращений
m. Diafragma крысы, вызванных электрической сти-
Рис. 2. Влияние температуры на силу сокращений
муляцией, в отсутствие и в присутствии АТФ
m. Diafragma крысы, вызванных карбахолином, в от-
(100 мкМ) и сурамина (100 мкМ). Результаты пред-
сутствие и в присутствии АТФ (100 мкМ) и сурамина
ставлены в виде M ± m в % от исходных величин, при-
(100 мкМ). Результаты представлены в виде M ± m в %
нятых за 100%; n = 12; * - р < 0.05 от эффекта при
от исходных величин, принятых за 100%; n = 12; * -
37°С, # - р < 0.05 от контроля.
р < 0.05 от эффекта при 37°С, # - р < 0.05 от контроля.
115.2 ± 8.1% от уровня исходных сокращений в
активности двигательных единиц [22,23]. Описа-
контроле (рис. 2), что достоверно отличается
но угнетающее действие АТФ в мионевральном
(р < 0.05) от соответствующих контрольных зна-
синапсе озерной лягушки [13]. Пресинаптиче-
чений, но не от эффекта АТФ на этой мышце при
ские ингибиторные эффекты пуринов в мио-
37°С.
невральном синапсе были зафиксированы пре-
Наличие сурамина в инкубационной среде
имущественно на препаратах холоднокровных
(100 мкМ) предупреждало не только влияние
животных [12-14, 24].
АТФ на мышцу, но и частично ингибиторный
Роль пуринергической модуляции в особенно-
эффект гипотермии на карбахолин-индуциро-
стях функционирования двигательных единиц
ванные сокращения.
грызунов долгое время оставалась неясна [25].
АТФ угнетает амплитуду сокращения, вызванно-
го непрямой электростимуляцией скелетных
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
мышц крысы. Также АТФ снижает амплитуду
В данной работе нами были проведены серии
карбахолин- индуцированных сократительных
механомиографических экспериментов на препа-
ответов мышц длинного разгибателя пальцев
ратах дыхательной (m. Diafragma) мышцы крысы
крысы. Известно, что ингибирующий эффект
и оценены эффекты АТФ, универсального агони-
АТФ на высвобождение нейромедиатора в нерв-
ста Р2-рецепторов, и сурамина, универсального
но-мышечном соединении опосредован P2Y-ре-
антагониста Р2-рецепторов. Метод стимуляци-
цепторами [8, 13]. Недавними исследованиями
онной изометрической механомиографии ис-
было предположено [26], а затем и доказано [27],
пользуется в физиологии и клинической патофи-
что в опосредовании этого эффекта в двигатель-
зиологии мышечных и нервно-мышечных забо-
ных единицах холоднокровных главную роль иг-
леваний
[16]. Его применение позволило
рают P2Y12-рецепторы. Предполагается, что в
получить новые данные о роли внешней регуля-
мышцах теплокровных основную роль играют
ции в функционировании скелетных мышц [17].
P2Y13-рецепторы [28]. Кроме того, было показано
Известно, что внеклеточные нуклеотиды, к
[29], что стабильные аналоги АТФ облегчают вы-
которым относится АТФ, оказывают разнообраз-
свобождение ацетилхолина путем активации пре-
ные эффекты при разных физиологических и па-
синаптических Р2Х-рецепторов.
тофизиологических состояниях (в том числе и
при гипо- и гипертермиях), влияя на мембранные
В ранних исследованиях, проведенных в на-
рецепторы, названные Р2-рецепторами [18-20].
шей лаборатории на нервно-мышечном препара-
Первая информация о внеклеточном действии
те озерной лягушки, было установлено, что гипо-
АТФ появилась почти полвека назад [21]. Доказа-
термия существенно повышает эффективность
но выделение АТФ из нервных терминалей при
Р2-рецептор-опосредованных ответов [20]. Тем-
БИОФИЗИКА том 65
№ 5
2020
1006
ХАЙРУЛЛИН и др.
пературная зависимость АТФ-опосредованных
гих тканях [29], в m. Diafragma теплокровных су-
процессов была позже продемонстрирована на
ществует естественный механизм, с помощью
гладкой и скелетной мускулатуре теплокровных.
которого Р2-рецепторы опосредуют увеличение
На изолированных препаратах мочевого пузыря и
высвобождения трансмиттера, который стано-
семявыносящих протоков морской свинки со-
вится более заметным при низких температурах и
кращения в ответ на альфа,бета-метилен АТФ
который полностью угнетается сурамином.
(агонист P2X-рецепторов) и в ответ на стимуля-
В сериях с карбахолин-индуцированными со-
цию электрическим полем были значительно бо-
кращениями АТФ усиливала сокращение мыш-
лее заметным при гипотермии, чем при физиоло-
цы. Для выявления термочувствительных меха-
гической температуре [20]. Кроме того, индуци-
низмов модуляции пуринами нервно-мышечного
рованное стимуляцией электрическим полем
синапса проводили эксперименты при понижен-
расслабление продольного тяжа слепой кишки
ной температуре (22°С).
морской свинки, опосредованное P2Y-рецепто-
рами, увеличивалось с уменьшением температу-
Мы предполагаем, что облегчающий постси-
ры среды [20]. Аналогичные результаты были по-
наптический эффект, который проявляет АТФ, с
казаны на изолированных мышечных препаратах
уменьшением температуры позволяет поддержи-
лягушки, в которых АТФ угнетала сокращения,
вать дыхание даже животным, подвергнутым глу-
вызванные стимуляцией электрическим полем,
бокому охлаждению.
более заметно при 17°C, чем при 22°С [14].
В этой работы мы установили, что сократи-
На препаратах холоднокровных регистриро-
мость m. Diafragma крысы, вызванная как элек-
вался исключительно пресинаптический эффект
тростимуляцией, так и аппликацией карбахолина
пуринов. Однако в последнее время накопились
(исключительно постсинаптическая стимуля-
данные о том, что АТФ в мионевральных синап-
ция), зависит от температуры. Температурная за-
сах теплокровных обладает выраженным постси-
висимость сокращений скелетных мышц - это
наптическим эффектом, часто отличающимся по
известный феномен. Однако ранее в этом отно-
знаку от того, который она оказывает на нервную
шении изучались либо скелетные мышцы холод-
терминаль [26, 30].
нокровных [40], либо быстрые смешанные мыш-
В данной работе мы установили, что АТФ уве-
цы теплокровных [23]. На препаратах этих мышц
личивала амплитуду сокращения m. Diafragma,
наблюдался ингибиторный модуляторный эф-
вызванного непрямой стимуляцией электриче-
фект АТФ, обратный представленному в данном
ским током, и карбахолин-индуцированные со-
исследовании [14]. Предполагалось, что данный
кратительные ответы. Данные эффекты оказа-
феномен имеет эндотермическую природу; и по-
лись высокочувствительны к неселективному ан-
вышение температуры увеличивает силу и натя-
тагонисту P2-рецепторов сурамину
[31].
жение миозиновых головок при изометрическом
Трипаноцидный препарат сурамин имеет широ-
сокращении [41, 42]. Было высказано предполо-
кий спектр биологической активности [33, 34],
жение, что снижение силы сокращений при низ-
включая неспецифическое ингибирование P2-
кой температуре возможно ввиду истощения ак-
рецепторов [31, 35] и ингибирование нескольких
тивности обменных ферментных систем [43, 44]
эктоферментов, разрушающих АТФ
[36-38].
или процессов синтеза и переноса энергии [45-
Считается, что сурамин является неселективным
49]. С другой стороны, было высказано мнение,
антагонистом P2-рецепторов, поскольку уста-
что вклад температурочувствительности соб-
новлено его угнетающее действие на большин-
ственно биохимии мышечных волокон не может
ство P2X и P2Y подтипов рецепторов [32]. Тот
оправдать столь драматические изменения в ха-
факт, что эффекты АТФ угнетались антагониста-
рактере сокращения всего мышечного органа при
ми P2-рецепторов, указывает на вовлечение P2-
изменении температуры [41].
рецепторов в опосредование этих эффектов. В
диафрагме крысы сурамин может ингибировать
Недавно было показано увеличение квантово-
пресинаптические кальциевые каналы
[39] и
го состава потенциалов концевой пластинки под
угнетать высвобождение медиатора. Таким обра-
действием АТФ в синапсах длинного разгибателя
зом, эффекты сурамина на нервно-мышечную
пальцев мыши [50]. Эти данные согласуются с на-
передачу являются очень сложными и, скорее
шими результатами и объясняет полученное на-
всего, различными в различных типах скелетных
ми повышение силы сокращения данного объек-
мышц. В наших экспериментах он не только про-
та под действие этого пурина. Другое исследова-
тиводействовал АТФ-зависимому потенцирова-
ние показало, что при повышении температуры
нию электровызванных или карбахолин-индуци-
происходит постоянное снижение постсинапти-
рованных сокращений m. Diafragma крысы, но и
ческого ответа [51]. На основании этих данных
предотвращал гипотермия-зависимое уменьше-
мы предполагаем, что в скелетных мышцах теп-
ние сократимости независимо от вида стимуля-
локровных существует цепь пурин-модулируе-
ции. Это может означать, что, также как и в дру-
мых синаптических эффектов.
БИОФИЗИКА том 65
№ 5
2020
ВЛИЯНИЕ ГИПОТЕРМИИ НА ПУРИНЕРГИЧЕСКУЮ СИНАПТИЧЕСКУЮ МОДУЛЯЦИЮ
1007
Подытоживая, скажем, что к настоящему вре-
15. A. E. Khairullin, A. U. Ziganshin, and S. N. Grishin,
мени температурная зависимость P2-рецептор-
Biochemistry (Moscow), Suppl. Ser. A: Membrane and
опосредованных реакций была показана на трех
Cell Biology 11 (1), 1 (2017).
различных препаратах мышц - гладких мышцах
16. А. Хилл, Механика мышечного сокращения (Мир,
млекопитающих [20], скелетной мускулатуре ам-
М., 1972).
фибий [14] и скелетных мышцах млекопитающих
17. Э. И. Богданов и P. P. Фасхутдинов, Журн. невро-
[52, 53]. Во всех трех мышечных тканях был уста-
логии и психиатрии им. Корсакова 91 (2), 129
новлен один и тот же результат - эффективность
(1991).
P2-рецептор-опосредованных процессов выше
18. R. A. North, Physiol. Rev. 82 (4), 1013 (2002).
при низких температурах, чем при физиологиче-
19. V. Ralevic and G. Burnstock, Pharmacol. Rev. 50 (3),
ской температуре. Мы предполагаем, что это сви-
413 (1998).
детельствует о сходной роли P2-рецепторов в мы-
шечных тканях - они малозаметны или маскиру-
20. A. U. Ziganshin, A. V. Rychkov, L. E. Ziganshina, and
ются другими системами регулирования при
G. Burnstock, Eur. J. Pharmacol. 456 (1-3), 107
физиологических условиях, но их роль становит-
(2002).
ся все более очевидной и важной при патологиче-
21. G. Burnstock, Br. J. Pharmacol. 40, 668 (1970).
ских или экстремальных условиях.
22. R. A. Cunha and A. M. Sebastiao, Pflugers Arch. 424
(5-6), 503 (1993).
23. E. S. Vizi, K. Nitahara, K. Sato, and B. Sperlágh, J. Au-
КОНФЛИКТ ИНТЕРЕСОВ
tonomic Nervous System 81 (1-3), 278 (2000).
Авторы заявляют об отсутствии конфликта
24. J. A. Ribeiro and A. M. Sebastião, J. Physiol. 384, 571
интересов.
(1987).
25. A. M. Kelly and N. A. Rubinstein, Med. Sci. Sports Ex-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
erc. 18 (3), 292 (1986).
26. S. N. Grishin and A. U. Ziganshin, Biochemistry
Проведенные эксперименты полностью соот-
(Moscow), Suppl. Ser. A: Membrane and Cell Biology
ветствуют действующим национальным и между-
7 (3), 183 (2013).
народным нормам в области этики.
27. A. Giniatullin, A. Petrov, and R. Giniatullin, Neuro-
science 285, 324 (2015).
СПИСОК ЛИТЕРАТУРЫ
28. J. F. Guarracino, A. R. Cinalli, V. Fernández, et al.,
1. G. Burnstock, Bioassays 34, 218 (2012).
Neuroscience 326, 31 (2016).
29. A. I. Salgado, R. A. Cunha and J. A. Ribeiro, Brain
2. G. Burnstock, Keio J. Med. 62 (3), 63 (2013).
Res. 877 (2), 245 (2000).
3. S. N. Grishin, A. I. Gabdrakhmanov, A. E. Khairullin,
30. S. N. Grishin, A. V. Galkin, A. L. Zefirov, et al., Neu-
et al., Biochemistry (Moscow), Suppl. Ser. A: Mem-
rochem. Int. 49 (8), 756 (2006).
brane and Cell Biology 11 (4), 253 (2017).
31. C. H. Hoyle, Gen. Pharmacol. 21 (6), 827 (1990).
4. A. U. Ziganshin, R. R. Kamaliev, A. I. Gabdrakhman-
ov, et al., Int. J. Pharmacol. 14, 1198 (2018).
32. G. Burnstock, Trends Pharmacol Sci. 22 (4), 182
(2001).
5. A. E. Khairullin, A. Yu. Teplov, S. N. Grishin, et al.,
33. R. P. McGeary, A. J. Bennett, Q. B. Tran, et al., Mini
Biophysics 64 (5), 812 (2019).
Rev. Med. Chem. 8, 1384 (2008).
6. G. Burnstock, Methods Mol. Biol. 2041, 1 (2020).
34. T. E. Voogd, E. L. Vansterkenburg, J. Wilting, and
7. G. Burnstock, T. R. Arnett, and I. R. Orriss, Purinergic
L. H. Janssen, Pharmacol. Rev. 45 (2), 177 (1993).
Signal. 9 (4), 541 (2013).
35. G. Lambrecht, K. Braun, M. Damer, et al., Curr.
8. R. A. Giniatullin and E. M. Sokolova, Br. J. Pharma-
Pharm. Des. 8, 2371 (2002).
col. 124 (4), 839 (1998).
36. T. Kiffer-Moreira, M. E. Fernandes Sampaio, D. S. Al-
9. S. N. Grishin, A. Shakirzyanova, A. Giniatullin, et al.,
viano, et al., FEMS Yeast Res. 10, 735 (2010).
Eur. J. Neurosci. 21, 1271 (2005).
37. E. Marti, C. Canti, I. Gomez de Aranda, et al., Br. J.
10. A. V. Galkin, R. A. Giniatullin, M. R. Mukhtarov,
Pharmacol. 118, 1232 (1996).
et al., Eur. J. Neurosci. 13, 2047 (2001).
38. L. Savegnago, C. W. Nogueira, R. Fachinetto, and
11. А. И. Маломуж и Е. Е. Никольский, Нейрофизио-
J. B. T. Rocha, Cell Biol. Int. 29 (7), 559 (2005).
логия 39, 289 (2007).
39. R. H. Henning, A. Nelemans, A. H. Scaf, et al., Eur. J.
12. W. M. Fu, J. Physiol. 477, 449 (1995).
Pharmacol. 216, 73 (1992).
13. E. Sokolova, S. Grishin, A. Shakirzyanova, et al., Eur.
40. П. В. Кочубей и C. Ю. Беpшицкий, Биофизика 59
J. Neurosci. 18, 1254 (2003).
(5), 967 (2014).
14. A. U. Ziganshin, R. R. Kamaliev, S. N. Grishin, et al.,
41. M. Nyitrai, R. Rossi, N. Adamek, et al., J. Mol. Biol.
Eur. J. Pharmacol. 509, 187 (2005).
355 (3), 432 (2006).
БИОФИЗИКА том 65
№ 5
2020
1008
ХАЙРУЛЛИН и др.
42. G. Piazzesi, M. Reconditi, N. Koubassova, et al., J.
48. I. M. Vikhlyantsev, Z. A. Podlubnaya, B. S. Shenkman,
Physiol. 549 (1), 93 (2003).
and I. B. Kozlovskaya, Dokl. Biochem. Biophys. 407,
88 (2006).
43. K. J. Cowan and K. B. Storey, Cryobiology 43 (1), 32
(2001).
49. A. Ulanova, Y. Gritsyna, I. Vikhlyantsev, et al.,
Biomed. Res. Int. 2015, 104 (2015).
44. J. A. MacDonald and K. B. Storey, Comp. Biochem.
50. П. О. Богачева и О. П. Балезина, Бюл. эксперим.
Physiol. B. BiochemMol. Biol. 131 (1), 27 (2002).
биологии и медицины 5, 532 (2015).
45. R. G. Boutilier and J. St-Pierre, J. Exp. Biol. 205 (15),
51. R. J. Balnave and P. W. Gage, J. Physiol. 239, 657
2287 (2002).
(1974).
46. M. Mantovani, N.C. Heglund and G.A. Cavagna, J.
52. A. U. Ziganshin, A. E. Khairullin, V. V. Zobov, et al.,
Physiol. 537 (3), 923 (2001).
Muscle & Nerve 55 (3), 417 (2017).
47. K. S. Litvinova, I. M. Vikhlyantsev, I. B. Kozlovskaya,
53. A. U. Ziganshin, A. E. Khairullin, A. Y. Teplov, et al.
et al., J. Gravit. Physiol. 11 (2), 131 (2004).
Muscle & Nerve 59 (4), 509 (2019).
Influence of Hypothermia on Purinergic Synaptic Modulation in Rat Diaphragm
A.E. Khayrullin, A.U. Ziganshin, and S.N. Grishin
Kazan State Medical University, ul. Butlerova 49, Kazan, 420012 Russia
The thermal sensitivity of the pre- and postsynaptic effects of ATP in the rat diaphragm was studied. It was
found that a decrease in ambient temperature from 37°C to 22°C leads to a decline in the force of m. Diafrag-
ma contractions caused by both electrical stimulation and carbacholine. At 37°C, the introduction of ATP in-
to the incubation medium increases the contractile activity of the diaphragmatic muscle, caused by both elec-
trical stimulation and carbacholinum. Application of ATP also has an effect on muscle contractions even
with a decrease in temperature, but after the application of carbacholinum, muscle contractions are more
pronounced. It has been suggested that in the rat diaphragm, the thermal sensitivity of purine modulation de-
velops predominantly postsynaptically.
Keywords: hypothermia, ATP, P2 receptors, diaphragm, synapse, suramin suramin
БИОФИЗИКА том 65
№ 5
2020