БИОФИЗИКА, 2020, том 65, № 5, с. 1009-1016
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
ВЛИЯНИЕ ПРИРОДЫ ЛИГАНДА НА ПРОТИВООПУХОЛЕВУЮ
АКТИВНОСТЬ И ЦИТОТОКСИЧЕСКИЙ ЭФФЕКТ БИЯДЕРНЫХ
ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
© 2020 г. А.Ф. Ванин*, **, Л.А. Островская***, Д.Б. Корман***, Е.И. Некрасова***,
О.О. Рябая****, Н.В. Блюхтерова***, В.А. Рыкова***, М.М. Фомина***
*Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН, 119334, Москва, ул. Косыгина, 4
**Институт регенеративной медицины Первого Московского государственного медицинского университета
имени И.М. Сеченова МЗ РФ, 119991, Москва, ул. Трубецкая, 8/2
***Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
****Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина МЗ РФ,
115478, Москва, Каширское шоссе, 24
Е mail: larros@list.ru
Поступила в редакцию 23.06.2020 г.
После доработки 23.06.2020 г.
Принята к публикации 29.06.2020 г.
Проведено изучение влияния природы лиганда на ростингибирующий и цитотоксический эффект
генерирующих оксид азота соединений - биядеpных динитpозильныx комплекcов железа, содер-
жащих глутатион и меркаптосукцинат, - в условиях in vivo и in vitro. Установлена преимущественная
противоопухолевая активность комплекcов c глутатионом по сравнению с комплекcами c меркап-
тосукцинатом, ингибирующих развитие опухоли (карцинома легких Льюис) на 90 и 65% по сравне-
нию с контролем соответственно. Обнаружено, что препараты обладают слабо выраженным цито-
токсическим эффектом в отношении культуры клеток опухоли человека МСF7. Расчетная кон-
центрация, вызывающая гибель
50% клеток (ИК50), составляет для комплекcов c мер-
каптосукцинатом 0.8 мкмоль/мл (640 мкг/мл), а для комплекcов c глутатионом значение ИК50 пре-
вышает 2 мкмоль/мл (1600 мкг/мл). Предполагается, что противоопухолевое действие исследован-
ных комплексов железа в значительной степени определяется их способностью включаться в имму-
нокомпетентные клетки, обеспечивающих направленную доставку комплексов к опухолям.
Ключевые слова: биядеpные динитpозильные комплекcы железа, противоопухолевая активность in vivo,
карцинома легких Льюис, цитотоксический эффект in vitro, культура клеток опухоли человека МСF7.
DOI: 10.31857/S0006302920050191
мости от дозового режима, схемы применения,
Ранее нами было обнаружено, что генерирую-
времени оценки эффекта и природы опухолевого
щие оксид азота соединения, такие как моно- и
штамма [1-6].
биядеpные фоpмы динитpозильныx комплекcов
железа (ДНКЖ), содержащие различные лиган-
В продолжение данного направления работ
ды, а также S-нитрозоглутатион, обладают спо-
нами с целью выявления оптимальных подходов
собностью ингибировать развитие ряда cолидных
для дальнейшего исследования доноров оксида
опуxолей мышей (каpцинома легкиx Льюиc, аде-
азота в качестве противоопухолевых агентов
нокарциномы Акатол и Са-755). Противоопухо-
проведено изучение влияния природы лиганда
левый эффект изученных препаратов проявлялся
на ростингибирующий и цитотоксический эф-
при их введении как внутрибрюшинно, так и
фект биядеpных динитpозильныx комплекcов
железа, содержащих глутатион (ДНКЖ-Г) и
внутривенно и колебался в пределах от 60 до 90%
меркаптосукцинат (ДНКЖ-МС) условиях in vivo
торможения роста опухоли, изменяясь в зависи-
и in vitro.
Сокращения: ДНКЖ - динитpозильные комплекcы желе-
за, ДНКЖ-Г - биядеpные динитpозильные комплекcы же-
леза, содержащие глутатион, ДНКЖ-МС - биядеpные ди-
МАТЕРИАЛЫ И МЕТОДЫ
нитpозильные комплекcы железа, содержащие меркапто-
Препараты. В экспериментах использовали
сукцинат, ТРО
- коэффициент торможения роста
опухоли.
ферросульфат железа (FeSO4 ⋅
7H2O, Fluka,
1009
1010
ВАНИН и др.
Швейцария), восстановленный глутатион, мер-
последующим смешиванием этих растворов в
каптосукцинат и нитрит натрия (Sigma, США).
присутствии NO, как это описано ранее [8]. Кон-
Газообразный NO получали в реакции ферро-
центрация ферросульфата в этой смеси составля-
сульфата железа с нитритом натрия в 0.1 М рас-
ла 5 мМ. После пятиминутного встряхивания
творе HCl с последующим разделением NO и
смеси, приводившей к включению всего двухва-
примесного диоксида азота (NO2) методом низ-
лентного железа в ДНКЖ-МС, NO удаляли из ап-
котемпературной сублимации жидкой смеси этих
парата откачкой, раствор полученного ДНКЖ-
газов в вакуумированной системе, как это описа-
МС замораживали и использовали (после размо-
но в работах [1, 7].
раживания) в экспериментах на животных. Кон-
центрацию препарата ДНКЖ-МС (молекулярная
Биядерная форма динитpозильныx комплекcов
масса 800 Да) оценивали по интенсивности поло-
железа с глутатионом. Синтез ДНКЖ-Г проводи-
сы его оптического поглощения на 360 нм с коэф-
ли согласно описанному ранее «простейшему»
фициентом экстинкции ε, равным 7000 М-1 см-1
методу синтеза ДНКЖ с тиолсодержащими ли-
(в пересчете на один атом железа в Б-ДНКЖ).
гандами [1, 8]. В соответствии с этим методом
синтез 5 мМ раствора ДНКЖ с глутатионом про-
Противоопухолевая активность in vivo. Экспе-
водили следующим образом. К 10 мл дистиллиро-
рименты проведены на 75 инбредных мышах ли-
ванной воды на воздухе добавляли 62 мг глутати-
нии BDF1
- гибриды первого поколения
она (20 мМ), вызывавшего подкисление раствора
f
1(C57Bl/6 × DBA2), самках с массой тела 18-20 г,
до рН 4.0, с последующим введением в него 28 мг
разведения питомника
«Филиал
«Столбовая»
(10 мМ) сернокислого железа, приводившего к
НЦБМТ ФМБА России».
дальнейшему снижению рН до 3.8. После этого в
В качестве опухолевой тест-системы служила
раствор добавляли 6.9 мг (10 мМ) нитрита натрия,
солидная опухоль мышей - карцинома легких
что приводило к розовому окрашиванию раство-
Льюис, перевиваемая подкожно в соответствии
ра, обусловленному образованием S-нитрозоглу-
со стандартной методикой [9].
татиона. Судя по интенсивности оптического по-
Исследовавшиеся препараты вводили живот-
глощения на 334 нм, характерного для S-нитро-
ным в виде водных растворов внутривенно в хво-
зоглутатиона, реакция заканчивалась через
стовую вену мышей при использовании различ-
полтора часа с образованием 10 мМ этого соеди-
ных дозовых режимов и схем применения.
нения. После этого рН раствора повышали до 7.2,
ДНКЖ-Г вводили в суточных дозах 0.5, 1.0, 2.0,
что приводило к оранжевому окрашиванию рас-
10.0 и 20.0 мкмоль/кг (400, 800, 1600, 8000 и
твора, обусловленному начавшимся процессом
16000 мкг/кг) пятикратно на 1-е, 4-е, 7-е, 11-е и
образования ДНКЖ-Г в растворе при участии S-
14-е сутки после перевивки опухоли. ДНКЖ-МС
нитрозоглутатиона, Fe2+ и глутатиона [9]. Для
вводили в суточных дозах 2,5 и 5 мкмоль/кг
полного превращения S-нитрозоглутатиона в
(2000 и 4000 мкг/кг) пятикратно на 1-е, 4-е, 7-е,
ДНКЖ-Г требовалось несколько часов. После
10-е и 14-е сутки после перевивки опухоли.
удаления образовавшегося за это время осадка
Оценка противоопухолевой активности пре-
гидроокиси трехвалентного железа путем филь-
паратов проведена при сопоставлении кинетики
трования раствора через фильтровальную бумагу
роста опухолей в группах контрольных и леченых
полученный раствор замораживали в жидком
животных. Показателем ростингибирующего эф-
азоте и использовали (после размораживания) в
фекта препарата служил коэффициент торможе-
экспериментах на животных. Оценку полученно-
ния роста опухоли (ТРО, %), который определял-
го количества ДНКЖ-Г (молекулярная масса
ся из соотношения: ТРО = (РС - РТ)/РС, где РС и
846 Да) проводили оптическим методом по ин-
РТ - объем (или масса) опухоли в группах кон-
тенсивности характерных для этого комплекса
полос поглощения на 310 и 360 нм, характеризую-
трольных (С) и леченых (Т) животных соответ-
щихся коэффициентами экстинкции ε, равными
ственно. Для изучения кинетики роста опухолей
проводили измерение двух взаимно перпендику-
соответственно, 9200 и 7400 М-1см-1 [1]. Соглас-
лярных размеров опухолевого узла на протяже-
но этой оценке концентрация Б-ДНКЖ в раство-
нии всего периода развития опухолей. Объем
ре составляла ∼2.5 мМ или 5 мМ в пересчете на
опухоли вычисляли в соответствии с формулой
один атом железа в комплексе.
для эллипсоида как V = ab2/2, где a - длина, b -
Биядерная форма динитpозильныx комплекcов
ширина и высота опухолевого узла. При оценке
железа с меркаптосукцинатом. Синтез ДНКЖ-МС
массы опухоли плотность опухолевой ткани при-
проводили путем обработки газообразным NO
(при давлении 150 мм рт. ст.) 1 мл раствора ферро-
нимали равной 1 г/см3 [9].
сульфата в дистиллированной воде и 4 мл 15 мМ
Каждая гpуппа животныx, получавшиx
раствора меркаптосукцината в 15 мМ HEPES-бу-
теpапевтичеcкое воздейcтвие, cоcтояла из шести-
фере (рН 7.4), помещенных соответственно в
восьми мышей пpи восьми-десяти животныx в
верхнюю и нижнюю части аппарата Тунберга, с
контpоле. Наблюдение за животными пpодолжа-
БИОФИЗИКА том 65
№ 5
2020
ВЛИЯНИЕ ПРИРОДЫ ЛИГАНДА НА ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ
1011
лоcь в течение вcего пеpиода pазвития опуxоли,
изучавшейся культуры опухолевых клеток - ИК50
вплоть до гибели животныx.
(значение концентрации вещества, которая вы-
Статистическая обработка данных проведена
зывает гибель 50% клеток).
путем оценки размеров опухолей (массы опухо-
Статистическая обработка результатов прове-
лей) у контрольных и леченых животных с ис-
дена с помощью программ «Statistica» и «Excel».
пользованием пакета компьютерных программ
Statistica 6.0.
РЕЗУЛЬТАТЫ
Цитотоксический эффект in vitro. Сравнитель-
ное изучение цитотоксичности биядерных ди-
Противоопухолевая активность биядерных ди-
нитрозильных комплексов железа с двумя раз-
нитрозильных комплексов железа с глутатионом и
личными лигандами - глутатионом и меркапто-
меркаптосукцинатом in vivo. Исследование влия-
сукцинатом - проведено на модели культуры
ния лиганда на противоопухолевый эффект би-
клеток опухоли молочной железы МСF7 челове-
ядерных динитрозильных комплексов железа
ка, полученной из банка опухолей НМИЦ онко-
проведено на модели карциномы легких Льюис
логии им. Н.Н. Блохина.
при сопоставлении активности препаратов, со-
Действие препаратов in vitro исследовано при
держащих глутатион и меркаптосукцинат.
их использовании в широком диапазоне концен-
Противоопухолевая активность ДНКЖ-Г ис-
траций - от 0.0039 до 2.0 мкмоль/мл (от 3 до
следована в суточных дозах, изменяющихся в
1600 мкг/мл).
диапазоне от 0.5 до 20 мкмоль/кг, вводимых внут-
Оценку цитотоксического эффекта осуществ-
ривенно на 1-е, 4-е, 7-е, 9-е и 11-е сутки после пе-
ляли путем определения доли выживших клеток
ревивки опухоли (рис. 1 и 2, табл. 1).
по отношению к контролю с использованием
Полученные результаты свидетельствуют о не-
стандартного МТТ-теста. Выживаемость клеток в
линейном характере зависимости противоопухо-
культуре оценивали спектрофотометрически по
левого эффекта ДНКЖ-Г от дозы. Как видно, при
окрашиванию жизнеспособных клеток [9, 11].
применении препарата в суточных дозах 0.5, 1.0 и
2.0 мкмоль/кг наблюдается повышение ростин-
Клетки (8 ⋅ 104 клеток/лунка) вносили в 96-лу-
гибирующего эффекта ДНКЖ-Г, вызывающего
ночный планшет в полной среде DMEM
торможение роста опухоли на 57, 73 и 90% соот-
(арт. 41965039, Thermo Fisher Scientific, США), со-
ветственно. Дальнейшее увеличение дозы до 10 и
держащей 10% эмбриональной телячьей сыворотки,
20 мкмоль/кг приводит к снижению торможения
2 мМ глутамина («ПанЭко», Россия) и 10 Ед/мл пе-
роста опухоли до 70 и 30% по сравнению с кон-
нициллина-стрептомицина («ПанЭко», Россия) в
тролем соответственно (рис. 2).
конечном объеме 200 мкл на лунку и помещали в
CO2-инкубатор.
Таким образом, исследование противоопухо-
левого эффекта ДНКЖ-Г в широком диапазоне
Через 24 ч проводили замену среды, после чего
доз (от 0.5 до 20 мкмоль/кг в сутки) позволило
добавляли исследуемые препараты в указанных
установить, что оптимальным режимом примене-
концентрациях. В контрольную группу клеток
ния препарата является его внутривенное введе-
препараты не вносили. Клетки инкубировали в
ние в суточной дозе 2 мкмоль/кг, пятикратно с
СО2-инкубаторе в течение 48 ч, затем добавляли в
интервалом в трое суток, вызывающее ингибиро-
каждую лунку по 20 мкл раствора МТТ-реагента
вание на 90% роста опухоли (карцинома легких
(3-[4,5-диметилтриазол-2-ил]-2,5-дифенил тет-
Льюис), что хорошо согласуется с полученными
разолия бромид) (AppliChem, Германия) в конеч-
ранее данными [4, 9].
ной концентрации 0.5 мг/мл. Клетки инкубиро-
Противоопухолевое действие ДНКЖ-МС изу-
вали в течение 3 ч, затем среду отбирали и добав-
чено при внутривенном введении в суточных до-
ляли к ним по 200 мкл диметилсульфоксида до
зах 2.5 и 5 мкмоль/кг пятикратно в течение четыр-
растворения кристаллов формазана
(37оС,
надцати суток с интервалом в двое-трое суток
10 мин, при встряхивании).
между инъекциями. Применение препарата в
Оптическую плотность (ОП) раствора форма-
указанных дозах приводит к подавлению разви-
зана определяли спектрофотометрически, при
тия карциномы легких Льюис на 65 и 50% по
длине волны 570 нм, на анализаторе Multiscan FC
сравнению с контролем соответственно. При
(Thermo Scientific, США), выживаемость клеток
этом противоопухолевый эффект, как видно из
высчитывали по формуле: (ОП эксперименталь-
представленных данных, усиливался при сниже-
ной группы / ОП контрольной группы) ⋅ 100%.
нии дозы препарата (рис. 3, табл. 2).
Результаты экспериментов представлены в ви-
Для сравнения противоопухолевой активно-
де зависимостей «доза-эффект», характеризую-
сти исследовавшихся препаратов на всем протя-
щих цитотоксическое действие препаратов и поз-
жении развития карциномы легких Льюис прове-
воляющих определить показатель цитотоксично-
дено сопоставление их ростингибирующего
сти ДНКЖ-Г и ДНКЖ-МС в отношении
эффекта при применении в максимально эффек-
БИОФИЗИКА том 65
№ 5
2020
1012
ВАНИН и др.
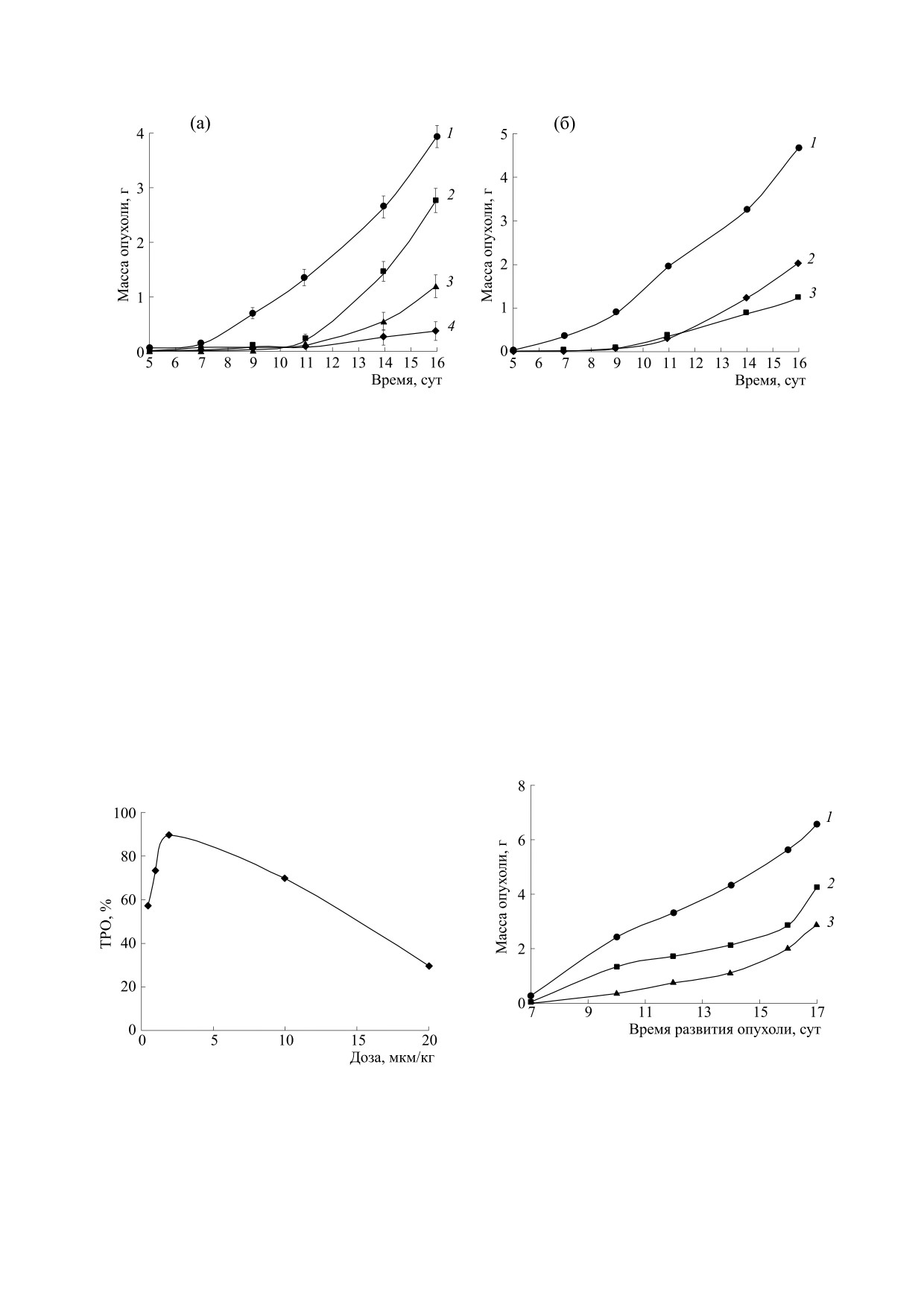
Рис. 1. Противоопухолевая активность ДНКЖ-Г при внутривенном введении различных доз препарата на модели кар-
циномы легких Льюис: (а) - 1 - контроль, 2-4 - ДНКЖ-Г в суточных дозах 20, 10 и 2 мкмоль/кг соответственно; (б) -
1 - контроль, 2 и 3 - ДНКЖ-Г в суточных дозах 0.5 и 1.0 мкМ/кг соответственно. Дозы ДНКЖ-Г приводятся в пере-
счете на один Fe(NO)2-фрагмент. Введение препарата осуществляли внутривенно, пятикратно, на 1-е, 4-е, 7-е, 9-е и
11-е сутки после перевивки опухоли.
тивных дозах - 2.0 мкмоль/кг/сутки (ДНКЖ-Г) и
(2.0 мкмоль/кг/сутки или 1600 мкг/кг/сутки), по-
2.5 мкмоль/кг/сутки (ДНКЖ-МС). Как видно из
давляет рост карциномы легких Льюис на 90%, в то
представленных зависимостей, при применении
время как препарат ДНКЖ-МС, введенный в мак-
ДНКЖ-Г показатель торможения роста опухоли
симально эффективной дозе (2.5 мкмоль/кг/сутки
за период наблюдения изменяется незначитель-
или 2000 мкг/кг/сутки), ингибирует развитие опу-
но, всего на 9%, колеблясь в пределах от 96 до
85%, регистрируемых на 7-е и 17-е сутки после пе-
холи не более чем на 65% по сравнению с контролем
ревивки опухоли соответственно. При примене-
(табл. 1 и 2, рис. 4).
нии ДНКЖ-МС показатель ТРО уменьшается за
Иными словами, использование глутатиона в
тот же срок на 30% - с 86 до 56% по сравнению с
контролем (рис. 4).
качестве лиганда обеспечивает на модели карци-
номы легких Льюис несколько более высокую
Сопоставление эффектов препаратов на 16-е сут-
эффективность биядерного динитрозильного
ки развития опухоли свидетельствует о том, что
ДНКЖ-Г, примененный в оптимальной дозе
Рис. 3. Влияние препарата ДНКЖ-МС на развитие
карциномы легких Льюис: 1 - контроль; 2 - ДНКЖ-
Рис. 2. Зависимость противоопухолевого эффекта
МС, 5.0 мкМ/кг в сутки; 3 - ДНКЖ-МС, 2.5 мкМ/кг
ДНКЖ-Г от дозы при внутривенном введении на
в сутки. Введение препарата осуществляли
модели карциномы легких Льюис (оценка эффекта на
внутривенно на 1-е, 4-е, 7-е, 10-е и 14-е сутки после
16-е сутки после перевивки опухоли).
перевивки опухоли
БИОФИЗИКА том 65
№ 5
2020
ВЛИЯНИЕ ПРИРОДЫ ЛИГАНДА НА ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ
1013
Таблица 1. Противоопухолевый эффект ДНКЖ-Г в ряде доз при внутривенном введении на модели карциномы
легких Льюис
Торможение роста
Суточная доза,
Средняя масса
Серия опыта, №
Группа
опухоли
мкмоль/кг
опухоли, г
на 16-е сутки, %
1
ДНКЖ-Г
20.0
2.76 ± 0.54
30
1
ДНКЖ-Г
10.0
1.19 ± 0.14
70
1
ДНКЖ-Г
2.0
0.37 ± 0.08
90
1
Контроль
-
3.93 ± 0.65
-
2
ДНКЖ-Г
1.0
1.2 ± 0.24
73
2
ДНКЖ-Г
0.5
1.97 ± 0.13
57
2
Контроль
-
4.54 ± 0.45
-
Примечание. Введение препарата осуществляли на 1-е, 4-е, 7-е, 9-е и 11-е сутки после перевивки опухоли.
комплекса железа по сравнению с препаратом,
5-22% при воздействии ДНКЖ-Г и на 1-15% при
содержащим меркаптосукцинат.
воздействии ДНКЖ-МС (рис. 5).
Цитотоксический эффект биядерных динитро-
При увеличении концентраций препаратов от
зильных комплексов железа с глутатионом и мер-
0.5 до 2 мкмоль/мл (что соответствует диапазону
каптосукцинатом in vitro. Влияние динитрозиль-
доз от 400 до 1600 мкг/мл) наблюдается постепен-
ных комплексов железа, содержащих различные
ное снижение доли выживших клеток - до 65%
лиганды - ДНКЖ-Г и ДНКЖ-МС, на выживае-
при воздействии ДНКЖ-Г и до 42% при воздей-
мость клеток культуры опухоли человека МСF7
ствии ДНКЖ-МС (рис.5).
изучено в широком диапазоне доз, изменяющих-
Зависимость гибели клеток от концентрации
ся в пределах от 0.0039 до 2.0 мкмоль/мл.
динитрозильных комплексов железа в указанном
диапазоне концентраций - от 0.5 до 2 мкмоль/мл -
Полученные данные свидетельствуют о немо-
показана на рис. 6.
нотонном характере зависимости доли выжив-
ших после воздействия препаратов клеток от
Как видно, максимальный цитотоксический эф-
дозы.
фект выражается в гибели 58% клеток при примене-
нии ДНКЖ-МС (концентрация
1 мкмоль/мл
Как видно из зависимостей, представленных
или 800 мкг/мл) и 35% клеток при применении
на рис. 5, применение препаратов в диапазоне
ДНКЖ-Г (концентрация
2 мкмоль/мл или
концентраций от 0.0039 до 0.125 мкмоль/мл (что
1600 мкг/мл).
соответствует диапазону доз, варьирующих в пре-
делах от 3 до 100 мкг/мл) приводит к некоторому
Расчетная концентрация, вызывающая гибель
увеличению числа выживших клеток. Доля вы-
50% клеток (ИК50), составляет для ДНКЖ-МС
живших клеток превышает уровень контроля на
0.8 мкмоль/мл (640 мкг/мл), а для ДНКЖ-Г зна-
Таблица 2. Противоопухолевый эффект ДНКЖ-МС при внутривенном введении на модели карциномы легких
Льюис
Суточная доза,
Средняя масса
Группа
ТРО на 16-е сутки, %
Критерий Стьюдента t
мкмоль/кг
опухоли, г
3.45 > t0.01 = 3.05
ДНКЖ-МС
2.5
2.00 ± 0.15
65
f = 12
2.69 > t0.05 = 2.22
ДНКЖ-МС
5.0
2.85 ± 0.35
50
f = 10
Контроль
-
5.61 ± 0.25
-
-
Примечание. Введение препарата осуществляли на 1-е, 4-е, 7-е, 10-е и 14-е сутки после перевивки опухоли.
БИОФИЗИКА том 65
№ 5
2020
1014
ВАНИН и др.
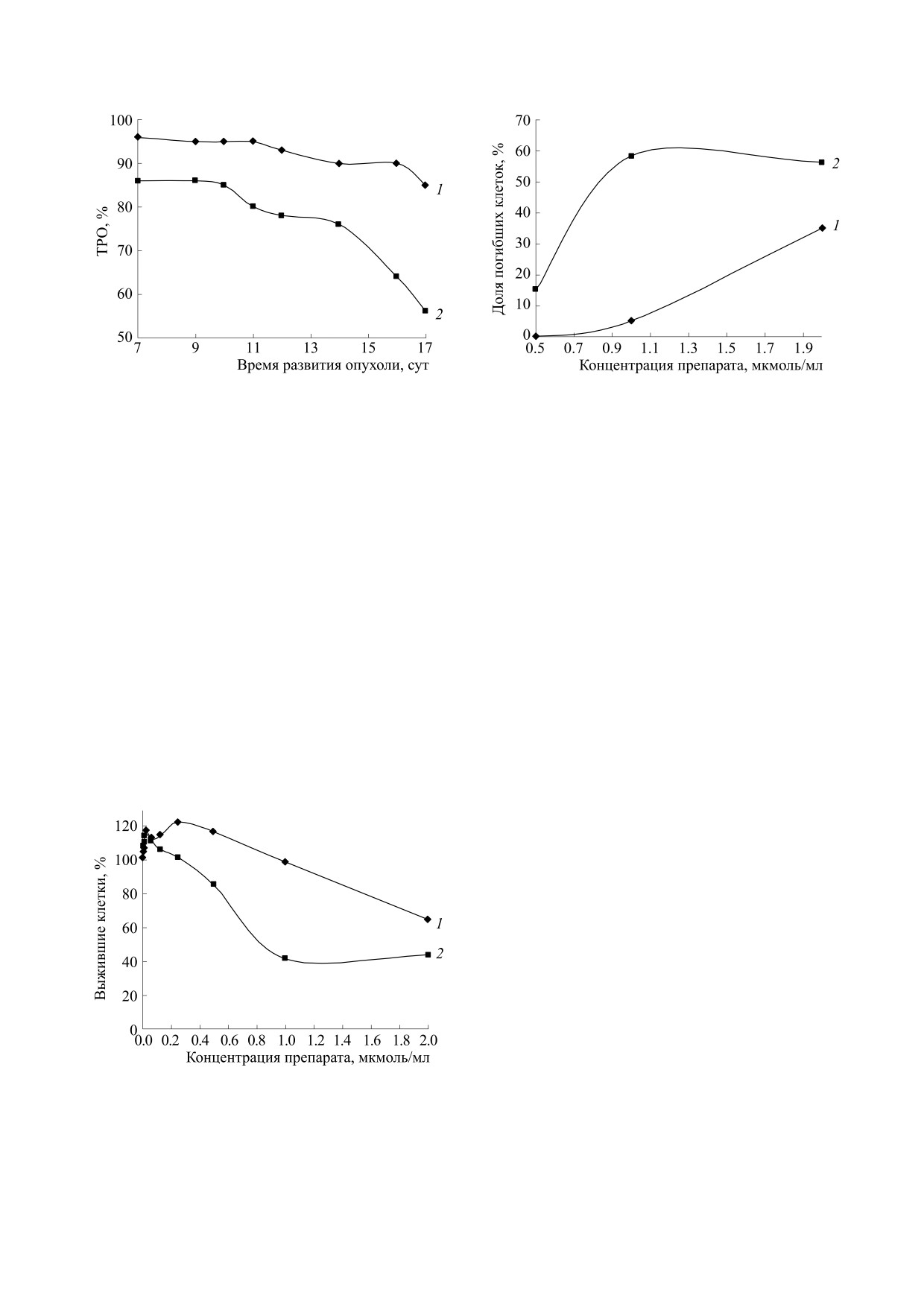
Рис. 4. Изменение показателя противоопухолевой
Рис. 6. Влияние динитрозильного комплекса железа с
активности биядерных динитрозильных комплексов
глутатионом (1) и с меркаптосукцинатом (2) на
железа с различными лигандами ДНКЖ-Г и ДНКЖ-
гибель клеток культуры МСF7 человека in vitro.
МС в зависимости от времени оценки эффекта на
модели карциномы Льюис: 1 - ДНКЖ-Г (2.0 мкмоль/
кг/сутки), 2 - ДНКЖ-МС (2.5 мкмоль/кг/сутки).
in vivo, изменяется примерно в одинаковых пре-
делах - от 30 до 16000 мкг/кг в опытах, проведен-
ных на культуре клеток, и от 400 до 16000 мкг/кг в
чение ИК50 превышает
2
мкмоль/мл
опытах, проведенных на лабораторных животных
(1600 мкг/мл) (рис. 6).
(мыши).
Учитывая, что согласно общепринятым крите-
Полученные результаты свидетельствуют о
риям оценки цитотоксического эффекта веще-
весьма значительной противоопухолевой актив-
ство считается цитотоксически активным при
ности динитрозильных комплексов железа с глу-
значениях ИК50 ≤ 100 мкг/мл [9], следует при-
татионом и с меркаптосукцинатом, ингибирую-
знать, что динитрозильные комплексы железа с
щих развитие опухоли (карцинома легких Льюис)
глутатионом (ДНКЖ-Г) и с меркаптосукцинатом
на 90 и 65%, соответственно, in vivo, при слабо вы-
(ДНКЖ-МС) не обладают цитотоксическим дей-
раженном цитотоксическом эффекте препаратов
ствием на опухолевые клетки культуры МСF7 че-
в отношении культуры опухолевых клетки чело-
ловека in vitro.
века МСF7 in vitro.
Представляется уместным отметить, при всей
условности такого сопоставления, что диапазон
ОБСУЖДЕНИЕ
доз, использованных в экспериментах in vitro и
Сопоставление результатов исследований
противоопухолевого действия использованных
ДНКЖ на уровне организма (in vivo) и на уровне
клеточной культуры (in vitro) приводит к следую-
щим, казалось бы, взаимоисключающим вы-
водам.
Во-первых, из опытов in vivo следует, что это
действие должно усиливаться по мере понижения
дозы ДНКЖ, вводившейся мышам, тогда как
опыты in vitro показывают, что гибель злокаче-
ственных клеток должна повышаться по мере
увеличения концентрации этих комплексов в
культуральной среде.
Во-вторых, из экспериментов на животных
следует, что для ДНКЖ-МС характерно более
слабое, чем для ДНКЖ-Г, противоопухолевое
действие, а в опытах на культуре клеток обнару-
живается обратная зависимость.
Рис. 5. Влияние динитрозильного комплекса железа с
Эти противоречия можно устранить, если при-
глутатионом (1) и с меркаптосукцинатом (2) на
выживаемость опухолевых клеток культуры МСF7
нять во внимание участие иммунной системы в
человека in vitro.
противоопухолевом действии ДНКЖ, а также
БИОФИЗИКА том 65
№ 5
2020
ВЛИЯНИЕ ПРИРОДЫ ЛИГАНДА НА ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ
1015
факт существенно меньшей стабильности
стью инициировать S-нитрозирование тиолсо-
ДНКЖ-МС. Последнее следует из факта более
держащих белков, нарушающее нормальное
быстрого распада этих комплексов при их выдер-
функционирование этих белков, что и приводит к
живании на воздухе при нейтральных и кислых
негативным для клеток и тканей последствиям.
значениях рН. Если ДНКЖ-Г сохранялись в этих
Остается открытым вопрос, какой из указанных
условиях соответственно в течение суток или в те-
компонентов ДНКЖ - молекулы NO или катио-
чение двух-четырех часов, то ДНКЖ-МС распа-
ны нитрозония, высвобождающиеся из ДНКЖ
дались при нейтральных значениях рН за два-три
при их распаде, - мог оказывать решающее цито-
часа, а при рН 1-2 - в течение получаса.
токсическое действие на злокачественные ткани
и клетки.
Участие иммунокомпетентных клеток в про-
тивоопухолевом действии ДНКЖ на уровне орга-
низма определяется способностью этих клеток,
КОНФЛИКТ ИНТЕРЕСОВ
например макрофагов, эффективно включать в
себя ДНКЖ [12] с последующей направленной
Авторы заявляют об отсутствии конфликта
транспортировкой этих комплексов к злокаче-
интересов.
ственным опухолям и их поступлением из макро-
фагов внутрь тканей этих опухолей. При этом
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
следует иметь в виду и то обстоятельство, что им-
мунокомпетентные клетки сами по себе могут
Все применимые международные, националь-
подвергаться токсическому действию ДНКЖ,
ные и институциональные принципы ухода и ис-
естественно, по мере повышения дозы этих ком-
пользования животных при выполнении работы
плексов. Именно поэтому противоопухолевое
были соблюдены.
действие обоих ДНКЖ усиливалось по мере сни-
жения дозы этих комплексов, вводившихся в ор-
ганизм животных, достигая оптимального дей-
СПИСОК ЛИТЕРАТУРЫ
ствия при дозах 2.0-2.5 мкмоля/кг веса живот-
1.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
ных. При этих дозах иммунокомпетентные
Биофизика 59 (3), 508 (2014).
клетки сохраняли интактность, целенаправленно
2.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
передавая ДНКЖ в ткани опухолей. При этом ло-
Биофизика 60 (1), 152 (2015).
кальная концентрация ДНКЖ в ближайшем
окружении опухолей из-за преимущественной
3.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
локализации этих комплексов в иммунокомпе-
Биофизика 60 (6), 1157 (2015).
тентных клетках, контактирующих с опухолями,
4.
A. F. Vanin, L. A. Ostrovskaya, and D. B. Korman,
могла быть достаточно высокой.
Austin J. Reprod. Medicine & Infertility 2, 1109 (2015).
В связи с вышесказанным более слабое проти-
5.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
воопухолевое действие ДНКЖ-МС in vivo могло
Биофизика 62 (3), 591 (2017).
быть обусловлено тем, что токсическое действие
6.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
на макрофаги и другие иммунокомпетентные
Биофизика 64 (6), 1216 (2019).
клетки, включающие в себя эти комплексы, мог-
ло иметь место при их более низкой, чем для
7.
A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
ДНКЖ-Г, дозе. В результате иммунокомпетент-
tric Oxide Biol. Chem. 23, 1236 (2010).
ные клетки могли доставлять к опухолям суще-
8.
R. R. Borodulin, L. N. Kubrina, V. O. Shvydkiy, et al.,
ственно меньшее количество ДНКЖ-МС и
Nitric Oxide Biol. Chem. 35, 110 (2013).
тем самым инициировать более слабое, чем
9.
Е. М. Трещалина, О. С. Жукова, Г. К. Герасимова
ДНКЖ-Г, противоопухолевое действие в экспе-
и др., в кн. Руководство по проведению доклиниче-
риментах in vivо.
ских исследований лекарственных средств. Часть 1,
Как сейчас установлено [13], цитотоксическое
под ред. А. Н. Миронова и др. («Гриф и К», М.,
действие ДНКЖ с тиолсодержащими лигандами
2012), сс. 642-657.
определяется их способностью высвобождать при
10.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
распаде как нейтральные молекулы NO, так и ка-
Биофизика 65 (1), 48 (2020).
тионы нитрозония (NO+). Первые, связываясь с
11.
Д. Б. Корман, Е. И. Некрасова, Л. А. Островская
ионами супероксида, продуцируют анионы пе-
и др., Биофизика 64 (6), 1138 (2019).
роксинитрита, продукты распада протонирован-
12.
H. Lewandowska, T. M. Stepkowski, S. Meczynska,
ной формы которых - гидроксильные радикалы
et al., J. Inorg. Biochem. 188, 29 (2018).
и диоксид азота - собственно и оказывают токси-
ческое действие на клетки и ткани. Что касается
13.
A. F. Vanin, Dinitrosyl Iron Complexes as a “Working
катионов нитрозония, их цитотоксическое дей-
Form”of Nitric Oxide in Living Organisms (Cambridge
ствие, определяется, по-видимому, их способно-
Scholars Publishing, Cambridge, UK, 2019).
БИОФИЗИКА том 65
№ 5
2020
1016
ВАНИН и др.
The Influence of the Ligand Nature on the Antitumour Activity and the Cytotoxic Effect
of the Binuclear Dinitrosyl Iron Complexes
A.F. Vanin*, **, L.A. Ostrovskaya***, D.B. Korman***, E.I. Nekrasova***, O.O. Riabaya****,
N.V. Bluhterova***, V.A. Rykova***, and M.M. Fomina***
*Semenov Federal Research Center of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Institute of Regenerative Medicine, Sechenov First Moscow State Medical University,
Ministry of Health of the Russian Federation, Trubetskaya ul. 8/2, Moscow, 119991 Russia
***Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosigina 4, Moscow, 119991 Russia
****Blokhin National Medical Research Center for Oncology, Ministry of Health of the Russian Federation,
Kashirskoe Shosse 24, Moscow, 115478 Russia
The influence of the ligand nature on the growth-inhibiting and cytotoxic effects of nitric oxide-generating
compounds such as binuclear dinitrosyl iron complexes containing glutathione and mercaptosuccinate was
studied in vivo and in vitro. It was established that complexes with glutathione demonstrated antitumor ac-
tivity prevailing over the effect exerted by complexes with mercaptosuccinate capable of inhibiting tumor
growth (Lewis lung carcinoma) (90% and 65%, respectively, versus control). It was found that these complex-
es are weakly cytotoxic against MCF7 human cancer cell line. Half-maximal inhibitory concentration at
which the viability of cells reduced by 50% (IC50) was equal to 0.8 mM/ml (640 μg/ml) when a complex with
mercaptosuccinate was administered and 2 mM/ml (1600 μg/ml) after injection of a complex with glutathi-
one. It is assumed that the antitumor activity of iron complexes under study is determined by the ability of
these complexes to enter into immunocompetent cells which provide a direct route to tumor tissues.
Keywords: binuclear dinitrosyl iron complexes, in vivo antitumor activity, Lewis lung murine carcinoma, cytotoxic
effect in vitro, MCF-7 human cancer cell line
БИОФИЗИКА том 65
№ 5
2020