БИОФИЗИКА, 2020, том 65, № 5, с. 1017-1024
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.35
ПОНИЖЕННАЯ БИОДОСТУПНОСТЬ ОКСИДА АЗОТА У ЛОШАДЕЙ
С СИМПТОМОКОМПЛЕКСОМ КОЛИК:
ОЦЕНКА МЕТОДОМ ЭПР-СПЕКТРОСКОПИИ
© 2020 г. В.А. Сереженков*, Н.А. Ткачев*, З.С. Артюшина**,
М.И Кузнецова**, М. Ковач***, А.Ф. Ванин*
*Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН, 119334, Москва, ул. Косыгина, 4
**Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина,
109472, Москва, ул. Академика Скрябина, 23
***Ветеринарная клиника КСК «Новый Век»,
143421, Красногорск Московской области, д. Поздняково, ул. Животноводов, вл. 1
E-mail: serezhenkov@yandex.ru
Поступила в редакцию 17.02.2020 г.
После доработки 17.02.2020 г.
Принята к публикации 25.05.2020 г.
Патогенез заболеваний пищеварительного тракта лошадей, сопровождающихся развитием воспа-
ления и окислительного стресса, может быть связан с недостатком моноксида азота, который кон-
тролирует различные сигнальные пути в организме. В работе проведено определение уровня нитри-
тов, метаболитов оксида азота, у лошадей с различными кишечными заболеваниями. Концентра-
ция нитрита в сыворотке крови у лошадей возрастной группы 7-26 лет составила 3.60 ± 3.02 мкМ,
а у молодых животных (1-5 лет) - 8.3 ± 6.0 мкМ. Резкое снижение нитрита было отмечено у всех
лошадей с кишечными заболеваниями (3.39 ± 2.85 мкМ), особенно при метеоризме (0.6 ± 0.4 мкМ)
и закупорке ободочной кишки (0.81 ± 0.5 мкМ).
Ключевые слова: лошадь, ЭПР-спектроскопия, нитрит, оксид азота, динитрозильные комплексы
железа, нитрозогемоглобин.
DOI: 10.31857/S0006302920050208
Распространенность заболеваний желудка и
CD14 эндотоксины связываются с Toll-подобны-
ми рецепторами (TLR2, TLR4) и митоген-акти-
кишечника у лошадей [1, 2], многофакторный ха-
вируемыми киназами [3, 4], что вызывает разви-
рактер их патогенеза, а также сложность диффе-
тие воспалительного ответа.
ренциальной диагностики требуют дальнейшего
изучения, обуславливая высокую практическую и
В этой связи важную роль в метаболизме нит-
теоретическую значимость этой проблемы.
росоединений (нитритов, нитратов и NO) при
развитии заболеваний кишечного тракта принад-
Одной из основных характеристик желудочно-
лежит не только патогенной, а всей микрофлоре
кишечных заболеваний у лошадей является ча-
кишечника [5-7]. Мембранные липополисахари-
стое развитие эндотоксического шока. Практиче-
ды бактерий и цитокины служат индукторами ин-
ски все заболевания кишечника лошади вызы-
дуцируемой NO-синтазы; возрастание продук-
вают изменение состава и количественных соот-
ции NO при заболеваниях желудочно-кишечного
ношений ее микрофлоры, снижение рН со-
тракта показано в многочисленных исследовани-
держимого кишечника. Как правило, эндотокси-
ях [8-11]. NO в высоких концентрациях может
ны грамотрицательных бактерий, всасываемые
оказывать токсическое действие, вызывая апо-
стенкой кишечника, связываются со специфиче-
птоз и некроз энтероцитов, нарушение кишечно-
скими рецепторами CD14 на эндотелиальных
го барьера, что способствует бактериальной
клетках кровеносных сосудов, дендритных клет-
транслокации, снижению моторики и возникно-
ках, моноцитах и макрофагах. Через рецепторы
вению диареи [12]. Вместе с тем при воспалении
NO может оказывать защитное действие: стиму-
Сокращения: ДНКЖ - динитрозильные комплексы желе-
лировать кровоток в стенке кишечника, усили-
за, ЭПР - электронный парамагнитный резонанс, МГД -
N-метил-D,L-глюкаминдитиокарбамат, МНКЖ - моно-
вать секрецию слизи, способствовать возраста-
нитрозильные комплексы железа.
нию антибактериального ответа [13].
1017
1018
СЕРЕЖЕНКОВ и др.
Иными словами, заболевания желудочно-ки-
(ЭПР) с использованием спиновых ловушек [29,
шечного аппарата лошадей имеют острый харак-
30] одновременно с измерением нитрозогемогло-
тер течения, и в результате гиперпродукции ак-
бина и трансферрина в крови лошадей с симпто-
тивных форм кислорода [14, 15] уровень NO, не-
мами колик и патологии желудочно-кишечного
обходимый для нормального функционирования
тракта в целом.
эндотелия сосудов слизистой оболочки кишеч-
ника и сфинктеров, может снижаться.
МАТЕРИАЛЫ И МЕТОДЫ
Особые физико-химические свойства NO
определяют способ его транспортировки: в фор-
Объектом исследования являлись лошади в
ме нитрозильных комплексов с гемовым желе-
количестве 62 животных, в том числе пород ган-
зом, нитрозотиолов [16, 17], а также высокомоле-
новер-голштинской, орлово-терской, ахалтекин-
кулярных комплексов негемового железа с тииль-
ской; при клиническом исследовании у десяти из
ными лигандами (глутатион, цистеин) - так
них были диагностированы: катаральный спазм,
называемых «комплексов 2.03» [18, 19]. Образова-
закупорка толстой кишки, колит, смещение тол-
ние динитрозильных комплексов (ДНКЖ) при
стой кишки, метеоризм.
связывании тиоловых групп железа (II) с NO и
NO образует с гемоглобином стабильные ком-
нитрозотиолов на белках представляет собой
плексы железа, что позволяет определять его не-
форму посттрансляционной регуляции их актив-
посредственно в образцах крови методом ЭПР.
ности [18-20]. Такой способ модификации белка
Для определения в сыворотке крови метаболита
является селективным, обратимым и стабилизи-
NO - нитрита - мы использовали метод спино-
рует NO в уникальной биологически активной
вой ловушки, основанный на использовании ди-
форме. Источником железа для синтеза ДНКЖ
тиокарбамата и железа (II).
служит нетрансферринсвязанное железо, в
Для исследования кровь брали из яремной ве-
транспорте которого важная роль принадлежит
ны в гепариновые пробирки и центрифугировали
альбумину, трансферрину крови и белкам клеток
в течение 10 мин на центрифуге модели CH80-2S
кишечника, ответственным за его всасывание.
(ООО НПЦ МТ «АРМЕД», Балашиха Москов-
Измерение концентрации нитратов и нитритов
ской области) со скоростью 3000 об/мин для оса-
- (NO)x - с использованием реактива Грисса тра-
ждения эритроцитов. После этого образцы сыво-
диционно применяется для количественной оцен-
ротки хранили в жидком азоте (-196°С). Для из-
ки тяжести воспалительного процесса
[16].
мерения концентрации нитрозогемоглобина
В литературе также имеются данные об измерении
цельную кровь (без гепарина) замораживали в
концентрации нитрозотиолов [21-23]. Из-за мето-
пластиковых контейнерах цилиндрической фор-
дологических трудностей данные об уровне нитро-
мы длиной 35 мм и диаметром 4 мм. Сигналы
зотиолов в норме и при воспалительных состояни-
ЭПР регистрировали на спектрометре Bruker
ях часто варьируют в широком диапазоне: от 1 нМ
ECS-106 (Германия).
до 7 мкМ [24]. В работах [25, 26] определяли по ме-
Синтез ДНКЖ с глутатионом проводили со-
тоду Грисса нитриты и нитраты в сыворотке крови
гласно ранее опубликованной работе [18].
лошадей при заболеваниях желудочно-кишечного
Метод определения NO, использованный в
тракта. Несмотря на очевидные клинические по-
данной работе, основан на реакции образования
казатели желудочно-кишечных заболеваний у жи-
нитрозотиола - нитрозоцистеина - в кислой сре-
вотных, оценка общего уровня нитратов и нитри-
тов [27] не позволила дифференцировать норму от
де (pH 3.5) из нитрит-аниона NO2- и гидрохлори-
патологии даже в случае исследования больших
да цистеина. Затем нитрозоцистеин в присут-
выборок животных. В литературе утвердилась точ-
ствии железа (2+) и N-метил-D,L-глюкаминди-
ка зрения, что как в норме, так и при патологии
тиокарбамата (МГД) образует водорастворимый
желудочно-кишечного тракта измерение метабо-
парамагнитный мононитрозильный комплекс
лита NO - нитрита [28] - является наиболее пра-
железа (МНКЖ) - МГД-Fe-NO. Определение
вильной оценкой его уровня в организме. Ранее
нитрит-аниона (NO–) осуществляли следую-
нами былa исследована группа лошадей разных
щим образом: сывороточные белки с массой бо-
пород и возраста, в том числе восемь животных с
лее 30 кДа после размораживания удаляли филь-
заболеваниями желудочно-кишечного тракта. В
трованием через фильтр Microcon 30 кДа (Milli-
данной работе мы дополнили наши исследования
pore Corp., США) в течение
20 мин при
животных с патологией.
14500 об/мин в мини-центрифуге «Спин плюс»
Целью работы, основанной на анализе литера-
(Эппендорф, Австрия). Разработанный метод
турных данных о возможной связи уровней окси-
позволяет, во-первых, контролировать влияние
да азота, было измерение уровня метаболита NO -
сывороточных белков на реакцию образования
нитрита - в сыворотке крови методом спектро-
МНКЖ МГД, во-вторых, учесть вклад высокомо-
скопии электронного парамагнитного резонанса
лекулярных нитрозотиолов [17] и ДНКЖ [18] в
БИОФИЗИКА том 65
№ 5
2020
ПОНИЖЕННАЯ БИОДОСТУПНОСТЬ ОКСИДА АЗОТА
1019
качестве источников NO. К 50 мкл цистеина в
концентрации 400 мМ после фильтрации добав-
ляли 10-120 мкл сыворотки, рН раствора доводи-
ли до 3.5 путем добавления 0.01 мМ HCl. Через
5 мин добавляли 50 мкл 40 мМ сульфата железа
(II), 200 мкл 400 мМ буфера (трис или HEPES) и
200 мкл МГД с концентрацией 250 мМ. Затем pH
раствора повысили до 7.6 с помощью 0.06% рас-
твора NaOH. В этих условиях образуется МНКЖ
МГД-Fe-NO.
Анализ данных. Для построения калибровоч-
ной кривой различные объемы (2-40 мкл) рас-
твора нитрита натрия с концентрацией 480 мкМ
добавляли к 50 мкл гидрохлорида цистеина с кон-
центрацией 400 мМ, рН раствора доводили до 3.5,
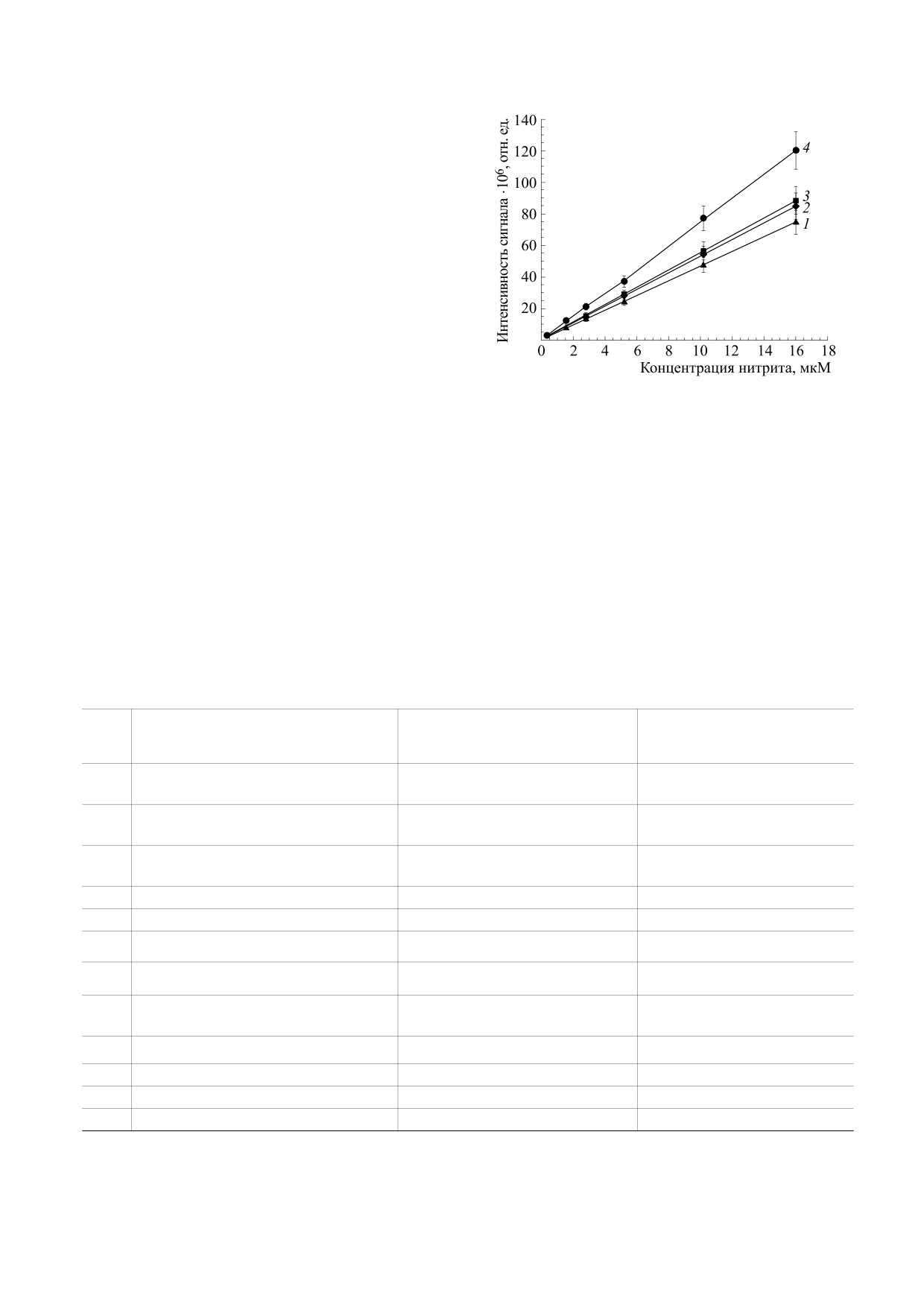
Рис. 1. Зависимости интенсивности сигнала ЭПР от
добавляя 0.01 мМ HCl. Через 5 мин добавляли
концентрации нитрита в диапазоне 0.3-16 мкМ в
50 мкл 40 мМ сульфата железа, 200 мкл 200 мМ
образце в присутствии (кривые 1-3) и после удаления
сывороточных белков (кривая 4).
(трис или HEPES), 200 мкл 250 мМ МГД, рН до-
водили до 7.6 с помощью 0.06% раствора NaOH.
Через 10 мин регистрировали спектр ЭПР МН-
РЕЗУЛЬТАТЫ
КЖ МГД-Fe-NO. Концентрацию нитрита в об-
Используя построенную калибровочную кри-
разце оценивали методом двойного интегрирова-
вую (рис. 1), мы измерили содержание нитритов в
ния и построения калибровочной кривой (рис. 1).
образцах сыворотки крови животных (табл. 1).
Для оценки степени различия использовали ана-
Оценку проводили после исследования влияния
лиз формы распределения (критерий Колмогоро-
сывороточных белков, которые вносят суще-
ва-Смирнова) и сравнение медиан и средних
ственный вклад в вариабельность данных. Также
(критерий Манна-Уитни и критерий Стьюдента
на рис. 1 можно видеть, что калибровочная кри-
соответственно).
вая в присутствии белков отличается от той, где
Таблица 1. Результаты измерения нитрозогемоглобина в цельной крови и нитритов в сыворотке крови лошадей
Концентрация
№
Характеристика животных
Концентрация нитрита, мкМ
нитрозогемоглобина, мкМ
Здоровые лошади;
min 0.74 ± 0.4
1
0.1 ± 0.1
возраст от 1 года до 6 лет, n = 8
max 16.8 ± 0.6
Здоровые лошади;
min 0.35 ± 0.3
2
0.14 ± 0.1
возраст от 7 до 26 лет, n = 14
max 14.9 ± 0.5
Закупорка большой ободочной
3
-
2.38 ± 0.70
кишки; 13.5 года
4
Метеоризм; 7 лет
-
0.60 ± 0.40
5
Закупорка слепой кишки; 14 лет
-
2.41 ± 0.70
6
Резекция после заворота; 12 лет
0.1 ± 0.1
3.45 ± 1.20
7
Резекция после заворота; 9 лет
0.1 ± 0.1
1.36 ± 0.4
Закупорка большой ободочной
8
-
0.81 ± 0.50
кишки, легкое перемещение; 26 лет
9
Хронические колики; 3.5 года
0.69 ± 0.30
2.30 ± 0.60
10
Колит (периодами); 15 лет
0.1 ± 0.1
3.8 ± 1.80
11
Колики, редко; 8 лет
-
11.4 ± 4.2
12
Колит; 2 гола
0.4 ± 0.1
7.2 ± 2.4
Примечание. Данные представлены в виде М ± m.
БИОФИЗИКА том 65
№ 5
2020
1020
СЕРЕЖЕНКОВ и др.
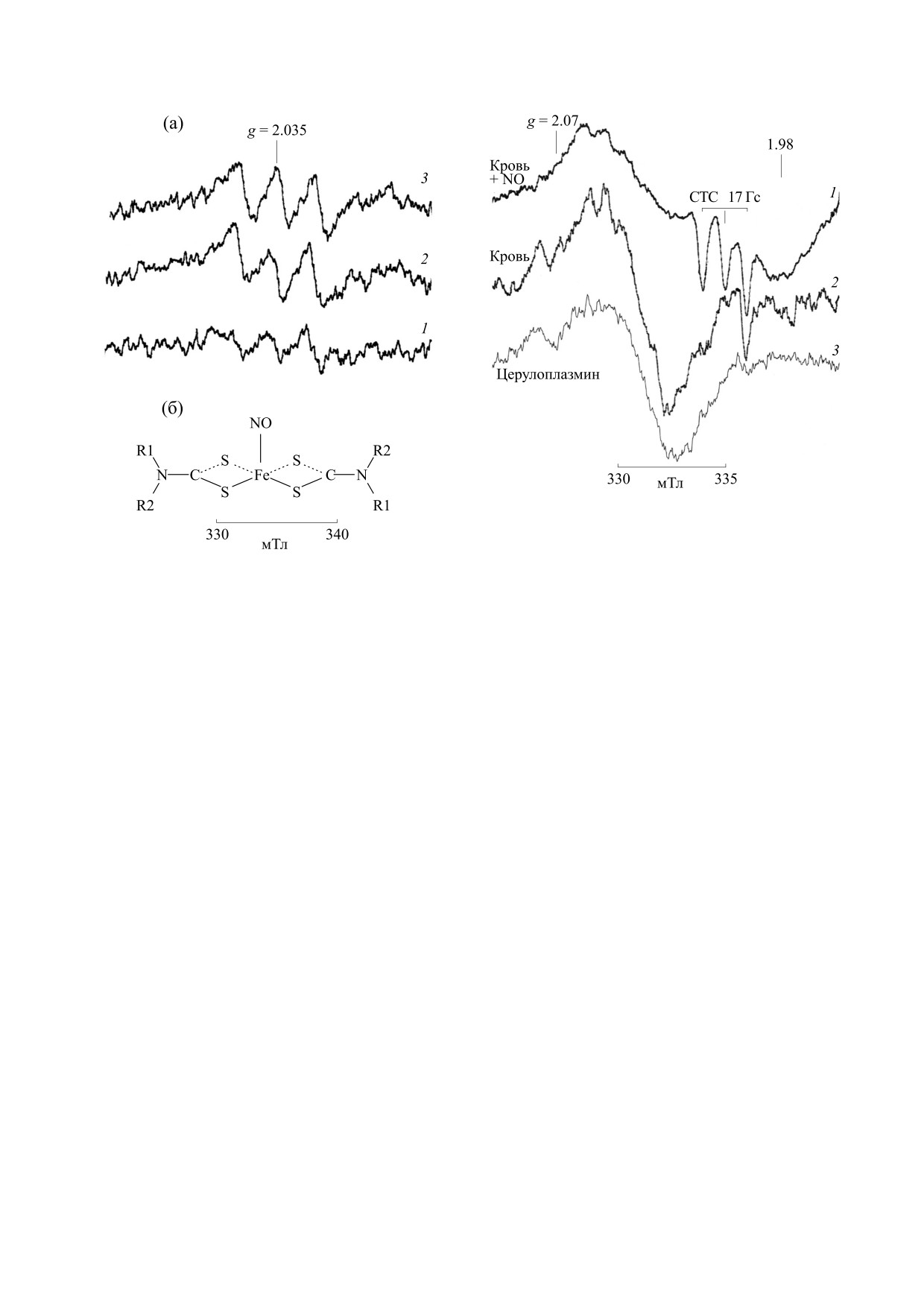
Рис.
3. Спектры ЭПР крови здоровой лошади
(спектр 2), крови, обработанной газообразным окси-
дом азота (спектр 1), и церулоплазмина (спектр 3).
Кровь здоровой лошади содержит нитрозогемогло-
бин в количестве 0.2 ± 0.5 мкМ; кровь, обработанная
Рис. 2. (а) - Спектры ЭПР комплекса N-метил-D,L-
глюкамин дитиокарбамата с железом (2+) и оксидом
оксидом азота, - 12,3 ± 0,3 мкМ. Условия регистра-
азота МНКЖ (комплекс МГД-Fe-NO) в сыворотке
ции, как указано выше. Спектр 1: усиление 2 ⋅ 105,
крови больных лошадей: 1 - метеоризм, 2 - закупор-
4 скана; спектр 2 - 1 ⋅ 105, 1 скан. Т = 77 К.
ка большой ободочной кишки, 3 - закупорка слепой
кишки. Условия записи спектров: Х-диапазон, центр
поля 334 мТл, развертка 10 мТл, амплитуда модуля-
0,0831), тогда как отличия по медиане между воз-
ции 5 Гс, мощность СВЧ 20 мВт. Усиление 1 ⋅ 105,
растными и заболевшими мало значимы
1 скан, Т = 290 К. (б) - Структурная формула пара-
магнитного комплекса МГД-Fe-NO (R1 и R2 - N-ме-
(р = 0.3340 и 0.0216). Эти результаты согласуются
тил-D,L-глюкамин).
с ранее полученными нами данными.
На рис. 5 показаны спектры ЭПР трансферри-
на крови здоровой лошади шестилетнего возраста
белки удалены фильтрацией, тангенс угла накло-
на у нее ниже. На рис. 2 показаны хорошо выра-
(спектр 1) и крови с добавлением 20 мкM Fe3+
женные спектры ЭПР МНКЖ МГД-Fe-NO с
(спектр 2), а также трех животных с метеоризмом
g = 2.035 сыворотки крови животных с желудоч-
(спектр 3), закупоркой слепой кишки (спектр 4) и
но-кишечными заболеваниями. На рис. 3 пред-
с закупоркой большой ободочной кишки
ставлен спектр нитрозогемоглобина с g = 2.07 и
(спектр 5). Форма ЭПР сигнала трансферрина
g = 1.98 при 77 К крови больной лошади и спектр
лошадей с патологией отличается от нормы, что,
крови, обработанной оксидом азота, где по вели-
по-видимому, обусловлено вкладом нетрансфер-
чине сверхтонкой структуры 17 Гс можно четко
ринсвязанного железа крови. Нельзя исключить
идентифицировать комплекс «гемоглобин-NO».
и возможность замены аминокислоты в активном
Это является строгим критерием его наличия.
центре связывания железа, что приводит к сни-
жению константы связывания железа трансфер-
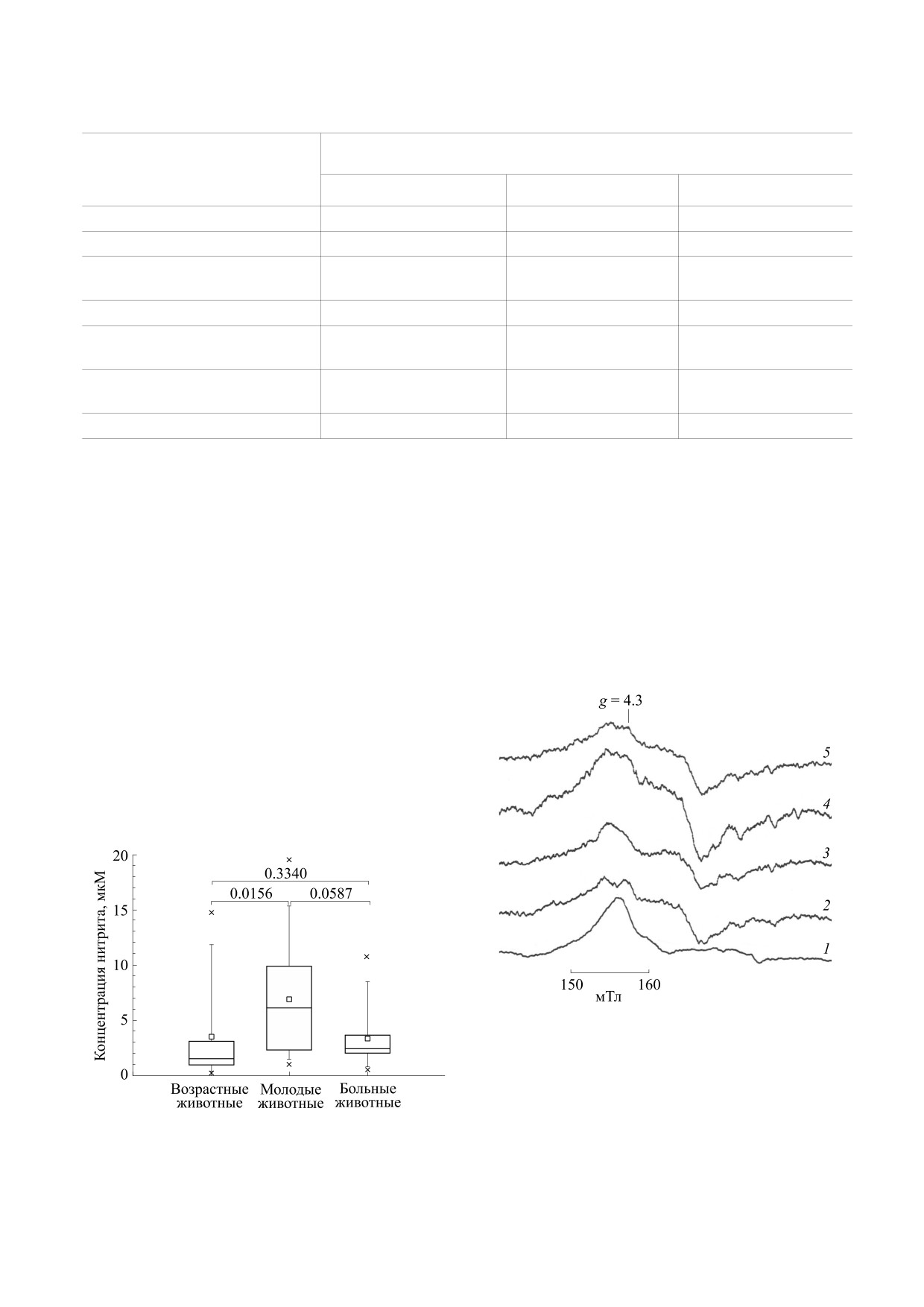
В табл. 1 приведены результаты измерений
рином и накоплению свободного железа. Обмен
нитритов в сыворотке крови здоровых животных
железа у лошадей отличается тем, что после ин-
двух возрастных групп: 1-6 и 7-26 лет, а также де-
тенсивных нагрузок его уровень в крови сильно
сяти животных с патологией (данные остальных
колеблется, что обусловлено гемолизом эритро-
восьми животных были приведены ранее). Ре-
цитов, в том числе легочными геморрагиями.
зультаты статистического анализа полученных
Анализ спектров ЭПР трансферрина здоровых
данных приведены в табл. 2 и на рис. 4. Статисти-
животных в нашей выборке свидетельствует о его
ческий анализ показал существенные отличия по
низкой насыщенности железом (44-46%), что со-
изученным параметрам возрастных и заболевших
гласуется с литературными данными. В случае
лошадей от молодых (р = 0.0484 и 0.0108; 0.0587 и
воспалительных процессов в организме лошади
БИОФИЗИКА том 65
№ 5
2020
ПОНИЖЕННАЯ БИОДОСТУПНОСТЬ ОКСИДА АЗОТА
1021
Таблица 2. Статистический анализ полученных данных
Группы лошадей
Молодые (1-6 лет)
Возрастные (7-26 лет)
Больные
Среднее ± SD, мкМ
8.32 ± 5.96
3.55 ± 3.02
3.39 ± 2.85
Медиана, мкМ
8.8
1.6
2.41
Нормальное распределение, тест
0.77
6⋅10-5
0.0021
Шапиро-Уилка, p
Молодые/возрастные
Молодые/больные
Возрастные/больные
Форма распределения, тест
0.0512
0.0831
0.0216
Колмогорова-Смирнова, p
Медианы, U-тест Манна-Уитни,
0.0156
0.0587
0.3340
p
Средние, t-тест Стьюдента, p
0.0194
0.0169
0.9791
также наблюдается снижение уровня железа и на-
вегетативной нервной системы составляют тре-
сыщенности трансферрина.
тий тип автономной нервной системы, NO играет
На рис. 6 приведен спектр ЭПР крови здоро-
роль нейромедиатора [31-33]. Активность K+-ка-
вой лошади, которой ввели ДНКЖ с глутатионом
налов в проводящих импульсах в нейронах силь-
(1 : 10) в дозе 1700 мкг/кг. Концентрация ком-
но зависит от степени нитрозилирования цистеи-
плекса с альбумином в крови соответствует
нов каналообразующего белка [15]. Нитрозили-
3.6 ± 0.5 мкМ. При комнатной температуре ЭПР-
рование цистеинов в четырех из пяти фрагментов
сигнал идентичен модельному комплексу ДНКЖ
белка замедляет проведение импульсов в нейро-
альбумина (спектр не приводится).
нах. У лошадей есть три автономных центра регу-
ляции перистальтики, связанных с интерстици-
ОБСУЖДЕНИЕ
NO следует рассматривать как один из важ-
нейших факторов защиты слизистой оболочки
желудочно-кишечного тракта. Сниженное обра-
зование NO влияет на секреторные и регенера-
тивные функции желудка. В неадренергических/
нехолинергических нейронах, которые наряду с
холин- и норадренергическими проводниками
Рис. 5. Спектры ЭПР трансферрина крови: 1 - здоро-
вая лошадь возраста 6 лет; 2 - то же, с добавлением
20 мкM Fe3+; 3 - метеоризм; 4 - закупорка слепой
кишки; 5 - закупорка большой ободочной кишки.
Условия записи спектров: Х-диапазон, центр поля
160 мТл, развертка 60 мТл, амплитуда модуляции
5 Гс, мощность СВЧ 20 мВт. Усиление 1 ⋅ 105, 1 скан,
Рис. 4. Концентрация нитрита в сыворотке лошадей.
Т = 77 К.
БИОФИЗИКА том 65
№ 5
2020
1022
СЕРЕЖЕНКОВ и др.
заболевания наблюдается дефицит NO, и, следо-
вательно, сниженная биодоступность NO вызы-
вает нарушение функций желудочно-кишечного
тракта у лошадей. В работах [2, 41] метронидазол
впервые применили для лечения лошадей и лю-
дей при желудочно-кишечных заболеваниях как
противовоспалительное и снимающее болевой
синдром средство. Мейсон и др. показали образо-
вание оксида азота из нитрогруппы метронидазо-
ла в присутствии железа и цистеина в виде ком-
плексов МНКЖ и ДНКЖ [42]. Аналогичным
эффектом обладает нестероидный противовоспа-
лительный препарат NO-аспирин (NCX-4016),
который выделяет NO [43]. Было показано инги-
бирование функции сфинктера Одди донором
оксида азота S-нитрозоацетилцистеином
[44].
Эксперименты на моделях колита грызунов пока-
зали положительный эффект нитратов жирных
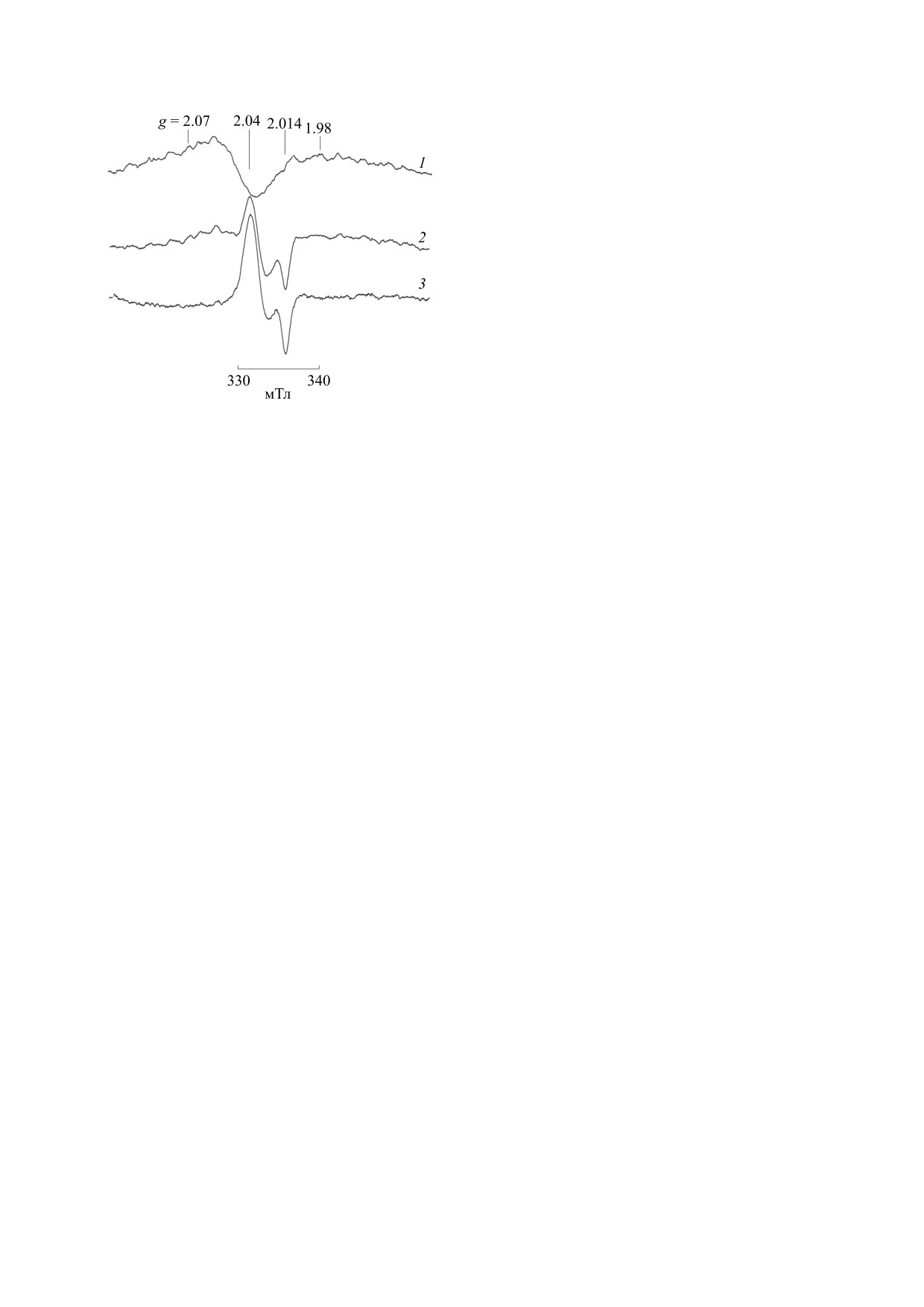
Рис. 6. 1 - Спектр ЭПР крови здоровой лошади до
кислот [45]. В работе [46] были исследованы за-
введения ДНКЖ (гемоглобин + церулоплазмин); 2 -
живление язв и изменения в микроциркуляции,
после введения экзогенного ДНКЖ с глутатионом
(1 : 10); 3 - разность спектров 2 и 1. Условия записи
вызванные синтезом оксида азота NO-синтаза-
спектров: Х-диапазон, центр поля 336 мТл, развертка
ми, вызванным препаратом BHB (benexate hydro-
40 мТл, амплитуда модуляции 5 Гс, мощность СВЧ
chloride betadex). Таким образом, введение в орга-
20 мВт. Усиление 1 ⋅ 105, 4 скана, Т = 77 К.
низм источников оксида азота оказывало значи-
тельный терапевтический эффект для работы
желудочно-кишечного тракта.
альными клетками Кахаля: гастродуоденальный
центр, илео-целиакальный центр и центр тазово-
Полученные нами данные показывают, что
го изгиба [34-36]. В дополнение к NO вегетатив-
концентрация нитритов (см. табл. 1 и рис. 2) в сы-
ная нервная система кишечника использует в ка-
воротке лошадей возрастной группы 7-26 лет бы-
честве нейромедиаторов вазоактивный кишеч-
ла в 2.4 раза выше, чем у молодых животных.
ный пептид и субстанцию P [35, 37]. Участие NO
Острое снижение нитрита наблюдалось у всех ло-
в патологических процессах, происходящих в
шадей с кишечными заболеваниями, особенно с
толстой кишке, было показано в работах [6, 38]. В
метеоризмом и спастическими коликами. Уро-
частности, экспериментальный колит сопровож-
вень нитрозогемоглобина (см. табл. 1 и рис. 3) ни-
дается снижением экспрессии нейрональной
же в цельной крови двух возрастных групп здоро-
NO-синтазы и нарушением релаксации толстой
вых лошадей, чем у больных животных.
кишки. Эти изменения могут способствовать на-
Как в норме, так и при заболеваниях основ-
рушению моторики и кишечной абсорбции. По
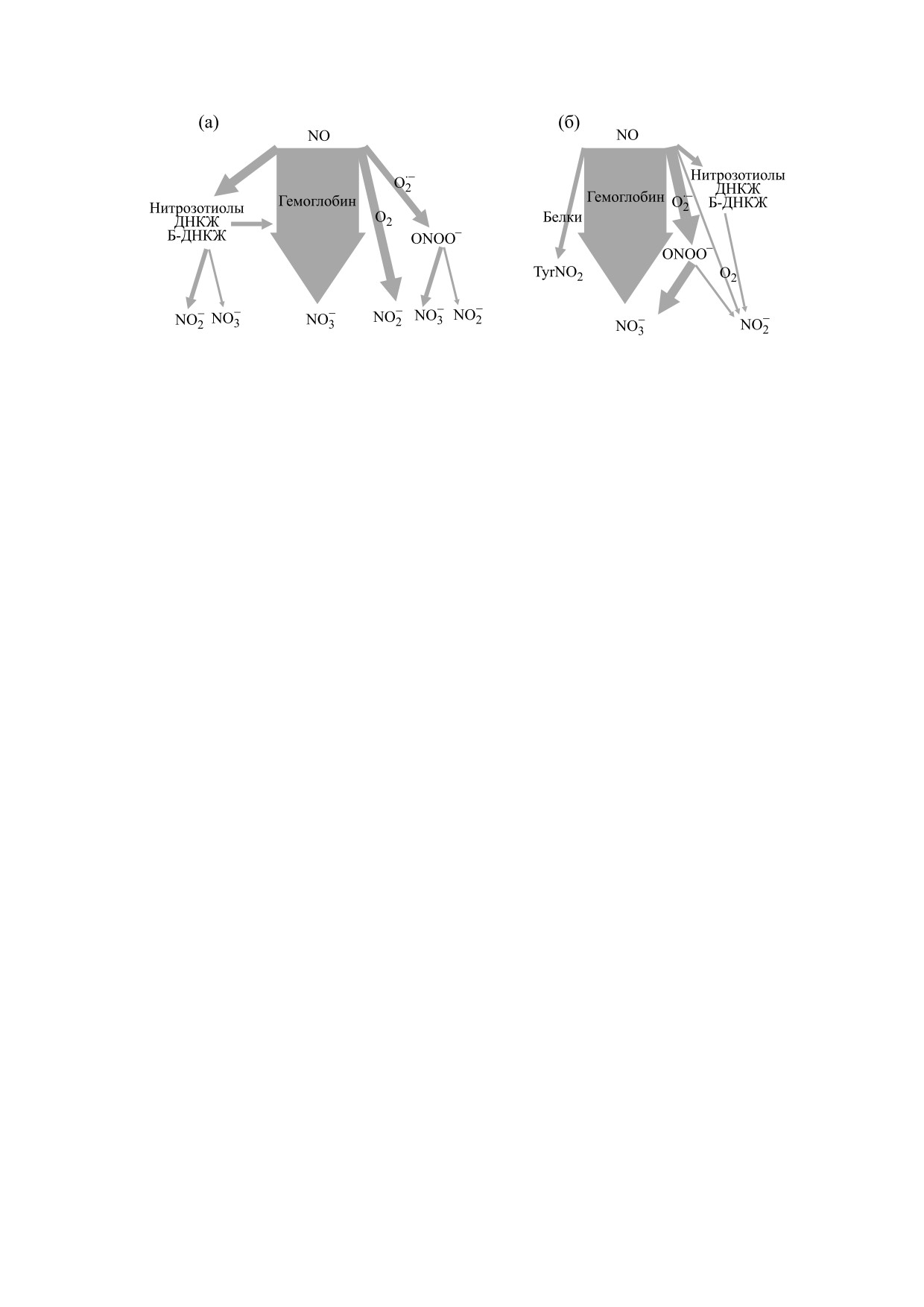
ным механизмом удаления избытка NO является
последним данным, повышенный общий уровень
его превращение в оксигенированном геме гемо-
(NO)x характеризует течение воспалительных
глобина в нитрат (рис. 7а). В то же время часть NO
процессов в организме в результате повышенной
может реагировать с кислородом с образованием
активности индуцируемой NO-синтазы. Хорошо
нитрита, но эта реакция очень медленная при их
известно, что в этом случае развивается окисли-
физиологических концентрациях. Одним из ав-
тельный стресс в клетках и тканях, процессы
торов настоящей работы был предложен иной ме-
инициируются с участием активных форм кисло-
ханизм возникновения нитрита из NO+ в процес-
рода [39, 40]. В результате эффективный NO пре-
се распада ДНКЖ (или биядерных ДНКЖ) [47,
вращается в активные формы азота (NOСl, OO-
48]. Превращение NO также может происходить
NO- и др.) и нитраты. Из измерений методом
при взаимодействии с супероксидным анион-ра-
масс-спектрометрии сыворотки крови человека
дикалом, образующимся при воспалении, с обра-
авторы работы [24] установили, что при патоло-
зованием пероксинитрита [39], который при рН
гии уровень нитратов в сыворотке увеличивается,
7.4 разлагается с образованием как нитратов, так
а уровень нитритов уменьшается по отношению к
и нитритов. Таким образом, в состоянии воспале-
норме.
ния и окислительного стресса пути метаболизма
Для обоснования сниженного уровня NO при
NO смещаются в сторону образования нитратов
развитии окислительного стресса предложена
(рис. 7б). Также возможно, что NO частично рас-
концепция биодоступного NO. Иными словами,
ходуется как на образование ДНКЖ [49], так и на
производится много NO, но его действие как ме-
неконтролируемое нитрозилирование белковых
диатора недостаточно. На определенных стадиях
тиолов, а также на образование нитротирозина в
БИОФИЗИКА том 65
№ 5
2020
ПОНИЖЕННАЯ БИОДОСТУПНОСТЬ ОКСИДА АЗОТА
1023
Рис. 7. Пути метаболизирования оксида азота: (а) - в норме, (б) - при окислительном стрессе.
белках [50], но вклад этого пути не так существе-
9. M. Herulf, B. Svenungsson, A. Lagergren, et al., J. In-
нен [51]. Нами не зарегистрированы значимые
fect. Dis. 180 (2), 542 (1999).
уровни ДНКЖ (или биядерных БДНКЖ) и нит-
10. N. K. Chokshi, Y. S. Guner, C. J. Hunter, et al., Semin.
розотиолов в сыворотке как здоровых, так и боль-
Perinatol. 32 (2), 92 (2008).
ных животных, что согласуется с данными работ
11. R. E. Malmström, H. Björne, A. Oldner, et al., Shock
[52-54].
18 (5), 456 (2002).
Мы полагаем, что эффективным средством
12. M. B. Grisham, K. P. Pavlick, F. S. Laroux, et al., J. In-
восполнения оксида азота как экзогенного мес-
vestig. Med. 50 (4), 272 (2002).
сенджера и регулятора при заболеваниях желу-
13. D. M. McCafferty, J. S. Mudgett, M. G. Swain, and
дочно-кишечного тракта у лошадей могут слу-
P. Kubes, Gastroenterology 112 (3), 1022 (1997).
жить ДНКЖ (или биядерные БДНКЖ) с тиолат-
14. H. M. M. Ibrahim, J. Equine Vet. Sci. 34 (10), 1205
ными лигандами.
(2014).
15. N. Gamper and L. Ooi, Antioxid. Redox Signal. 22 (6),
КОНФЛИКТ ИНТЕРЕСОВ
486 (2015).
Авторы заявляют об отсутствии конфликта
16. J. S. Stamler, O. Jaraki, J. Osborne, et al., Proc. Natl.
интересов.
Acad. Sci. USA 89 (16), 7674 (1992).
17. D. T. Hess, A. Matsumoto, S.-O. Kim, et al., Nature
Rev. Mol. Cell Biol. 6, 150 (2005).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
18. A. F. Vanin, V. A. Serezhenkov, V. D. Mikoyan, and
Проведенные эксперименты полностью соот-
M. V. Genkin, Nitric Oxide 2 (4), 224 (1998).
ветствуют действующим национальным и между-
19. V. P. Mokh, A. P. Poltorakov, V. A. Serezhenkov, and
народным нормам в области этики.
A. F. Vanin, Nitric Oxide 22 (4), 266 (2010).
20. В. А. Сереженков, С. М. Борунова, М. И. Кузнецо-
СПИСОК ЛИТЕРАТУРЫ
ва и Н. А. Ткачев, Дезинфекция. Антисептика 5
(1), 50 (2014).
1. P. C. Barko, M. A. McMichael, K. S. Swanson, and
D. A. Williams, J. Vet. Intern. Med. 32, 9 (2018).
21. A. Gow and J. Stamler, Nature 391 (6663), 169 (1998).
2.
2. N. D. Cohen, Equine Vet. Educ. 14 (4), 212 (2002).
22. S. A. Rocks, C. A. Davies, S. L. Hicks, et al., Free Rad-
ic. Biol. Med. 39 (7), 937 (2005).
3. E. Lorenz, Curr. Pharmaceut. Design 12 (32), 4185
(2006).
23. P. H. MacArthur, S. Shiva, and M. T. Gladwin, J.
Chromatogr. 851, 93 (2007).
4. H. Hug, M. H. Mohajeri, and G. La Fata, Nutrients
10, 203 (2018).
24. D. Tsikas, J. Chromatogr. B. Analyt. Technol. Biomed.
Life Sci. 851, 51 (2007).
5. J. Vermeiren, T. Van de Wiele, W. Verstraete, et al.,
J. Biomed. Biotechnol. 2009, 284718 (2009).
25. M. H. Mirza, J. L. Oliver, T. L. Seahorn, et al., Can. J.
Vet. Res. 63 (4), 230 (1999).
6. J. O. Lundberg and E. Weitzberg, Gut 62 (4), 616
(2013).
26. N. Galvin, H. Dillon, and F. McGovern, Irish Vet. J.
57 (8), 467 (2004).
7. F. A. Uzal and S. S. Diab, Vet. Clin. North Am. Equine
Pract. 31, 337 (2015).
27. M. H. Mirza, T. L. Seahorn, J. L. Oliver, et al., Can. J.
Vet. Res. 69, 106 (2005).
8.
8. D. Rachmilewitz, J. S. Stamler, D. Bachwich, et al.,
Gut 36 (5), 718 (1995).
28. D. Tsikas, Anal. Biochem. 379 (2), 139 (2008).
БИОФИЗИКА том 65
№ 5
2020
1024
СЕРЕЖЕНКОВ и др.
29. V. D. Mikoyan, L. N. Kubrina, V. A. Serezhenkov,
42. R. P. Mason and P. D. Josephy, J. Inorg. Biochem. 24
et al., Biochim. Biophys. Acta 1336 (2), 225 (1997).
(2), 161 (1985).
30. S. K. Jackson, M. P. Thomas, S. Smith, et al., Faraday
43. B. Whittle, Expert Opin. Investig. Drugs 14 (11), 1347
Discuss. 126, 103 (2004)
(2005).
31.
31. G. Dijkstra, H. van Goor, P. L. Jansen, and H.
44. A. Slivka, R. Chuttani, D. L. Carr-Locke, et al., J. Clin.
Moshage, Curr. Opin. Invest. Drugs 5 (5), 529 (2004).
Invest. 94 (5), 1792 (1994).
32. M. J. Rand and C. G. Li. Annu. Rev. Physiol. 57, 659
45. S. Borniquel, E. A. Jansson, M. P. Cole, et al., Free
(1995).
Radic. Biol. Med. 48, 499 (2010).
33. O. Dietz and B. Huskamp, Handbuch Pferdepraxis,
46. J. M. Lee, J. Y. Lim, Y. Kim, et al., Exp. Ther. Med. 12
3rd ed. (Enke, 2006).
(2), 573 (2016).
34. M. Kovach, Colic horses. Causes. Diagnosis. Treatment
(Royal Publ. House, 2010).
47. A. F. Vanin, Nitric Oxide 54, 15 (2016).
35. N. A. White and B. Edwards, Handbook of Equine Colic
48. A. F. Vanin, Cell. Biochem. Biophys. 77 (4), 279
(Butterworth-Heinemann, 2001).
(2019).
36. H. Bult, G. E. Boeckxstaens, P. A. Pelckmans, et al.,
49. J. R. Hickok, D. Vasudevan, G. R. Thatcher, et al., An-
Nature 345, 346 (1990).
tioxid. Redox Signal. 17 (7), 962 (2012).
37. N. E. Robinson, Current Therapy in Equine Medicine,
50. H. Ischiropoulos, Arch. Biochem. Biophys. 356 (1), 1
5th ed. (Saunders, 2003).
(1998).
38. C. A. Reinders, D. Jonkers, E. A. Janson, et al., Scand.
51. D. Tsikas and J. C. Frölich, Circ. Res. 90, 39 (2002).
J. Gastroenterol. 42 (10), 1151 (2007).
52. V. Y. Titov, A. M. Dolgorukova, V. G. Vertiprakhov,
39. F. Dalloz, V. Maupoil, S. Lecour, et al., Mol. Cell.
et al., Bull. Exp. Biol. Med. 168, 321 (2020).
Biochem. 177, 193 (1997).
40. C. Nathan and M. U. Shiloh, Proc. Natl. Acad. Sci.
53. E. D. Lamprecht and A. Carey, Williams Oxid. Med.
USA 97 (16), 8841 (2000).
Cell. Longevity 2012, 1 (2012).
41. I. Bjarnason, J. Hayllar, A. J. MacPherson, and
54. G. T. Mukosera, T. Liu, A. S. Ahmed, et al., Nitric Ox-
A. S. Russell, Gastroenterol. 104, 832 (1993).
ide 79, 57 (2018).
Reduced Nitric Oxide Bioavailability in Horses with Colic:
Evaluation by ESR Spectroscopy
V.A. Serezhenkov*, N.A. Tkachev*, Z.S. Artyushina**, M.I. Kuznetsova**,
M. Kovac***, and A.F. Vanin*
*Semenov Federal Research Center of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**K.I. Skryabin Moscow State Academy of Veterinary Medicine and Biotechnology,
ul. Akademika Skryabina 23, Moscow, 109472 Russia
***“New Century” Veterinary Clinic, ul. Zhivotnovodov 1, Pozdnyakovo, Krasnogorsk, Moscow Region, 143421 Russia
The pathogenesis of diseases of the gastrointestinal tract of horses, which is caused by inflammation and ox-
idative stress, may be associated with a lack of nitric oxide, that controls various signaling pathways in the
body. This study was aimed at determining the level of nitrites, metabolites of nitric oxide in horses with var-
ious intestinal diseases. The concentration of nitrite in blood serum was 3.60 ± 3.02 μM and 8.3 ± 6.0 μM in
horses aged 7-26 years and 1-5 years, respectively. The sharp changes downwards in nitrite concentrations
were observed in all horses with intestinal diseases (3.39 ± 2.85 μM), especially in horses with flatulence
(0.6 ± 0.4 μM) and obstruction of the colon (0.81 ± 0.5 μM).
Keywords: horse, ESR spectroscopy, nitrite, nitric oxide, dinitrosyl iron complexes, nitrosyl hemoglobin
БИОФИЗИКА том 65
№ 5
2020