БИОФИЗИКА, 2020, том 65, № 6, с. 1051-1057
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ПОРООБРАЗУЮЩИЕ СВОЙСТВА ХЕЛИКАЗЫ SsoHel308
ИЗ SACCHAROLOBUS SOLFATARICUS
© 2020 г. А.В. Сиунов*, М.П. Борисова**, Ж.И. Андреева-Ковалевская*, А.С. Нагель*,
А.С. Колесников*, А.К. Сурин***, ****, А.С. Солонин*
*Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина - обособленное подразделение ФИЦ
«Пущинский научный центр биологических исследований РАН, 142290, Пущино Московской области, просп. Науки, 5
**Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, ул. Институтская, 3
***Филиал Института биоорганической химии им. Академиков М.М. Шемякина и Ю.А. Овчинникова РАН,
142290, Пущино Московской области, ул. Институтская, 6
****Институт белка РАН, 142290, Пущино Московской области, ул. Институтская, 4
E-mail: solonin@ibpm.pushchino.ru
Поступила в редакцию 26.08.2020 г.
После доработки 26.08.2020 г.
Принята к публикации 23.09.2020 г.
Впервые продемонстрирована порообразующая активность хеликазы SsoHel308 из экстремаль-
ной термофильной археи Saccharolobus solfataricus. Этот белок способен при встраивании в мем-
браны эритроцитов кролика обеспечивать их гемолиз. Показано, что данный фермент образует
поры в плоской искусственной бислойной мембране и является мембранным трансформером.
Встраиваясь в бислойные липидные мембраны, он вызывает изменение их проводимости. Сум-
мируя полученные результаты, мы приходим к выводу, что хеликаза SsoHel308 способна образо-
вывать поры в искусственных бислойных мембранах и в некоторых случаях ток, протекающий
через мембраны, имеет особенности, характерные для работы ионных каналов. Короткое время
существования пор на мембране значительно снижает токсичность хеликазы для живой клетки,
а возможность направленной транслокации однонитевой ДНК в присутствии АТФ позволит в бу-
дущем использовать этот фермент в качестве молекулярного шприца для инъекций однонитевых
ДНК в живые клетки.
Ключевые слова: хеликаза, экстратермофильные археи, гемолиз, искусственные бислойные мембраны,
порообразование.
DOI: 10.31857/S0006302920060022
В последние годы внимание исследователей
через пору однонитевые последовательности, во-
направлено на создание и развитие нанопоровой
вторых, слишком высокой скоростью прохожде-
технологии, позволяющей прочитывать длинные
ния полинуклеотидных нитей через пору, что в
последовательности ДНК и РНК с определением
значительной степени повышает ошибки в опре-
не только последовательности нуклеотидов, но и
деляемых последовательностях, в-третьих, слож-
их модификаций [1, 2]. По этой технологии с по-
ностью самой природной части технологии,
мощью встроенных в белковую пору датчиков
включающей различные белковые продукты. Ча-
определяют последовательность нуклеотидов од-
стично эти ограничения снимаются за счет ис-
нонитевой полинуклеотидной цепи при ее про-
пользования фермента хеликазы, который не
хождении через поры, сформированные в искус-
только расплетает двунитевую ДНК, но и значи-
ственной бислойной мембране. Перемещение
тельно замедляет прохождение ДНК через отвер-
ДНК через природные нанопоры управляется
стие, сформированное гексамерной формой это-
внешней силой, например приложенным элек-
го белка, благодаря зависимой от АТФ трансло-
трическим напряжением, в связи с этим функции
кации однонитевой ДНК [3]. Практически все
нанопор в первую очередь изучали in vitro. Огра-
белки нуклеинового обмена, к которым также от-
ничения использования этой технологии опреде-
носятся хеликазы, функционируют на мембра-
ляются, во-первых, необходимостью пропускать
нах. Возможность совместимости мутантной хе-
1051
1052
СИУНОВ и др.
ликазы вируса папилломы крупного рогатого
МАТЕРИАЛЫ И МЕТОДЫ
скота (BPV E1) [4, 5], относящейся к SFIII-семей-
Клонирование гена hel308. Для создания про-
ству хеликаз [6], с мембранами ранее была изуче-
дуцента хеликазы на основе клеток E. coli целе-
на на липосомных везикулах с использованием
вой ген ssohel308 из геномной ДНК Saccharolo-
криоэлектронной микроскопии [7].
bus solfataricus был клонирован в векторную
плазмиду pET19mod [9]. Выбор рестрикцион-
В настоящей работе мы продемонстрировали,
ных сайтов, по которым будет осуществляться
что хеликаза экстремальной термофильной археи
клонирование, проводили с помощью про-
Saccharolobus solfataricus [8], встраиваясь в мем-
граммы SnapGene. Вследствие штаммовых раз-
брану эритроцитов, обеспечивает их гемолиз. В
личий ген мог содержать сайты для любых эн-
то же время этот фермент способен образовывать
донуклеаз рестрикции, используемых при кло-
поры в плоской искусственной бислойной мем-
нировании, поэтому была применена тактика
бране, свойства которых позволяют предполо-
безлигазного клонирования. Отбор фрагмен-
жить их возможное потенциальное использова-
тов ДНК, содержащих ген ssohel308, осуществ-
ние в нанопоровой технологии определения по-
ляли с использованием следующих синтетиче-
следовательностей ДНК и РНК.
ских праймеров:
5' CTTTATTTTCAGGGCCATATGGGTTTAGAATTAGAGTG 3' - прямой,
5' GCCGGATCCCTCGAGTTAATGAAATCTATTAAGTAATC 3' - обратный.
Аликвоты реакционной смеси анализировали
(США) к набору реагентов для клонирования
на наличие фрагментов соответствующего разме-
ДНК FusionTM CF Dry-Down PCR Cloning Kit (в
ра электрофоретически в 1%-м агарозном геле.
молярном соотношении 2 : 1). Скрининг клонов
Полученные фрагменты ДНК были очищены при
трансформированных клеток E. coli XL1-Blue
помощи QIAquick Gel Extraction kit (Qiagen,
(Stratagene, США) на наличие плазмид со встав-
США). Безлигазное клонирование в ДНК pET19-
ками нужного размера проводили методом ПЦР с
mod проводили при 42°С в течение 30 мин с ис-
колоний с помощью ДНК-полимеразы TaqSE
пользованием фрагмента NdeI-XhoI вектора и
ПЦР-фрагментов геномной ДНК по схеме, раз-
(фирмы СибЭнзим) и универсальных праймеров
работанной фирмой Clontech Laboratories Inc.
для векторов серии pET - T7P и T7T:
T7P: 5' TAATACGACTCACTATAGG 3'- прямой,
T7T: 5' AAGGGGTTATGCTAGTTA 3' - обратный.
Последовательность клонированного гена
тенсивной аэрации и температуре 37°С. На 6 л
сравнили с базой данных EMBL (ген депониро-
среды было получено 90 г сырого веса биомассы,
ван под номером AM778123) [8]. Рекомбинантные
которую использовали для выделения и очистки
плазмиды, содержащие ген ssohel308, полностью
хеликазы SsoHel308.
совпадающий по последовательности нуклеоти-
Очистка хеликазы SsoHel308. 15 г индуциро-
дов, трансформировали в экспрессионный
ванных клеток E. coli BL21(DE3) c геном
штамм E.coli Rosetta (DE3) (Novagene, США). Для
ssohel308, содержащих 8.15 г белка, суспендирова-
экспрессии использовали рекомбинантный ген
ли в 6 мл буфера А, обработанного фенилметил-
ssohel308, содержащий сайт, узнаваемый Tev-про-
сульфонил фторидом (50 мМ Na2PО4, pH 7.4,
теазой, и шесть гистидиновых остатков на N-кон-
300 мМ NaCl), заморозили при -20°С и разруши-
це. Клон, содержащий ген ssohel308, использова-
ли с помощью Френч-пресса. Для эффективной
ли для получения биомассы конечного продукта
экстракции белков и деградации нуклеиновых
при выращивании в 10-литровом ферментере в
кислот полученный лизат озвучивали во льду на
объеме 6 л при pH 7.0 и 37°С. При достижении
ультразвуковом дезинтеграторе MSPE в режиме
культурой плотности 1.9 (оптическая плотность
15 циклов по 30 с с минутными перерывами,
при длине волны 595 нм) для индукции синтеза
осветляли центрифугированием (9000 g, 30 мин),
SsoHel308 вносили изопропил-β-D-1-тиогалак-
фильтровали через 0.22 мкм фильтр (type GS, Mil-
топиранозид до конечной концентрации 1 мМ
lipore, США) и разбавляли буфером А до 200 мл.
(0.8 г) и выращивали в течение 7 ч в условиях ин-
Полученный препарат с концентрацией белка
БИОФИЗИКА том 65
№ 6
2020
ПОРООБРАЗУЮЩИЕ СВОЙСТВА ХЕЛИКАЗЫ
1053
40.49 мг/мл наносили на уравновешенные буфе-
стиллированной воды. В качестве контрольных об-
ром А спаренные колонки (с целлюлозой ДЕ-52
разцов использовали значения спонтанного и пол-
(Whatman, США) объемом 50 мл и Ni-NTA-агаро-
ного лизиса эритроцитов. Степень лизиса опреде-
зой (Qiagen, США) объемом 10 мл. После нанесе-
ляли согласно следующему уравнению:
ния препарата предколонку с целлюлозой ДЕ-52
E = (Ae - A0)/(A100 - A0) × 100,
(1)
удалили, колонку с Ni-NTA-агарозой промыли
20 объемами буфера Б (50 мМ Na-фосфатного бу-
где Ae, A0 и A100 - обратные величины оптической
фера, pH 7.4, 500 мМ NaCl, 25 мМ имидазола). Бе-
плотности при 595 нм для образца и контролей
лок элюировали градиентом имидазола от 50 мМ
спонтанного и полного лизиса соответственно.
до 1 M в буфере Б. Собирали фракции по 5 мл.
Реакцию гемолиза проводили в объеме 100 мкл
Объединенные пиковые фракции диализовали
в течение 12 ч на планшетном ридере Microplate
против буфера, содержащего 10 мМ трис-HCl,
Reader FilterMax F5 (Molecular Devices, США) с
pH 7.5 и 10 мM NaCl (буфер В) и нанесли на урав-
постоянным помешиванием при 30°С, показания
новешенную этим же буфером 50 мл колонку с
снимали каждые 10 мин на длине волны 595 нм.
ДЭAЭ-сефарозой (DEAE Sepharose Fast Flow,
Pharmacia, Швеция), затем промыли 10 объемами
Бислойные липидные мембраны. Мембраны на-
буфера В и трижды по 50 мл растворами, содержа-
слаивали по методу Мюллера-Рудина [12]. Для
щими соответственно 0.1, 0.2 и 0.3 М NaCl в буфе-
формирования мембран использовали соевый ле-
ре В. Белки элюировали градиентом NaCl от 0.3
цитин в концентрации 20 г/л (L-α-phosphatidyl-
до 1.25 М в том же буфере в объеме 90 мл, фрак-
choline Type IV-S, Sigma, США). Окружающий
ции тестировали электрофоретически. Получен-
раствор содержал 1 М KCl и 5 мМ трис-НCl (Sig-
ный препарат диализовали против буфера В и ис-
ma, США), pH 7.3. Все эксперименты проводили
пользовали в экспериментах по анализу порооб-
в условиях клямпа напряжения. Trans-отделение
разования. Для хранения при -20°С препарат
было связано с виртуальной землей через усили-
фермента диализовали против 50% глицерина в
тель Keithle 301 (Keithlе, США) в конфигурации
буфере В.
«ток-напряжение». Мембранный потенциал
поддерживали через Ag/AgCl-электроды в 3 M
Хромато-масс-спектрометрический
анализ.
KCl и агаровые мостики. Регистрацию тока вели с
Полосы белков, полученных при электрофорезе
использованием платы ЦАП/АЦП DT2801A (Da-
выделенных препаратов хеликазы, анализирова-
ta Translation, США) и специализированной про-
ли с помощью тандемной масс-спектрометрии,
граммы «БЛМ», разработанной А.Я. Зильбер-
как описано в работе [10]. Для этого участки ге-
штейном (личное сообщение). Исследуемый
лей, содержащие белки, вырезали и обрабатыва-
агент всегда вносили в отсек камеры, где нахо-
ли протеиназой К. Затем полученные пептиды
дился измерительный электрод. Знак потенциала
разделяли с помощью высокоэффективной нано-
на рисунках указан для trans-отделения. Все изме-
потоковой жидкостной хроматографии в обра-
рения проводили при комнатной температуре
щенной фазе (Easy nLC 1000, Thermo Fisher Scien-
(22-23°С).
tific, США), совмещенной с масс-спектрометри-
ей высокого разрешения (OrbiTrap Elite, Thermo
Fisher Scientific, Германия). Масс-спектрометри-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ческий анализ проводили при разрешении 60000
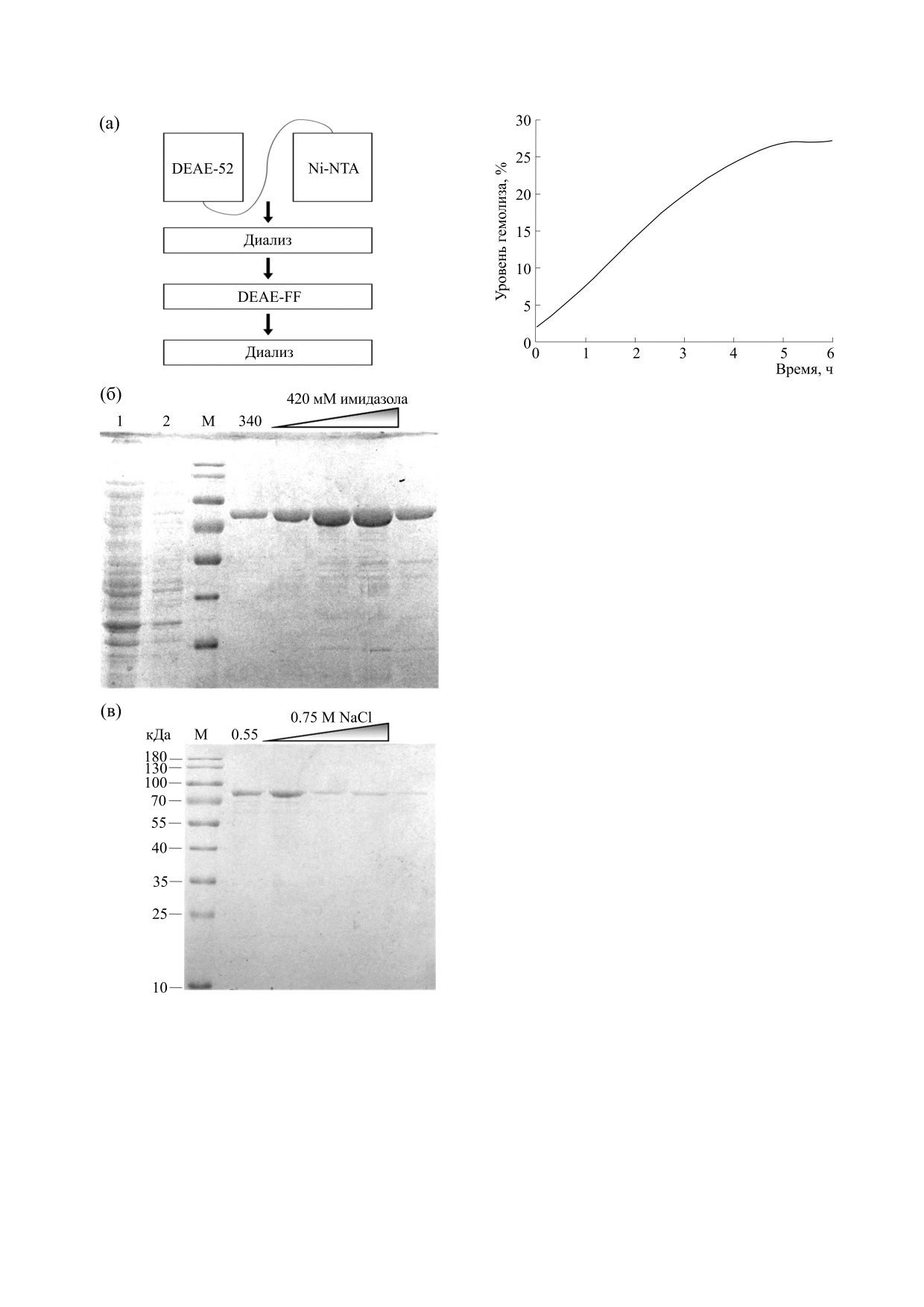
Очистка хеликазы SsoHel308. Схема очистки
для панорамных масс-спектров ионов пептидов и
хеликазы SsoHel308 представлена на рис. 1а. По-
15000 для спектров фрагментации ионов, активи-
сле прохождения препарата фермента через ко-
рованной соударениями с инертным газом.
лонку с целлюлозой ДЕ-52 и хроматографии на
Гемолитическая активность. Проведение реак-
отделенной колонке с Ni-NTA-агарозой пиковые
ции по определению гемолитической активности
фракции элюировали при концентрации имида-
было описано ранее в работе [11]. В данной работе
зола от 340 до 420 мМ. Концентрация белка в пи-
использовали эритроциты кролика и процедуру,
ковой фракции составила 0.9 мг/мл. Объединен-
основанную на измерении концентрации гемогло-
ные фракции общим объемом 18 мл с концентра-
бина, высвобождаемого при лизисе эритроцитов.
цией 2.2 мг/мл, содержащие хеликазу, диали-
Эритроциты кролика промывали 74 мМ Na-фос-
зовали против буфера В. Затем провели хромато-
фатным буфером (pH 6.8), содержащим 74 мМ
графию на 50 мл колонке с ДЭAЭ-сефарозой ФФ
NaCl, и доводили до концентрации 2% (об/об).
и фракции, элюированные при концентрации
Конечная концентрация хеликазы в пробе соста-
NaCl от 0.55 до 0.75 М в буфере В, содержащие хе-
вила 0.15 мг/мл. Для контроля спонтанного гемо-
ликазу, объединили и диализовали против
лиза эритроцитов добавляли физиологический
буфера В. Фракции на всех этапах очистки тести-
раствор. Полный лизис достигали осмотическим
ровали электрофоретически (рис. 1б). Выход очи-
шоком при добавлении в реакционную среду ди-
щенного белка из 15 г сырого веса рекомбинант-
БИОФИЗИКА том 65
№ 6
2020
1054
СИУНОВ и др.
Рис. 2. Кинетика гемолитической активности хелика-
зы SsoHel308.
ных бактериальных клеток составил 0.73% от то-
тального белка экстракта клеток, или 25 мл,
содержащих 16 мг белка. Идентичность очищен-
ного фермента хеликазы SsoHel308 подтвердили с
использованием тандемной масс-спектрометрии
(см. раздел «Материалы и методы»).
Гемолитическая активность хеликазы SsoHel308.
Хеликаза SsoHel308 способна образовывать гек-
самерные структуры, в центре которых образует-
ся отверстие для транслокации однонитевой
ДНК. Кроме того, необходимо учитывать, что
практически все бактериальные белки нуклеино-
вого обмена способны распознавать мембраны,
так как всевозможные процессы модификации
ДНК проходят на бактериальных мембранах. В
связи с этим было сделано предположение, что
при встраивании предобразованных гексамерных
форм хеликазы SsoHel308 в мембраны возможно
создание пор. Для проверки этого предположе-
ния мы использовали эритроциты, нарушение
целостности мембраны которых приводит к гемо-
лизу. Образец очищенной хеликазы SsoHel308 в
концентрации 0.642 мг/мл тестировали в реакции
гемолиза с использованием эритроцитов кро-
лика.
На рис 2 продемонстрирована кинетика гемо-
лиза эритроцитов кролика при добавлении хели-
казы SsoHel308 в условиях, описанных в разделе
«Материалы и методы» при температуре 25°С. В
этих условиях достигался 30%-й гемолиз эритро-
цитов в течение трех с половиной часов, что мо-
жет указывать на возможность порообразования.
Рис. 1. Этапы очистки SsoHel308: (а) - схема очистки
Однако эффективность порообразования невы-
хеликазы SsoHel308, (б) - электрофореграмма белка
сока. Возможно, полученный результат связан с
при элюции с отделенной колонки Ni-NTA, (в) -
низкой эффективностью олигомеризации (гекса-
электрофореграмма белка при элюции с колонки
DEAE-FF.
меризации) хеликазы в водном растворе в услови-
БИОФИЗИКА том 65
№ 6
2020
ПОРООБРАЗУЮЩИЕ СВОЙСТВА ХЕЛИКАЗЫ
1055
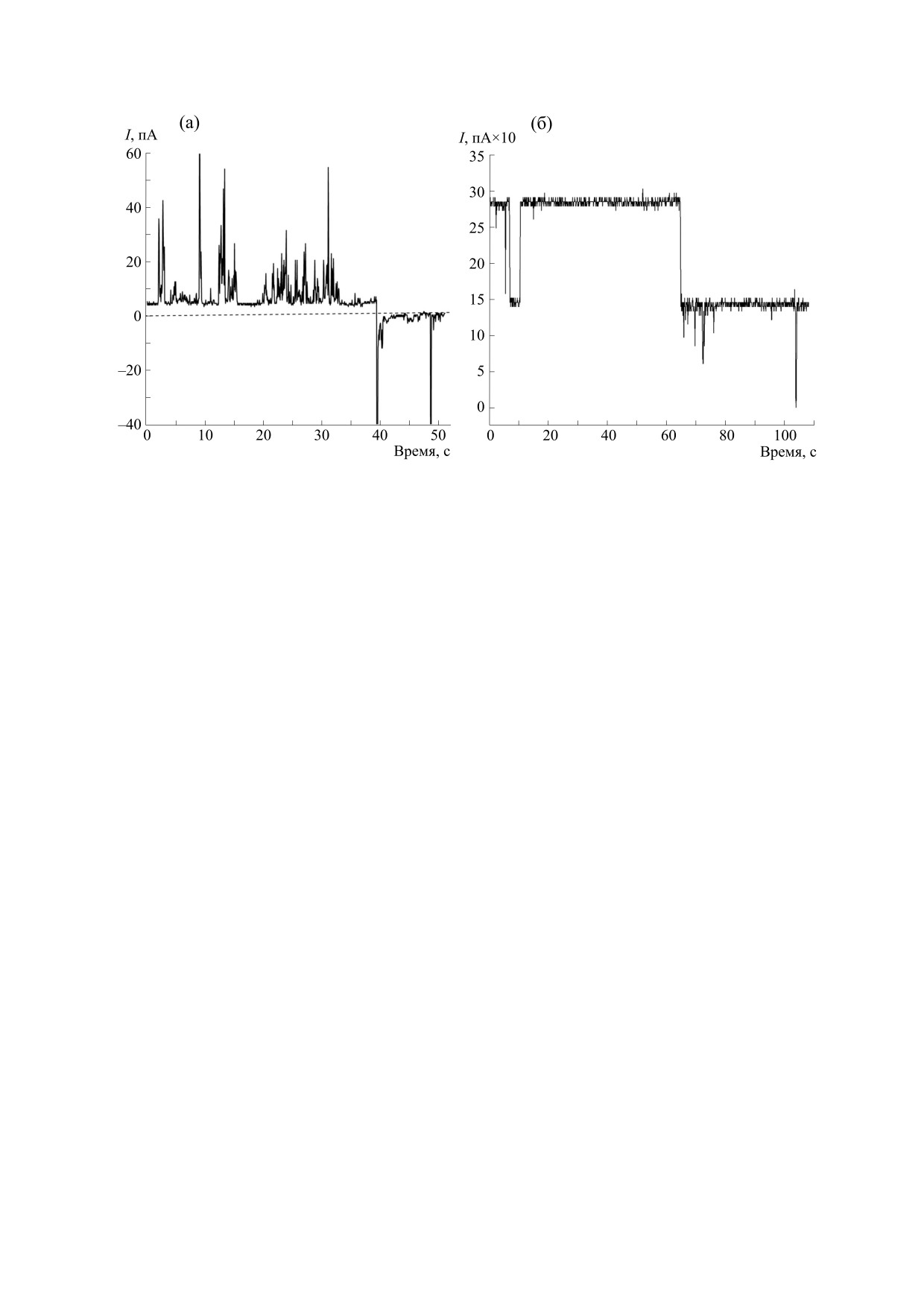
Рис. 3. Электрофизические характеристики пор, образованных хеликазой SsoHel308. (а) - Флуктуации тока при до-
бавлении 38.52 мкг/мл хеликазы (out), напряжение +/-100 мВ. (б) - Флуктуации тока в присутствии хеликазы
SsoHel308. Концентрация (out) 8.12 мкг/мл, напряжение +100 мВ, раствор - 1 M KCl.
ях проводимого эксперимента с последующим
уровни отключения и включения тока. Такое по-
встраиванием в мембраны эритроцитов или с не-
ведение тока характерно для мембран с работаю-
стабильностью образуемых пор. Таким образом,
щими ионными каналами. Обращает на себя вни-
показано, что хеликаза SsoHel308, которая входит
мание очень большая величина тока (около
в семейство хеликаз SFII, проявляет цитолитиче-
150 пA), протекающая через такие структуры.
скую активность на живых эукариотических
Встраивание очищенной хеликазы SsoHel308 в
клетках, атакуя их мембрану. Ограничение вре-
искусственные бислойные мембраны позволяет
мени проявления гемолитической активности
предположить, что этот белок является мембран-
может определяться стабильностью фермента в
ным трансформером, так как он вызывает изме-
условиях эксперимента.Чтобы оценить, способна
нение проводимости бислойных липидных мем-
ли хеликаза SsoHel308 создавать поры в мембра-
бран. Суммируя полученные результаты, мы при-
нах со свойствами каналов, использовали искус-
ходим к выводу, что хеликаза SsoHel308 способна
ственные бислойные мембраны.
образовывать поры в искусственных бислойных
мембранах, и в некоторых случаях ток, протекаю-
Добавление хеликазы до конечной концентра-
щий через мембраны, имеет особенности, харак-
ции 1.93 мкг/мл к искусственным бислойным
терные для работы ионных каналов.
мембранам увеличивало проводимость мембраны
более чем на порядок. Изменения тока через мем-
брану проявляются отдельными всплесками. На
ЗАКЛЮЧЕНИЕ
рис. 3а видны хаотичные всплески тока как при
Нами было сделано предположение, что при
положительном, так и при отрцательном потен-
встраивании предобразованных гексамерных
циале со стороны белка. Изменения электропро-
форм хеликазы SsoHel308 в мембраны возможно
водности мембраны, определяемой присутствием
создание пор, которые будут способны трансло-
хеликазы, чаще проявляется при отрицательном
цировать ДНК через естественные или искус-
потенциале со стороны белка. Всплески могут
ственные мембраны, так как модификации ДНК
указывать на ограниченное время существования
проходят на бактериальных мембранах. В данной
пор. В экспериментах мы использовали материал
работе продемонстрирована принципиальная
после длительного хранения в глицерине при -20°С
возможность формирования поры хеликазой
с последующим диализом против буфера В. На
SsoHel308 в бислойных и природных мембранах.
рис. 1б видны изменения тока через мембрану в
Ранее авторы работы [7] показали возможность
присутствии хеликазы и четкие и одинаковые
порообразования в бислойных мембранах шести-
БИОФИЗИКА том 65
№ 6
2020
1056
СИУНОВ и др.
мерной хеликазой E1 вируса папилломы
БЛАГОДАРНОСТИ
крупного рогатого скота. E1-хеликаза относится
Авторы благодарны С.В. Тищенко за предо-
к третьему суперсемейству хеликаз (SF3), функ-
ставление геномной ДНК Saccharolobus solfatari-
ционирует на ранних стадиях рекомбинации по-
cus. Масс-спектрометрический анализ был про-
сле остановки репликационной вилки и обладает
веден на базе ЦКП «Структурно-функциональ-
специфичностью для удаление отстающей нити в
ные исследования белков и РНК» (ИБ РАН,
вилках репликации модели. Авторы использова-
Пущино Московской области).
ли делеционный вариант хеликазы, лишенный
активности связывающей ДНК. По сравнению с
другими нативными мембранными каналами на-
ФИНАНСИРОВАНИЕ РАБОТЫ
нопора хеликазы Е1 показала относительно низ-
Работа выполнена при финансовой поддержке
кую эффективность направленного переноса од-
Министерства науки и высшего образования Рос-
ноцепочечной ДНК и относительно короткое
сийской Федерации (грант № RFMEFI60419X0218).
время пребывания в составе бислойной мем-
браны.
КОНФЛИКТ ИНТЕРЕСОВ
Мы исследовали хеликазу экстремально тер-
Авторы заявляют об отсутствии конфликта
мофильной археи Saccharolobus solfataricus
интересов.
SsoHel308, входящую во второе суперсемейство
хеликаз (SF2). Описанная ранее кристаллическая
структура этой хеликазы обнаруживает пятидо-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
менную структуру с центральной порой размером
1.3 нм, выстланной необходимыми аминокислот-
Настоящая работа не содержит описания ис-
ными остатками для связывания с ДНК [8]. Ана-
следований с использованием людей и животных
лиз пор, образуемых хеликазой SsoHel308 в ис-
в качестве объектов.
кусственных бислойных мембранах, с учетом ра-
нее опубликованных данных указывает на
СПИСОК ЛИТЕРАТУРЫ
принципиальную возможность использования
этих пор в нанопоровой технологии определения
1. J. J. Kasianowicz, A. K. Balijepalli, J. Ettedgui, et al.,
Biochim. Biophys. Acta
1858
(3),
593
(2016).
нуклеотидных последовательностей, хотя на этом
DOI:10.1016/j.bbamem.2015.09.023
этапе существуют определенные ограничения из-
2. H. Gamaarachchi, C. W. Lam, G. Jayatilaka, et al.,
за короткого времени существования сформиро-
BMC Bioinformatics
21
(1),
343
(2020). DOI:
ванных в мембранах пор и, следовательно, умень-
10.1186/s12859-020-03697-x
шения времени прохождения полинуклеотидных
3. J. M. Craig, A. H. Laszlo, I. M. Derrington, et al.,
цепей через пору. Хеликаза вируса папилломы
PLoS One
10
(11), e0143253
(2015). DOI:
крупного рогатого скота E1 (суперсемейство SF3)
10.1371/journal.pone.0143253
при встраивании в искусственные бислойные
4. S. Castella, G. Bingham, and C. M. Sanders, Nucl. Ac-
мембраны сохраняет основные активности,
ids Res. 34, 3008 (2006).
включая способность к транслокации ДНК в
5. C. M. Sanders, O. V. Kovalevskiy, D. Sizov, et al., Nucl.
присутствии АТФ. Несмотря на то что гексамер-
Acids Res.
35(19),
6451
(2007). DOI:
10.1093/
ная хеликаза SsoHel308 входит в другое суперсе-
nar/gkm705
мейство (SF2), по-видимому, при встраивании ее
6. S. S. Patel and K. M. Picha, Annu. Rev. Biochem. 69,
основные активности также должны сохраняться.
651 (2000).
7. K. Sun, C. Zhao, X. Zeng, et al., Nat. Commun. 10 (1),
Короткое время существования пор на мем-
5083 (2019). DOI: 10.1038/s41467-019-13047-y
бране значительно снижает токсичность хелика-
8. J. D. Richards, K. A. Johnson, H. Liu, et al., J. Biol.
зы для клетки, а возможность направленной
Chem.
283
(8),
5118
(2008).
DOI:
транслокации однонитевой ДНК в присутствии
10.1074/jbc.M707548200
АТФ позволит в будущем использовать этот фер-
9. K. Alexandrov, I. Simon, V. Yurchenko, et al., Eur. J.
мент в качестве молекулярного шприца для инъ-
Biochem. 265 (1), 160 (1999). DOI: 10.1046/j.1432-
екций однонитевых ДНК в живые клетки. В за-
1327.1999.00699.x
висимости от конкретной цели применения
10. A. S. Syutkin, M. van Wolferen, A. K. Surin, et al., Mi-
хеликазы (например, доставка лекарственных
crobiologyOpen 8 (5), e00718 (2019).
препаратов, анализ отдельных клеток, таргетная
11. Zh. I. Andreeva, V. F. Nesterenko, M. G. Fomkina,
терапия опухолевых клеток и редактирование ге-
et al., Biochim. Biophys. Acta 1768 (2), 253 (2007).
номов на основе CRISPR Cas системы) должна
DOI: 10.1016/j.bbamem.2006.11.004
быть разработана соответствующая адресная тех-
12. P. Mueller, D. O. Rudin, H. T. Tien, and W. C. Wes-
нология.
cott, Nature 194, 979 (1962).
БИОФИЗИКА том 65
№ 6
2020
ПОРООБРАЗУЮЩИЕ СВОЙСТВА ХЕЛИКАЗЫ
1057
Pore-Forming Properties of SsoHel308 Helicase from Saccharolobus solfataricus
A. V. Siunov*, M. P. Borisova**, Zh. I. Andreeva-Kovalevskaya*, A. S. Nagel*, A.S. Kolesnikov*,
A.K. Surin***, ****, and A.S. Solonin*
*G.K. Skryabin Institute of Biochemistry and Physiology of Microorganisms, Russian Academy of Sciences,
prospekt Nauki 5, Pushchino, Moscow Region, 142290 Russia
**Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
ul. Institutskaya 3, Pushchino, Moscow Region, 142290 Russia
***Branch of Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences,
ul. Institutskaya 6, Pushchino, Moscow Region, 142290 Russia
****Institute of Protein Research, Russian Academy of Sciences,
ul. Institutskaya 4, Pushchino, Moscow Region, 142290 Russia
The pore-forming activity of SsoHel308 helicase from extreme thermophilic archaea Saccharolobus solfatar-
icus has been demonstrated for the first time. This protein, embedded into rabbit erythrocyte membranes,
may cause erythrocyte hemolysis. It has been shown that this enzyme forms pores in a flat artificial bilayer
membrane and acts as the transformer. After embedding this enzyme into bilayer lipid membranes, the mem-
brane conductivity alters. Taken together, our results show that SsoHel308 helicase is able to form pores in
artificial bilayer membranes and, in some cases, the current that flows across the membranes shares features
typical of ion channels. The short lifetime of the pores in the membrane significantly reduces the toxicity of
helicase for a living cell, and the possibility of directed translocation of single-stranded DNA in the presence
of ATP will enable the use of this enzyme as a molecular syringe for injecting single-stranded DNA into living
cells.
Keywords: helicase, extra thermophilic archaea, hemolysis, artificial bilayer membranes, pore formation
БИОФИЗИКА том 65
№ 6
2020