БИОФИЗИКА, 2020, том 65, № 6, с. 1058-1064
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.323
ИЗУЧЕНИЕ СТРУКТУРЫ ДНК В ПЛЕНКАХ
МЕТОДОМ ИК-ФУРЬЕ-СПЕКТРОСКОПИИ
© 2020 г. С.В. Пастон*, А.М. Поляничко*, О.В. Шуленина**, Д.Н. Осинникова*
*Физический факультет Санкт-Петербургского государственного университета,
198504, Санкт-Петербург, Старый Петергоф, ул. Ульяновская, 1
**Петербургский институт ядерной физики им. Б.П. Константинова Национального исследовательского центра
«Курчатовский институт», 188300, Ленинградская обл., Гатчина, мкр. Орлова роща, 1
E-mail: s.v.paston@spbu.ru
Поступила в редакцию 30.11.2019 г.
После доработки 30.11.2019 г.
Принята к публикации 24.09.2020 г.
Водная среда и ионное окружение являются важнейшими факторами, определяющими конформа-
цию ДНК и ее функционирование в клетке. Специфичность взаимодействия ДНК с катионами осо-
бенно ярко проявляется при снижении активности воды. В данной работе с помощью ИК-Фурье-
спектроскопии (метод нарушенного полного внутреннего отражения) исследован В-А-переход в
высокомолекулярной ДНК при уменьшении влажности в пленке с различным содержанием ионов
Na+. ИК-спектр ДНК не только весьма чувствителен к состоянию ее вторичной структуры, но так-
же позволяет оценить количество связанной с ДНК воды. При дегидратации пленки ДНК в спектре
ИК-поглощения наблюдали изменения, характерные для В-А-перехода. С помощью термограви-
метрического анализа показано, что степень гидратации ДНК достигает насыщения при относи-
тельной влажности 60% и при дальнейшем высушивании снижается незначительно. Установлено,
что с ростом концентрации Na+ снижается количество сильно связанной с ДНК воды. При этом
ионы натрия разрушают гидратную оболочку ДНК и способны взаимодействовать непосредствен-
но с фосфатными группами.
Ключевые слова: ДНК, гидратация, вторичная структура, В-А переход, ИК-Фурье-спектроскопия,
термогравиметрический анализ.
DOI: 10.31857/S0006302920060034
нуклеотид, которые связаны непосредственно с
Взаимодействие с водным окружением играет
группами ДНК [1-3]. Этот внутренний слой
ключевую роль в структуре и функционировании
сильно отличается по структуре и свойствам от
нуклеиновых кислот. Гидрофобные и гидрофиль-
обычной воды, в частности, он не замерзает при
ные взаимодействия стабилизируют двуспираль-
температурах значительно ниже
0°С
[4,
5].
ную вторичную структуру ДНК [1]. В водной сре-
Остальные восемь-девять молекул воды первич-
де ДНК сильно и неравномерно гидратирована,
ной гидратной оболочки связаны с внутренним
что приводит к упорядоченному расположению
слоем. Вторичная гидратная оболочка связана
молекул воды в непосредственной близости от
с первичной и существенно менее структуриро-
ДНК, формируя так называемые первичную и
вана [1].
вторичную гидратные оболочки. Первичная гид-
Структура гидратных оболочек ДНК зависит
ратная оболочка заполняется при относительной
от нуклеотидной последовательности. Методами
влажности около 80% и составляет 20 молекул во-
рентгеновской кристаллографии и ЯМР было по-
ды на нуклеотид [1, 2]. В порядке уменьшения
казано, что в малой бороздке В-ДНК существует
гидрофильности группы ДНК располагаются
так называемый «водный хребет» (spine of hydra-
следующим образом: 1) отрицательно заряжен-
tion), молекулы воды в котором менее подвижны,
ные фосфатные группы; 2) фосфодиэфирные
чем те, которые расположены в большой борозд-
связи и остатки сахаров; 3) основания. Внутрен-
ке [6-9]. Наиболее сильно связанной оказывает-
ний слой первичной гидратной оболочки состоит
ся вода в малой бороздке А-Т-последовательно-
из одиннадцати-двенадцати молекул воды на
стей [9].
Сокращениe: НПВО - нарушенное полное внутреннее от-
Изменение степени гидратации ДНК влечет за
ражение.
собой перестройки вторичной структуры макро-
1058
ИЗУЧЕНИЕ СТРУКТУРЫ ДНК В ПЛЕНКАХ
1059
молекулы. Понижение активности воды в раство-
пределах В-семейства [18, 23-25], определяет ста-
ре ДНК случайной нуклеотидной последователь-
бильность вторичной структуры и радиочувстви-
ности при количестве молекул воды на один нук-
тельность ДНК [26-29]. Взаимодействие с катио-
леотид менее двадцати приводит, в зависимости
нами металлов играет ключевую роль в функцио-
от природы противоиона, к переходу В→А (меж-
нировании нуклеиновых кислот, в частности, в
ду разными семействами двойных спиралей, от-
разнообразных взаимодействиях
«нуклеиновая
личающихся конформацией сахара) или внутри-
кислота-белок» [1, 30-35].
семейственному переходу В→С [1, 3]. Гидратация
В данной работе проводится исследование
А-формы двойной спирали более экономична,
вторичной структуры высокомолекулярной ДНК
чем для В-формы, из-за сближения соседних
со случайной нуклеотидной последовательно-
фосфатных групп [10-12]. Сахара и основания
стью в пленках с различным содержанием NaCl
при этом не гидратированы. В одной макромоле-
при снижении влажности. Для наблюдения за
куле могут соседствовать участки, имеющие раз-
конформацией ДНК использован метод ИК-Фу-
ные формы вторичной структуры [13]. Мини-
рье-спектроскопии, весьма чувствительный к
мальная степень гидратации ДНК оценивается,
форме двойной спирали. Кроме того, ИК-спектр
по разным данным, от трех-шести [1] до пяти-ше-
позволяет оценить количество воды в образце. В
сти [5] молекул воды на нуклеотид, при этом вся
настоящее время ИК-спектроскопия широко
ДНК находится в А-форме.
применяется для исследования структуры биоло-
гических макромолекул [36-38], в частности,
Вторичная структура ДНК является важней-
этот метод позволяет анализировать сложные
шим фактором ее функционирования. Переход
многокомпонентные системы - биологические
В→А сопутствует многим внутриклеточным про-
среды [39-43], клетки и ткани [44, 45], что откры-
цессам, в частности, процессам репликации и
вает широкие возможности для его использова-
транскрипции [14]. Изучать конформационные
ния не только в фундаментальных исследовани-
переходы в ДНК in vitro можно путем варьирова-
ях, но и в диагностике заболеваний [39-41, 43-
ния активности воды в образце, например, изме-
45]. С помощью ИК-Фурье-спектроскопии уда-
няя концентрации противоионов, добавляя
валось наблюдать переход В→А не только для
спирты или изменяя влажность [1, 5, 13]. Катио-
растворов ДНК, но и для клеточных ядер, а также
ны щелочных, щелочноземельных и переходных
целых клеток [46], причем во всех этих случаях
металлов взаимодействуют с отрицательно заря-
переход В→А оказывался обратимым.
женными фосфатными группами ДНК, а также с
кетогруппами и эндоциклическими атомами азо-
та оснований [1]. С ростом концентрации проти-
МАТЕРИАЛЫ И МЕТОДЫ
воионов увеличивается степень экранировки за-
ряда ДНК, что приводит к снижению объема мак-
В работе использовали натриевую соль ДНК
ромолекулярного клубка в растворе [15-17]. В
из эритроцитов цыплят производства фирмы Re-
разбавленном растворе контакты между однова-
anal (Болгария) с М = 1.4 ± 0.2 МДа, химически
лентными катионами и электроотрицательными
чистый NaCl, деионизованную воду. Растворы
группами ДНК опосредованы водой; проникно-
NaCl необходимой концентрации готовили из
вение катионов в бороздки двойной спирали
насыщенного раствора. Разбавленные водные
определяется соответствием между размерами ка-
растворы ДНК перед измерением ИК-спектров
тиона и бороздки (причем размер последней мо-
концентрировали на концентраторе биомолекул
жет
«подстроиться» под размер катиона) и,
Concentrator-plus фирмы Eppendorf (Германия),
соответственно, зависит от нуклеотидной после-
на 1100 об/мин не более 30 мин за один сеанс при
довательности [18-20]. Специфичность взаимо-
комнатной температуре, до достижения концен-
действия ДНК с одновалентными катионами
трации ДНК в растворе 2 мМ в пересчете на нук-
обостряется при понижении активности воды:
леотиды.
уменьшение влажности в присутствии Na+ инду-
ИК-спектры. Одним из главных маркеров А- и
В-формы является полоса, соответствующая ас-
цирует переход В→А, а в присутствии Li+ - пере-
симетричным колебаниям фосфатной группы
ход В→C во вторичной структуре ДНК [1, 13].
[47].
Двухвалентные катионы проявляют более ярко
выраженную специфичность при взаимодей-
Измерения проводили на ИК-Фурье-спектро-
ствии с ДНК и могут образовывать даже в разбав-
метре Nicolet 8700 (Thermo Scientific, США),
ленном растворе комплексы не только в форме
оснащенном приставкой однократного нарушен-
гидратов, но и непосредственно с электроотрица-
ного полного внутреннего отражения (НПВО) на
тельными группами ДНК [1, 16, 17, 21, 22]. Ион-
основе кристалла алмаза, а также низкошумящим
ное окружение ДНК в растворе обуславливает ва-
детектором MCT (HgCdTe). Оптические пути
риации в архитектуре гидратных оболочек макро-
продували сухим воздухом. Регистрацию ИК-
молекулы и в геометрии двойной спирали в
спектров исследуемых образцов осуществляли с
БИОФИЗИКА том 65
№ 6
2020
1060
ПАСТОН и др.
После высушивания образца на кристалле
НПВО получали тонкую пленку. Спектр пленки
регистрировали отдельно с усреднением по
100 накоплениям.
Коррекцию базовой линии спектров и обра-
ботку проводили по описанной ранее методике
[48]. Каждый спектр нормировали на интенсив-
ность полосы 963 ± 2 см-1 (валентные колебания
связей С-С сахаро-фосфатного остова). Группа
С-С не взаимодействует с ионами Na+, поэтому
спектральные изменения полосы 963 ± 2 см-1 не-
значительны [49]. Процедура нормировки позво-
лила устранить влияние концентрации ДНК (ко-
торая варьируется при высушивании образцов)
на интенсивность спектра.
Термогравиметрический анализ лиофилизован-
ной ДНК проводили на сорбционном гравимет-
рическом анализаторе TGA Q5000SA TA Instru-
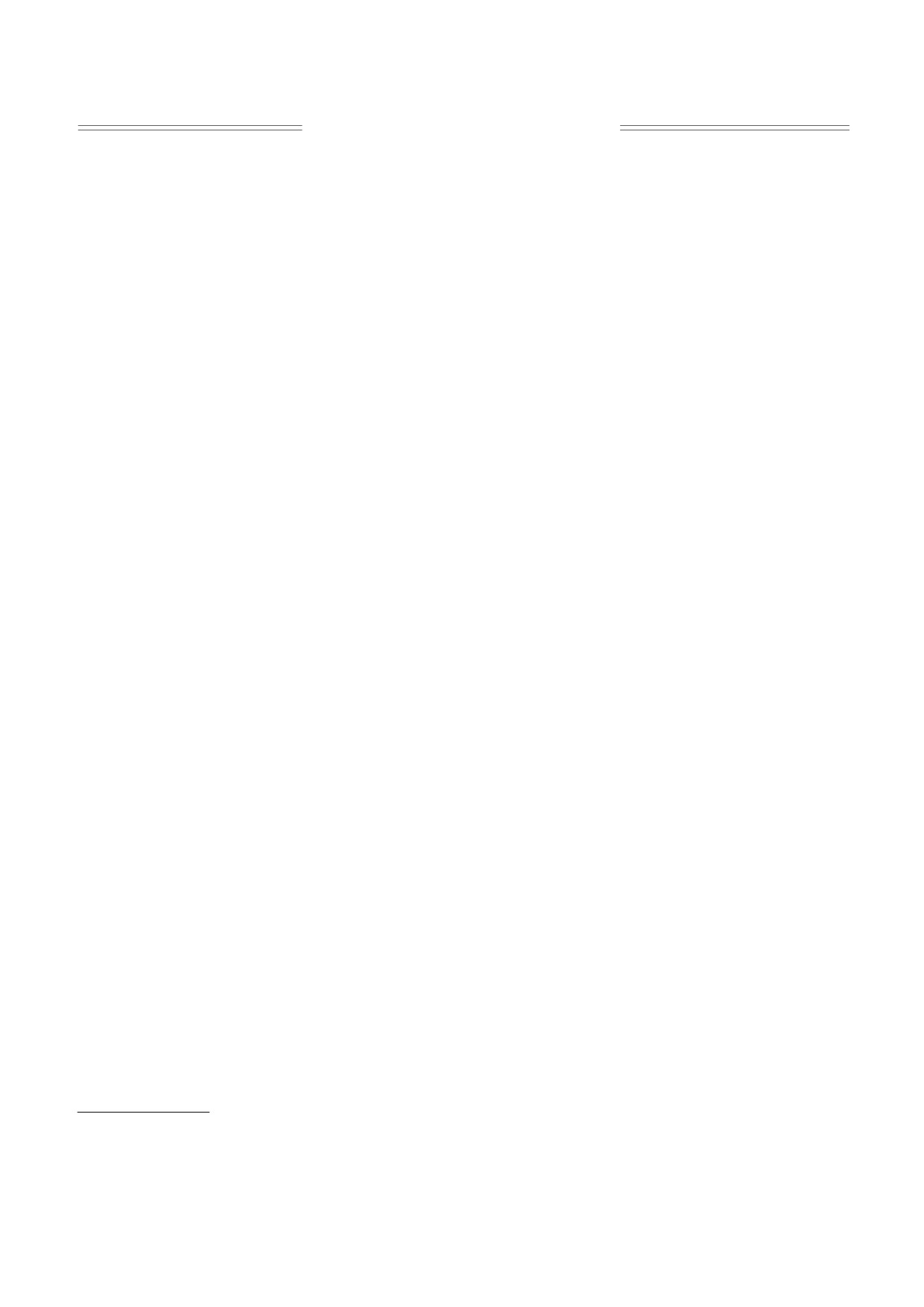
Рис. 1. Схема эксперимента.
ments (США) с высокостабильными термостати-
рованными весами (чувствительность 0.1 мкг), в
помощью модифицированной установки (рис. 1).
изотермическом режиме при температуре
Над ячейкой НПВО была установлена система
25.0 ± 0.1°С, точность установки относительной
влажности (rh) составляла ±1%, шаг по rh - 5%, в
подачи чистого сухого воздуха (точка росы не вы-
атмосфере азота. Содержание натрия в образце
ше -50°С). Спектры регистрировали в диапазоне
[Na]/[P] = 1.
3500-600 см-1 с разрешением 2 см-1. Каждый
спектр усредняли по десяти накоплениям в тече-
ние 13 с. Регистрацию спектров осуществляли в
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
непрерывном режиме в течение всего времени
Динамика изменения ИК-спектров в процессе
высушивания образца, которое в среднем состав-
дегидратации образца, помещенного на кристалл
ляло 10 мин. Начальный объем образца, помеща-
НПВО, представлена на рис. 2. На начальном эта-
емого на кристалл, составлял 10 мкл, в концен-
пе дегидратации в спектрах доминируют полосы
трации [P] = 2 мМ (в пересчете на фосфаты).
поглощения воды, соответствующие колебаниям
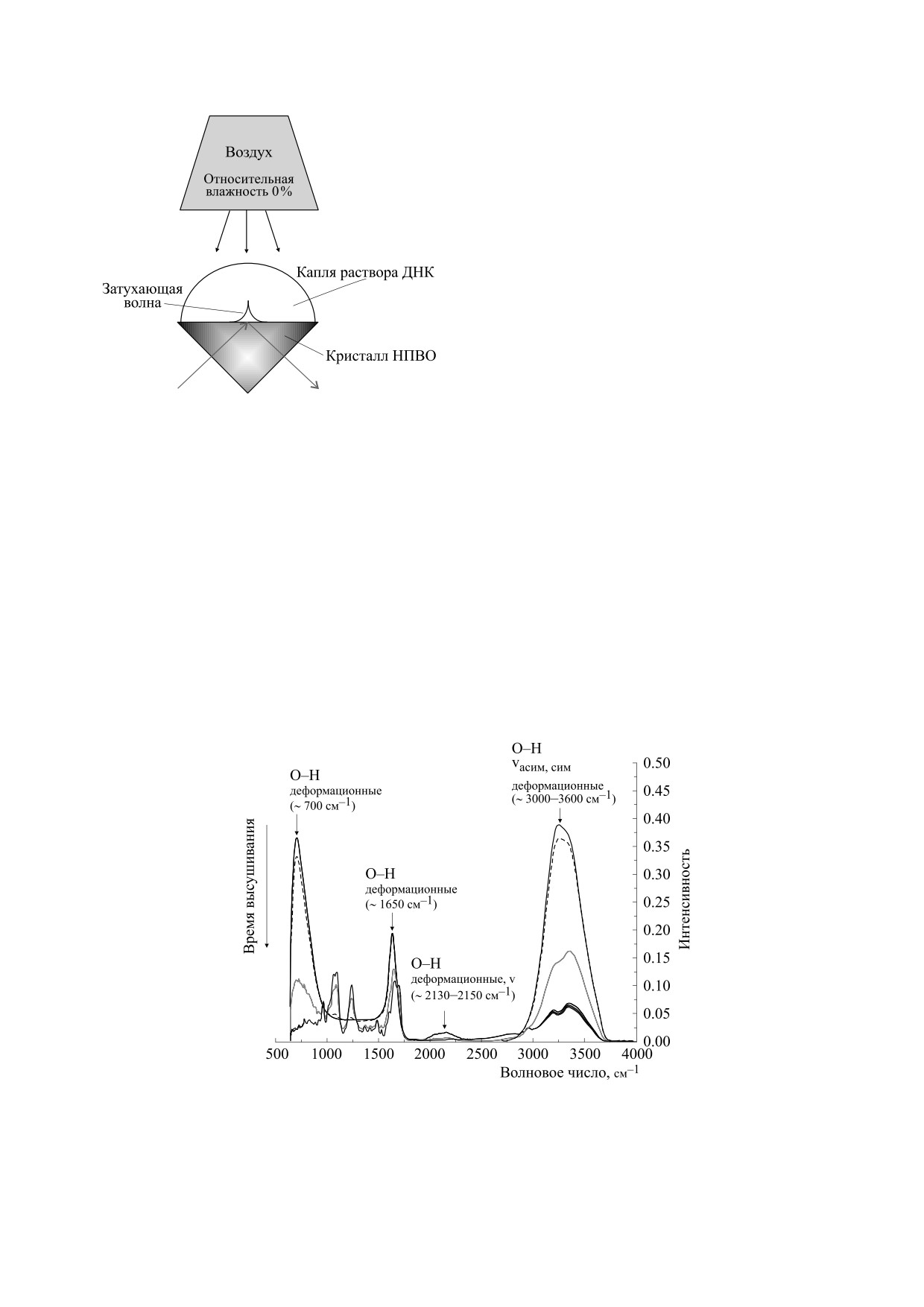
Рис. 2. Серия ИК-спектров (ненормированных) раствора ДНК, измеренных в процессе его высушивания на кристал-
ле НПВО. Стрелками показаны области колебаний О-Н-групп во влажных образцах, которые возникают в основном
за счет колебаний молекул воды; v - валентные колебания.
БИОФИЗИКА том 65
№ 6
2020
ИЗУЧЕНИЕ СТРУКТУРЫ ДНК В ПЛЕНКАХ
1061
Рис. 4. Термогравиметрический анализ образца ДНК.
Зависимости от времени:
1
- массы ДНК, 2 -
относительной влажности в измерительной камере.
Пунктиром показаны условия стабилизации массы
ДНК.
лосы, соответствующей валентным колебаниям
О-Н, довольно быстро снижается и выходит на
плато через 200-300 с после начала высушива-
ния; дальнейшее обдувание пленки сухим возду-
хом не приводит к заметным изменениям интен-
сивности, что соответствует минимально дости-
жимому в условиях эксперимента количеству
воды в пленке. На рис. 3б представлен спектр
ИК-поглощения полностью высушенных пленок
в области 3000-3600 см-1.
Для установления степени дегидратации об-
разца обратимся к данным термогравиметриче-
ского анализа (рис. 4). На графике приведены за-
Рис. 3. (а) - Интенсивность полосы 3353 см-1 в зависи-
мости от времени высушивания образца; (б) - полоса
висимости массы образца ДНК и относительной
3353 см-1 в полностью высушенных пленках (после на-
влажности (rh) в измерительной камере от време-
сыщения).
ни. При rh = 95% ДНК стремительно набухает -
масса образца резко увеличивается. Затем посте-
ОН-групп. В процессе высушивания интенсив-
пенное уменьшение влажности приводит к поте-
ность полос, соответствующих деформационным
ре массы образца - ДНК теряет воду. Это продол-
колебаниям в молекуле воды, постепенно падает,
жается до rh = 60%, когда масса ДНК достигает
и начинают проявляться полосы, характерные
насыщения. Дальнейшее снижение влажности (в
для колебаний групп в составе ДНК. Широкая
течение более чем 100 часов) весьма слабо влияет
на массу образца. Можно считать, что это состоя-
полоса в области 3000-3600 см-1 отвечает комби-
ние соответствует минимальной степени гидрата-
нации симметричных и антисимметричных ва-
ции ДНК - около шести молекул воды на нуклео-
лентных, а также обертона деформационных ко-
тид [5]. Таким образом, можно заключить, что
лебаний молекулы воды [50]. По интенсивности
дальнейшее выдерживание пленки ДНК на кри-
именно этой полосы можно судить о количестве
сталле НПВО в потоке воздуха с rh, близкой к 0%,
воды, оставшейся в пленке. На рис. 3а представ-
также не приведет к заметному снижению коли-
лены зависимости I3353/I963 величины поглоще-
чества воды в образце, и наблюдаемое на рис. 3а
ния в максимуме этой полосы 3353 см-1, отнесен-
плато действительно соответствует минимально
ной к величине поглощения при 963 см-1, от вре-
возможному количеству молекул воды в первич-
мени высушивания образца для растворов с
ной (и единственной в данном случае) гидратной
разным содержанием NaCl. Интенсивность по-
оболочке ДНК.
БИОФИЗИКА том 65
№ 6
2020
1062
ПАСТОН и др.
Рис. 5. ИК-спектры (нормированные) раствора ДНК, измеренные в процессе его высушивания на кристалле НПВО.
Стрелками показаны полосы колебаний групп ДНК.
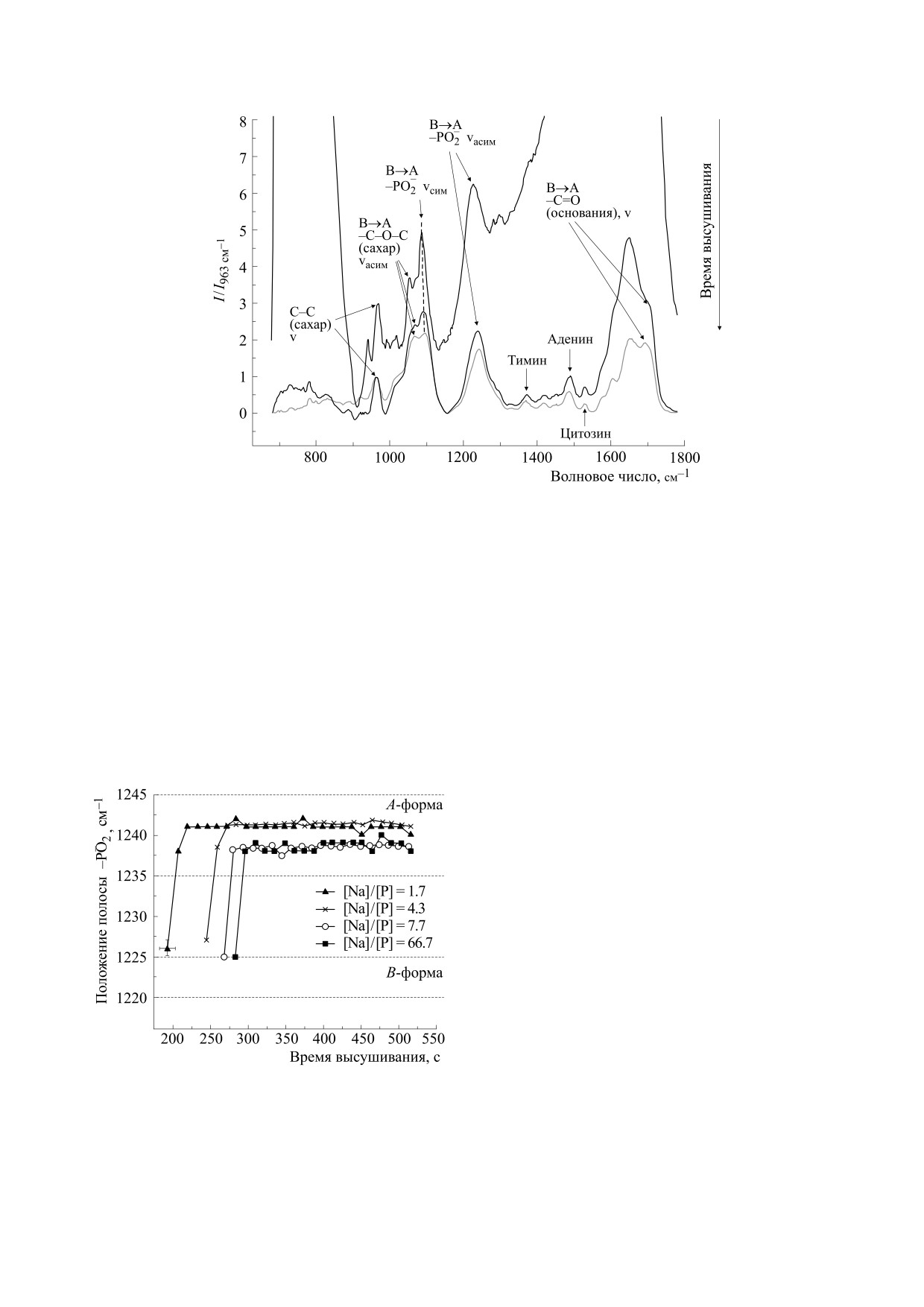
Рассмотрим спектральный интервал
900-
рая считается одним из главных маркеров перехо-
1800 см-1, в котором можно наблюдать полосы
да В→А во вторичной структуре ДНК: положение
колебаний различных групп ДНК в процессе де-
1225-1220 см-1 отвечает В-форме, а
1245-
гидратации пленок (рис. 5) (подробное отнесение
1235 см-1 - А-форме [47]. На рис. 6 показаны за-
полос в этой области спектра можно найти в ра-
висимости положения этой полосы от времени
ботах [47, 50]). Положение и форма этих полос из-
высушивания образцов с разным содержанием
NaCl. Области значений волновых чисел для дан-
меняются с уменьшением влажности пленки, что
ной полосы, отвечающие В- и А-формам ДНК,
отражает изменение конформации ДНК. Наи-
отмечены на рисунке. Видно, что резкое падение
больший интерес представляет полоса антисим-
интенсивности полосы 3353 см-1 (см. рис. 3а), со-
метричных колебаний фосфатной группы, кото-
ответствующее быстрому снижению содержания
воды в пленке, сопровождается изменением по-
ложения полосы антисимметричных колебаний
PO–. Выход на плато интенсивности полосы ва-
лентных колебаний О-Н (рис. 3а), отражающее
полную дегидратацию пленки, соответствует
окончанию смещения полосы колебаний фос-
фатных групп (рис. 6), которое к этому моменту
прочно устанавливается в области, отвечающей
А-форме ДНК. Таким образом, можно сделать
вывод о том, что плато на рис. 3а, действительно,
соответствует ситуации, когда в образце осталась
только сильно связанная вода в первичной гид-
ратной оболочке А-ДНК, в количестве около 6
молекул воды на нуклеотид.
Обратим внимание, что в ИК-спектрах высу-
шенных пленок ДНК с разным содержанием
NaCl увеличение концентрации соли приводит к
снижению интенсивности полосы колебаний
Рис. 6. ИК-спектры (нормированные) раствора ДНК,
О-Н (3000-3600 см-1) (рис. 3б). Иными словами,
измеренные в процессе его высушивания на кристалле
НПВО. Стрелками показаны полосы колебаний групп
присутствие соли приводит к уменьшению коли-
ДНК.
чества молекул воды в первичной гидратной обо-
БИОФИЗИКА том 65
№ 6
2020
ИЗУЧЕНИЕ СТРУКТУРЫ ДНК В ПЛЕНКАХ
1063
лочке ДНК. В литературе есть сведения о том, что
КОНФЛИКТ ИНТЕРЕСОВ
одновалентные катионы могут встраиваться в
Авторы заявляют об отсутствии конфликта
гидратную оболочку ДНК, особенно в условиях
интересов.
низкой активности воды [15, 17, 18, 23]. Таким об-
разом, уменьшение количества связанной воды
в высушенных пленках с ростом концентрации
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
NaCl можно объяснить нарушением первичной
Настоящая работа не содержит описания ис-
гидратной оболочки молекулы ДНК ионами на-
следований с использованием людей и животных
трия в условиях пониженной влажности. Кроме
в качестве объектов.
того, из графиков на рис. 6 видно влияние ионов
натрия на положение полосы колебаний фосфат-
ных групп в области, отвечающей А-форме ДНК;
СПИСОК ЛИТЕРАТУРЫ
оно немонотонно по соотношению
[Na]/[P].
1. В. Зенгер, Принципы структурной организации
Можно заключить, что вторичная структура, ко-
нуклеиновых кислот (Мир, М., 1987).
торую принимает ДНК в высушенной пленке, от-
2. J. Texter, Prog. Biophys. Mol. Biol. 33, 83 (1979).
носится к семейству А-форм и зависит от содер-
3. Water and Biological Macromolecules. Topics in Molecu-
жания ионов Na+, которые, вытесняя молекулы
lar and Structural Biology, Ed. by E. Westhof (Palgrave,
воды из первичной гидратной оболочки, образу-
London, 1993).
ют непосредственные контакты с фосфатными
4. M. Falk, A. G.Poole, and C. G. Goymour, Can. J.
группами ДНК.
Chem. 48, 1536 (1970).
5. N. J. Tao, S. M. Lindsay, and A. Rupprecht, Biopoly-
mers 28, 1019 (1989).
ВЫВОДЫ
6. H. R. Drew and R. E. Dickerson, J. Mol. Biol. 151, 535
(1981).
Наблюдали переход В→А во вторичной струк-
7. M. L. Kopka, A. V. Fratini, H. R. Drew, and R. E. Di-
туре высокомолекулярной ДНК со случайной
ckerson, J. Mol. Biol. 163, 129 1983.
нуклеотидной последовательностью в пленках с
8. M. G. Kubinec and D. E. Wemmer, J. Am. Chem. Soc.
различным содержанием NaCl при уменьшении
114 (22), 8739 (1992).
влажности. Установлено, что степень гидратации
9. E. Liepinsh, G. Otting, and K. Wüthrich, Nucl. Acids
ДНК достигает постоянного значения при отно-
Res. 20 (24), 6549 (1992).
сительной влажности 60% и при дальнейшем
10. B. Schneider, K. Patel, and H. M. Berman, Biophys. J.
просушивании снижается незначительно. До-
75, 2422 (1998).
стигнутая в исследуемых образцах степень гидра-
11. M. Harmouchi, G. Albiser, and S. Premilat, Eur. Bio-
тации ДНК соответствует примерно 6 молекулам
phys. J. 19, 87 (1990).
воды на нуклеотид. Вторичная структура ДНК
12. M. Egli, V. Tereshko, M. Teplova, et al., Biopolymers
при этом относится к А-семейству, но варьирует в
(Nucl. Acid Sci.) 48, 234 (1998).
зависимости от содержания Na+ в пленке. С ро-
13. V. I. Ivanov, L. E. Minchenkova, E. E. Minyat, et al., J.
стом концентрации NaCl в образце количество
Mol. Biol. 87 (4), 817 (1974)
воды в нем, соответствующее предельной дегид-
14. В. И. Иванов, Биополимеры и клетка 1 (1), 5 (1985)
ратации, снижается. В условиях низкой влажно-
15. Э. В. Фрисман и Н. А. Касьяненко, Молекуляр.
сти ионы натрия разрушают гидратную оболочку
биология 24, 301 (1990).
ДНК и взаимодействуют непосредственно с фос-
16. Н.А.Касьяненко, Н.Е. Дьяконова, Э.В. Фрисман,
фатными группами.
Молекуляр. биология 23, 975 (1989).
17. Н. А. Касьяненко, Журн. структур. химии 47 (1),
163 (2006).
БЛАГОДАРНОСТИ
18. N. V. Hud and M. Polak, Curr. Opin. Struct. Biol. 11,
Исследования проведены с использованием
293 (2001).
оборудования ресурсных центров Научного пар-
19. M. Egli, Chemistry & Biology 9, 277 (2002).
ка СПбГУ «Оптические и лазерные методы ис-
20. Y. Lu and N. C. Stellwagen, Biophys. J. 94, 1719 (2008).
следования вещества», «Термогравиметрические
21. A. M. Polyanichko, V. V. Andrushchenko, E. V. Chikh-
и калориметрические методы исследования» и
irzhina, et al., Nucl. Acids Res. 32 (3), 989 (2004).
«Развитие молекулярных и клеточных техноло-
22. A. M. Polyanichko, E. V. Chikhirzhina, V. V. Andrush-
гий».
chenko, et al., Biophysics 50 (5), 710 (2005)
23. B. Heddi, N. Foloppe, E. Hantz, and B. Hartmann, J.
Mol. Biol. 368, 1403 (2007).
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
24. M. L. Sushko, D. G. Thomas, S. A. Pabit, et al., Bio-
Работа выполнена при финансовой поддержке
phys. J. 110, 315 (2016).
Российского фонда фундаментальных исследова-
25. M. A. Young, B. Jayaram, and D. L. Beveridge, J. Am.
ний (грант №18-08-01500).
Chem. Soc. 119, 59 (1997).
БИОФИЗИКА том 65
№ 6
2020
1064
ПАСТОН и др.
26. Z.-J. Tan and S.-J. Chen, Biophys. J. 90, 1175 (2006).
copy, Ed. by D. S. Rodgers (Nova Science Publishers
27. G. L. Eichhorn and Y. A. Shin, J. Am. Chem. Soc. 90,
Inc., N.-Y., 2012), pp. 67-126.
7323 (1968).
39. L. V. Plotnikova, M. O. Kobeleva, E. V. Borisov, et al.,
28. S. A. Tankovskaia, O. M. Kotb, O. A. Dommes, and
Cell Tissue Biol. 13 (2), 130 (2019).
S. V. Paston, Spectrochim. Acta Part A: Mol. Biomol.
40. L. Plotnikova, A. Polyanichko, M. Kobeleva, et al., J.
Spectroscopy 200, 85 (2018).
Physics: Conf. Ser. 784 (1), 012047 (2017).
29. S. V. Paston, I. M. Zyryanova, Yu. V. Zaichikova, and
41. L. Plotnikova, A. Polyanichko, T. Nosenko, et al., AIP
V. V. Zamotin, J. Struct. Chem. 48 (4) 734 (2007).
Conf. Proc. 1760, 020052 (2016)
30. S. A. Mauro and G. B. Koudelka, J. Mol. Biol. 340, 445
42. K. V. Abrosimova, O. V. Shulenina, and S. V. Paston, J.
(2004).
Physics: Conf. Ser. 769, 012016 (2016).
31. A. M. Polyanichko, E. V. Chikhirzhina, V. V. Andrush-
chenko, et al., Mol. Biol. 38 (4), 590 (2004)
43. M. Gniadecka, O. F. Nielsen, D. H. Christensen, and
H. C. Wulf, J. Invest. Dermatol. 110, 393 (1998).
32. A. M. Polyanichko, E. V. Chikhirzhina, E. I. Kostyleva,
and V. I. Vorob'ev, Mol. Biol. 38 (6) 891 (2004).
44. Z .Movasaghi, Sh .Rehman, and I. ur Rehman, Appl.
33. A. M. Polyanichko, E. U. Chikhirzhina, V. V. Andrush-
Spectrosc. Rev. 43, 134 (2008).
chenko, et al., Biopolymers 83 (2), 182 (2006).
45. L. B. Mostaco-Guidolin and L. Bachmann, Appl.
34. E. V. Chikhirzhina, A. M. Polyanichko, E. I. Kostyleva,
Spectrosc. Rev. 46, 388 (2011).
and V. I. Vorobyev, Mol. Biol. 45 (2), 318 (2011).
46. D. R. Whelan, K. R. Bambery, P. Heraud, et al., Nucl.
35. A. M. Polyanichko, V. I. Vorob'ev, and E. V. Chikhir-
Acids Res. 39 (13) 5439 (2011).
zhina, Mol. Biol. 47 (2), 299 (2013).
47. M. Banyay, M. Sarkar, and A. Graslund, Biophys.
36. A. Polyanichko and H. Wieser, Biopolymers 78 (6), 329
Chem. 104, 477 (2003).
(2005).
48. A. M. Polyanichko, N. M. Romanov, T. Y. Starkova,
37. A. M. Polyanichko and H. Wieser, in Methods in Protein
et al., Cell Tissue Biol. 8 (4), 352 (2014).
Structure and Stability Analysis: Vibrational Spectrosco-
py, Ed. by E. Permyakov and V. Uversky (Nova Science
49. J. F. Neault and H. A. Tajmir-Riahi, Biophys. J. 76,
Publishers Inc., N.-Y., 2007), pp. 267-302.
2177 (1999).
38. A. Polyanichko, V. Andrushchenko, P. Bouř, and
50. J. Chalmers and P. Griffiths, Handbook of Vibrational
H. Wieser, in: Circular Dichroism: Theory and Spectros-
Spectroscopy (Wiley, Chichester, 2002).
Study of DNA Structure in Films by Means of FTIR Spectroscopy
S.V. Paston*, A.M. Polyanichko*, O.V. Shulenina**, and D.N. Osinnikova*
*Faculty of Physics, St. Petersburg State University, Ulyanovskaya ul. 1, Stariy Petergof, St. Petersburg 198504 Russia
**Petersburg Nuclear Physics Institute named by B.P. Konstantinov, National Research Center «Kurchatov Institute»,
mkr. Orlova Roshcha 1, Gatchina, Leningrad Region, 188300 Russia
The aqueous environment and ionic surrounding are the most important factors determining the conforma-
tion of DNA and its functioning in the cell. The specificity of the interaction between DNA and cations is
especially pronounced with a decrease in water activity. In this work, we studied the B-A transition in high
molecular weight DNA with a decrease of humidity in the film with different contents of Na+ ions using
FTIR spectroscopy. The IR spectrum of DNA is not only very sensitive to the state of its secondary structure,
but also allows us to estimate the amount of water bound to DNA. Upon dehydration of the DNA film,
changes characteristic of the B-A transition were observed in the IR absorption spectrum. Using thermograv-
imetric analysis, it was shown that the degree of DNA hydration reaches the saturation level at a relative hu-
midity of 60% and decreases slightly upon further drying. It has been established that with increasing Na+
concentration, the amount of water strongly bound to DNA decreases. Along with it, sodium ions destroy the
hydration shell of DNA and are able to interact directly with phosphate groups.
Keywords: DNA, hydration, secondary structure, B-A transition, FTIR spectroscopy, thermogravimetric analysis
БИОФИЗИКА том 65
№ 6
2020