БИОФИЗИКА, 2020, том 65, № 6, с. 1072-1080
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ЭЛЕКТРОСТАТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ГЛОБИНОВ
С ФОСФОЛИПИДНЫМИ МЕМБРАНАМИ
© 2020 г. Г.Б. Постникова, Е.А. Шеховцова, В.С. Сивожелезов
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, Институтская ул., 3
E-mail: gb_post@icb.psn.ru
Поступила в редакцию 27.11.2019 г.
После доработки 19.02.2020 г.
Принята к публикации 22.09.2020 г.
Проанализирована роль электростатических взаимодействий в стабилизации нативной конформа-
ции гемовой полости в структуре миоглобина кашалота (swMb) и лошади (hhMb), гемоглобина I
(HbI) овода Gasterophilus intestinalis (giHbI)и мономерных и димерных гемоглобинов HbI и HbII мол-
люска Lucina pectinata (lpHbI и lpHbII), а также возможной ее дестабилизации при взаимодействии
с отрицательно заряженными фосфолипидными мембранами. Показано, что нативная конформа-
ция гемовой полости в этих глобинах, как в проксимальной, так и в дистальной ее части, поддержи-
вается системой водородных связей с участием проксимального и дистального белковых остатков,
обеих пропионовокислых групп гема и близких к ним на поверхности белка полярных аминокислот
(His, Arg, Lys). Сеть водородных связей в проксимальной части гемовой полости контролирует по-
ложение атома Fe вне или в плоскости протопорфирина, которое влияет на эффективность связы-
вания лиганда, в то время как в дистальной части гемовой полости сеть водородных связей, образо-
ванная с участием дистального остатка белка (HisE7 в swMb, hhMb и giHbI, и GlnE7 в lpHbII), оче-
видно, должна стабилизировать такую его конформацию, в которой тот способен донировать
водород лиганду O2. Водородная связь дистального остатка E7 с лигандом O2 препятствует его быст-
рой диссоциации и играет важнейшую роль в регуляции сродства к лиганду. Найденные сети водо-
родных связей в проксимальной и в особенности дистальной части гемовой полости, должны нару-
шаться при связывании оксиглобина с мембранной поверхностью из-за контакта отрицательно за-
ряженных головок фосфолипидов с экспонированными в сторону мембраны лизинами или
аргининами белка, измененного локального pH вблизи мембраны и эффекта отрицательного элек-
тростатического поля мембраны, приводя к уменьшению сродства белка к лиганду O2 и облегчая его
отщепление при физиологических значениях pO2 в клетке.
Ключевые слова: глобины, фосфолипидная мембрана, пространственная структура, электростатиче-
ские взаимодействия, водородные связи.
DOI: 10.31857/S0006302920060058
Глобины относятся к древнему семейству ды-
высокогомологичные пространственные струк-
туры, которые включают, как правило, восемь α-
хательных глобулярных белков млекопитающих,
спиральных фрагментов, обозначаемых ла-
моллюсков, членистоногих и насекомых, просте-
тинcкими буквами от A до H, а также межспи-
тическая группа которых представлена железо-
ральные участки AB, BC, CD и т.д. Гемовая груп-
порфириновым комплексом - гемом. Они спо-
па, протопорфирин IX, локализована в гидро-
собны обратимо связывать газообразные лиган-
фобном «кармане» между E- и F-спиралями и
ды, O2, CO и NO, обеспечивая протекание
ориентирована таким образом, что оба пропио-
окислительных и других процессов в тканях. Не-
новокислых остатка гема направлены в раствори-
смотря на значительные различия в аминокис-
тель.
лотных последовательностях, все глобины имеют
Гемовая группа связана с белком нековалент-
но через ван-дер-ваальсовы или π-π-контакты
Сокращения: Mb - миоглобин; MbO2 - оксимиоглобин;
Hb - гемоглобин; swMb - миоглобин кашалота; hhMb - между π-электронной системой протопорфирина
миоглобин лошади; giHbI - гемоглобин личинок овода и боковыми группами белка в гемовой полости,
Gastrophilus intestinalis; lpHbI - гемоглобин I моллюска Lu-
через аксиальную координацию гемового железа
cina pectinata; lpHbII - гемоглобин II моллюска Lucina
pectinata.
с белковыми лигандами и, наконец, через водо-
1072
ЭЛЕКТРОСТАТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ГЛОБИНОВ
1073
родные (и ионные или солевые) связи между A- и
В результате взаимодействия миоглобина с
D-пропионатами гема и ближайшими заряжен-
фосфолипидной мембраной имеет место измене-
ными поверхностными остатками белка. Эти вза-
ние конформации белка, в первую очередь натив-
имодействия позволяют белку «узнавать» гемо-
ной конформации гемовой полости, без заметно-
вую группу. Из двух аксиальных лигандов атома
го изменения третичной структуры, что приводит
железа гема только пятый лиганд - проксималь-
к уменьшению сродства миоглобина к лиганду и
ный гистидин принадлежит белку, а шестое коор-
облегчает отщепление кислорода от MbO2 при
динационное место либо, как правило, свободно
физиологических значениях pO2 в клетке [8-10].
(дезокси-форма глобина), либо занято молекулой
Полученные результаты хорошо согласуются с
O2 или другим внешним лигандом.
выводом, сделанным ранее из детального изуче-
ния функциональных свойств и пространствен-
Со времен Хилла и Милликана [1, 2] счита-
ных структур миоглобинов млекопитающих и
лось, что по аналогии с гемоглобином крови мио-
глобинов из других организмов, что электроста-
глобин (Mb) функционирует в соответствии с его
тическая стабилизация является общим механиз-
кривой оксигенации в растворе, т. е. дезоксигена-
мом контроля лигандного связывания [11].
ция оксимиоглобина (MbO2) в мышечной клетке
Все вышеупомянутые исследования проводи-
должна происходить при снижении парциально-
лись с использованием миоглобина кашалота и
го давления O2 (pO2) в среде до рO2 < 3 мм рт. ст.
его модифицированных производных и митохон-
и при этом не требуется какого-либо взаимодей-
дрий из печени крысы с сукцинатом в качестве
ствия MbO2 с клеточными органеллами или мета-
дыхательного субстрата. Позднее была изучена
болитами. Мы впервые показали [3-5], что, во-
дезоксигенация в присутствии митохондрий из
преки давно сформированным и вошедшим в
сердца голубя (с глутаматом и малатом в качестве
учебники представлениям, для отщепления кис-
дыхательных субстратов) шести других оксигло-
лорода от оксимиоглобина (MbO2) необходимо
бинов, миоглобина лошади и моллюска Busycon,
не только снижение pО2 в клетке, но и активное
мономерного леггемоглобина сои, мономерных и
взаимодействие его с дышащими митохондрия-
димерных гемоглобинов (Hb) I и II моллюска Lu-
ми. Если же митохондрии отделены от раствора
cina pectinata, а также димерного HbI насекомого
белка полупроницаемой мембраной, то даже при
Gasterophilus intestinalis, которые в десятки и сотни
близком к нулю значении pO2 никакой дезок-
раз различаются по кинетическим и равновесным
параметрам их реакции с O2 в растворе [12]. Одна-
сигенации MbO2 не происходит. При этом для
ко в присутствии митохондрий во всех случаях
разных состояний митохондрий (нативные со-
регистрировалась одинаковая скорость дезокси-
пряженные, свежезамороженные и разобщенные
генации оксиглобина, которая также соответ-
реагентом FCCP (n-трифторометоксикарбонил-
ствовала, как и для MbO2 кашалота, скорости ды-
цианидфенилгидразоном) митохондрии) ско-
рость дезоксигенации MbO2 полностью совпада-
хания митохондрий, что свидетельствует в пользу
взаимодействия всех изученных глобинов с мито-
ет со скоростью потребления митохондриями O2
хондриями, хотя авторы работы [12] это отрица-
из раствора, т. е. полностью определяется интен-
ли.
сивностью их дыхания.
В данной работе проанализирована роль элек-
Проведенное нами изучение механизма мио-
тростатических взаимодействий в стабилизации
глобин-митохондриального взаимодействия с
нативной конформации гемовой полости и воз-
привлечением различных физико-химических
можной ее дестабилизации при взаимодействии с
методов, использованием природных митохон-
отрицательно заряженными фосфолипидными
дриальных и искусственных нейтральных и отри-
мембранами в структурах миоглобинов кашалота
цательно заряженных бислойных фосфолипид-
(swMb) и лошади (hhMb), димерного Hb Gaster-
ных мембран показало, что на внешней мембране
ophilus intestinalis (giHbI) и мономерных и димер-
митохондрий белки, специфичные к миоглоби-
ных HbI и HbII моллюска Lucina pectinata (lpHbI и
ну, отсутствуют, а MbO2 неспецифически связы-
lpHbII)
вается с мембранными фосфолипидами [6, 7].
Найдено также, что основной вклад в это взаимо-
МАТЕРИАЛЫ И МЕТОДЫ
действие вносят кулоновские электростатиче-
ские взаимодействия локального характера, в ко-
Координаты атомов пространственных струк-
торых с анионными группами (головками) отри-
тур Mb кашалота (код структуры 1А6М, окси-
цательно заряженных фосфолипидов наиболее
форма), Mb лошади (код структуры 5D5R, дезок-
вероятно взаимодействуют положительно заря-
си-форма), HbI личинок паразитирующего овода
женные остатки в окружении гемовой полости.
Gasterophilus intestinalis (код структуры 2C0K, ок-
БИОФИЗИКА том 65
№ 6
2020
1074
ПОСТНИКОВА и др.
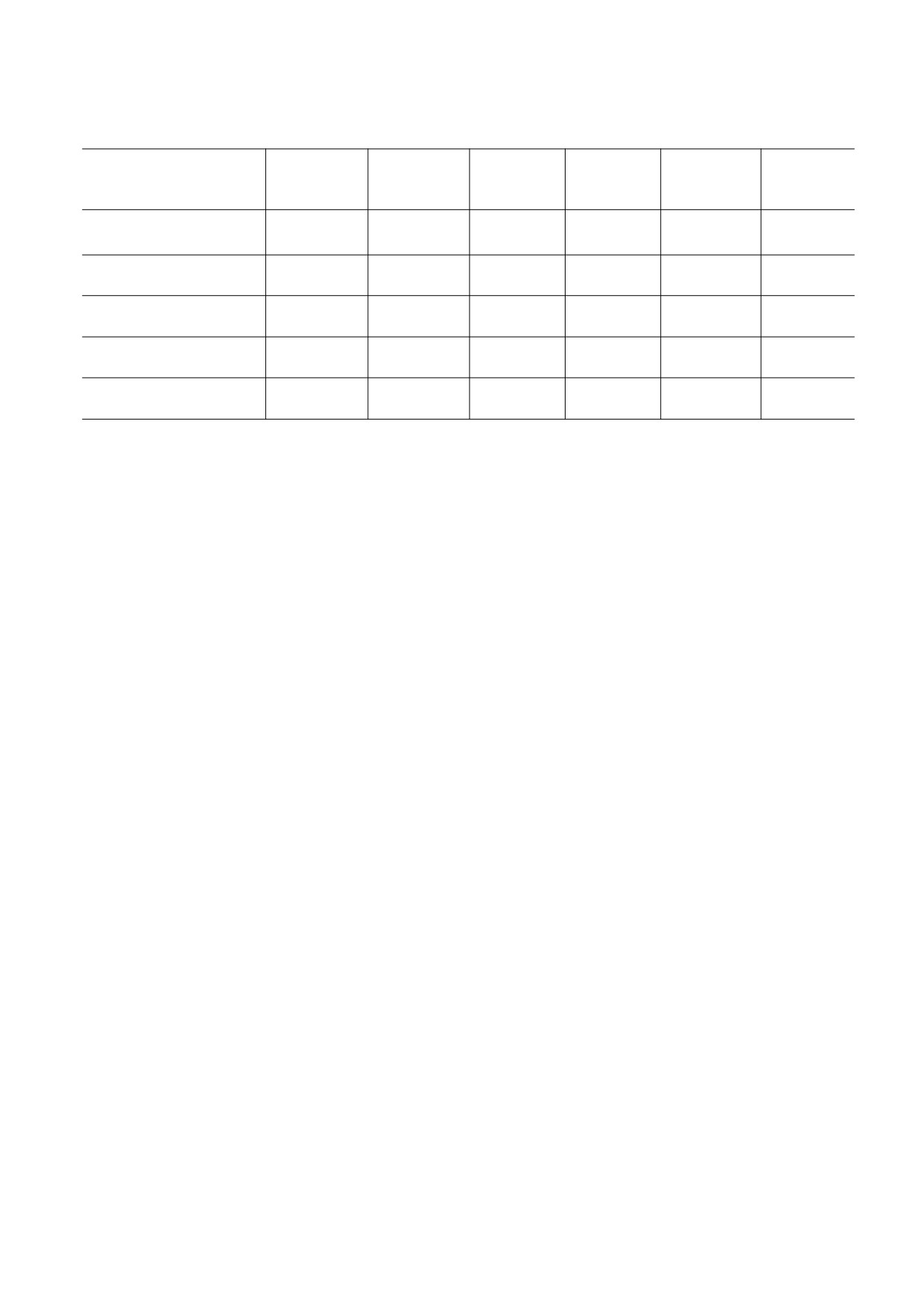
Таблица 1. Параметры реакции мономерных и димерных миоглобинов и гемоглобинов с кислородом (рН 7.0-7.5,
20-25°С)
K = kon/koff,
р50,
kon ⋅ 10-6,
Белок
koff, с-1
Т, °С
Cсылка
М-1 с-1
М-1
мм рт. ст.
0.33-0.51
20
[12]
Mb кашалота
19
10
1.9
0.9
25
[18]
[12]
Mb лошади
14
11
1.3
0.43-0.65
20
[18]
Hb Gasterophilus intestinalis
10
2.4
4.2
0.15
25
[22]
HbI Lucina pectinata
100
61
1.6
0.34
20
[23]
HbII Lucina pectinata
0.39
0.11
3.5
0.16
20
[23]
си-форма), HbI моллюска Lucina pectinata (код
terophilus intestinalis и мономерных и димерных ге-
структуры 1MOH, H2S-форма) и HbII моллюска
моглобинов HbI и HbII моллюска Lucina pectinata,
Lucina pectinata (код структуры 2OLP, лиганд О2)
а также возможной ее дестабилизации при взаи-
модействии с отрицательно заряженными фос-
взяты из Банка белковых данных и визуализиро-
фолипидными мембранами.
ваны в программе MolMol. Расстояния между
атомами указаны в ангстремах.
Миоглобин кашалота (153 аминокислотных
остатка, 17.8 кДа) - мономерный глобин, содер-
Конформационный анализ аминокислот в
жащий пентакоординированный атом железа ге-
окружении гема проводили путем сплошного пе-
ма c His93(F8) в качестве проксимального лиган-
ребора конформаций соответствующих амино-
да. Благодаря тому, что миоглобин может быть
кислот с шагом 10 градусов по каждому из дву-
получен в больших количествах и легко кристал-
гранных углов, с оптимизацией ван-дер-ваальсо-
лизуется, он был первым белком, пространствен-
вых конфликтов, электростатических (по
ная структура которого была расшифрована с
Эвальду) и водородных связей, согласно методи-
атомным разрешением [14]. Миоглобин кашало-
ке, описанной в работе [13]. Учитывали взаимо-
та обладает очень высоким сродством к кислоро-
действия исследуемых аминокислот со всеми ато-
ду, мерой которого значение рO2, при котором
мами миоглобина, включая гемовую область. На
дезокси-Mb(2) оксигенирован наполовину (р50).
рис. 1-3 представлены структуры, оптимальные
по указанным критериям.
Для него характерны высокая скорость ассоциа-
ции О2 (kon), низкая скорость диссоциации его из
комплекса (koff ) и соответственно низкие значе-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ния p50 (табл. 1).
Как отмечалось выше, ранее все исследования
Свободный комплекс феррогема с O2 в раство-
проводили на миоглобине кашалота и его моди-
фицированных производных c митохондриями
ре нестабилен и очень быстро окисляется до фер-
из печени крысы с сукцинатом в качестве дыха-
ригема, в то время как автоокисление нативного
тельного субстрата. Позднее была изучена дезок-
MbO2 кашалота до окисленной мет-формы пред-
сигенация других мономерных и димерных окси-
ставляет собой медленный процесс, который за-
глобинов, в десятки и сотни раз различающихся
нимает несколько суток при рН 7.2 и комнатной
по кинетическим и равновесным параметрам их
температуре, заметно ускоряясь при низких рН и
реакции с O2 в растворе. Однако в присутствии
повышении температуры [15, 16]:
митохондрий регистрировалась одинаковая ско-
kox
рость дезоксигенации всех оксиглобинов, соот-
Mb(2)O2 + O2 + 2H+ → Mb(3)H2O + O2 .
(1)
ветствующая скорости дыхания митохондрий.
В данной работе проанализирована роль элек-
Показано, что причина высокой стабильности
тростатических взаимодействий в стабилизации
O2-комплекса в MbO2 (и в оксигемоглобине) жи-
нативной конформации гемовой полости в
вотных заключается в гидрофобном характере
структуре Mb кашалота и лошади, HbI овода Gas-
окружения гемовой группы в белке, а также в на-
БИОФИЗИКА том 65
№ 6
2020
ЭЛЕКТРОСТАТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ГЛОБИНОВ
1075
личии водородной связи между лигандом O2 и
инвариантным дистальным His64(E7) в гемовой
полости, которая играет важнейшую роль в регу-
ляции сродства к кислороду, препятствуя его
быстрой диссоциации [17]. Замена His64(E7) не-
полярными аминокислотными остатками, не-
способными к Н-связыванию с лигандным O2,
приводит к значительному снижению сродства к
O2, главным образом, из-за увеличения koff [15].
Показано также, что заметный вклад в стаби-
лизацию нативной конформации гемовой поло-
сти MbO2 вносят электростатические взаимодей-
ствия между пропионовокислыми остатками ге-
ма, A- и D-пропионатами, и близко рас-
положенными положительно заряженными груп-
пами (Lys, Arg) белка. Электростатические взаи-
модействия между гем-D-пропионатом и
Arg45(CD3), который в свою очередь образует
Рис. 1. Окружение гемовой группы миоглобина каша-
лота. Показаны водородные связи и их длина в Å. Ами-
Н-связь c дистальным HisE7, стабилизируют по-
нокислоты надписаны при атомах Cα, гемовые A- и
зицию дистального гистидина, в которой он спо-
D-пропионаты - при атомах первого карбоксильного
кислорода O1A и O1D. Черные шарики - атомы кисло-
собен донировать водород лиганду O2. Потеря
рода, серые шарики - атомы азота, белые шарики -
положительного заряда в позиции 45, а тем более
атомы углерода.
добавление туда отрицательного заряда нарушает
нативную конфигурацию этой области, увеличи-
вая доступность дистального кармана белка рас-
Mиоглобин из сердца лошади (153 аминокис-
творителю [15].
лотных остатка, 17.8 кДа) по своей структуре и
свойствам очень близок к Mb кашалота [20]. На-
В данной работе проанализировано участие
блюдается высокая степень гомологии аминокис-
заряженных остатков Arg и Lys в окружении гема
лотных последовательностей обоих белков, осо-
в СD-, D-, E- и FG-фрагментах структуры MbO2
бенно среди аминокислотных остатков, форми-
кашалота (использовали аминокислотные остат-
рующих гемовый карман, где имеются всего две
ки с 40 по 100), а также гемпропионатов в образо-
замены - Lys45(CD3) и Val67(E10) в миоглобине
вании ионных и водородных связей, стабилизи-
лошади вместо Arg45(CD3) и Thr67(E10) в мио-
рующих нативную конформацию гемовой поло-
глобине кашалота. Пентакоординированный
сти. Найдено, что с проксимальной стороны гема
атом железа гема в hhMb также содержит прокси-
A-пропионат образует
«солевой мостик» с
мальный His93(F8) и имеется дистальный
His97(FG3), который в свою очередь участвует в
His64(E7), способный образовать Н-связь со свя-
сети H-связей, включающей проксимальный
занной молекулой кислорода. Замена Arg45(CD3)
His93(F8), Ser92(F7), Leu89(F4), Lys96(FG2) и
на Lys45(CD3) в миоглобине лошади лишь незна-
Lys98(FG4) (рис. 1, табл. 2). Очевидно, что эта
чительно влияет на кислородсвязывающие свой-
разветвленная сеть водородных связей с участием
ства белка (табл. 1) и скорость его автоокисления,
A-пропионата способствует нахождению прокси-
так что эта естественная мутация рассматривает-
мального His93(F8) в безлигандном дезоксиMb в
ся как нейтральная [15].
конформации, аналогичной T-форме гемоглоби-
на с низким сродством к лиганду [18].
C проксимальной стороны гема сетка из Н-свя-
зей в hhMb образована, как и в Mb кашалота, гем-
В дистальной части гемовой полости также об-
A-пропионатом, His97(FG3), Ser92(F7), прокси-
наруживается сетка водородных связей, образо-
мальным His93(F8), Lys96(FG2), Lys98(FG4) и
ванная главным образом гем-D-пропионатом,
Leu89(F4), и стабилизирует нативную конформа-
Arg45(CD3), Asp60(E3) и дистальным His64(E7)
цию этой области молекулы (табл. 2). В дисталь-
(рис. 1, табл. 2). Водородная связь между N-дель-
ной части гемовой полости имеются определен-
та карбонильным кислородом Asp60(E3) и
ные отличия сетки водородных связей в hhMb от
His64(E7) и должна блокировать вращение ди-
Mb кашалота (табл. 2). Наряду с Н-связью гем-D-
стального His64(E7) вокруг Сα-Сβ-связи и стаби-
пропионата с Lys45(CD3), обнаруживается водо-
лизировать «закрытую» конформацию этого ги-
родная связь дистального His64(E7) c пептидной
стидина, донирующего водород лиганду O2 [19].
NH-группой Val68(E11), а также связь Asp60(E3) с
БИОФИЗИКА том 65
№ 6
2020
1076
ПОСТНИКОВА и др.
Таблица 2. Сеть водородных связей в окружении гемовой группы глобинов
Проксимальная сторона
Расстояние, Å
Дистальная сторона
Расстояние, Å
Миоглобин кашалота, мономер, окси-форма
Проп.А - (N)His97(FG3)
2.73
(N)His64(E7) - O2-лиганд
2.97
(N)His93(F8) - (O)Ser92(F7)
2.96
Проп.D - (N)Arg45(CD3)
2.84
(N)His93(F8) - (CO)Leu89(F4)
2.94
(N)Arg45(CD3) - Asp60(E3)
2.73
(NH)Lys96(FG2) - (CO)Ser92(F7)
2.94
(N)Arg45(CD3) - Asp60(E3)
2.95
(NH)Lys98(FG4)-(CO)His97(FG3)
2.26
(NH)His64(E7) - Asp60(E3)
2.99
Миоглобин лошади, мономер, дезокси-форма
Проп.А - (N) His97(FG3)
2.80
Проп.D - (N)Lys45(CD3)
2.97
(N) His93(F8) - (O) Ser92(F7)
2.87
(NH) Lys62(E5) - (CO)Asp60(E3)
3.55
(NH)Lys96(FG2) - (CO)Ser92(F4)
2.93
(NH)Lys63(E6) - (CO)Asp60(E3)
3.30
(NH)Lys98 (FG4)-(CO)His97(FG3)
2.25
(CO)His64(E7) - (NH)Val68(E11)
2.77
(NH)Ser92 (F4) - (CO)Leu89(F4)
3.38
Гемоглобин овода Gasterophilus intestinalis, димер, цепь А, окси-форма
(N)His62(E7) - O2-лиганд
Проп.А - (N)Arg65(E10)
2.91
2.88
(N)Lys92(F3) - (O)Gln69(E14)
3.54
Проп.D - (N1)Arg58(E3)
3.50
Проп.D - (N2)Arg58(E3)
3.38
(NH)His62(E7) - (CO)Arg58(E3)
3.12
(NH)Gln69(E14) - (CO)Ile66(E11)
3.43
Гемоглобин Lucina pectinata I, мономер, H2S-форма
Проп.А - (N)Arg99(F18)
2.91
(O)Gln64(E7) - H2S-лиганд
3.34
(CO)His96(F15)-(NH)Arg99(F18)
2.94
Проп.D - (N)Gln64(E7)
3.84
Проп.D - (N)Arg99(F18)
6.11
(CO)Gln64(E7) - (NH)Ser67(E10)
3.26
Гемоглобин Lucina pectinata II, димер, цепь А, окси-форма
Проп.А - (N)Arg100(F18)
2.71
(N)Gln65(E7) - O2-лиганд
3.43
(N)His97(F15) - (CO)Met93(F11)
2.89
(O)Tyr30(B10) - O2-лиганд
1.94
(NH)His97(F15)-(CO)Met93(F11)
3.12
Проп.D - (N)Lys92(F10)(цепь В)
2.63
(СO)His97(F15)-(NH)Arg100(F18)
2.99
(O)Gln65(E7)-(N)Lys92(F10)(ц. В)
2.73
Проп.D - (N)Lys95(F13)(цепь В)
4.72
Примечание. Используемые сокращения: (N) - азот функциональной группы аминокислотного остатка, (О) - кислород
функциональной группы аминокислотного остатка, (NH) - азот пептидной группы аминокислотного остатка, (CO) -
кислород пептидной группы аминокислотного остатка.
БИОФИЗИКА том 65
№ 6
2020
ЭЛЕКТРОСТАТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ГЛОБИНОВ
1077
соседними Lys62(E5) и Lys63(E6). Отсутствует
H-связь с лигандным кислородом, так как взята
структура безлигандного белка.
Очень важную роль в сохранении нативной
конформации дистальной части гемовой полости
в миоглобинах играют электростатические взаи-
модействия между гем-D-пропионатом и
Arg(Lys)45 в положении CD3. Замена Lys45 в
MbO2 свиньи на небольшой и незаряженный Ser
приводит к увеличению равновесной константы
диссоциации O2 (Kdis) мутантного белка в 1.7 раза
и скорости его автоокисления (kox) - в 6 раз, а при
замещении Lys45 на Glu наблюдалось увеличение
Kdis в 2.5 раза и почти двадцатикратное увеличе-
ние kox [15]. Прямая корреляция между kox и Kdis
связана с тем, что оба процесса «запускаются»
разрывом Н-связи дистального HisE7 с лигандом
О2 [15, 16].
Рис. 2. Окружение гемовой группы гемоглобина овода
На примере лошадиного Mb изучено также
Gasterophilus intestinalis. Показаны водородные связи и
влияние водородного связывания с участием про-
их длина в Å. Аминокислоты надписаны при атомах Cα,
гемовые A- и D-пропионаты
- при атомах
пионовокислых групп гема и поверхностных
первого карбоксильного кислорода O1A и O1D. Черные
аминокислотных остатков на динамику гем-бел-
шарики - атомы кислорода, серые шарики - атомы
кового взаимодействия
[21]. При замене
азота, белые шарики - атомы углерода.
Ser92(F7) на Asp или His97(FG3) на Leu, а
Lys45(CD3) на Glu константа скорости диссоциа-
ние koff отражает более высокую, чем в swMb, сте-
ции гема из миоглобина увеличивалась в три-
пять раз (при pH 7.0). При этерификации же обо-
пень стабилизации связанного лиганда со сторо-
их пропионатов она возрастает в 20 раз [21].
ны дистального His62(E7).
Гемоглобин личинок паразитирующего овода
Поверхность giHbI богата заряженными ами-
нокислотными остатками. C проксимальной сто-
Gasterophilus intestinalis, живущих в желудке лоша-
ди, содержит несколько изоформ белка, присут-
роны гема имеется лишь водородная связь А-про-
пионата с Arg65(E10), а с дистальной - гораздо
ствующих в трахейных дыхательных клетках
в миллимолярной концентрации. Гемоглобин
более разветвленная система H-связей с участием
D-пропионата (рис. 2, табл. 2).
giHbI представляет собой гомодимер (151 амино-
кислотный остаток в одной цепи, 37 кДа), субъ-
Гемоглобин, обнаруженный в жабрах дву-
единицы которого контактируют между собой в
створчатого моллюска Lucina pectinata, заселяю-
области G- и H-спиралей таким образом, что ге-
щего богатый сероводородом тропический ил,
мовые группы ориентированы в разные стороны
содержит в высокой концентрации три различ-
[22]. Контактная поверхность содержит несколь-
ных белка: сульфид-реактивный мономерный
ко полярных контактов, т. е. ассоциация димера
lpHbI (142 аминокислотных остатка, 14.9 кДа),
основана на электростатических взаимодей-
способный также связывать кислород, и транс-
ствиях.
портирующие кислород димерные lpHbII и
lpHbIII (35 кДа), состоящие из разных мономеров
По аминокислотной последовательности
A и B (151 и 152 аминокислотных остатка соответ-
giHbI имеет только 21% гомологии с swMb, одна-
ственно). Все они способствуют потоку H2S и O2
ко их пространственные структуры близки: прок-
из окружающей морской воды к внутриклеточ-
симальный остаток гема представлен His97(F8),
ным H2S-окисляющим симбионтам. Оксигени-
дистальный остаток - His62(E7), лигандная мо-
лекула O2 стабилизируется H-связью с His E7
рованный lpHbI реагирует с H2S, образуя ферри-
(3.1 Å и 2.6 Å для субъединиц A и B соответствен-
lpHbI-сульфид, а окси-lpHbII остается оксигени-
но). Константа скорости ассоциации кислорода
рован в присутствии сероводорода [23].
kon cоответствует величине, характерной для
Первичные последовательности lpHbII и
swMb, а константа скорости диссоциации koff в
lpHbIII очень близки, но значительно отличают-
четыре раза меньше и, соответственно, сродство
ся от AK-состава lpHbI. Пространственная струк-
giHbI существенно выше (табл. 1). Низкое значе-
тура мономерного lpHbI и димерного lpHbII со-
БИОФИЗИКА том 65
№ 6
2020
1078
ПОСТНИКОВА и др.
В структуре димерного lpHbII, в отличие от
lpHbI, присутствуют разветвленные сетки H-свя-
зей в проксимальной и дистальной областях ге-
мовой полости (рис. 3). В их образовании актив-
ное участие принимают проксимальный
His97(F15), А-пропионат и Arg100(F11), а в ди-
стальной области гема - соответственно D-про-
пионат, дистальный Gln65(E7) и Lys92(F10) со-
седней субъединицы.
ЗАКЛЮЧЕНИЕ
Хорошо известно, что даже небольшие изме-
нения структуры гемовой полости в разных гло-
бинах при высокой степени гомологии их третич-
Рис. 3. Окружение гемовой группы гемоглобина II
моллюска Lucina pectinata. Показаны водородные связи
ных структур приводят к существенным различи-
и их длина в Å. Аминокислоты надписаны при
ям (в десятки и сотни раз) кинетических и
атомах Cα, гемовые A- и D-пропионаты - при атомах
первого карбоксильного кислорода O1A и O1D. Черные
равновесных параметров связывания лиганда
шарики - атомы кислорода, серые шарики - атомы
[18]. В данной работе показано, что нативная
азота, белые шарики - атомы углерода.
конформация гемовой полости в глобинах жи-
вотных, swMb и hhMb, насекомого, giHbI, и мол-
люска, lpHbI и lpHbII, как проксимальной, так и
стоит из шести α-спиралей (A, B, E, F, G и H),
дистальной ее части, поддерживается системой
окружающих гемовый карман, и двух минорных
водородных связей с участием проксимального и
спиральных фрагментов между B и E спиралям
дистального белковых лигандов, обеих пропио-
[23, 24]. В димерном lpHbII пропионатные груп-
новокислых групп гема, а также близко располо-
пы гемовых групп субъединиц A и B направлены
женных к ним на поверхности белка положитель-
в сторону контактной площадки. Оба белка со-
но заряженных аминокислот (His, Arg, Lys).
держат атом Fe в плоскости гема, более длинную
Обычно в структурно-функциональных исследо-
F-спираль (18 аминокислотных остатков), прок-
ваниях гемовой полости глобинов главная роль
симальный His96 или His97(F15) и консерватив-
отводится методу молекулярной динамики. Од-
ный дистальный глутамин в положении E7,
нако сети водородных связей, подобные обнару-
Gln64(E7) в lpHbI и Gln65(E7) в lpHbII).
женным нами в настоящей работе, плохо воспро-
Для мономерного lpHbI значения kon и koff на
изводятся этим методом из-за значительного
вклада квантовых эффектов в их образование, в
порядок выше, чем у Mb кашалота, однако равно-
частности, обобществления протона между доно-
весная константа ассоциации и значения p50
ром и акцептором. Поэтому для уточнения про-
близки (табл. 1). Для димерного lpHbII значения
странственной структуры окружения гема вместо
kon и koff существенно ниже, и значительно выше
метода молекулярной динамики был использован
его сродство к лиганду O2, такое же, как у giHb1
сплошной перебор конформаций боковых групп
овода (табл. 1), что отражает, очевидно, разную
аминокислот гемового окружения и пропионатов
степень стабилизации кислородного комплекса в
гема.
lpHbI и lpHbII. Действительно, лигандный O2
Сеть водородных связей в проксимальной ча-
тесно связан в дистальном гемовом сайте lpHbII
сти гемовой полости контролирует положение
через водородные связи с двумя аминокислотны-
атома Fe вне или в плоскости протопорфирина,
ми остатками, Gln65(E7) и Tyr30(B10) (рис. 3), а в
которое влияет на эффективность связывания
lpHbI вместо Tyr30(B10) присутствует Phe29(B10),
лиганда, в то время как сеть водородных связей в
неспособный донировать водород лиганду O2
дистальной части гемовой полости, образованная
(табл. 2).
с участием дистального остатка белка (HisE7
в swMb, hhMb и giHbI, и GlnE7 в lpHbII), очевид-
В проксимальной части гемовой полости
но, должна стабилизировать его конформацию,
lpHbI, позиции А-пропионата и проксимального
в которой он способен донировать водород ли-
His96(F15) стабилизируются водородными связя-
ганду O2.
ми с Arg99(F18), а в дистальной области гема ди-
стальный Gln64(E7) связан водородными связя-
С помощью рамановской спектроскопии было
ми с D-пропионатом и Ser67(E10). В направлении
изучено соотношение молекул swMb с «закры-
D-пропионата ориентирован также один из ато-
тым» и «открытым» дистальным гемовым карма-
мов азота Arg99(F18) (табл. 2).
ном в результате вращения дистального
БИОФИЗИКА том 65
№ 6
2020
ЭЛЕКТРОСТАТИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ ГЛОБИНОВ
1079
His64(E7) вокруг Сα-Сβ-связи как функции рН
КОНФЛИКТ ИНТЕРЕСОВ
[19]. Значительный рост скорости диссоциации
Авторы заявляют об отсутствии конфликта
лиганда для открытой формы обусловлен потерей
интересов.
H-связи с дистальным His64(E7), который стаби-
лизирует связанный O2 в закрытом состоянии.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Энергия стабилизации водородной связи состав-
Настоящая работа не содержит описания ис-
ляет ~ 4(±3) ккал/моль. Отмечается, что рост «от-
следований с использованием людей и животных
крытой» популяции миоглобина в результате
в качестве объектов.
протонирования дистального гистидина или вза-
имодействия с другими метаболическими агента-
ми в клеточной области, где локальная кислот-
СПИСОК ЛИТЕРАТУРЫ
ность и метаболизм выше, а кислород быстро
1.
R. L. Hill, Nature 132, 897 (1933).
истощается, может рассматриваться как потен-
2.
G. A. Millikan, Physiol. Rev. 19, 503 (1939).
циально важный бимолекулярный механизм для
3.
G. B. Postnikova and S. V. Tselikova, Biophysics (Mos-
контроля за связыванием и отщеплением кисло-
cow) 50, 284 (2005).
рода в мышечной клетке.
4.
G. B. Postnikova, S. V. Tselikova, and E. A. Shek-
hovtsova, Biochemistry (Moscow) 74, 1211 (2009).
Подобная ситуация реализуется, по-видимо-
5.
G. B. Postnikova and E. A. Shekhovtsova, J. Phys.
му, при взаимодействии глобина с митоходриями
Chem. Biophys. 3, 126 (2013).
в условиях гипоксии. Найденные в настоящей ра-
6.
G. B. Postnikova and E. A. Shekhovtsova, Biochemis-
боте сети водородных связей в проксимальной и в
try (Moscow) 77, 280 (2012).
особенности дистальной части гемовой полости
7.
P. A. Grigoriev, G. B. Postnikova, and E. A. Shek-
могут нарушаться под влиянием отрицательно за-
hovtsova, Biophysics (Moscow) 57, 55 (2012).
ряженной фосфолипидной мембраны. Механиз-
8.
G. B. Postnikova and E. A. Shekhovtsova, Biochemis-
мы такого влияния могут включать контакты от-
try (Moscow) 83, 168 (2018).
рицательно заряженных головок фосфолипидов с
9.
G. B. Postnikova and E. A. Shekhovtsova, Am. J. Biol.
экспонированными в сторону мембраны лизи-
Chem, 3, 16 (2015).
нами или аргининами белка, измененный ло-
10.
G. B. Postnikova and E. A. Shekhovtsova, Physiol. Sci.
1, 1 (2014).
кальный pH вблизи мембраны и даже более даль-
нодействующий эффект отрицательного элек-
11.
S. Kundu and M. S. Hargrove, Proteins: structure,
function, and genetics 50, 239 (2003).
тростатического поля мембраны. Все эти
12.
J. B. Wittenberg and B. A. Wittenberg, J. Experim. Bi-
взаимозависимые факторы могут приводить к
ol, 210, 2082 (2007).
существенному изменению сродства белка к ли-
13.
M. U. Johansson, V. Zoete, O. Michielin, and
ганду O2.
N. Guex, BMC bioinformatics 13, 173 (2012).
14.
J. C. Kendrew, R. T. Dickerson, B. E. Strandberg,
В отличие от тетрамерного Hb крови, cродство
et al., Nature (Lond.) 185, 422 (1960).
которого к О2 регулируется как самим лигандом,
15.
R. E. Brantley, S. J. Smerdon, A. J. Wilkinson, et al., J.
так и аллостерическими эффекторами - дифос-
Biol. Chem. 268, 6995 (1993).
фоглицератом, протонами и СО2, обеспечивая
16.
K. Shikama, Chem. Rev. 98, 1357 (1998).
необходимую скорость доставки O2 с кровью, для
17.
J. S. Olson, A. J. Mathews, R. J. Rohlfs, et al., Nature
336 (6196), 265 (1988).
миоглобина были неизвестны какие-либо низко-
18.
E. Antonini and M. Brunori, Hemoglobin and myoglo-
молекулярные соединения или клеточные мета-
bin in their reactions with ligands (Amsterdam-London,
болиты, способные уменьшить его сродство к ли-
1971).
ганду, т. е. сдвинуть кривую оксигенации Mb в
19. W. D. Tian, J. T. Sage, and P. M. Champion, J. Mol.
сторону более высоких значений pO2 = 10-20 мм
Biol. 233, 155 (1993).
рт. ст., реально наблюдающихся в мышечной
20. S. V. Evans and G. D. Brayer, J. Biol. Chem. 263 (9),
клетке при гипоксии. В наших исследованиях
4263 (1988).
впервые показано, что регуляция сродства Mb к
21. Ch. L. Hunter, E. Lloyd, L. D. Eltis, et al., Biochemis-
try 36, 1010 (1997).
O2, как и в случае других белков-переносчиков,
22. A. Pesce, M. Nardini, S. Dewilde, et al., Prot. Sci. 14,
осуществляется с помощью его взаимодействия с
3057 (2005).
мишенью - митохондриальной мембраной, что
23. D. W. Kraus and J. B. Wittenberg, J. Biol. Chem. 265
облегчает диссоциацию О2 в физиологических
(27), 16043 (1990).
условиях и обеспечивает поступление его с нуж-
24. J. A. Gavira, A. Camara-Artigas, W. De Jesus-Bonilla,
ной скоростью непосредственно в митохондрии.
et al., J. Biol. Chem. 283 (14), 9414 (2008).
БИОФИЗИКА том 65
№ 6
2020
1080
ПОСТНИКОВА и др.
Electrostatic Interaction of Globins with Phospholipid Membranes
G.B. Postnikova, E.A. Shekhovtsova, and V.S. Sivozhelezov
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
The present study aimed to analyze the role of electrostatic interactions contributing to the stability of the na-
tive conformations of the heme group in the structure of sperm whale myoglobin (SWMb), horse heart myo-
globin (HHMb), hemoglobin I (HbI) from the botfly Gasterophilus intestinalis (giHbI) and monomeric and
dimeric hemoglobins HbI and HbII from the mollusk Lucina pectinata (lpHbI and lpHbII) as well as inves-
tigate a possible reason of destabilization due to interaction with negatively charged phospholipid mem-
branes. It was shown that the native conformation of the heme cavity in these globins, both in its proximal
and distal sides, is sustained by a system of hydrogen bonds involving the proximal and distal protein residues,
both heme propionic acid groups and the nearby polar amino acids on the protein surface (His, Arg, Lys).
The hydrogen bond network in the proximal part of the heme pocket controls the position of the Fe atom
outside or in the protoporphyrin plane, affecting the efficiency of ligand binding, while in the distal part of
the heme cavity the hydrogen bond network formed with the participation of the distal protein residue (HisE7
in swMb, hhMb and giHbI, and GlnE7 in lpHbII) should, apparently, stabilize conformation where the pro-
tein is able to donate hydrogen to O2 ligand. The hydrogen bond between distal residue E7 and O2 ligand pre-
vents its rapid dissociation and plays an important role in the regulation of ligand affinity. The hydrogen bond
networks found in the proximal and, especially, distal heme environments should be disturbed when oxyglo-
bin binds to the membrane surface due to the contact of negatively charged phospholipid heads with the lysine
or arginine exposed to the membrane, the altered local pH near the membrane and the effect of the negative
electrostatic field of the membrane, resulting in a decrease in the affinity of the protein to O2 ligand and fa-
cilitating its dissociation at normal pO2 values of the cell.
Keywords: globins, phospholipid membrane, spatial structure, electrostatic interactions, hydrogen bonds
БИОФИЗИКА том 65
№ 6
2020