БИОФИЗИКА, 2020, том 65, № 6, с. 1081-1092
БИОФИЗИКА КЛЕТКИ
УДК 577.3’32/.’36:577.218
ХЕМОСЕНСИБИЛИЗАЦИЯ ОПУХОЛЕВЫХ КЛЕТОК ФЕНОЛЬНЫМИ
АНТИОКСИДАНТАМИ: РОЛЬ ФАКТОРА ТРАНСКРИПЦИИ Nrf2
© 2020 г. Г.Г. Мартинович*, И.В. Мартинович*, А.В. Вчерашняя*, Н.К. Зенков**,
Е.Б. Меньщикова**, С.Н. Черенкевич*
*Белорусский государственный университет, 220030, Минск, просп. Независимости, 4, Республика Беларусь
E-mail: martinovichgg@bsu.by
**Федеральный исследовательский центр фундаментальной и трансляционной медицины,
630117, Новосибирск, ул. Тимакова, 2
E-mail: lemen@centercem.ru
Поступила в редакцию 18.02.2020 г.
После доработки 18.02.2020 г.
Принята к публикации 22.05.2020 г.
Фармакологическая коррекция редокс-свойств опухолевых клеток является перспективным подхо-
дом для повышения эффективности противоопухолевой терапии. В настоящее время в качестве но-
вой мишени для разработки селективных хемосенсибилизаторов рассматривается фактор тран-
скрипции Nrf2 - ключевой участник регуляции клеточного редокс-гомеостаза при стрессовых воз-
действиях и адаптационных процессах. Многие природные и синтетические фенольные
антиоксиданты являются индукторами транскрипционной активности Nrf2. Вследствие различий в
транскрипционной активности Nrf2 в нормальных и опухолевых клетках фенольные антиоксидан-
ты при определенных концентрациях являются биологическими регуляторами с бинарным дей-
ствием: в опухолевых клетках усиливают развитие окислительного стресса и действие противоопу-
холевых препаратов, в нормальных - проявляют протекторные свойства. В обзоре обсуждаются
возможные молекулярные механизмы действия и перспективы клинического использования при-
родных и синтетических фенольных антиоксидантов в противоопухолевой терапии.
Ключевые слова: фенольные антиоксиданты, активные формы кислорода, фактор транскрипции Nrf2,
опухолевые клетки, противоопухолевая терапия, хемосенсибилизаторы.
DOI: 10.31857/S000630292006006X
факторов, но и в процессах клеточного метабо-
Поиск эффективных методов лечения и про-
лизма, фармакологическая коррекция редокс-
филактики онкологических заболеваний, не-
свойств опухолевых клеток является перспектив-
смотря на достигнутые в последние десятилетия
ным подходом для повышения эффективности
успехи, остается одной из наиболее актуальных
противоопухолевой терапии.
задач в медицине. В методах противоопухолевой
терапии (химиотерапия, фотодинамическая тера-
Ввиду высокой реакционной способности ря-
пия, радиотерапия и др.) применяются подходы,
да АФК, в частности синглетного кислорода (1О2)
основанные на индуцировании гибели клеток пу-
и гидроксильного радикала (НО•), их чрезмерное
тем повышения внутриклеточной концентрации
активных форм кислорода (АФК) - высокореак-
образование ведет к повреждению молекулярных
ционных продуктов метаболизма кислорода [1-
компонентов клетки, развитию окислительного
стресса и гибели клеток [4]. Стимуляция генера-
3]. Поскольку АФК (1О2, О2•-, НО•, ONOO-,
ции АФК используется в методах фототерапии и
Н2О2 и др.) образуются в клетках не только в ре-
лучевой терапии онкологических заболеваний. В
зультате действия внешних физико-химических
химиотерапии онкологических заболеваний ши-
роко используются препараты, усиливающие
Сокращения: АФК - активные формы кислорода, Nrf2 -
продукцию АФК клетками. В последние десяти-
транскрипционный фактор 2 семейства NFE (NF-E2-relat-
летия показано, что генерация АФК является
ed factor 2), ARE - антиоксидант-респонс(ив)ный элемент
(antioxidant respons(iv)e element), Keap1 - Kelch-подобный важным этапом в процессе индуцирования апо-
ECH-ассоциированный протеин 1 (Kelch-like ECH-associ-
птоза раковых клеток такими широко используе-
ated protein 1), Klf9 - Kruppel-подобный фактор 9 (Krup-
pel-like factor 9), ТС-13 - 3-(3'-трет-бутил-4'-гидроксифе-
мыми химиотерапевтическими агентами, как ци-
нил)пропилтиосульфонат натрия.
сплатин, блеомицин и этопозид [5-7]. Генерация
1081
1082
МАРТИНОВИЧ и др.
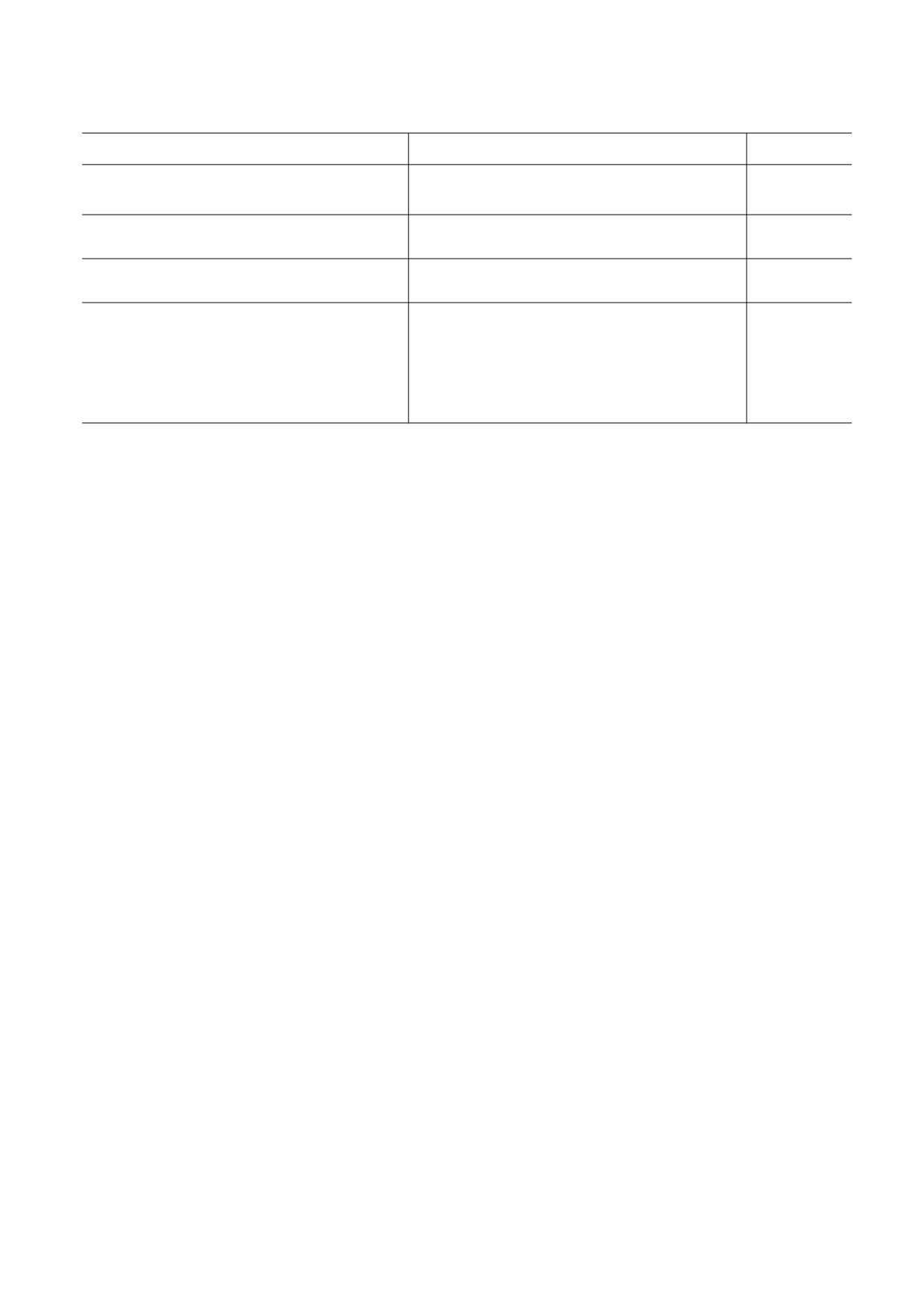
Противоопухолевые препараты, индуцирующие окислительный стресс
Механизмы повышения продукции АФК
Препараты
Ссылки
Генерация АФК митохондриальными
Даунорубицин, доксорубицин, паклитаксел,
[16-19]
оксидоредуктазами
ресвератрол
Образование АФК с участием металлов
Блеомицин, артемизинин, цисплатин
[20-22]
переменной валентности
Образование синглетного кислорода в
Фотодитазин, фотолон, фотофрин
[23-25]
фотохимических процессах
Ингибирование компонентов
антиоксидантной системы клеток:
- тиоредоксинредуктазы
Мотексафин гадолиний, ауранофин,
[26, 27]
Тризенокс (As2O3),
[28]
- γ-глутаматцистеинлигазы
Бутионин-сульфоксимин,
[29]
- супероксиддисмутазы
2-Метоксиэстрадиол
[30]
АФК в опухолевых клетках усиливается также
гут способствовать развитию резистентности
при действии моноклонального антитела ритук-
опухолевых клеток к повреждающим факторам.
симаба [8], протеасомного ингибитора бортезо-
Повышение стационарной внутриклеточной
миба [9], а также противоопухолевых антибиоти-
концентрации АФК служит необходимым этапом
ков-ингибиторов гистондиацилаз SAHA (sub-
передачи сигнала в регуляции широкого спектра
eroylanilide hydroxamic acid) [10] и адафостина
биохимических и физиологических процессов,
[11].
включая пролиферативные и адаптационные
процессы [33]. Высокий уровень генерации АФК
Для увеличения эффективности противоопу-
в клетках может вызвать ответ систем регуляции
холевых соединений предлагаются подходы, на-
редокс-гомеостаза, направленный на его сниже-
правленные на индуцирование окислительного
ние путем увеличения концентрации антиокси-
стресса в опухолевых клетках [12-14]. Участие
дантов («редокс-адаптация»). Рост уровня анти-
АФК в механизмах действия многих противоопу-
оксидантов при редокс-адаптации усиливает ре-
холевых препаратов позволяет выделить отдель-
зистентность клеток к ионизирующей радиации
ную область противоопухолевой терапии - «ре-
и действию ряда лекарственных соединений. В
докс-направленную терапию рака» [15]. Новый
результате повышения концентрации антиокси-
класс перспективных противоопухолевых аген-
дантов нарушается редокс-сигнализация, что
тов, уже продемонстрировавших эффективность
способствует изменению клеточного функцио-
в доклинических и клинических исследованиях,
нирования и развитию химиорезистентности
включает артемизинин, ауранофин, мотексафин
[34]. Таким образом, регуляция внутриклеточной
гадолиний, ресвератрол,
2-метоксиэстрадиол
продукции АФК является комплексным процес-
и др. (см. таблицу).
сом, требующим учета вклада всех участников
В рамках современных представлений регуля-
клеточного редокс-метаболизма. Для повышения
селективности действия лекарственных препара-
ция окислительных процессов может осуществ-
тов в стратегиях противоопухолевой терапии, на-
ляться не только редокс-активными соединения-
правленных на фармакологическую коррекцию
ми, но и регуляторами активности АФК-проду-
редокс-свойств, необходимо учитывать особен-
цирующих и антиоксидантных ферментов. Так,
ности редокс-метаболизма опухолевых клеток
наряду с препаратами, способными генерировать
[35].
АФК в биохимических и фотохимических реак-
циях, разрабатываются препараты, действие ко-
Важными модуляторами редокс-свойств кле-
торых включает ингибирование ферментов анти-
ток выступают природные и синтетические анти-
окислительной системы. Например, в качестве
оксиданты, способные индуцировать перестрой-
перспективных противоопухолевых соединений
ки редокс-метаболизма в результате регуляции
рассматриваются природные и синтетические
экспрессии генов белков антиоксидантной систе-
ингибиторы тиоредоксинредуктазы [31] и су-
мы клеток. Выявленные отличия экспрессии ге-
пероксиддисмутаз [32]. Тем не менее в разработке
нов белков антиоксидантной системы в нормаль-
методов редокс-направленной терапии необхо-
ных и опухолевых клетках позволяют рассматри-
димо учитывать тот факт, что молекулярные и
вать использование природных и синтетических
клеточные изменения, индуцируемые АФК, мо-
антиоксидантов для сенсибилизации опухолевых
БИОФИЗИКА том 65
№ 6
2020
ХЕМОСЕНСИБИЛИЗАЦИЯ ОПУХОЛЕВЫХ КЛЕТОК
1083
клеток в качестве перспективного подхода повы-
нию убиквитинирования и стабилизации Nrf2,
шения эффективности современной противоопу-
его транспорту в клеточное ядро и связыванию с
холевой терапии. В обзоре обсуждаются возмож-
ARE [46]. Неразрывная связь таких молекуляр-
ные молекулярные механизмы и перспективы
ных структур, как Keap1, Nrf2 и ARE, при переда-
клинического использования природных и син-
че внутриклеточных сигналов позволяет объеди-
тетических фенольных антиоксидантов в проти-
нить их в единую редокс-зависимую сигнальную
воопухолевой терапии.
систему Keap1/Nrf2/ARE, главным назначением
которой является защита клеток от токсических
соединений - окислителей и ксенобиотиков [45].
РЕДОКС-СИГНАЛЬНАЯ СИСТЕМА
Нарушения в функционировании данной систе-
Keap1/Nrf2/ARE КАК МИШЕНЬ
мы играют важную роль в патогенезе многих хро-
ДЛЯ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ
нических заболеваний, включая аутоиммунные,
В последние годы выяснено, что ключевую
респираторные, сердечно-сосудистые и нейроде-
роль в поддержании клеточного редокс-гомео-
генеративные [47, 48].
стаза при стрессовых воздействиях выполняет ре-
Следует отметить, что экспрессия некоторых
докс-зависимая сигнальная система Keap1/
антиоксидантных ферментов может также усили-
Nrf2/ARE [36]. Главным элементом системы яв-
ваться с участием других факторов транскрип-
ляется фактор транскрипции Nrf2 (транскрипци-
ции. Например, активация транскрипционного
онный фактор 2 семейства NFE (NF-E2-related
фактора FoxO (чаще всего через фосфорилирова-
factor 2)), контролирующий экспрессию генов, в
ние киназой Akt) увеличивает экспрессию ряда
промоторных областях которых содержится регу-
антиоксидантных ферментов митохондрий (Mn-
ляторная последовательность, получившая на-
супероксиддисмутаза, пероксиредоксины 3 и 5) и
звание «антиоксидант-респонсивный элемент»
пероксисом (каталаза) [49]. Активация HIF уве-
(ARE) [37]. Среди Nrf2-подконтрольных генов
личивает синтез глюкозо-6-фосфатдегидрогена-
для регуляции редокс-метаболизма важное зна-
зы, регулирующей образование низкомолекуляр-
чение имеют гены каталазы, легкой и тяжелой
ного компонента антиоксидантной системы
цепей глутаматцистеинлигазы, глутатионперок-
НАДФН [50]. Однако наиболее комплексная пе-
сидазы 2, глутатион-S-трансфераз, глутатион-
рестройка антиоксидантной системы клеток осу-
редуктазы, тиоредоксинов, глутаредоксинов, пе-
ществляется при активации Nrf2. Многочислен-
роксиредоксинов, тиоредоксинредуктазы и глю-
ные исследования последних лет свидетельству-
козо-6-фосфатдегидрогеназы [38-40]. Показано,
ют о ключевой роли системы Keap1/Nrf2/ARE в
что активация сигнальной системы Keap1/
сохранении здоровья [51]. Фактор транскрипции
Nrf2/ARE посредством усиления синтеза ABCC1
Nrf2 рассматривается как потенциальная мишень
(Mrp1), ключевого белка АТФ-зависимого экс-
для терапии широкого спектра заболеваний, в па-
порта ксенобиотиков из клеток, способствует
тогенезе которых окислительный стресс играет
развитию множественной лекарственной устой-
важную роль [48, 52]. Поиск эффективных регу-
чивости опухолевых клеток [41]. Под контролем
ляторов системы Keap1/Nrf2/ARE относится к
системы Keap1/Nrf2/ARE находятся также клю-
актуальным задачам современной фармакологии
чевые белки метаболизма глутатиона, увеличение
[53, 54].
концентрации которого способствует выжива-
Большинство известных индукторов системы
нию клеток в стрессовых условиях [42].
Keap1/Nrf2/ARE содержат электрофильные груп-
В неактивном состоянии фактор транскрип-
пы (прямые активаторы) или после метаболиче-
ции Nrf2 нековалентно связан со специфическим
ских превращений становятся электрофилами
редокс-зависимым белком Keap1 (Kelch-подоб-
(метаболические активаторы). К прямым актива-
ный ECH-ассоциированный протеин 1 (Kelch-
торам относятся такие группы соединений, как
like ECH-associated protein 1)). В отсутствие акти-
акцепторы Михаэля, изотиоцианаты, геминаль-
ваторов Nrf2, находящийся в комплексе с адап-
ные дитиолы, сероорганические и селенсодержа-
терным белком Keap1, подвергается фермента-
щие соединения, электрофилы с уходящей груп-
тивному убиквитинированию лизиновых остат-
пой, соединения трехвалентного мышьяка, ато-
ков с последующей деградацией в
26S-
мы тяжелых металлов, гидропероксиды и
протеасомах [43]. Время жизни Nrf2 (t1/2) в клет-
нитрозирующие агенты [45, 55]. Активация Nrf2
ках при нормальных условиях составляет от 7 до
осуществляется также при действии многих при-
20 мин [44, 45]. Ключевую роль в снятии репрес-
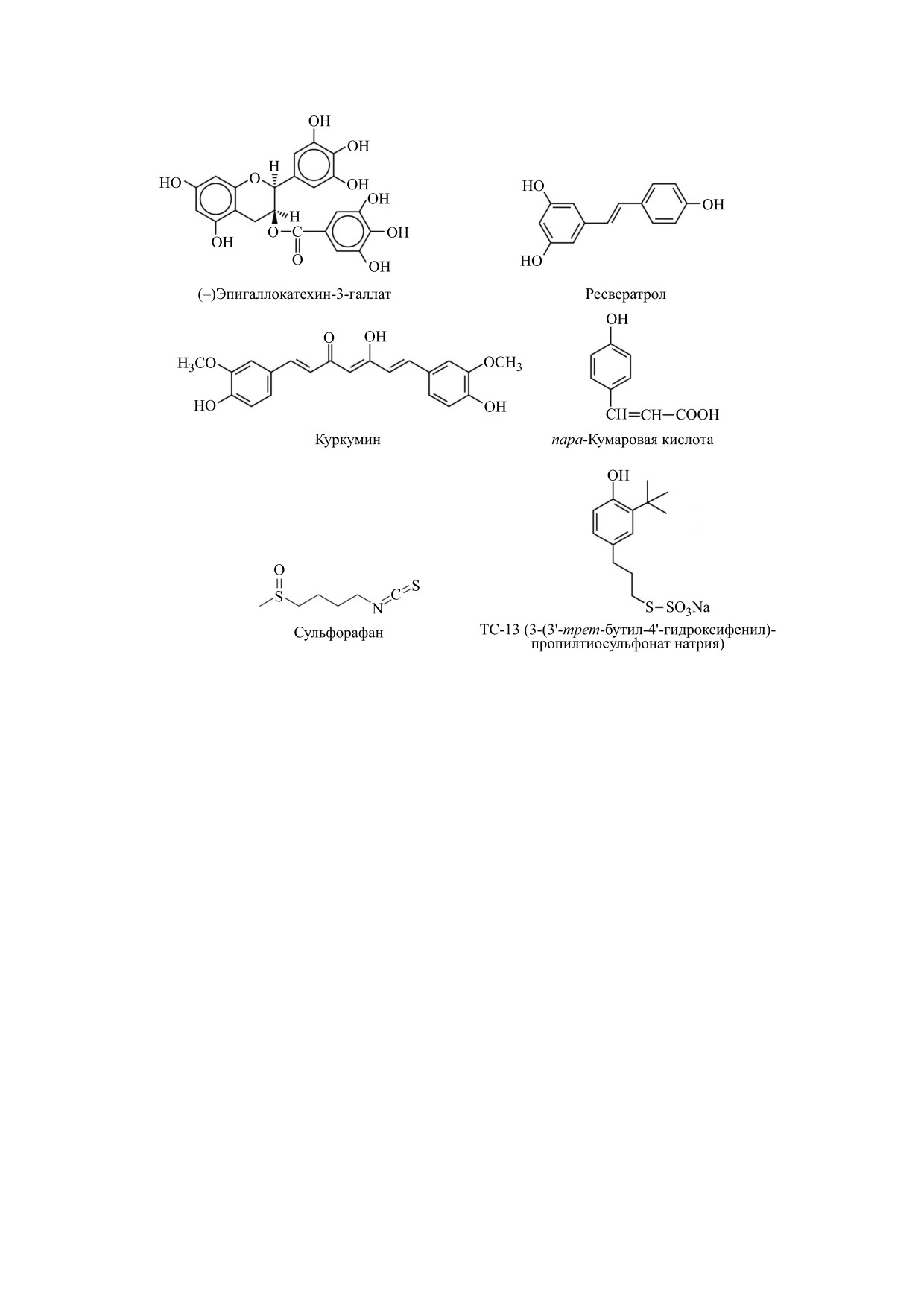
родных (кумарин, ресвератрол, эпигаллокатехин-
сии транскрипционного фактора Nrf2 посред-
3-галлат) и синтетических (3-(3'-трет-бутил-4'-
ством убиквитинирования играют процессы мо-
гидроксифенил)пропилтиосульфонат натрия,
дификации сульфгидрильных групп остатков ци-
трет-бутилгидрохинон) фенольных антиокси-
стеина в Keap1. Модификация SH-групп остатков
дантов (рис. 1). Непрямое защитное действие ан-
цистеина в Keap1 за счет их окисления или элек-
тиоксидантов при окислительном стрессе, реали-
трофильного присоединения приводит к наруше-
зующееся с участием системы Keap1/Nrf2/ARE,
БИОФИЗИКА том 65
№ 6
2020
1084
МАРТИНОВИЧ и др.
Рис. 1. Химическая структура природных и синтетических индукторов системы Keap1/Nrf2/ARE.
наблюдается при более низких концентрациях
типом и величиной концентрации АФК, но и ти-
соединений, чем те, которые необходимы для эф-
пом и величиной концентрации клеточных анти-
фективного перехвата свободных радикалов в
оксидантов, а также местом образования АФК
биологической среде [56]. Предполагается, что
[59, 60]. Иначе говоря, эффект действия редокс-
активация экспрессии ARE-регулируемых генов
активных соединений определяется не конкрет-
происходит в результате двухэлектронного окис-
ной молекулой, а группой взаимодействующих
ления-восстановления, в котором могут участво-
участников, образующих электрон-транспорт-
вать полифенолы со взаимным орто- и пара-, но
ные цепи (редокс-цепи), и зависит от величин па-
не мета-расположением гидроксильных групп
раметров редокс-гомеостаза [61, 62]. Близкие по
[57]. Именно благодаря тому, что большинство
структуре эндогенные и экзогенные антиокси-
индукторов ARE относится к группе фенольных
данты могут выступать участниками разных элек-
антиоксидантов, последний получил название
трон-транспортных цепей, запуская при этом
«антиоксидант-респонсивный элемент».
различные клеточные ответы в нормальных и
опухолевых клетках.
Важно отметить, что ARE-активирующие
свойства проявляют только хинонные формы со-
Следует отметить, что уровень повышения ак-
единений, которые образуются при взаимодей-
тивности антиоксидантной системы клетки огра-
ствии фенолов с внутриклеточными АФК [58].
ничен наличием отрицательной обратной связи в
Это позволяет рассматривать внутриклеточную
системе Keap1/Nrf2/ARE. Показано, что Nrf2 на-
продукцию АФК в качестве ключевого фактора,
ряду с регуляцией компонентов антиоксидант-
определяющего специфичность регуляторного
ной системы также усиливает продукцию АФК,
действия антиоксидантов. В соответствии с со-
опосредованную митохондриями и НАДФН-ок-
временной концепцией редокс-сигнализации
сидазой [63]. При превышении определенного
эффект регуляции функциональной активности
порога активации Nrf2 запускается экспрессия
клеток с участием АФК определяется не только
генов, продукты которых способствуют развитию
БИОФИЗИКА том 65
№ 6
2020
ХЕМОСЕНСИБИЛИЗАЦИЯ ОПУХОЛЕВЫХ КЛЕТОК
1085
окислительного стресса. При высокой тран-
скрипционной активности Nrf2 повышается со-
держание фактора транскрипции Klf9 (Kruppel-
подобный фактор 9 (Kruppel-like factor 9)) [64].
Klf9 принадлежит к семейству Kruppel-подобных
факторов транскрипции (KLF) и играет важную
роль в онкогенезе, дифференцировке и гибели
клеток [64, 65]. Взаимодействие Klf9 с сайтами
связывания ДНК изменяет экспрессию ряда бел-
ков, участвующих в регуляции метаболизма АФК
[64]. Вместе с тем фактор транскрипции Klf9 по-
давляет экспрессию антиоксидантных генов, в
том числе ген пероксиредоксина 6 (PRDX6). Низ-
кая активность Prdx6 в митохондриях приводит к
смещению редокс-баланса в пользу окислителей
и к последующей АФК-индуцированной гибели
Рис. 2. Изменения редокс-гомеостаза нормальных и
клеток.
Передача сигнала через путь
опухолевых клеток, индуцированные модуляторами
системы Keap1/Nrf2/ARE.
Nrf2/Klf9/Prdx6 рассматривается как молекуляр-
ный механизм переключения от редокс-регуля-
ции к сверхпродукции АФК и гибели клеток [66,
Мутации Keap1, ведущие к нарушению его
67]. С использованием эпителиальных клеток
функционирования, обнаружены в карциномах
хрусталика в качестве модельной системы было
различных органов [70]. В результате во многих
показано, что сульфорафан (рис. 1), один из са-
опухолевых тканях и клеточных линиях опухолей
мых «сильных» природных индукторов тран-
наблюдается конститутивная активация Nrf2 [71],
скрипционной активности Nrf2, в низких микро-
что во многом обуславливает изменения эффек-
молярных концентрациях (3-6 мкМ) стимулиро-
тов действия экзогенных регуляторов сигнально-
вал рост клеток и обеспечивал цитопротекцию
го пути Keap1/Nrf2/ARE и приводит к сдвигу за-
при действии пероксида водорода и ультрафиоле-
висимости доза-эффект в направлении более
товом облучении за счет усиления активности
низких концентраций. Наличие аутопротектор-
Nrf2, а в концентрациях выше 10 мкМ вызывал
ной сверхэкспрессии Nrf2 в опухолевых клетках
гибель клеток [67, 68]. При более высокой дозе
позволяет предположить, что при действии анти-
сульфорафана избыточное количество Nrf2 при-
оксидантов превышение порога экспрессии Nrf2
водило к активации программы клеточной гибе-
будет приводить к усилению окислительных про-
ли через индукцию Klf9 и последующее увеличе-
цессов в результате активации фактора Klf9 и по-
ние продукции АФК. Ингибирование Klf9 умень-
вышения экспрессии АФК-продуцирующих бел-
шало продукцию АФК и способствовало
ков. U-образная зависимость уровня внутрикле-
выживанию клеток [67]. Таким образом, фактор
точных
окислителей
от
концентрации
транскрипции Nrf2 является важным регулято-
модуляторов системы Keap1/Nrf2/ARE также бу-
ром редокс-гомеостаза клеток, способным уси-
дет наблюдаться для нетрансформированных
ливать как восстановительные, так и окислитель-
клеток. Однако в нормальных клетках защитный
ные процессы в клетках.
эффект, проявляющийся в снижении концентра-
Наличие порога для активации защитного
ции окислителей и обусловленный ростом содер-
действия через фактор транскрипции Nrf2 позво-
жания антиоксидантных ферментов, будет про-
ляет предположить, что зависимости доза-эф-
являться при тех концентрациях антиоксидантов,
фект для модуляторов системы Keap1/Nrf2/ARE
при которых индуцируется окислительный
будут характеризоваться гормезисом (рис.
2).
стресс в опухолевых клетках.
Термин «гормезис» используется для описания
явлений, в которых физические или химические
В
силу
специфичности
регуляции
факторы индуцируют противоположно направ-
Keap1/Nrf2/ARE в опухолевых клетках можно пред-
ленные биологические ответы при разных дозах:
положить, что антиоксидантные модуляторы дан-
стимулирующие и защитные эффекты при низ-
ной системы будут сенсибилизировать действие
ких дозах и токсические при высоких [69]. По-
АФК-продуцирующих противоопухолевых агентов
скольку антиоксидантный эффект, который ин-
только в трансформированных клетках. При опре-
дуцируется
при действии модуляторов
деленных концентрациях антиоксидантов в опухо-
Keap1/Nrf2/ARE в клетках, опосредован актива-
левых клетках будет наблюдаться прооксидантный
цией соответствующего сигнального пути, можно
эффект, тогда как в нормальных клетках - защит-
предположить отличие регуляторных ответов
ный. Таким образом, антиоксидантные модуляторы
опухолевых и нормальных клеток на действия ан-
системы Keap1/Nrf2/ARE являются биологически
тиоксидантных модуляторов (рис. 2).
активными соединениями бинарного действия, ко-
БИОФИЗИКА том 65
№ 6
2020
1086
МАРТИНОВИЧ и др.
торые могут использоваться для повышения эффек-
мальных эпителиальных клетках, но индуцирует
тивности современной противоопухолевой терапии.
генерацию АФК в опухолевых клетках [79]. В
Ниже представлен анализ собственных и литератур-
трансформированных клетках эпигаллокатехин-3-
ных данных о действии природных и синтетических
галлат активирует митохондриально опосредован-
фенольных антиоксидантов на редокс-процессы
ный путь клеточной гибели, сопровождающийся
опухолевых клеток и их роли в сенсибилизации опу-
генерацией АФК, снижением трансмембранного
холевых клеток к действию противоопухолевых пре-
митохондриального потенциала и высвобождени-
паратов.
ем апоптотических белков [80]. Аналогичные ре-
зультаты были получены в клеточных линиях рака
поджелудочной железы [81], рака легкого [82], рака
АНТИОКСИДАНТЫ
толстой кишки [83] и меланомы [84], а также на
КАК ХЕМОСЕНСИБИЛИЗАТОРЫ
животных моделях ксенотрансплантата рака мо-
Известно несколько тысяч природных фе-
лочной железы [85]. В концентрациях 5-20 мкМ
нольных соединений [72]. Ввиду большого коли-
эпигаллокатехин-3-галлат вызывал апоптоз только
чества и разнообразия фенольных соединений
в клетках меланомы, не оказывая токсического
противоопухолевые свойства многих из них не
действия на нормальные меланоциты [84]. В кон-
исследованы. В последние годы наиболее актив-
центрациях 10-80 мг/мл эпигаллокатехин-3-гал-
но исследуются регуляторные свойства эпигалло-
лат вызывал апоптоз клеток гепатоцеллюлярной
катехин-3-галлата - основного катехина зелено-
карциномы линии LM6, но не нормальных клеток
го чая, ресвератрола - одного из основных поли-
печени (HL-7702) [86].
фенолов, содержащихся в кожуре ягод винограда
Сенсибилизация опухолевых клеток эпигал-
и красных винах, и куркумина - основного кур-
локатехин-3-галлатом к действию ряда противо-
куминоида, входящего в состав корня куркумы
опухолевых препаратов показана в исследовани-
Curcuma longa L. [73]. Действие эпигаллокатехин-
ях как in vitro, так и in vivo [87]. Эпигаллокатехин-
3-галлата, ресвератрола и куркумина, как и дру-
3-галлат усиливает действие доксорубицина [88],
гих полифенолов, на клетки описывается горме-
5-фторурацила (5-флюороурацила) [89], циспла-
зисом, характеризующимся U-образной зависи-
тина [90], тризенокса (As2O3) [91], бортезомиба
мостью [74]. Фенолы при низких микромолярных
[92] и этопозида [93]. Среди предложенных меха-
концентрациях вызывают защитный антиокси-
дантный эффект. При высоких концентрациях
низмов хемосенсибилизации опухолевых клеток
фенолы проявляют прооксидантные и цитоток-
ключевую роль играет редокс-модуляция в ре-
сические свойства [75, 76]. При одинаковых кон-
зультате усиления внутриклеточной продукции
АФК [87, 94]. В раковых клетках яичников линий
центрациях в опухолевых и нормальных клетках
SKOV3, CAOV3 и C200 эпигаллокатехин-3-галлат
фенолы могут индуцировать противоположно на-
правленные эффекты.
увеличивал токсичность цисплатина в три-шесть
раз, включая резистентные к цисплатину клетки
Эпигаллокатехин-3-галлат. Одним из наиболее
[90]. Однако избирательность действия соедине-
изученных природных индукторов системы
ния в отношении опухолевых клеток не обосно-
Keap1/Nrf2/ARE, проявляющим антиканцеро-
вана. Как обсуждалось ранее, сверхэкспрессия
генные свойства, является полифенол эпигалло-
Nrf2 в опухолевых клетках может обуславливать
катехин-3-галлат (рис. 1) - эфир эпигаллокатехи-
прооксидантный эффект при более низких кон-
на и галловой кислоты.
центрациях агента, чем в нормальных клетках.
Защитное действие полифенола, связанное со
стимуляцией антиоксидантной системы клеток,
Показано, что через активацию фактора тран-
наблюдается при многих стрессовых и повреждаю-
скрипции Nrf2 эпигаллокатехин-3-галлат повы-
щих воздействиях. Так, побочным действием про-
шает чувствительность раковых клеток толстой
тивоопухолевого препарата цисплатина является
кишки к радиационному воздействию [95]. С дру-
нефротоксичность, проявляющаяся в развитии
гой стороны, при совместном действии эпигалло-
окислительного стресса и воспаления в почках.
катехин-3-галлата и противоопухолевых препа-
Введение крысам вместе с цисплатином полифе-
ратов в нетрансформированных клетках снижа-
нола эпигаллокатехин-3-галлата индуцирует акти-
ется токсичность последних. Эпигаллокатехин-
вацию Nrf2 и ингибирование NF-κB, что приводит
3-галлат снижает радиационно-индуцированное
к снижению окислительного стресса и содержания
метастазирование [96], оказывает защитный эф-
воспалительных цитокинов в почках [77]. При ин-
фект при кардиотоксичности доксорубицина [97,
дуцированном окислительном стрессе в эпители-
98], нейротоксичности и ототоксичности циспла-
альных клетках защитный эффект эпигаллокате-
тина [99, 100], снижает развитие индуцированно-
хин-3-галлата опосредован увеличением антиок-
го блеомицином фиброза легких [101]. Молеку-
сидантной емкости в результате активации
лярный механизм протекторного действия эпи-
фактора транскрипции Nrf2 [78]. Эпигаллокате-
галлокатехин-3-галлата включает активацию
хин-3-галлат ингибирует образование АФК в нор-
системы Keap1/Nrf2/ARE [77, 102].
БИОФИЗИКА том 65
№ 6
2020
ХЕМОСЕНСИБИЛИЗАЦИЯ ОПУХОЛЕВЫХ КЛЕТОК
1087
Куркумин. Куркумин (1,7-бис-(4-гидрокси-3-
условиях аутофагия может вызывать гибель кле-
метоксифенил)-1,6-гептадиен-3,5-дион) являет-
ток или инициировать апоптоз [130].
ся высокоактивным биорегулятором, обладаю-
Следует отметить, что усиление внутриклеточ-
щим антиоксидантными, противовоспалитель-
ной продукции АФК при действии куркумина
ными, иммуномодулирующими и противоопухо-
может реализоваться через Nrf2-зависимый меха-
левыми свойствами
[103,
104]. Многие
низм. Показано, что ингибирование пролифера-
биологические эффекты куркумина связаны с его
тивной активности клеток аденокарциномы мо-
способностью активировать систему антиокси-
лочной железы линии MCF-7 при действии кур-
дант-респонсивного элемента Keap1/Nrf2/ARE и
кумина происходит в результате Nrf2-
индуцировать экспрессию генов антиоксидант-
индуцированного снижения сверхэкспрессии эн-
ной защиты
[105]. Для активации системы
донуклеазы Fen1 (Flap endonuclease-1, флэп-эн-
Keap1/Nrf2/ARE куркумином важна электро-
донуклеазa-1), участвующей в развитии рака мо-
фильная группировка с α,β-ненасыщенными
лочной железы [131]. Недавно обнаружено, что
карбонильными связями, которая, будучи акцеп-
молекулярный механизм сенсибилизации клеток
тором Михаэля, взаимодействует с цистеиновы-
линии MCF-7 к действию паклитаксела и адрено-
ми остатками Keap1 [46].
мицина растительными полифенолами включает
ингибирование эндонуклеазы Fen1 с участием
В многочисленных исследованиях in vitro и
in vivo показана высокая противоопухолевая ак-
АФК и Nrf2 [132].
тивность куркумина [106, 107]. В клинических ис-
Эксперименты на крысах показали, что курку-
следованиях фазы II куркумин тестируется в от-
мин снижает потерю веса и повреждения слизи-
ношении множественной миеломы, рака кожи,
стой оболочки кишечника при химиотерапии
рака шейки матки, рака поджелудочной железы
5-фторурацилом [133]. Показано, что куркумин
[15, 108]. Биологическое действие куркумина в
защищает клетки печени от цисплатин-индуци-
низких микромолярных концентрациях в опухо-
рованного повреждения [134], снижает окисли-
левых и нормальных клетках характеризуется се-
тельный стресс и апоптоз в костном мозге после
лективностью. Например, куркумин в концен-
химиотерапии цисплатином и карбоплатином
трациях 50 мкМ вызывает апоптоз в клетках гепа-
[135, 136]. Молекулярные механизмы защитных
тоцеллюлярной карциномы человека линии
эффектов куркумина в отношении нетрансфор-
HepG2, не оказывая токсического действия на
мированных клеток также могут реализоваться с
нормальные гепатоциты
[109]. В опухолевых
участием Nrf2 [137]. В экспериментах на мышах с
клетках куркумин усиливает действие радиации
лимфомой показано, что куркумин приводит к
[110], гемцитабина
[111], капецитабина
[112],
профилактике рака, индуцируя антиоксидантные
5-фторурацила [113, 114], этопозида [115], пакли-
ферменты и ферменты II фазы детоксикации ксе-
таксела [116, 117], цисплатина [118], тамоксифена
нобиотиков посредством активации передачи
[119] и иринотекана [120]. Обнаружено, что кур-
сигналов через Keap1/Nrf2/ARE, восстановления
кумин в сочетании с кверцетином снижает коли-
экспрессии гена опухолевого супрессора p53 и
чество и размер аденом у пациентов с семейным
модуляции экспрессии и содержания медиаторов
аденоматозным полипозом, аутосомно-доми-
воспаления, таких как TGF-β и циклооксигеназа
нантным расстройством, характеризующимся
2 [138]. В результате активации Nrf2 куркумин ин-
развитием колоректальных аденом и в конечном
гибирует апоптоз клеток мочевого пузыря у крыс
итоге колоректального рака [121].
и ослабляет цистопатию, вызванную цисплати-
ном [139].
Показано, что противоопухолевые свойства
куркумина реализуются с участием АФК [122,
Ресвератрол. К природным биорегуляторам с
123]. Предполагается, что куркумин вызывает
противоопухолевыми свойствами относится так-
АФК-индуцируемое снижение трансмембранно-
же полифенольный фитоалексин ресвератрол
го митохондриального потенциала, в результате
(транс-3,5,4'-тригидроксистильбен) (рис.
1)
активируется апоптоз [124, 125]. В ряде работ по-
[140]. Эпидемиологические исследования пока-
казана способность куркумина через усиление
зали, что у женщин, употребляющих богатый ре-
внутриклеточной продукции АФК активировать
свератролом виноград, риск развития рака мо-
аутофагию, при этом антиоксидант N-ацетилци-
лочной железы снижается почти на 50% [141].
стеин снижал, а пероксид водорода усиливал
Ресвератрол проявляет цитотоксичность и умень-
аутофагию [126, 127]. При активации аутофагии
шает жизнеспособность опухолевых клеток при
основным источником АФК являются митохон-
раке кожи, раке предстательной железы, раке по-
дрии [128, 129]. Функциональные отношения
лости рта, немелкоклеточном раке легкого, но
между апоптозом и аутофагией комплексны: в
обладает низкой токсичностью в нормальных
некоторых случаях аутофагия является частью
клетках [142-145]. Показано, что ресвератрол ин-
клеточного адаптационного механизма, защища-
дуцирует аутофагию и апоптоз в опухолевых
ющего клетки от апоптоза, в то время как в других
клетках посредством увеличения продукции
БИОФИЗИКА том 65
№ 6
2020
1088
МАРТИНОВИЧ и др.
АФК [146, 147]. Активация механизмов клеточ-
снижает среднюю продолжительность жизни
ной гибели при действии ресвератрола протекает
самцов D. melanogaster линии lgl558OR/Cy, содер-
с участием Nrf2 [148].
жащей в гетерозиготном состоянии рецессивную
При химиотерапии ресвератрол сенсибилизи-
летальную мутацию опухолевого супрессора
рует опухолевые клетки к действию радиации
[175]. Неоднозначность действия антиоксиданта
[149, 150], цисплатина [151, 152], доцетаксела
в различных экспериментальных условиях может
[153], доксорубицина [154, 155], паклитаксела
быть опосредована особенностями клеточного
[156], 5-фторурацила [157], сорафениба [158],
редокс-гомеостаза, который определяет протека-
карфилзомиба [159] и бортезамиба [160]. Синер-
ние ряда метаболических и регуляторных процес-
гизм действия наблюдается при совместном ис-
сов и может влиять на биологическое действие
пользовании ресвератрола и куркумина в отно-
редокс-активных соединений.
шении рака молочной железы, рака толстой киш-
В опухолевых клетках в сравнении с нетранс-
ки, рака легкого и гепатоцеллюлярного рака
формированными клетками наблюдается значи-
[161-163]. Ключевую роль в механизме сенсиби-
тельное повышение концентрации восстановите-
лизации клеток при действии ресвератрола игра-
лей, в результате которого функциональный
ет увеличение внутриклеточной продукции АФК
ответ трансформированных клеток на внеклеточ-
[164, 165]. Показано, что ресвератрол повышает
ные сигналы отличается от реакции нормальных
чувствительность раковых клеток поджелудоч-
клеток [13, 62]. Полученные нами результаты поз-
ной железы в результате активации Nrf2 и увели-
воляют предположить, что одним из ключевых
чения продукции АФК [166]. Важно отметить, что
механизмов, ответственных за формирование
при радиотерапии и химиотерапии ресвератрол
устойчивости опухолевых клеток к действию про-
защищает нормальные клетки от радиационного
тивоопухолевых соединений, является ингибиро-
повреждения и токсического действия химиоте-
вание программы клеточной гибели вследствие
рапевтических препаратов [167, 168]. Защитные
повышения суммарной внутриклеточной кон-
биологические эффекты ресвератрола связаны с
центрации восстановителей, количественно ха-
его способностью индуцировать экспрессию ге-
рактеризуемой редокс-буферной емкостью [34].
нов антиоксидантной защиты в результате акти-
Нами также показано, что синтетические моно-
вации системы антиоксидант-респонсивного
фенольные серосодержащие антиоксиданты c
элемента Keap1/Nrf2/ARE [169-171].
различной структурой боковых радикалов могут
Синтетические монофенольные серосодержа-
разнонаправленно регулировать редокс-свойства
щие антиоксиданты. Наряду с природными ин-
и химиорезистентность опухолевых клеток [34,
176]. Установлено, что при использовании 3,5-
дукторами системы Keap1/Nrf2/ARE в настоящее
диметил-4-гидроксибензилтиоэтаноата калия ре-
время активно ведется поиск синтетических регу-
ляторов антиоксидантной системы клетки.
докс-буферная емкость и резистентность опухо-
левых клеток к доксорубицину увеличивается.
Исследования структурно взаимосвязанного
При действии ТС-13 наблюдается уменьшение
ряда бифункциональных монофенольных соеди-
редокс-буферной емкости, что приводит к сни-
нений, содержащих разное количество орто-
жению лекарственной устойчивости опухолевых
трет-бутильных заместителей, а также сульфо-
клеток [34]. При более высоких концентрациях
натные и тиосульфонатные группы в пара-ал-
ТС-13 индуцирует кратковременное повышение
кильных заместителях позволили выявить новые
продукции АФК и активацию митохондриально-
регуляторы антиоксидантной системы клетки с
опосредованной гибели клеток [177].
выраженными противовоспалительными свой-
В экспериментальной модели мышей с лим-
ствами in vivo [172]. Показано, что одним из ак-
фолейкозом (P-388) ТС-13 усиливал химиотера-
тивных синтетических индукторов сигнальной
системы Keap1/Nrf2/ARE является фенольный
певическую активность цитостатика циклофос-
антиоксидант
3-(3'-трет-бутил-4'-гидроксифе-
фана, используемого в субтерапевтической дозе,
увеличивая индекс средней продолжительности
нил)пропилтиосульфонат натрия (ТС-13), содер-
жизни мышей с лейкемией со 196 до 283% по от-
жащий тиосульфонатную группу с лабильной S-
ношению к контролю [178]. При моделировании
S-связью (рис. 1) [172]. Обнаружено защитное
действие ТС-13 при остром [173] и хроническом
роста перевиваемой карциномы легких Льюис у
воспалении in vivo [174]. Показано также, что ТС-
мышей ТС-13 усиливал действие противоопухо-
левого агента доксорубицина и снижал воспали-
13 увеличивает выживаемость разных линий Dro-
тельные процессы [179].
sophila melanogaster в условиях окислительного
стресса, индуцированного H2O2 и паракватом
Исследования синтетических водораствори-
[175]. При этом в нормальных условиях введение
мых серосодержащих монофенолов, отличаю-
в диету фенольного антиоксиданта ТС-13 повы-
щихся от ТС-13 длиной углеводородной цепи ал-
шает продолжительность жизни у самцов и самок
килтиосульфонатного заместителя, находящего-
долгоживущей линии D. melanogaster Canton S, но
ся в пара-положении по отношению к
БИОФИЗИКА том 65
№ 6
2020
ХЕМОСЕНСИБИЛИЗАЦИЯ ОПУХОЛЕВЫХ КЛЕТОК
1089
гидроксильной группе, количеством трет-бу-
5. P. Bragado, A. Armesilla, A. Silva, et al., Apoptosis 12
тильных орто-заместителей и варьированием
(9), 1733 (2007).
фрагмента «S-S», показали, что активация ауто-
6. E. Kucuksayan, A. Cort, M. Timur et al., J. Cell. Bioch.
фагии и активация системы Keap1/Nrf2/ARE за-
114 (7), 1685 (2013).
висят от структуры соединения [180]. Показано,
7. S. Y. Oh, Y. W. Sohn, J. W. Park, et al., Mol. Cancer
что структурные особенности, определяющие
Ther. 6 (8), 2178 (2007).
противоопухолевую активность гидрофильных
8. B. Bellosillo, N. Villamor, A. López-Guillermo, et al.,
серосодержащих фенольных антиоксидантов,
Blood 98, 2771 (2001).
связаны с наличием тиосульфонатной группы в
9. X. Y. Pei, Y. Dai, S. Grant, et al., Clin. Cancer Res. 10,
пара-пропильном заместителе соединения [181,
3839 (2004).
182]. При этом фенольные антиоксиданты, со-
10. J. S. Ungerstedt, Y. Sowa, W. S. Xu, et al., Proc. Natl.
держащие тиосульфонатную группу, не только
Acad. Sci. USA 102, 673 (2005).
проявляют противоопухолевую активность, но
11. T. D. Shanafelt, Y. K. Lee, N. D. Bone, et al., Blood
также повышают структурную устойчивость
105, 2099 (2005).
эритроцитов в условиях индуцированного окис-
12. D. Trachootham, J. Alexandre, and P. Huang, Nat.
лительного стресса [182].
Rev. Drug Discov. 8, 579 (2009).
Таким образом, исследования модуляторов
13. Г. Г. Мартинович, И. В. Мартинович, Е. Н. Голу-
системы Keap1/Nrf2/ARE открывают новые воз-
бева и др., Изв. НАН Беларуси. Сер. мед. наук, №
2, 85 (2012).
можности для развития методов противоопухоле-
вой терапии. Специфичность редокс-регуляции в
14. C. Gorrini, I. S. Harris, and T. W. Mak, Nat. Rev. Drug
Discov. 12 (12), 931 (2013).
опухолевых клетках позволяет рассматривать ан-
тиоксиданты направленного действия в качестве
15. G. T. Wondrak, Antiox. Redox Signal. 11, 3013 (2009).
потенциальных корректоров свойств опухолевых
16. K. L. Malisza and B. B. Hasinoff, Free Radic. Biol.
клеток, включая их устойчивость к противоопу-
Med. 20, 905 (1996).
холевым препаратам. В сравнении с другими хе-
17. A. Kuznetsov, R. Margreiter, A. Amberger et al., Bio-
мосенсибилизаторами важным преимуществом
chim. Biophys. Acta 1813, 1144 (2011).
антиоксидантов
- индукторов системы
18. G. Varbiro, B. Veres, F. Gallyas, et al., Free Radic.
Keap1/Nrf2/ARE - являются протекторные свой-
Biol. Med. 31, 548 (2001).
ства этих соединений, проявляемые по отноше-
19. J. H. Ko, J. Sethi, J. Y. Um, et al., Int. J. Mol. Sci. 18
нию к нетрансформированным клеткам в услови-
(12), 2589 (2017).
ях патологии и стресса.
20. J. Gutteridge and F. Ziai-Chang, Biochem. Biophys.
Res. Commun. 99, 1354 (1981).
21. W. Gao, F. Xiao, X. Wang, et al., Apoptosis 18 (10),
ФИНАНСИРОВАНИЕ РАБОТЫ
1201 (2013).
Работа выполнена при финансовой поддержке
22. P. A. Ma, H. Xiao, C. Yu, et al., Nano Lett. 17 (2), 928
Белорусского республиканского фонда фунда-
(2017).
ментальных исследований (грант № Б20У-001).
23. A. B. Uzdensky, O. Y. Dergacheva, A. A. Zhavoronko-
va, et al., Life Sci. 74, 2185 (2004).
24. М. А. Каплан, А. М. Шубина, И. А. Замулаева
КОНФЛИКТ ИНТЕРЕСОВ
и др., Фотодинамическая терапия и фотодиагно-
Авторы заявляют об отсутствии конфликта
стика 3 (4), 18 (2014).
интересов.
25. S. Wu and D. Xing, J. X-ray Sci. Technol. 20 (3), 363
(2012).
26. S. I. Hashemy, J. S. Ungerstedt, F. Zahedi Avval, et al.,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
J. Biol. Chem. 281, 10691 (2006).
Настоящая работа не содержит описания ис-
27. C. Marzano, V. Gandin, A. Folda, et al., Free Radic.
следований с использованием людей и животных
Biol. Med. 42 (6), 872 (2007).
в качестве объектов.
28. J. Lu, E. Chew and A. Holmgren, Proc. Natl. Acad.
Sci. USA 104, 12288 (2007).
29. J. G. Villablanca, S. L. Volchenboum, H. Cho, et al.,
СПИСОК ЛИТЕРАТУРЫ
Pediatr. Blood Cancer 63, 1349 (2016).
1. P. Kovacic and J. Osuna, Curr. Pharm. Design. 6 (3),
30. P. Huang, L. Feng, E. A. Oldham, et al., Nature 407,
277 (2000).
390 (2000).
2. H. Pelicano, D. Carney and P. Huang, Drug Resist.
31. Д. Б. Корман, Л. А. Островская и В. А. Кузьмин,
Updat. 7 (2), 97 (2004).
Биофизика 64 (3), 552 (2019).
3. J. Wang and J. Yi, Cancer Biol. Ther. 7 (12), 1875
32. G. Pani, R. Colavitti, B. Bedogni, et al., Curr. Med.
(2008).
Chem. 11 (10), 1299 (2004).
4. H. Sies, C. Berndt and D. P. Jones, Annu. Rev. Bio-
33. J. Roy, J. M. Galano, T. Durand, et al., FASEB J. 31
chem. 86, 715 (2017).
(9), 3729 (2017).
БИОФИЗИКА том 65
№ 6
2020
1090
МАРТИНОВИЧ и др.
34. Г. Г. Мартинович, И. В. Мартинович, А. В. Вче-
63. S. Kovac, P. R. Angelova, K. M. Holmstrom, et al.,
рашняя и др., Биофизика 62 (6), 1142 (2017).
Biochim. Biophys. Acta 1850, 794 (2015).
35. Н. К. Зенков, П. М. Кожин, А. В. Вчерашняя и др.,
64. S. N. Zucker, E. E. Fink, A. Bagati, et al., Mol. Cell 53,
Сиб. науч. мед. журн. 39 (9), 11 (2019).
916 (2014).
36. T. W. Kensler, N. Wakabayashi, and S. Biswal, Annu.
65. M. Ying, J. Tilghman, Y. Wei, et al., J. Biol. Chem. 289,
Rev. Pharmacol. Toxicol. 47, 89 (2007).
32742 (2014).
37. K. Itoh, T. Chiba, S. Takahashi, et al., Biochem. Bio-
66. E. E. Fink, S. Moparthy, A. Bagati, et al., Cell Rep. 25
phys. Res. Commun. 236 (2), 313 (1997).
(1), 212 (2018).
38. M. K. Kwak, N. Wakabayashi, K. Itoh, et al., J. Biol.
67. B. Chhunchha, E. Kubo, and D. P. Singh, Cells 8 (10),
Chem. 278, 8135 (2003).
1159 (2019).
39. K. C. Wu, J. Y. Cui, and C. D. Klaassen, Toxicol. Sci.
68. E. Kubo, B. Chhunchha, P. Singh, et al., Sci. Rep. 7,
123, 590 (2011).
14130 (2017).
40. Y. Mitsuishi, K. Taguchi, Y. Kawatani, et al., Cancer
69. E. J. Calabrese, K. A. Bachmann, A. J. Bailer, et al.,
Cell 22, 66 (2012).
Toxicol. Appl. Pharmacol. 222, 122 (2007).
70. L. M. Solis, C. Behrens, W. Dong, et al., Clin. Cancer
41. X. J. Wang, Z. Sun, N. F. Villeneuve, et al., Carcino-
Res. 16, 3743 (2010).
genesis 29, 1235 (2008).
71. M. B. Sporn and K. T. Liby, Nat. Rev. Cancer 12, 564
42. E. Sun, H. Erb, and T. H. Murphy, Biochem. Biophys.
(2012).
Res. Commun. 326, 371 (2005).
72. Е. Б. Меньщикова, В. З. Ланкин и Н. В. Кандалин-
43. P. Canning, F. J. Sorrell, and A. N. Bullock, Free Rad-
цева, Фенольные антиоксиданты в биологии и меди-
ic. Biol. Med. 88, 101 (2015).
цине (LAP LAMBERT, 2012).
44. 44. K. Itoh, N. Wakabayashi, Y. Katoh, et al., Genes
73. D. Del Rio, A. Rodriguez-Mateos, J. P. Spencer, et al.,
Cells 8, 379 (2003).
Antioxid. Redox Signal. 18 (14), 1818 (2013).
45. 45. Н. К. Зенков, Е. Б. Меньщикова и В. О. Ткачев,
74. T. G. Son, S. Camandola, and M. P. Mattson, Neuro-
Биохимия 78, 27 (2013).
molec. Med. 10 (4), 236 (2008).
46. M. Kobayashi, L. Li, N. Iwamoto, et al., Mol. Cell Bi-
75. A. J. Vargas and R. Burd, Nutr. Rev. 68 (7), 418 (2010).
ol. 29, 493 (2009).
76. V. Stepanic, A. C. Gasparovic, K. G. Troselj, et al.,
47. A. Cuadrado, G. Manda, A. Hassan, et al., Pharmacol.
Curr. Top. Med. Chem. 15 (5), 496 (2015).
Rev. 70, 348 (2018).
77. K. Sahin, M. Tuzcu, H. Gencoglu, et al., Life sci. 87
48. A. Cuadrado, A. I. Rojo, G. Wells, et al., Nat. Rev.
(7-8), 240 (2010).
Drug Discov. 18 (4), 295 (2019).
78. X. Du, J. Yu, X. Sun et al., Mol. Med. Rep. 17 (6), 7952
49. L. O. Klotz, C. Sánchez-Ramos, I. Prieto-Arroyo,
(2018).
et al., Redox biology 6, 51 (2015).
79. T. Yamamoto, S. Hsu, J. Lewis, et al., J. Pharmacol.
50. D. Samanta and G. L. Semenza, Redox Biol. 13, 331
Exp. Ther. 307 (1), 230 (2003).
(2017).
80. T. Nakazato, K. Ito, Y. Ikeda, et al., Clin. Cancer Res.
51. M. Yamamoto, T. W. Kensler, and H. Motohashi,
11 (16), 6040 (2005).
Physiol. Rev. 98 (3), 1169 (2018).
81. S. Qanungo, M. Das, S. Haldar, et al., Carcinogenesis
52. Е. Б. Меньщикова, В. О. Ткачев и Н. К. Зенков,
26 (5), 958 (2005).
Молекуляр. биология 44 (3), 389 (2010).
82. G. X. Li, Y. K. Chen, Z. Hou, et al., Carcinogenesis 31
53. S. Crunkhorn, Nat. Rev. Drug Discov. 11, 96 (2012).
(5), 902 (2010).
54. P. Deshmukh, S. Unni, G. Krishnappa, et al., Biophys.
83. C. Chen, G. Shen, V. Hebbar, et al., Carcinogenesis 24
Rev. 9 (1), 41 (2017).
(8), 1369 (2003).
55. M. C. Lu, J. A. Ji, Z. Y. Jiang, et al., Med. Res. Rev. 36,
84. M. Nihal, N. Ahmad, H. Mukhtar, et al., Int. J. Cancer
924 (2016).
114 (4), 513 (2005).
56. L. Saso and O. Firuzi, Curr. Drug Targets 15 (13), 1177
85. M. S. Baliga, S. Meleth, and S. K. Katiyar, Clin. Can-
(2014).
cer Res. 11 (5), 1918 (2005).
57. A. T. Dinkova-Kostova, J. W. Fahey, and P. Talalay,
86. Y. Zhang, W. Duan, L. Owusu, et al., Int. J. Mol. Med.
Methods Enzymol. 382, 423 (2004).
35 (1), 117 (2015).
58. X. J. Wang, J. D. Hayes, L. G. Higgins, et al., Chem.
87. E. Lecumberri, Y. M. Dupertuis, R. Miralbell, et al.,
Biology 17 (1), 75 (2010).
Clin. Nutrition 32 (6), 894 (2013).
59. С. Н. Черенкевич, Г. Г. Мартинович, И. В. Марти-
88. M. E. Stearns, M. D. Amatangelo, D. Varma, et al.,
нович и др., Изв. НАН Беларуси. Сер. биол. наук,
Am. J. Pathol. 177 (6), 3169 (2010).
№ 1, 92 (2013).
89. J. Qiao, C. Gu, W. Shang, et al., Food Chem. Toxicol.
60. I. I. C. Chio and D. A. Tuveson, Trends Mol. Medicine
49 (6), 1410 (2011).
23 (5), 411 (2017).
90. M. M. Chan, K. J. Soprano, K. Weinstein, et al., J. Cell
61. Г. Г. Мартинович, И. В. Мартинович и С. Н. Че-
Physiol. 207 (2), 389 (2006).
ренкевич, Биофизика 56 (3), 465 (2011).
91. T. C. Lee, I. C. Cheng, J. J. Shue, et al., Toxicol. Appl.
62. Г. Г. Мартинович, И. В. Мартинович, Е. Б. Мень-
Pharmacol. 250 (1), 69 (2011).
щикова и др., Докл. НАН Беларуси 59 (3), 82
92. B. Bannerman, L. Xu, M. Jones, et al., Cancer Chemo-
(2015).
ther. Pharmacol. 68 (5), 1145 (2011).
БИОФИЗИКА том 65
№ 6
2020
ХЕМОСЕНСИБИЛИЗАЦИЯ ОПУХОЛЕВЫХ КЛЕТОК
1091
93. J. T. Hwang, J. Ha, I. J. Park, et al., Cancer Lett. 247
123. K. Mortezaee, E. Salehi, H. Mirtavoos-Mahyari,
(1), 115 (2007).
et al., J. Cell Physiol. 234 (8), 12537 (2019).
94. J. D. Lambert and R. J. Elias, Arch. Biochem. Biophys.
124. Q. Chen, Y. Wang, K. Xu, et al., Oncol. Rep. 23 (2),
501 (1), 65 (2010).
397 (2010).
95. T. Enkhbat, M. Nishi, K. Yoshikawa, et al., Anticancer
125. Z. Chang, J. Xing, and X. Yu, Tumor Biol. 35 (1), 753
Res. 38 (11), 6247 (2018).
(2014).
96. B. Annabi, Y. T. Lee, C. Martel, et al., Cancer Biol.
126. J. Y. Kim, T. J. Cho, B. H. Woo, et al., Arch. Oral. Bi-
Ther. 2 (6), 642 (2003).
ol. 57, 1018 (2012).
97. W. Li, S. Nie, M. Xie, et al., J. Agric. Food Chem. 58
127. Y. J. Lee, N. Y. Kim, Y. A. Suh, et al., Korean J. Physi-
(16), 8977 (2010).
ol. Pharmacol. 15, 1 (2011).
98. J. Zheng, H. C. Lee, M. M. Bin Sattar, et al., Eur. J.
128. Y. Chen, E. McMillan-Ward, J. Kong, et al., J. Cell
Pharmacol. 652 (1-3), 82 (2011).
Sci. 120, 4155 (2007).
99. S. A. Khan, S. Priyamvada, W. Khan, et al., Pharmacol.
129. M. B. Azad, Y. Chen, and S. B. Gibson, Antioxid. Re-
Res. 60 (5), 382 (2009).
dox Signal. 11, 777 (2009).
100.N. C. Schmitt, E. W. Rubel, and N. M. Nathanson, J.
130. M. C. Maiuri, E. Zalckvar, A. Kimchi, et al., Nat. Rev.
Neurosci. 29 (12), 3843 (2009).
Mol. Cell Bio. 8 (9), 741 (2007).
101. N. Sriram, S. Kalayarasan, and G. Sudhandiran,
131. B. Chen, Y. Zhang, Y. Wang, et al., J. Steroid Bio-
Chem. Biol. Interact. 180 (2), 271 (2009).
chem. Mol. Biol. 143, 11 (2014).
102. N. Sriram, S. Kalayarasan, and G. Sudhandiran,
132. M. Mileo, D. Di Venere, S. Mardente, et al., Oxid.
Pulm. Pharmacol. Ther. 22 (3), 221 (2009).
Med. Cell. Longev. 2020 (3), 1 (2020).
103. S. Patel, A. Acharya, R. S. Ray, et al., Crit. Rev. Food
133. Q. Yao, X. Ye, L. Wang, et al., Int. J. Clin. Exp.
Sci. Nutr. 1, 1 (2019).
Pathol. 6, 2342 (2013).
104. B. Salehi, Z. Stojanović-Radić, J. Matejić, et al., Eur.
134. S. Palipoch, C. Punsawad, P. Koomhin, et al., Tract.
J. Med. Chem. 163, 527 (2019).
BMC Complement. Altern. Med. 14, 111 (2014).
105. J. Wu, Q. Li, X. Wang, et al., PLoS One 8, 59843
135. X. Chen, J. Wang, Z. Fu, et al., Sci. Rep. 7 (1), 17724
(2013).
(2017).
106. B. S. Vinod, T. T. Maliekal, and R. J. Anto, Antiox.
136. N. I. Said Salem, M. M. Noshy, and A. A. Said, Food
Redox Signal. 18 (11), 1307 (2013).
Chem. Toxicol. 105, 370 (2017).
107. E. Willenbacher, S. Z. Khan, S. C. A. Mujica, et al.,
137. M. Ashrafizadeh, Z. Ahmadi, R. Mohamamdinejad,
Int. J. Mol. Sci. 20 (8), 1808 (2019).
et al., Curr. Mol. Med. 20 (2), 116 (2020).
108. F. Thayyullathil, S. Chathoth, A. Hago, et al., Free
138. L. Das and M. Vinayak, PLoS One 10 (4), 1 (2015).
Radic. Biol. Med. 45, 1403 (2008).
139. Y. P. Shao, Q. Zhou, Y. P. Li, et al., Neurourol. Uro-
109. C. Syng-Ai, A. L. Kumari, and A. Khar, Mol. Cancer
dyn. 37 (8), 2470 (2018).
Ther. 3 (9), 1101 (2004).
140. C. K. Sing, M. A. Ndiaye, and N. Ahmad, Biochim.
110. P. Javvadi, A. T. Segan, S. W. Tuttle, et al., Mol. Phar-
Biophys. Acta - Mol. Basis Dis. 1852 (6), 1178 (2015).
macol. 73 (5), 1491 (2008).
141. F. Levi, C. Pasche, F. Lucchini, et al., Eur. J. Cancer
111. S. Lev-Ari, A. Vexler, A. Starr, et al., Cancer Invest.
Prev. 14 (2), 139 (2005).
25, 411 (2007).
142. M. Jang, L. Cai, G. O. Udeani, et al., Science 275
112. B. Kunnumakkara, P. Diagaradjane, P. Anand, et al.,
(5297), 218 (1997).
Int. J. Cancer 125, 2187 (2009).
143. C. H. Chang, C. Y. Lee, C. C. Lu, et al., Int. J. Oncol.
113. T. C. Hour, J. Chen, C. Y. Huang, et al., Prostate 51,
50 (3), 873 (2017).
211 (2002).
144. D. Martinez-Martinez, A. Soto, B. Gil-Araujo, et al.,
114. B. Du, L. Jiang, Q. Xia, et al., Chemotherapy 52, 23
Food Chem. Toxicol. 124, 273 (2019).
(2006).
115. M. A. Papież, W. Krzyściak, K. Szade, et al., Drug
145. L. J. Ma, W. P. Li, R. X. Wang, et al. Int. J. Oncol. 47
Des. Devel. Ther. 10, 557 (2016).
(4), 1460 (2015).
116. S. V. Bava, V. T. Puliappadamba, A. Deepti, et al., J.
146. F. F. Lang, Z. Y. Qin, F. Li, et al., PLOS One 10 (6), 1
Biol. Chem. 280, 6301 (2005).
(2015).
117. C. N. Sreekanth, S. V. Bava, E. Sreekumar, et al., On-
147. Y. Tian, W. Song, D. Li, et al., Onco Targets Ther. 12,
cogene 30, 3139 (2011).
8601 (2019).
118. B. H. Park, J. E. Lim, H. G. Jeon, et al., Oncotarget 7
148. L. Zhang, J. Li, J. Ma, et al., Oxid. Med. Cell. Longev.
(39), 63870 (2016).
2016, 1 (2016).
119. S. J. Chatterjee and S. Pandey, Cancer Biol. Ther. 11,
149. H. F. Liao, C. D. Kuo, Y. C. Yang, et al., J. Radiat.
216 (2011).
Res. 46 (4), 387 (2005).
120. Y. F. Huang, D. J. Zhu, X. W. Chen, et al., Oncotarget
150. H. Luo, L. Wang, B. A. Schulte, et al., Int. J. Oncol. 43
8 (25), 40264 (2017).
(6) 1999 (2013).
121. M. Cruz-Correa, D. A. Shoskes, P. Sanchez, et al.,
151. W. P. Li, Y. Shi, R. X. Wang, et al., Int. J. Oncol. 53
Clin. Gastroenterol. Hepatol. 4, 1035 (2006).
(5), 2123 (2018).
122. S. Fujisawa, T. Atsumi, M. Ishihara, et al., Anticancer
152. Leon-Galicia, J. Diaz-Chavez, M. E. Albino-San-
Res. 24, 563 (2004).
chez, et al., Oncol. Rep. 39 (6), 3025 (2018).
БИОФИЗИКА том 65
№ 6
2020
1092
МАРТИНОВИЧ и др.
153. S. K. Singh, S. Banerjee, E. P. Acosta, et al., Oncotar-
169. Z. Ungvari, Z. Bagi, A. Feher, et al., Am. J. Physiol.
get 8 (10), 17216 (2017).
Heart Circ. Physiol. 299 (1), H18 (2010).
154. S. H. Kweon, J. H. Song, and T. S. Kim, Biochem.
170. X. Zhou, Y. Zhao, J. Wang, et al., Biochem. Pharma-
Biophys. Res. Commun. 395 (1), 104 (2010).
col. 155, 252 (2018).
155. J. Díaz-Chávez, M. A. Fonseca-Sánchez, E. Arecha-
171. V. L. Truong, M. Jun, and W. S. Jeong, Biofactors 44
ga-Ocampo, et al., PLoS One 8, 1 (2013).
(1), 36 (2018).
156. A. R. Jazirehi and B. Bonavida, Mol. Cancer Ther. 3,
172. Н. К. Зенков, Е. Б. Меньщикова, Н. В. Кандалин-
71 (2004).
цева и др., Биохимия 72, 790 (2007).
157. Y. Chan, M. S. Phoo, M. V. Clement, et al., Cancer
173. E. Б. Меньщикова, В. О. Ткачев, Н. К. Зенков
Biol. Ther. 7, 1305 (2008).
и др., Бюл. эксперим. биологии и медицины 155,
344 (2013).
158. Mondal and L. L. Bennett, Biomed. Pharmacother.
84, 1906 (2016).
174. Е. Б. Меньщикова, Н. К. Зенков, А. Е. Лемза и др.,
Бюл. эксперим. биологии и медицины 155, 305
159. Q. Li, Y. Yue, L. Chen, et al., Front. Pharmacol. 9, 334
(2013).
(2018).
175. Н. Я. Вайсман, Е. Б. Меньщикова, Н. К. Зенков и
160. R. Popat, T. Plesner, F. Davies, et al., Br. J. Haematol.
др., Успехи геронтологии 24, 591 (2011).
160, 714 (2013).
176. Г. Г. Мартинович, И. В. Мартинович, А. В. Вче-
161. D. C. Liu, B. Z. He, L. D. Lin, et al., Drug Chem.
рашняя и др., Актуальные вопросы биологиче-
Toxicol. 42 (3), 328 (2019).
ской физики и химии 2 (1), 411 (2017).
162. E. Talero, J. Avila-Roman, and V. Motilva, Curr.
177. Г. Г. Мартинович, И. В. Мартинович, Н. К. Зен-
Pharm. Design. 18 (26), 3939 (2012).
ков и др., Биофизика 60 (1), 120 (2015).
163. Q. Du, B. Hu, H. M. An, et al., Oncol. Rep. 29 (5),
178. Т. Н. Богатыренко, Н. В. Кандалинцева, Т. Е. Са-
1851 (2013).
шенкова и др., Изв. РАН. Сер. Хим. 4, 700 (2018).
164. F. M. Santandreu, A. Valle, J. Oliver, et al., Cell.
179. Е. Б. Меньщикова, Н. К. Зенков, П. М. Кожин и
Physiol. Biochem., 28 (2), 219 (2011).
др., Бюл. эксперим. биологии и медицины 166
165. H. Luo, A. Yang, B. A. Schulte, et al., PLoS One 8 (3),
(11), 592 (2018).
1 (2013).
180. Е. Б. Меньщикова, А. В. Чечушков, П. М. Кожин
166. L. Cheng, B. Yan, K. Chen, et al., Oxid. Med. Cell.
и др., Цитология 60 (12), 1008 (2018).
Longev. 2018 (12), 1 (2018).
181. П. И. Гайнутдинов, П. М. Кожин, А. В. Чечушков
167. Mortezaee, M. Najafi, B. Farhood, et al., Curr. Can-
и др., Сиб. науч. мед. журн. 38 (1), 22 (2018).
cer Drug Targ. 20, 1 (2020).
182. Г. Г. Мартинович, И. В. Мартинович, А. В. Вче-
168. Q. Xiao, W. Zhu, W. Feng, et al., Front Pharmacol. 9,
рашняя и др., Актуальные вопросы биологиче-
1534 (2019).
ской физики и химии 4 (2), 253 (2019).
Chemosensibilization of Tumor Cells by Phenolic Antioxidants:
the Role of Transcription Factor Nrf2
G.G. Martinovich*, I.V. Martinovich*, A.V. Vcherashniaya*, N.K. Zenkov**,
E.B. Menshchikova**, and S.N. Cherenkevich*
*Belarusian State University, prosp. Nezavisimosti 4, Minsk, 220030, Republic of Belarus
**Federal Research Center for Fundamental and Translational Medicine, ul. Timakova 2, Novosibirsk, 630117 Russia
Pharmacological modification of the redox properties of tumor cells is a promising approach to enhance the
efficiency of antitumor therapy. Currently, the transcription factor Nrf2 is considered as a new target for the
development of selective chemosensitizers. Nrf2 plays a key role in regulation of cellular redox homeostasis
against stress and during adaptation processes. Many natural and synthetic phenolic antioxidants are inducers
of Nrf2 transcriptional activity. Due to differences in Nrf2 transcriptional activity between normal and tumor
cells, phenolic antioxidants at certain concentrations act as biological regulators the antioxidant activity of
which has two different effects: in tumor cells they promote the development of oxidative stress and enhance
the effect of antitumor drugs, in normal cells these antioxidants exhibit protective properties. The review dis-
cusses the possible molecular mechanisms of action and the prospects for the clinical use of natural and syn-
thetic phenolic antioxidants in antitumor therapy.
Keywords: phenolic antioxidants, reactive oxygen species, transcription factor Nrf2, tumor cells, antitumor thera-
py, chemosensitizers
БИОФИЗИКА том 65
№ 6
2020