БИОФИЗИКА, 2020, том 65, № 6, с. 1099-1106
БИОФИЗИКА КЛЕТКИ
УДК 57.088.1
АДАПТАЦИЯ МЕТОДА ИНТЕРФЕРОМЕТРИИ СЛОЯ БИОМОЛЕКУЛ
ДЛЯ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ СОДЕРЖАНИЯ ФАКТОРА РОСТА
ЭНДОТЕЛИЯ СОСУДОВ В КОНДИЦИОНИРОВАННОЙ
КЛЕТОЧНОЙ СРЕДЕ
© 2020 г. М.В. Волкова, В.В. Бояринцев, А.В. Трофименко, С.А. Бирюков,
Е.В. Горина, Г.И. Фильков, М.О. Дурыманов
*Московский физико-технический институт (национальный исследовательский университет),
141701, Долгопрудный Московской облаcти, Институтский пер., 9
E-mail: durymanov.mo@mipt.ru
Поступила в редакцию 12.08.2020 г.
После доработки 18.08.2020 г.
Принята к публикации 20.08.2020 г.
Количественное определение цитокинов, хемокинов, факторов роста и других растворимых белко-
вых молекул в различных биологических жидкостях является рутинной задачей современной диа-
гностики и биомедицины, однако существующие в настоящее время методы анализа включают в се-
бя несколько этапов и занимают продолжительное время. В работе представлен протокол, позволя-
ющий с помощью метода интерферометрии слоя биомолекул определить в течение нескольких
минут концентрацию аналита в пробе. В качестве модельной системы были использованы конди-
ционированные среды, полученные от мезенхимальных стволовых клеток мыши, выращенных
условиях нормоксии и гипоксии в виде монослоя, 3D-клеточных листов или в виде 3D-сфероидов,
в которых определяли концентрацию VEGF-A (фактора роста эндотелия сосудов). Метод показал
высокую чувствительность (как минимум 0.10 нг VEGF-A в мл). Полученные значения концентра-
ций VEGF-A в кондиционированных средах мезенхимальных стволовых клеток оказались близки к
величинам, определенным с помощью иммуноферментного анализа. С использованием интерфе-
рометрии слоя биомолекул было обнаружено достоверное увеличение продукции VEGF-A в 2.5-
3.0 раза сфероидами и клеточными листами мезенхимальных стволовых клеток по сравнению с
клетками, выращенными в монослое. Таким образом, разработанный протокол позволил адаптиро-
вать метод интерферометрии слоя биомолекул для быстрого количественного анализа факторов ро-
ста в кондиционированных средах.
Ключевые слова: интерферометрия слоя биомолекул, биосенсор, мезенхимальные стволовые клетки,
кондиционированная среда, 3D-культура клеток, фактор роста эндотелия сосудов.
DOI: 10.31857/S0006302920060083
этим происходит усовершенствование текущих
В настоящее время в современной диагности-
рутинных методов анализа, а также ведется разра-
ке и биомедицинских исследованиях существует
ботка новых.
ряд методов для оценки количественного содер-
жания растворимых белков в биологических жид-
Метод интерферометрии слоя биомолекул
костях. К таким подходам относят иммунофер-
(BLI, Bio-Layer Interferometry) появился относи-
ментный и мультиплексный анализы, а также ра-
тельно недавно и с успехом был использован для
диоиммунный метод. Как правило, процедура
количественной оценки взаимодействий «белок-
детекции с помощью этих способов занимает
нуклеиновая кислота» и «белок-белок» [1]. В
длительное время либо подразумевает примене-
данной технологии применяются оптоволокон-
ние дорогостоящего оборудования. В связи с
ные чипы, имеющие на конце оптический слой,
на внешней поверхности которого находится свя-
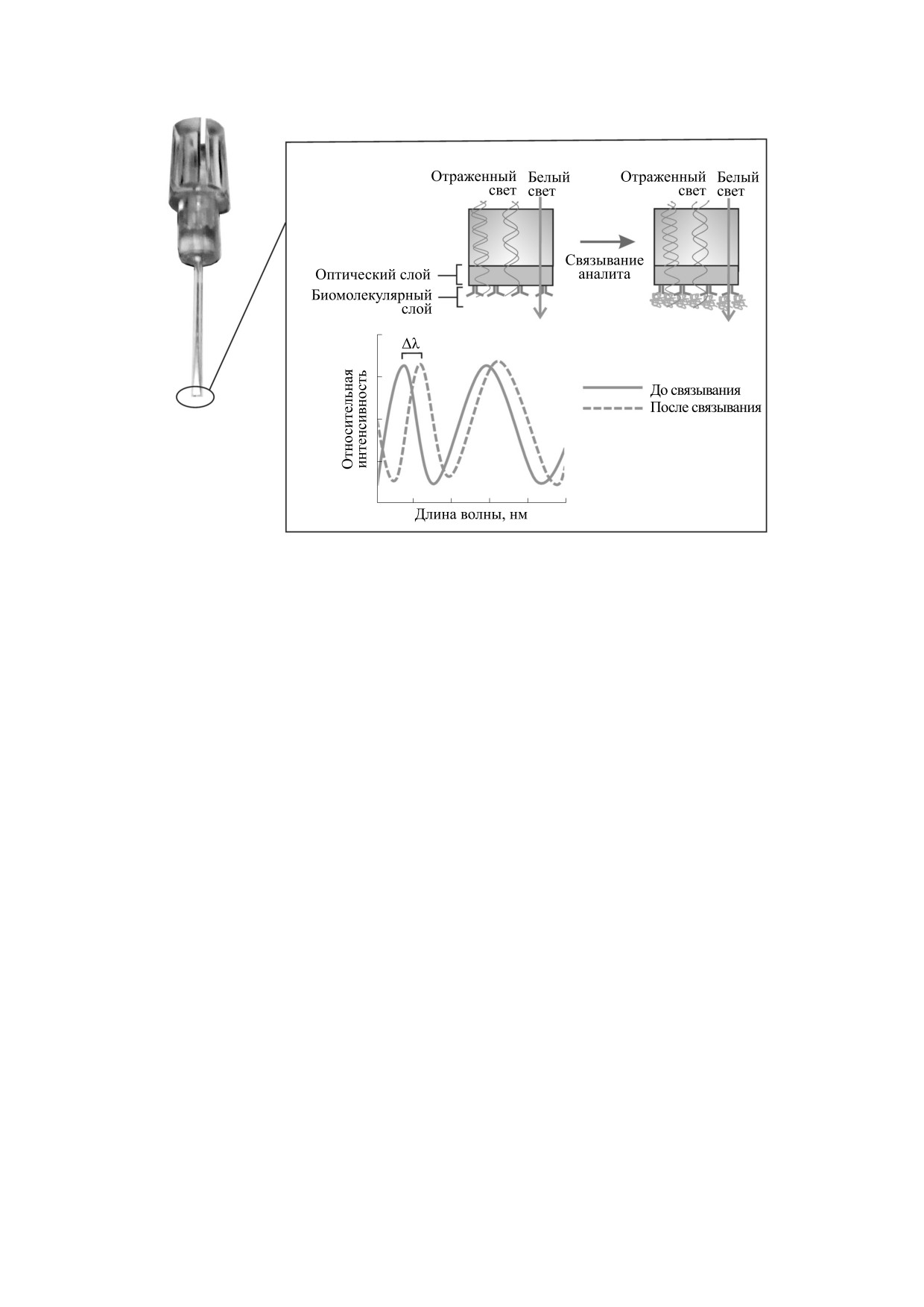
занный слой биомолекул (рис. 1). Принцип мето-
Сокращения: BLI - интерферометрия слоя биомолекул
(Bio-Layer Interferometry), BLItz - система регистрации да основан на регистрации пучков белого света,
интерферометрии слоя биомолекул, VEGF-A - фактор ро-
отраженных от внутренней границы раздела оп-
ста эндотелия сосудов A (Vascular Endothelial Growth Fac-
тического слоя и от биомолекулярного слоя. Дан-
tor A), МСК - мезенхимальные стволовые клетки, PBS -
ные пучки интерферируют между собой, в ре-
фосфатно-буферный раствор (Phosphate Buffer Solution).
1099
1100
ВОЛКОВА и др.
Рис. 1. Схема принципа метода BLI. Спектрометр регистрирует в реальном времени сдвиг интерферентного паттерна
(Δλ), величина которого возрастает пропорционально утолщению биомолекулярного слоя биосенсора в результате
связывания молекул аналита.
зультате чего получается характерный спектр,
аналитов к иммобилизованному на чипе белку
называемый интерферентным паттерном. При
или нуклеиновой кислоте [4, 7, 8].
связывании молекул аналита с иммобилизован-
В данной работе мы адаптировали метод BLI
ными на поверхности чипа лигандами толщина
для оценки количественного содержания факто-
биомолекулярного слоя увеличивается во време-
ров роста в биологических жидкостях. Разрабо-
ни в соответствии с кинетикой межмолекулярных
танный протокол позволил измерить содержание
взаимодействий. Изменение толщины биомоле-
фактора роста эндотелия сосудов (VEGF-A) в
кулярного слоя в результате связывания лиганда
кондиционированных средах от мезенхимальных
и аналита приводит к пропорциональному увели-
стволовых клеток в течение нескольких минут в
чению величины спектрального сдвига (Δλ) ин-
расчете на один образец.
терферентного паттерна, которая и регистрирует-
ся спектрометром в реальном времени [2].
МАТЕРИАЛЫ И МЕТОДЫ
Система регистрации интерферометрии слоя
биомолекул (BLItz) предполагает использование
Культивирование клеток. Мезенхимальные
оптоволоконных чипов, содержащих на своей по-
стволовые клетки (МСК), полученные согласно
верхности различные варианты молекул для им-
стандартному протоколу выделения из красного
мобилизации биомолекул, связывающих аналит,
костного мозга самцов мышей Balb/c (пос. Стол-
или для детекции аналита напрямую. Например,
бовая Московской области, Россия), выращива-
для присоединения аналитсвязывающих белков,
ли в среде DMEM (Gibco, США) с 10% бычьей
имеющих в своем составе His-tag, или нуклеино-
эмбриональной сыворотки (Gibco, США), заме-
вых кислот, помеченных биотином, могут быть
нимыми аминокислотами (Capricorn Scientific,
использованы чипы с покрытием из Ni-NTA [3]
Германия) и 50 мкг в мл гентамицина (Дальхим-
или стрептавидина [4] соответственно. Если ана-
фарм, Хабаровский край, Россия). Культивиро-
литом являются антитела, то для их детекции
вание МСК в условиях нормоксии проводили
можно применить чипы, покрытые протеином А
при 37°С в атмосфере 21% кислорода, 5% углекис-
или протеином G [1]. В подавляющем большин-
лого газа и влажности 95% в инкубаторе Smart
стве случаев система BLItz используется для
Biotherm (Biosan, Латвия). В условиях гипоксии
оценки кинетики связывания/диссоциации [5,
МСК содержали в мультигазовом инкубаторе
6], а также скрининга сродства макромолекул-
CB150 (Binder, Германия) при 37°С в атмосфере с
БИОФИЗИКА том 65
№ 6
2020
АДАПТАЦИЯ МЕТОДА ИНТЕРФЕРОМЕТРИИ СЛОЯ БИОМОЛЕКУЛ
1101
5% кислорода, 5% уклекислого газа и влажности
начальной базовой линии, а затем перемещали в
95%.
каплю стокового раствора антитела против
VEGF-A мыши (ab52917, Abcam, США) с концен-
3D-культуры мезенхимальных стволовых кле-
трацией 0.296 мг в мл на 120 с (рис. 2). После за-
ток. Сфероиды МСК выращивали в агарозных
грузки биосенсор перемещали на 60 с в PBS и еще
вставках, полученных с использованием Micro-
на 60 с в некондиционированную питательную
Tissues 3D Petri dish micromolds (Z764019, Sigma
среду для отмывки сенсора от неспецифически
Aldrich, США). В агарозные вставки вносили по
связанных антител и регистрации новой базовой
150 мкл среды, содержащей 16000 клеток. Культи-
линии. С целью измерения биосенсор помещали
вирование сфероидов осуществляли в условиях
в каплю с исследуемой кондиционированной
нормоксии в течение четырех суток. Для получе-
средой на 60 с. После получения профилей свя-
ния листов из МСК клетки высеивали на шести-
зывания Δλ(t) была определена площадь под кри-
луночные пленшеты в количестве 300000 клеток
вой в течение измеряемого временного интер-
на лунку и инкубировали до достижения моно-
вала:
слоя. После этого питательную среду заменяли на
среду аналогичного состава, дополнительно со-
t2=60
держащую аскорбиновую кислоту (PanReac, Ис-
S
sample
=
Δλ
t)dt,
dt
=
0.2 с.
пания) в концентрации 50 мкг/мл, и культивиро-
1
t
=0
вали еще в течение семи суток.
Для построения калибровочного графика вме-
Получение кондиционированных сред. Для по-
сто исследуемой кондиционированной среды ис-
лучения кондиционированных сред от МСК,
пользовали стандарты VEGF-A в питательной
культивируемых в условиях гипоксии с 5% кисло-
среде с концентрациями 0.1, 1.0, 10, 100 и 1000 нг
рода или в условиях нормоксии с 21% кислорода,
в мл. Процесс ассоциации антител с белком в ка-
клетки высеивали на шестилуночные планшеты в
либровочных растворах проводили последова-
количестве 250000 клеток на лунку в 1 мл среды.
тельно от меньшей концентрации к большей, с
Спустя сутки клеткам меняли среду, а затем инку-
инкубацией на каждом шаге длительностью 60 с,
бировали в течение 48 ч. После этого среды отби-
после чего определяли величины площадей под
рали, замораживали и хранили при -20°С. Для
кривыми связывания S0.1, S1.0, S10, S100 и S1000 со-
получения кондиционированных сред от сферои-
ответственно. Таким образом, калибровочный
дов МСК их извлекали из агарозной подложки и
график определял зависимость площади под кри-
переносили в 96-луночный планшет в количестве
вой связывания от концентрации VEGF-A и был
20-30 штук на лунку. Культивирование сферои-
использован для определения содержания анали-
дов в планшете проводили в 100 мкл питательной
та в экспериментальных образцах.
среды в течение 48 ч, после чего питательные сре-
ды отбирали. Листы МСК инкубировали в тече-
Значения констант ka и kd были получены с по-
ние 48 ч в 1 мл среды, а затем брали ее для анализа.
мощью аппроксимации кривых связывания и
Для правильной оценки секреторной активности
диссоциации одноэкспоненциальной функцией,
3D-культур МСК по сравнению с клетками, вы-
выполненной в автоматическом режиме с помо-
ращенными в монослое, важно было нормиро-
щью программного обеспечения прибора BLItz
вать измеренные величины концентраций
Pro 1.3 (ForteBio, Pall Life Sciences, NY). Значения
VEGF-A на объем среды и тотальный клеточный
КD были определены из соотношений kd/ka.
белок. Концентрацию белка определяли методом
Бредфорда в лизатах, полученных из МСК в мо-
нослое, в сфероидах и в листах. В качестве лизи-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
рующего буфера применяли 0.2 мМ ЭДТА (VWR
Для определения содержания фактора роста
international LLC, West Chester, США) и 0.1% три-
эндотелия сосудов VEGF-A в кондиционирован-
тон X-100 (VWR international LLC, West Chester,
ных средах от МСК мыши были использованы
США) в фосфатно-буферном растворе (PBS),
оптоволоконные чипы с конъюгированным про-
pH 7.4.
теином А. Этот белок бактериального происхож-
Изучение секреции VEGF-A с использованием
дения обладает высокой природной аффинно-
метода BLI. Концентрацию VEGF-A определяли
стью к Fc-доменам тяжелых цепей иммунногло-
с помощью прибора BLItz Pro (ForteBio, Pall Life
булинов типа G (IgG) человека, мыши, кролика и
Sciences, США), для чего использовали оптоволо-
некоторых других млекопитающих [9]. В класси-
конные биосенсоры с конъюгированным протеи-
ческом приложении данные чипы применяются
ном A. Все измерения проводили после предва-
для прямого количественного определения со-
рительного выдерживания чипов в фосфатном
держания антител в очищенных препаратах или
буфере в течение как минимум 10 мин (этап гид-
биологических жидкостях [10]. Разработаный на-
ратации). Биосенсор устанавливали в прибор, по-
ми протокол предполагает иммобилизацию оди-
гружали в пробирку с PBS на 30 с для регистрации
накового количества антител против VEGF-A на
БИОФИЗИКА том 65
№ 6
2020
1102
ВОЛКОВА и др.
Рис. 2. Схема протокола определения концентрации растворенного фактора роста VEGF-A методом BLI. Протокол
включает пять этапов: 1 - регистрация начальной базовой линии (в PBS); 2 - загрузка биосенсора с протеином А
антителами против VEGF-A (стоковый раствор антител); 3 - отмывка биосенсора от слабо связавшихся антител и
определение новой базовой линии (сначала в PBS, затем - в среде с сывороткой); 4 - детекция VEGF-A в образце (в
кондиционированной среде с сывороткой); 5 - отмывка от VEGF-A (в среде с сывороткой).
несколько биосенсоров. Один из чипов использу-
пов сопровождалась частичной диссоциацией
ется для детекции возрастающей и известной
связавшихся антител (рис. 3б), что позволило
концентрации VEGF-A в некондиционирован-
оценить эффективную константу диссоциации
ной среде с целью построения калибровочного
KD, которая составила 7.5 ⋅ 10-7 М (таблица). Ин-
графика. С помощью других чипов проводят из-
тересно отметить, что протеин А имеет четыре до-
мерения в опытных образцах, применяя один чип
мена для связывания с IgG, и его взаимодействие
для одного измерения и последующего определе-
с иммуноглобулинами описывается сложной ки-
ния концентрации VEGF-A по калибровке. На
нетикой. Величина KD, отражающая силу его вза-
рис. 2 представлена общая схема последователь-
имодействия с Fc-регионами, снижается при уве-
ности протокола детекции VEGF-A и соответ-
личении концентрации антител, варьируя в пре-
ствующие каждому этапу изменения значений
сдвига интерференционного паттерна Δλ во вре-
делах от 10-10 до 10-6 М [11]. Полученное в нашем
мени.
случае относительно высокое значение эффек-
тивной константы диссоциации можно объяс-
Первичная загрузка биосенсоров с протеином
нить высокой концентрацией стокового раствора
А антителами продемонстрировала одинаковую
антител, которая составила 0.296 мг/мл.
кинетику связывания с выходом на плато в преде-
лах очень близких значений (рис. 3а), что свиде-
Как отмечалось выше, один из биосенсоров
тельствует об однородности загрузки чипов анти-
был использован для построения калибровочного
телами против VEGF-A мыши. После процедуры
графика зависимости спектрального сдвига ин-
загрузки чипы переносили в фосфатный буфер,
терференционного паттерна от количества
где они инкубировались до начала измерений
связавшегося аналита, т.е. VEGF-A. Каждое по-
концентрации VEGF-A в образцах. Отмывка чи-
следовательное погружение связанного с антите-
БИОФИЗИКА том 65
№ 6
2020
АДАПТАЦИЯ МЕТОДА ИНТЕРФЕРОМЕТРИИ СЛОЯ БИОМОЛЕКУЛ
1103
лами чипа в среды с увеличивающейся концен-
трацией VEGF-A приводило к связыванию до-
полнительного количества ростового фактора, о
чем говорит выход кривой изменения спектраль-
ного сдвига на новый более высокий стационар-
ный уровень. По значениям площади под кривой
кинетики связывания был построен калибровоч-
ный график (рис. 4). Для валидации полученной
калибровки были проведены измерения в средах,
содержащих известные концентрации VEGF-A
мыши. В результате полученные площади под
кривой связывания оказывались близкими к ка-
либровочным значениям, а полученные констан-
ты связывания, диссоциации и равновесия соот-
ветствовали значениям, описывающим кинетику
взаимодействия антитело-антиген (таблица).
В качестве модельной системы нами были ис-
пользованы кондиционированные среды, ото-
бранные из культур мезенхимальных стволовых
клеток мыши. Применение МСК и их производ-
ных в регенеративной медицине является пер-
спективным подходом для лечения повреждений
костной ткани, инфаркта миокарда, ожогов и ме-
ханических ран [12, 13]. Значительный вклад в
минимизацию повреждений тканей, вызванных
воспалением, вносит паракринная активность
Рис. 3. Первичная загрузка биосенсоров с протеином
А антителами против VEGF-A мыши. Профили свя-
МСК, которая выражается в продукции антивос-
зывания четырех биосенсоров с антителами (а) и вид
палительных молекул и цитокинов, включая про-
типичной кривой связывания-диссоциации (б).
стогландин Е2 (PGE2) и интерлейкин 10 (IL-10),
а также факторов роста, например, инсулинопо-
добного ростового фактора (IGF-1), фактора ро-
ченных от МСК при культивировании в атмосфе-
ста фибробластов (FGF-2), фактора роста эндо-
ре с нормальным содержанием кислорода, а так-
телия сосудов (VEGF) и других [14, 15]. Следует
же в атмосфере с 5% кислорода. Оказалось, что в
отметить, что на паракринную активность МСК
условиях гипоксии содержание VEGF-A в средах
огромное влияние оказывают условия культиви-
от МСК мыши возрастает, хотя полученные раз-
рования и внешнее молекулярное окружение.
личия не являются статистически значимыми
Одним из таких факторов является гипоксия, ко-
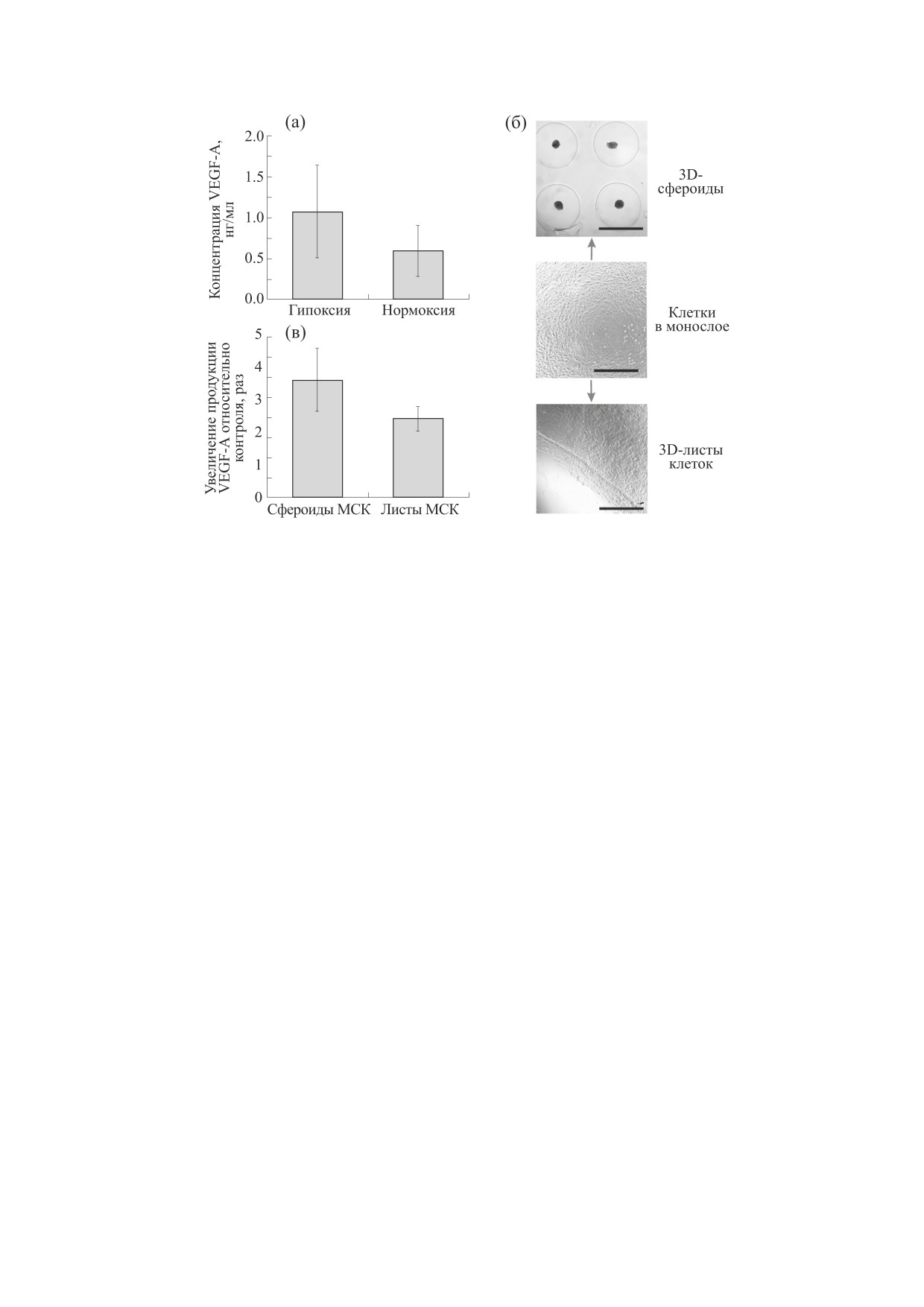
(рис. 5а). Полученные значения концентрации
торая характерна для тканей при различных пато-
VEGF-A согласно калибровочному графику со-
логиях, сопровождающихся воспалением. Гипо-
ставили порядка 0.5-1.0 нг/мл, что по порядку
ксия наряду с провоспалительными цитокинами
величины совпадает с концентрациями, измерен-
стимулирует МСК к повышенной продукции раз-
ными в похожих условиях для кондиционирован-
личных молекул, в том числе VEGF-A. В свою
ных сред от мышиных МСК с помощью иммуно-
очередь, VEGF-A способствует васкуляризации
ферментного анализа [16].
поврежденной ткани, что необходимо для ее за-
Метод BLI также позволил сравнить экспрес-
живления.
сию VEGF-A в средах от МСК, выращенных в мо-
В условиях культивирования МСК ex vivo су-
нослое в условиях нормоксии (контроль) и в со-
ществует несколько способов обеспечить условия
ставе 3D-культур, включая сфероиды и листы.
гипоксии и тем самым увеличить продукцию
Полученные сфероиды МСК были выращены в
VEGF-A и других факторов роста. Во-первых,
агарозных вставках и имели диаметр 140 ± 40 мкм
можно культивировать клетки в условиях пони-
(среднее значение ± стандартное отклонение).
женного содержания кислорода в атмосфере в
Листы МСК были получены в шестилуночных
специальном инкубаторе. Во-вторых, можно вы-
планшетах и имели толщину в два-три слоя кле-
растить МСК в виде 3D-культур, например сфе-
ток (рис. 5б). Для правильной оценки получен-
роидов, представляющих собой тканеподобные
ные величины концентраций VEGF-A были до-
агрегаты клеток и содержащие включения вне-
полнительно нормированы на белок и на объем
клеточного матрикса, а также клеточных листов,
среды. Результаты измерений продемонстриро-
состоящих из нескольких слоев МСК. Сначала
вали увеличение экспрессии VEGF-A в 3D-куль-
мы с помощью метода BLI оценили экспрессию
турах в 2.5-3.0 раза по сравнению с монослоем
VEGF-A в кондиционированных средах, полу-
МСК, хотя между собой показатели для сферои-
БИОФИЗИКА том 65
№ 6
2020
1104
ВОЛКОВА и др.
Рис. 4. Построение калибровочного графика и определение аналита в пробе. (а) - Кривые связывания загруженного ан-
тителами биосенсора возрастающих концентраций VEGF-A в калибровочных растворах, содержащих 0.1, 1.0, 10, 100 и
1000 нг VEGF-A в мл среды с сывороткой. (б) - Вид калибровочного графика, в котором значения величины связывания
(S) соответствуют площади под кривой связывания в растворе с определенной концентрацией VEGF-A. (в) - Типичный
вид кривой связывания загруженного антителами биосенсора с VEGF-A в образце с кондиционированной средой.
дов и листов статистически значимо не отлича-
рой находится измеряемый аналит. В нашем слу-
лись (рис. 5в). Иммуноферментный анализ также
чае чипы с протеином А могут применяться для
ранее показал увеличение экспрессии VEGF-A
детекции VEGF-A мыши в кондиционированной
МСК в составе сфероидов по сравнению с МСК в
среде, содержащей телячью сыворотку, но не мо-
монослое в несколько раз [17].
гут быть использованы для определения VEGF-A
человека в его плазме, поскольку она помимо
Таким образом, с помощью метода интерфе-
VEGF-A содержит иммуноглобулины субтипов
рометрии слоя биомолекул можно оценивать
G1, G2 и G4, обладающих высоким сродством к
концентрации растворимых белков в кондицио-
протеину А [9]. Наконец, несмотря на высокую
нированных средах как при работе с клетками в
чувствительность метода, его погрешность будет
монослое, так и в 3D-культурах клеток. Следует
увеличиваться при уменьшении количества ана-
отметить, что при адаптации метода BLI к кон-
лита в образце, что будет создавать сложности с
кретному аналиту следует принимать во внима-
определением белковых молекул в очень малых
ние несколько факторов. Во-первых, используе-
мые антитела должны обладать высоким
концентрациях (менее 100 пг/мл). Тем не менее
не исключено, что уменьшить ошибку вполне
сродством к выбранному чипу. Например, имму-
ноглобулины коровы будут слабо связываться с
возможно при использовании других биосенсо-
чипами с протеином А, а потому более целесооб-
ров, например аминореактивных, к которым
разным является использование антител кроли-
можно ковалентно присоединять любые молеку-
ка, обладающим гораздо более высоким срод-
лы, содержащие аминогруппы. Главным несо-
ством к протеину А [9]. Во-вторых, стоит брать в
мненным плюсом метода BLI является его быст-
расчет и состав биологической жидкости, в кото-
рота и простота, что при наличии калибровочно-
Кинетические константы связывания и диссоциации, измеренные методом BLI
Межмолекулярные
ka, M-1 c-1
KD, M
kd, c-1
взаимодействия
Протеин А - IgG
1.449 ⋅ 104
1.087 ⋅ 10-2
7.506 ⋅ 10-7
IgG - VEGF-A
4.285 ⋅ 104
<10-7
<10-12
БИОФИЗИКА том 65
№ 6
2020
АДАПТАЦИЯ МЕТОДА ИНТЕРФЕРОМЕТРИИ СЛОЯ БИОМОЛЕКУЛ
1105
Рис. 5. Определение концентрации VEGF-A в кондиционированных средах от МСК мыши, выращенных в различных
условиях. (а) - Сравнение уровня VEGF-A в средах от МСК, выращенных в монослое в условиях нормоксии (21%
кислорода) и гипоксии (5% кислорода). (б) - Изображения МСК мыши в монослое, а также производных 3D-культур
на основе МСК, включая сфероиды и клеточные листы. Масштабный отрезок соответствует 800 мкм. (в) - Увеличение
экспрессии VEGF-A 3D-клеточными культурами на основе МСК мыши по сравнению с клетками, выращенными в
монослое в условиях нормоксии (контроль). Измерения для диаграмм (а) и (в) были проведены в трех повторах;
величины представлены как среднее ± стандартное отклонение.
го графика позволяет оценить концентрацию
КОНФЛИКТ ИНТЕРЕСОВ
аналита в образце за несколько минут.
Авторы заявляют об отсутствии конфликта
интересов.
В работе была продемонстрирована возмож-
ность использования метода интерферометрии
слоя биомолекул для количественной оценки
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
фактора роста эндотелия сосудов в биологиче-
ских жидкостях. Возможности этого подхода бы-
Настоящая работа не содержит описания ис-
ли показаны на примере анализа кондициониро-
следований с использованием людей и животных
ванных сред от культур МСК, выращенных в мо-
в качестве объектов.
нослое, а также в виде 3D-сфероидов и клеточных
листов. Чувствительность адаптированного мето-
СПИСОК ЛИТЕРАТУРЫ
да BLI составила для VEGF-A как минимум 100
пг/мл. Несмотря на ограничения этого способа
1. A. Sultana and J. E. Lee, Cur. Protocols Prot. Sci. 79,
детекции, его основным преимуществом служит
19 (2015).
быстрота и простота проведения анализа.
2. C. W. Meyerhofer and D. Yao, in Label-Free Technolo-
gies for Drug Discovery (Wiley, 2011).
3. W.-H. Lua, S. K.-E. Gan, D. P. Lane, and C. S. Verma,
Npj Breast Cancer 1, 1 (2015).
ФИНАНСИРОВАНИЕ РАБОТЫ
4. C. J. Weeramange, M. S. Fairlamb, D. Singh, et al.,
Работа выполнена при поддержке гранта в
Prot. Sci. 29, 1004 (2020).
форме субсидии по соглашению от 28.10.2018 г.
5. M. Groner, T. Ng, W. Wang, and A. K. Udit, Anal. Bio-
№14.575.21.0179 (уникальный идентификатор
anal. Chem. 407, 5843 (2015).
проекта RFMEFI57518X0179), заключенному
6. W. A. Lea, P. T. O’Neil, A. J. Machen, et al., Biochem-
между Министерством науки и высшего образо-
istry 55, 4885 (2016).
вания Российской Федерации и Московским фи-
7. H. Müller-Esparza, M. Osorio-Valeriano, N. Steube,
зико-техническим институтом.
et al., Front. Mol. Biosci. 7 (2020).
БИОФИЗИКА том 65
№ 6
2020
1106
ВОЛКОВА и др.
8. Y. Wang, E. E. Dzakah, Y. Kang, et al., Anal. Bioanal.
13. P. Bianco, X. Cao, P.S. Frenette, et al., Nature Med.
Chem. 411, 5499 (2019).
19, 35 (2013).
9. S. Hober, K. Nord, and M. Linhult, J. Chromatogra-
14. Y. Shi, Y. Wang, and Q. Li, Nature Rev. Nephrol. 14,
phy B 848, 40 (2007).
493 (2018).
10. C. H. Goey, D. Bell, and C. Kontoravdi, MAbs. 10, 476
15. M. J. Fontaine, H. Shih, and R. Schäfer, Transfus.
(2018).
Med. Rev. 30, 37 (2016).
11. J. T. Nelson, S. Kim, N. F. Reuel, et al., Anal. Chem.
16. L. Chen, Y. Xu, J. Zhao, et al., PLoS One 9 (2014).
87, 8186 (2015).
17. I. A. Potapova, G. R. Gaudette, and P. R. Brink, Stem
12. Y. Han, X. Li, Y. Zhang, et al., Cells 8, 886 (2019).
Cells 25, 1761 (2007).
Adaptation of Bio-Layer Interferometry for Quantification of Vascular Endothelial
Growth Factor in Cell-Conditioned Culture Media
М.V. Volkova, V.V. Boyarintsev, А.V. Тrofimenkо, S.А. Biryukov, Е.V. Gorinа,
G.I. Filkov, and М.О. Durymanov
Moscow Institute of Physics and Technology (National Research University),
Institutsky per. 9, Dolgoprudny, Moscow Region, 141701 Russia
Quantitative analysis of cytokines, chemokines, growth factors and other soluble proteins in different biolog-
ical liquids is routinely performed in contemporary diagnostics and biomedicine research. However, current
methods of analysis are time-consuming and include multiple steps. In this study, we have developed a pro-
tocol that describes how bio-layer interferometry can be applied to quantify an analyte in several minutes.
Conditioned growth media collected from mouse mesenchymal stem cells grown in normoxia or hypoxic
conditions in a monolayer fashion, MSC-derived 3D cell sheets and 3D spheroids were used as a model sys-
tem in which we determined a concentration of vascular endothelial growth factor (VEGF-A). This technique
displayed a high sensitivity (down to 0.1 ng of VEGF-A per mL as a minimum). The measured concentrations
of VEGF-A in the conditioned media from mesenchymal stem cells turned out to be similar with values de-
termined by the enzyme-linked immunosorbent assay. Using bio-layer interferometry, it was shown that as
compared to mesenchymal stem cells grown in monolayer, spheroids and 3D sheets of mesenchymal stem
cells produce significantly more VEGF-A (by 2.5-3.0-fold). Thus, due to the developed protocol it was pos-
sible to adapt bio-layer interferometry for rapid quantification of growth factors in conditioned media.
Keywords: bio-layer interferometry, biosensor, mesenchymal stem cells, conditioned media, 3D cell culture, vas-
cular endothelilal growth factor
БИОФИЗИКА том 65
№ 6
2020