БИОФИЗИКА, 2020, том 65, № 6, с. 1118-1125
БИОФИЗИКА КЛЕТКИ
УДК 576.52
ИНТЕРНАЛИЗАЦИЯ КЛЕТКАМИ И ПРОТИВООПУХОЛЕВАЯ
АКТИВНОСТЬ АНТИТЕЛ И ИММУНОТОКСИНОВ,
СПЕЦИФИЧНЫХ К -ИЗОФОРМЕ БЕЛКА ТЕПЛОВОГО ШОКА 90
© 2020 г. М.А. Жмурина, В.В. Врублевская, Ю.Ю. Скарга, В.С. Петренко,
В.К. Жалимов, О.С. Моренков
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
E-mail: mariya100694@gmail.com
Поступила в редакцию 15.07.2020 г.
После доработки 20.07.2020 г.
Принята к публикации 24.07.2020 г.
Показано, что мышиные моноклональные антитела к Hsp90β (β-изоформа белка теплового шока
90) специфически связываются с Hsp90β, локализованным на поверхности опухолевых и нетранс-
формированных клеток. После связывания с мембрано-ассоциированным Hsp90β антитела актив-
но диссоциировали в культуральную среду, а также интернализовались клетками. Иммуноконъюгат
на основе Hsp90β-специфического антитела и цитотоксического агента мертанзина не обладал вы-
сокой цитотоксической активностью для опухолевых клеток in vitro. Введение Hsp90β-специфиче-
ских антител мышам не влияло на рост первичной опухоли эпидермоидной карциномы Льюиса, в
то время как метастазирование опухоли в легкие снижалось и увеличивалась средняя продолжи-
тельность жизни мышей. Полученные результаты свидетельствуют об определенном терапевтиче-
ском потенциале антител к Hsp90β для лечения опухолевых заболеваний.
Ключевые слова: экстраклеточный Hsp90β, моноклональные антитела, иммунотоксины, интернализа-
ция антител клетками, эпидермоидная карцинома Льюиса, метастазирование.
DOI: 10.31857/S0006302920060113
внеклеточном пространстве и в форме Hsp90, ас-
Белок теплового шока 90 (Hsp90) является
социированного с плазматической клеточной
белком-шапероном и участвует в фолдинге вновь
мембраной [5-7]. eHsp90 играет важную роль в
синтезированных белков, сборке мультимолеку-
обеспечении миграции и инвазии нормальных и
лярных комплексов, деградации белков, предот-
опухолевых клеток, а также в процессах метаста-
вращает агрегацию и денатурацию белков при
зирования опухолевых клеток [5-15]. В сравне-
различных видах стресса [1]. Выявлено более
нии с нормальными клетками в опухолевых клет-
200 внутриклеточных белков-клиентов Hsp90,
ках существенно повышена мембранная экспрес-
участвующих в клетках в трансдукции сигналов,
сия и секреция Hsp90, при этом уровень Hsp90 на
внутриклеточной сигнализации, транскрипции,
плазматической мембране коррелирует с мета-
регуляции экспрессии генов и т.д. [2, 3]. Суще-
статическим потенциалом клеток [11, 16]. Пока-
ствуют две изоформы Hsp90: Hsp90α (индуци-
зано, что поверхностно-ассоциированный Hsp90
бельная форма) и Hsp90β (конститутивная фор-
активно интернализуется опухолевыми клетками
ма). Уровень гомологии двух изоформ Hsp90 со-
in vitro и в организме животных [17].
ставляет 86%, однако имеются существенные
различия в их биохимических свойствах, экс-
Важная роль eHsp90 в обеспечении инвазии и
прессии и функционировании [4].
метастазирования опухолевых клеток [5-15], а
Кроме выполнения внутриклеточных функ-
также выраженная экспрессия Hsp90 на мембра-
ций Hsp90 обнаруживается вне клетки (экстрак-
не опухолевых клеток [11, 16] делают его перспек-
леточный Hsp90 - eHsp90) в свободной форме во
тивной молекулярной мишенью для создания
противоопухолевых препаратов. Показано, что
Сокращения: Hsp90 - белок теплового шока 90, eHsp90 - ингибирование eHsp90 с помощью специфиче-
экстраклеточный Hsp90, ДМЕМ - среда Игла в модифи-
ских антител, а также с помощью непроникаю-
кации Дальбекко, ЭБС - эмбриональная бычья сыворот-
ка, ИФА - иммуноферментный анализ, ФСБР - фосфат-
щих в клетку низкомолекулярных ингибиторов
но-солевой буферный раствор.
Hsp90 приводило к снижению миграции опухоле-
1118
ИНТЕРНАЛИЗАЦИЯ КЛЕТКАМИ И ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ АНТИТЕЛ
1119
вых клеток in vitro и ингибированию метастазиро-
(Пущино Московской обл.). Клетки выращивали
вания опухолей у животных [6, 18-22]. Очевидно,
в среде ДМЕМ, содержащей 10% эмбриональной
что ингибиторы eHsp90, в том числе и Hsp90-спе-
бычьей сыворотки и антибиотики (по 40 Ед пени-
цифичекие антитела, имеют значительный по-
циллина, стрептомицина и гентамицина)
тенциал для создания на их основе противоопу-
(ДМЕМ-ЭБС).
холевых препаратов антиметастатического
Очистка антител и конъюгирование с DM1. По-
действия. Кроме этого, так как повышенная мем-
лученные в лаборатории культур клеток и клеточ-
бранная экспрессия и интернализация eHsp90
ной инженерии ИБК РАН мышиные монокло-
является феноменом, характерным для опухоле-
нальные антитела к Hsp90 (клон 1D5/A7, матери-
вых клеток in vitro и in vivo [11, 16, 17], eHsp90 мо-
алы готовятся к публикации) и контрольные
гут рассматриваться в качестве опухолеспецифи-
антитела против gB вируса болезни Ауески (клон
ческих мишеней для иммунотоксических
34/2) [23] очищали из асцитной жидкости с помо-
препаратов, селективно связывающихся с опухо-
щью ионообменной хроматографии, как описано
левыми клетками и поражающих их. К настояще-
ранее [24]. Очищенные антитела 1D5/A7 и 34/2
му времени продемонстрирована активность
конъюгировали с цитотоксическим соединением
Hsp90α-специфических антител в ингибирова-
мертанзин (DM1) с использованием гетероби-
нии метастазирования опухолей у мышей [20, 21].
функционального агента Sulfo-SMCC [25]. Для
Противоопухолевая активность антител, направ-
проведения экспериментов на клеточных культу-
ленных к Hsp90β изоформе, к настоящему време-
рах препараты очищенных антител и конъюгатов
ни не исследована. Также не исследован потен-
антител с мертанзином диализовали против боль-
циал Hsp90-специфических антител для создания
шого объема среды ДМЕМ в течение двух суток
цитотоксических противоопухолевых препара-
(три смены среды ДМЕМ) и стерилизовали филь-
тов. В данной работе мы показали, что иммуно-
трацией через фильтры Durapor (Millipore, США)
токсины на основе Hsp90β-специфических анти-
с диаметром пор 0.22 мкм.
тел и мертанзина (DM1) обладают слабой
цитотоксической активностью in vitro в отноше-
Оценка связывания антител с клетками, их ин-
нии опухолевых клеток, что, вероятно, связано с
тернализации клетками и диссоциации в культу-
активной диссоциацией антител с поверхности
ральную среду. Для оценки связывания антител с
клеток и медленной интернализацией антител
клетками, клетки выращивали до состояния мо-
клетками. На модели мышиной эпидермоидной
нослоя, промывали холодным фосфатно-соле-
карциномы Льюиса продемонстрирована проти-
вым буферным раствором (ФСБР), содержащим
воопухолевая активность Hsp90β-специфических
азид натрия (ФСБР-NaN3), и инкубировали с ан-
антител в части снижения метастазирования опу-
тителами (1D5/A7 или 34/2) в концентрации
холи и увеличения времени жизни мышей с при-
5 мкг/мл в течение 1 ч при температуре 4°С. По-
витой опухолью.
сле инкубации клетки тщательно отмывали
холодным ФСБР-NaN3, лизировали в 0.5%-м
растворе тритона Х-100 и определяли в лизатах
МАТЕРИАЛЫ И МЕТОДЫ
содержание антител с помощью иммунофермент-
Материалы и реактивы. В работе использовали
ного анализа (ИФА), как описано ниже. Для
среду Игла в модификации Дальбекко (ДМЕМ) и
оценки диссоциации антител, связавшихся с кле-
эмбриональную сыворотку коров (ЭБС) произ-
точной поверхностью, клетки обрабатывали ан-
водства GE Healthcare (США), растворы версена
тителами (5 мкг/мл) в среде ДМЕМ при 4°С в те-
и трипсина производства ООО «БиолоТ» (Санкт-
чение 1 ч. После тщательной отмывки холодной
Петербург), антитела к IgG мышей («Имтек»,
средой к клеткам добавляли культуральную среду
Москва), пероксидазные конъюгаты антител
ДМЕМ-ЭБС и инкубировали при 4°С или 37°С в
против IgG мышей (Biorad, США). Общелабора-
течение 2 ч с последующей оценкой содержания
торная пластиковая посуда и пластиковая посуда
антител в культуральной среде (диссоциирован-
для культивирования клеток были производства
ные антитела) и в клеточных лизатах (клеточно-
компаний Greiner и Corning (США). Все осталь-
ассоциированные антитела) с помощью ИФА.
ные химические реактивы приобретали в компа-
Для оценки интернализации антител клетками,
нии Sigma (США).
клетки инкубировали в течение 4 ч при 37°С в
Клеточные линии. Были использованы клеточ-
присутствии в культуральной среде антител
ные линии фибросаркомы человека HT1080 и
(5 мкг/мл), отмывали и определяли количество
глиобластомы человека А-172 из коллекции кле-
клеточно-ассоциированных антител с помощью
точных культур Института цитологии РАН
ИФА. Для определения количества интернализо-
(Санкт-Петербург). Клетки фибробластов сирий-
ванных клетками антител мембрано-ассоцииро-
ского хомяка ВНК-21, зеленой мартышки Vero и
ванные антитела удаляли посредством обработки
эпидермоидной карциномы Льюиса (LLC) полу-
раствором 0.1 М цитрата натрия (рН 3.0) в тече-
чали из коллекции клеточных культур ИБК РАН
ние 2 мин при комнатной температуре с последу-
БИОФИЗИКА том 65
№ 6
2020
1120
ЖМУРИНА и др.
зию клеток карциномы Льюиса LLC, выращен-
ных in vitro, центрифугировали, разводили в среде
ДМЕМ до концентрации 1 ⋅ 107 кл./мл и вводили
сингенным мышам линии C57BL/6 (шесть-во-
семь недель, самки массой 18-20 г). В работе ис-
пользовали мышей линии C57BL/6, полученных
из Питомника животных ИБХ РАН (Пущино
Московской обл.). Введение опухолевых клеток
осуществляли в объеме 100 мкл (1 ⋅ 106 кл./мышь)
подкожно в боковую область животного.
Стерильные диализованные против ФСБР анти-
тела вводили внутрибрюшинно на протяжении
11 суток, начиная с первых суток после введения
опухолевых клеток. Дозы введения антител: пер-
вая инъекция - 2 мг/мышь, последующие инъек-
ции - 1 мг/мышь. Контрольной группе подопыт-
Рис. 1. Оценка связывания Hsp90β-специфического
антитела 1D5/A7 с клетками. За 100% принимали
ных животных вводили контрольные антитела
связывание антител 1D5/A7 с клетками А-172; 34/2 -
34/2 по той же схеме. Экспериментальная и кон-
негативное антитело.
трольная группы состояли из 15 мышей при оцен-
ке метастазирования и из 20 мышей при оценке
продолжительности жизни мышей и размеров
ющим анализом внутриклеточных антител с по-
мощью ИФА.
первичной опухоли. Измерения длины (Д) и ши-
рины (Ш) опухоли проводили с помощью штан-
Определение содержания антител 1D5/A7 в кле-
генциркуля ежесуточно, начиная с девятых суток.
точных лизатах и культуральной среде. Для опре-
Объем опухоли рассчитывали по формуле:
деления содержания антител 1D5/A7 в лизатах
V = (1/2) × Д × Ш2. В этих же экспериментах
клеток и культуральной среде 96-луночные план-
определяли влияние антител на среднюю продол-
шеты сенсибилизировали аффинно-очищенны-
жительность жизни животных. В экспериментах
ми козьими антителами против IgG мыши (Им-
по оценке метастазирования на 21-е сутки роста
тек) и блокировали неспецифическую сорбцию в
карциномы животным проводили цервикальную
ФСБР, содержащем 0.1% твин-20 и 5% сыворотки
дислокацию, извлекали легкие и определяли ко-
крупного рогатого скота (ФСБР-Т-КРС). Иссле-
личество окрашенных метастазов на поверхности
дуемые лизаты клеток и культуральную среду тит-
легких.
ровали в ФСБР-Т-КРС и инкубировали в лунках
в течение 1 ч при 37°С. Для построения калибро-
Статистическая обработка. Каждый экспери-
вочной кривой использовали очищенный препа-
мент проводили не менее трех раз. Каждая точка
рат антител 1D5/A7 с известной концентрацией.
представляет собой среднее арифметическое зна-
После промывки в лунки вносили пероксидаз-
чение повторов ± стандартное отклонение. Ста-
ный конъюгат против IgG мыши, адсорбирован-
тистическую обработку полученных результатов
ный иммуноглобулинами человека, и инкубиро-
проводили с использованием t-теста Стьюдента.
вали планшеты в течение 1 ч при 37°С. Лунки
промывали, проявляли реакцию с помощью ор-
РЕЗУЛЬТАТЫ
то-фенилендиамина, определяли оптическую
плотность при 490 нм (ОП490) и рассчитывали
В работе исследовали полученные в ИБК РАН
концентрацию антител в образцах.
моноклональные мышиные антитела 1D5/A7, на-
правленные к β-изоформе Hsp90 (материалы го-
Определение цитотоксичности конъюгатов ан-
товятся к печати). Количественную оценку свя-
тител с DM1. Стерильные диализованные препа-
зывания антитела 1D5/A7 с клеточной поверхно-
раты иммуноконъюгатов антител 1D5/A7 и 34/2 с
стью
проводили
с
помощью ИФА,
DM1 разводили до необходимых концентраций в
определяющего содержание антител в образцах.
среде ДМЕМ-ЭБС. Определение цитотоксично-
При 4°С, в условиях блокирования процесса ин-
сти препаратов антител и иммунотоксических
тернализации антител клетками, антитела
конъюгатов проводили на клетках A-172, HT1080,
1D5/A7 эффективно и специфически связыва-
ВНК-21 и Vero с помощью МТТ-метода, как опи-
лись с клетками опухолевых линий А-172 и
сано ранее [26]. IC50 рассчитывали как мини-
НТ1080, а также нетрансформированных клеточ-
мальную концентрацию иммуноконъюгата, вы-
ных линий ВНК-21 и Vero (рис. 1).
зывающую гибель 50% клеток за 72 ч.
Для оценки интернализации антител клетками
Определение противоопухолевой активности
в условиях постоянного присутствия антител в
препаратов антител 1D5/A7 на животных. Суспен-
среде клетки инкубировали с антителами в среде
БИОФИЗИКА том 65
№ 6
2020
ИНТЕРНАЛИЗАЦИЯ КЛЕТКАМИ И ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ АНТИТЕЛ
1121
Рис. 2. Оценка интернализации антител 1D5/A7 клет-
ками в условиях постоянного присутствия антител в
культуральной среде. За 100% принимали суммарное
количество антител 1D5/A7 (мембрано-ассоцииро-
ванные и интернализованные антитела) в клетках
НТ1080.
Рис. 3. Оценка диссоциации в культуральную среду
антител 1D5/A7, связавшихся с поверхностью клеток.
Антитела инкубировали с клетками в течение 1 ч при
4°С. После тщательной отмывки клетки инкубирова-
ДМЕМ-ЭБС при 37°С в течение 4 ч, после чего
ли в среде в течение 2 ч при 4°С или при 37°С. Оцени-
оценивали количество антител, ассоциирован-
вали количество клеточно-ассоциированных (Ка-
ных с клетками, включая количество интернали-
1D5/A7) и диссоциированных от клеточной поверх-
ности (Д-1D5/A7) антител.
зованных антител (обработка клеток «кислым»
буферным раствором приводила к удалению с по-
верхности клеток антител, что позволяло диффе-
Далее мы оценили потенциал Hsp90β-специ-
ренцировать мембрано-ассоциированные и ин-
фических антител 1D5/A7 для создания иммуно-
тернализованные антитела). Результаты пред-
токсинов. Антитела конъюгировали с широко ис-
ставлены на рис. 2. В условиях постоянного
пользуемым токсическим агентом мертанзином
присутствия антител в среде антитела 1D5/A7 ин-
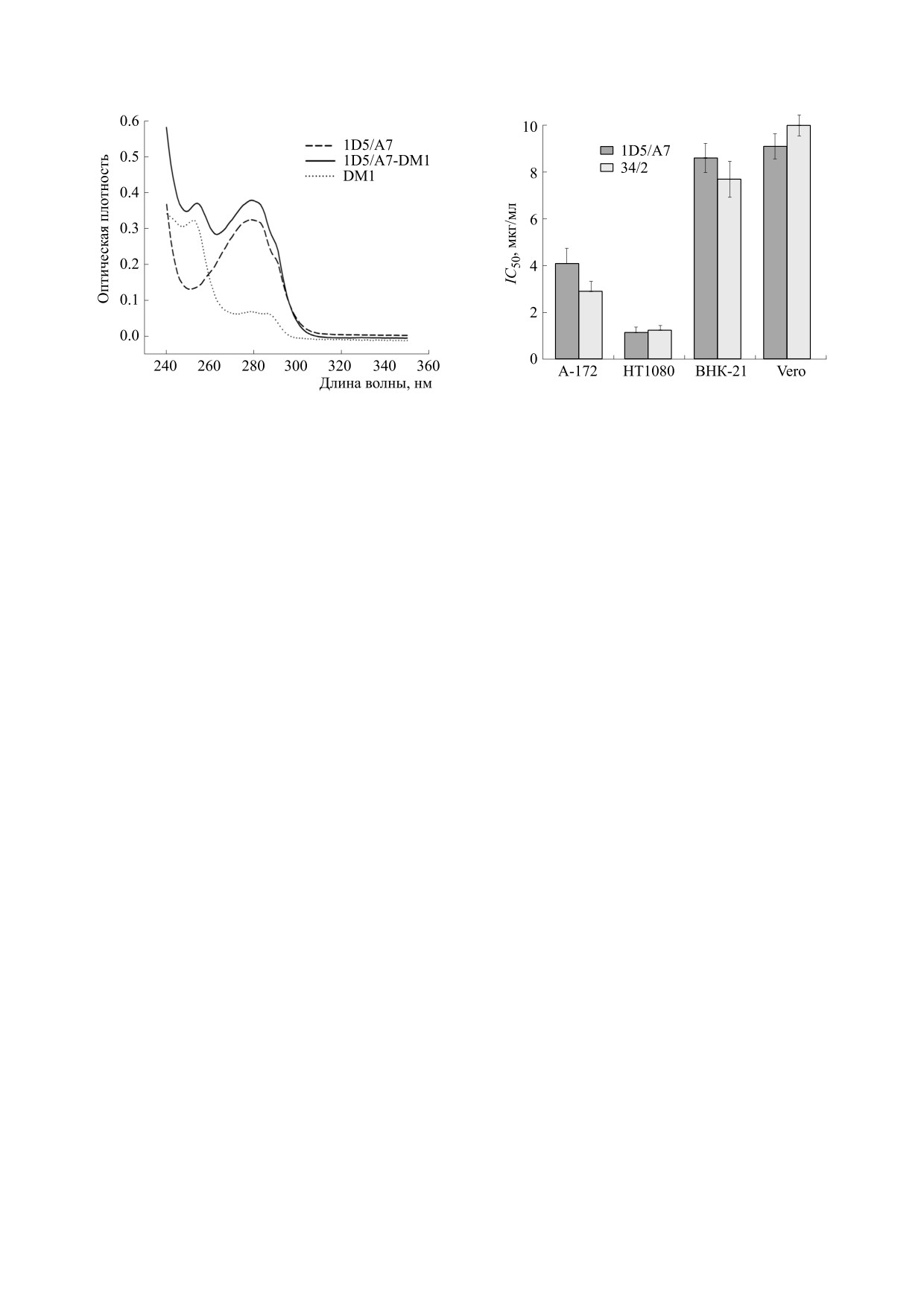
(DM1). Спектры полученного конъюгата 1D5A7
тернализовались опухолевыми клетками А-172 и
представлены на рис. 4. Наличие дополнитель-
НТ1080, интернализация антитела неопухолевы-
ных пиков на спектре конъюгатов с пиком погло-
ми клетками ВНК-21 и Vero была снижена в два-
щения 250 нм свидетельствовало о пришивке
четыре раза в сравнении с опухолевыми клетка-
DM1 к антителу.
ми. Следует отметить, что негативное антитело
34/2 также эффективно интернализовалось клет-
Полученный иммуноконъюгат 1D5/A7-DM1
ками: уровень интернализации негативного ан-
взаимодействовал с нативным бычьим Hsp90 в
титела был лишь в полтора раза ниже по сравне-
ИФА, что свидетельствовало о сохранении актив-
ности антител в составе иммуноконъюгата. Конъ-
нию с антителами 1D5/A7.
югат 1D5/A7-DM1 обладал токсичностью в отно-
Для оценки диссоциации в культуральную
шении клеток, однако концентрация, вызываю-
среду мембрано-ассоциированных антител
щая 50%-ю гибель клеток (IC50), для опухолевых
1D5/A7 клетки инкубировали с антителами при
линий А-172 и НТ1080 была довольно высокой и
4°С в течение 1 ч в условиях блокирования эндо-
составляла 1-4 мкг/мл (рис. 5). IC50 для иммуно-
цитоза/пиноцитоза. Далее клетки промывали
конъюгата контрольного антитела 34/2 была со-
средой и инкубировали в среде без антител при
поставима с иммуноконъюгатом антитела
4°С или 37°С в течение 2 ч, оценивая количество
1D5/A7, что согласуется с данными по сопостави-
клеточно-ассоциированных антител и антител,
мой эффективности интернализации антитела
диссоциированных в среду с поверхности клеток.
1D5/A7 и контрольного антитела 34/2. Цитоток-
Оказалось, что за 2 ч инкубации клеток при 37°С
сичность иммуноконъюгата
1D5/A7-DM1 для
значительная часть антител, связанных с Hsp90β
опухолевых клеток была в два-пять раз выше, чем
(более 80%), диссоциировала от поверхности кле-
для клеток нетрансформированных линий; ги-
ток и переходила в среду (рис. 3). Диссоциация
бель опухолевых клеток НТ1080 и А-172 наблюда-
антител (комплексов антитело-Hsp90β) в среду
лась при более низких концентрациях иммуно-
при инкубации при 4°С также наблюдалась, но в
конъюгатов, чем для клеток ВНК-21 и Vero
меньшей степени (рис. 3).
(рис. 5).
БИОФИЗИКА том 65
№ 6
2020
1122
ЖМУРИНА и др.
Рис. 4. Оценка пришивки мертанзина к монокло-
Рис. 5. Цитотоксичность иммуноконъюгата 1D5/A7-
нальному антителу 1D5/A7.
DM1 на линиях опухолевых и неопухолевых клеток.
В целом полученные данные свидетельствова-
вый потенциал Hsp90β-специфических антител
ли о невысокой эффективности иммунотоксинов
(клон 1D5/A7), полученных в ИБК РАН. При
на основе Hsp90β-специфического антитела
этом оценивали противоопухолевую активность
1D5/A7. С учетом полученных результатов мы по-
1D5/A7 как в форме очищенного антитела, так и
считали нецелесообразным проведение экспери-
в форме иммунотоксина.
ментов на животных для оценки активности им-
В основе цитотоксического действия иммуно-
мунотоксина 1D5/A7-DM1, так как необходи-
токсинов лежит их специфическое связывание с
мость поддержания высоких концентраций
поверхностью клеток и интернализация клетка-
конъюгата неизбежно приводит к высокой общей
ми, что приводит к высвобождению цитотоксина
токсичности препарата для животных.
внутри клетки и их гибели. Мы обнаружили, что
Связывание антител с опухолевыми клетками
антитело 1D5/A7 специфически связывалось как
может запускать врожденные иммунные эффек-
с опухолевыми клетками А-172 и НТ1080, так и с
торные механизмы [27-30], приводящие к эли-
нетрансформированными клетками ВНК-21 и
минации или торможению развития опухолевых
Vero, и интернализовались клетками. При этом
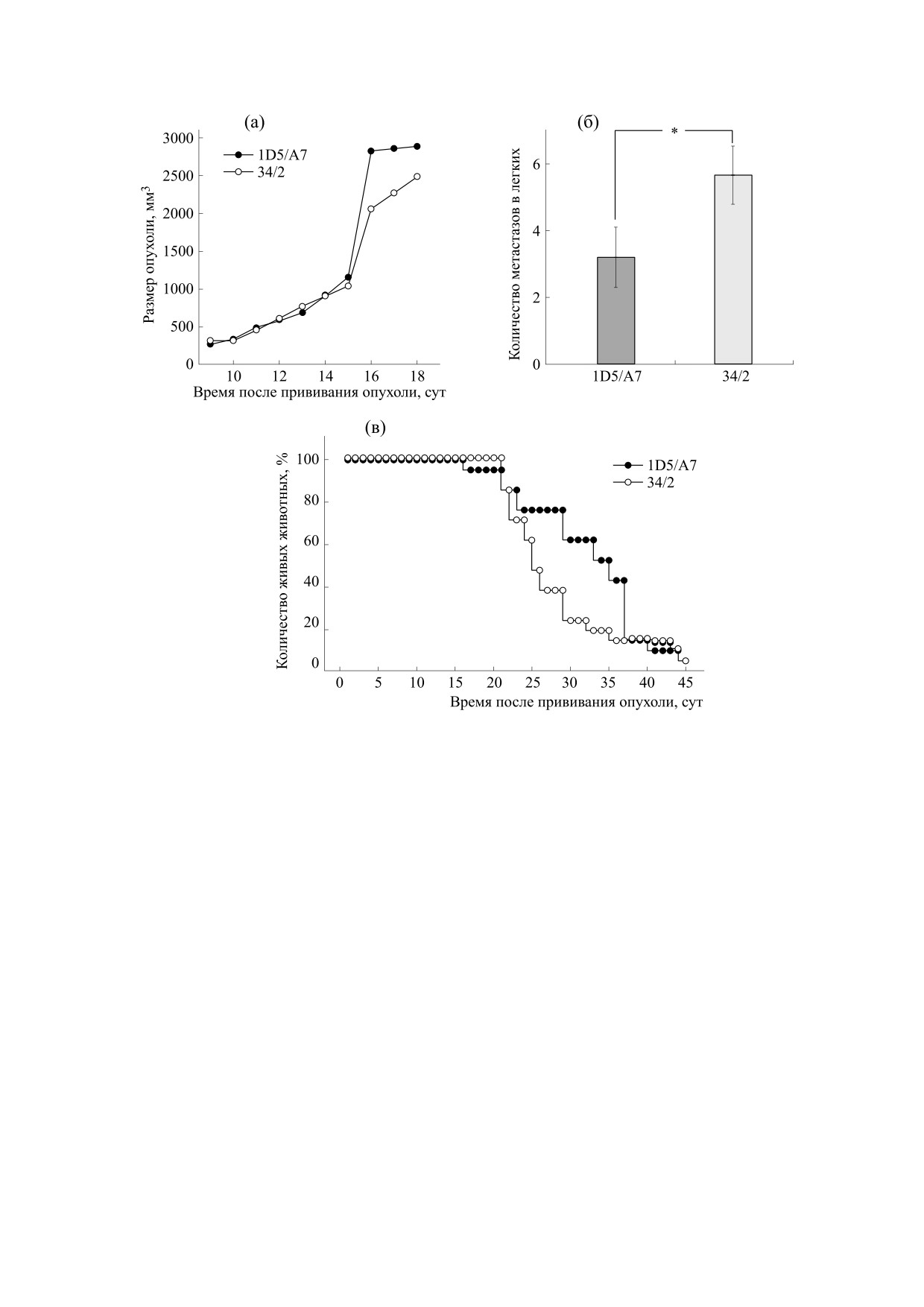
клеток. С учетом этого, мы оценили влияние ан-
эффективность интернализации антител опухо-
титела 1D5/A7 на рост первичной опухоли, мета-
левыми клетками А-172 и НТ1080 была в два-че-
стазирование и выживаемость мышей на модели
тыре раза выше в сравнении с нетрансформиро-
метастазирующей эпидермоидной карциномы
ванными клетками ВНК-21 и Vero. Следует отме-
легких Льюиса. Введение антитела 1D5/A7 жи-
тить, что интернализация контрольных антител
вотным не влияло на процесс развития первич-
34/2, которые не связываются с клетками, была
ной опухоли, однако снижало примерно в два ра-
сопоставима с Hsp90β-специфическими антите-
за метастазирование опухоли в легкие и увеличи-
лами 1D5/A7. Это свидетельствовало в пользу то-
вало на 16% среднюю продолжительность жизни
го, что рецептор-зависимая интернализация ком-
животных после введения опухоли (рис. 6).
плексов «антитело-Hsp90β» клетками была мед-
ленной и незначительно превалировала над
неспецифическим захватом антител клетками
ОБСУЖДЕНИЕ
посредством пиноцитоза. Ранее было также про-
Hsp90 экспрессируется на мембране опухоле-
демонстрировано, что Hsp90α-специфические
вых клеток и играет важную роль в инвазии и
антитела 4C5 после связывания с поверхностным
метастазировании опухолевых клеток [8-13, 16].
Hsp90 практически не интернализовались клет-
Ингибирование eHsp90 с помощью Hsp90α-спе-
ками [21], что согласуется с нашими данными. С
цифических антител приводило к замедлению
другой стороны, известно, что поверхностно-ас-
миграции опухолевых клеток in vitro и снижению
социированный Hsp90 активно интернализуется
метастазирования опухолей у животных [19-21],
опухолевыми клетками [17]. Возможно, что свя-
что свидетельствует о потенциале Hsp90-специ-
зывание антитела с поверхностно-ассоциирован-
фических антител в качестве противоопухолевых
ным Hsp90 замедляет его интернализацию. Кро-
препаратов антиметастатического действия. В
ме медленной интернализации Hsp90β-специфи-
данной работе мы исследовали противоопухоле-
ческих антител мы обнаружили, что после их
БИОФИЗИКА том 65
№ 6
2020
ИНТЕРНАЛИЗАЦИЯ КЛЕТКАМИ И ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ АНТИТЕЛ
1123
Рис. 6. Влияние введения антитела 1D5/A7 мышам с привитой карциномой Льюиса на рост первичной опухоли (а),
метастазирование в легкие (б) и выживаемость животных (в); * - p < 0.05.
связывания с мембрано-ассоциированным
антитела 1D5/A7 были сопоставимы, что согласо-
Hsp90β значительная часть антител быстро дис-
вывалось с данными по сопоставимой эффектив-
социировала от поверхности клеток в культураль-
ности интернализации антитела 1D5/A7 и кон-
ную среду; при этом скорость диссоциации анти-
трольного антитела 34/2. В целом полученные
тел значительно превышала скорость их интерна-
данные свидетельствовали о невысокой эффек-
лизации клетками.
тивности иммунотоксинов на основе Hsp90β-
специфического антитела 1D5/A7: для достиже-
Для оценки возможности использовать анти-
ния цитотоксического эффекта необходимы вы-
тело 1D5/A7 для создания иммунотоксинов анти-
сокие концентрации иммуноконъюгатов, что, ве-
тела конъюгировали с известным токсическим
агентом мертанзином (DM1). Мертанзин взаимо-
роятно, связано с активной диссоциацией ком-
действует с тубулином в месте связывания ризок-
плексов антител с Hsp90β с поверхности клеток и
сина, тем самым ингибируя сборку микротрубо-
не слишком высокой скоростью интернализации
чек, что приводит к деградации последних и на-
антител, связавшихся с мембрано-ассоциирован-
рушению митоза
[31]. Мы показали, что
ным Hsp90β. С учетом этого обстоятельства мы не
полученный конъюгат 1D5/A7-DM1 обладал не-
исследовали иммуноконъюгат 1D5/A7-DM1 на
высокой токсичностью в отношении опухолевых
животных, так как высокие концентрации имму-
клеток: IC50 для линий А-172 и НТ1080 составляла
ноконъюгата 1D5/A7-DM1 неизбежно приведут к
1-4 мкг/мл. При этом IC50 для иммуноконъюгата
высокой токсичности препарата при введении
контрольного антитела 34/2 и иммуноконъюгата
животным.
БИОФИЗИКА том 65
№ 6
2020
1124
ЖМУРИНА и др.
Известно, что связывание антител с белками,
C57BL/6 с привитой опухолью карциномы Льюи-
экспрессирующимися на поверхности опухоле-
са рост первичной опухоли не замедлялся, в то
вых клеток, может запускать врожденные иммун-
время как метастазирование опухолевых клеток в
ные эффекторные механизмы [27-30]. Антитела
легкие снижалось и увеличивалось среднее время
класса G способны активировать антителозави-
жизни мышей. Полученные результаты свиде-
симую клеточную цитотоксичность посредством
тельствуют о терапевтическом потенциале анти-
связывания иммунных эффекторных клеток
тел, специфичных к Hsp90β, для лечения опухо-
(NK-клетки и др.) через Fc-γ-рецепторы, распо-
левых заболеваний.
ложенные на поверхности эффекторных клеток,
с Fc-фрагментом опухолеспецифических анти-
СПИСОК ЛИТЕРАТУРЫ
тел; после связывания эффекторные клетки вы-
зывают лизис опухолевых клеток, используя раз-
1. J. Li and J. Buchner, Biomed. J. 36, 106 (2013).
личные механизмы
[32]. Ассоциированные с
2. P. C. Echeverria, A. Bernthaler, P. Dupuis, et al., PLoS
клетками антитела также способны активировать
One 6, 26044 (2011).
классический путь активации комплемента по-
3. D. Picard, Cell. Mol. Life Sci. 59 (10), 1640 (2002).
средством связывания комплекса белков компле-
4. A. S. Sreedhar, E. Kalmar, P. Csermely, and Y. F. Shen,
мента с Fc-фрагментом антитела; формирование
FEBS Lett. 562, 11 (2004).
такого комплекса приводит в конечном счете к
клеточному лизису и фагоцитозу [33, 34]. С уче-
5. W. Li, Y. Li, S. Guan, et al., EMBO J. 26, 1221 (2007).
том вышесказанного мы провели оценку проти-
6. S. Tsutsumi, K. Beebe, and L. Neckers, Future Oncol.
воопухолевой активности Hsp90β-специфиче-
5, 679 (2009).
ского антитела 1D5/A7 на модели эпидермоид-
7. X. Wang, X. Song, W. Zhuo, et al., Proc. Natl. Acad.
ной карциномы Льюиса - опухоли мышей с
Sci. USA 106, 21288 (2009).
относительно быстрым развитием, дающей выра-
8. J. S. Chen, Y. M. Hsu, C. C. Chen, et al., J. Biol.
женные метастазы в легкие животных [35]. При
Chem. 285, 25458 (2010).
многократном введении мышам антитело 1D5/A7
9. C. F. Cheng, J. Fan, M. Fedesco, et al., Mol. Cell. Biol.
не влияло на процесс развития первичной опухо-
28, 3344 (2008).
ли, что согласуется с данными, полученными с
другими экстраклеточными ингибиторами Hsp90
10. U. Gopal, J. E. Bohonowych, C. Lema-Tome, et al.,
[6, 18-22]. С другой стороны, введение Hsp90β-
PLoS One 6, 17649 (2011).
специфического антитела мышам снижало мета-
11. M. W. Hance, K. Dole, U. Gopal, et al., J. Biol. Chem.
стазирование опухоли в легкие и увеличивало
287 (45), 37732 (2012).
среднее время жизни животных. Ранее было по-
12. P. Jayaprakash, H. Dong, M. Zou, et al., J. Cell Sci.
казано, что антитела к Hsp90α-изоформе суще-
128, 1475 (2015).
ственно ингибировали метастазирование опухо-
13. F. Tsen, A. Bhatia, K. O’Brien, et al., Mol. Cell Biol.
лей у мышей [20, 21], что согласуется с нашими
33, 4947 (2013).
данными. Ингибирующий эффект Hsp90β-спе-
14. S. Tsutsumi, B. Scroggins, F. Koga, et al., Oncogene
цифического антитела 1D5/A7 вероятнее всего
27,
2478
(2008).15. D. Thuringer, A. Hammann,
связан с торможением миграции и инвазии опу-
N. Benikhlef, et al., J. Biol. Chem. 286, 3418 (2011).
холевых клеток, что приводит к снижению мета-
стазирования клеток. Необходимы дальнейшие
15. D. Thuringer, A. Hammann, N. Benikhlef, et al., J.
исследования антиметастатической активности
Biol. Chem. 286, 3418 (2011).
Hsp90α- и Hsp90β-специфических антител на
16. B. Becker, G. Multhoff, B. Farkas, et al., Experim.
различных моделях опухолей животных и челове-
Dermatology 13, 27 (2004).
ка.
17. L. B. Crowe, P. F. Hughes, D. A. Alcorta, et al., ACS
Chem. Biol. 12, 1047 (2017).
18. B. K. Eustace, T. Sakurai, J. K. Stewart, et al., Nat. Cell
ВЫВОДЫ
Biol. 6, 507 (2004).
Моноклональные антитела 1D5/A7, направ-
19. K. Sidera, M. Gaitanou, D. Stellas, et al., J. Biol.
ленные к белку теплового шока Hsp90β, эффек-
Chem. 283, 2031 (2008).
тивно связывались с Hsp90β, ассоциированным с
20. D. Stellas, A. El Hamidieh, and E. Patsavoudi, BMC
поверхностью клеток опухолевых и нетрансфор-
Cell Biol. 11, 51 (2010).
мированных культур. Связавшиеся с клетками
21. D. Stellas, A. Karameris, and E. Patsavoudi, Clin.
антитела активно диссоциировали в культураль-
Cancer Res. 13 (6), 1831 (2007).
ную среду и интернализовались клетками. Конъ-
югат на основе Hsp90β-специфического антитела
22. J. McCready, D. S. Wong, J.A. Burlison, et al., Cancers
и цитотоксического агента мертанзина не обла-
(Basel) 6, 1031 (2014).
дал высокой цитотоксической активностью. При
23. M. M. Zaripov, O. S. Morenkov, B. Siklodi, et al., Res.
многократном введении антитела 1D5/A7 мышам
Virol. 149, 29 (1998).
БИОФИЗИКА том 65
№ 6
2020
ИНТЕРНАЛИЗАЦИЯ КЛЕТКАМИ И ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ АНТИТЕЛ
1125
24. M. Oppermann, in Monoclonal antibodies, Ed. by
29. C. W. Shuptrine, R. Surana, and L. M. Weiner, Semin.
J. P. Peters and H. Baumgarten (Springer-Verlag, Ber-
Cancer Biol. 22, 3 (2012).
lin, Heidelberg, 1992), pp. 271-275.
30. L. M. Weiner, J. C. Murray, and C. W. Shuptrine, Cell
148, 1081 (2012).
25. A. G. Polson, S.-F. Yu, K. Elkins, et al., Blood 110 (2),
616 (2007).
31. M. Lopus, Cancer Lett. 307, (2011).
32. T. Kubota, R. Niwa, M. Satoh, et al., Cancer Sci. 100,
26. A. Lisov, V. Vrublevskaya, Z. Lisova, et al., Viruses 7
1566 (2009).
(10), 5343 (2015).
33. J. R. Dunkelberger and W. C. Song, Cell. Res. 20, 34
27. T. Ben-Kasus, B. Schechter, M. Sela, and Y. Yarden,
(2010).
Mol. Oncol. 1, 42 (2007).
34. K. A. Stoermer and T. E. Morrison, Virology 411, 362
28. A. M. Scott, J. D. Wolchok, and L. J. Old, Nat. Rev.
(2011).
Cancer 12, 278 (2012).
35. J. S. Bertram and P. Janik, Cancer Lett. 11, 63 (1980).
Internalization by Cells and Antitumor Activity of Antibodies and Immunotoxins Specific
for Heat Shock Protein 90 Beta Isoform
M.A. Zhmurina, V.V. Vrublevskaya, Y.Y. Skarga, V.S. Petrenko, V.K. Zhalimov, and O.S. Morenkov
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
We showed that the mouse monoclonal antibodies directed against the beta isoform of heat shock protein 90
(Hsp90β) bind specifically to Hsp90β found on the surface of tumor and untransformed cells. After binding
to membrane-associated Hsp90β, antibodies actively dissociated into the culture medium and were internal-
ized by cells. An immunoconjugate prepared on the basis of the Hsp90β-specific antibody and the cytotoxic
agent mertansine did not exhibit high cytotoxic activity against tumor cells in vitro. The injection of the
Hsp90β-specific antibody into mice did not influence the growth of primary tumor of epidermoid Lewis lung
carcinoma but suppressed the metastasis of tumor in the lungs and increased the mean life span of mice. The
results suggest a certain therapeutic potential of antibodies directed against Hsp90β for tumor therapy.
Keywords: extracellular Hsp90β, monoclonal antibodies, immunotoxins, internalization of antibodies by cells, epi-
dermoid Lewis lung carcinoma, metastasis
БИОФИЗИКА том 65
№ 6
2020