БИОФИЗИКА, 2020, том 65, № 6, с. 1126-1134
БИОФИЗИКА КЛЕТКИ
УДК 57.089.67
ВЛИЯНИЕ УСЛОВИЙ КУЛЬТИВИРОВАНИЯ МЕЗЕНХИМАЛЬНЫХ
СТВОЛОВЫХ КЛЕТОК НА ИХ ЖИЗНЕСПОСОБНОСТЬ
ПРИ ТРАНСПЛАНТАЦИИ В СУБРЕТИНАЛЬНОЕ ПРОСТРАНСТВО
© 2020 г. М.А. Плахотний*, А.М. Кодунов*, Е.В. Горина**, В.В. Бояринцев**,
А.В. Трофименко**, С.А. Бирюков**, Г.И. Фильков**
*Калужский филиал НМИЦ «МНТК «Микрохирургия глаза» имени академика С.Н. Федорова» Минздрава России,
248007, Калуга, ул. Святослава Федорова, 5
E-mail: nauka@eye-kaluga.com
**Московский физико-технический институт (национальный исследовательский университет),
141701, Долгопрудный Московской облаcти, Институтский пер., 9
E-mail: biryukov.sa@mipt.ru
Поступила в редакцию 19.08.2020 г.
После доработки 19.08.2020 г.
Принята к публикации 23.08.2020 г.
Использование мезенхимальных стволовых клеток является эффективной стратегией лечения ряда
дегенеративных заболеваний сетчатки. Лимитирующим фактором данного подхода является огра-
ниченная выживаемость этих клеток после трансплантации. Ранее было показано, что выращива-
ние мезенхимальных стволовых клеток в условиях гипоксии способно увеличить их пролифератив-
ную активность. Мы предположили, что такой способ культивирования позволит улучшить жизне-
способность данных клеток после введения в субретинальное пространство. С этой целью мы
выделили мезенхимальные стволовые клетки красного костного мозга мышей, охарактеризовали их
фенотип, способность к дифференцировке в хондрогенном, остеогенном и адипогенном направле-
ниях, а также их пролиферативную активность в условиях культивирования при гипоксии (5% кис-
лорода в атмосфере) и в условиях нормоксии (21% кислорода в атмосфере). Таким же образом были
получены клетки из красного костного мозга от мышей линии С57 Black, несущих ген GFP. Эти
клетки после предварительного культивирования в условиях нормоксии (контроль) и гипоксии
(опыт) были нагружены магнитными микрочастицами и введены субретинально кроликам. Клетки
удерживали в месте инъекции с помощью магнитного импланта, препятствующего их миграции.
Выживаемость клеток оценивали на третьи, пятые, девятые, двенадцатые и пятнадцатые сутки по
данным флуоресцентной микроскопии и оптической когерентной томографии. Согласно получен-
ным данным, выращенные в гипоксических условиях клетки сохраняли жизнеспособность в субре-
тинальном пространстве в течение девяти суток, в то время как клетки, которые росли в условиях
нормоксии, погибали спустя шесть суток. Таким образом, предварительное культивирование ме-
зенхимальных стволовых клеток в условиях гипоксии способно увеличить их жизнеспособность по-
сле введения в субретинальное пространство, что может быть использовано при терапии дегенера-
тивных заболеваний сетчатки.
Ключевые слова: мезенхимальные стволовые клетки, условия культивирования, выживаемость,
субретинальная трансплантация, болезни сетчатки, гипоксия.
DOI: 10.31857/S0006302920060125
мия сетчатки и гибель клеток, вызванные, среди
Возрастная дегенерация желтого пятна, диабе-
тическая ретинопатия и глаукома, являющиеся
прочего, апоптозом и воспалительными процес-
основными причинами необратимой слепоты, в
сами, являются основой патогенеза многих забо-
одной только Европе, согласно прогнозам, затро-
леваний, приводящих к потере зрения [1]. Совре-
нут около 200 миллионов человек к 2020 г. Ише-
менная терапия направлена на предотвращение
прогрессирования этих заболеваний с использо-
ванием внутриглазных инъекций (например, ан-
Сокращения: VEGF - фактор роста эндотелия сосудов
(Vascular Endothelial Growth Factor), МСК - мезенхималь- ти-VEGF-препаратов, препятствующих росту
ные стволовые клетки, GFP - зеленый флуоресцентный
патологических сосудов в сетчатке), метаболи-
белок (Green Fluorescent Protein), PBS - фосфатный буфер
(Phosphate Buffer Solution).
ческих, антиоксидантных и вазоактивных препа-
1126
ВЛИЯНИЕ УСЛОВИЙ КУЛЬТИВИРОВАНИЯ
1127
ратов в форме глазных капель или хирургическо-
водили с использованием сред для дифференци-
го вмешательства. Тем не менее эффективность
ровки StemPro® Chondrogenesis Differentiation
этих методов ограничена.
Kit, StemPro® Osteogenesis Differentiation Kit и
StemPro® Adipogenesis Differentiation Kit (все -
Использование мезенхимальных стволовых
Gibco, Life Technologies, США) соответственно,
клеток (МСК) для лечения офтальмологических
согласно рекомендованным протоколам. Диффе-
заболеваний является одним из перспективных
ренцированные клетки окрашивали растворами
направлений исследования. МСК являются
красителей сафранин O, ализариновый красный
мультипотентными клетками с регенеративными
и Судан III соответственно.
и иммуномодулирующими свойствами
[2,
3].
Субретинальные инъекции препаратов на основе
Оценка жизнеспособности и пролиферации
стволовых клеток запускают процессы нейропро-
МСК. Для оценки жизнеспособности и пролифе-
текции и/или регенерации сетчатки [4]. Одним из
рации МСК высеивали на шестилуночные план-
ограничений данной стратегии является слабая
шеты в количестве 250000 клеток на лунку в 2 мл
выживаемость трансплантированных МСК в суб-
среды. Спустя сутки клеткам меняли среду. Затем
ретинальном пространстве [5]. Вместе с тем вы-
через одни или двое суток клетки снимали с при-
ращивание МСК в условиях гипоксии способно
менением холодного раствора 0.05% трипсина
увеличить пролиферативную активность и выжи-
(Gibco, США), промывали раствором фосфатно-
ваемость данных клеток в культуре и при транс-
буферного раствора (PBS), pH 7.4, и фиксировали
плантации в поврежденные ткани, что было по-
в 66%-м этаноле на льду. Далее МСК отмывали, а
казано на примере инфаркта миокарда [6]. В свя-
затем инкубировали с пропидий-йодидом (Mo-
зи с этим целью данной работы была оценка
lecular Probes, США) в концентрации 50 мкг/мл в
влияния культивирования МСК в условиях гипо-
присутствии 50 ед./мл РНКазы А в течение
ксии на жизнеспособность клеток после введения
30 мин для удаления из клеток РНК. Анализ об-
в субретинальное пространство. Проведенное на-
разцов МСК проводили на проточном цитометре
ми исследование сроков выживаемости МСК при
CytoFLEX. Всего были проанализированы как
субретинальном введении является важным ша-
минимум 10000 событий для каждой пробы. Ана-
гом на пути к эффективному лечению офтальмо-
лиз каждой пробы проводили в трех повторах.
логических заболеваний с применением препара-
Модификация МСК магнитными частицами. По-
тов на основе МСК.
сле достижения 80% плотности монослоя в клеточ-
ную культуру МСК, изолированных из красного
костного мозга мышей со стабильной экспрессией
МАТЕРИАЛЫ И МЕТОДЫ
GFP, добавляли коммерческие магнитные части-
Выделение и культивирование первичных МСК.
цы Dynabeads M-280 (Invitrogen, США) диаметром
Первичные линии мезенхимальных стволовых
2.8 мкм, обработанные 4%-м поверхностно-актив-
клеток животных были получены из аутбредных
ным веществом Pluronic L-123 (Sigma-Aldrich,
мышей ICR (CD 1) и SHK, а также от мышей ли-
США). Через 24 ч после инкубации с магнитными
нии С57 Black, модифицированной геном зелено-
частицами мезенхимальные стволовые клетки по-
го флуоресцентного белка (GFP). Выделение
глощали частицы. Клетки снимали с подложки,
первичных МСК из красного костного мозга мы-
обрабатывая культуру 0.05%-м раствором трипси-
шей в возрасте 8-11 недель проводили по стан-
на, содержащего ЭДТА (Gibсo, США).
дартному протоколу [7]. Клетки культивировали
Трансплантация стволовых клеток. Для фикса-
в среде DМЕМ с добавлением 10% эмбриональ-
ции трансплантированных клеток, содержащих
ной телячьей сыворотки (Gibсo, США). Смену
магнитные частицы, использовали полимерные
среды проводили каждые трое суток.
эластичные фиксирующие магнитные импланта-
Анализ фенотипа МСК и способности к диффе-
ты, пластины толщиной 0.35 мм круглой формы,
ренцировке. Для фенотипирования МСК снимали
диаметром 7 мм, с индукцией магнитного поля
с культуральных флаконов с помощью раствора
5 мТл, оригинальной конструкции с лазерным
Версена и окрашивали растворами антител про-
зондом, разработанные совместно МНТК «Мик-
тив CD105 (BioLegend,
120408; Biorbyt,
рохирургия глаза» (Калуга) с НЭП
«МГ»
orb187245), CD73 (BioLegend, 127220; Bioss, bs-
(Москва).
4834R-A488), CD29 (BioLegend, 102205), CD44
Экспериментальная группа составила пять
(BioLegend, 203906), CD45 (BioLegend, 103107) и
кроликов-самцов породы Шиншила массой
CD34 (BioLegend, 152204), содержащими 0.5%
2000-2500 г. После семи суток карантина живот-
бычьего сывороточного альбумина. Анализ об-
ным проводили хирургическое вмешательство.
разцов МСК проводили на проточном цитометре
После достижения медикаментозного мидриаза
CytoFLEX (Beckman Coulter, CШA).
животные находились под общим ингалаяцион-
Дифференцировку клеток в хондрогенном,
ным масочным наркозом (Фторатан - 2.7 л/мин,
остеогенном и адипогенном направлениях про-
кислород - 2 л/мин). Под контролем операцион-
БИОФИЗИКА том 65
№ 6
2020
1128
ПЛАХОТНИЙ и др.
Фенотипирование полученных образцов МСК из красного костного мозга аутбредных мышей ICR (CD 1) и SHK
Маркер
CD105
CD73
CD29
CD44
CD45
CD34
Доля положительных
94.6%
98.80%
98.25%
98.00%
0.30%
0.10%
клеток в популяции, %
ного микроскопа ALLEGRA 90 (Moller-Wedel,
частицы, идентифицируемую GFP-флуоресцен-
Германия) комплекс из полимерного эластично-
цию и миграцию МСК.
го магнитного имплантата и световода заводили в
субтеноново пространство и фиксировали в верх-
РЕЗУЛЬТАТЫ
не-наружном квадранте глазного яблока.
В правый глаз субретинально вводили суспен-
Согласно принятым в научном сообществе
зию клеток, культивированных при 5%-м содер-
нормам МСК должны экспрессировать на своей
поверхности такие маркеры, как CD105, CD73,
жании кислорода; в левый глаз вводили суспен-
СD29 и CD44. В то же время МСК не должны
зию клеток, культивированных при 21%-м содер-
жании кислорода. Для введения 10000 клеток,
иметь на поверхности гемопоэтических антиге-
находящихся в жидкой среде (0.05 мл), канюля
нов, включая, например, CD45 и CD34. Феноти-
была присоединена к субретинальному инжекто-
пирование полученных нами МСК аутбредных
мышей ICR (CD 1) и SHK показало, что более
ру (MicroDose injection kit 1 ml, Med One, США).
95% МСК экспрессируют CD105, CD73, СD29 и
Оценка жизнеспособности МСК в субретиналь-
CD44 (таблица). При этом популяция практиче-
ном пространстве. Исследования выживаемости
ски не содержит CD45- и CD34-позитивных кле-
трансплантированных клеток проводили на тре-
ток, что говорит высокой чистоте и однородности
тьи, шестые, девятые, двенадцатые и пятнадца-
популяции полученных МСК. Поскольку метод
тые сутки.
выделения и культивирования МСК мышей ли-
Оптическую когерентную томографию прово-
нии С57 Black был тот же, что и линии ICR (CD 1)
дили на приборе RTVue-100 (Optovue, США).
и SHK, мы принимаем, что эти клетки тоже отно-
Скорость захвата изображений - 26000 А-ска-
сятся к МСК.
нов/с; частота строк от
256 до
1024 А-ска-
Еще одним важным признаком МСК является
нов/кадр; захват скана: глубина 2 мм, длина 12
способность к дифференцировке в адипогенном,
мм, длина волны сканирующего луча от 830 до 750
хондрогенном и остеогенном направлениях. В ре-
мкВт. После фиксации животного выполняли
зультате хондрогенной дифференцировки клетки
ряд сканирований и отбирали наиболее инфор-
приобретали характерную фибробласто-подоб-
мативные снимки, позволяющие оценить состоя-
ную морфологию, во внеклеточном матриксе
ние места введения клеток.
присутствовало большое содержание глюкозами-
После выведения животных из эксперимента
ногликанов, окрашенных сафранином O. МСК,
методом ингаляции углекислого газа в указанные
дифференцировавшиеся по остеогенному пути,
сроки наблюдения глазные яблоки энуклеирова-
приобретали кубоидальную и полигональную
ли, вскрывали переднюю камеру, глаза фиксиро-
форму, а окраска ализариновым красным С про-
вали с помощью погружения в раствор 4%-го па-
демонстрировала наличие минерализованного
раформальдегида в PBS-буфере, рН 7.3 в течение
внеклеточного матрикса. В случае индукции
24 ч при температуре 4°С. Затем глаза пропитыва-
адипогенеза МСК приобретали округленную
ли в 30%-м растворе сахарозы в PBS-буфере 24 ч
форму, отмечалось формирование вакуолей и
при 4°С и замораживали при температуре -24°С,
внутриклеточное накопление нейтральных жи-
после чего изготавливали срезы толщиной 40 мкм
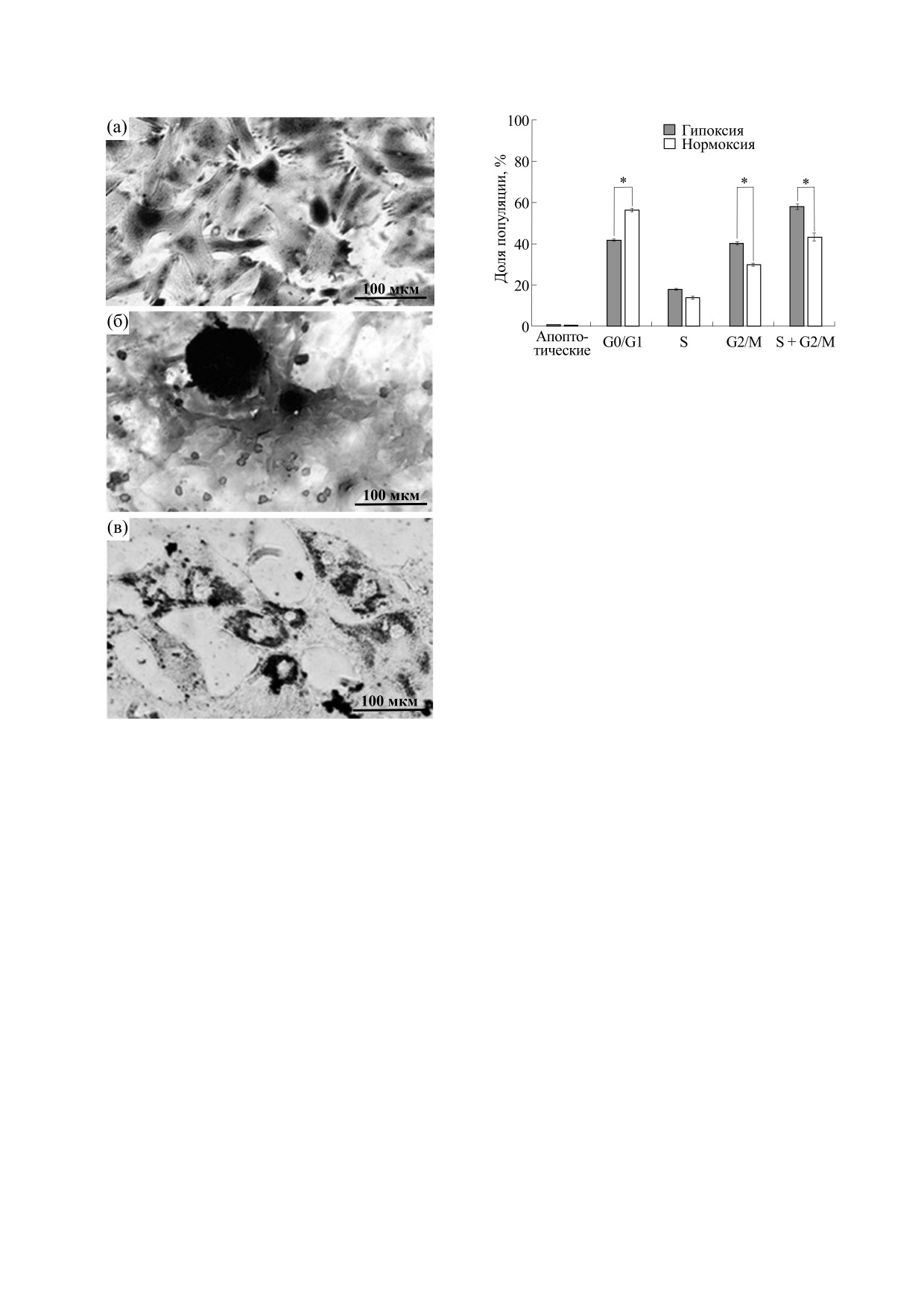
ров, окрашенных Суданом III (рис. 1).
с помощью криотома CM 1510S (Leica, Герма-
На следующем этапе мы решили оценить, как
ния).
влияют условия культивирования МСК при по-
Срезы монтировали на предметных стеклах,
ниженном содержании кислорода на пролифера-
высушивали при комнатной температуре и ана-
цию и жизнеспособность клеток. Для оценки
лизировали с помощью микроскопа Olympus IX81
влияния гипоксии на пролиферативную актив-
(Olympus, Япония) в режиме флуоресценции.
ность МСК мы сравнили профили содержания
Микроскоп был снабжен цифровой камерой
ДНК в клетках, культивируемых в стандартных
Olympus DP72 (Olympus, Япония), соединенной с
условиях (при 21% кислорода), и при выращива-
компьютером.
нии в мультигазовом СО2-инкубаторе в атмосфе-
По гистологическим препаратам срезов глаз-
ре с пониженным содержанием кислорода (5%
СО2, 5% О2, 95% влажности). Сравнение профи-
ных яблок определяли наличие в области введе-
ния стволовых клеток, содержащих магнитные
лей у мышиных МСК не выявило разницу в коли-
БИОФИЗИКА том 65
№ 6
2020
ВЛИЯНИЕ УСЛОВИЙ КУЛЬТИВИРОВАНИЯ
1129
Рис. 2. Количественный анализ профилей ДНК МСК
красного костного мозга. Показаны размеры субпо-
пуляций МСК мыши при культивации в условиях
нормоксии (в атмосфере с 21% кислорода) и при
культивировании при пониженном содержании кис-
лорода в атмосфере (5%) Доля пролиферирующих
клеток (S + G2/M) при переносе клеток в атмосферу с
5%-м содержанием кислорода достоверно увеличива-
ется на несколько процентов (* - Р < 0.05 согласно
дисперсионному анализу ANOVA с последующим те-
стом Тьюки).
Для оценки влияния культивирования МСК в
условиях гипоксии на жизнеспособность этих
клеток после введения в субретинальное про-
странство мы использовали клетки с постоянной
экспрессией GFP. Для наблюдения за трансплан-
тированными МСК важно было удержать клетки
в месте инъекции. Чтобы достичь этого, МСК
мыши были нагружены магнитными частицами,
которые поглощались путем эндоцитоза и остава-
лись локализованы в цитоплазме клеток (рис. 4).
Рис. 1. Оценка способности МСК к дифференциров-
Одной из важнейших задач для контроля вы-
ке: (а) - хондрогенная дифференцировка экспери-
живаемости трансплантированных клеток явля-
ментального образца МСК мыши, окраска сафрани-
ном O; (б) - остеогенная дифференцировка экспери-
ется их визуализация in vivo. Оптическая
ментального образца МСК мыши, окраска
когерентная томография позволяет увидеть
ализариновым красным С; (в) - адипогенная диффе-
трансплантированные субретинально клетки, на-
ренцировка экспериментального образца МСК мы-
груженные магнитными наночастицами. Этот
ши, окраска Суданом III.
метод визуализации является неинвазивным и
применим в клинической практике. По данным
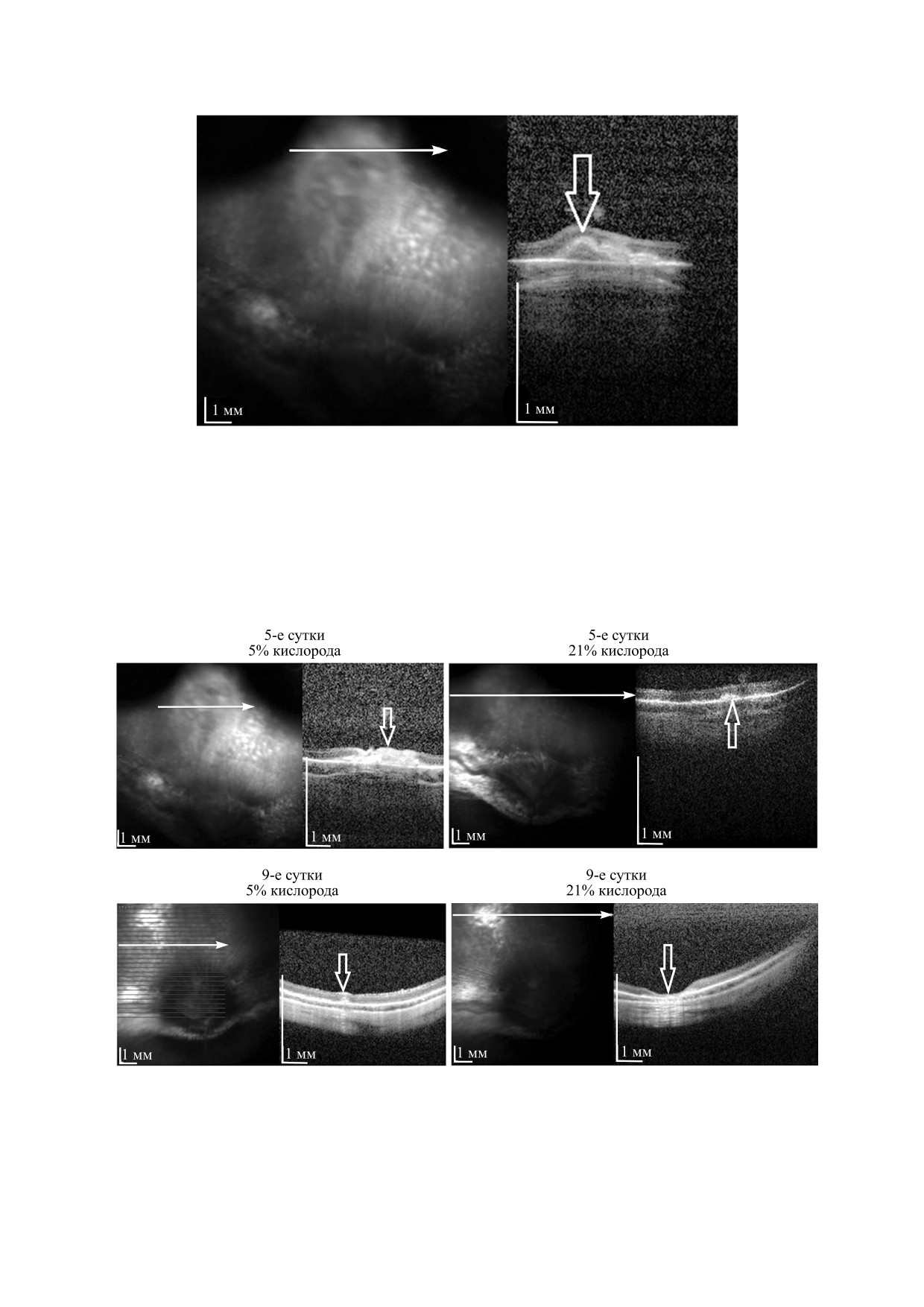
когерентной томографии на третьи сутки в месте
честве апоптических клеток: как при содержании
введения визуализировался локальный дефект с
кислорода 5%, так и при 21% их количество было
конгломератом клеток под сетчаткой в обоих гла-
меньше 1%. В то же время мы наблюдали досто-
зах. Различие между выживаемостью трансплан-
верное увеличение числа клеток, находящихся в
тированных клеток на третьи сутки в зависимо-
S- и G2/M-стадиях клеточного цикла, т.е. нахо-
сти от условий культивирования не наблюдалось
дящихся в процессе удвоения (рис. 2). Это гово-
(рис. 5).
рит о том, что атмосфера с пониженным содержа-
На пятые сутки наблюдали большее количе-
нием кислорода является оптимальной для роста
ство клеточного конгломерата под сетчаткой в
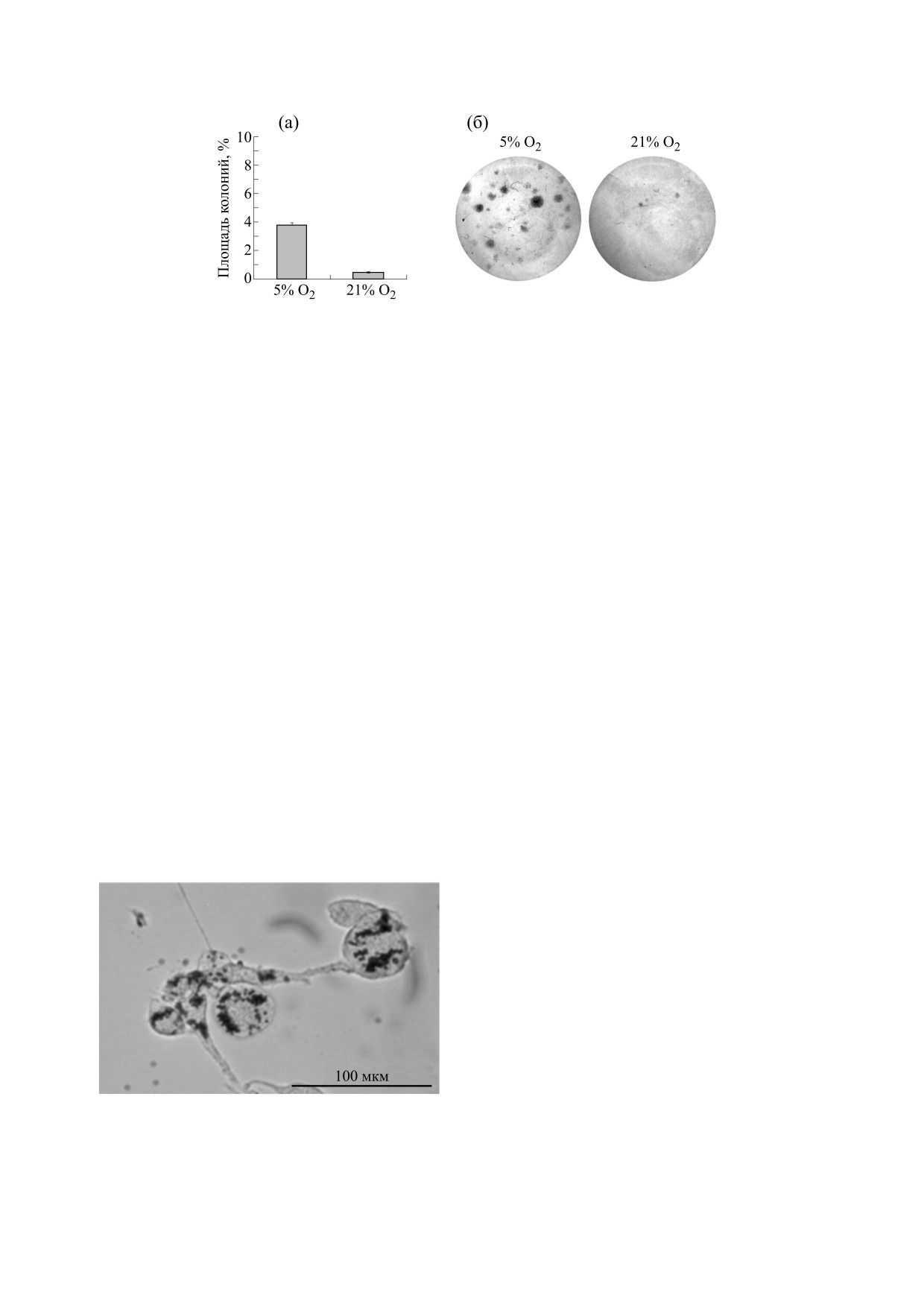
МСК. Этот же вывод был подтвержден в результе
глазу, в который вводили клетки, культивирован-
эксперимента с колониеобразованием: при гипо-
ные в гипоксических условиях. В другом глазу ко-
ксии наблюдали более ускоренный рост площади
личество клеток было значительно меньшим.
колоний МСК, чем в условиях нормоксии
На девятые сутки в глазах, где были транс-
(рис. 3).
плантированы МСК, культивированные в гипо-
БИОФИЗИКА том 65
№ 6
2020
1130
ПЛАХОТНИЙ и др.
Рис. 3. Размеры колоний популяций первичных МСК мыши при культивировании в условиях нормоксии (в
атмосфере с 21% кислорода) и при пониженном содержании кислорода в атмосфере (5%): (а) - площадь колоний,
(б) - общий вид планшетов. Окраска метиловым фиолетовым проведена спустя две недели после высевания колоний
на планшеты.
ксических условиях, некоторое количество кле-
ше по сравнению с клетками, которые выращива-
ток сохранялось. Там, где были трансплантирова-
ли при 21% О2.
ны нормоксические МСК, наблюдали локальный
На девятые сутки одиночные живые клетки,
дефект сетчатки с зонами дистрофии пигментно-
содержащие GFP, были обнаружены только в
го эпителия вокруг них, однако МСК не визуали-
правом глазу (клетки культивировали при 5% О2).
зировались (рис. 6).
В тканях левого глаза, куда вводили клетки, куль-
Аналогичная динамика наблюдалась по дан-
тивированные при 21% О2, флуоресцентное све-
ным гистологического исследования. На третьи
чение не наблюдалось (рис. 7).
сутки у всех животных в левом и правом глазу
На двенадцатые и пятнадцатые сутки в тканях
МСК, содержащие GFP, располагались в месте
глаза кролика ни в одной группе МСК GFP-клет-
введения. В стекловидном теле и в других струк-
ки не были найдены.
турах глаза трансплантированные клетки обнару-
жены не были (рис. 7). Это свидетельствует об от-
сутствии миграции МСК под воздействием маг-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
нитного имплантата.
В рамках проведенного исследования было
На шестые сутки в левом и правом глазу клет-
установлено, что клетки, культивированные в
ки, содержащие GFP, располагались в месте
условиях гипоксии (5% О2), при субретинальной
введения под сетчаткой и сохраняли свою жизне-
трансплантации живут дольше, чем клетки, куль-
способность. В стекловидном теле и других
тивированные в нормоксических условиях. Этот
структурах глаза клетки обнаружены не были.
результат согласуется со множеством литератур-
Количество жизнеспособных (сохраняющих
ных данных.
свою способность к зеленой флуоресценции)
Условия культивирования оказывают значи-
клеток, которые предварительно культивирова-
мое влияние на время выживаемости МСК.
лись в условиях гипоксии, визуально было боль-
Предшествующее трансплантации кондициони-
рование в условиях гипоксии, включающее куль-
тивирование в течение 15 мин при 2.5% О2, реок-
сигенацию в течение 30 мин при 21% O2 и предва-
рительное кондиционирование в условиях
гипоксии в течение 72 ч при 2.5% O2, значительно
улучшает пролиферативные и миграционные
способности МСК in vitro [8]. При инкубации в
среде с низким содержанием сыворотки МСК пе-
рейдут в состояние апоптоза, но предварительное
кондиционирование при гипоксии (1% O2) мо-
жет предотвратить повреждение путем увеличе-
ния секреции ангиогенных факторов, VEGF и
bFGF (осн¯вного фактора роста фибробластов)
[9]. Более того, 1% O2 также увеличивает метабо-
Рис. 4. Мезенхимальные стволовые клетки мыши,
лическую активность и снижает активность кас-
содержащие магнитные частицы в цитоплазме.
пазы-3/7 и высвобождение лактатдегидрогеназы
БИОФИЗИКА том 65
№ 6
2020
ВЛИЯНИЕ УСЛОВИЙ КУЛЬТИВИРОВАНИЯ
1131
Рис. 5. Оптическая когерентная томография на третьи сутки после трансплантации клеток, культивированных при 5%
О2. Визуализируется конгломерат из суспензии клеток под сетчаткой (отмечен стрелкой).
МСК, тем самым снижая чувствительность МСК
вано уменьшение онкогенного потенциала МСК,
к ишемическому микроокружению без измене-
индуцированное 2% O2, что обусловлено увели-
ния их биологического поведения, иммунофено-
чением экспрессии генов-супрессоров опухолей,
типа или кариотипа [10]. Было продемонстриро-
а также индукцией субоптимальных разрывов
Рис. 6. Оптическая когерентная томография на пятые и девятые сутки после трансплантации клеток. Место введения
клеток отмечено стрелкой. На пятые сутки в обоих глазах визуализируется трансплантированная суспензия клеток.
На девятые сутки в глазу, куда были трансплантированы МСК, культивированные при 5% О2, клетки сохраняются, в
другом глазу - клетки полностью отсутствуют.
БИОФИЗИКА том 65
№ 6
2020
1132
ПЛАХОТНИЙ и др.
Рис. 7. Флуоресцентная микроскопия гистологических срезов сетчатки. Граница сетчатки отмечена пунктирной
линией.
двухцепочечной ДНК в МСК in vitro [11]. Гипо-
вывод, что предварительная инкубация в услови-
ксическое состояние при 3% O2 снижает частоту
ях гипоксии улучшает генетическую стабиль-
анеуплоидии в МСК по сравнению с нормокси-
ность и стабильность хромосом [12]. Культивиро-
ческим состоянием при 21% О2. Можно сделать
вание при 5% O2 последовательно повышает кло-
БИОФИЗИКА том 65
№ 6
2020
ВЛИЯНИЕ УСЛОВИЙ КУЛЬТИВИРОВАНИЯ
1133
ногенный потенциал и скорость пролиферации
клеточные продукты применимы для лечения де-
МСК за счет усиления секреции VEGF [13].
генеративных заболеваний сетчатки.
Хотя в большинстве исследований было дока-
МСК также могут продуцировать и секретиро-
зано, что гипоксия является защитным фактором
вать белки, которые стимулируют регенерацию
для МСК in vitro и in vivo, оптимальная концен-
тканей. МСК продуцируют ангиогенные факто-
трация кислорода для повышения выживаемости
ры (такие как хемокиновые лиганды CXCL2 и
и терапевтических эффектов МСК остается не
CXCL5, глия-активирующий фактор FGF9). Так-
выявленной.
же они могут секретировать нейротрофические
факторы, включая нейротрофический фактор
В ходе исследования впервые была оценена
нейротрофин-3, мидкин и глиальные клетки [21].
выживаемость МСК, культивированных в гипо-
Благодаря этим свойствам МСК могут сыграть
ксических и нормоксических условиях при
значительную роль в лечении многих офтальмо-
трансплантации клеток в субретинальное про-
логических заболеваний.
странство. Применены методы визуализации
трансплантированных МСК in vivo, которые под-
тверждались данными гистологического исследо-
ВЫВОДЫ
вания. Возможность точной визуализации и
оценки состояния стволовых клеток in vivo позво-
МСК обладают значительным потенциалом в
терапии глазных болезней. Одним из важных
лит в дальнейшем осуществлять контроль лече-
ния при клиническом применении клеточных
факторов, влияющих на успех лечения, является
препаратов. Оптическая когерентная томография
время выживания МСК.
может являться методом выбора для контроля
Полимерный эластичный магнитный имплан-
распределения трансплантированных МСК
тат с оптоволоконным зондом позволяет осуще-
in vivo при субретинальном введении.
ствить интраоперационную диафаноскопию и
Применение гибкого магнитного импланта
локализовать место фиксации имплантата. В
оригинальной конструкции эффективно препят-
дальнейшем магнитный имплантат эффективно
препятствует миграции МСК, что значительно
ствовало миграции МСК, нагруженных магнит-
упрощает оценку жизнеспособности трансплан-
ными наночастицами: в результате клетки на
тированных клеток.
протяжении всего срока своей жизни находились
в месте введения. Удержание клеток в зоне транс-
МСК, культивированные в гипоксических
плантации важно для возможности репарации
условиях при 5% О2, продемонстрировали боль-
повреждений и лечения нейродегенетаивных за-
шую жизнеспособность (девять суток) при транс-
болеваний сетчатки. Однако установка гибкого
плантации в субретинальное пространство по
магнитного импланта - инвазивная процедура,
сравнению с МСК, выращенными в условиях
поэтому необходим дальнейший поиск простых и
нормальной оксигенации (шесть суток).
безопасных решений, которые позволят контро-
лировать миграцию трансплантированных МСК.
ФИНАНСИРОВАНИЕ РАБОТЫ
МСК сохраняют высокую способность к диф-
ференцировке. Так, МСК, полученные из пупо-
Работа выполнена при поддержке гранта в
винной крови, могут трансформироваться в раз-
форме субсидии по соглашению от 28.10.2018 г.
ные нервные клетки, включая дофаминергиче-
№14.575.21.0179 (уникальный идентификатор
ские нейроны [14], холинергические нейроны
проекта RFMEFI57518X0179), заключенному
[15], клетки Шванна [16] и олигодендроциты [17].
между Министерством науки и высшего образо-
В доклиническом исследовании инсульта МСК,
вания Российской Федерации и Московским фи-
полученные из пуповинной крови и имплантиро-
зико-техническим институтом.
ванные в мозг крыс, дифференцировались в эн-
дотелиальные клетки и нейроны [18]. Следова-
КОНФЛИКТ ИНТЕРЕСОВ
тельно, МСК могут потенциально способство-
вать
восстановлению нервной системы,
Авторы заявляют об отсутствии конфликта
дифференцируясь в специализированные клетки
интересов.
и позволяя заменить поврежденные болезнью
нейроны или олигодендроциты, что может быть
ключом к лечению дегенеративных заболеваний
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
зрительного нерва.
Все применимые международные, националь-
Исследования показали, что МСК, получен-
ные и институциональные принципы ухода и ис-
ные из красного костного мозга крысы, могут
пользования животных при выполнении работы
дифференцироваться в фоторецепторы [19] и
были соблюдены. Животных содержали в соот-
пигментные эпителиальные клетки сетчатки [20].
ветствии с Директивой 2010/63/EU по защите жи-
Данный факт позволяет предположить, что эти
вотных, используемых в научных целях.
БИОФИЗИКА том 65
№ 6
2020
1134
ПЛАХОТНИЙ и др.
СПИСОК ЛИТЕРАТУРЫ
11. J. R. Choi, B. Pingguan-Murphy, W. A. Wan Abas,
et al., Biochem. Biophys. Res. Commun. 448, 218
1. E. J. Duh, J. K. Sun, and A. W. Stitt, JCI insight 2 (14),
(2014).
e93751 (2017).
12. J. Liu, H. Hao, H. Huang, et al., Int. J. Low Extrem.
2. B. Yu, X. Zhang, and X. Li, Int. J. Mol. Sci. 15 (3), 4142
Wounds 14, 63 (2015)
(2014).
13. L. B. Boyette, O. A. Creasey, L. Guzik, et al., Stem
Cells Transl. Med. 3, 241 (2014).
3. H. J. Kim and J. S. Park, Development & Reproduc-
tion 21 (1), 1 (2017).
14. I. Datta, S. Mishra, L. Mohanty, et al., Cytotherapy 13
(8), 918 (2011).
4. B. Mathew, J. N. Poston, J. C. Dreixler, et al., Ophthal-
15. J. Liang, S. Wu, H. Zhao, et al., Neurosci. Lett. 532, 59
mologie 255 (8), 1581 (2017).
(2013).
5. D. Sacks, B. Baxter, C. V. Campbell, et al., Int. J.
16. J. Peng, Y. Wang, L. Zhang, et al., Brain Res. Bull. 84
Stroke 13 (6), 612 (2018)
(3), 235 (2011).
6. X. Hu, S. P. Yu, and J. L. Fraser, J. Thoracic Cardio-
17. E. Mikaeili Agah, K. Parivar, M. Nabiuni, et al., J. Mol.
vasc. Surg. 135 (4), 799 (2008)
Neurosci. 51 (2), 328 (2013).
7. X. Liu and N. Quan, Bio Protoc. 5 (20), e1631 (2015)
18. W. Liao, J. Xie, J. Zhong, et al., Transplantation 87 (3),
350 (2009).
8. M. Kheirandish, S. P. Gavgani, and S. Samiee, Trans-
19. A. Kicic, W. Y. Shen, A. S. Wilson, et al., J. Neurosci.
fus. Apher. Sci. 56, 392 (2017)
23 (21), 7742 (2003).
9. L. Liu, J. Gao, Y. Yuan, et al., Cell Biol. Int. 37, 551
20. C. Huang, J. Zhang, M. Ao, et al., J. Cell. Biochem.
(2013)
113 (2), 590-598 (2012).
10. A. M. Bader, K. Klose, K. Bieback, et al., PLoS One
21. J. Y. Hsieh, H. W. Wang, S. J. Chang, et al., PLoS One
10, e0138477 (2015)
8 (8), e72604 (2013).
Influence of Cultivation Conditions on Viability of Mesenchymal Stem Cells
after Injection into Subretinal Space
M.A. Plakhotniy*, A.M. Kodunov*, E.V. Gorina**, V.V. Boyarintsev**, A.V. Trofimenko**,
S.A. Biryukov**, and G.I. Filkov**
*Kaluga Branch of the National Medical Research Center “Inter-Branch Research and Technical Complex “Eye Microsurgery”
named after academician S.N. Fedorov, Ministry of Health of the Russian Federation,
ul. Svyatoslava Fedorova 5, Kaluga, 248007 Russia
**Moscow Institute of Physics and Technology (National Research University),
Institutskiy per. 9, Dolgoprudny, Moscow Region, 141701 Russia
The use of mesenchymal stem cells is an effective treatment strategy for a number of retinal degenerative dis-
eases. Limited survival of these cells following transplantation remains a significant barrier in achieving a
therapeutic effect. It has been shown earlier that hypoxia-grown mesenchymal stem cells display enhanced
proliferative activity. We hypothesized that such cultivation condition could be beneficial for successful injec-
tion of these cells into the subretinal region. For this purpose, we isolated mesenchymal stem cells from
mouse red bone marrow, described phenotypic characterization and the ability of these cells to chondrogen-
ic, osteogenic and adipogenic differentiation, and proliferative activity in hypoxic (5% of oxygen in the atmo-
sphere) and normoxic (21% of oxygen in the atmosphere) conditions. In the same manner, we isolated mes-
enchymal stem cells from red bone marrow obtained from GFP-expressing C57 black mice. After preliminary
cultivation under normoxia (control cells) or hypoxia (experimental cells), the cells were loaded with mag-
netic particles and injected into the subretinal region of rabbit eyes. The cells were retained in the injection
site tissue using magnet implant to prevent migration. The survival of transplanted mesenchymal stem cells
was evaluated by fluorescence microscopy and optical coherence tomography on day 3, day 5, day 9, day 12,
and day 15. We found that mesenchymal stem cells cultured under hypoxic condition demonstrated greater
viability (9 days) in the subretinal space than those cultured in normoxia (6 days). Thus, the use of low oxygen
conditions for cultivation of mesenchymal stem cells can improve cell viability after injection into the subret-
inal space that might be used for retinal degenerative disease therapy.
Keywords: mesenchymal stem cells, cultivation conditions, survival, subretinal transplantation, retinal diseases,
hypoxia
БИОФИЗИКА том 65
№ 6
2020