БИОФИЗИКА, 2020, том 65, № 6, с. 1135-1141
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.325.2 + 577.151.042
ВЛИЯНИЕ ОСМОЛИТОВ НА БИОЛЮМИНЕСЦЕНТНУЮ РЕАКЦИЮ
БАКТЕРИЙ: СТРУКТУРНО-ДИНАМИЧЕСКИЕ АСПЕКТЫ
© 2020 г. Л.А. Суковатый*, А.Е. Лисица*, В.А. Кратасюк*, **, Е.В. Немцева*, **
*Сибирский федеральный университет, 660041, Красноярск, Свободный просп., 79
**Институт биофизики СО РАН, 660036, Красноярск, Академгородок, 50/50
E-mail: lsukovatyy@sfu-kras.ru
Поступила в редакцию 30.11.2019 г.
После доработки 30.11.2019 г.
Принята к публикации 24.07.2020 г.
Исследовано влияние вязких сред c глицерином и сахарозой (10-40%) на кинетику биолюминес-
центной реакции бактерий методом остановленного потока. Показано увеличение квантового вы-
хода реакции при концентрации осмолитов ≥10 %. Дальнейшее увеличение концентрации до 30-
40% приводит к снижению количества испускаемых квантов света в средах с глицерином, в то время
как для сахарозы подобный эффект не наблюдается. Моделирование молекулярной динамики бак-
териальной люциферазы в окружении молекул воды и различного количества молекул глицерина
и сахарозы показало, что оба осмолита в исследованном диапазоне концентраций не оказывают
значительного эффекта на конформацию белка. Расчет среднеквадратичной флуктуации Cα-атомов
α-субъединицы люциферазы указывает на то, что увеличение квантового выхода в присутствии 10%
сахарозы и глицерина может объясняться большей подвижностью мобильной петли фермента по
сравнению с водным окружением. Установлено, что глицерин, в отличие от сахарозы, имеет доступ
в активный центр бактериальной люциферазы, а при высоких концентрациях (30 и 40%) вытесняет
оттуда молекулы воды на протяжении всего времени моделирования (40 нс), что может объяснять
снижение квантового выхода реакции.
Ключевые слова: биолюминесценция, светящиеся бактерии, бактериальная люцифераза, осмолит,
молекулярная динамика, структура и динамика белка.
DOI: 10.31857/S0006302920060137
обеспечивающих функцию биолюминесценции
Биохимической основой биолюминесценции
бактерий является реакция окисления восстанов-
бактерий, в настоящее время не исследован, хотя
ленного флавинмононуклеотида (FMN) и длин-
их эффекты были неоднократно зарегистрирова-
ны [5, 6].
ноцепочечного альдегида кислородом воздуха,
катализируемая ферментом - люциферазой [1, 2].
Известно, что осмолиты способны вызывать
Светящиеся бактерии обитают по всему мирово-
изменение стабильности и функциональной ак-
му океану: от глубоководных участков, при тем-
тивности белков [7, 8]. Это обусловлено, в част-
пературе около 0°С, до тропических вод, где тем-
ности, балансом между преимущественной гид-
пература поверхности может превышать 30°С [2].
ратацией белка и преимущественным связывани-
В окружающей среде бактерии регулярно сталки-
ем молекул оcмолита c его поверхностью [9, 10].
ваются с изменением условий - температуры,
Эффект осмолитов на активность ферментов мо-
pH, осмотического давления, радиации, концен-
жет быть также вызван изменением структурно-
трации питательных веществ и токсинов. Одна из
динамических свойств отдельных функциональ-
стратегий, обусловливающих адаптивный потен-
но важных участков белка и проникновением
циал бактерий в изменяющихся условиях, заклю-
осмолитов в область активного центра [8, 11]. В
чается в накоплении растворенных органических
данной работе с помощью методов молекулярно-
веществ в ответ на повышение осмолярности вне
клетки и быстрого высвобождения этих веществ
го моделирования были исследованы механизмы
влияния глицерина и сахарозы на реакцию, ката-
при ее снижении [3, 4]. Эти низкомолекулярные
соединения называют осмолитами. Механизм
лизируемую бактериальной люциферазой. Гли-
влияния осмолитов на активность ферментов,
церин и сахароза являются известными осмоли-
тами в бактериальных системах [4], а также сорас-
Сокращениe: FMN - флавинмононуклеотид.
творителями, используемыми для изучения
1135
1136
СУКОВАТЫЙ и др.
влияния вязкости на ферментативные реакции
белковых структур (PDBeChem ID: GOL и SUC
[8, 11, 12].
соответственно) [18]. Для моделирования кон-
центраций осмолитов 5, 10, 20, 30 и 40 вес. % в
боксе было размещено следующее количество
МАТЕРИАЛЫ И МЕТОДЫ
молекул глицерина/воды: 399/38615, 799/36445,
В работе были использованы следующие рас-
1597/32289, 2396/28208 и 3194/24323 или сахаро-
творы: FMN (Sigma, США), 30 мкМ; ЭДТА (Roth,
зы/воды:
108/39109,
215/37443,
430/34136,
Германия), 0.02 М; рекомбинантная люцифераза
645/30819, 859/27589 соответственно. Параметры
Photobacterium leiognathi (ООО «Биолюмдиагно-
силового поля для молекулы глицерина были по-
стика», Красноярск), 1.96 мкМ; деканаль (Acros
лучены с помощью онлайн-сервиса CGenFF [19],
для сахарозы - посредством модификации уже
Organics, США), 2·10-3 М; глицерин (Panreac,
известных параметров для α-D-глюкозы и β-D-
Испания), 10-40 вес. %; сахароза (Gerbu, Герма-
фруктозы, как рекомендовано в руководстве к
ния), 10-40 вес. %. Все стоковые растворы были
CHARMM36 [16]. Для анализа полученных тра-
приготовлены с использованием калий-натрий
екторий использовали программный пакет
фосфатного буфера (0.05 М, рН 6.9), за исключе-
GROMACS.
нием раствора деканаля, который готовили на
этаноле.
До начала моделирования была проведена
нейтрализация заряда всей системы, а затем -
Определение активности бактериальной люци-
минимизация ее энергии при изохорно-изотер-
феразы в присутствии глицерина и сахарозы. Реги-
мических (NVT-ансамбль) и изотермо-изобари-
стрировали квантовый выход реакции (общее ко-
ческих (NPT-ансамбль) условиях. В первом слу-
личество квантов, излученных в реакции за один
чае релаксация систем происходила в течение
оборот фермента) как площадь под кинетической
5 нс при температуре в 300 K, во втором - в тече-
кривой, измеренной методом остановленного
ние 10 нс при постоянной температуре (300 K) и
потока с помощью анализатора кинетики SX-20
(Applied Photophysics, Великобритания) при 20°С.
давлении (105 Па). Положение тяжелых атомов
Реакцию инициировали, смешивая раствор лю-
белка при данных минимизациях было зафикси-
циферазы (1.96 мкМ) с раствором, содержащим
ровано. Далее был проделан еще один этап релак-
фотовосстановленный в присутствии ЭДТА фла-
сации NPT-ансамбля в течение 10 нс без фикса-
винмононуклеотид (30 мкМ) и деканаль (20-
ции атомов белка, необходимость которого была
100 мкМ). Каждая кинетическая кривая была по-
связана с исключением FMN из активного цен-
лучена усреднением по пяти повторностям.
тра кристаллической структуры люциферазы и
реконструированием участка мобильной петли.
Расчеты молекулярной динамики люциферазы в
различных средах. Трехмерная структура бактери-
Вычисление молекулярно-динамической тра-
альной люциферазы была получена из банка дан-
ектории проводили для канонического NPT-ан-
ных белковых структур (PDB ID: 3FGC) [13, 14].
самбля при постоянной температуре (300 K) и
Для данной структуры было проведено рекон-
давлении (105 Па) в течение 40 нс с шагом вычис-
струирование участка мобильной петли α-субъ-
ления 2 фс. Для каждой из систем были проведе-
единицы белка
(283-290 аминокислотный
ны три независимых запуска, включающих в себя
остаток), как описано в работе [15]. Флавинмоно-
все шаги релаксации и молекулярную динамику.
нуклеотид, ионы и связанная вода, расшифро-
ванные вместе с люциферазой, были исключены
из структуры до старта вычислений.
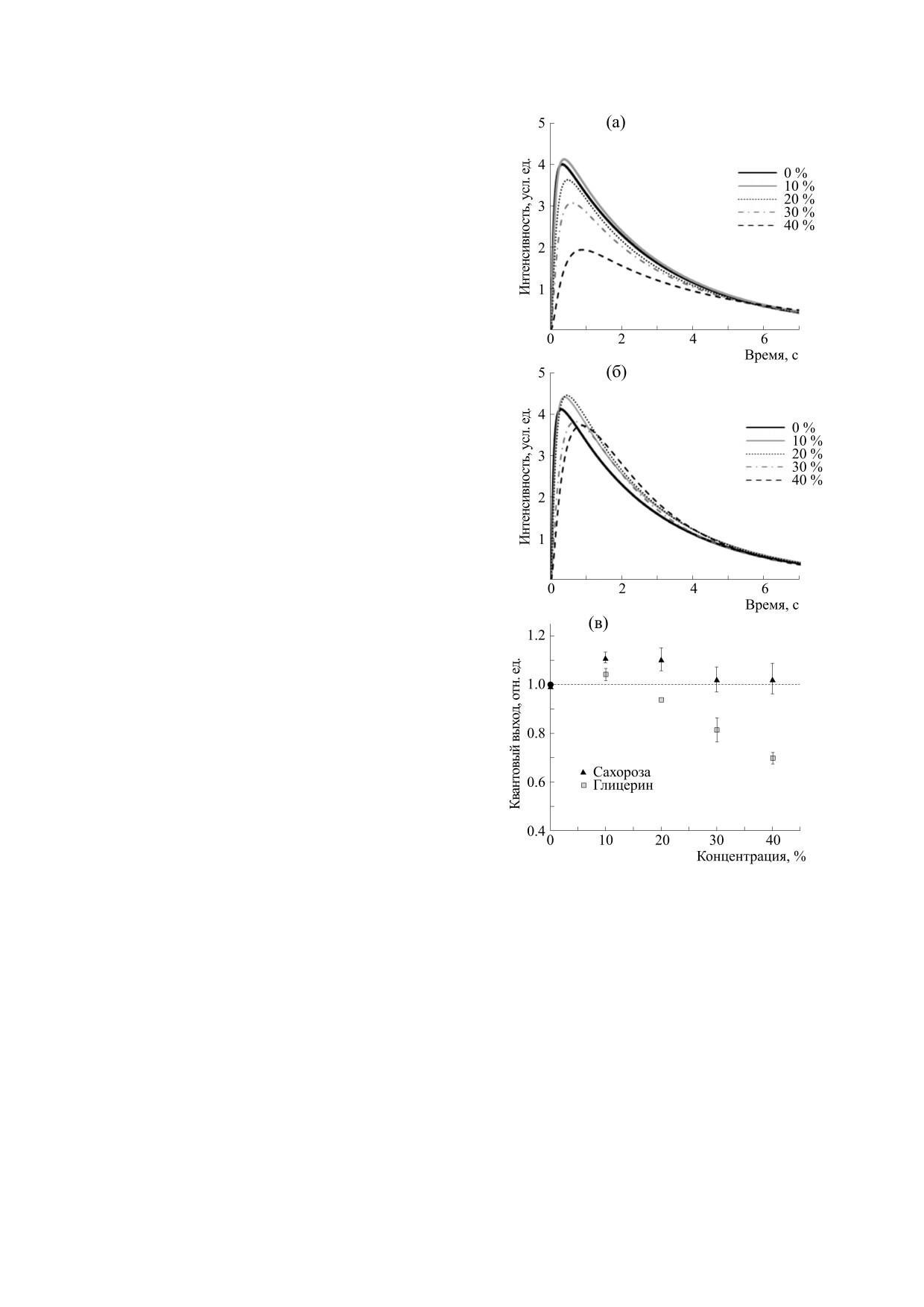
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Вычисление молекулярной динамики структу-
Влияние глицерина и сахарозы на квантовый вы-
ры бактериальной люциферазы в явном раство-
ход реакции, катализируемой бактериальной люци-
рителе было проведено с помощью программы
феразой. Была измерена нестационарная кинети-
GROMACS версии 5.1.4 [16]. Для описания пара-
ка биолюминесцентной реакции, катализируе-
метров взаимодействия между атомами системы
мой бактериальной люциферазой, в средах с
было использовано силовое поле CHARMM36
различным содержанием глицерина или сахаро-
[17].
зы. Для различных концентраций деканаля (10-
Моделируемая система представляла собой
50 мкM) наблюдали сходные закономерности из-
кубический бокс с условиями периодической
менения кинетики в модельных средах, отражен-
границы, в центре которого размещали молекулу
ные на рис. 1а,б. Видно, что эффекты глицерина
люциферазы. Расстояние между боксом и фер-
и сахарозы на кинетику реакции различаются. В
ментом составляло 12 Å от любого атома белка.
области малых концентраций осмолитов (10%
Для создания водного окружения в данный бокс
для глицерина и 10-20% для сахарозы) наблюда-
поместили 40821 молекулу воды (модель TIP3P).
ется увеличение максимальной интенсивности
Начальная геометрия молекул глицерина и саха-
свечения. Дальнейший рост содержания осмоли-
розы была взята из Европейского банка данных
тов в среде до 30-40% приводит к снижению мак-
БИОФИЗИКА том 65
№ 6
2020
ВЛИЯНИЕ ОСМОЛИТОВ НА БИОЛЮМИНЕСЦЕНТНУЮ РЕАКЦИЮ
1137
симальной интенсивности, что особенно ярко
проявляется для сред с глицерином. Также видно,
что в средах с глицерином и сахарозой кинетика
реакции замедляется, что выражается в более
позднем выходе свечения на максимальный уро-
вень по сравнению с реакцией в буфере. Замедле-
ние кинетики может быть связано с увеличением
вязкости реакционной среды и, как следствие,
уменьшением скорости диффузии компонентов
реакции.
На основе кинетических кривых был рассчи-
тан квантовый выход реакции, т. е. общее количе-
ство квантов света, излученных за один оборот
фермента (рис. 1в). Видно, что присутствие в сре-
де как 10% сахарозы, так и 10% глицерина приво-
дит к увеличению квантового выхода реакции.
При высоких концентрациях глицерина (30-
40%) эффективность реакции снижается, в то
время как в средах с таким же содержанием саха-
розы квантовый выход не изменяется по сравне-
нию с контролем (буфер). Полученные тенден-
ции сохраняются при вариации концентрации
альдегида в диапазоне 10-50 мкМ. Следует отме-
тить, что такая немонотонная зависимость кван-
тового выхода реакции от концентрации осмоли-
тов говорит о наличии нескольких механизмов их
влияния на фермент и/или субстраты, вовлечен-
ные в реакцию. Также очевидно, что наблюдае-
мые эффекты не могут объясняться только увели-
чением вязкости раствора, поскольку эта харак-
теристика изменяется монотонно с ростом
концентрации осмолитов.
Полученные результаты позволяют предполо-
жить, что в присутствии глицерина и сахарозы
происходит изменение структурно-динамиче-
ских характеристик фермента люциферазы в це-
лом, либо функционально важных структурных
элементов данного белка. Для выявления таких
эффектов были применены методы молекуляр-
ного моделирования.
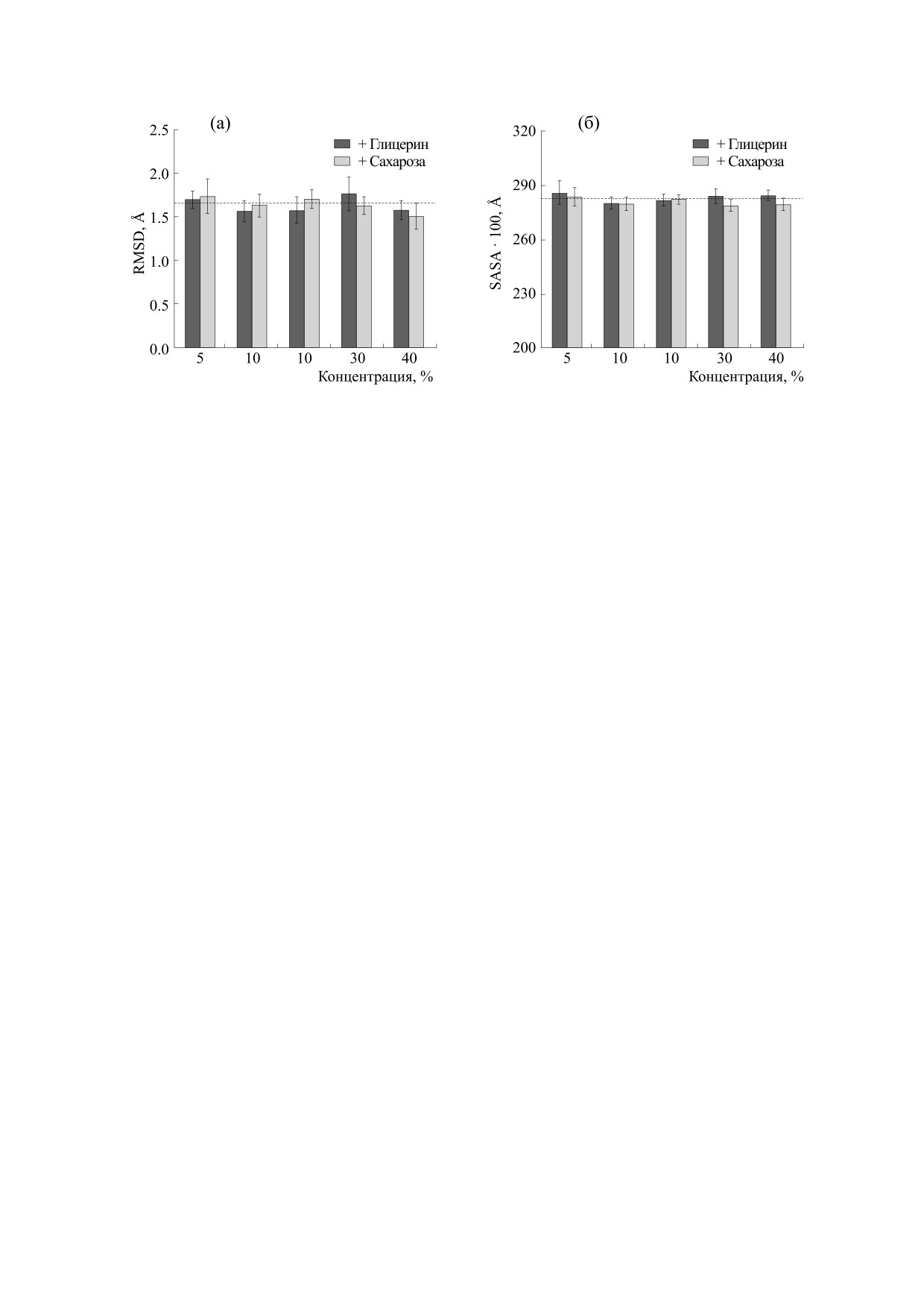
Влияние глицерина и сахарозы на стабильность
и компактность бактериальной люциферазы. Изме-
нение конформации люциферазы под влиянием
осмолитов было оценено с помощью двух пара-
метров: среднеквадратичного отклонения Cα-ато-
Рис. 1. Кинетика биолюминесцентной реакции, ката-
лизируемой бактериальной люциферазой, в присут-
мов белка и площади поверхности белка, до-
ствии различных концентраций (в %) глицерина (а)
ступной растворителю. Вычисление средне-
или сахарозы (б) и изменение квантового выхода ре-
квадратичного отклонения было проведено
акции (в). Концентрация люциферазы - 0.96 мкM,
относительно координат атомов в расшифрован-
FMNH2 - 15 мкM, C10 - 50 мкM. Среднее значение и
погрешность определения квантового выхода вычис-
ной кристаллической структуре люциферазы
лена на основе экспериментов с разными концентра-
(PDB ID: 3FGC). Для люциферазы расчет площа-
циями альдегида
(10-50 мкM). Горизонтальная
ди поверхности, доступной растворителю, прово-
штриховая линия указывает на величину квантового
дили с помощью пробной сферы радиусом 1.4 Å.
выхода реакции в буфере.
Значения параметров среднеквадратичного от-
клонения и площади поверхности, доступной
Видно, что при разном количестве глицерина и
растворителю при различном содержании осмо-
литов, усредненные для последних 20 нс молеку-
сахарозы в среде данные параметры варьируют
лярного моделирования, представлены на рис. 2.
незначительно. Это говорит об отсутствии влия-
БИОФИЗИКА том 65
№ 6
2020
1138
СУКОВАТЫЙ и др.
Рис. 2. Значения среднеквадратичного отклонения Cα-атомов (а) и площади поверхности, доступной раствори-
телю (б), бактериальной люциферазы в средах с осмолитами, усредненные для последних 20 нс молекулярной ди-
намики. Штриховые горизонтальные линии показывают значения для люциферазы в воде.
ния рассматриваемых осмолитов на конформа-
люциферазы может объяснять увеличение кван-
цию люциферазы, аналогично тому, как это было
тового выхода реакции в присутствии 10% глице-
установлено для лизоцима [10]. Таким образом,
рина и сахарозы, наблюдавшееся в эксперимен-
ингибирующее влияние на реакцию, катализиру-
тах in vitro (рис. 1в). Однако он не объясняет сни-
емую бактериальной люциферазой, сред с 30-
жение квантового выхода реакции при более
40% глицерина не связано с изменением структу-
высоких концентрациях глицерина.
ры фермента (взаимным положением атомов ос-
Доступность активного центра фермента для мо-
новной цепи).
лекул осмолитов. Проникновение молекул глице-
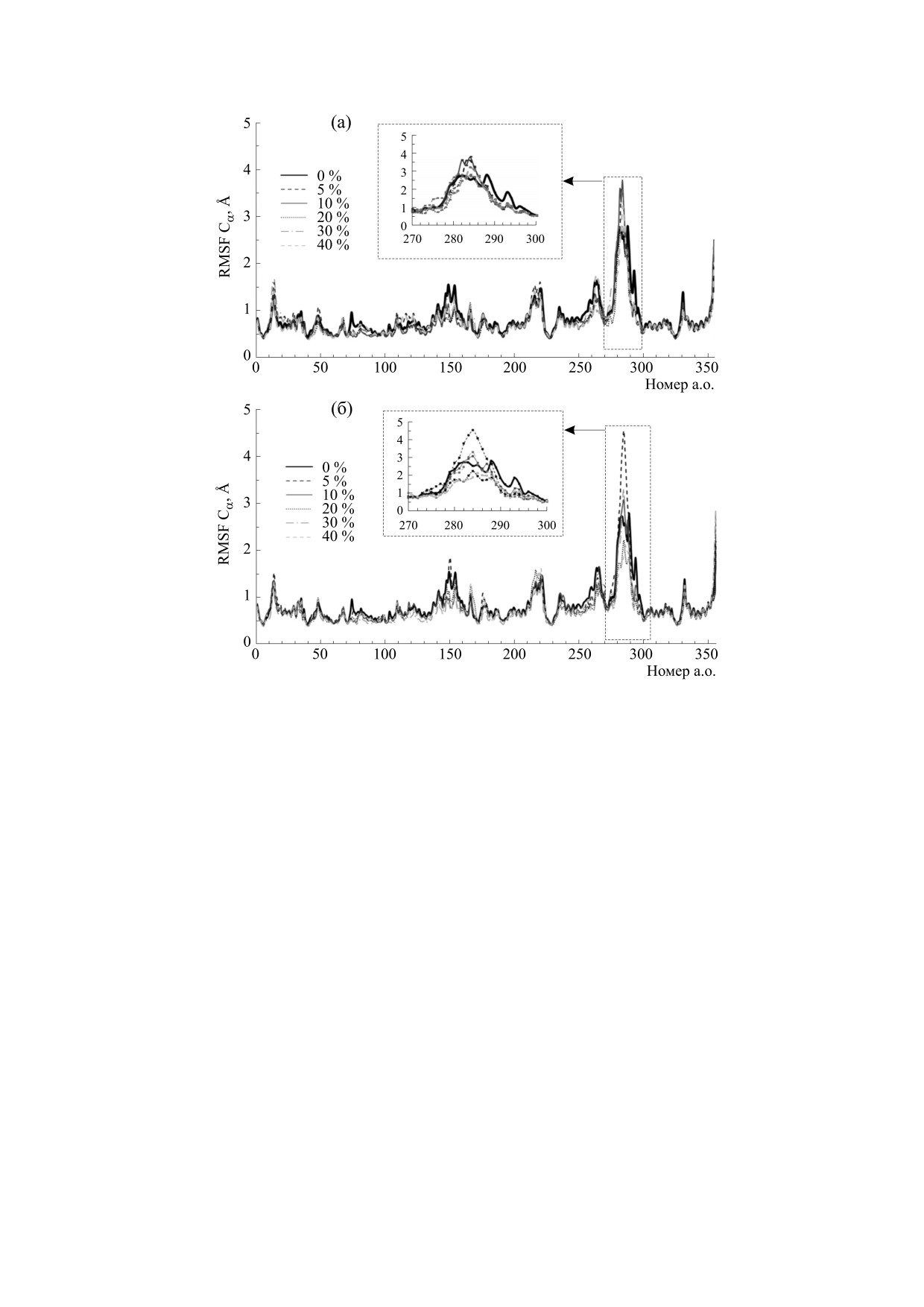
Влияние сред на динамические свойства бакте-
рина или сахарозы в область активного центра
риальной люциферазы. Для оценки подвижности
фермента может приводить к снижению эффек-
различных участков бактериальной люциферазы
тивности реакции за счет таких механизмов, как
в присутствии осмолитов на основе полученных
конкурентное ингибирование, изменение срод-
молекулярно-динамических траекторий был рас-
ства к субстрату посредством изменения поляр-
считан такой параметр, как среднеквадратичная
ности среды, нарушение сети водородных связей
флуктуация Cα-атомов α-субъединицы белка
между функционально важными аминокислот-
(рис. 3). Видно, что большинство Cα-атомов ис-
ными остатками и других [8, 11, 22].
пытывают небольшие колебания около своего
Для количественной оценки доступности ак-
положения с амплитудой ≤1 Å. Наиболее подвиж-
тивного центра бактериальной люциферазы для
ным элементом α-субъединицы как в водном
молекул осмолитов было вычислено число моле-
окружении, так и в присутствии осмолитов явля-
кул глицерина и сахарозы, находящихся на рас-
ется мобильная петля (262-291 а.о.). Получено,
стоянии ≤ 8 Å от атома серы αCys106. В рассмат-
что при 5-10%-м содержании глицерина и саха-
риваемую область вошли все аминокислотные
розы в среде наблюдается увеличение средне-
остатки, участвующие в связывании флавина.
квадратичной флуктуации данного участка
Расчет и усреднение количества молекул осмоли-
структуры, особенно аминокислотных остатков
тов проводили для последних 20 нс моделирова-
282-285 (рис. 3, врезки). При дальнейшем росте
ния динамики белка в различных средах.
концентрации осмолитов влияние среды на по-
Установлено, что присутствие молекул глице-
движность петли пропадает. Известно, что мо-
рина в активном центре наблюдается при всех его
бильная петля α-субъединицы играет важную
концентрациях, изменяется только доля време-
роль в ходе ферментативной реакции [13, 20].
ни, в течение которого глицерин находится там
Считается, что данный участок отвечает за стаби-
(таблица). При концентрациях 30 и 40% в сред-
лизацию интермедиатов реакции и предотвраща-
нем хотя бы одна молекула глицерина находится
ет попадание молекул растворителя в активный
в активном центре в течение всего времени моде-
центр после связывании белка с флавином [21].
лирования, а количество молекул воды снижает-
Полученный эффект сред с низкими концен-
ся. В то же время в активном центре фермента не
трациями глицерина и сахарозы на мобильность
было обнаружено ни одной молекулы сахарозы, а
функционально важного участка бактериальной
количество молекул воды оставалось неизмен-
БИОФИЗИКА том 65
№ 6
2020
ВЛИЯНИЕ ОСМОЛИТОВ НА БИОЛЮМИНЕСЦЕНТНУЮ РЕАКЦИЮ
1139
Рис. 3. Среднеквадратичная флуктуация Cα-атомов α-субъединицы люциферазы в присутствии различных концен-
траций глицерина (а) и сахарозы (б). На вставках показаны значения среднеквадратичной флуктуации для участка мо-
бильной петли фермента (части последовательности, выделенной серой штриховой рамкой).
ным при увеличении концентрации сахарозы в
является актуальной задачей как с точки зрения
среде.
необходимости понимания принципов организа-
Данный результат может объяснять снижение
ции метаболизма клеток в экстремальных усло-
квантового выхода биолюминесцентной реакции
виях, так и учитывая потребность в разработке
методов стабилизации и активации полипепти-
в средах с 30 и 40% глицерина и отсутствие такого
эффекта при больших концентрациях сахарозы.
дов для нужд биотехнологии. Биолюминесцент-
Разница в доступности области активного центра
ная реакция бактерий широко используется как
люциферазы для глицерина и сахарозы может
элемент различных биоаналитических систем
быть связана с размерами этих молекул (их моле-
[23, 24].
кулярная масса составляет 92 и 342 Да соответ-
В данной работе было рассмотрено влияние
ственно). Вероятно, бóльшая по размеру молеку-
растворов глицерина и сахарозы (10-40%) на эф-
ла сахарозы испытывает стерические ограниче-
фективность биолюминесцентной реакции бак-
ния, не позволяющие ей проникать в активный
терий. Экспериментально было зарегистрирова-
центр фермента, в отличие от молекулы глицери-
но увеличение квантового выхода реакции при
на. Аналогичный эффект для других белков был
концентрации 10% для обоих осмолитов. В то же
ранее продемонстрирован в ряде работ [7, 8, 22].
время в присутствии 30 и 40% глицерина проис-
ходит снижение количества квантов света, испус-
каемых за один оборот фермента, а высокие кон-
ЗАКЛЮЧЕНИЕ
центрации сахарозы не изменяют эффективность
Исследование механизмов влияния природ-
реакции. Моделирование молекулярной динами-
ных осмолитов на структуру и функцию белков ки бактериальной люциферазы в окружении мо-
БИОФИЗИКА том 65
№ 6
2020
1140
СУКОВАТЫЙ и др.
Число молекул воды и осмолитов в активном центре бактериальной люциферазы
Число молекул воды в активном
Число молекул осмолита
Параметр
центре, шт.
в активном центре, шт.
Добавляемый осмолит
Глицерин
Сахароза
Глицерин
Сахароза
0
20,1 ± 5,8
0
5
19,7 ± 2,6
19,0 ± 2,5
0,2 ± 0,4
0
10
16,5 ± 4,5
19,4 ± 3,6
0,5 ± 0,6
0
20
20,6 ± 2,2
20,8 ± 3,4
0,2 ± 0,4
0
30
15,9 ± 4,0
21,6 ± 2,3
1,1 ± 0,8
0
40
14,4 ± 3,3
20,6 ± 2,2
1,5 ± 0,7
0
Примечание. Усреднение проведено по последним 20 нс моделирования.
лекул воды и различного количества молекул
ФИНАНСИРОВАНИЕ РАБОТЫ
осмолитов позволило установить возможные ме-
Исследование выполнено при частичной фи-
ханизмы наблюдаемых эффектов: при малых
нансовой поддержке Министерства науки и выс-
концентрациях глицерина и сахарозы наблюдает-
шего образования РФ (№ FSRZ-2020-0006) и
ся увеличение подвижности мобильной петли
Российского фонда фундаментальных исследова-
ний (№ 19-04-00420 и № 20-34-90118\20).
белка, а при высоких концентрациях глицерина
его молекулы непрерывно присутствуют в обла-
сти активного центра фермента. При этом кон-
КОНФЛИКТ ИНТЕРЕСОВ
формация бактериальной люциферазы не пре-
Авторы заявляют об отсутствии конфликта
терпевает существенных изменений в средах с
интересов.
глицерином и сахарозой. Таким образом, в работе
установлено, что влияние исследованных осмо-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
литов на функционирование биолюминесцент-
ной системы бактерий может осуществляться че-
Настоящая работа не содержит описания ка-
ких-либо исследований с использованием людей
рез изменение динамических, а не структурных,
и животных в качестве объектов.
свойств люциферазы. Интересным новым ре-
зультатом работы является выявленная избира-
тельность активного центра бактериальной лю-
СПИСОК ЛИТЕРАТУРЫ
циферазы относительно химической природы
1. Е. В. Немцева и Н. С. Кудряшева, Успехи химии 76
осмолита: молекулы сахарозы не проникают в об-
(1), 101 (2007).
ласть связывания субстратов даже при 40%-м
2. J. Lee, Bioluminescence, the nature of the light (Univer-
содержании в среде, в отличие от молекул глице-
sity of Georgia, 2017).
рина.
3. P. H. Yancey, M. E. Clark, S. C. Hand, et al., Science
217 (4566), 1214 (1982).
Следует заметить, что для понимания того, ка-
4. I. Dandapath, M. Chatterjee, D. Sarkar, et al., in Cel-
кой эффект оказывают осмолиты на бактериаль-
lular osmolytes: From chaperoning protein folding to
clinical perspectives, Ed. by S. L. Rajendrakumar and
ную биолюминесценцию in vivo, требуется изуче-
T. A. Dar (Springer, Singapore, 2017) pp. 229-249.
ние их влияния на активность других ферментов,
5. O. S. Sutormin, I. E. Sukovataya, S. Pande, and
обеспечивающих свечение бактерий: например,
V. A. Kratasyuk, Mol. Catalysis 458, 60 (2018).
NADH:FMN-оксидоредуктазы, работающей в
6. О. С. Сутормин, И. Е. Суковатая и В. А. Кратасюк,
сопряжении с люциферазой [25].
Вестн. Оренбург. гос. ун-та 10, 159 (2013).
БИОФИЗИКА том 65
№ 6
2020
ВЛИЯНИЕ ОСМОЛИТОВ НА БИОЛЮМИНЕСЦЕНТНУЮ РЕАКЦИЮ
1141
7. А. В. Фонин, В. Н. Увеpcкий, И. М. Кузнецова и К.
17. R. B. Best, X. Zhu, J. Shim, et al., J. Chem. Theory
К. Туpовеpов, Биофизика 61 (2), 222 (2016).
Comput. 8, 3257 (2012).
8. P. Masson, S. Lushchekina, L. M. Schopfer, and
18. A. Gutmanas, Y. Alhroub, G. M. Battle, et al., Nucl.
O. Lockridge, Biochem. J. 454 (3), 387 (2013).
Acids Res. 42, 285 (2014).
9. V. Vagenende, M. G. S. Yap, and B. L. Trout, Biochem.
19. K. Vanommeslaeghe, E. Hatcher, C. Acharya, et al., J.
48, 11084 (2009).
Comput. Chem. 31, 671 (2010).
10. A. Lerbret, P. Bordat, F. Affouard, et al., J. Phys.
Chem. B 111, 9410, (2007).
20. R. Tinikul and P. Chaiyen, Adv. Biochem. Eng. Bio-
technol. 154, 47 (2016).
11. Y. Meng, Y. Yuan, Y. Zhu, et al., J. Mol. Model. 19 (9),
3749 (2013).
21. J. C. Low and S.-C. Tu, Biochemistry 41 (6), 1724
12. G. Gadda and P. Sobrado, Biochem. 57 (25), 3445
(2002).
(2018).
22. Д. Э. Хоштария, Н. Г. Гогуадзе и Е. Ульструп,
13. Z. T. Campbell, A. Weichsel, W. R. Montfort, and
Биоорган. химия 17 (5), 618 (1991).
T. O. Baldwin, Biochemistry 48, 6085 (2009).
23. E. Esimbekova, V. Kratasyuk, and O. Shimomura, Adv.
14. H. M. Berman, J. Westbrook, Z. Feng, et al., Nucl. Ac-
Biochem. Eng. Biotechnol. 144, 67 (2014).
ids Res. 28, 235 (2000).
24. E. N. Esimbekova, E. V. Nemtseva, A. E. Bezrukikh,
15. Z. T. Campbell, Thomas O. Baldwin, and O. Miyashi-
et al., Toxic. in Vitro 45, 128 (2017).
ta, Biophys. J. 99, 4012 (2010).
16. D. Van Der Spoel, E. Lindahl, B. Hess, et al., J. Com-
25. A. A. Deeva, E. A. Zykova, E. V. Nemtseva, and
put. Chem., 26 (16), 1701, (2005).
V. A. Kratasyuk, Proteins 87 (9), 723 (2019).
The Effects of Osmolytes on the Bioluminescent Reaction of Bacteria:
Structural and Dynamic Aspecìts
L.A. Sukovatyi*, A.E. Lisitsa*, V.A. Kratasyuk*, **, and E.V. Nemtseva*, **
*Siberian Federal University, Svobodnyi prosp. 79, Krasnoyarsk, 660041 Russia
**Institute of Biophysics, Siberian Branch of the Russian Academy of Sciences,
Akademgorodok 50/50, Krasnoyarsk, 660036 Russia
The effects of viscous media with glycerol and sucrose (10-40%) on the kinetics of the bacterial biolumines-
cent reaction have been investigated by stopped-flow technique. Increment of quantum yield in media with
10% of both osmolytes was shown. Higher concentrations of glycerol, up to 30-40%, were found to reduce
the efficiency of the reaction, while this effect was not observed in the media with sucrose. The molecular
dynamics simulation was used to study the structure of bacterial luciferase surrounded by either water mole-
cules solely or by mixture of water with various numbers of glycerol/sucrose molecules. It was found that both
cosolvents at studied concentrations did not cause a significant change in conformation of bacterial lucifer-
ase. The calculated root mean square fluctuations for Cα-atoms of bacterial luciferase α-subunit indicated
that the higher flexibility of the enzyme mobile loop could be responsible for increment of quantum yield in
the presence of 10% of both osmolytes. The active site of bacterial luciferase was found to be accessible for
glycerol molecules while sucrose did not enter catalytic gorge. Moreover, at 30% and 40% concentration the
glycerol molecules were found to locate in the active site of bacterial luciferase throughout the whole simula-
tion time (40 ns) and to exclude water molecules, which can explain the experimentally obtained reaction
quantum yield decrease.
Keywords: bioluminescence, luminous bacteria, bacterial luciferase, osmolyte, molecular dynamics, protein struc-
ture and dynamics
БИОФИЗИКА том 65
№ 6
2020