БИОФИЗИКА, 2020, том 65, № 6, с. 1142-1153
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА C ТИОЛСОДЕРЖАЩИМИ
ЛИГАНДАМИ ПРЕДСТАВЛЕНЫ В ЖИВЫХ ОРГАНИЗМАХ
В ОСНОВНОМ ИХ БИЯДЕРНОЙ ФОРМОЙ
© 2020 г. В.Д. Микоян*, Е.Н. Бургова*, Р.Р. Бородулин*, А.Ф. Ванин*, **
*Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН, 119334, Москва, ул. Косыгина, 4
**Институт регенеративной медицины Первого Московского государственного медицинского университета
имени И.М. Сеченова МЗ РФ, 119991, Москва, ул. Трубецкая, 8/2
E-mail: vanin@polymer.chph.ras.ru
Поступила в редакцию 26.06.2020 г.
После доработки 26.06.2020 г.
Принята к публикации 29.06.2020 г.
Методом электронного парамагнитного резонанса оценено количество мононитрозильных ком-
плексов железа с диэтилдитиокарбаматом, образующихся в печени мышей in vivo и in vitro после
внутрибрюшинного введения биядерных динитрозильных комплексов железа с N-ацетил-L-цисте-
ином или глутатионом, S-нитрозоглутатиона, нитрита натрия или вазодилатирующего препарата
Изокет®. В противоположность комплексам, образующимся после введения нитрита или Изокета,
уровень которых резко возрастал после обработки препаратов печени сильным восстановителем -
дитионитом, количество мононитрозильнных комплексов железа с диэтилдитиокарбаматом,
появившихся в печени мышей после введения им биядерных динитрозильных комплексов железа с
N-ацетил-L-цистеином или глутатионом или S-нитрозоглутатиона, в присутствии дитионита не
изменялось. Сделан вывод, что в первом случае ЭПР-детектируемые мононитрозильные комплек-
сы железа с диэтилдитиокарбаматом в отсутствие и в присутствии дитионита возникали в результа-
те реакции NO, образующегося из нитрита, соответственно с комплексами Fe2+-диэтилдитиокар-
бамата и Fe3+-диэтилдитиокарбамата. Во втором случае мононитрозильные комплексы железа с ди-
этилдитиокарбаматом возникали в результате перехода железо-мононитозильных фрагментов из
готовых железо-динитрозильных групп биядерных динитрозильных комплексов, в три-четыре раза
превышающих содержание в ткани моноядерной формы этих комплексов. Полученные результаты
позволяют утверждать, что при появлении в тканях животных in vivo динитрозильных комплексов
железа с тиолсодержащими лигандами, либо введенных в организм, либо продуцируемых при уча-
стии эндогенного NO, данные комплексы представлены в этих тканях преимущественно их диамаг-
нитной, ЭПР-недектируемой биядерной формой.
Ключевые слова: мононитрозильные комплексы железа, динитрозильные комплексы железа, биядерная
форма динитрозильных комплексов.
DOI: 10.31857/S0006302920060149
содержащими лигандами [3]. В том же году по
В 1964-1965 гг. Р.М. Налбандяном и А.Ф. Ва-
сигналу 2.03 эти комплексы были зарегистриро-
ниным в дрожжевых клетках по характерному
ваны и в тканях животных [4]. Последующие дли-
сигналу ЭПР со значениями g-фактора g⊥ = 2.04 и
тельные исследования позволили нашей группе
= 2.014 (названным в соответствии с его сред-
g||
(под руководством А.Ф. Ванина) установить не
ним значением сигналом 2.03) были обнаружены
только их состав и происхождение, но и проде-
парамагнитные центры [1, 2], идентифицирован-
монстрировать разнообразную биологическую
ные в 1967 г. как моноядерная форма динитро-
активность этих комплексов, обусловленную их
зильных комплексов железа (М-ДНКЖ) с тиол-
способностью выступать в качестве доноров од-
ного из универсальных регуляторов метаболиче-
Сокращения: М-ДНКЖ - моноядерная форма динитро-
ских процессов во всех представителях живого
зильных комплексов железа, Б-ДНКЖ - биядерная форма
динитрозильных комплексов железа, ДЭТК - диэтилди-
мира - монооксида азота (NO) или, как сейчас
тиокарбамат, МГД - N-метил-D-глюкамин-дитиокарба-
принято говорить, оксида азота [5, 6].
мат, МНКЖ - мононитрозильные комплексы железа,
GSH - глутатион, NAC - N-ацетил-L-цистеин, GS-NO -
В настоящее время установлено, что наряду с
S-нитрозоглутатион, ПДК - производные дитиокарбамата.
моноядерной формой ДНКЖ с тиолсодержащими
1142
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
1143
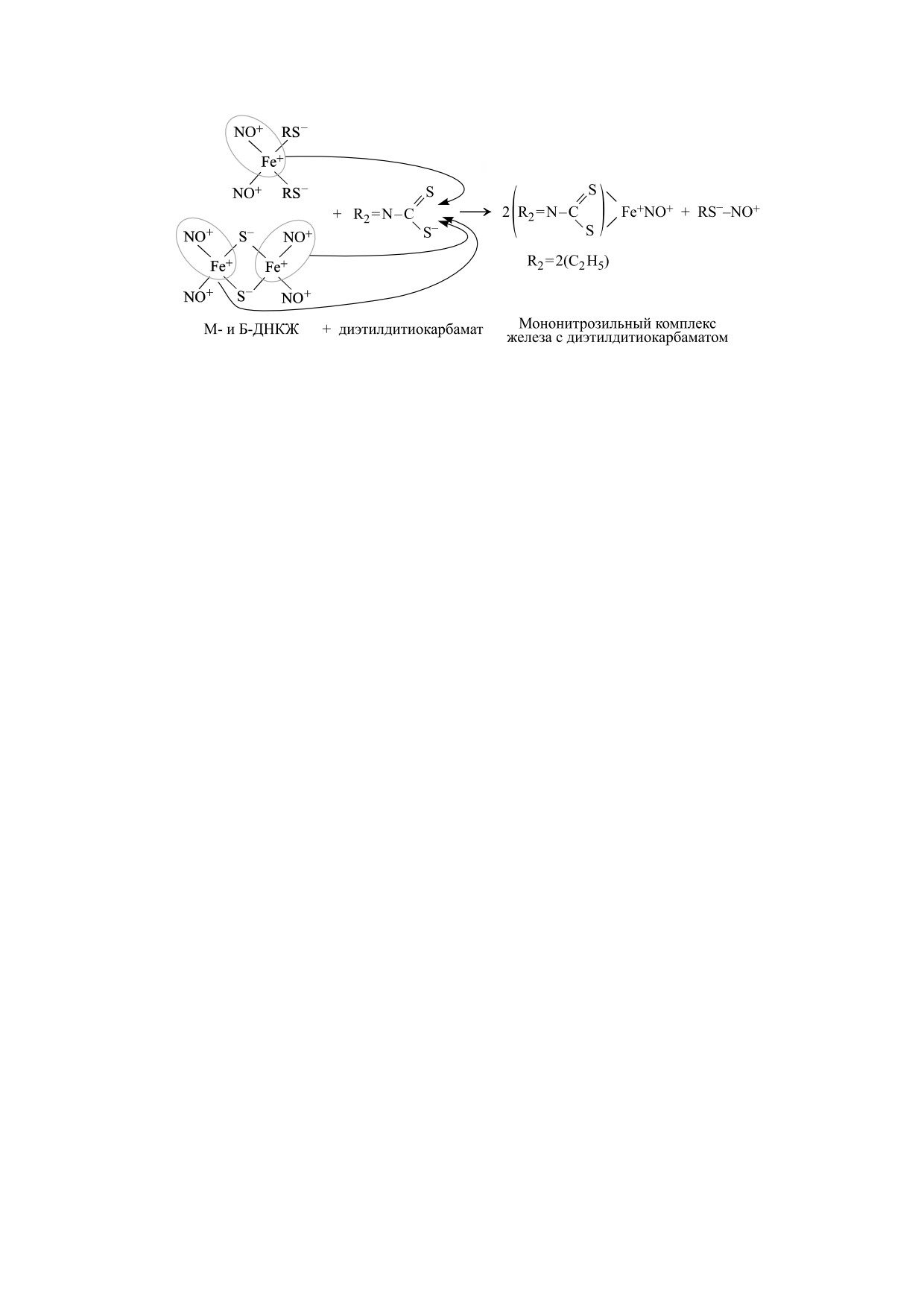
Рис. 1. Механизм превращения М- и Б-ДНКЖ с тиолсодержащими лигандами в МНКЖ с диэтилдитиокарбаматом.
лигандами в различных биообъектах может возни-
водными дитиокарбамата - диэтилдитиокарба-
кать и биядерная, диамагнитная (ЭПР-недетекти-
матом (ДЭТК) или N-метил-D-глюкамин-дитио-
руемая) форма этих комплексов - Б-ДНКЖ [5-
карбаматом (МГД), способными в соответствии
10]. Изучение электронной и пространственной
со схемой, приведенной на рис. 1 [7, 8], перехва-
структуры обеих форм ДНКЖ, их способности
тывать на себя железо-мононитрозильный фраг-
выступать не только в качестве доноров ней-
мент из железо-динитрозильной группы Б-ДНКЖ
тральных молекул NO, но и в качестве производ-
с образованием ЭПР-детектируемых мононитро-
ных этих молекул, не менее биологически актив-
зильных комплексов железа (МНКЖ) с ДЭТК
ных - катионов нитрозония (NO+), позволило
или МГД, а также S-нитрозотиолы (RS--NO+).
нам предложить для М- и Б-ДНКЖ формулы, ха-
МНКЖ-ДЭТК, будучи водонерастворимыми
рактеризующие одну из основных резонансных
комплексами, локализуются преимущественно в
структур этих комплексов, соответственно как
гидрофобных компартментах мембран, тогда как
МНКЖ-МГД (водорастворимые комплексы) - в
[(RS-)2Fe+(NO+)2] и [(RS-)2(Fe+)2(NO+)4] [5, 6].
водосодержащих областях клеток и тканей.
Более того, в настоящее время есть основание
В работе
[8] мы изучили взаимодействие
полагать, что ДНКЖ с тиолсодержащими лиган-
ДЭТК и МГД с изолированными органами мы-
дами, образующиеся в различных живых орга-
шей, в организм которых предварительно внут-
низмах, продуцирующих оксид азота, функцио-
рибрюшинно вводили в качестве возможных эк-
нируют в этих организмах в качестве «рабочей
зогенных доноров NO нитрит натрия, органиче-
формы» этого агента, т.е. оксид азота способен
ский нитрит (изосорбида динитрат) или
оказывать физиологическое действие на орга-
S-нитрозоглутатион. Кроме того, некоторые ор-
низм животных и человека только после его
ганы in vitro обрабатывали газообразным NO с по-
включения в ДНКЖ как в форме NO, так и в форме
следующей инкубацией этих органов в растворах
NO+. ДНКЖ обеспечивает депонирование и стаби-
ДЭТК или МГД. Что касается эндогенного NO,
лизацию этих агентов с последующей их доставкой
его появление в организме мышей в высоком ко-
к мишеням их биологического действия - соот-
личестве инициировали активацией воспали-
ветственно к гем- и тиолсодержащим белкам. По-
тельных процессов, что достигалось введением в
следующее связывание NO и NO+ соответствен-
организм животных бактериальных липополиса-
но с гемовой или тиоловой группами этих белков,
харидов. В результате в органах мышей начинался
приводящее соответственно к образованию нит-
усиленный синтез мощного NO-генератора - ин-
розильных комплексов гемового железа или
дуцибельной NO-синтазы. Повышение уровня
S-нитрозотиолов, вызывает резкое изменение
NO в печени мышей, которое мы оценивали по
конформации этих белков и тем самым их акти-
количеству МНКЖ-ДЭТК, возникших in vivo в
вацию или дезактивацию [5, 6].
результате связывания NO с его ловушками -
комплексами железа с ДЭТК, сопоставлялось за-
В последнее время нами были получены дан-
тем с количеством МНКЖ-ДЭТК, образовав-
ные, свидетельствующие о том, что в тканях жи-
шихся in vitro в печени мышей, обработанных ли-
вотных образующиеся в них ДНКЖ с тиолсодер-
пополисахаридами, после выдерживания этой
жащими лигандами представлены преимуще-
ткани в растворе ДЭТК.
ственно биядерной формой этих комплексов [7,
8]. Эти результаты были получен в опытах с обра-
Что касается работы [7], то в ней обработку изо-
боткой изолированных органов животных произ-
лированной печени растворами ДЭТК проводили
БИОФИЗИКА том 65
№ 6
2020
1144
МИКОЯН и др.
путем ее перфузии этими растворами. Было пока-
Полученную таким образом суспензию остав-
зано, что внутрибрюшинное введение мышам Б-
ляли на воздухе при комнатной температуре на 8-
ДНКЖ с глутатионом приводило к образованию в
12 ч до полного осаждения железо-гидроокисных
печени этих животных значительного количества
комплексов, удалявшихся из раствора Б-ДНКЖ
МНКЖ-ДЭТК, в четыре-пять раз превышавшего
его фильтрацией на бумаге. Концентрацию со-
уровень М-ДНКЖ, появлявшийся в печени in vivo
хранившихся при этом Б-ДНКЖ-GSH определя-
после введения мышам Б-ДНКЖ с глутатионом.
ли по интенсивности характерных для этих ком-
плексов полос на 310 и 360 нм с коэффициентами
В связи с этим встает вопрос, действительно ли
экстинкции, равными соответственно
4600 и
введение животным перечисленных выше доно-
3700 М-1см-1 (в пересчете на один атом железа в
ров NO приводило во всех случаях к образованию
Б-ДНКЖ) [9]. Концентрация синтезированных
в печени (а возможно, и в других органах живот-
таким образом Б-ДНКЖ-GSH в среднем состав-
ных) диамагнитных Б-ДНКЖ с тиолсодержащи-
ляла 9.5 мМ.
ми лигандами, превращавшихся под действием
ДЭТК (или МГД) в парамагнитные, ЭПР-детек-
Аналогичным образом синтезировали ком-
тируемые МНКЖ-ДЭТК(МГД)? В настоящей ра-
плексы Б-ДНКЖ с N-ацетил-L-цистеином
боте мы попытались, проведя соответствующие
(Б-ДНКЖ-NAC) за следующими исключениями.
эксперименты, ответить на этот вопрос.
На синтез S-нитрозо-NAC затрачивали не более
20 мин, на синтез Б-ДНКЖ-NAC - не более 3-
4 ч. В ряде экспериментов мы использовали
МАТЕРИАЛЫ И МЕТОДЫ
Б-ДНКЖ-GSH(NAC), синтезированные путем
обработки газообразным NO растворов Fe2+ c по-
Материалы. В экспериментах использовали
следующим контактом этих растворов с раствора-
ферросульфат (FeSO4 . 7H2O) (Fluka, Швейца-
ми GSH или NAC по методике, описанной в ра-
рия), восстановленный глутатион (GSH), дитио-
боте [9].
нит натрия, N-ацетил-L-цистеин (NAC) и цитрат
Для получении S-нитрозоглутатиона (GS-NO)
натрия (все - от Sigma, США), изосорбида ди-
к 5.5 мМ раствору глутатиона в 15 мМ HEPES-бу-
нитрат (ISDN, изокет) (UCB Farma, Ирландия) и
фере, рН которого снижался после введения глу-
ДЭТК (Acros, США). Газообразный NO получали
татиона с нейтральных значений до рН 3.0-3.5,
в реакции ферросульфата с нитритом натрия в
на воздухе добавляли 5 мМ нитрита натрия, после
0.1 М HCl с последующей очисткой от примеси
чего раствор приобретал розовую окраску, харак-
NO2 методом низкотемпературной сублимации в
терную для GS-NO. Концентрацию последнего
вакуумированной системе [9].
определяли по интенсивности его основной по-
Синтез Б-ДНКЖ с глутатионом или N-ацетил-
лосы поглощения на 334 нм с коэффициентом
L-цистеином и S-нитрозоглутатиона. Б-ДНКЖ-
экстинкции, равным 0.94 М-1см-1 [11].
GSH синтезировали по методу, описанному в ра-
Исследования на животных. Эксперименты
боте [10]. В 10 мл 15 мМ HEPES-буфера, рН 7.4
проводили на белых беспородных мышах-самцах
последовательно растворяли 120 мг глутатиона
массой 18-20 г. Все вещества, за исключением
(40 мМ), 56 мг ферросульфата (20 мМ) и 14 мг
цитратных комплексов железа, вводили живот-
нитрита натрия. Введение в раствор глутатиона
ным внутрибрюшинно в 0.2 мл физиологическо-
приводило к существенному снижению рН этого
го раствора в следующих дозах: NaNO2 - 50 мг/кг
раствора (до 3.5), что обеспечивало растворение
ферросульфата без образования водонераствори-
(0.7 мМ/кг), изокет (ISDN) - 1 мМ/кг, ДЭТК -
мых гидроокисных комплексов железа и последу-
500 мг/кг (3 мМ/кг), GS-NO - 0,2 мМ/кг,
ющее образование GS-NO при введении в рас-
Б-ДНКЖ-GSH(NAC) - 0.12-0.15 мМ/кг (в пере-
твор нитрита. Последнее сопровождалось розо-
счете на один атом железа в Б-ДНКЖ). Fe-цитрат
вым окрашиванием раствора. По завершении
вводили внутримышечно в лапу в следующих до-
синтеза GS-NO через один-полтора часа (о чем
зах: FeSO4. 7H2O - 37.5 мг (0.135 мМ/кг), цитрат -
можно было судить по интенсивности полосы по-
187.5 мг (0.675 мМ/кг).
глощения GS-NO на длине волны 334 нм), рН
раствора повышали до нейтральных значений,
Животных, обработанных NaNO2, ISDN, GS-
добавляя в раствор каплями 0.1 М раствор NaOH.
NO или Б-ДНКЖ-GSH одновременно с введени-
При этом окраска раствора изменялась от розо-
ем им Fe-цитратных комплексов, через 30 мин де-
вой до темно-оранжевой, характерной для обра-
капитировали, извлекали у них печень, помеща-
зующихся комплексов Б-ДНКЖ с глутатионом
ли в ЭПР-ампулы и замораживали в жидком азо-
(Б-ДНКЖ-GSH). При этом ионное железо, не
те. После регистрации в этих образцах спектров
включившееся в эти комплексы, начинало посте-
ЭПР их размораживали и выдерживали в 200 мМ
пенно выпадать в осадок в форме железо-гидро-
растворе ДЭТК при комнатной температуре в те-
окисных комплексов.
чение 30 мин, затем снова замораживали в ЭПР-
БИОФИЗИКА том 65
№ 6
2020
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
1145
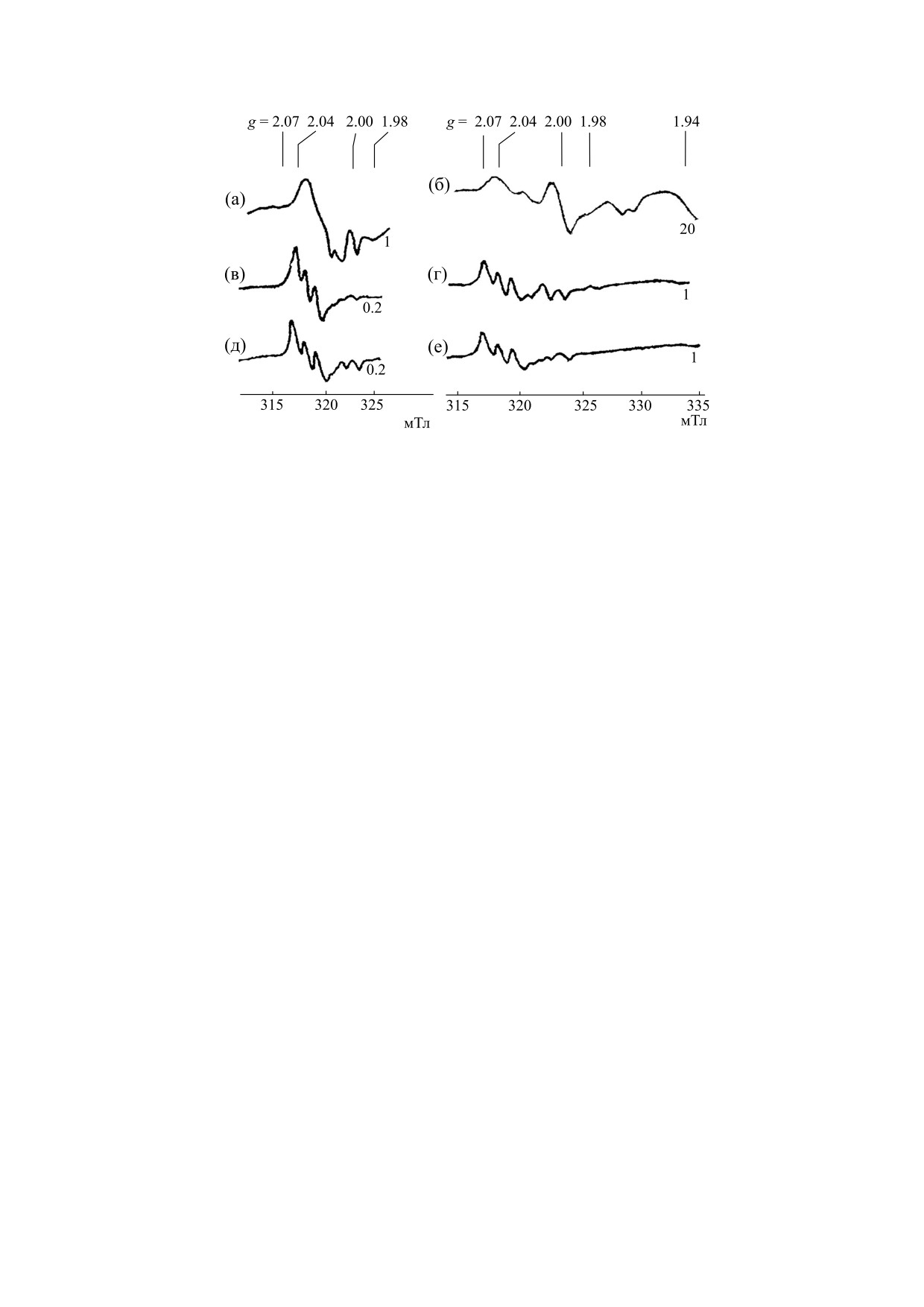
Рис. 2. Спектры ЭПР, зарегистрированные: (а, б) - в печени мышей через 30 мин после внутрибрюшинного введения
им Б-ДНКЖ-NAC или ДНКЖ-GSH, (в, г) - через 30 мин инкубации препаратов печени таких же мышей в 200 мМ
растворе ДЭТК, (д, е) - в печени таких же мышей с последующим внутрибрюшинным введением им на 30 мин ДЭТК.
Спектры зарегистрированы при 77 К. Справа указано усиление радиоспектрометра в отн. ед.
ампулах и снова регистрировали в этих образцах
500 мг/кг (3 мМ/кг) через полчаса после инъек-
спектры ЭПР.
ции им Б-ДНКЖ-NAC на полчаса вызывало пол-
ное исчезновение в печени этих животных сигна-
ЭПР-измерения проводили на модифициро-
ла 2.03. Вместо него регистрировался интенсив-
ванном ЭПР-радиоспектрометре Radio-Pan
ный ЭПР-сигнал МНКЖ-ДЭТК со значениями
(Польша) Х-диапазона при 77 К в образцах пече-
g⊥ = 2.035, g|| = 2.02 и триплетной сверхтонкой
ни в цилиндрических ЭПР-ампулах диаметром
4 мм, помещаемых в палец кварцевого сосуда
структурой при g⊥ (рис. 2д). В соответствии с этим
Дьюара. Концентрацию парамагнитных центров
сигналом концентрация МНКЖ-ДЭТК суще-
определяли методом двойного интегрирования
ственно превышала уровень М-ДНКЖ и состав-
сигналов ЭПР, используя в качестве стандартно-
ляла 400 ± 30 микромолей на 1 кг влажной ткани
го образца замороженный раствор М-ДНКЖ-
печени.
GSH с известной концентрацией.
Иная ситуация наблюдалась в опытах, в кото-
Статистический анализ. Экспериментальные ре-
рых образцы печени, взятые у мышей через пол-
зультаты представляли в виде средних величин ±
часа после введения им Б-ДНКЖ-NAC, инкуби-
среднее отклонение (по трем-четырем измерениям).
ровали на воздухе в 15 мМ HEPES-буфере при
рН 7.4, содержавшем 200 мМ ДЭТК. Такая обра-
ботка также приводила к исчезновению в препа-
РЕЗУЛЬТАТЫ
ратах печени М-ДНКЖ и появлению в них МН-
КЖ-ДЭТК (рис. 2в). Однако в этом случае кон-
Образование МНКЖ-ДЭТК в ткани печени жи-
центрация последних не превышала уровня
вотных, обработанных Б-ДНКЖ-NAC или
исходных М-ДНКЖ. Обработка этих препаратов
Б-ДНКЖ-GSH. Внутрибрюшинное введение
сильным восстановителем - дитионитом натрия,
мышам Б-ДНКЖ-NAC в дозе 0.12-0.15 мМ/кг
вводившемся в препараты в порошкообразной
массы животных приводило к появлению в их пе-
форме, не влияла на содержание МНКЖ-ДЭТК
чени М-ДНКЖ, концентрация которых, судя по
(данные не приводятся).
интенсивности характерного для этих комплек-
сов сигнала 2.03 (рис. 2а), практически не изме-
В аналогичных опытах на животных, в кото-
нялась в течение часа после введения Б-ДНКЖ и
рых Б-ДНКЖ-NAC были заменены на Б-ДНКЖ-
составляла 90 ± 20 микромолей на 1 кг влажной
GSH, были получены идентичные результаты
ткани печени. Дополнительное внутрибрюшин-
(рис. 2, правая панель). Различие состояло лишь в
ное введение этим животным ДЭТК в дозе
том, что при внутрибрюшинном введении мы-
БИОФИЗИКА том 65
№ 6
2020
1146
МИКОЯН и др.
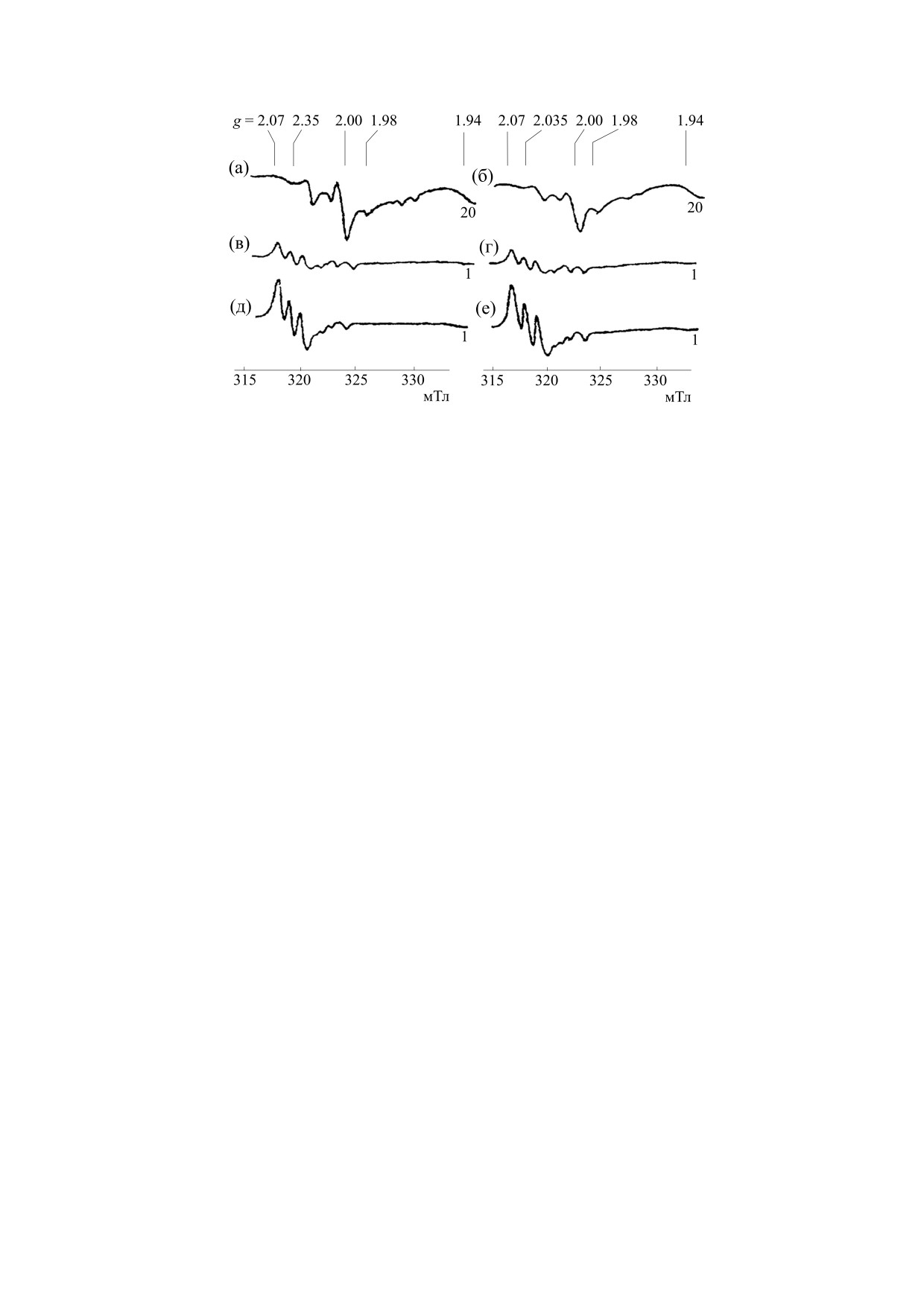
Рис. 3. Слева: спектры ЭПР препаратов печени мышей: (а) - обработанных in vitro газообразным NO при давлении
150 торр, (в) - с последующей 30-минутной инкубацией этих препаратов в 200 мМ растворе ДЭТК, (д) - затем
обработанных дитионитом. Справа: (б) - спектры ЭПР, зарегистрированные в печени мышей через 30 мин после
внутрибрюшинного введения им GS-NO, (г) - с последующей 30-минутной обработкой этих препаратов 200 мМ
раствором ДЭТК, (е) - далее обработанных дитионитом. Спектры зарегистрированы при 77 К.
шам Б-ДНКЖ-GSH и ДЭТК в тех же дозах, что и
при средней концентрации М-ДНКЖ, равной
в опытах с использованием Б-ДНКЖ-NAC, уро-
40 ± 10 микромолей/кг влажной ткани (рис. 3а,в).
вень образующихся М-ДНКЖ и МНКЖ-ДЭТК
Характерно, что и в этом случае обработка препа-
был существенно ниже, достигая соответственно
ратов печени, содержавших МНКЖ-ДЭТК, ди-
концентраций 15 ± 5 и 80 ± 15 микромолей на 1 кг
тионитом натрия не влияла на уровень этих ком-
влажной ткани (рис. 2б,е). Это снижение могло
плексов (рис. 3д). Как и в работе [8], приведен-
быть обусловлено более слабым проникновением
ный выше высокий уровень образующихся
Б-ДНКЖ-GSH из брюшины в кровеносные сосу-
МНКЖ-ДЭТК достигался в образцах печени мы-
ды, возможно, из-за существенно более низкой
шей, которым до их забоя внутрибрюшинно вво-
проницаемости клеточных мембран для глутати-
дили цитратный комплекс железа. Без такой об-
она по сравнению с уникально эффективным
работки животных концентрация МНКЖ-ДЭТК
проникновением сквозь мембраны N-ацетил-L-
в образцах печени снижалась в три-пять раз.
цистеина. При выдерживании изолированных
Следует отметить, что обработка препаратов
образцов печени в 200 мМ растворе ДЭТК уро-
печени in vitro газообразным NO приводила к об-
вень образующихся МНКЖ-ДЭТК составлял
разованию в них, кроме ДНКЖ, нитрозильных
20 ±
5 микромолей на
1 кг влажной ткани
комплексов гемсодержащих белков (преимуще-
(рис. 2г).
ственно гемоглобина), характеризующихся сиг-
Не обнаружено никаких различий в результа-
налом ЭПР с крайними значениями g-фактора,
тах вышеописанных экспериментов при введе-
равными 2.07 и 1.98 (рис. 3а).
нии животным Б-ДНКЖ c GSH или NAC, синте-
Образование МНКЖ-ДЭТК в ткани печени мы-
зированных с использованием либо соответству-
шей, обработанных in vivo S-нитрозоглутатионом.
ющих S-нитрозотиолов (GS-NO или S-нитрозо-
При одновременном введении мышам GS-NO и
NAC), либо газообразного NO.
Fe-цитратного комплекса через 30 мин в печени
Образование МНКЖ-ДЭТК в ткани печени мы-
этих животных, как и в опытах с введением им
шей, обработанной in vitro газообразным NO и ди-
Б-ДНКЖ с NAC или GSH, регистрировали сиг-
этилдитиокарбаматом. Как и в нашем предыду-
нал 2.03, интенсивность которого соответствова-
щем исследовании [8], обработка изолированной
ла концентрации М-ДНКЖ, не превышавшей 1-
печени мышей последовательно газообразным
2 микромолей на 1 кг влажной ткани (рис. 3б).
NO, а затем ДЭТК путем 30-минутной инкубации
При последующей 30-минутной инкубации этих
ткани в 200 мМ растворе ДЭТК при нейтральном
препаратов в 200 мМ растворе ДЭТК в них возни-
значении рН приводила к появлению в ткани
кали МНКЖ-ДЭТК в концентрации 10-5 микро-
МНКЖ-ДЭТК в концентрации, в среднем дости-
молей на 1 кг влажной ткани (рис. 3г). При после-
гавшей 250 ± 50 микромолей/кг влажной ткани
дующей обработке дитионитом препаратов пече-
БИОФИЗИКА том 65
№ 6
2020
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
1147
Рис. 4. (а, б) - Спектры ЭПР, зарегистрированные в печени мышей через 30 мин после внутрибрюшинного введения им
нитрита натрия или изокета; (в,г) - в препаратах печени таких же животных при последующем 30-минутном
внутрибрюшинном введении мышам ДЭТК; (д) - после последующей обработки этих препаратов в растворе ДЭТК, а
затем (е) дитионитом.
ни, содержавших МНКЖ-ДЭТК, уровень пос-
глобина. Что касается образования М-ДНКЖ в
ледних практически не изменялся (рис. 3е). Сле-
этих препаратах, наблюдавшегося в опытах с вве-
дует отметить, что в отличие от результатов опы-
дением животным Б-ДНКЖ или GS-NO, инъек-
тов с введением мышам «готовых» Б-ДНКЖ, с
ция нитрита не сопровождалась, судя по отсут-
последующим действием ДЭТК на печень этих
ствию в спектрах ЭПР сигнала 2.03, появлением
животных in vivo или in vitro, количество МНКЖ-
этих комплексов (рис. 4а). Этот результат, демон-
ДЭТК, образующихся в печени in vitro, было су-
стрирующий неспособность нитрита иницииро-
щественно меньше, чем в опытах in vivo (рис. 2); в
вать при одноразовом введении образования в
аналогичных опытах с введением мышам GS-NO
тканях животных in vivo М-ДНКЖ, многократно
существенных различий в количестве МНКЖ-
регистрировался нашей группой на всем более
ДЭТК в препаратах печени не обнаруживалось.
чем 50-летнем протяжении наших исследований
ДНКЖ в живых организмах [5, 6, 12-16].
Без добавления цитратных комплексов железа
мышам одновременно с GS-NO в печени
Обнаружилось и другое существенное отличие
этих животных, во-первых, не обнаруживалось
результатов опытов с введением мышам нитрита
и опытов с введением им Б-ДНКЖ или GS-NO, а
образования М-ДНКЖ, а во-вторых, уровень
МНКЖ-ДЭТК, возникавших в этом органе под
также опытов по обработке печени мышей газо-
действием ДЭТК, не превышал 0.15 микромолей
образным NO - а именно ∼ трехкратное повыше-
на 1 кг
ние содержания МНКЖ-ДЭТК в препаратах пе-
чени мышей с нитритом при их обработке силь-
Образование МНКЖ-ДЭТК в ткани печени мы-
ным восстановителем - дитионитом (рис. 4д).
шей, обработанных in vivo нитритом натрия или изо-
Трехкратное увеличение содержания МНКЖ-
кетом. При введении мышам нитрита натрия вме-
ДЭТК под действием дитионита наблюдалось
сте цитратным комплексом железа с последую-
(рис. 4е) и в опытах на препаратах печени мышей,
щей через полчаса обработкой печени ДЭТК
в организм которых вводили водорастворимую
in vivo или in vitro - соответственно путем допол-
форму нитроглицерина - изокет (ISDN) - прак-
нительной инъекции животным раствора ДЭТК в
тически в той же дозе, что и нитрит (рис. 4б,г,е).
дозе 500 мг/кг (3 мМ/кг) с последующим через
Не исключено, что это сходство с препаратами
полчаса забоем животных или получасовой инку-
печени мышей, которым вводили нитрит, могло
бацией печени мышей в 200 мМ растворе ДЭТК -
быть обусловлено тем, что при распаде в организ-
в обоих случаях в печени возникали, судя по ха-
ме изокет высвобождал не только NO, но и, как
рактерному для них сигналу ЭПР (рис. 4в),
указывается в его описании как лекарства [17],
МНКЖ-ДЭТК в примерно равной концентрации -
преимущественно анионы нитрита.
20 ± 5 микромолей на 1 кг влажной ткани. Без
контакта с ДЭТК в препаратах печени, судя по их
Следует отметить, что в экспериментах с вве-
спектрам ЭПР (рис. 4а), нитрит инициировал по-
дением нитрита и изокета без добавления живот-
явление только нитрозильных комплексов гемо-
ным цитратного комплекса железа уровень обра-
БИОФИЗИКА том 65
№ 6
2020
1148
МИКОЯН и др.
зующихся в печени мышей МНКЖ-ДЭТК был в
ния в печени полностью бы распадались, а обра-
три-четыре раза ниже приведенных выше вели-
зование МНКЖ-ДЭТК было бы обусловлено
чин (данные не приводятся).
связыванием c ДЭТК оксида азота, высвободив-
шегося из вводимых соединений или включени-
ем в этот процесс нитрита как продукта окисле-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ния NO, то дитионит как сильнейший восстано-
витель должен был повышать уровень
Перед тем как перейти к обсуждению получен-
парамагнитных, ЭПР-детектируемых МНКЖ-
ных результатов, обсудим возможные механизмы
ДЭТК. Факт полного отсутствия этого феномена
образования парамагнитных МНКЖ-ДЭТК, ко-
в экспериментах на всех препаратах печени мы-
торые могли бы реализоваться в наших опытах
шей, обработанных in vivo Б-ДНКЖ-GSH(NAC)
при введении мышам Б-ДНКЖ-GSH(NAC), GS-
или GS-NO, а также препаратов, обработанных
NO, нитрита или изокета, а также при обработке
in vitro газообразным NO, с большой вероятно-
изолированных препаратов печени газообразным
NO. В соответствии с многочисленными резуль-
стью свидетельствует о том, что во всех этих слу-
чаях в печени мышей in vivo возникали ДНКЖ с
татами изучения этого процесса, МНКЖ с произ-
тиолсодержащими лигандами. Об образовании
водными дитиокарбамата (ПДК), например, с
ДЭТК или МГД [18-27], могут возникать по двум
их моноядерной формы свидетельствовала реги-
следующим механизмам. Во-первых, при нали-
страция сигнала 2.03 (рис. 2а,б и 3а,б); о появле-
чии в органах животных ДНКЖ производные ди-
нии Б-ДНКЖ, причем в концентрации, в не-
тиокарбамата могут, как это показано на рис. 1,
сколько раз превышающей уровень М-ДНКЖ,
перехватывать на себя железо-мононитрозиль-
можно было судить по соответственно более вы-
ные фрагменты из «уже готовых» железо-динит-
сокой интегральной интенсивности сигнала ЭПР
розильных групп с образованием парамагнитных,
МНКЖ-ДЭТК по сравнению с аналогичной ха-
ЭПР-детектируемых МНКЖ, характеризующих-
рактеристикой сигнала 2.03.
ся формулой (ПДК)2-Fe2+-NO (или (ПДК)2-Fe+-
Повышение в три раза уровня МНКЖ-ДЭТК
NO+) [18, 20, 23, 25, 26]. Во-вторых, в отсутствие
под влиянием дитионита в препаратах печени
ДНКЖ, но при появлении в ткани NO, послед-
мышей, обработанных in vivo нитритом или изо-
ний может равноэффективно связываться с иона-
кетом (рис. 4д,е), свидетельствует о наличии в
ми двух- или трехвалентного железа с последую-
этих препаратах двух типов МНКЖ-ДЭТК. Пер-
щим образованием соответственно парамагнит-
вый (парамагнитный, ЭПР-детектируемый) ха-
ных
[(ПДК)2-Fe2+-NO] или диамагнитных
рактеризуется формулой (ДЭТК)2-Fe2+-NO, вто-
(ЭПР-недектируемых) [(ПДК)2-Fe3+-NO] ком-
рой (диамагнитный, ЭПР-недетектируемый) -
плексов [19, 21-24, 26, 27]. Последние легко пере-
формулой (ДЭТК)2-Fe3+-NO. Именно взаимо-
ходят в парамагнитную форму под действием раз-
действие последнего с дитионитом обеспечивало
личных восстановителей, например, дитионита,
трехкратное повышение уровня ЭПР-детектиру-
цистеина или аскорбата [19, 21, 23-27]. Посколь-
емых МНКЖ-ДЭТК. Что касается МНКЖ-
ку в тканях животных in vivo значительная часть
ДЭТК, ЭПР-детектируемых без добавления ди-
ионов железа - слабосвязанного железа, включа-
тионита и составляющих ∼30% от общего количе-
ющегося в МНКЖ с ПДК, - находится в трехва-
ства МНКЖ-ДЭТК, они могли возникать в ре-
лентном состоянии [26], именно резкое, трех-
зультате взаимодействия ДЭТК с Б-ДНКЖ, воз-
кратное увеличение содержания МНКЖ-ПДК
можно образующихся в печени при ее контакте с
под действием различных восстановителей долж-
нитритом.
но отличать второй механизм образования этих
комплексов от первого.
Такого рода предположение абсолютно не со-
гласуется с результатами сравнительных исследо-
Такое различие в ответ на обработку изолиро-
ваний гипотензивной активности Б-ДНКЖ-GSH
ванных препаратов печени дитионитом наблюда-
и нитрита натрия, Было показано, что в дозовом
лось нами на препаратах мышей, с одной сторо-
отношении нитрит как гипотензивный агент бо-
ны, обработанных in vivo нитритом натрия или
лее чем в 100 раз менее активен, чем Б-ДНКЖ
изокетом, а с другой - обработанных in vivo
[28]. Это означает, что нитрит при введении в ор-
Б-ДНКЖ-GSH(NAC) или GS-NO, а также после
ганизм животных не способен эффективно ини-
обработки препаратов печени in vitro газообраз-
циировать образование ДНКЖ с тиолсодержа-
ным NO. Этот результат, собственно, и позволяет
щими лигандами, так что никоим образом 30%
нам говорить о наличии в печени в первом случае
молекул NO, продуцируемых нитритом, не могли
преимущественно NO или во втором случае пре-
включиться в образование ДНКЖ. Очевидно, эти
имущественно Б-ДНКЖ. Действительно, если
бы через полчаса после введения животным
молекулы связывались с Fe2+-ДЭТК-комплекса-
Б-ДНКЖ-GSH(NAC) или GS-NO эти соедине-
ми, что и обеспечивало образование исходно па-
БИОФИЗИКА том 65
№ 6
2020
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
1149
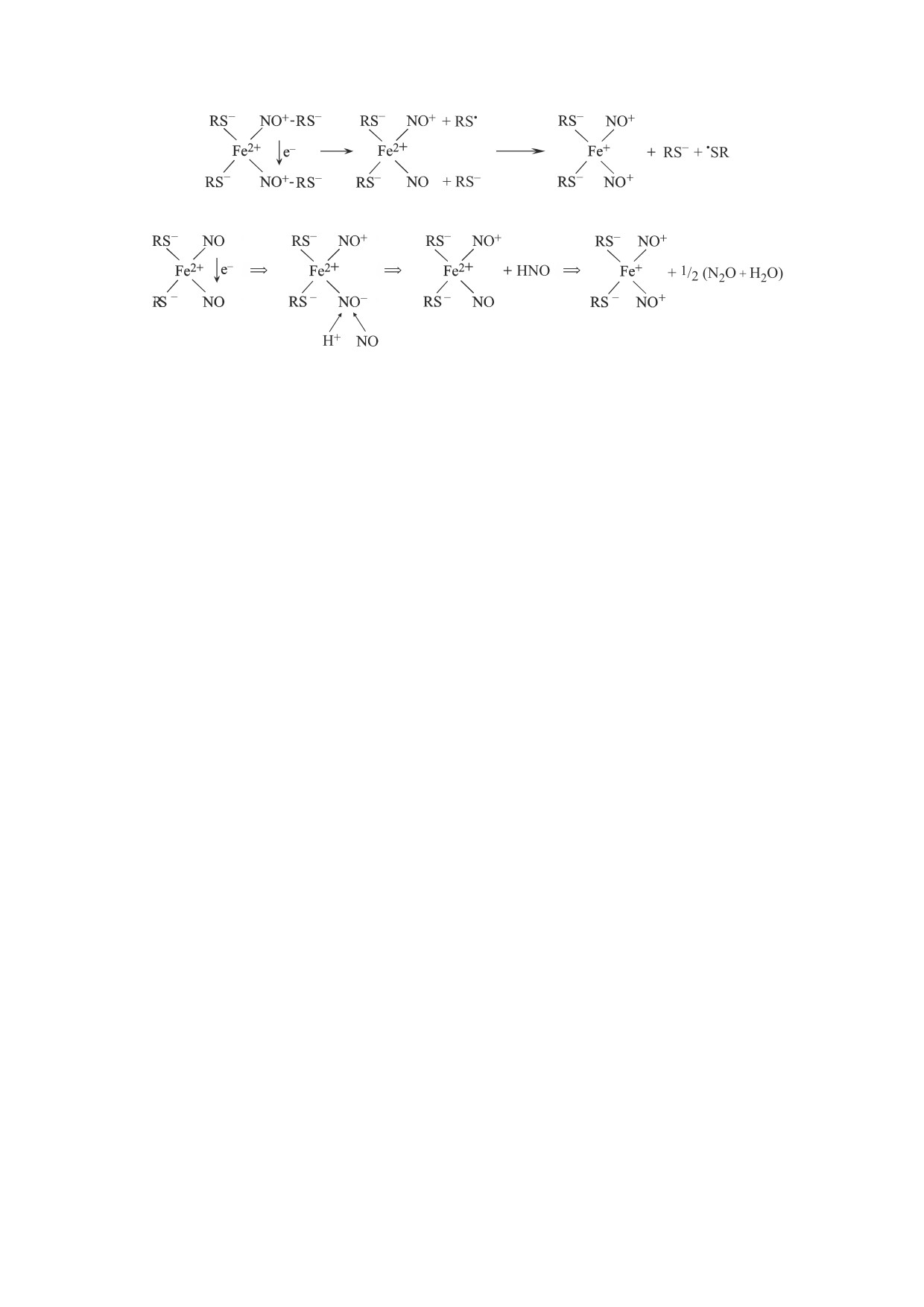
Рис. 5. Механизмы образования М-ДНКЖ с тиолсодержащими лигандами, инициируемого в присутствии Fe2+ и тиолов
S-нитрозотиолами (а) или газообразным NO (б) [5, 6].
рамагнитных, ЭПР-детектируемых МНКЖ-
молекулы нитроксила (HNO) [5, 6, 9, 29-32].
ДЭТК, не взаимодействующих с дитионитом.
Очевидно, что в этом случае вероятность образо-
Встает вопрос, почему GS-NO, вводившийся
вания железо-динитрозильной группы, обуслов-
мышам в дозе в три раза меньшей, чем нитрит,
ленного трехстадийным характером этого про-
тем не менее мог, судя по нашим результатам,
цесса (сначала связыванием с ионом железа двух
обеспечивать образование в печени in vivo как М-,
молекул NO, затем выходом из координационной
так и Б-ДНКЖ. При этом количество ЭПР-де-
сферы железа молекулы нитроксила и последую-
тектируемых МНКЖ-ДЭТК, возникших в препа-
щим включением на его координационное место
ратах печени при взаимодействии ДНКЖ с ДЭТК
третьей молекулы NO), должно существенно уве-
(10-15 микромолей на кг ткани) было примерно
личивать время образования указанной группы
равно количеству тех же МНКЖ, возникших в
по сравнению со временем ее синтеза при уча-
печени мышей, обработанных in vivo нитритом, в
стии только двух молекул GS-NO. Более того, с
результате взаимодействия образовавшегося NO
учетом возможной нестабильности промежуточ-
с Fe2+-ДЭТК-комплексами (20 ± 5 микромолей
ных продуктов оно может делать невозможным
на 1 кг ткани). Другими словами, почему факти-
образование в ткани печени железо-динитро-
чески при одинаковом количестве NO его было
зильной группы при участии молекул NO, появ-
достаточно для образования ДНКЖ при введе-
ляющихся в этой ткани в сравнительно неболь-
нии мышам GS-NO, но недостаточно при введе-
шом количестве (∼ 0.1 мМ), как это имело место в
нии мышам нитрита?
наших опытах. Ясно, что только при существен-
Столь разное влияние GS-NO и нитрита на об-
ном повышении уровня NO в ткани, как это име-
разование ДНКЖ в организме животных можно
ло место при обработке изолированных препара-
объяснить исходя из предложенных нами меха-
тов печени мышей газообразным NO, можно бы-
низмов синтеза этих комплексов при участии в
ло достигнуть образования М- и Б-ДНКЖ с
этом процессе S-нитрозотиолов (RS-NO) или
тиолсодержащим лигандами (рис. 3а,в,д). В этом
свободных молекул NO, приведенных на рис. 5.
случае образцы печени мышей, помещенные
Существенное различие этих механизмов со-
при давлении газообразного NO 100-150 торр в
стоит в том, что для образования одной железо-
100-миллилитровые аппараты Тунберга, находи-
динитрозильной группы в ДНКЖ при участии
лись в контакте с этим газом в количестве
RS-NO и свободных молекул NO требуются соот-
1 ммоль. Если учесть, что объем одного препарата
ветственно две и три молекулы этих агентов. В
печени равен ∼1 см3, указанного количества NO
обоих случаях этот процесс инициируется реак-
могло хватить для образования в этом препарате
цией диспропорционирования (взаимного одно-
до 0.3 моля железо-динитрозильных групп на 1 кг
электронного окисления-восстановления) двух
влажной ткани.
молекул RS-NO и NO. Его достаточно для обра-
зования железо-динитрозильной группы при уча-
При обсуждении этой проблемы следует иметь
стии RS-NO, тогда как для реализации этого про-
ввиду тесную взаимосвязь между RS-NO и
цесса при участии NO необходима его третья мо-
ДНКЖ с тиолсодержащими лигандами. В соот-
лекула, включающаяся в координационную
ветствии с работами [5, 6, 30] не исключено, что
сферу железа вместо высвобождающейся из нее
оба типа этих соединений, будучи взаимопревра-
БИОФИЗИКА том 65
№ 6
2020
1150
МИКОЯН и др.
щаемыми, могут образовывать в клетках и тканях
рофагах, включали в себя все слабосвязанное
живых организмах самоподдерживающуюся, са-
(«свободное») железо в этих клетках (а именно
морегулирующуюся химическую систему, обес-
оно включается в ДНКЖ), вряд ли можно гово-
печивающую в колебательном режиме появление
рить о наличии в них и биядерной формы этих
преимущественно или ДНКЖ или RS-NO.
комплексов. В этом отношении отдельные клет-
Следует отметить, что в работах [7, 8] мы сооб-
ки, продуцирующие ДНКЖ, существенно отли-
щали о возможном образовании Б-ДНКЖ с тиол-
чаются от клеток, составляющих ткани и органы
содержащими лигандами при участии NO, проду-
животных. Как показывают наши исследования,
цируемого в печени мышей индуцибельной NO
в последних ДНКЖ с тиолсодержащими лиганда-
синтазой (iNOS). Синтез этого фермента мы ини-
ми представлены in vivo преимущественно их би-
циировали обработкой мышей бактериальным
ядерной формой. Поэтому есть все основания по-
липополисахаридом как мощным воспалитель-
лагать, что эта же форма возникала и в иммунной
ным агентом, а о появлении Б-ДНКЖ в печени
системе мышей, активированной липополисаха-
мышей судили по появлению в ней МНКЖ-
ридом, так что именно она определяла появление
ДЭТК. Для этого в организм животных на полча-
в препаратах печени мышей, обработанных
ДЭТК, парамагнитной формы МНКЖ-ДЭТК,
са вводили комплексы Fe2+ c цитратом, после че-
ЭПР-детектируемой вне зависимости от добавле-
го ткань печени обрабатывали in vitro ДЭТК.
ния к препаратам дитионита. Другая форма
Предполагалось, что добавленное железо будет
МНКЖ-ДЭТК, характеризующаяся формулой
связывать эндогенное NO и образовывать вместе
с эндогенными тиолами Б-ДНКЖ. Оказалось,
[(ДЭТК)2-Fe3+-NO], т.е. та, которая становилась
что эти комплексы могли включать в себя до 70%
ЭПР-детектируемой в присутствии дитионита,
NO, выработанного iNOS. О полном количестве
могла возникать при участии нитрита - продукта
NO, продуцируемым этим ферментом, мы судили
окисления NO, продуцируемого iNOS, и пред-
по количеству образующихся в печени in vivo
ставлять наибольшую часть МНКЖ-ДЭТК в пре-
МНКЖ-ДЭТК при введении в организм этих жи-
паратах печени мышей, обработанных липополи-
вотных избирательных ловушек NO - комплек-
сахаридом.
сов железа с ДЭТК.
Недавно появилась публикация [40], в кото-
Вместе с тем в последующей работе [26] мы об-
рой были изучены стабильность и превращения
наружили, что уровень образующихся в этих опы-
in vitro NO, нитрита, GS-NO и Б-ДНКЖ- GSH
тах МНКЖ-ДЭТК повышался в три-четыре раза
при их добавлении к препаратам гомогената пла-
под действием дитионита ( как это имело место в
центы человека, овец и мышей. Эта работа фак-
вышеописанных опытах с введением животным
тически находится в русле наших вышеизложен-
нитрита или изокета). В связи с этим нельзя было
ных исследований превращений тех же агентов
исключить того, что в препаратах печени при по-
(за исключением NO) как in vitro в ткани препара-
явлении в них эндогенного NO последний мог
тов печени мышей, так и их метаболизма в печени
включаться не в Б-ДНКЖ, а сразу в МНКЖ-
тех же животных in vivo в течение 30 мин до их за-
ДЭТК, часть которых, характеризующаяся фор-
боя. Сопоставление результатов, описанных в ра-
боте [40] и полученных нашей группой, свиде-
мулой (ДЭТК)2-Fe2+-NO, регистрировалась ме-
тельствует как об их совпадении, так и об их раз-
тодом ЭПР без предварительной обработки дити-
личии. В обеих работах наблюдался распад М-
онитом, а другая часть, ЭПР-недектируемая и ха-
и Б-ДНКЖ-GSH в изученных биопрепаратах
рактеризующаяся формулой (ДЭТК)2-Fe3+-NO,
in vitro. В работе [40] об этом распаде судили по
становилась ЭПР-детектируемой после ее одно-
снижению количества этих комплексов, опреде-
электронного восстановления дитионитом.
лявшемуся по уровню газообразного NO, выде-
Реализация такого сценария исключается, ис-
лявшегося из ДНКЖ в условиях распада этих
ходя из полученных к настоящему времени мно-
комплексов под действием феррицианида. В на-
гочисленных данных о способности иммуноком-
шей работе о таком распаде можно было судить
петентных клеток, например макрофагов, проду-
по значительному снижению количества
цировать при их активации тем же бак-
МНКЖ-ДЭТК, образующихся in vitro в препара-
териальным липополисахаридом значительного
тах печени, содержащих ДНКЖ, при их выдержи-
количества М-ДНКЖ с тиолсодержащими ли-
вании в растворах ДЭТК, по сравнению с количе-
гандами [33-39], переходящих из активирован-
ством МНКЖ-ДЭТК, образующихся in vivo в пе-
ных макрофагов в клетки-мишени их действия
чени мышей, после внутрибрюшинного введения
[36]. Поскольку, в соответствии с работой [39],
сначала Б-ДНКЖ-NAC(GSH), а затем ДЭТК
М-ДНКЖ, возникавшие в активированных мак-
(рис. 2в,д и 2г,е соответственно). Исходя из ре-
БИОФИЗИКА том 65
№ 6
2020
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
1151
зультатов работы [40] и наших данных, получен-
GS-NO возникали только в присутствии экзоген-
ных в 1960-1980 гг. [5, 6], можно утверждать, что
ного железа. Что касается опытов с нитритом, то,
обнаруженное нами снижение уровня МНКЖ-
как было показано в работе [40], добавление этого
ДЭТК не имело отношения к ДЭТК, а было обу-
агента к гомогенату плаценты человека приводи-
словлено распадом непосредственно ДНКЖ
ло к заметному его превращению в ДНКЖ. В
с тиолсодержащими лигандами, возникшими
наших опытах такое превращение при введении
in vivo в ткани печени в результате введения в ор-
животным значительного количества нитрита (в
ганизм мышей Б-ДНКЖ-NAC(GSH) и последу-
дозе 0.7 ммолей/кг веса животного) не обнаружи-
ющей инкубацией этой ткани вне организма при
валось. Вероятнее всего, в этих опытах МНКЖ-
комнатной температуре. Не исключено, что этот
ДЭТК возникали в препаратах печени не в реак-
распад инициировался ацидозом, развивавшимся
ции ДЭТК с ДНКЖ, а в результате связывания
в ткани в этих (анаэробных) условиях. Ацидоз,
NO, образующегося из нитрита, с комплексами
т.е. подкисление внутриклеточной среды, мог
Fe2+/Fe3+-ДЭТК.
обеспечивать протонизацию тиоловых групп
Вместе с тем, как было продемонстрировано в
тиолсодержащих лигандов в ДНКЖ и тем самым
нашей предыдущей работе [8], при замене ДЭТК
распад последних.
в опытах in vitro на глутатион, цистеин или NAC в
Если это так, то почему в наших опытах мы на-
препаратах печени мышей, обработанных in vivo
блюдали значительное возрастание МНКЖ-
нитритом, возникало заметное количество
ДЭТК при выдерживании в растворе ДЭТК изо-
ДНКЖ с указанными тиолсодержащими лиган-
лированных препаратов печени, предварительно
дами (особенно, при замене ДЭТК на NAC, тиол-
обработанных газообразным NO (рис. 3а,в)? По-
содержащее соединение, эффективно проникаю-
ка ответить на этот вопрос однозначно мы не мо-
щее сквозь клеточные мембраны). Аналогичная
жем. Возможно, как это предполагается в работе
ситуация имела место и в наших исследованиях
[40], в тканях животных имеются активирующие-
1970-1980 гг., в которых было продемонстриро-
ся в анаэробных условиях ферментные системы,
вано образование in vitro значительного количе-
вызывающие распад ДНКЖ. Не исключается и
ства М-ДНКЖ с тиолсодержащими лигандами в
более простая причина этого явления, а именно
ткани печени и ее гомогенате при их контакте с
подщелачивание внутриклеточной среды в ходе
0.5-1.0 мМ нитрита натрия [5, 6]. При обоих под-
синтеза ДНКЖ в ткани печени под действием га-
ходах образование заметного количества ДНКЖ
зообразного NO, нейтрализующее процесс аци-
инициировалось повышением уровня компонен-
доза. Как следует из приведенного на рис. 5 меха-
тов этих комплексов - соответственно либо тио-
низма образования ДНКЖ в этих условиях, появ-
лов, либо NO.
ление аниона нитроксила (NO-) в результате
предполагаемого диспропорционирования моле-
ЗАКЛЮЧЕНИЕ
кул NO как основополагающей стадии синтеза
ДНКЖ должно приводить к подщелачиванию
Полученные нами результаты позволяют
среды из-за акцептирования протонов анионами
утверждать, что при появлении в тканях живот-
нитроксила с последующим необратимыми пре-
ных in vivo ДНКЖ с тиолсодержащими лиганда-
вращением молекул нитроксила (HNO) в закись
ми, либо введенных в организм, либо продуциру-
азота и воду. Аналогичным образом, подщелачи-
емых при участии эндогенного NO, эти комплек-
вание внутриклеточной среды могло происходить
сы «предпочитают» находиться в этих тканях в
при синтезе ДНКЖ из соответствующих RS-NO.
диамагнитной, ЭПР-недектируемой форме. Вы-
явить ее наличие можно, вводя животным произ-
В соответствии с приводимым на рис. 5 механиз-
водные дитиокарбамата (например, ДЭТК) или
мом образования этих комплексов протонирова-
обрабатывая изолированные органы и ткани
ние высвобождающегося из RS-NO тиолового
этим агентом в водном растворе. Такой подход
аниона и могло приводить к подщелачиванию
обеспечивает
превращение диамагнитных
окружающей ДНКЖ внутриклеточной среды.
ДНКЖ в парамагнитные, ЭПР-детектируемые
Как в нашей работе, так и в работе [40] полу-
МНКЖ с использованными производными ди-
ченные результаты свидетельствуют о возможно-
тиокарбамата как лигандами.
сти превращения в ДНКЖ одного из представи-
телей RS-NO - GS-NO, естественно при участии
ВКЛАД АВТОРОВ В РАБОТУ
слабосвязанного железа и тиолов (экзогенного
или эндогенного происхождения). Характерно,
Все авторы внесли существенный вклад в пуб-
что в наших опытах ДНКЖ и соответственно
ликуемую работу. В.Д. Микоян и А.Ф. Ванин
МНКЖ-ДЭТК в печени мышей при введении им
определили основное направление исследова-
БИОФИЗИКА том 65
№ 6
2020
1152
МИКОЯН и др.
ний, В.Д. Микоян и Е.Н. Бургова осуществили
13. А. Ф. Ванин, Дисс. … канд. физ.-мат. наук (МГУ
все эксперименты на животных, В.Д. Микоян и
им. М.В. Ломоносова, М., 1968).
Р.Р. Бородулин проводили синтез Б-ДНКЖ-
14. Ф. Ванин, Л. Н. Кубрина, И. Л. Лисовская и др.,
GSH(NAC), А.Ф. Ванин осуществил полное на-
Биофизика 16, 650 (1971).
писание статьи и ее оформление для печати.
15. A. F. Vanin, A. N. Osipov, L. N. Kubrina, et al., Studia
Biophys. 49, 13 (1975).
ФИНАНСИРОВАНИЕ РАБОТЫ
16. А. Ф. Ванин, Дисс. … докт. биол. наук (Институт
Работа выполнена в рамках Государственного
Хим. Физики АН СССР, М., 1980).
задания (темы № АААА-А17-117040610310-6 и
17. Description of the drug form of isosorbide dinitrate
№ АААА-А17-170403100008-5), а также при фи-
(Isoket) (UCB Manufacturing Island Limited Shannon
нансовой поддержке Российского академическо-
Industrial Estate Co., Clair, Ireland).
го проекта «5-100» и Российского фонда фунда-
18. A. F. Vanin, P. I. Mordvintcev, and A. L. Kleschyov,
ментальных исследований (грант
№ 18-04-
Studia Biophys. 102, 135 (1984).
00059а).
19. S. Fujii, T. Yoshimura, and H. Komada, Chem. Lett. 9,
785 (1996).
КОНФЛИКТ ИНТЕРЕСОВ
20. A. F. Vanin, Methods Enzymol. 301, 269 (1999).
Авторы заявляют об отсутствии конфликта
21. K. Tsuchiya, J.-J. Jang, M. Yoshizumi, et al., Free Rad-
интересов.
ic. Biol. Med. 27, 347 (1999).
22. L. Kleschyov, H. Mollnau, V. Oelze, et al., Biochem.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Biophys. Res. Comm. 275, 262 (2000).
23. F. Vanin, X. Liu, A. Samouilov, et al., Biochim. Bio-
Все применимые международные, националь-
ные и институциональные принципы ухода и ис-
phys. Acta 1474, 365 (2000).
пользования животных при выполнении работы
24. S. Fujii and T. Yoshimura, Coord. Chem. Rev. 198, 89
были соблюдены.
(2000).
25. A. F. Vanin, A. Huisman, and E. van Faassen, Methods
Enzymol. 359, 27 (2002).
СПИСОК ЛИТЕРАТУРЫ
26. A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
1. Р. М. Налбандян, А. Ф. Ванин и Л. А. Блю-
tric Oxide Biol. Chem. 15, 295 (2006).
менфельд, Тез докл. конф. «Свободнорадикальные
процессы в биологических системах» (Москва, 1964),
27. A. F. Vanin and A. A. Timoshin, Methods Mol. Biol.
с. 18.
704, 135 (2011).
2. А. Ф. Ванин и Р. М. Налбандян, Биофизика 10, 167
28. E. I. Chazov, O. V. Rodnenkov, A. V. Zorin, et al., Ni-
(1965).
tric Oxide Biol. Chem. 26, 148 (2012).
3. А. Ф. Ванин, Биохимия 32, 228 (1967).
29. A. F. Vanin, I. V. Malenkova, and V. A. Serezhenkov,
4. А. Ф. Ванин, Л. А. Блюменфельд и А. Г. Четвери-
Nitric Oxide Biol. Chem. 1, 191, (1997).
ков, Биофизика 12, 829 (1967).
30. A. F. Vanin, A. A. Papina, V. A. Serezhenkov, et al., Ni-
tric Oxide Biol. Chem. 10, 60 (2004).
5. А. Ф. Ванин, Динитрозильные комплексы железа с
тиолсодержащими лигандами: физхимия, биология,
31. A. F. Vanin, Nitric Oxide Biol. Chem. 21, 1 (2009).
медицина (Институт компьютерных исследований,
32. A. F. Vanin and D. Sh. Burbaev, Biophys. J. 14, 818836
Ижевск, 2015).
(2011).
6. A. F. Vanin, Dinitrosyl Iron Complexes as a “Working
33. A. F. Vanin, Austin J. Analyt. Pharmac. Chem. 5 (4),
Form” of Nitric Oxide in Living Organisms (Cambridge
id 1109 (2018).
Scholars Publishing, Cambridge, 2019).
34. A. F. Vanin, Nitric Oxide Biol. Chem. 54, 15 (2018).
7. А. Ф. Ванин, В. Д. Микоян, Л. Н. Кубрина и др.
35. J. R. Lancaster and J. B. Hibbs, Proc. Natl. Acad. Sci.
Биофизика 60, 735 (2015).
USA 87, 1223 (1990).
8. V. D. Mikoyan, E. N. Burgova, R. R. Borodulin, et al.,
36. J.-C. Drapier, C. Pellat, and Y. Henry, J. Biol. Chem.
Nitric Oxide Biol. Chem. 62, 1 (2017).
266, 10162 (1991).
9. A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
37. A. F. Vanin, P. I. Mordvintcev, S. Hauschildt, et al.,
tric Oxide Biol. Chem. 23, 136 (2010).
Biochim. Biophys. Acta 1177, 37 (1993).
10. R. R. Borodulin, L. N. Kubrina, V. O. Shvydkiy, et al.,
38. C. A. Bosworth, J. C. Toledo, J.W. Zmiewski, et al.,
Nitric Oxide Biol. Chem. 35, 110 (2013).
Proc. Natl. Acad. Sci. USA 106, 4671 (2009).
11. D. L. H. Williams, Nitrosation Reactions and the Chem-
39. J. R. Hickok, S. Sahni, H. Shen. et al., Free Rad. Biol.
istry of Nitric Oxide (Elsevier, Amsterdam, 2004).
Med. 51, 1558 (2011).
12. A. Ф. Ванин и А. Г. Четвериков, Биофизика 13, 608
40. G. K. Mukosera, T. C. Clark, L. Ngo, et al., J. Physiol.
(1968).
598 (11), 2223 (2020).
БИОФИЗИКА том 65
№ 6
2020
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
1153
Dinitrosil Iron Complexes with Thiol-Containing Ligands are Predominantly
Represented by The Binuclear Form in Living Organisms
V.D. Mikoyan, E.N. Burgova, R.R. Borodulin, and A.F. Vanin*, **
*Semenov Federal Research Center of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Institute of Regenerative Medicine, Sechenov First Moscow State Medical University,
Ministry of Health of the Russian Federation, Trubetskaya ul. 8/2, Moscow, 119991 Russia
The number of mononitrosyl iron complexes with diethyldithiocarbamate, formed in the liver of mice in vivo
and in vitro after intraperitoneal injection of binuclear dinitrosyl iron complexes with N-acetyl-L-cysteine or
glutathione, S-nitrosoglutathione, sodium nitrite or the vasodilating drug Isoket® was assessed by electron
paramagnetic resonance (EPR). The number of the said complexes, in contrast to the complexes, formed af-
ter nitrite or Isoket administration, the level of which sharply increased after treatment of liver preparations
with a strong reducing agent - dithionite, did not change in the presence of dithionite. It was concluded that,
in the first case, EPR-detectable mononitrosyl iron complexes with diethyldithiocarbamate in the absence
and presence of dithionite appeared as a result of the reaction of NO formed from nitrite with Fe2+-dieth-
yldithiocarbamate and Fe3+-diethyldithiocarbamate complexes, respectively. In the second case, mononi-
trosyl iron complexes with diethyldithiocarbamate appeared as a result of the transition of iron-mononitosyl
fragments from ready-made iron-dinitrosyl groups of binuclear dinitrosyl complexes, which is three to four
times higher than the content of the mononuclear form of these complexes in the tissue. The results obtained
suggest that when dinitrosyl iron complexes with thiol-containing ligands, either introduced into the body or
produced with the participation of endogenous NO, appear in animal tissues in vivo, these complexes are pre-
sented in these tissues mainly by their diamagnetic, EPR-undetectable binuclear form.
Keywords: mononitrosyl iron complexes, dinitrosyl iron complexes, binuclear form of dinitrosyl complexes
БИОФИЗИКА том 65
№ 6
2020