БИОФИЗИКА, 2020, том 65, № 6, с. 1154-1160
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.112.7, 543.421/.424
ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ СЫВОРОТКИ КРОВИ БОЛЬНЫХ
ОНКОГЕМАТОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
© 2020 г. Е.А. Тельная*, Л.В. Плотникова*, А.Д. Гарифуллин**, ***, ****,
А.Ю. Кувшинов**, ***, ****, С.В. Волошин**, ***, ****, А.М. Поляничко*, *****
*Физический факультет Санкт-Петербургского государственного университета,
199034, Санкт-Петербург, Петергоф, Ульяновская ул., 3
**Российский научно-исследовательский институт гематологии и трансфузиологии ФМБА России,
191024, Санкт-Петербург, ул. 2-я Советская, 16
***Военно-медицинская академия им. С.М. Кирова, 194044, Санкт-Петербург, ул. Академика Лебедева, 6
****Северо-Западный государственный медицинский университет им. И.И. Мечникова,
191015, Санкт-Петербург, ул. Кирочная, 4
*****Институт цитологии РАН, 194064, Санкт-Петербург, Тихорецкий просп., 4
Эл. почта: a.polyanichko@spbu.ru
Поступила в редакцию 25.01.2020 г.
После доработки 12.07.2020 г.
Принята к публикации 08.07.2020 г.
Проведен сравнительный анализ вторичной структуры белков сыворотки крови больных множе-
ственной миеломой, хроническим лимфолейкозом и здоровых доноров. Вторичную структуру бел-
ков в составе сыворотки определяли методом инфракрасной спектроскопии. Показано, что предло-
женный подход позволяет зарегистрировать уменьшение доли α-спиральных участков и рост коли-
чества β-слоев в образцах сыворотки крови больных множественной миеломой по сравнению со
здоровыми донорами и больными хроническим лимфолейкозом.
Ключевые слова: ИК-спектроскопия, множественная миелома, вторичная структура белка.
DOI: 10.31857/S0006302920060150
ция М-белка приводит к сильному увеличению
Множественная миелома (ММ) - онкологи-
содержания иммуноглобулинов и их фрагментов.
ческое заболевание крови, характеризующееся
Параллельно у больных ММ может наблюдаться
наличием в крови так называемого М-белка, обу-
падение содержания сывороточного альбумина в
словленного гиперпродукцией моноклональных
крови [4]. Будучи наиболее многочисленными
иммуноглобулинов, и/или их тяжелых и легких
белками в составе сыворотки крови иммуногло-
цепей [1-3]. В качестве первичного метода диа-
гностики ММ широко применяется электрофо-
булины и альбумины обладают различной вто-
ричной структурой. Так, сывороточный альбу-
ретический анализ, способный выявить присут-
мин на две трети состоит из участков в α-спи-
ствие М-белка в виде хорошо разрешимой фрак-
ральной конформации
[7,
8] тогда как во
ции [4]. Постановка окончательного диагноза
вторичной структуре IgG более 70% приходится
требует, однако, проведения дорогостоящих им-
на β-слои [9, 10]. Таким образом, мы полагаем,
мунологических исследований. Вместе с тем та-
что при гиперпродукции М-белка будет изме-
кой подход позволяет выявить лишь около 80%
няться не только содержание патологического
случаев заболевания, в основном на поздних ста-
белка в сыворотке крови, но и среднее относи-
диях [5, 6]. В настоящее время во всем мире ведет-
тельное содержание полипептидных цепей с раз-
ся активный поиск альтернативных подходов вы-
личной вторичной структурой.
явления заболевания, в особенности на более
ранних стадиях.
Одним из методов, позволяющих оценить вто-
ричную структуру белков в составе концентриро-
Развитие ММ сопровождается существенны-
ванных неоднородных смесей, является инфра-
ми изменениями протеома крови. Гиперпродук-
красная (ИК) спектроскопия [11-19]. Ранее нами
была продемонстрирована принципиальная воз-
Сокращения: ММ - множественная миелома, ИК - ин-
фракрасная, ХЛЛ - хронический лимфолейкоз, НПВО -
можность различать образцы сыворотки крови
нарушенное полное внутренне отражение.
больных ММ и здоровых доноров по их ИК-спек-
1154
ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ СЫВОРОТКИ КРОВИ
1155
Таблица. 1. Соответствие положения основных полос в разложении «амид I» различным типам вторичной
структуры полипептидной цепи
Структура:
Н2О
D2O
α-спирали
1650-1657 см-1
1649-1656 см-1
310-спирали
1656-1663 см-1
-
1612-1640 см-1
β-слои (антипараллельные)
Особо выражены: 1624 ± 2 см-1,
1630 ± 2 см-1
1627 ± 2 см-1, 1633 ± 2 см-1
1626-1640 см-1
β-слои (параллельные)
Особо выражены: 1627 ± 2 см-1,
1630 ± 2 см-1
1633 ± 2 см-1
1662-1696 см-1
1663 ± 2 см-1
-1
Особо выражены: 1667 ± 2 см-1,
1671 ± 2 см
Повороты
1675 ± 2 см-1, 1680 ± 2 см-1,
1683 ± 2 см-1
1685 ± 2 см-1, 1691 ± 2 см-1
1689 ± 2 см-1
Неупорядоченная структура
1640-1651 см-1
1645 ± 4 см-1
трам [16, 20]. В данной работе на основе суще-
or27 (Bruker, Германия) в разборных кюветах на
ственно более обширной выборки проводится
основе кристаллов BaF2 с длиной оптического
сравнительный анализ вторичной структуры бел-
пути 50 мкм. Спектры регистрировали с шагом
ков в составе сыворотки крови больных множе-
2 см-1 в диапазоне 4000-800 см-1. Первичную
ственной миеломой, хроническим лимфолейко-
обработку и анализ спектров проводили с исполь-
зом (ХЛЛ) и здоровых доноров.
зованием программного обеспечения, поставляе-
мого с прибором.
МАТЕРИАЛЫ И МЕТОДЫ
Анализ вторичной структуры проводили путем
разложения полосы «амид I» на составляющие на
Получение образцов сыворотки крови. Для по-
основе анализа спектра второй производной по
лучения образцов сыворотки крови использовали
описанной ранее методике [15, 16]. Каждый полу-
пробирки S-Monovette (Sarstedt, Германия) с ак-
ченный контур в разложении сопоставляли с
тиватором свертывания. Собранные образцы
определенным типом вторичной структуры
крови оставляли в пробирках в течение
(табл. 1) согласно полученным ранее отнесениям
20-30 мин при комнатной температуре
[11, 12, 21-24]. Долю каждого типа вторичной
(18-24°С), после чего центрифугировали в тече-
структуры в общей структуре белка определяли
ние 15 мин при скорости 3000 об/мин (1000 g) на
по доле площади соответствующего контура в по-
центрифуге Heraeus Labofuge 200 (Thermo Scien-
лосе «амид I». Полученные результаты основаны
tific, США). До проведения физико-химических
на анализе ИК-спектров образцов сыворотки
исследований образцы замораживали и хранили
крови 60 здоровых доноров, 45 пациентов с диа-
при температуре -30°С.
гнозом ММ и 15 пациентов с диагнозом ХЛЛ.
ИК-спектры нарушенного полного внутреннего
отражения регистрировали на ИК-Фурье-спек-
трометре Nicolet 8700 (Thermo Scientific, США),
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
оснащенном приставкой однократного нарушен-
Поглощение белковых молекул в среднем ИК-
ного полного внутреннего отражения (НПВО) на
диапазоне обусловлено в первую очередь колеба-
основе кристалла алмаза, а также низкошумящим
ниями в пептидной связи. Эти колебания прояв-
MCT(HgCdTe)-детектором. Оптические пути
ляются в спектрах в виде нескольких широких
продували сухим воздухом. Спектры регистриро-
полос, известных как полосы «амид». Наиболее
вали в диапазоне 4000-600 см-1 с разрешением
информативными при анализе вторичной струк-
2 см-1. Каждый спектр усредняли по 128-ми на-
туры белков являются колебания групп С=О и
коплениям. Коррекцию базовой линии и обра-
N—Н пептидной связи [15, 25, 26]. Наиболее вос-
ботку спектров проводили по описанной ранее
производимые результаты позволяет получить
методике [15].
анализ суперпозиции колебаний карбонильных
групп, проявляющейся в спектре в виде полосы
Спектры ИК-поглощения регистрировали в
растворах D2O, изотопное замещение раствори-
«амид I» в окрестности 1650 см-1.
теля проводили согласно описанной ранее мето-
На практике регистрация ИК-спектров вод-
дике [18]. Измерения проводили на приборе Ten-
ных растворов белков осложняется сильным по-
БИОФИЗИКА том 65
№ 6
2020
1156
ТЕЛЬНАЯ и др.
Рис. 1. Спектры ИК-поглощения сыворотки крови при измерении методом НПВО в D2O (а) и в воде (б): 1 - спектр
сыворотки, 2 - спектр растворителя.
глощением воды (H2O) в этой области спектра.
щества. Высокие концентрации белков в сыво-
Одним из возможных путей анализа полосы
ротке крови позволяют использовать данный
«амид I» в растворах является использование изо-
подход без дополнительной пробоподготовки.
Однако в этом случае в спектрах возможно появ-
топного замещения растворителя на тяжелую во-
ление артефактов, связанных с ошибками ком-
ду (D2O), у которой в области полосы «амид I»
пенсации вклада растворителя (H2O) (рис. 1б).
имеется окно прозрачности (рис. 1а). Изотопное
замещение позволяет добиться удовлетворитель-
В данной работе нами проведен сравнитель-
ного соотношения сигнал/шум, дает надежное
ный анализ ИК-спектров образцов сыворотки
определение вторичной структуры белков в про-
крови здоровых доноров, больных ММ и ХЛЛ,
бе, однако требует довольно длительной пробо-
как после изотопного замещения (рис. 2а), так и
подготовки. Другой возможный подход основан
без дополнительной подготовки методом НПВО
на применении метода НПВО. Метод основан на
(рис. 2б). В спектрах поглощения отчетливо вы-
эффекте полного внутреннего отражения элек-
деляются две полосы: полоса «амид I» (1700-
тромагнитной волны на границе раздела двух
1600 см-1), соответствующая валентным колеба-
сред. При таком отражении происходит частич-
ниям карбонильной группы C=O пептидной свя-
ное проникновение излучения в приграничные
зи, а также полоса «амид II» (1600-1500 см-1 в
области соседней среды на глубину около четвер-
растворах Н2O), либо соответствующая ей после
ти длины волны. В результате отраженная волна
изотопного замещения полоса
«амид II¢»
содержит информацию о свойствах пригранич-
(1500-1400 см-1 в растворах D2O), происходящие
ного слоя соседней среды. Вместе с тем зависи-
мость глубины проникновения луча от длины
от суперпозиции деформационных колебаний
волны требует проведения корректировки абсо-
связи N-H (N-D), связанных с валентными ко-
лютных величин поглощения в различных обла-
лебаниями связи C-N. На рис. 1 отчетливо видно
стях спектра. Поправочная функция будет зави-
отличие в форме полос «амид I» в спектрах образ-
сеть не только от длины волны, но и от различия
цов ММ, отражающее изменение относительного
показателей преломления двух сред, а также от
содержания участков в α-спиральных и β-слой-
угла падения луча. На практике для создания пол-
ных конформациях вследствие гиперпродукции
ного внутреннего отражения используют про-
иммуноглобулинов. Для определения удельного
содержания различных типов вторичной структу-
зрачные в ИК-области материалы с высоким по-
ры в пробе было проведено разложение полос
казателем преломления, на поверхность которых
«амид I» на составляющие методом второй произ-
наносят исследуемый образец. При такой схеме
водной [15]. Характерные разложения спектров
проведения измерений влияние растворителя
сыворотки крови здоровых доноров, больных
оказывается минимальным, вследствие малой
ММ и ХЛЛ представлены на рис. 3 (H2O) и рис. 4
глубины проникновения луча в среду. По этой же
причине необходимо использовать образцы с до-
(D2O). Отнесения полученных в результате раз-
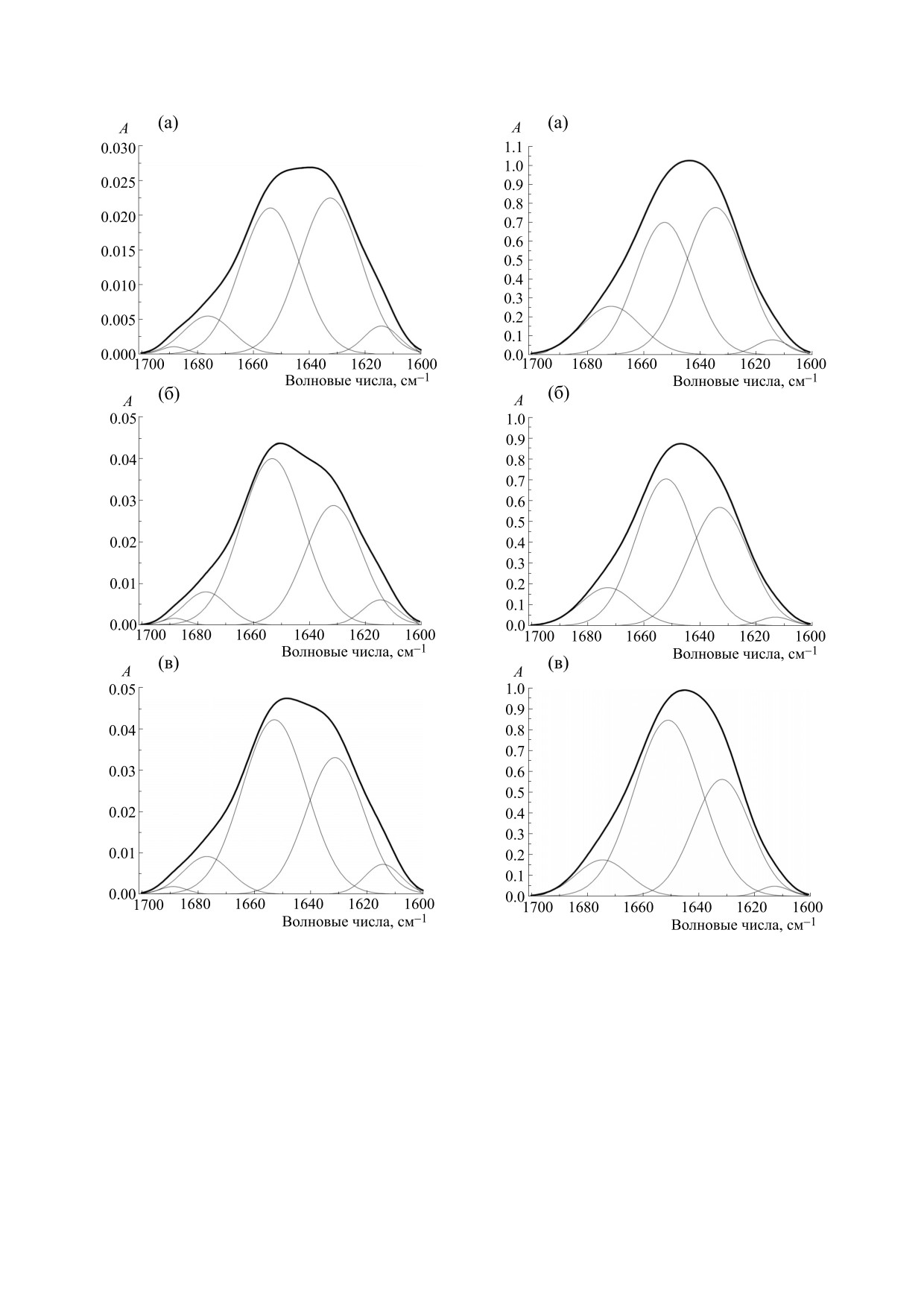
статочно высоким содержанием исследуемого ве-
ложения полос представлены в табл. 1. На осно-
БИОФИЗИКА том 65
№ 6
2020
ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ СЫВОРОТКИ КРОВИ
1157
Рис. 2. Спектры ИК-поглощения сыворотки крови при измерении методом НПВО в D2O (а) и в воде (б): 1 - пациент
с ММ, 2 - пациент с ХЛЛ, 3 - здоровый донор.
вании приведенных отнесений было определено
различиями белкового состава сыворотки крови
среднее содержание каждого типа вторичных
здоровых доноров от пациентов с произвольной
структур во всех образцах.
патологией крови.
Было установлено, что наиболее информатив-
Анализ ИК-спектров образцов сыворотки
ными при сравнении образцов являются показа-
крови, подвергавшихся изотопному замещению,
тели содержания α-спиральных и β-слойных
дал результаты, полностью аналогичные описан-
участков (табл. 2). Анализ результатов, получен-
ным выше (табл. 2). Для вторичной структуры
ных с использованием приставки НПВО, пока-
белков в сыворотке крови пациентов с ММ харак-
зал, что в сыворотке крови здоровых доноров и
терно повышенное по сравнению со здоровыми
больных ХЛЛ доминируют полипептидные цепи
донорами содержание β-структур (54 ± 5%) и
в α-спиральных конформациях (около 50%), то-
снижение доли α-спиральных участков (38 ± 2%).
гда как участки с β-структурами различного типа
Наиболее наглядно зарегистрированные измене-
составляют чуть более 40%. Для образцов боль-
ния проявляются при анализе соотношения меж-
ных ММ картина противоположная: доминируют
ду основными типами вторичных структур в ис-
участки с β-структурой (более 50%), тогда как до-
следуемых образцах (табл. 2). В частности, соот-
ля α-спиралей падает до уровня ниже 40%. Для
ношение вкладов α-спиральных участков и
описанной выше процедуры анализа вторичной
β-структур дает для здоровых пациентов в сред-
структуры белков по спектрам водных растворов
нем величину 1.1 (1.04 ± 0.06 при измерениях ме-
характерна достаточно высокая погрешность в
тодом НПВО и 1 13 ± 0.07 в растворах D2O). В то
определении содержания α-спиральных участ-
же время для больных ММ этот параметр суще-
ков, обусловленная перекрыванием соответству-
ственно меньше и составляет в среднем
0.7
ющей полосы в разложении с полосой поглоще-
(0.7 ± 0.1 при измерениях методом НПВО и
ния воды. При этом в группе образцов, получен-
0.70 ± 0.04 в растворах D2O). Таким образом, оба
ных из сыворотки крови больных ММ,
подхода дали хорошо согласующиеся между со-
дополнительно наблюдается достаточно высокая
бой результаты, что позволяет использовать для
гетерогенность, и абсолютные показатели от-
экспресс-анализа вторичной структуры белков в
дельных образцов могут заметно отличаться. Это
составе сыворотки крови метод НПВО без какой-
обусловлено объективными различиями, в том
либо дополнительной подготовки образцов. Вме-
числе различиями в типе и количестве секретиру-
сте с тем измерения, проведенные в растворах
емого М-белка у пациентов с разным типом ММ.
D2O, позволили заметно повысить точность
Сравнение образцов сыворотки крови больных
определения доли α-спиралей во вторичной
ММ с результатами анализа второй контрольной
группы - больных ХЛЛ, у которых отсутствует ги-
структуре белков благодаря отсутствию полос по-
перпродукция иммуноглобулинов и их фрагмен-
глощения растворителя в данной области. Как
тов, выявилJ аналогичные различия. Таким обра-
следствие, в умеренно гетерогенных образцах
здоровых доноров и пациентов с ХЛЛ при изме-
зом, изменения, наблюдаемые в спектрах, обу-
словлены особенностями развития ММ, а не
рениях в D2O удалось выявить незначительные
БИОФИЗИКА том 65
№ 6
2020
1158
ТЕЛЬНАЯ и др.
Рис. 3. Пример разложения полосы «амид I» при
Рис. 4. Пример разложения полосы «амид I» при
регистрации спектра методом НПВО: (а) - пациент с
регистрации спектра в растворе D2O: (а) - пациент с
ММ, (б) - пациент с ХЛЛ, (в) - здоровый донор.
ММ, (б) - пациент с ХЛЛ, (в) - здоровый донор.
отличия в содержании α-спиральных участков:
точного альбумина в крови может наблюдаться при
54 ± 2% и 49 ± 1% соответственно. Наблюдаемое
различных заболеваниях и не является уникальной
снижение доли α-спиральных участков у пациентов
особенностью ХЛЛ. Данное обстоятельство с на-
с ХЛЛ может быть следствием понижения уровня
шей точки зрения указывает на перспективность
сывороточного альбумина в сыворотке крови при
использования данного подхода при изучении и
развитии заболевания. Снижение уровня сыворо-
диагностике более широкого круга заболеваний.
БИОФИЗИКА том 65
№ 6
2020
ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ СЫВОРОТКИ КРОВИ
1159
Таблица 2. Процентное содержание участков в α-спиральных и β-слойных конформациях и их соотношение в
образцах сыворотки крови
Больные
Тип вторичной структуры:
Здоровые доноры
Больные ХЛЛ
ММ
НПВО
49 ± 3%
38 ± 8%
51 ± 2%
α-спирали
D
2
O
54 ± 2%
38 ± 2%
49 ± 1%
НПВО
47 ± 2%
54 ± 5%
46 ± 2%
β-структуры
D
O
48 ± 3%
54 ± 5%
46 ± 2%
2
НПВО
1.04 ± 0.06
0.7 ± 0.1
1.11 ± 0.05
α/β
D
2
O
1.13 ± 0.07
0.70 ± 0.04
1.07 ± 0.04
ЗАКЛЮЧЕНИЕ
КОНФЛИКТ ИНТЕРЕСОВ
Соответствие результатов, полученных в двух
Авторы заявляют об отсутствии конфликта ин-
различных сериях экспериментов, позволяет за-
тересов.
ключить, что оба подхода оказываются пригод-
ными для определения вторичной структуры бел-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ков в составе сыворотки крови. Полученные на-
ми результаты указывают на то, что ИК-
Все процедуры, выполненные в исследовании
спектроскопия позволяет выделять образцы сы-
с участием людей, соответствовали этическим
воротки крови пациентов с диагнозом ММ на фо-
стандартам Хельсинкской декларации 1964 г. и ее
не здоровых доноров. Можно также заключить,
последующим изменениям. От участников иссле-
что при гиперпродукции моноклональных имму-
дования было получено информированное доб-
ноглобулинов в сыворотке крови больных ММ
ровольное согласие.
удается наблюдать увеличение доли полипептид-
ных цепей в β-слойных конформациях на 6-9% и
уменьшение доли α-спиральных участков на 8-
СПИСОК ЛИТЕРАТУРЫ
16%. Данные различия можно наблюдать путем
1. S. K. Kumar, V Rajkumar, R. A. Kyle, et al., Nat. Rev.
прямого анализа ИК-спектра сыворотки крови в
Dis. Prim. 3, 17046 (2017).
области полосы «амид I» без какой-либо допол-
2. C. Röllig, S. Knop, M. Bornhäuser, et al., Lancet 385
нительной пробоподготовки образца. Вместе с
(9983), 2197 (2015).
тем результаты наших наблюдений показали, что
3. S. V. Rajkumar, Am. J. Hematol. 93 (8), 1091 (2018).
имеются также небольшие различия в спектрах
4. Л. П. Менделеева, О. М. Вотякова, О. С. Покров-
здоровых доноров и больных ХЛЛ, которые нам
ская и др., Гематология и трансфузиология 61 (1-
удалось выявить только при измерениях в раство-
2), (2016).
рах D2O.
5. R. A. Kyle, S. V. Rajkumar, et al., Leukemia 23 (1), 3
(2009).
6. С. С. Бессмельцев, Клин. онкогематология 6 (3),
БЛАГОДАРНОСТИ
237 (2013).
Часть работ была выполнена с использовани-
7. K. A. Majorek, P. J. Porebski, A. Dayal, et al., Mol.
ем оборудования ресурсных центров научного
Immunol. 52 (3-4), 174 (2012).
парка СПбГУ («Оптические и лазерные методы
8. A. A. Bhattacharya, T. Grüne, S. Curry, et al., J. Mol.
исследования вещества»
«Центр диагностики
Biol. 303 (5), 721 (2000).
функциональных материалов для медицины фар-
9. H. R. Costantino, J. D. Andya, J. D. Shire, et al.,
макологии и наноэлектроники», «Нанотехноло-
Pharm. Sci. 3 (3), 121 (1997).
гии», «Криогенный отдел»).
10. L. J. Harris, S. B. Larson, K. W. Hasel, et al., Biochem-
istry 36 (7), 1581 (1997).
11. H. Yang, S. Yang, and J. Kong, Nat. Protoc. 10 (3), 382
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
(2015).
Работа выполнена при финансовой поддержке
12. G. E. Trante, in Encyclopedia of Spectroscopy and Spec-
Российского фонда фундаментальных исследова-
trometry, (Academic Press, Amsterdam, Netherlands,
ний (грант № 18-08-01500).
2017), pp. 740-758.
БИОФИЗИКА том 65
№ 6
2020
1160
ТЕЛЬНАЯ и др.
13. I. Rehman, Z. Movasaghi, and S. Rehman, in Vibration
19. T. S. Sych, Z. V. Reveguk, V. A. Pomogaev, et al., J.
spectroscopy for tissue analysis (CRC Press, New-York,
Phys. Chem. C 122 (51), 29549 (2018).
USA, 2013), pp 356.
20. L. V. Plotnikova, M. O. Kobeleva, E. V. Borisov, et al.,
Cell and Tissue Biology 13 (2), 130 (2019).
14. L. Benezzeddine-Boussaidi, G. Cazorla, and
A. M. Melin, Clin. Chem. Lab. Med. 47 (1), 83 (2009).
21. M. K. Bellamy, J. Chem. Educ. 87 (12), 1399 (2010).
22. A. Barth, Biochim. Biophys. Acta 1767 (9),
1073
15. A. M. Polyanichko, N. M. Romanov, T. Y. Starkova,
(2007).
et al., Cell Tissue Biol. 8 (4), 352 (2014).
23. E. Goormaghtigh, V. Cabiaux and J. M. Ruysschaert,
16. L. V. Plotnikova, A. M. Polyanichko, T. Nosenko,
Subcell. Biochem. 23, 405 (1994).
et al., AIP Conference Proceedings 1760, 020052
24. J. Kong and S. Yu, Acta Biochim. Biophys. Sin. 39 (8),
(2016).
549 (2007).
17. A. M. Polyanichko and H. Wieser, Biopolymers 78 (6),
25. A. Barth and C. Zscherp, Q. Rev. Biophys. 35 (4), 369
329 (2005).
(2002).
18. A. M. Polyanichko, V. V. Andrushchenko, E. V. Chikh-
26. K. Murayama and M. Tomida, Biochemistry 43 (36),
irzhina, et al., Nucl. Acids Res. 32 (3), 989 (2004).
11526 (2004).
Infrared Spectroscopy of Serum from Patients with Oncohematological Diseases
E.A. Telnaya*, L.V. Plotnikova*, A.D. Garifullin**, ***, ****, A.Yu. Kuvshinov**, ***, ****,
S.V. Voloshin**, ***, ****, and A.M. Polyanichko*, *****
*Department of Physics, St. Petersburg State University, Uljanovskaya ul. 3, Peterhof, St. Petersburg, 199034 Russia
**Russian Research Institute of Hematology and Transfusiology, Federal Biomedical Agency of the Russian Federation,
ul. 2-ya Sovetskaya 16, St. Petersburg, 191024 Russia
***Military Medical Academy named after S.M. Kirov, ul. Akademika Lebedeva 6, St. Petersburg, 194044 Russia
****North-Western State Medical University named after I.I. Mechnikov, ul. Kirochnaya, 4, St. Petersburg, 191015 Russia
*****Institute of Cytology, Russian Academy of Sciences, Tikhoretskii prosp. 4, St. Petersburg, 194064 Russia
A comparative analysis was performed of the secondary structure of serum proteins in patients with multiple
myeloma, chronic lymphocytic leukemia patients and healthy donors. Determination of serum protein sec-
ondary structure was accomplished by the application of IR spectroscopy. It has been shown that the pro-
posed approach allows to detect a decrease in the length of α-helical regions and an increase in the content
of β-sheets in the serum of patients with multiple myeloma compared to healthy donors and chronic lympho-
cytic leukemia patients.
Keywords: IR spectroscopy, multiple myeloma, protein secondary structure
БИОФИЗИКА том 65
№ 6
2020