БИОФИЗИКА, 2021, том 66, № 1, с. 23-30
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.323
ВЗАИМОДЕЙСТВИЕ ДНК С ФЕНАНТРОЛИНОМ И НОВЫМИ
ФЕНАНТРОЦИАНИНОВЫМИ КОМПЛЕКСАМИ Zn(II)
© 2021 г. Е.В. Акуленкова*, В.Н. Демидов**, А.О. Мартынова*, С.В. Пастон*
*Физический факультет Санкт-Петербургского государственного университета,
198504, Санкт-Петербург, Старый Петергоф, Ульяновская ул., 1
**ООО «Pro-Brite», 192289, Санкт-Петербург, ул. Софийская, 93
E-mail: s.v.paston@spbu.ru
Поступила в редакцию 25.01.2020 г.
После доработки 12.07.2020 г.
Принята к публикации 08.07.2020 г.
Методами оптической спектроскопии, флуоресценции и плавления ДНК изучено взаимодействие
ДНК в водно-солевых растворах с комплексами Zn(II) и производных 1,10-фенантролина:
бис-(1,10-фенантролин)-(1,10-фенантроцианин)-дицинка(II) ацетатом (diZn) и его предшествен-
ником - бис-(1,10-фенантролин)-цинка(II) ацетатом (monoZn). Взаимодействие фенантролина и
металлокомплексов на его основе с ДНК существенно различается. MonoZn и diZn образуют ком-
плексы с ДНК, причем в зависимости от соотношения компонентов реализуется несколько типов
связывания, один из которых, предположительно, - интеркаляция. Насыщение связывания не за-
фиксировано при 0,1 ≤ r ≤ 20 для monoZn и при 0,1 ≤ r ≤ 1,67 для diZn. Возможно образование вто-
ричных комплексов monoZn и diZn на ДНК. Взаимодействие с ДНК приводит к тушению флуорес-
ценции металлокомплексов.
Ключевые слова: ДНК, фенантролин, металлокомплексы, плавление ДНК, спектроскопия флуоресцен-
ции, интеркаляция.
DOI: 10.31857/S0006302921010038
условиях из их спектров флуоресценции [2, 7].
Производные 1,10-фенантролина находят ши-
1,10-Фенантролин используют в качестве флуо-
рокое применение в координационной химии,
ресцентных датчиков для обнаружения ионов ме-
химии материалов, аналитической химии, фар-
таллов. Спектральные сдвиги происходят в фе-
макологии в качестве металлоферментов, зондов
нантролиновом фрагменте после связывания
нуклеиновых кислот, хелатирующих агентов [1,
иона металла на открытом координационном
2]. Фенантролин - слабый флуорофор (кванто-
сайте [4-6].
вый выход Φфл = 0.0087, время жизни синглетно-
го состояния менее 1 нс в дихлорметане при ком-
Взаимодействие 1,10-фенантролина и его ком-
натной температуре) [2, 3], однако к настоящему
плексов d-элементов с молекулой ДНК были рас-
времени сконструировано множество вариантов
смотрены различными методами, при этом была
замещенных фенантролинов и металлокомплек-
отмечена способность лигандов к интеркаляции
сов на их основе, проявляющих весьма интерес-
[1, 8-13]. Среди подобных комплексов d-элемен-
ные флуоресцентные свойства: спектры испуска-
тов особое внимание привлекают соединения
ния лежат в диапазоне от ультрафиолетовой до
Ru(II). Это обусловлено различными факторами,
ближней инфракрасной области, а квантовый
среди которых следует отметить флуоресцентные
выход некоторых соединений достигает 0.8 [2, 4-
свойства, весьма чувствительные к ближнему
6]. Синтезированы также полимеры на основе
окружению соединения, а также способность та-
фенантролина. Они обладают повышенной спо-
ких металлокомплексов выступать в качестве эф-
собностью координировать ионы металлов, кро-
фективных фотосенсибилизаторов [14-16]. Зна-
ме того, они склонны образовывать эксимеры,
чительный интерес вызывают комплексы железа
что дает возможность получать информацию о
с 1,10-фенантролином и его производными [17-
конформации таких полимеров в различных
19]. Благодаря способности фенантролина хела-
тировать ион Fe2+ он может блокировать реак-
Сокращения: monoZn
- бис-(1,10-фенантролин)-(1,10-
фенантроцианин)-дицинка(II) ацетат, diZn - бис-(1,10-
цию Фентона и влиять на баланс Fe2+/Fe3+ в
фенантролин)-цинка(II) ацетат.
клетках [19].
23
24
АКУЛЕНКОВА и др.
Металлокомплексы на основе фенантролина и
ной сфере входят 1 ацетат-ион в Zn8 и 2 ацетат-
других органических лигандов широко использу-
иона в Zn7, которые при растворении соединений
ются для разработки новых противоопухолевых,
замещаются молекулами воды. Все растворы го-
противомикробных и противогрибковых препа-
товили на деионизованной воде, рН 6-7. Кон-
ратов и искусственных нуклеаз [1, 8, 20-22]. Од-
центрацию поддерживающего электролита
ними из наиболее перспективных препаратов
(0.00 M NaCl) сохраняли постоянной во всех экс-
данного спектра действия являются комплексы
периментах.
Zn(II) [8, 9, 23]. Связывание с молекулой ДНК
Оптическое поглощение растворов ДНК, фе-
или ее расщепление приводит к ингибированию
нантролина и металлокомплексов измеряли на
синтеза макромолекулы в клетке [24]. В ряде слу-
спектрофотометре СФ-56 (ЛОМО, Россия). Кон-
чаев металлокомплексы проявляют фотосенси-
центрацию ДНК в растворе определяли по методу
билизирующий эффект [1, 25, 26]. К сожалению,
Спирина [36]. Измерения проводили при 20°С.
часто на пути применения подобных соединений
Использовали кварцевую прямоугольную кювету
в качестве лекарственных форм стоит их плохая
с длиной оптического пути l =1 см.
растворимость в воде. Поэтому разработка новых
Измерения спектров флуоресценции раство-
комплексных соединений, обладающих хорошей
ров проводили на флуоресцентном спектрофото-
биосовместимостью, и исследование их биологи-
метре Lumina (Thermo Fisher Scientific, США) под
ческой активности является актуальной задачей.
90° в прямоугольной кварцевой кювете (l =1 см)
Наиболее распространенным методом иссле-
при температуре 20°. Длина волны возбуждения
дования взаимодействия низкомолекулярных со-
фенантролина 263 нм, monoZn и diZn - 270 нм.
единений с ДНК в растворе является метод элек-
Спектры испускания корректировались на спек-
тронной спектроскопии. Неаддитивность спек-
тральную чувствительность прибора. Оптическая
тров поглощения компонентов при их
плотность растворов на длине волны возбужде-
смешивании свидетельствует о комплексообра-
ния составляла D ≈ 0.1.
зовании в растворе [27]. Однако если спектры
Измерения кривых плавления ДНК в исследу-
ДНК и исследуемого соединения перекрывают-
емых растворах проводили на приборе Specord
ся, сделать однозначный вывод о причинах спек-
200 plus (Analytik Jena, Germany) с приставкой
тральных изменений сложно. В данной работе
Пельтье, с шагом 1°, скорость нагрева 2°/мин.
изучается взаимодействие ДНК в растворе с фе-
Использовали кварцевые кюветы с длиной опти-
нантролином и двумя новыми комплексами
ческого пути l = 1 см. В экспериментах измеряли
Zn(II) с фенантролиновыми и фенантроциани-
оптическое поглощение раствора в максимуме
новыми лигандами с помощью методов спектро-
поглощения ДНК D260 в зависимости от темпера-
скопии в ультрафиолетовой и видимой областях
туры T. Сбор данных и управление эксперимен-
спектра, а также флуоресцентной спектроскопии
том осуществляли с помощью программы Wi-
и спектрофотометрического плавления ДНК.
nASPECT (Analytik Jena, Германия). Обработку
Последний метод активно применяется для изу-
данных проводили в программном пакете Origin-
чения комплексообразования ДНК с биологиче-
Pro. Значение температуры плавления ДНК (Тпл)
ски активными соединениями и нарушений в
структуре ДНК, так как он дает информацию о
определяли по положению максимума на диффе-
степени спиральности макромолекулы и позво-
ренциальной кривой плавления dD260(T)/dT [37].
ляет в ряде случаев оценить термодинамические
параметры связывания [28-34].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
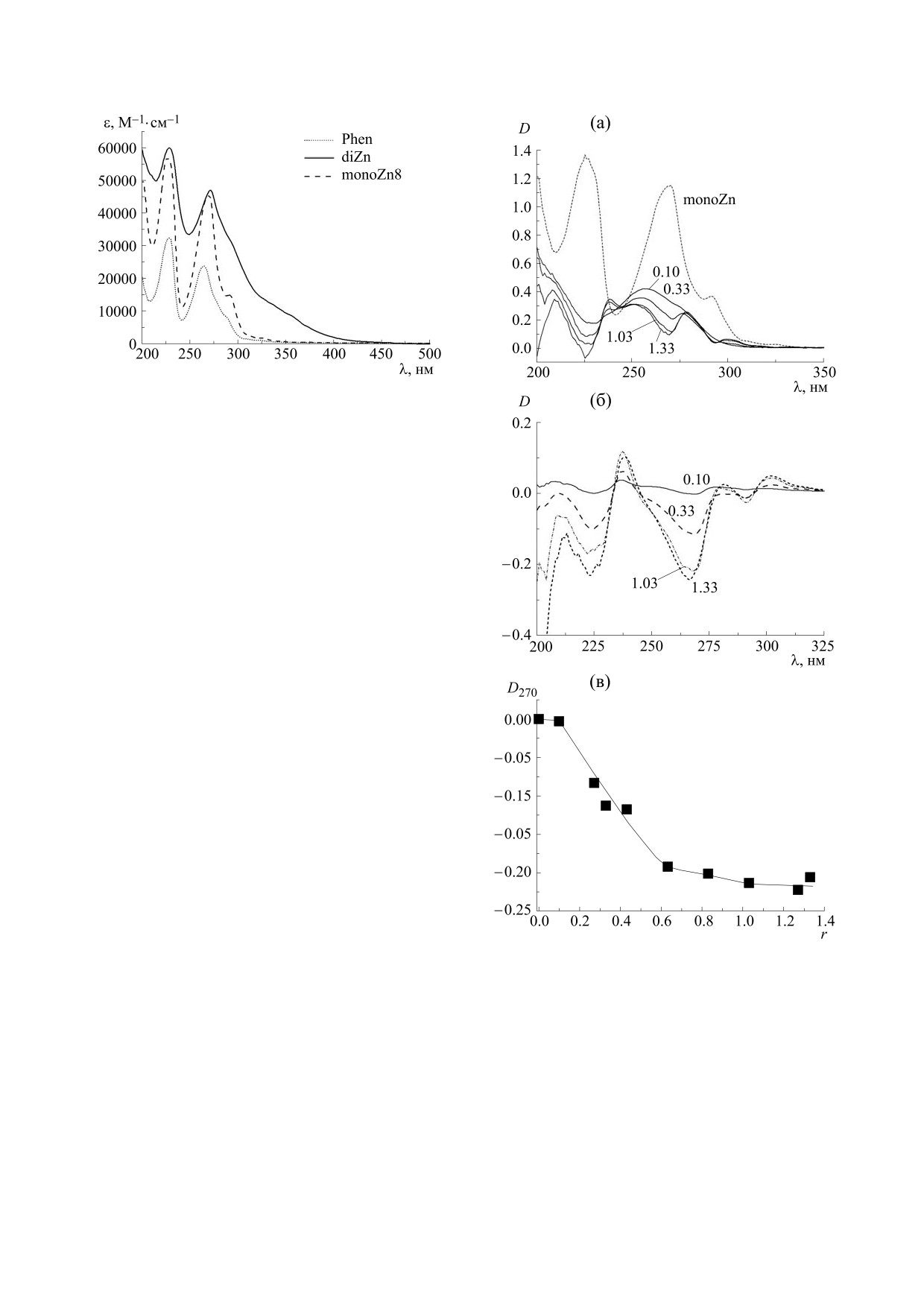
На рис. 2 представлены спектры поглощения
МАТЕРИАЛЫ И МЕТОДЫ
фенантролина, monoZn и diZn в воде при рН 6.0.
В работе использовали ДНК тимуса теленка
Спектр поглощения фенантролина имеет два
(Sigma, США) молекулярной массы M = (9 ± 1) ⋅
максимума: при 227 и 263 нм. Спектр поглощения
monoZn имеет максимумы при 225, 270 и 292 нм и
106 Да, химически чистые NaCl и фенантролин,
длинноволновое плечо в области 300 нм < λ <
два новых комплексных соединения Zn(II) с про-
< 350 нм. В спектре diZn наблюдаются два макси-
изводными
1,10-фенантролина: бис-(1,10-фе-
нантролин)-(1,10-фенантроцианин)-дицинка(II)
мума: при 227 и 271 нм. Кроме того, в диапазоне
ацетат (условное обозначение diZn) и его предше-
λ = 290÷450 нм присутствуют два длинноволно-
вых плеча, обусловленные наличием неразре-
ственник
- бис-(1,10-фенантролин)-цинка(II)
шенных полос. Как видно, спектры металлоком-
ацетат (условное обозначение monoZn) (рис. 1).
плексов в значительной мере перекрываются со
Синтез соединений проводили по методике, опи-
санной в работе [35]. Zn7 представляет собой
спектром поглощения ДНК.
аморфное вещество красно-бурого цвета, Zn8 -
Были проведены исследования взаимодей-
бесцветное вещество. В твердом состоянии в со-
ствия monoZn и diZn с ДНК в водно-солевых рас-
став комплексов во внутренней координацион-
творах 0.003M NaCl. На рис. 3а показана часть
БИОФИЗИКА том 66
№ 1
2021
ВЗАИМОДЕЙСТВИЕ ДНК С ФЕНАНТРОЛИНОМ
25
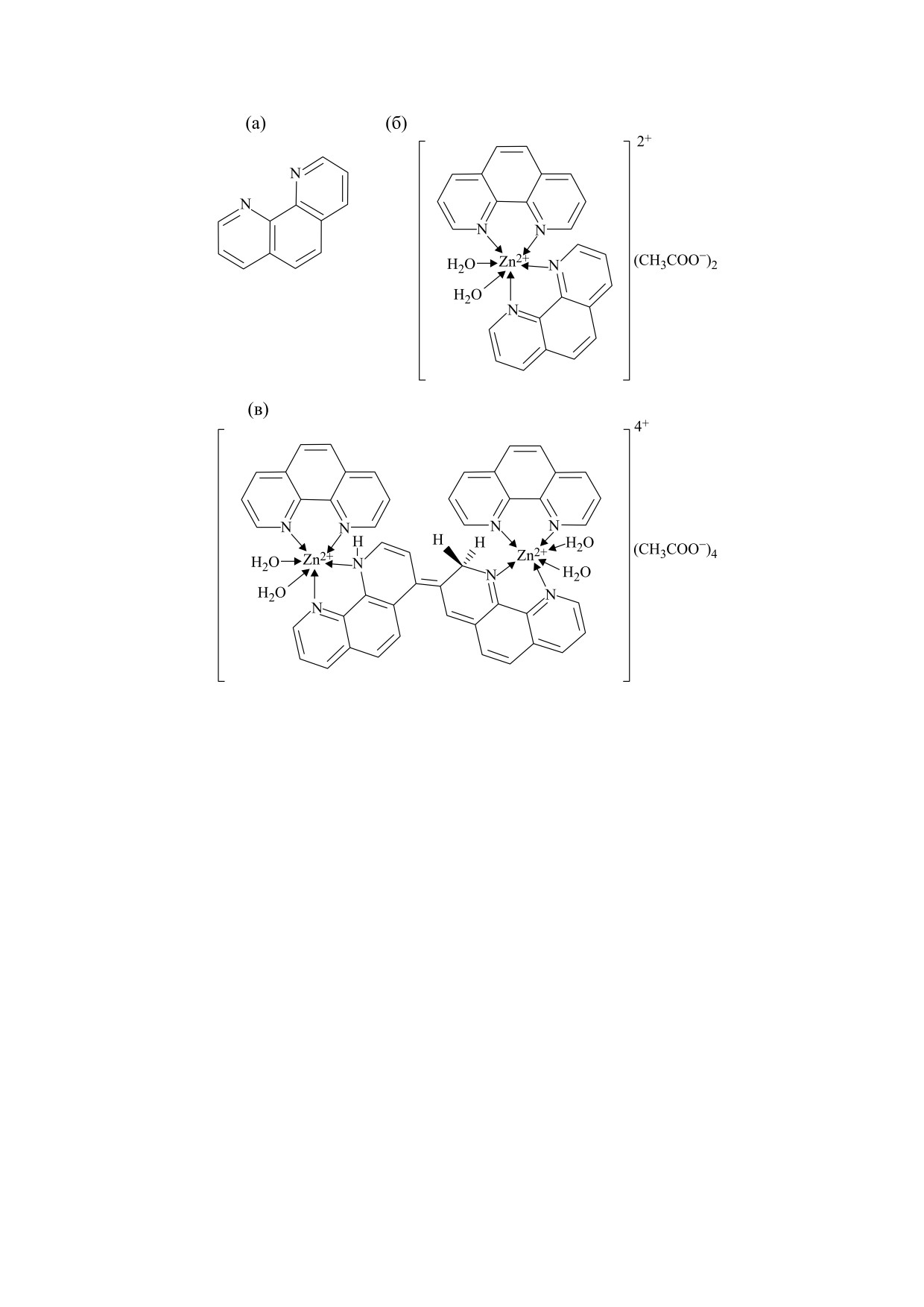
Рис. 1. Структурные формулы исследуемых соединений: (а) - 1,10-фенантролин, (б) - бис-(1,10-фенантролин)-цин-
ка(II) ацетат (monoZn) в водном растворе, (в) - бис-(1,10-фенантролин)-(1,10-фенантроцианин)-дицинка(II) ацетат
(diZn) в водном растворе.
спектров, полученных в серии при постоянной
цательную область D, тем большую, чем больше
концентрации ДНК и варьировании концентра-
величина r. Заметим, что наибольшие отклоне-
ции monoZn, причем в качестве растворителя при
ния от нуля наблюдаются в разностных спектрах
измерении поглощения использовали раствор
в диапазонах длин волн, соответствующих макси-
monoZn в той же концентрации, что и в растворе
мумам в спектре поглощения monoZn. Это свиде-
в присутствии ДНК. На рис. 3а приведено отно-
тельствует о том, что спектр металлокомплекса
существенно изменяется при комплексообразо-
шение концентрации металлокомплекса к кон-
вании с ДНК, а именно, интенсивность его по-
центрации ДНК в парах оснований: r = [Zn]/
глощения снижается (вычитание спектра раство-
[ДНКbp]. Таким образом, спектры на рис. 3а по-
рителя с той же концентрацией monoZn в пред-
казывают поглощение ДНК в комплексе (при
положении, что спектр металлокомплекса не
условии, что спектр monoZn не изменился при
изменился в присутствии ДНК привело к избы-
взаимодействии) - и неаддитивность спектров
точному вычитанию поглощения свободного
ДНК и monoZn в смеси очевидна из рис. 3а. Для
monoZn из спектра комплекса). Отметим, что ги-
более наглядного представления спектральных
похромный эффект в полосе поглощения соеди-
изменений при комплексообразовании спектр
нения является одним из признаков интеркаля-
ДНК также был вычтен из спектров двухкомпо-
ционного типа связывания [1, 8, 9, 16]. Амплитуда
нентных растворов (рис. 3б). При отсутствии вза-
интенсивности разностного спектра на длине
имодействия результат равнялся бы нулю, однако
волны максимума поглощения monoZn (270 нм)
в этих разностных спектрах мы наблюдаем откло-
монотонно растет с увеличением r (рис. 3в); на
нения от нуля как в положительную, так и в отри-
этой зависимости можно выделить несколько
БИОФИЗИКА том 66
№ 1
2021
26
АКУЛЕНКОВА и др.
Рис. 2. Спектры поглощения фенантролина (phen),
monoZn и diZn в нейтральном водном растворе.
участков, характеризующихся разной скоростью
нарастания спектральных изменений: при r ≤ 0.1
D270 ≈ 0, при 0.1 ≤ r ≤ 0.6 наблюдается резкий рост
|D270|, затем при r ≥ 0.6 зависимость становится
более пологой. Можно предположить, что это яв-
ляется следствием разных типов связывания
monoZn с ДНК, которые реализуются при разных
значениях r. Сходные эффекты наблюдаются в
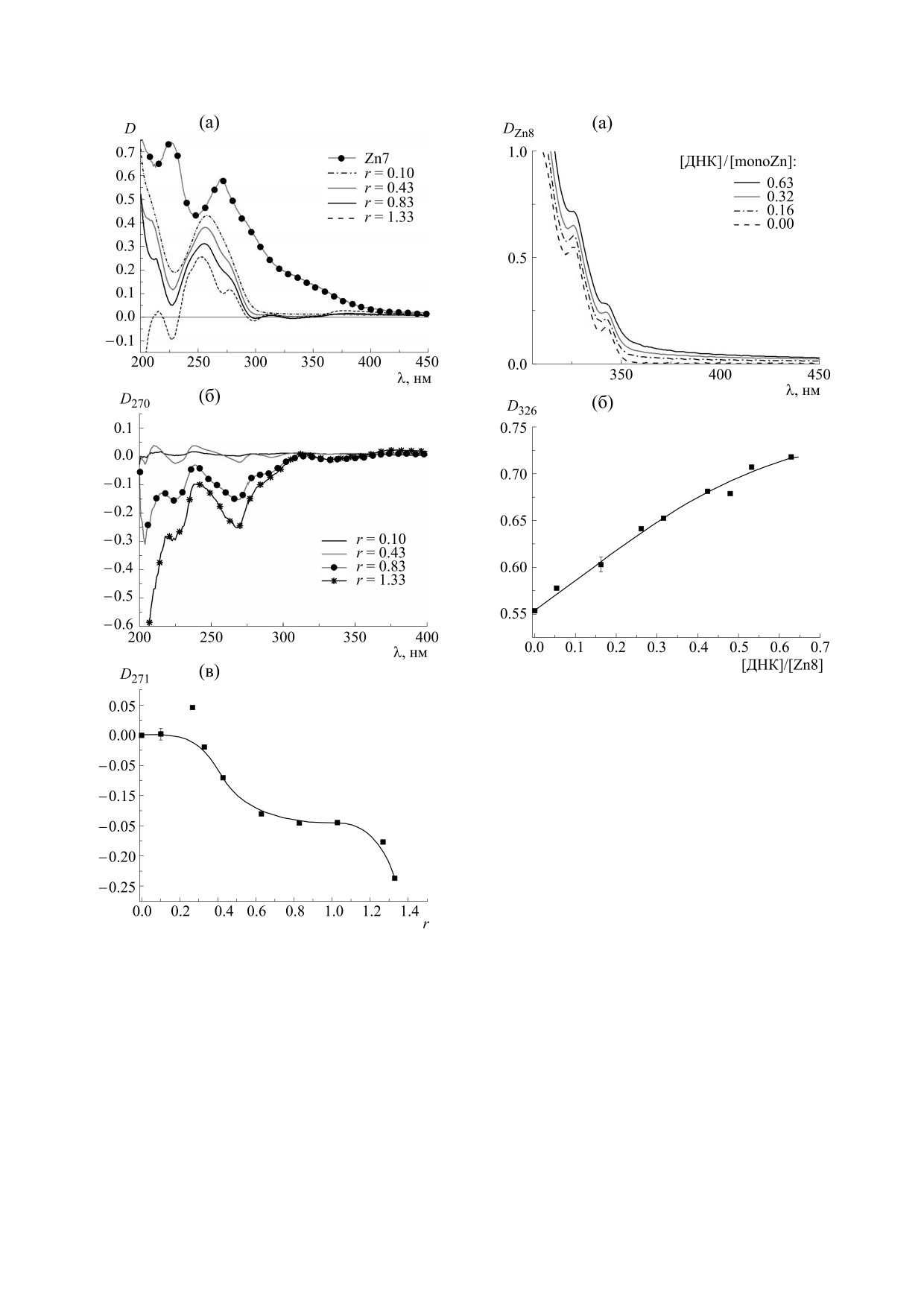
аналогичном эксперименте при взаимодействии
diZn с ДНК (рис. 4). Однако в этом случае при
больших значениях r пологий ход зависимости
D271(r) сменяется участком быстрого роста |D271|.
Таким образом, и в случае diZn мы можем пред-
положить формирование его комплексов с ДНК с
разным типом связывания, причем насыщения
связывания не наблюдается до r ≅ 1.2. Учитывая
большие размеры молекулы diZn, при соотноше-
нии более одной молекулы diZn на пару основа-
ний ДНК мономерное связывание реализовы-
ваться не может. Очевидно, что при больших кон-
центрациях diZn его молекулы взаимодействуют
с уже связавшимися с ДНК металлокомплексами
(вторичное связывание) [38].
Отметим, что при взаимодействии monoZn с
ДНК наблюдается гиперхромный эффект в обла-
сти длинноволнового плеча в полосе поглощения
monoZn ( ≥ 310 нм), в которой ДНК не поглощает
(рис. 3б). Это дает возможность провести спек-
трофотометрическое титрование раствора метал-
локомплекса, варьируя концентрацию ДНК (т.е.
число мест связывания). К сожалению, при взаи-
модействии diZn с ДНК аналогичный эффект в
Рис. 3. (а) - Спектры поглощения ДНК в комплексе с
длинноволновой области не наблюдается
monoZn (показана часть спектров в серии, чтобы не
загромождать рисунок). Рядом со спектрами указаны
(рис. 4б). Спектры поглощения monoZn в обла-
значения r. (б) - Результат вычитания из спектров на
сти вне полосы поглощения ДНК при разных со-
рисунке (а) спектра ДНК (CДНК = 3
⋅
10-5,
отношениях ДНКbp/[monoZn] = 1/r приведены
Мbp = const). в) - Зависимость оптической плотности
на рис. 5а. Зависимость интенсивности поглоще-
(λ = 270 нм) от r, полученная из рисунка (б), погреш-
ния от ДНКbp/[monoZn] (рис. 5б) отражает тот
ность задается размером точек.
БИОФИЗИКА том 66
№ 1
2021
ВЗАИМОДЕЙСТВИЕ ДНК С ФЕНАНТРОЛИНОМ
27
Рис. 5. (а) - Спектры поглощения monoZn в ком-
плексе с ДНК (часть спектров серии), C(monoZn) =
= 4.6 ⋅ 10-4, M = const; (б) - зависимость оптической
плотности (λ = 326 нм) от [ДНК]/[monoZn], получен-
ная из рисунка (а).
ся. Заметим, что значения r в этом эксперименте
варьируют в пределах 1.4 ≤ r ≤ 20. Таким образом,
и в случае взаимодействия ДНК с monoZn мы
должны сделать вывод о наличии вторичного свя-
зывания.
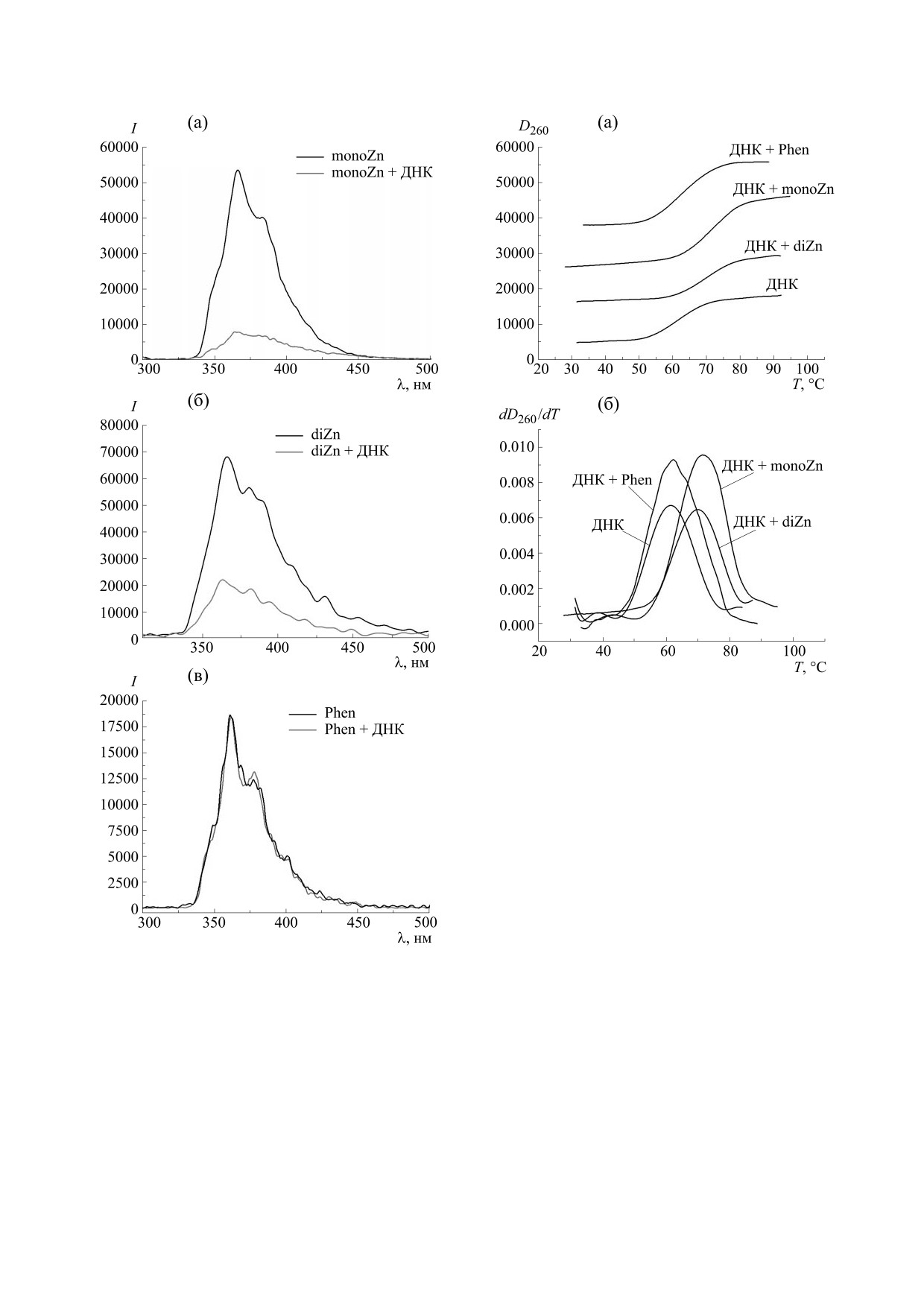
Спектры флуоресценции металлокомплексов
Рис. 4. (а) - Спектры поглощения ДНК в комплексе с
в водно-солевых растворах без добавок и в при-
diZn (показана часть спектров в серии, чтобы не за-
сутствии ДНК приведены на рис. 6а,б. Видно, что
громождать рисунок), значения r указаны на рисунке;
в растворах с ДНК наблюдается тушение флуо-
(б) - результат вычитания из спектров на рисункe (а)
ресценции monoZn и diZn, что также является
спектра ДНК (CДНК = 3 ⋅ 10-5, Мbp = const); (в) - за-
признаком комплексообразования. Можно пред-
висимость оптической плотности (λ = 270 нм) от r,
полученная из рисунка (б).
положить, что имеет место перенос возбуждения
с молекул металлокомплекса, связанных с ДНК,
на макромолекулу. Это позволяет рассматривать
факт, что с ростом числа мест связывания коли-
monoZn и diZn как возможные фотосенсибилиза-
чество monoZn в комплексе с ДНК увеличивается
торы. В растворе фенантролина, содержащем
и насыщение связывания при этом не наблюдает-
ДНК, тушение флуоресценции не наблюдается
БИОФИЗИКА том 66
№ 1
2021
28
АКУЛЕНКОВА и др.
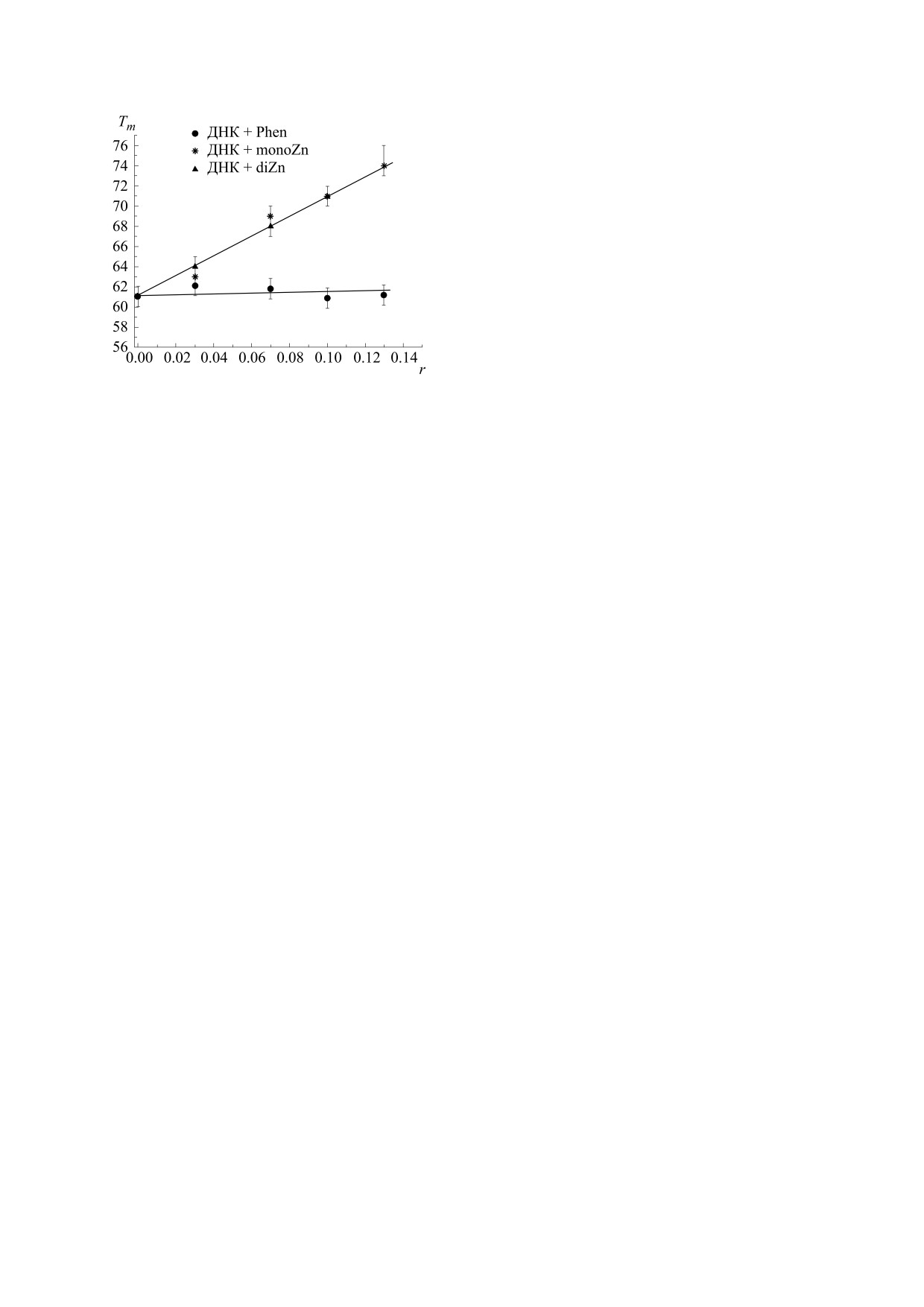
Рис. 7. Кривые плавления ДНК в растворах в присут-
ствии металлокомплексов и фенантролина: (а) - за-
висимость поглощения в максимуме спектра ДНК от
температуры; (б) - дифференциальные кривые плав-
ления.
Результаты плавления ДНК в растворах с фе-
нантролином, monoZn и diZn показаны на рис. 7
и 8. В присутствии металлокомплексов темпера-
тура плавления ДНК существенно возрастает, ли-
нейно с ростом r (рис. 8). Интересно отметить,
что оба соединения одинаково влияют на темпе-
ратуру плавления ДНК. Это может свидетель-
ствовать о том, что способ первичного (мономер-
ного) связывания с ДНК у monoZn и diZn сход-
Рис. 6. Спектры испускания исследуемых соедине-
ный. Основываясь на литературных данных,
ний в водно-солевых растворах и в растворах с ДНК:
можно предположить, что столь значительная
= 270 нм (в максимуме поглоще-
(а) - monoZn, λвозб
стабилизация двойной спирали ДНК при взаимо-
ния monoZn); (б) - diZn, λвозб = 270 нм (в максимуме
действии с металлокомплексами свидетельствует
поглощения diZn); (в) - фенантролин, λвозб = 263 нм
об интеркаляционном типе связывания [10, 11, 16,
(в максимуме поглощения phen).
30]. Температура плавления ДНК в присутствии
фенантролина заметно не изменилась (рис. 7 и 8),
(рис. 6в). Это говорит об отличии в способе взаи-
что подтверждает вывод о разных способах взаи-
модействия с ДНК фенантролина и металлоком-
модействия ДНК с металлокомплексами и фе-
плексов на его основе.
нантролином.
БИОФИЗИКА том 66
№ 1
2021
ВЗАИМОДЕЙСТВИЕ ДНК С ФЕНАНТРОЛИНОМ
29
ВЫВОДЫ
Данные, полученные методами спектроско-
пии поглощения, флуоресценции и спектрофото-
метрического плавления ДНК свидетельствуют о
комплексообразовании с ДНК двух новых метал-
локомплексов - бис-(1,10-фенантролин)-(1,10-
фенантроцианин)-дицинка(II) ацетата (diZn) и
его предшественника бис-(1,10-фенантролин)-
цинка(II) ацетата (monoZn). Для обоих исследо-
ванных соединений реализуются несколько
типов связывания с ДНК, один из которых, веро-
ятно, интеркаляция. Насыщения связывания не
происходит при 0.1 ≤ r ≤ 20 для monoZn и при
0.1 ≤ r ≤ 1.67 для diZn, поэтому мы предполагаем
образование вторичных (ди- или n-мерных) ком-
плексов исследуемых соединений на ДНК. Свя-
Рис. 8. Зависимости температуры плавления ДНК от
зывание с ДНК приводит к тушению флуорес-
содержания металлокомплексов и фенантролина в
ценции металлокомплексов. Это позволяет рас-
растворе.
сматривать monoZn и diZn как возможные
фотосенсибилизаторы.
Из полученных данных однозначно следует,
что происходит комплексообразование ДНК с
БЛАГОДАРНОСТИ
изучаемыми соединениями. Для металлоком-
Часть исследований проведена с использова-
плексов это вполне ожидаемо, так как monoZn и
нием оборудования ресурсных центров Научного
diZn заряжены положительно: в водном растворе
парка СПбГУ «Оптические и лазерные методы
monoZn имеет заряд 2+, diZn — заряд 4+. Для
исследования вещества», «Методы анализа соста-
monoZn исследование проведено при 0.1 ≤ r ≤ 20,
ва вещества» и «Центр диагностики функцио-
для diZn - при 0.1 ≤ r ≤ 1.67, для обоих соединений
нальных материалов для медицины, фармаколо-
гии и наноэлектроники».
насыщение из связывания с ДНК не зарегистри-
ровано. Для однозначного вывода о типе
связывания полученных результатов пока недо-
КОНФЛИКТ ИНТЕРЕСОВ
статочно, можно лишь высказать некоторые
Авторы заявляют об отсутствии конфликта
предварительные предположения, опираясь на
интересов.
аналогичные данные, имеющиеся в литературе [1,
8-11, 16]. Можно предположить, что как в случае
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
monoZn, так и в случае diZn один из типов ком-
плексообразования - интеркаляция. На это ука-
Настоящая работа не содержит описания ис-
зывает гипохромный эффект на полосах погло-
следований с использованием людей и животных
в качестве объектов.
щения соединений, а также сильное повышение
температуры плавления ДНК в комплексе с
monoZn и diZn. Интеркаляция в двойную спи-
СПИСОК ЛИТЕРАТУРЫ
раль различных металлокомплексов, содержащих
1. J. A. McCleverty and T. J. Meyer, Comprehensive Coor-
фенантролин, описана в литературе [1, 8, 9, 16].
dination Chemistry II: From Biology to Nanotechnology
При этом, согласно полученным нами данным,
(Newnes, 2003).
отдельные молекулы фенантролина не интерка-
2. G. Accorsi, A. Listorti, K. Yoosaf, and N. Armaroli,
лируют в ДНК. Наблюдаемое нами отсутствие на-
Chem. Soc. Rev. 38, 1690 (2009).
сыщения связывания для металлокомплексов
3. M. S. Henry and M. Z. Hoffman, J. Phys. Chem. 83,
618 (1979).
при соотношении более чем одна молекула со-
единения на одну пару оснований (а в случае
4. Y.-W. Sie, C.-L. Li, C.-F. Wanb, et al., Inorgan. Chim.
Acta 469, 397 (2018).
monoZn - более десяти молекул соединения на
5. L. Zhang, Z. Wang, J. Zhang, et al., Nanomaterials 8,
одну пару оснований) может говорить о том, что
1071 (2018).
при больших значениях r осуществляется вторич-
6. S. Sangeetha, G. Sathyaraj, D. Muthamilselvan, et al.,
ное связывание молекул соединения с молекула-
Dalton Trans. 41, 5769 (2012).
ми, уже связанными с ДНК, с образованием ди-
7. K. Hayashi, H. Akutsu, H. Ozaki, and H. Sawai, Chem.
меров (и, возможно, n-меров) [38].
Commun. 13 (12), 1386 (2004).
БИОФИЗИКА том 66
№ 1
2021
30
АКУЛЕНКОВА и др.
8. В. Н. Демидов, Н. А. Касьяненко, В. С. Антонов и
25. А. А. Кузнецова, Л. И. Соловьева и О. С. Федорова,
др., Рос. хим. журн. 54 (6), 120 (2010).
Биоорган. химия 34 (5), 683 (2008).
9. N. Raman and R. Mahalakshmi, Inorgan. Chem.
26. C. M. Allen, W. M. Sharman, and J. E. Van Lier, J. Por-
Commun. 40, 157 (2014).
phyrins Phthalocyanines 5 (2), 161 (2001).
10. N. Kasyanenko, Z. Qiushi, V. Bakulev, et al., Polymers
27. D. S. Ershov, S. V. Paston, L. A. Kartsova, et al., Struct.
9, 211 (2017).
Chem. 22 (2), 475 (2011).
11. G. Barone, A. Terenzi, A. Lauria, et al., Coord. Chem.
28. А. А. Веденов, А. М. Дыхне и М. Д. Франк-Каме-
Rev. 257, 2848 (2013).
нецкий, Успехи физ. наук 107 (3), 479 (1971).
12. С. В. Пастон, В. М. Бакулев, В. Н. Демидов и др.,
29. A. T. Karapetian, N. M. Mehrabian, G. A. Terzikian,
Вестн. СПбГУ. Сер. 4. Физика. Химия 2 (3), 299
et al., J. Biomol. Structure and Dynamics 14 (2), 275
(2015).
(1996).
13. H.-L. Seng, S.-T. Von, K.-W. Tan, et al., Biometals 23,
30. A. T. Karapetian, P. O. Vardevanian, G. A. Tarzikian,
99 (2010).
and M. D. Frank-Kamenetskii, J. Biomol. Structure
14. C. S. Devi, P. Nagababu, and S. Natarajan, Eur. J.
and Dynamics 8 (1), 123 (1990).
Med. Chem. 72, 160 (2014).
31. P. O. Vardevanyan, A. P. Antonyan, M. A. Par-
15. R. B. Sears, L. E. Joyce, M. Ojaimi, et al., J. Inorgan.
sadanyan, et al., J. Biomol. Structure and Dynamics 34
Biochem. 121, 77 (2013).
(7), 1377 (2016).
16. Y. J. Jang, G-Y. Yeo, B. Park, and S. K. Kim, Biophys.
Chem. 158, 38 (2011).
32. S. A. Tankovskaia, O. M. Kotb, O. A. Dommes, and
S. V. Paston, J. Physics: Conf. Series 1038, 012027
17. В. Н. Демидов, Е. А. Божкова, И. М. Зырянова и
(2018).
Н. А. Касьяненко, Вестн. СПбГУ. Сер. 4, № 1, 150
(2012).
33. S. A. Tankovskaia, O. M. Kotb, O. A. Dommes, and
18. Mudasir, K. Wijaya, E. Tri Wahyuni, et al., Spectro-
S. V. Paston, Spectrochim. Acta Part A: Molecular and
chim. Acta Part A 66, 163 (2007).
Biomolecular Spectroscopy 200 (2018) 85.
19. I. G. J. de Avellar, M. M. M. Magalhaes, A. B. Silva,
34. D. Y. Lando, C.-L. Chang, A. S. Fridman, et al., J. In-
et al., Biochim. Biophys. Acta 1675, 46 (2004).
org. Biochem. 137, 85 (2014).
20. Q. Jiang, N. Xiao, P. Shi, et al., Coord. Chem. Rev.
35. В. Н. Демидов, Дис. … д-ра хим. наук (Санкт-Пе-
251, 1951 (2007).
тербургский государственный технологический
21. S. Ramakrishnan and M. Palaniandavar, Dalton Trans.
институт, СПб, 2010).
17 (29), 3866 (2008).
36. А. С. Спирин, Биохимия 23, 656 (1958).
22. S. Roy, K. D. Hagen, P. U. Maheswari, et al.,
37. D. Y. Lando, A. S. Fridman, C.-L. Chang, et al., Anal.
ChemMedChem 3, 1427 (2008).
Biochem. 479, 28 (2015).
23. W. H. Mahmoud, G. G. Mohamed, and M. M. I. El-
38. D. N. Osinnikova, E. B. Moroshkina, and
Dessouky, Int. J. Electrochem. Sci. 9, 1415 (2014).
D. M. Glushkina, J. Physics: Conf. Series 661, 012020
24. A. Bolhuis and R. Janice, Bioorg. Chem. 55, 51 (2014).
(2015).
Interaction of DNA with Phenanthroline
and New Phenanthrocyanine Complexes of Zn(II)
E.V. Akulenkova*, V.N. Demidov**, A.O. Martynova*, and S.V. Paston*
*Faculty of Physics, St. Petersburg State University, Ulyanovskaya ul. 1, Stary Petergof, St. Petersburg, 198504 Russia
**LLC “Pro-Brite”, ul. Sofiyskaya 93, St. Petersburg, 192289 Russia
The interaction of Zn (II) complexes and derivatives of 1,10-phenanthroline: bis-(1,10-phenanthroline)-
(1,10-phenanthrocyanine)-dizinc (II) acetate (diZn) and its precursor - bis-(1,10-phenanthroline)-zinc (II)
acetate (monoZn) with DNA in aqueous-salt solutions has been studied by means of optical spectroscopy and
fluorescence melting method. Interaction between phenanthroline and DNA is significantly different from
interaction between metal complexes of phenanthroline and DNA. MonoZn and diZn form complexes with
DNA; depending on molar ratio of the components, ligands may interact with DNA by several ways, one of
them is, presumably, intercalation. No saturation binding was recorded at 0.1 ≤ r ≤ 20 and 0.1 ≤ r ≤ 1.67 for
monoZn and diZn, respectively. The formation of secondary complexes of monoZn and diZn on DNA is
possible. The interaction with DNA leads to quenching the fluorescence from metal complexes.
Keywords: DNA, phenanthroline, metal complexes, DNA melting, fluorescence spectroscopy, intercalation
БИОФИЗИКА том 66
№ 1
2021