БИОФИЗИКА, 2021, том 66, № 1, с. 31-39
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.29:615
ОЦЕНКА ЭФФЕКТИВНОСТИ ГИБРИДИЗАЦИОННОГО АНАЛИЗА
ПРИ МАРКИРОВАНИИ ДНК ЦИАНИНОВЫМИ КРАСИТЕЛЯМИ
КРАСНОГО И БЛИЖНЕГО ИНФРАКРАСНОГО ДИАПАЗОНА
© 2021 г. А.Ю. Иконникова, В.Е. Шершов, Ю.В. Мороз, В.А. Василисков, С.А. Лапа,
Р.А. Мифтахов, В.Е. Кузнецова, А.В. Чудинов, Т.В. Наседкина
Институт молекулярной биологии им. В.А. Энгельгардта РАН, 119991, Моcква, ул. Вавилова, 32
E-mail: nased@biochip.ru
Поступила в редакцию 22.09.2020 г.
После доработки 22.09.2020 г.
Принята к публикации 26.09.2020 г.
Исследована чувствительность гибридизационного анализа с использованием биологического
микрочипа при маркировании ДНК пpоизводными 5′-тpифоcфатов 2′-дезокcиуpидина, содержа-
щими цианиновые красители типа Сy5 и Cy7 в качестве флуорофора. Были выбраны два Cy5-dUTP
и два Cy7-dUTP, способные эффективно встраиваться в растущую цепь ДНК в ходе ПЦР. Продукты
ПЦР, флуоресцентно-меченные разными красителями, гибридизовали с матрицей олигонуклео-
тидных зондов, иммобилизованных в гидрогелевых ячейках биологического микрочипа. Результа-
ты гибридизации регистрировали с помощью цифровой люминесцентной микроскопии в красном
(для Cy5-dUTP) и ближнем инфракрасном (для Cy7-dUTP) диапазонах. Методом последователь-
ных разведений определена минимальная исходная концентрация ДНК, при которой возможно
определение генотипа в результате специфического взаимодействия флуоресцентно-меченного
ПЦР-продукта и олигонуклеотидных зондов на биочипе. Показано, что флуоресцентно-меченные
Cy7-dUTP обеспечивают более высокую чувствительность гибридизационного анализа по сравне-
нию с Cy5-dUTP.
Ключевые слова: флуоресценция, модифицированные нуклеотиды, цианиновые красители, ИК-диапазон,
ближний ИК-диапазон, биологические микрочипы, аллель-специфичная гибридизация.
DOI: 10.31857/S000630292101004X
ала. Переход в ближнюю инфракрасную область в
Флуоресцентное маркирование нуклеиновых
диапазоне 700-900 нм с меньшей фоновой флуо-
кислот с целью визуализации результатов моле-
ресценцией, в так называемое «диагностическое
кулярно-генетического анализа является широко
окно биологической ткани», позволяет решить
распространеным подходом в диагностических
эту проблему [4, 5].
исследованиях [1]. Цианиновый краситель Cy5,
поглощающий и флуоресцирующий в красной
К флуоресцентным меткам, спектрально по-
области спектра (600-700 нм), используется во
падающим в «диагностическое окно биологиче-
многих исследовательских и коммерческих те-
ской ткани», относятся гептаметиновые циани-
стах, основанных на полимеразной цепной реак-
новые флуоресцентные красители Cy7 с макси-
ции (ПЦР) в реальном времени или гибридизаци-
мумами поглощения и флуоресценции в
онном анализе с использованием биологических
диапазоне 700-900 нм. Биологические ткани и их
микрочипов (microarray) [2, 3].
компоненты в этой спектральной области имеют
Основными характеристиками любого диа-
минимальное поглощение и минимальную соб-
гностического метода являются его аналитиче-
ственную флуоресценцию [6, 7], поэтому, напри-
ская чувствительность и точность. Естественным
мер, оказалось возможным использовать гепта-
препятствием для повышения анналитической
метиновые красители Cy7, связанные с рецептор-
чувствительности анализа является остаточная
ными группами, в инфракрасной визуализации
фоновая флуоресценция биологического матери-
опухолевых тканей [8, 9].
Интерес к флуоресцентным красителям ближ-
Сокращения: ПЦР - полимеразная цепная реакция, Cy5-
него инфракрасного диапазона возрос после того,
dUTP - флуоресцентно-меченные 5'-трифосфаты 2'-дез-
оксиуридина dU2 и dU49, Cy7-dUTP - флуоресцентно-ме-
как было показано, что использование гептаме-
ченные 5'-трифосфаты 2'-дезоксиуридина dU83 и dU84.
тиновых цианиновых флуоресцентных красите-
31
32
ИКОННИКОВА и др.
лей в твердофазном иммунологическом анализе в
1) rs4808801_F GTCCTGCTGACCCCCACAG
качестве флуоресцентной метки позволяет до-
и rs4808801_R
биться чрезвычайно высокой чувствительности,
tcattggatctcattaGTGCCACTGTGACTTCCCCT;
соизмеримой с чувствительностью иммунофер-
2) rs4849887_F TCGAGTGTCTGGCTTCCAGC
ментного анализа, использующего в качестве
и rs4849887_R
метки пероксидазу хрена [10]. С флуоресцентны-
tcattggatctcattaCAGGGGTCCAGGTGGTTGAG;
ми метками видимого оптического диапазона до-
3) rs4973768_F CTGTCACTGTCTCTCAAT-
биться такой чувствительности не представляется
GAATGCT и rs4973768_R
возможным.
tcattggatctcattaCTGACTACTCCATTTAAGAGCA-
AAGGT.
Гептаметиновые цианиновые красители до-
статочно стабильны в условиях проведения моле-
Последовательность обратного праймера
кулярно-биологического анализа и обладают вы-
включала локус-специфичную часть и адаптер
сокими коэффициентами молярной экстинкции
(выделен прописными буквами), что позволяло
и высокими квантовыми выходами флуоресцен-
асимметрично нарабатывать ПЦР-продукт в ходе
ции [11-13].
одноэтапной ПЦР для последующей гибридиза-
ции на биочипе.
Ранее было показано, что флуоресцентно-ме-
Оценивали влияние Cy5-dUTP и Cy7-dUTP на
ченные 5'-трифосфаты 2'-дезоксиуридина dU2 и
прохождение ПЦP в зависимости от их концен-
dU49 (Cy5-dUTP) встраиваются в растущую цепь
трации с помощью ПЦР в реальном времени в
ДНК в ходе ПЦР, причем эффективность встраи-
присутствии интеркалирующего красителя Eva-
вания зависит от структуры флуорофора, а также
Green. Амплификацию проводили с праймерами
химического строения линкера, соединяющего
для анализа rs4849887 в локусе 2q14. Использова-
нуклеотид с флуорофором [14-16]. Также было
ли коммерчески доступную полимеразу с горя-
показано, что флуоресцентно-меченные 5'-три-
чим стартом SynTaq ДНК-полимераза (НПК
фосфаты 2'-дезоксиуридина dU83 и dU84 (Cy7-
«Синтол», Россия). Состав реакционной смеси:
dUTP) способны встраиваться в ПЦР-продукты и
5 нг ДНК, дезокcинуклеозидтpифоcфаты (dATP,
обеспечивать высокую эффективность гибриди-
dGTP, dCTP, dTTP) в концентpации 200 мкМ
зационного анализа [17]. Однако прямое сравне-
каждый, 1×ПЦР буфер SynTaq, 1.5 мМ MgCl2,
ние наиболее перспективных производных Cy5-
пpаймеpы в концентpации 300 нM, 1×EvaGreen
dUTP и Cy7-dUTP по их способности влиять на
(Biotium, CША) и 0.75 ед. активности поли-
чувствительность и специфичность аллель-спе-
меpазы на реакцию (объем реакционной массы
цифичной гибридизации на биологических мик-
25 мкл). Также в реакцию добавляли один из двух
рочипах ранее не проводилось.
Cy7-dUTP (dU83, dU84) или Cy5-dUTP (dU2,
dU49) в концентpации 20, 8 и 4 мкМ. Реакцию
В настоящей работе проведен сравнительный
проводили на приборе Light-Cycler 96 (Roche,
анализ эффективности гибридизационного ана-
Швейцаpия) по следующей программе: 94°С -
лиза при маркировании ДНК, синтезируемой de
4 мин, 45 циклов (94°С - 15 с, 62°С - 30 с, 72°С -
novo в ходе ПЦР, с помощью 5′-тpифоcфатов 2′-
30 с) с детекцией флуоресценции красителя Eva-
дезокcиуpидина, содержащих пентаметиновый
Green по каналу ResoLight.
аналог Cy5, флуоресцирующий в красной обла-
сти, или гептаметиновый аналог Cy7, флуоресци-
Для оценки показателя динамики ПЦP в
рующий в ближней инфракрасной области. По-
pеальном вpемени иcпользовали cкоpоcть ампли-
казано, что Cy7-dUTP позволяют достичь более
фикации, pаccчитанную по тангенcу угла наклона
высокой разрешающей способности гибридиза-
линейного учаcтка кpивой накопления
ционного анализа по сравнению с Cy5-dUTP.
флуоpеcцентного cигнала (tgα) [5], которую нор-
мировали на скорость ПЦР без добавления моди-
фицированных нуклеотидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пpодукты ПЦP разделяли электpофоpезом в
2%-м агаpозном геле и проводили детекцию по
ДНК выделяли из лейкоцитов перифериче-
каналу SYBR Green I с помощью системы гель-
ской крови человека с помощью набора QIAamp
документирования Gel Doc XR+ (BioRad, США)
DNA Blood Mini Kit (Qiagen, Германия) согласно
и по каналам Cy5 и Cy7 с использованием иссле-
инструкции производителя. В качестве мишени
довательского анализатора гелей. Возбуждение
для амплификации выступали локусы, которые
флуоресценции осуществлялось с помощью ртут-
вносят вклад в полигенный риск развития рака
ной лампы, регистрация - с помощью встроен-
молочной железы: rs4808801 в гене SSBP4,
ного прибора с зарядовой связью RTE/CCD-
rs4849887 в локусе
2q14.2, rs4973768 в гене
1536-K/1 (Roper Scientific, США), поле регистра-
SLC4A7. Использовали следующие пары прайме-
ции 15 × 15 см. Флуоpеcценцентные сигналы ре-
ров:
гистрировали c диапазоном пpопуcкания 630-
БИОФИЗИКА том 66
№ 1
2021
ОЦЕНКА ЭФФЕКТИВНОСТИ ГИБРИДИЗАЦИОННОГО АНАЛИЗА
33
690 нм для Cy5 и 810-830 нм для Cy7 соответ-
флуоресценции внутри ячейки, Iout - интеграль-
ственно.
ное значение флуоресценции фона.
Электрофореграммы анализировали с помо-
щью программы ImageJ. Эффективность встраи-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
вания (Eff) исследуемых Cy5- dUTP и Cy7-dUTP
опpеделяли как долю флуоpеcцентно-меченного
Мы исследовали четыре производных 5′-тpи-
пpодукта в общем количеcтве наpаботанного
фоcфатов 2′-дезокcиуpидина, связанных по 5-по-
продукта, т. е. как отношение суммарной интен-
ложению с цвитерионными индодикарбоциани-
сивности сигналов по каналам Cy5 и Cy7 (ICy =
новыми красителями (два Cy5-dUTP) и индотри-
= S ⋅ Iсредн, где S - площадь, занимаемая флуорес-
карбоцианиновыми красителями (два Cy7-
центно-меченным продуктом, Iсредн - среднее ло-
dUTP). Химическое строение и оптические ха-
кальное значение флуоресценции ПЦР-продук-
рактеристики флуоресцентно-меченных дезок-
та) к интенсивности сигналов по каналу SYBR
сиуридинтрифосфатов приведены на рис. 1. Все
Green I (ISG = S ⋅ Iсред), с учетом квантового выхо-
соединения имели суммарный нейтральный за-
ряд, что обеспечивает высокую эффективность
да (QCy7) и коэффициента молярной экстинк-
встраивания флуоресцентно-меченных нуклео-
ции (εCy7).
тидов в ПЦР продукты [12, 15, 17].
I
Cy7
Eff
=
Влияние Cy5-dUTP и Cy7-dUTP на скорость
I
Q
ε
амплификации изучали методом ПЦР в реальном
SG Cy7 Cy7
времени с использованием интеркалирующего
Для проведения аллель-специфичной гибри-
красителя EvaGreen [17]. Каждый из исследуемых
дизации с флуоресцентно-меченным ПЦР-про-
дезоксиуридинтрифосфатов добавляли в трех
дуктом использовали иммобилизованные олиго-
концентрациях: 20, 8 и 4 мкМ. Результаты пред-
нуклеотиды, позволяющие определять различ-
ставлены на рис. 2. Видно, что в присутствии про-
ные аллели для rs4808801, rs4849887, rs4973768:
изводного Cy7-dU83 скорость реакции практиче-
N1 (rs4808801)_A CAAGAAGCAGACGAGCT
ски не изменяется при всех трех концентрациях,
N1 (rs4808801)_G CAAGAAGCGGACGAGC
в случае остальных соединений выраженный эф-
фект ингибирования ПЦР наблюдался при кон-
N2 (rs4849887)_C TGGCAATGCTGAAGCT-TG
центрации 20 мкМ. Наименьшее влияние на ско-
N2 (rs4849887)_T CTGGCAATGTTGAAGCT-TG
рость реакции отмечается для всех соединений
N3 (rs4973768)_C GCAGTTAATTACCTAAAC-
при концентрации 4 мкМ, как было описано ра-
ATGAG
нее [15, 17].
N3 (rs4973768)_T GCAGTTAATTACTTAAAC-
Cпособность изучаемых модифициpованныx
ATGAGT
d-UTP встраиваться в ДНК в ходе ПЦР оценива-
В состав реакции входили 1×ПЦР буфер, 4 мМ
ли на оcновании количественного анализа
MgCl2, 0.2 мМ каждого дезоксинуклеозидтри-
электpофоpегpамм, полученныx для продуктов
ПЦР в реальном времени, по каналам SYBR, Cy5
фосфата, 2.5 ед. полимеразы SynTaq, по 1 пмолю
и Cy7 (рис. 3). Эффективность встраивания опре-
локус-специфичных праймеров, 100 пмолей уни-
деляли по отношению количества флуоpеcцент-
версального праймера
5'-TCATTGGATCTCAT-
но-меченного пpодукта, определенном на кана-
TA-3', ДНК в количестве 10, 5, 0.5 или 0.05 нг, а
лах Cy5 и Cy7, к общему количеcтву наpаботанно-
также исследуемые Cy5-dUTP или Cy7-dUTP в
го в pеакции полноpазмеpного пpодукта,
концентрациях 20, 8 и 4 мкМ (объем реакцион-
определеного на канале SYBR, с учетом кванто-
ной массы 25 мкл). Гибридизацию на биочипе
вого выхода Q и коэффициента молярной экс-
осуществляли в смеси, содержащей 25% форма-
тинкции ε соответствующего красителя (рис. 1).
мида, 5×SSPE, 50 об.% ПЦР-продукта, в течение
6-8 ч при 37ºС, после инкубации промывали и
Результаты анализа электрофореграмм пред-
высушивали. Флуоресцентные сигналы реги-
ставлены на рис. 4. Эффективность встраивания
стрировали методом цифровой люминесцентной
флуоресцентно-меченных нуклеотидов в расту-
микроскопии с помощью двух разных анализато-
щую цепь ДНК заметно снижается с уменьшени-
ров биочипов: 1) при возбуждении на 655 нм и ре-
ем концентрации 20 мкМ > 8 мкМ > 4 мкМ для
гистрации флуоpеcцентных сигналов в диапазоне
всех использованных соединений. Наименьшая
716 ± 22 нм для Cy5; 2) при возбуждении на
эффективность встраивания наблюдается для
760 ± 25 нм и регистрации на 810-830 нм для Cy7
dU83 по сравнению с другими флуоресцентно-
[18, 19]. Анализ изображения проводили с помо-
меченными трифосфатами в тех же концентраци-
щью программы ImaGeWare (ООО «БИОЧИП-
ях. В то же время при концентрации 4 мкМ все
ИМБ», Россия). Интенсивность флуоресценции
исследованные соединения имели близкую эф-
в ячейке биочипа I(f) определяли по формуле
фективность встраивания. С учетом того, что все
(Iin - Iout)/Iout, где Iin - интегральное значение
исследованные трифосфаты при концентрации
БИОФИЗИКА том 66
№ 1
2021
34
ИКОННИКОВА и др.
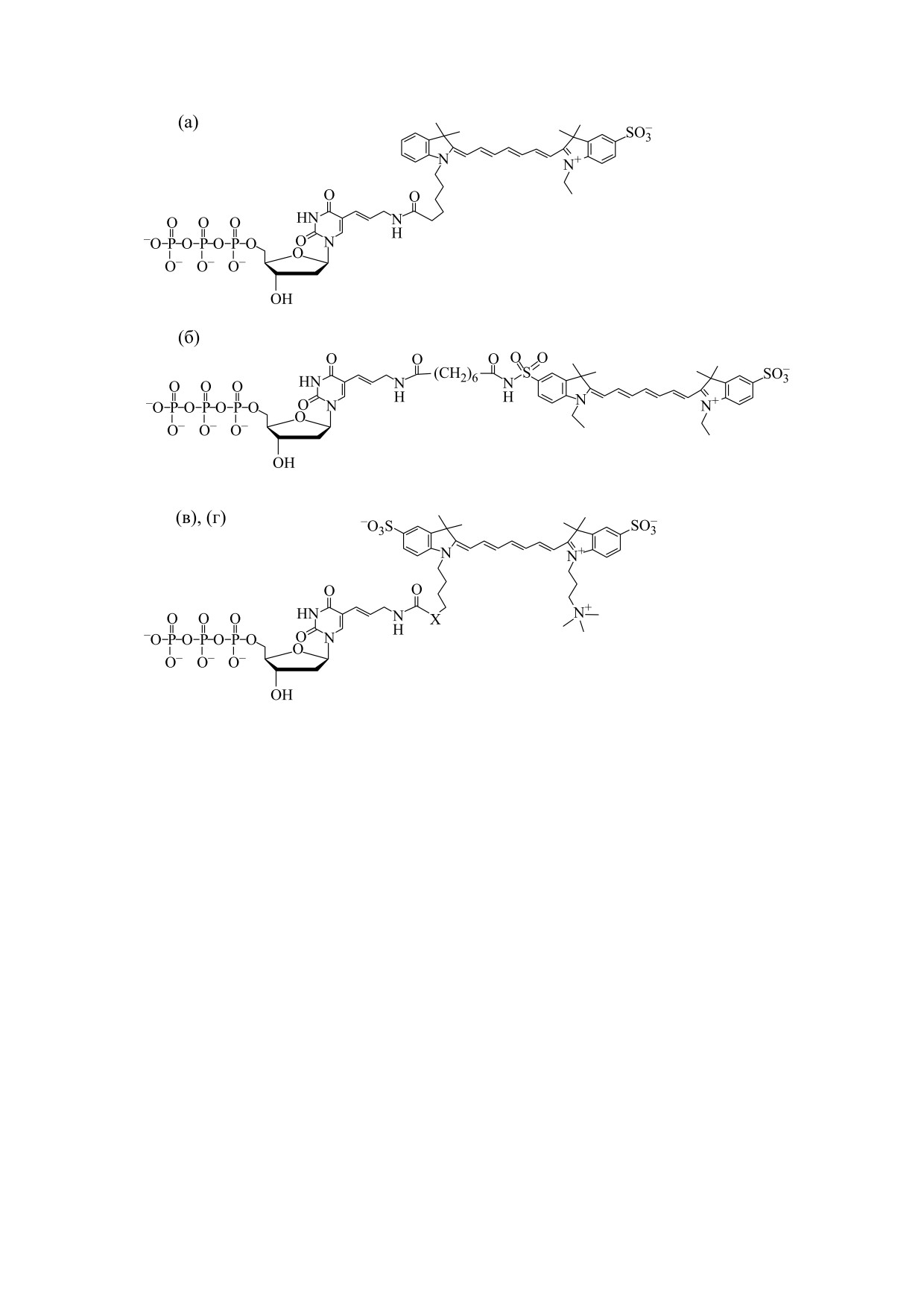
Рис. 1. Химическое строение и оптические характеристики аналогов Cy5 и Cy7, измеренные в фосфатно-солевом
буфере (0.15 M NaCl, 10 мМ калий-фосфат, pH 7.4). (а) - dU2: ε = 2.10 ⋅ 105 M-1 см-1, λabsmax =
643 нм, λemmax =
661 нм,
квантовый выход Q = 12%; (б) - dU49: ε = 2.12 ⋅ 105 M-1 см-1, λabsmax =
647 нм, λemmax =
664 нм, квантовый выход
Q = 36%; (в) - dU83: X = -СH2-, ε = 1.95 ⋅ 105 M-1 см-1; λabsmax =
744 нм, λemmax = 767 нм, квантовый выход Q = 27%;
(г) - dU84: X = -(CH2)5NHCOCH2-, ε = 1.99 ⋅ 105 M-1 см-1; λabsmax =
744 нм, λemmax =
767 нм, квантовый выход
Q = 29%.
4 мкМ практически не ингибируют ПЦР, именно
Гибридизационный анализ проводили в двух
эта концентрация была выбрана в качестве рабо-
форматах: 1) три моноплексные ПЦР с последую-
чей в дальнейших экспериментах.
щей мультиплексной гибридизацией и 2) мульти-
плексная ПЦР с тремя парами праймеров и муль-
Для сравнительной оценки аналитической
типлексная гибридизация. Как видно, dU84 де-
чувствительности метода при использовании раз-
монстрирует наиболее четкое распределение и
личных флуоресцентно-меченных трифосфатов
наибольшую интенсивность флуоресцентных
проводили ПЦР с последовательными разведе-
сигналов как в моноплексном, так и в мульти-
ниями ДНК-мишени таким образом, что в реак-
плексном формате ПЦР. В целом интенсивность
ции ПЦР использовали 5, 0.5 и 0.05 нг ДНК. Да-
лее флуоресцентно-меченные продукты ПЦР ги-
флуоресцентных сигналов на биочипе заметно
бридизовали с матрицей олигонуклеотидных
выше для Cy7-dUTP по сравнению с Cy5-dUTP.
зондов, иммобилизованных в гидрогелевых ячей-
Среди производных Cy5-dUTP наиболее четкую
ках биочипа. На рис. 5 представлены результаты
картину наблюдали для dU49 по сравнению с
гибридизационного анализа при количестве ис-
dU2, это различие более заметно при проведении
ходной ДНК мишени 5 нг в одной реакции ПЦР.
ПЦР в мультиплексном формате (рис. 5в).
БИОФИЗИКА том 66
№ 1
2021
ОЦЕНКА ЭФФЕКТИВНОСТИ ГИБРИДИЗАЦИОННОГО АНАЛИЗА
35
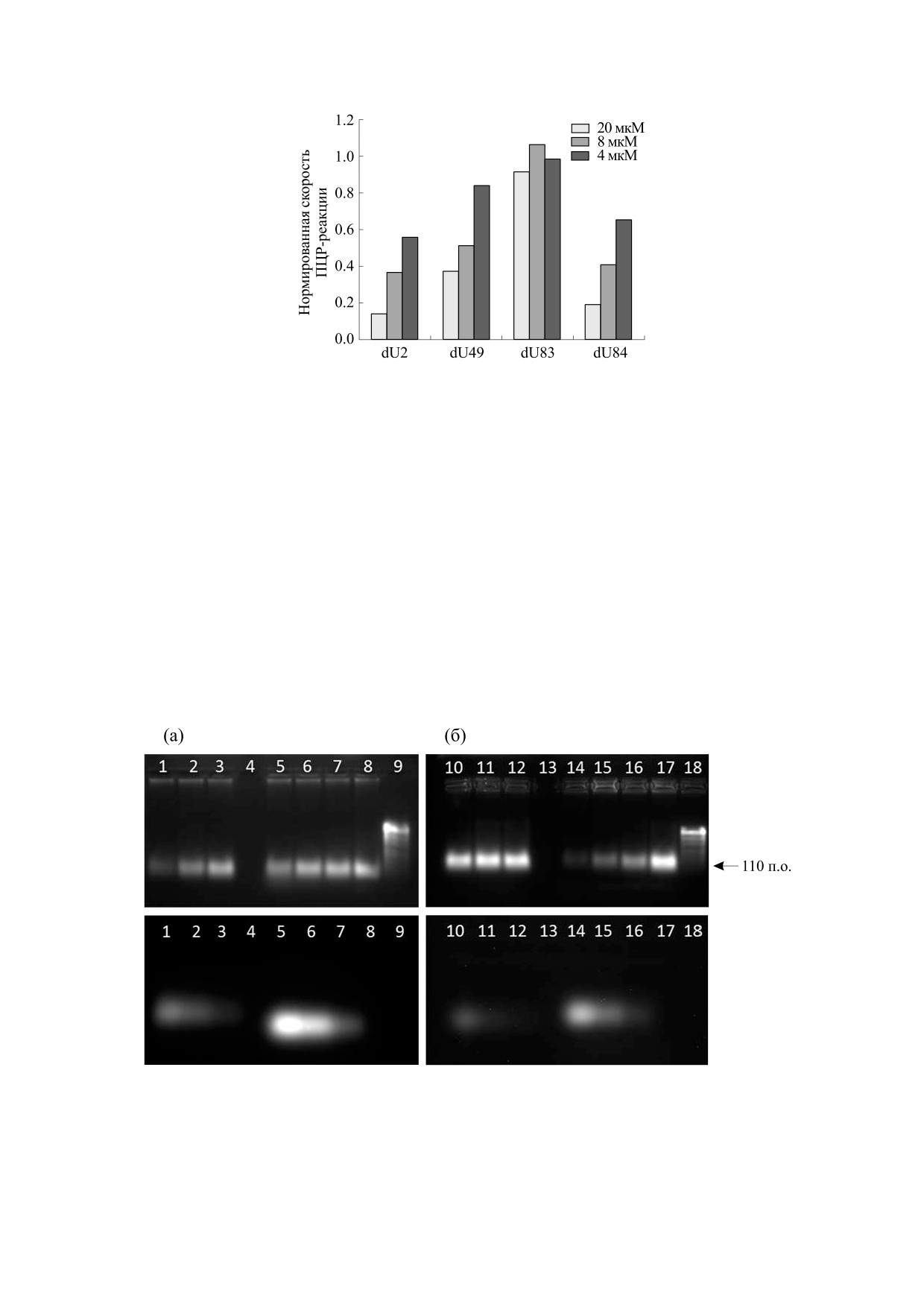
Рис. 2. Ингибирование полимеразной цепной реакции в зависимости от концентрации Cy5- и Cy7-dUTP. По оси ор-
динат - скорость реакции в присутствии Cy-dUTP, нормированная на скорость реакции без добавления модифици-
рованного нуклеотида, по оси абсцисс - различные соединения-аналоги Cy5 и Cy7 в концентрации 20, 8 и 4 мкМ со-
ответственно.
Чувствительность и специфичность гибриди-
водили для наиболее сильно гибридизующегося
зации также зависит от последовательности само-
зонда N3 (рис. 6). В целом интенсивность флуо-
го олигонуклеотидного зонда и вторичной струк-
ресцентных сигналов для Cy7-dUTP существенно
туры участвующего в гибридизации ПЦР-про-
выше по сравнению с Cy5-dUTP. При количестве
дукта. Это приводит к тому, что при уменьшении
исходной ДНК, равном 5 нг, различие между
количества ДНК-мишени наблюдается «выпада-
dU84 и dU2, dU49 составляет около одного по-
ние» сигналов, в первую очередь от тех зондов,
рядка. Интенсивность сигнала при минимальном
которые по ряду причин образуют совершенные
количестве ДНК (0.05 нг) для dU84 достаточно
дуплексы с меньшей температурой плавления.
высока и составляет около 40% от уровня сигнала
Дальнейшие измерения интенсивности флуорес-
центных сигналов для dU2, dU49, dU83 и dU84
при 5 нг ДНК, в то время как для dU2 и dU49 флу-
при различных количествах ДНК-мишени про-
оресцентные сигналы едва превышают фон.
Рис. 3. Электрофореграммы ПЦР-продуктов, полученных в реакции с Cy5-dUTP (а) и Cy7-dUTP (б). Вверху -
детекция по каналу SYBR Green, внизу - по каналу Cy5 (а) и Cy7 (б). Дорожки 1, 2, 3 - dU2, 5, 6, 7 - dU49, 10, 11, 12 -
dU83, 14, 15, 16 - dU84 в концентрациях 20, 8 и 4 мкМ каждый соответственно; 4 и 13 - пустой гель; 8 и 17 - продукт
ПЦР без модифированного нуклеотида; 9 и 18 - маркер длины фрагментов PUC19.
БИОФИЗИКА том 66
№ 1
2021
36
ИКОННИКОВА и др.
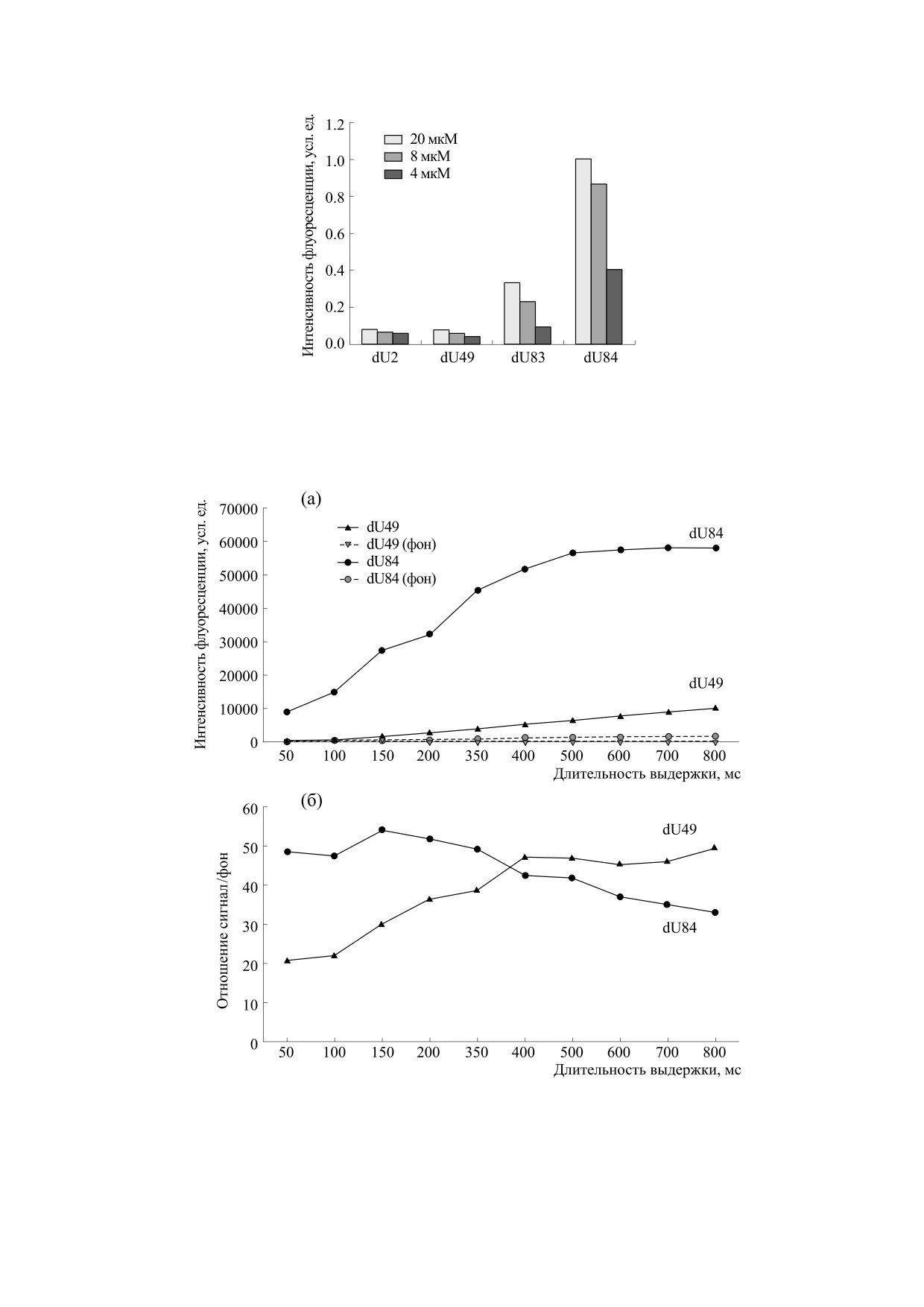
Рис. 4. Результаты количественного определения эффективности встраивания модифицированных нуклеотидов Cy5-
dUTP и Cy7-dUTP. По оси ординат - нормированное значение эффективности встраивания (эффективность встраи-
вания в процентном отношении к максимальному значению для dU2), по оси абсцисс- различные соединения-ана-
логи Cy5 и Cy7 в концентрации 20, 8 и 4 мкМ соответственно.
Более длительное время экспозиции биочипа
общая интенсивность флуоресценции была су-
при регистрации флуоресцентного сигнала при-
щественно ниже, регистрация при всех выдерж-
водит к увеличению интенсивности флуоресцен-
ках от 50 до 800 мс происходила в пределах дина-
ции, однако эта зависимость проявляется по раз-
мического диапазона, поэтому мы наблюдали по-
ному для Cy5- и Cy7-dUTP (рис. 7а). Для dU84
стоянный рост интенсивности флуоресцентных
(Cy7-dUTP) наблюдали быстрый рост флуорес-
сигналов от ячеек с совершенными дуплексами
центных сигналов при выдержках от 50 до 400 мс,
при очень низкой фоновой флуоресценции. Эта
при дальнейших измерениях интенсивность флу-
картина наглядно воспроизводится при опреде-
оресценции достигала максимума и выходила за
лении отношения сигнала от совершенных дуп-
пределы динамического диапазона регистрирую-
лексов к фоновой флуоресценции пустого геля
щего устройства, в то же время фоновая флуорес-
(рис. 7б). При выдержках от 50 до 300 мс это отно-
ценция продолжала расти. Для dU49 (Cy5-dUTP)
шение заметно выше для dU84, при времени экс-
Рис. 5. Результаты гибридизационного анализа при количестве исходной ДНК-мишени 5 нг в реакции ПЦР. (а) -
Схема расположения олигонуклеотидных зондов на биочипе: 0 - пустой гель, N1 - rs4808801 (аллели A и G), N2 -
rs4849887 (аллели С и Т), N3 - rs4973768 (аллели С и Т); серым цветом отмечены ячейки, соответствующие генотипу
данного образца AG/CC/CC. (б) и (в) - Картины гибридизации после ПЦР с добавлением различных Cy-dUTP
(выдержка 300 мс): (б) - моноплексный формат ПЦР (три параллельные реакции с гибридизацией на одном биочипе);
(в) - мультиплексный формат ПЦР (одна реакция с тремя парами праймеров в одной пробирке).
БИОФИЗИКА том 66
№ 1
2021
ОЦЕНКА ЭФФЕКТИВНОСТИ ГИБРИДИЗАЦИОННОГО АНАЛИЗА
37
Рис. 6. Результаты гибридизационного анализа. По оси ординат - интенсивность флуоресцентного сигнала от совер-
шенных дуплексов для олигонуклеотидного зонда N3; по оси абсцисс - различные соединения-аналоги Cy5 и Cy7 при
количестве исходной ДНК-мишени 5, 0.5 и 0.05 нг соответственно (выдержка 300 мс).
Рис. 7. Интенсивность флуоресценции для Cy5-dU49 и Cy7-dU84 в зависимости от длительности выдержки при
регистрации картины гибридизации. По оси ординат: (а) - абсолютные значения интенсивности сигналов от
совершенных дуплексов и ячейки с пустым гелем (фоновая флуоресценция геля), (б) - отношение сигнал/фон; по оси
абсцисс - выдержка при регистрации сигналов в мс.
БИОФИЗИКА том 66
№ 1
2021
38
ИКОННИКОВА и др.
позиции более 400 мс это преимущество утрачи-
нологического комплекса России на
2014-
вается в связи с ограничениями самой системы
2020 годы» (соглашение № 05.604.21.0234, уникаль-
регистрации флуоресценции.
ный идентификатор проекта RFMEFI60419X0234).
Известно, что применение красителей, флуо-
ресцирующих при возбуждении в красной обла-
КОНФЛИКТ ИНТЕРЕСОВ
сти спектра, позволяет повысить чувствитель-
Авторы заявляют об отсутствии конфликта
ность анализов за счет уменьшения интенсивно-
интересов.
сти флуоресценции компонентов исследуемого
объекта, подложки, реагентов для проведения
анализа [6, 7]. В настоящее время в качестве флу-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
оресцентных меток в молекулярно-биологиче-
ских исследованиях, включая исследования, про-
Настоящая работа не содержит описания ис-
водимые с помощью биочипов, широко исполь-
следований с использованием людей и животных
зуют красители, флуоресцирующие в красной
в качестве объектов.
области спектра [20, 21]. Переход к красителям
ближнего инфракрасного диапазона позволяет
СПИСОК ЛИТЕРАТУРЫ
повысить надежность регистрации целевого флу-
оресцентного сигнала на фоне флуоресцирую-
1.
R. T. Ranasinghe and T. Brown, Chem. Commun. 44,
щих примесей [10].
5487 (2005).
2.
M. Dullaert-de Boer, O. W. Akkerman, M. Vermeer,
Ранее при анализе флуоресценции ячеек, со-
et al., PLoS One 13 (1), e0190847 (2018).
держащих растворы красителей Cy5 и Сy7 с раз-
3.
J. L. Ballard, V. K. Peeva, C. J. deSilva, et al., Mol. Bio-
личной концентрацией, было показано, что при
technol. 36 (3), 175 (2007).
одной и той же концентрации краситель Cy7 да-
4.
E. Terpetsching and O. S. Wolfberg, in Near-Infrared
вал более высокую интенсивность флуоресцент-
Dyes for High Technology Applicatios. NATO ASI Series.
ного сигнала по сравнению с красителем Cy5 [18].
Series 3. High Technology (Kluwer Acad. Publ., 1998),
Гибридизационный анализ продуктов ПЦР явля-
vol. 52, p. 161.
ется многоэтапным процессом. Помимо спек-
5.
E. Soini and I. Hemmila. Clin. Chem. 25 (3), 353
тральных характеристик самих красителей на
(1979).
интенсивность флуоресцентных сигналов оказы-
6.
S. Daehne, U. Resch-Genger, and O. S. Wolfberg, in
вают влияние эффективность встраивания моди-
Near-Infrared Dyes for High Technology Applicatios.
фицированных нуклеотидов в анализируемую
NATO ASI Series. Series 3. High Technology (Kluwer
ДНК, количество наработанного продукта при
Acad. Publ., 1998), vol. 52, p. 458.
проведении ПЦР, константа связывания ПЦР-
7.
G. Patonay and M. D. Antoine, Anal. Chem. 63 (6),
продукта с комплементарным зондом и способ-
321a (1991).
ность неспецифически связываться с некомпле-
8.
W. M. Leevy, S. T. Gammon, and J. R. Johnson. Bio-
ментарными зондами и элементами биочипа, а
conj. Chem. 19, 686 (2008).
также характеристики самого регистрирующего
9.
B. A. Smith, W. J. Akers, and W. M. Leevy, Am. Chem.
устройства [19].
Soc. 132 (1), 67 (2010).
По результатам комплексного исследования
10.
A. E. Boyer, M. Lipowska, J.-M. Zen, and G. Patonay.
показано, что Cy7-dUTP обладают рядом пре-
Anal. Lett. 25 (3), 415 (1992).
имуществ по сравнению с Cy5-dUTP в качестве
11.
M. A. Spitsyn, V. E. Kuznetsova, V. E. Shershov, et al.,
флуоресцентной метки при маркировании ДНК
Dyes and Pigments 147, 199 (2017).
для гибридизационного анализа. Более высокая
12.
O. A. Zasedateleva, V. A. Vasiliskov, S. A. Surzhikov,
интенсивность регистрируемых сигналов, высо-
et al., Nucl. Acids Res. 46, е732018 (2018).
кая эффективность встраивания в ходе ПЦР,
13.
Д. О. Фесенко, Т.О. Гусейнов, С.А. Лапа и др., Мо-
меньшее влияние на специфичность взаимодей-
лекуляр. биология 52 (3), 533 (2018).
ствия праймеров с ДНК-мишенью обеспечивают
14.
В. Е. Шеpшов, В. Е. Кузнецова, Ю. П. Лыcов и др.,
более высокую аналитическую чувствительность
Биофизика 60 (6), 1216 (2015).
метода, что дает возможность использовать более
15.
Т. C. Лиcица, В. Е. Шеpшов, М. А. Cпицын и др.,
высокий уровень мультиплексности ПЦР при ис-
Биофизика 62 (3), 464 (2017).
пользовании флуоресцентно-меченных Cy7-
16.
М. А. Спицын, В. Е. Кузнецова, В. Е. Шершов
dUTP по сравнению с Cy5-dUTP.
и др., Биоорган. химия 43 (4), 444 (2017).
17.
В. Е. Шеpшов, А. Ю. Иконникова, В. А. Василис-
ков, С. А. Лапа и др., Биофизика 65 (5), 865 (2020).
ФИНАНСИРОВАНИЕ РАБОТЫ
18. М. А. Спицын, В. Е. Шершов, В. Е. Кузнецова
Работа выполнена при поддержке Федеральной
и др., Молекуляр. биология 49 (5), 760 (2015).
целевой программы «Исследования и разработки по
19. Y. Lysov, V. Barsky, D. Urasov, et al., Biomed. Opt. Ex-
приоритетным направлениям развития научно-тех-
press 8 (11), 4798 (2017).
БИОФИЗИКА том 66
№ 1
2021
ОЦЕНКА ЭФФЕКТИВНОСТИ ГИБРИДИЗАЦИОННОГО АНАЛИЗА
39
20. W. Li, F. Jiangli, Q. Xiaoqiang, et al., Photobiol. A:
21. W. Lee, P. H. von Hippel, and A. H. Marcus, Nucl. Ac-
Chemistry 210, 168 (2010).
ids Res. 42, 5967 (2014).
Evaluation of the Effectiveness of Hybridization Analysis when DNA is Labeled
with Red and Near-Infrared Cyanine Dyes
A.Yu. Ikonnikova, V.E. Shershov, Yu.V. Moroz, V.A. Vasiliskov, S.A. Lapa, R.A. Miftakhov,
V.E. Kuznetsova, A.V. Chudinov, and T.V. Nasedkina
Engelhard Institute of Molecular Biology, Russian Academy of Sciences,
ul. Vavilova 32, Moscow, 119991 Russia
We present a study of the sensitivity of hybridization analysis using a biological microchip when DNA is la-
beled with 2'-deoxyuridine¬-5'-triphosphates derivatives containing cyanine dyes Cy5 and Cy7 used as flu-
orophores. Two Cy5-dUTP and two Cy-7-dUTP dye analogs that can be effectively incorporated into a newly
synthesized DNA strand during PCR were chosen for this study. The PCR products fluorescently labeled
with different dyes were hybridized with a matrix of oligonucleotide probes immobilized within the microchip
hydrogel cells. Fluorescent signals were recorded on a digital fluorescence microscope in the red (for Cy5-
dUTP) and near-infrared (for Cy-7-dUTP) range. The minimum DNA concentration needed for genotypic
studies at the end point of the relationship between the fluorescent-labeled PCR product and oligonucleotide
probes on the biochip was determined using the serial dilution method. It was shown that the fluorescent la-
beled Cy7-dUTP unlike Cy5-dUTP provides greater sensitivity of hybridization analysis.
Keywords: fluorescence, modified nucleotides, cyanine dyes, red range, near-infrared range, biological microarray,
allele-specific hybridization
БИОФИЗИКА том 66
№ 1
2021