БИОФИЗИКА, 2021, том 66, № 1, с. 71-77
БИОФИЗИКА КЛЕТКИ
УДК 577.152.1
РАЗРУШЕНИЕ ЦИТОХРОМА c, НАХОДЯЩЕГОСЯ В КОМПЛЕКСЕ
С КАРДИОЛИПИНОМ, ПРИ ОСУЩЕСТВЛЕНИИ КАТАЛИЗА
ЛИПОПЕРОКСИДАЗНОЙ РЕАКЦИИ
© 2021 г. Л.А. Ромодин*, Ю.А. Владимиров**, ***, ****, *****, Н.П. Лысенко*
*Московская государственная академия ветеринарной медицины и биотехнологии - МВА имени К.И. Скрябина,
109472, Москва, ул. Академика Скрябина, 23
**Институт регенеративной медицины Первого Московского государственного медицинского университета имени
И.М. Сеченова (Сеченовского университета) МЗ РФ, 119991, Москва, ул. Трубецкая, 8/2
***Московский государственный университет имени М. В. Ломоносова, 119991, Москва, Ленинские горы, 1
****Российский национальный исследовательский медицинский университет имени Н.И. Пирогова МЗ РФ,
117997, Москва, ул. Островитянова, 1
*****Институт кристаллографии им. А.В. Шубникова ФНИЦ «Кристаллография и фотоника» РАН,
119333, Москва, Ленинский просп., 59
E-mail: rla2904@mail.ru
Поступила в редакцию 15.06.2020 г.
После доработки 23.06.2020 г.
Принята к публикации 26.06.2020 г.
Изучено разрушения цитохрома c во время катализа им липопероксидазной реакции, обуславлива-
ющей в живых клетках разрушение митохондриальных мембран и выход в цитозоль различных
проапоптотических факторов. С помощью спектрофотометрического анализа показано гораздо бо-
лее интенсивное разрушение цитохрома c при добавлении перекиси водорода в присутствии тетра-
олеилкардиолипина при соотношениях белок : кардиолипин, равных 1 : 30 и 1 : 60 и являющихся
оптимальными для образования комплекса цитохрома c с кардиолипином, в сравнении с пробой, в
которой присутствовали только перекись водорода и цитохром c. Во втором случае разрушение пор-
фиритовой группировки гема принимало вид линейной функции, в то время как в присутствии кар-
диолипина зависимость носила явно экспоненциальный характер, причем при внесении дополни-
тельного липидного субстрата, в роли которого выступала фосфатидная кислота, значение констан-
ты скорости первого порядка разрушения цитохрома c возрастало. Предположено, что быстрое
разрушение цитохрома c при осуществлении им катализа липопероксидазной реакции является
эволюционно развившимся механизмом, направленным на предотвращение самопроизвольного
запуска апоптоза.
Ключевые слова: апоптоз, комплекс цитохрома c с кардиолипином, пероксидаза, спектрофотометрия,
липопероксидазная реакция.
DOI: 10.31857/S0006302921010075
ленной глобулы», англ. «molten globule») при его
Ключевым фактором запуска программы апо-
связывании с кардиолипином [1, 2]. В силу того
птоза (запрограммированной гибели клеток) по
что ЦитC проявляет пероксидазную активность
внутреннему, или митохондриальному, пути яв-
только в определенных условиях (в клетках тако-
ляется разрушение митохондриальных мембран,
вым является его связывание с кардиолипином),
происходящее вследствие липопероксидазной
называть его классической пероксидазой нельзя.
активности цитохрома c (ЦитC) [1]. Пероксидаз-
В обзоре [3] по отношению к нему наряду с гемо-
ная активность у ЦитC появляется благодаря раз-
глобином, цитоглобином, миоглобином и другим
рыву координационной связи между гемовым
белкам со схожими свойствами применяется тер-
железом и остатком метионина в положении 80
мин
«псевдопероксидаза». Однако, на наш
апопротеина и специфическому изменению кон-
взгляд, данный термин не совсем уместен, так как
формации белка (переходу в состояние «расплав-
механизм пероксидазной активности указанных
выше белков в целом схож с таковым для класси-
Сокращения: ЦитC - цитохром c, ФК - фосфатидная кис-
лота, ТОКЛ - тетраолеилкардиолипин, ЦитC-ТОКЛ -
ческих ферментов-пероксидаз, а образующиеся
комплекс цитохрома c с тетраолеилкардиолипином.
продукты реакции взаимодействия фермента с
71
72
РОМОДИН и др.
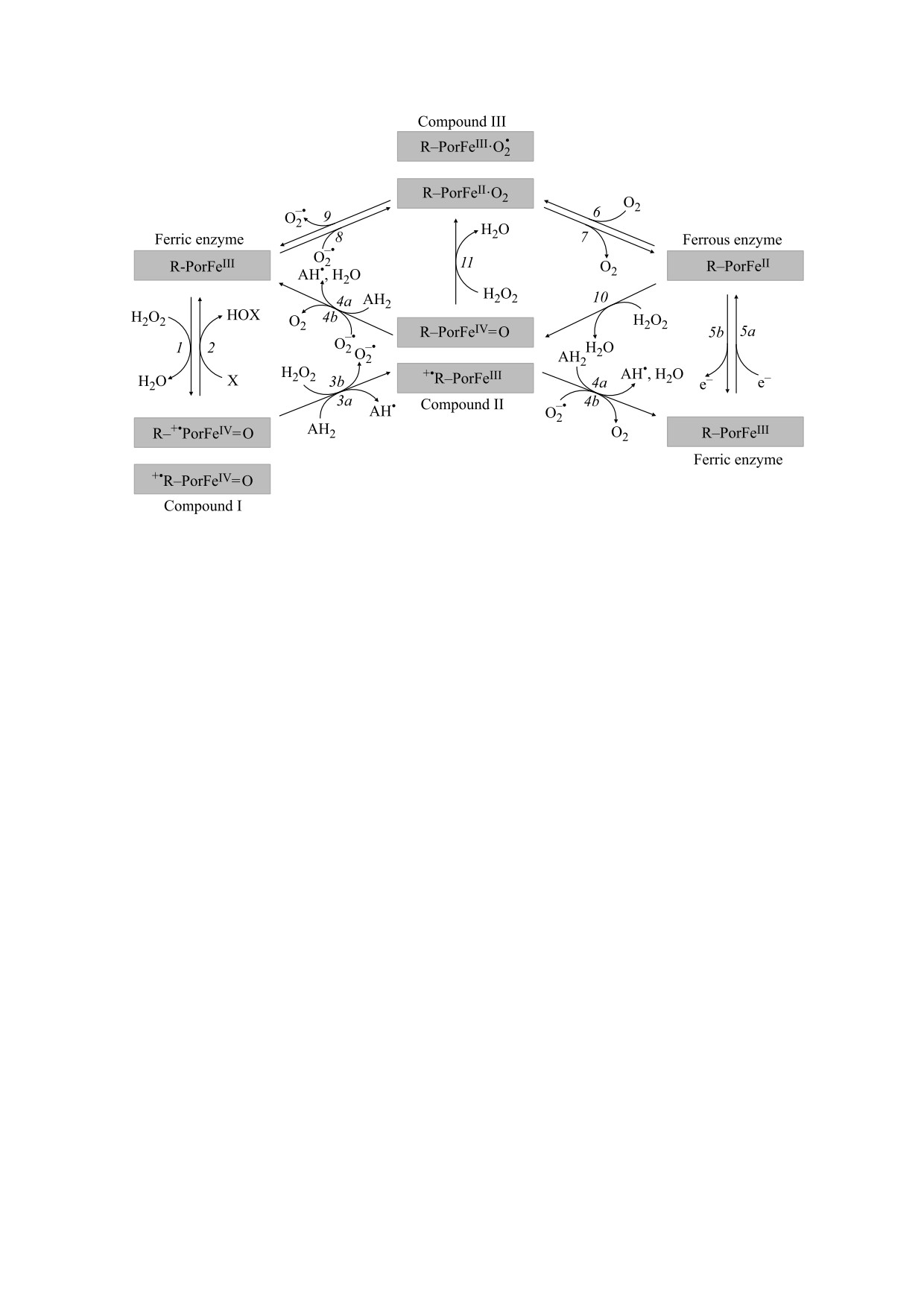
Рис. 1. Общая схема реакций ферментов-пероксидаз. AH2 - липидный субстрат, X - атом галогена [6]. Основными
реакциями считаются реакции 1, 3a и 4a, осуществляющие запуск перекисного окисления липидов [3].
пероксидазой идентичны как для этих белков, так
диолипином и катализирующего пероксидазную
и для классических пероксидаз [4, 5]. А приставка
реакцию. Однако в работе [8] указывается лишь
«псевдо-» скорее означает что-то внешне похо-
на качественный факт разрушения ЦитC без ана-
жее, лишь кажущееся, но не являющееся тако-
лиза кинетики этого процесса. Разрушение ЦитC
вым. Поэтому по отношению к цитохрому c и
при катализе пероксидазной реакции внима-
другим похожим белкам, на наш взгляд, больше
тельным образом исследовалось в работе [9], од-
подходит термин «факультативная пероксидаза».
нако в указанном исследовании соотношение
На рис. 1 приведена схема механизма проявления
ЦитC : кардиолипин при максимальном количе-
белком пероксидазной активности, целиком и
стве кардиолипина составило 1:10, в то время как,
полностью заимствованная из статьи [6]; приве-
согласно данным работы [1], чтобы ЦитC в пол-
денные на ней реакции справедливы как для
ной мере начал проявлять пероксидазную актив-
классических, так и для факультативных перок-
ность, необходимо, чтобы на одну его молекулу
сидаз, в том числе и для комплекса цитохрома c с
приходилось более 20 молекул кардиолипина. В
кардиолипином.
одном из экспериментов, результаты которого
Основными реакциями, способствующими
представлены в работе [9], количество молекул
последующему разрушению мембран митохон-
фосфолипидов на одну молекулу ЦитC все-таки
дрий и, следовательно, ведущими к апоптозу, яв-
равно 20, однако половина из них - это молекулы
ляются реакция 1 и реакции 3a и 4a, приводящие
1,2-диолеил-sn-глицеро-3-фосфохолина, кото-
к образованию липидных радикалов, запускаю-
рые, по данным самих авторов работы [9], сами
щих каскад реакций перекисного окисления ли-
по себе даже в соотношении 20 на 1 молекулу
пидов. Механизмы этих реакций подробно изло-
ЦитC не вызывали никакого увеличения скоро-
жены в работах [3, 6, 7], поэтому не будем здесь на
сти окисления белка в сравнении с пробой, со-
них останавливаться; а в обзоре [3] приводятся
держащей только ЦитC и H2O2. А это в свете дан-
частные отличия между реакциями классических
ных касательно факультативных пероксидаз,
и факультативных пероксидаз, называемых авто-
представленных в обзоре [3], означает, что в том
ром работы [3] псевдопероксидазами. В частно-
случае активация пероксидазных свойств ЦитC
сти, приводятся сведения касательно того, что
не происходила вовсе.
факультативные пероксидазы разрушаются в хо-
де проявления пероксидазной активности. Кроме
Поэтому в настоящей работе мы поставили
того, в работе [8] непосредственно показано раз-
цель изучить разрушение ЦитC, находящегося в
рушение ЦитC, находящегося в комплексе с кар-
комплексе с тетраолеилкардиолипином при со-
БИОФИЗИКА том 66
№ 1
2021
РАЗРУШЕНИЕ ЦИТОХРОМА c
73
отношениях белок : липид, равных 1 : 60 и 1 : 30,
пользованием кювет из кварцевого стекла с дли-
во время катализа им липопероксидазной реак-
ной оптического пути 1 см. Спектры поглощения
ции при внесении в качестве дополнительного
регистрировали в пробе объемом 3 мл в диапазоне
липидного субстрата в некоторые пробы со вто-
300-600 нм, в качестве растворителя использова-
рым соотношением фосфатидной кислоты (ФК).
ли 20 мМ фосфатный буфер с pH 7.4. Концентра-
На наш взгляд, также необходимо обратить
цию ЦитC вычисляли, используя уравнение Бу-
внимание читателя на то, что пероксидазный
гера-Ламберта-Бера, на основании серии спек-
тров поглощения, зарегистрированных по
цикл может проходить и без участия липидного
алгоритму, подробно изложенному в патенте [11].
субстрата, посредством взаимодействия с други-
В опытную пробу мы вносили 100 мкл 100 мкМ
ми молекулами H2O2. К примеру, Compound I
ЦитC, в пробу для формирования комплекса ци-
способен окислить не только молекулу липида,
тохрома c с тетраолеилкардиолипином (ЦитC-
но и H2O2 с образованием супероксидного ани-
ТОКЛ) при соотношении ЦитC : ТОКЛ = 1 : 30
онного радикала (реакция 3b на рис. 1), который
вносили 150 мкл 6 мМ метанольного раствора
Compound II окисляет до кислорода (реакция 4b
ТОКЛ, при соотношении 1 : 60 - 300 мкл, в неко-
на рис. 1). Также Compound II может окислить
торые пробы, содержащие ЦитC-ТОКЛ при со-
еще одну молекулу H2O2 (реакция 11 на рис. 1) с
отношении ЦитC : ТОКЛ = 1 : 30, также вносили
образованием еще одной формы фермента - пе-
150 мкл 12 мМ метанольного раствора ФК. Липо-
роксидазы, называемой Compound III (его не
пероксидазную реакцию мы запускали внесени-
нужно путать с «промежуточным соединением
ем в пробы 300 мкл 2150 мкМ раствора H2O2.
III» из работы [10], так как в ней не установлен его
состав, и под ним может крыться лишь одна из
других форм пероксидазы с окисленным апопро-
РЕЗУЛЬТАТЫ
теином), который, выделяя супероксидный ани-
Нами были зарегистрированы серии спектров
онный радикал, превращается в исходную форму
оптической плотности реакционных смесей следу-
пероксидазы, содержащую трехвалентное железо
ющего состава: 1) 10 мкМ ЦитC, 215 мкМ H2O2 -
(реакция 9 на рис. 1), или же, выделяя кислород, -
эта проба позволяет оценить непосредственное
в форму, содержащую двухвалентное железо (ре-
разрушение ЦитC под действием перекиси водо-
акция 7 на рис. 1). Эта форма по реакции 10,
рода, другие три пробы отражают разрушение это-
идентичной реакции 1 для Ferric-формы, превра-
го белка, являющееся следствием проявления им
щается в Compound II [6]. Все эти реакции нужно
пероксидазной активности; 2) ЦитC-ТОКЛ при
иметь в виду при анализе данных экспериментов
соотношении ЦитC : ТОКЛ = 1 : 30 в присутствии
по изучению свойств комплекса цитохрома c с
215 мкМ H2O2; 3) ЦитC-ТОКЛ при соотношении
кардиолипином, особенно когда липидный суб-
страт в системе трудноокисляем, а перекись водо-
ЦитC : ТОКЛ = 1 : 60 в присутствии 215 мкМ H2O2;
рода находится в высокой концентрации.
4) ЦитC-ТОКЛ при соотношении ЦитC : ТОКЛ =
= 1 : 30 в присутствии 600 мкМ ФК и 215 мкМ
H2O2. Некоторые из зарегистрированных спектров
МАТЕРИАЛЫ И МЕТОДЫ
представлены на рис. 2 и 3. На рис. 2 показаны
В настоящей работе были использованы сле-
спектры поглощения в диапазоне длин волн 300-
дующие реактивы: КH2PO4, 20 мМ буферный
600 нм.
раствор (рН 7.4); пероксид водорода, 8.6 М вод-
На рис. 3 показана область спектра в диапазо-
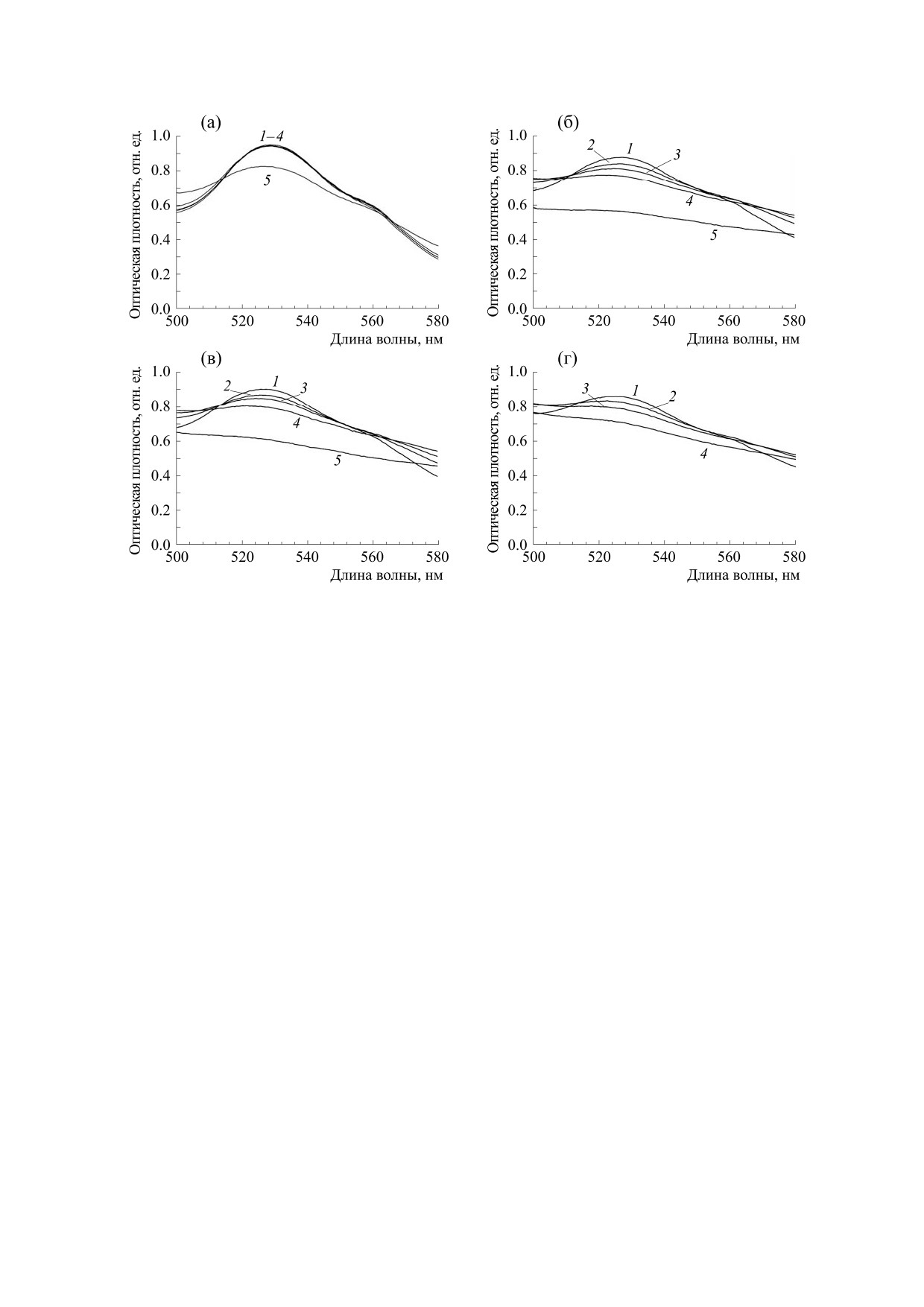
ный раствор (Sigma-Aldrich, США); цитохром с,
не длин волн 500-580 нм, содержащая второй пик
1 мМ раствор, приготовленный из навески необ-
поглощения ЦитC, значение оптической плотно-
ходимой массы (Sigma-Aldrich, США); 1,1',2,2'-
сти в котором значительно меньше, чем в полосе
тетраолеилкардиолипин (ТОКЛ), 6 мМ мета-
Соре. Но тем не менее по этому пику тоже можно
нольный раствор, приготовленный из навески
судить о разрушении ЦитC в процессе реакции.
необходимой массы (Avanti Polar Lipids, США);
Из данных, представленных на рис. 2 и 3, сле-
фосфатидная кислота, 12 мМ метанольный рас-
дует, что ЦитC разрушается при действии пере-
твор, приготовленный из навески необходимой
киси водорода, о чем свидетельствует уменьше-
массы (Avanti Polar Lipids, США).
ние оптической плотности в пиках поглощения,
Растворы указанных выше веществ более низ-
причем это разрушение сильнее в том случае, ко-
ких концентраций приготовляли методом после-
гда в смеси присутствует кардиолипин, связыва-
довательных разведений растворов, указанных в
ние с которым придает ЦитC пероксидазную ак-
списке, кратность последовательных разбавле-
тивность. Сам по себе этот факт был установлен
ний не превышала 10.
ранее, хотя в том исследовании соотношение
Методика эксперимента. Спектрофотометри-
ЦитC : кардиолипин и отличалось от оптималь-
ческие измерения проводили на спектрофото-
ного, способствующего максимальной перокси-
метре Specord 200 (Analytik Jena, Германия) с ис-
дазной активности данного белка [9].
БИОФИЗИКА том 66
№ 1
2021
74
РОМОДИН и др.
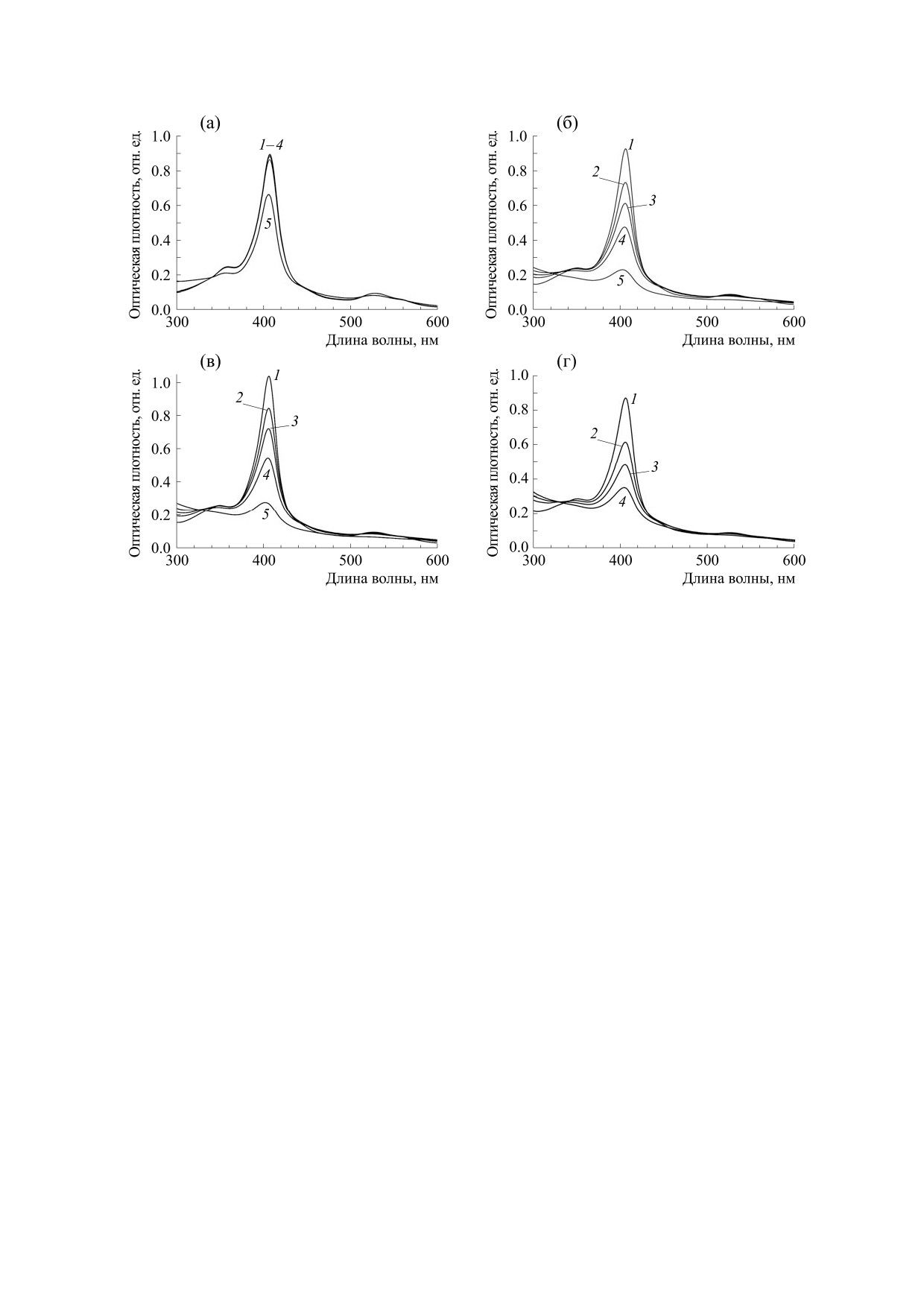
Рис. 2. Спектры поглощения в диапазоне 300-600 нм реакционных смесей: (а) - 10 мкМ ЦитC, 215 мкМ H2O2; (б) -
ЦитC-ТОКЛ при соотношении ЦитC : ТОКЛ = 1 : 30 в присутствии 215 мкМ H2O2; (в) - ЦитC-ТОКЛ при соотношении
ЦитC : ТОКЛ = 1 : 60 в присутствии 215 мкМ H2O2; (г) - ЦитC-ТОКЛ при соотношении ЦитC : ТОКЛ = 1 : 30 в
присутствии 600 мкМ ФК и 215 мкМ H2O2. Спектры зарегистрированы в определенные моменты с начала реакции: 1 -
через 1 мин; 2 - через 3.5 мин; 3 - через 6 мин; 4 - через 12 мин для (а), (б), (г) и через 13 мин для (в); 5 - через 86 мин.
Далее нами с использованием уравнения Буге-
сутствии H2O2 и в отсутствие липида в целом но-
ра-Ламберта-Бера были определены концентра-
сит линейный характер.
ции ЦитC в различные моменты времени от нача-
ла реакции. Так как в изучаемом диапазоне длин
волн (300-600 нм) вкладом в общую оптическую
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
плотность смеси, вносимом ТОКЛ, ФК и H2O2,
Используя данные об уменьшении концентра-
можно пренебречь, то при вычислении концен-
ций ЦитC, мы определили константы скорости
трации ЦитC можно использовать непосред-
реакции первого порядка для его разрушения.
ственно значения оптической плотности смеси.
Рассматривать разрушение ЦитC в качестве реак-
При определении концентрации ЦитC мы ис-
ции первого порядка в данном случае уместно,
пользовали значение оптической плотности на
так как его концентрация более чем на порядок
длине волны, равной 409 нм. Поглощение на этой
ниже концентрации перекиси водорода. Разру-
длине волны обусловлено содержанием в молеку-
шение ЦитC в системе, где к нему добавлена
ле ЦитC порфириновой группировки гема [10].
только перекись водорода (рис. 2а, 3а, 4а), являет-
ся результатом просто действия H2O2 на белок,
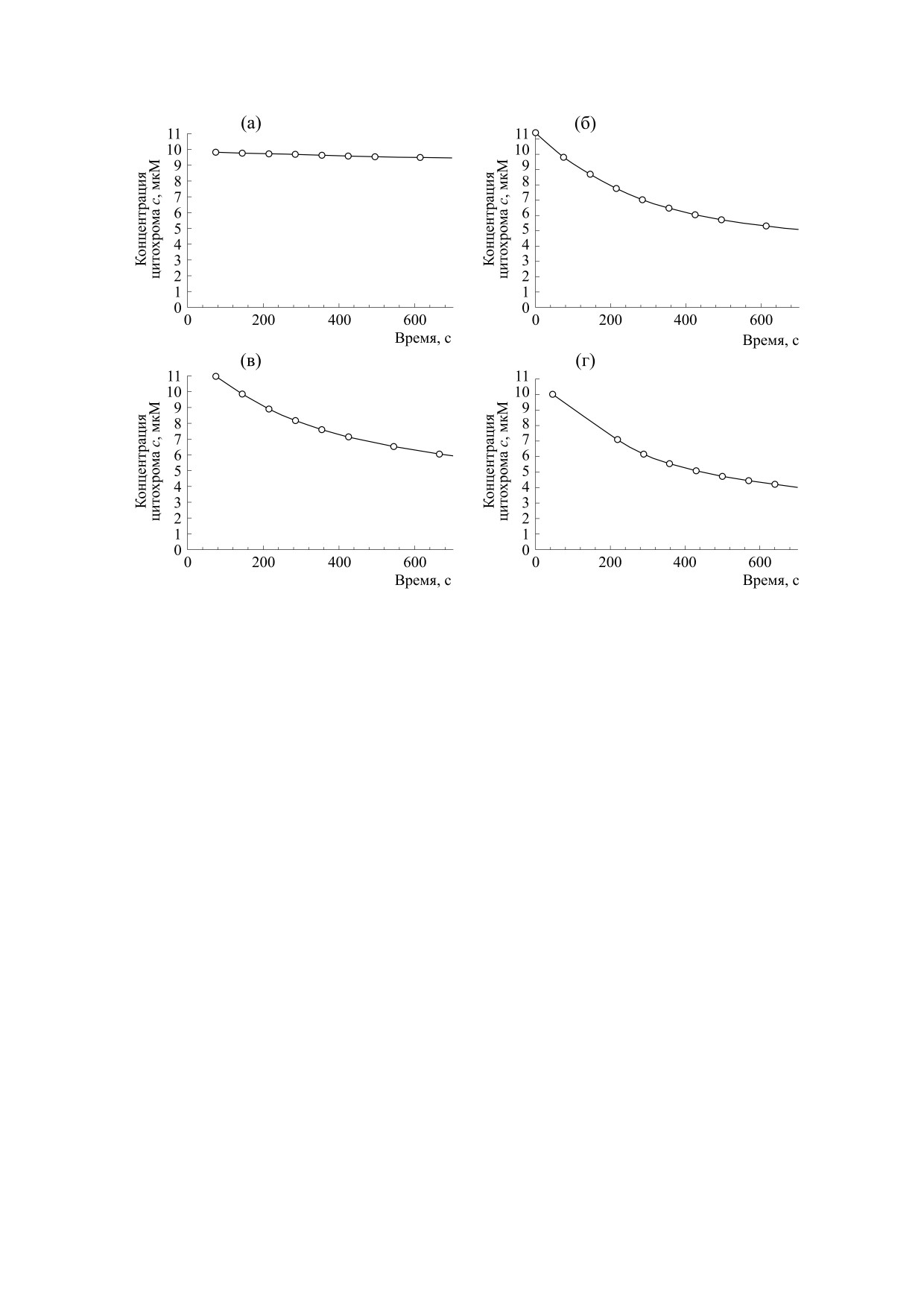
Вычисленные значения концентрации ЦитC
для указанных выше проб представлены на рис. 4.
вернее - на содержащуюся в нем порфириновую
группировку гема. Разрушение же ЦитC в других
Как видно из графиков, представленных на
рассматриваемых случаях - следствие проявле-
рис. 4, разрушение ЦитC, находящегося в составе
ния им пероксидазной активности. Мы предпо-
комплекса ЦитC-ТОКЛ и, следовательно, прояв-
лагаем, что быстрое разрушение ЦитC в этом слу-
ляющего пероксидазную активность, носит ха-
чае, в сравнении с классическими пероксидазами
рактер экспоненциальной функции (рис. 4б-г), в
[3], - это механизм защиты клеток от запуска
то время как функция разрушения ЦитC в при-
программы апоптоза.
БИОФИЗИКА том 66
№ 1
2021
РАЗРУШЕНИЕ ЦИТОХРОМА c
75
Рис. 3. Спектры поглощения в диапазоне 500-580 нм реакционных смесей: (а) - 10 мкМ ЦитC, 215 мкМ H2O2; (б) -
ЦитC-ТОКЛ при соотношении ЦитC : ТОКЛ = 1 : 30 в присутствии 215 мкМ H2O2; (в) - ЦитC-ТОКЛ при
соотношении ЦитC : ТОКЛ = 1 : 60 в присутствии 215 мкМ H2O2; (г) - ЦитC-ТОКЛ при соотношении ЦитC : ТОКЛ =
= 1 : 30 в присутствии 600 мкМ ФК и 215 мкМ H2O2. Спектры зарегистрированы в определенные моменты с начала
реакции: 1 - через 1 мин; 2 - через 3.5 мин; 3 - через 6 мин; 4 - через 12 мин для (а), (б), (г) и через 13 мин для (в); 5 -
через 86 мин.
Однако перед вычислением констант скорости
ляется применительно к данной реакции наибо-
разрушения ЦитC, находящегося в составе ком-
лее верным, равное (52.3 ± 0.4)∙10-11 моль/л∙с.
плекса с ТОКЛ, мы определили ее для разруше-
Относительная ошибка аппроксимации функции
ния свободного ЦитC под действием перекиси
уменьшения концентрации ЦитC в ходе реакции,
водорода. Эту реакцию мы рассмотрели двумя
определенной как реакция нулевого порядка, со-
способами: 1) как реакцию первого порядка;
ставляет всего 0.3%.
2) как реакцию нулевого порядка - в пользу этого
свидетельствует визуальная близость функции
Далее мы определили константы скорости раз-
уменьшения концентрации (рис. 4а) к линейной,
рушения ЦитC, находящегося в составе комплек-
а также то, что применение дифференциального
са с ТОКЛ. Константы скорости реакции разру-
метода Вант-Гоффа дало такое значение: резуль-
шения ЦитC, определенные нами для первых ми-
нут реакции, составляют: для системы ЦитC-
тат округления до единиц углового коэффициен-
ТОКЛ при соотношении белок : липид = 1 : 30
та прямой, построенной в координатной плоско-
сти зависимости натурального логарифма скоро-
при внесении 215 мкМ H2O2 (0.00159 ± 0.00007) с-1,
сти реакции от натурального логарифма
при соотношении 1:60 - (0.00139 ± 0.00007) с-1;
концентрации ЦитC для соответствующих мо-
для системы ЦитC-ТОКЛ при соотношении
ментов времени, равен нулю. Таким образом, мы
ЦитC : ТОКЛ = 1:30 при внесении 600 мкМ лег-
получили значение константы скорости реакции
коокисляемой ФК и 215 мкМ H2O2 (0.00262 ±
первого порядка для разрушения свободного
ЦитC при действии
215 мкМ H2O2, равное
± 0.00162) с-1.
(0.000057 ± 0.000001) с-1, и значение константы
Схожесть значений констант скорости перво-
скорости реакции нулевого порядка, которое яв- го порядка разрушения ЦитC при соотношениях
БИОФИЗИКА том 66
№ 1
2021
76
РОМОДИН и др.
Рис. 4. Уменьшение концентрации ЦитC за первые 700 с реакции в смесях: (а) - 10 мкМ ЦитC, 215 мкМ H2O2; (б) -
ЦитC-ТОКЛ при соотношении ЦитC : ТОКЛ = 1 : 30 в присутствии 215 мкМ H2O2; (в) - ЦитC-ТОКЛ при
соотношении ЦитC : ТОКЛ = 1 : 60 в присутствии 215 мкМ H2O2; (г) - ЦитC-ТОКЛ при соотношении ЦитC : ТОКЛ =
= 1 : 30 в присутствии 600 мкМ ФК и 215 мкМ H2O2.
ЦитC : ТОКЛ 1 : 30 и 1 : 60 позволяет сделать вы-
ВЫВОДЫ
вод о том, что, достигнув оптимальных значений
В ходе изучения процесса разрушения цитохро-
для активации пероксидазных свойств у ЦитC,
ма c, находящегося в комплексе с ТОКЛ в соотно-
соотношение ЦитC : кардиолипин внутри этих
шении, свойственном таковому для наблюдаемого
значений не особо влияет на скорость катализи-
в природе, в ходе катализируемой им липоперок-
руемой ЦитC пероксидазной реакции, о чем
сидазной реакции определены константы скоро-
можно судить по скорости разрушения самого
сти реакции первого порядка этого процесса. Пу-
ЦитC в ходе реакции для первых двух систем. От-
тем сравнения динамики уменьшения концентра-
метим, что в случае, когда в систему не добавлена
ции цитохрома c в ходе катализа им пероксидазной
фосфатидная кислота, по нашему мнению, ско-
реакции с динамикой уменьшения концентрации
рее всего пероксидазный цикл протекает через
свободного цитохрома c, подвергнутого воздей-
реакции 3b, 11, 10, 4b (рис. 1), а не через реакции
ствию H2O2, показано, что разрушение этого белка
3a и 4a, так как остатки олеиновой кислоты, име-
в первом случае гораздо выше и носит выражен-
ющие место в ТОКЛ, должны давать липидные
ный экспоненциальный характер. По нашему
радикалы с большим трудом. Значение же кон-
предположению, быстрое разрушение цитохрома c
станты скорости реакции первого порядка в при-
в ходе катализа им липопероксидазной реакции
сутствии ФК для разрушения ЦитC, находящего-
является эволюционным механизмом защиты кле-
ся в комплексе с ТОКЛ, выше (хотя тут необходи-
ток от разрушения мембран митохондрий и даль-
мо указать на большие пределы погрешностей,
нейшего запуска апоптоза.
поэтому для данной системы целесообразно в бу-
дущем провести более детальное исследование).
ФИНАНСИРОВАНИЕ
В данном случае как раз происходит липоперок-
сидазная реакция, имеющая место в живых мито-
Выполнение экспериментов, результаты кото-
хондриях.
рых представлены в работе, было поддержано
БИОФИЗИКА том 66
№ 1
2021
РАЗРУШЕНИЕ ЦИТОХРОМА c
77
грантом Российского фонда фундаментальных
2. M. Li, A. Mandal, V. A. Tyurin, et al., Structure 27, 806
исследований № 18-015-00491 «Изучение меха-
(2019). DOI: 10.1016/j.str.2019.02.007
низма реакций образования свободных радика-
3. I. I. Vlasova, Molecules 23 (10), 2561 (2018). DOI:
лов в мембранах клеток и митохондрий, катали-
10.3390/molecules23102561
зируемых комплексом цитохрома c с анионными
4. A. Mandal, C. L. Hoop, M. DeLucia, et al., Biophys. J.
липидами (Cyt-AL)».
109, 1873 (2015). DOI: 10.1016/j.bpj.2015.09.016
5. N. A. Belikova, Y. A. Vladimirov, A. N. Osipov, et al.,
Biochemistry 45, 4998 (2006).
КОНФЛИКТ ИНТЕРЕСОВ
6. P. G. Furtmuller, W. Jantschko, M. Zederbauer, et al.,
Все авторы настоящей статьи заявляют, что не
Jpn. J. Infect. Dis. 57, 830 (2004).
имеют конфликта интересов касательно материа-
7. J. N. Rodriguez-Lopez, D. J. Lowe, J. Hernandez-
лов, представленных в работе.
Ruiz, et al., J. Am. Chem. Soc. 123, 11838 (2001).
8. Л. А. Ромодин, С. В. Шангин, Ю. А. Владимиров
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
и др., Изв. Международной академии аграрного
образования, № 42-1, 118 (2018).
Настоящая статья не содержит описания вы-
полненных авторами исследований с участием
9. Ю. А. Владимиров, Е. В. Проскурнина, Д. Ю. Из-
майлов и др., Биохимия 71, 1225 (2006).
людей или использованием животных в качестве
экспериментальных объектов.
10. C. Dallacosta, E. Monzani, and L. Casella, J. Biol. In-
org. Chem. 8, 770 (2003). DOI: 10.1007/s00775-003-
0478-z
СПИСОК ЛИТЕРАТУРЫ
11. Л. А. Ромодин, М. Ф. Трифонова, Н. П. Лысенко и
1. Ю. А. Владимиров, Е. В. Проскурнина и А. В. Алек-
С. А. Бекузарова, Патент РФ № 2720807 (заявл.
сеев, Биохимия 78, 1391 (2013).
04.06.2019, опубл. 13.05.2020).
Destruction of Cytochrome c in Cardiolipin Complex
during Catalysis of Lipid Peroxidation
L.A. Romodin*, Yu.A. Vladimirov**, ***, ****, *****, and N.P. Lysenko*
*Skryabin Moscow State Academy of Veterinary Medicine and Biotechnology,
ul. Akademika Skryabina 23, Moscow, 109472 Russia
**Institute for Regenerative Medicine, Sechenov First Moscow State Medical University (Sechenov University),
Ministry of Health of the Russian Federation, Trubetskaya ul. 8/2, Moscow, 119991 Russia
***Lomonosov Moscow State University, Leninskiye Gory 1, Moscow, 119991 Russia
****Pirogov Russian National Research Medical University, Ministry of Health of the Russian Federation,
ul. Ostrovityanova 1, Moscow, 117997 Russia
*****Shubnikov Institute of Crystallography, Federal Research Center “Crystallography and Photonics”,
Russian Academy of Sciences, Leninsky prosp. 59, Moscow, 119333 Russia
This study explores the changes in cytochrome c catalyzing the lipoperoxidase reaction, thereby causing the
destruction of mitochondrial membranes in living cells and the release of various pro-apoptotic molecules in-
to the cytosol. Spectrophotometric analysis revealed that cytochrome c destroyed much more intensively
when hydrogen peroxide was added in the presence of tetraoleilcardiolipin at the protein/cardiolipin ratios of
1 : 30 and 1 : 60. These ratios are optimum for the formation of the cytochrome c-cardiolipin complex rather
than the sample, which contained only hydrogen peroxide and cytochrome c. At a ratio of 1 : 60, the shape of
the destruction of heme porphyrin group was linear, while data looked exactly exponential after addition of
cardiolipin. Besides, the value of a first order rate constant of destruction of cytochrome c was increased after
applying the lipid substrate. It was a phosphatidic acid. These results suggest that a rapid destruction of cyto-
chrome c during catalysis of lipid peroxidation is the mechanism designed by evolution to prevent the spon-
taneous initiation of apoptosis.
Keywords: apoptosis, cytochrome c-cardiolipin complex, peroxidase, spectrophotometry, lipid peroxidation
БИОФИЗИКА том 66
№ 1
2021