БИОФИЗИКА, 2021, том 66, № 1, с. 84-91
БИОФИЗИКА КЛЕТКИ
УДК 577.322.2
АДСОРБЦИЯ ФИБРИНОГЕНА НА ЛИПИДНОЙ ПОВЕРХНОСТИ
КАК ФАКТОР РЕГУЛЯЦИИ ФИБРИНООБРАЗОВАНИЯ
© 2021 г. Д.А. Файзуллин*, Ю.А. Валиуллина*, В.В. Сальников*, Ю.Ф. Зуев*
*Казанский институт биохимии и биофизики ФИЦ «Казанский научный центр РАН»,
420111, Казань, ул. Лобачевского 2/31
E-mail: dfaizullin@mail.ru
Поступила в редакцию 29.11.2019 г.
После доработки 29.06.2020 г.
Принята к публикации 26.10.2020 г.
Установлено, что ферменты каскада коагуляции взаимодействуют с липидными микрочастицами
или микровезикулами природного или искусственного происхождения, циркулирующими в крови.
Такие взаимодействия могут модулировать гемостаз. Меньше известно о последствиях прямого вза-
имодействия фибриногена/фибрина с микровезикулами. С использованием очищенных систем в
работе показано, что присутствие в растворе липидных частиц различного состава может оказывать
специфическое влияние на кинетику полимеризации фибрина. Представлены экспериментальные
данные, свидетельствующие, что эти эффекты являются следствием адсорбции фибриногена на по-
верхности микровезикул. В частности, показано, что адсорбция фибриногена в достаточно высокой
концентрации приводит к ускорению индуцированной тромбином полимеризации фибрина, бла-
годаря локальному концентрирующему эффекту и включению микровезикул в структуру сгустка.
Таким образом, непосредственное взаимодействие фибриногена с микровезикулами представляет
собой существенный фактор гемостаза, который следует учитывать при анализе нарушения сверты-
вания крови и разработке искусственных липидных носителей лекарственных препаратов.
Ключевые слова: липиды, фибрин, адсорбция, коагуляция.
DOI: 10.31857/S0006302921010099
лено, что микровезикулы крови могут влиять на
Фибриноген является ключевым участником
фибринообразование, структуру и устойчивость
системы гемостаза. Для поддержания коагуляци-
сгустка к лизису благодаря их участию в генера-
онного равновесия значение имеют как концен-
ции активного тромбина и плазмина [1-5]. Вме-
трация фибриногена в крови, так и его актив-
сте с тем имеются данные, что влияние тромбо-
ность. Известно, что одним из компонентов кро-
цитарных микровезикул на строение и свойства
ви, который оказывает существенное влияние на
фибрина не ограничивается тромбин-опосредо-
свертывание крови, являются липиды. Липиды в
ванным кинетическим механизмом, но может
кровотоке представлены в форме липопротеинов
также быть прямым, т.е. за счет их непосред-
высокой и низкой плотности и в виде микровези-
ственного связывания с фибрином в процессе его
кул, которые отшнуровываются от наружной кле-
образования [3, 6-12].
точной мембраны в ходе активации и апоптоза
Помимо естественно циркулирующих в крови
клеток крови и эндотелиоцитов. Микровезикулы
липидных микровезикул, на гемостаз могут вли-
окружены фосфолипидной мембраной и характе-
ять также искусственные липидные частицы,
ризуются размерами приблизительно от
30-
применяемые в качестве носителей лекарств [13-
100 нм (экзосомы) до 1 мкм (клеточные микрове-
15] или заменителей тромбоцитов [16]. Имеются
зикулы) и больше (апоптотические тела и части-
данные, что липосомы из дипальмитоилфосфа-
цы липидных отложений). Основную популяцию
тидилхолина обладают прокоагулянтной актив-
циркулирующих в крови микровезикул образуют
ностью, значительно превышающей активность
тромбоцитарные микровезикулы, выделяемые в
других тромбоцитарных липидов [7].
кровоток при активации тромбоцитов. Установ-
Одной из причин изменения свертывающих
свойств фибриногена может быть его адсорбция
Сокращения: ДПФХ
- 1,2-дипальмитоил-sn-глицеро-3-
на поверхности липидных частиц [17-19], по-
фосфохолин, ПОФГ - 1-пальмитоил-2-олеоил-sn-глице-
ро-3-фосфо-(1'-рац-глицерин), ПОФХ - 1-пальмитоил-2-
скольку вторичная и третичная структура и ори-
олеоил-sn-глицеро-3-фосфохолин.
ентация молекул относительно поверхности вли-
84
АДСОРБЦИЯ ФИБРИНОГЕНА НА ЛИПИДНОЙ ПОВЕРХНОСТИ
85
яют на доступность молекул фибриногена для
пленки: ΔМ = -ΔF/Cf, где ΔF - наблюдаемое из-
тромбина [20-23]. В свою очередь, изменение ди-
менение частоты в Гц; ΔМ - изменение массы на
намики полимеризации фибрина приводит к ва-
единицу площади, в мкг/см2; Cf - коэффициент
риациям его пористости, толщины и разветвлен-
чувствительности кристалла (56.6 Гц ⋅ мкг-1 ⋅ см2).
ности волокон [24], определяющих механиче-
Толщину пленки липида оценивали, используя
скую устойчивость, проницаемость и скорость
значение удельного объема для ДПФХ, равное
лизиса сгустка [25, 26].
0.94 см3/г [27]. Толщина пленок липидов варьи-
В настоящей работе методами турбидиметрии
ровала в пределах 100 ÷ 200 нм. Затем погружали
и инфракрасной спектроскопии, а также микро-
открытую резонаторную ячейку с высушенной
весовым методом изучена адсорбция фибриноге-
пленкой липида в буферный раствор при 60°С в
на на поверхности липидных бислоев из дипаль-
течение 60 мин для гидратации и формирования
митоилфосфатидилхолина и бинарных липидных
однородного слоя [28, 29]. После уравновешива-
смесей и обсуждаются факторы, влияющие на
ния и охлаждения вносили аликвоты стокового
способность фибриногена к свертыванию в этих
раствора фибриногена, последовательно увели-
условиях.
чивая его концентрацию. Измеряли изменение
частоты колебаний, пропорциональное массе
МАТЕРИАЛЫ И МЕТОДЫ
сорбированного фибриногена. Все измерения
проводили в идентичных условиях при темпера-
Фибриноген из плазмы быка (Сalbiochem, Гер-
туре 25°С.
мания) растворяли в воде, после чего переводили в
Кинетику полимеризации фибрина изучали
буфер (20 мМ трис; 150 мМ NaCl, pH 7,4), исполь-
методом турбидиметрии [30]. В кювете спектро-
зуя колонки Zeba 7 kDa (ThermoFisher, USA). Кон-
фотометра Lambda 25 (Perkin-Elmer, США) с тол-
центрацию белка определяли, принимая коэффи-
щиной оптического слоя 1 см смешивали раствор
циент экстинкции равным Е1%280нм = 15,1. Фор-
фибриногена и буферный раствор (контроль) или
мирование сгустка инициировали введением
раствор, содержащий липосомы, в соотношении
тромбина из плазмы быка (Sigma, США).
1 : 1 по объему. Смесь инкубировали в течение
В качестве липидной компоненты использо-
30 мин при температуре 37°C, после чего вносили
вали липосомы, приготовленные из следующих
тромбин. Конечные концентрации фибриногена
фосфолипидов: яичного лецитина (Sigma,
и тромбина составляли 1 мг/мл и 0.26 ед/мл, соот-
США), 1,2-дипальмитоил-sn-глицеро-3-фосфо-
ветственно. Концентрация липидов - 1.0 или
холина (ДПФХ) (Sigma, США), 1-пальмитоил-
0.5 мг/мл. Формирование сгустка регистрирова-
2-олеоил-sn-глицеро-3-фосфо-(1'-рац-глицери-
ли по увеличению оптической плотности образца
на) (ПОФГ) и 1-пальмитоил-2-олеоил-sn-гли-
на длине волны 350 нм. Максимальную скорость
церо-3-фосфохолина (ПОФХ) (Avanti, США).
роста рассеяния и длительность лаг-периода
Навески липидов растворяли в хлороформе, вы-
определяли по графику первой производной от
паривали под вакуумом и разводили в буфере.
турбидиметрической кривой.
Суспензию кефалина («Технология-стандарт»,
Инфракрасные спектры регистрировали на
Россия) готовили в соответствии с рекоменда-
спектрофотометре IR Affinity1 (Shimadzu, Япо-
циями изготовителя. Полученные грубые ли-
ния) на приставке нарушенного полного внут-
пидные дисперсии подвергали нескольким цик-
реннего отражения с кристаллом ZnSe в качестве
лам замораживания при температуре жидкого
измерительного элемента. Спектральное разре-
азота и оттаивания при 55°С. Липосомы получа-
шение 8 см-1, число накоплений 512. Суспензии
ли методом экструзии через поликарбонатные
свободных липосом и липосом с фибриногеном
фильтры с размером пор 100 нм (Avanti, США)
пропускали через проточную микрокювету,
при 55°С.
смонтированную на кристалле приставки нару-
Измерение сорбции фибриногена на пленках
шенного полного внутреннего отражения. Ад-
липидов проводили с помощью кварцевых мик-
сорбцию липосом на поверхности измерительно-
ровесов QCM-200 (Stanford Research Systems,
го элемента регистрировали по росту интенсив-
США). Использовали кварцевые резонаторы на
ности полосы поглощения эфирных карбонилов
5 МГц с золотым покрытием. Исследуемые рас-
1730 см-1 до завершения кинетики. Неадсорбиро-
творы липидов (1 мг/мл) в смеси хлороформ/эта-
ванные липосомы удаляли, пропуская раствор
нол (95 : 5 по объему) наносили на поверхность
буфера. Кювету термостатировали при 37°С.
электрода кварцевого резонатора и сушили при
комнатной температуре. Полноту удаления рас-
Для сканирующей электронной микроскопии
творителей контролировали по постоянству ча-
на поверхность металлического (золотого) элек-
стоты колебания резонатора. По изменению ча-
трода кварцевого резонатора наносили раствор
стоты колебаний резонатора до и после нанесе-
фибриногена, инкубировали при 37°С в течение
ния вещества судили о массе образовавшейся
1 часа, ополаскивали буфером и наносили рас-
БИОФИЗИКА том 66
№ 1
2021
86
ФАЙЗУЛЛИН и др.
добавления тромбина. В течение этого времени,
называемого лаг-периодом, происходит образо-
вание и рост коротких двухтяжевых протофиб-
рилл. По достижении критического размера про-
тофибрилл начинается быстрый рост рассеяния,
обусловленный латеральной агрегацией прото-
фибрилл и формированием относительно тол-
стых многотяжевых нитей фибрина. От толщины
нитей фибрина и пористости сгустка зависит уро-
вень рассеяния на плато после завершения фор-
мирования фибрина [24]. Присутствие липидных
частиц вызывает ряд эффектов в зависимости от
химической природы липида (табл. 1). Наиболее
выраженное воздействие оказывает ДПФХ: по
сравнению с контролем наблюдается сокращение
лаг-периода до нуля, некоторое увеличение на-
чальной скорости и линейный рост рассеяния
вместо выхода на плато после завершения поли-
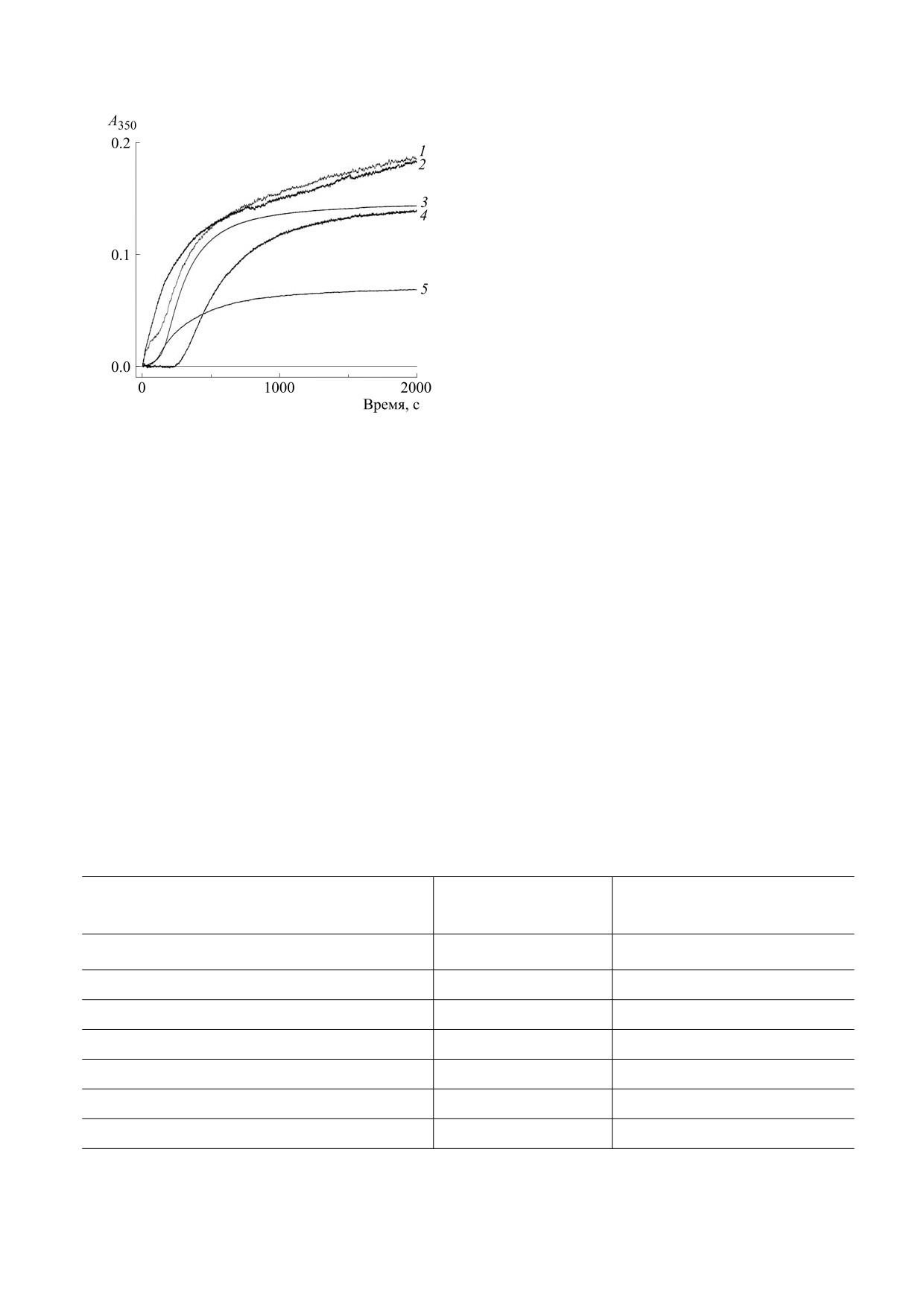
Рис. 1. Кинетика полимеризации фибриногена в сус-
меризации (кривая 1). Двукратное уменьшение
пензии липосом. Номера на кривых соответствуют: 1,
концентрации липида усложняет зависимость:
2 - ДПФХ, 3 - контроль без липида, 4 - ДПФХ +
+ 20%ПОФХ, 5 - ДПФХ + 20%ПОФГ; 1, 4-5 - кон-
наблюдается как начальный резкий рост рассея-
центрация липида 1 мг/мл, 2 - 0.5 мг/мл. Концентра-
ния, так и сокращенный по длительности участок
ция фибриногена 1 мг/мл.
лаг-периода (кривая 2). Добавление 20% ПОФГ в
липосомы из ДПФХ существенно нивелирует
воздействие последнего: увеличивается длитель-
твор тромбина. Через 1 ч поверхность ополаски-
ность лаг-периода и уменьшается начальная ско-
вали буфером и водой и высушивали на воздухе.
рость, при этом существенно понижается уровень
Образующиеся структуры исследовали без пред-
варительной металлизации на сканирующем
плато (кривая 5). Влияние таких липидов, как
микроскопе Merlin (Carl Zeiss, Германия) в Меж-
яичный лецитин и кефалин, минимально и за-
дисциплинарном центре «Аналитическая микро-
ключается в небольших вариациях длительности
скопия» КФУ (Казань).
лаг-периода и начальной скорости роста рассея-
ния (зависимости не приводятся). В смеси
«ДПФХ + 20% ПОФХ» наблюдается существен-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ное удлинение лаг-периода и уменьшение на-
чальной скорости (кривая 4). Таким образом,
Кинетика фибринообразования, отслеживае-
мая по росту светорассеяния в буфере и в суспен-
присутствие липидных частиц влияет на все ос-
зии липосом, приведена на рис. 1. На контроль-
новные параметры кинетической кривой. Резуль-
ной кривой без липидов (кривая 3 на рис. 1) рост
татом является образование фибринового сгуст-
рассеяния происходит с задержкой от момента
ка, морфологические характеристики которого
Таблица 1. Параметры кинетики фибринообразования в суспензиях липидов
Липид
Длительность
Максимальная скорость роста
лаг-периода, с
светорассеяния, с-1
Контроль без липида, фибриноген 1 мг/мл
55 ± 8
6.35e-4 ± 0.2
ДПФХ 1 мг/мл, фибриноген 1 мг/мл
0
6.95e-4 ± 0.4
ДПФХ 0,5 мг/мл, фибриноген 1 мг/мл
0
4.22e-4 ± 0.4
ДПФХ / 20% ПОФХ, фибриноген 1 мг/мл
207 ±2 0
2.91e-4 ± 0.6
ДПФХ / 20% ПОФГ, фибриноген 1 мг/мл
82 ± 17
2.20e-4 ± 0.2
Яичный лецитин, фибриноген 1 мг/мл
61 ± 8
5.98e-4 ± 0.2
Кефалин, фибриноген 1 мг/мл
59 ± 6
БИОФИЗИКА том 66
№ 1
2021
АДСОРБЦИЯ ФИБРИНОГЕНА НА ЛИПИДНОЙ ПОВЕРХНОСТИ
87
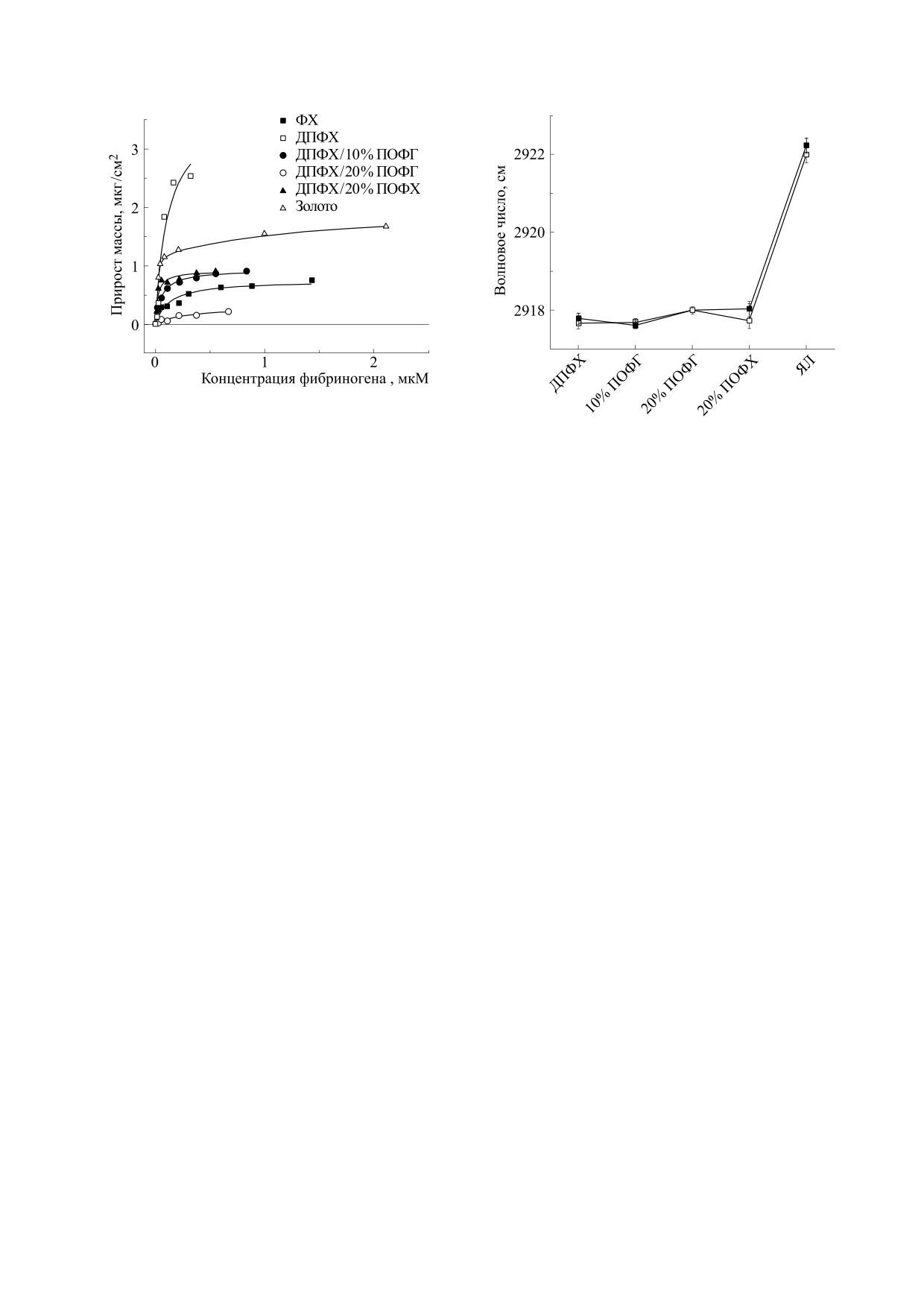
Рис. 2. Изотермы адсорбции фибриногена на иммо-
билизованных липидных бислоях и поверхности зо-
лотого электрода. Обозначения экспериментальных
Рис. 3. Положение максимума полосы метиленовых
точек указаны на легенде. Зависимости аппроксими-
групп липида в контроле (темные символы) и при
рованы моделью Ленгмюра (сплошные линии).
адсорбции фибриногена (светлые символы).
видоизменяются в зависимости от химической
увеличение подвижности алифатических групп.
структуры липидных частиц [3, 6].
Аналогичный эффект оказывает добавление 20%
ПОФХ, нейтрального по заряду. Максимальную
Одной из возможных причин указанных явле-
подвижность имеют гетерогенные по структуре
ний может быть адсорбция молекул фибриногена
жирнокислотные цепи яичного лецитина. При-
на поверхности липидных микрочастиц. Изобра-
сутствие фибриногена не оказывает достоверного
женные на рис. 2 изотермы сорбции фибриногена
влияния на упорядоченность гидрофобной части
на плоских иммобилизованных липидных бисло-
бислоя, из чего можно заключить, что фибрино-
ях свидетельствуют, что фибриноген способен
ген не проникает глубоко в структуру бислоя, ад-
адсорбироваться на липидной поверхности, при-
сорбируясь на его внешней поверхности.
чем константа и предельная величина адсорбции
зависят от химической структуры липида
Состояние полярной области бислоя оценива-
(табл. 1). Максимальную адсорбирующую спо-
ли по спектрам фосфатных групп липидов. Поло-
собность по отношению к фибриногену имеет
са асимметричных валентных колебаний νasPO2-
бислой из ДПФХ - незаряженного липида с пол-
имеет двухкомпонентную структуру, образуемую
ностью насыщенными жирнокислотными остат-
расщеплением основного колебания при образо-
ками. Добавление к ДПФХ липидов, содержащих
вании водородной связи [32-34]. Величина рас-
ненасыщенные жирнокислотные цепи или несу-
щепления зависит от силы водородной связи с
щих отрицательный заряд, снижает сродство к
окружением и для исследованных нами липидов
фибриногену.
определяется преимущественно гидратированно-
Взаимодействие фибриногена с липидным
стью фосфатной группы. Мы сопоставили вели-
бислоем оценивали также на основании анализа
чины предельной адсорбции фибриногена с ин-
инфракрасных спектров. Известно, что частота
тенсивностью расщепления фосфатной полосы
колебаний метиленовых групп имеет более низ-
(рис. 4). Данные свидетельствуют, что фибрино-
кое значение в бислоях с более упорядоченной
ген проявляет меньшее сродство к липидам, у ко-
структурой гидрофобного слоя [31]. Из данных на
торых расщепление и, следовательно, гидратиро-
рис. 3 следует, что в бислое из ДПФХ валентное
ванность больше. Таким образом, гидратирован-
колебание метиленовых групп имеет частоту
ность поверхности препятствует адсорбции.
2917.7 ± 0.1 см-1, что соответствует высокоупоря-
Ранее уже отмечалось, что низкое сродство фиб-
доченному состоянию жирнокислотных цепей.
риногена к липидам с ненасыщенными жирно-
Добавление к ДПФХ 10% ПОФГ - отрицательно
кислотными остатками, в частности к яичному
заряженного липида с одной ненасыщенной це-
лецитину, может быть следствием высокой по-
пью - практически не сказывается на упорядо-
движности липидных молекул в бислое и гидра-
ченности углеводородной части бислоя. Увеличе-
тированности их полярных частей [35]. Известно,
ние содержания ПОФГ до 20% приводит уже к за-
что при температурах выше точки плавления ли-
метному росту частоты, что указывает на
пидных структур одновременно с увеличением
БИОФИЗИКА том 66
№ 1
2021
88
ФАЙЗУЛЛИН и др.
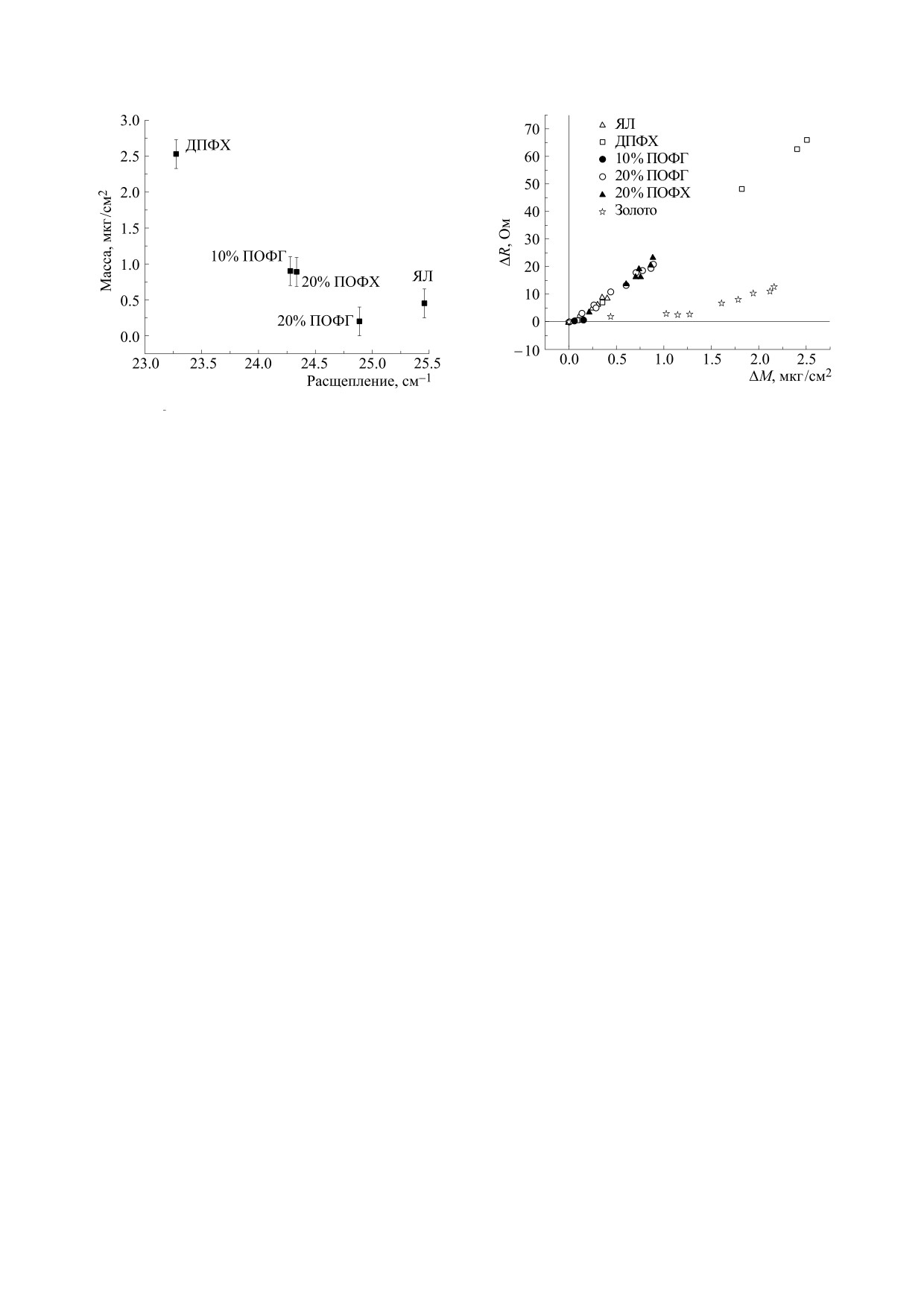
Рис. 5. Корреляции между приростом коэффициента
потерь ΔR и массы ΔМ при адсорбции фибриногена
Рис. 4. Соотношение между величиной предельной
на иммобилизованных липидных бислоях. Обозначе-
адсорбции и величиной расщепления компонент по-
ния экспериментальных точек указаны на легенде.
лосы поглощения νasPO2- фосфатной группы ли-
пида.
По достижении определенного уровня адсорб-
ции, соответствующей выходу изотермы адсорб-
подвижности возрастает и гидратация [36]. Из ис-
ции на более пологий участок, зависимость по-
пользованного набора липидов только ДПФХ
терь от массы адсорбированного белка усилива-
при температуре 37°С находится в высокоупоря-
ется, что указывает на формирование более
доченном гелевом состоянии. Добавление к бис-
рыхлого и гидратированного слоя [38]. Каче-
лою из ДПФХ липидов, содержащих ненасыщен-
ственно сходный вид имеют и зависимости, полу-
ные жирнокислотные цепи, приводит к пониже-
ченные при адсорбции на бислоях липидов, с тем
нию температуры плавления, так что при 37°С
отличием, что начальный пологий участок имеет
бислой находится в более подвижной жидкокри-
небольшую протяженность, а основная масса
сталлической конформации. Фибриноген интен-
белка образует адсорбционный слой с высоким
сивно адсорбируется на наименее гидратирован-
коэффициентом потерь, более рыхлый и вязкий
ной поверхности жесткого бислоя из ДПФХ. В то
по сравнению с адсорбцией на металле. Очевид-
же время наименьшим сродством фибриноген
но, что в рыхлом слое молекулы фибриногена бо-
обладает к высокогидратированной поверхности
лее подвижны и доступны растворителю, что де-
рыхлого и подвижного бислоя яичного лецитина.
лает их также более доступными и действию
Таким образом, различия в сорбционной способ-
тромбина. О том, что адсорбированный в виде
ности изученных нами липидных бислоев по от-
рыхлого слоя фибриноген сохраняет способность
ношению к фибриногену в значительной мере
к полимеризации, свидетельствуют результаты
определяются их гидратированностью.
исследования методом атомно-силовой микро-
скопии поверхности адсорбированного фибри-
Определенные выводы о структуре адсорбци-
ногена на металле после действия тромбина. При
онных слоев фибриногена можно сделать, сопо-
адсорбции из раствора с очень низкой концен-
ставляя их механические (вязкоупругие) свойства
трацией белка (0.01 мкМ), соответствующей на-
с интенсивностью адсорбции. На рис. 5 приведе-
чальному крутому участку изотермы адсорбции,
ны величины коэффициента потерь при возбуж-
образуется плотный слой фибриногена, не поли-
дении радиочастотных колебаний резонатора с
меризующийся под действием тромбина. В то же
нанесенной на его поверхность липидной плен-
время фибриноген, адсорбированный из раство-
кой в зависимости от массы адсорбированного
ра с концентрацией 3 мкМ и образующий более
фибриногена. При адсорбции фибриногена не-
толстые и рыхлые слои, под действием тромбина
посредственно на металлической поверхности
превращается в фибрин, формируя длинные во-
резонатора коэффициент потерь, соответствую-
локна (рис. 6). Сходство вязкоупругих характери-
щий начальному крутому участку изотермы (см.
стик фибриногена, адсорбированного на золоте и
рис. 2), имеет небольшую величину и слабо зави-
на липидном бислое, позволяет предполагать
сит от массы, что характерно для плотных адсорб-
структурное сходство адсорбционных слоев и со-
ционных слоев, прочно связанных с поверхно-
хранение коагуляционной способности фибри-
стью [37].
ногена при адсорбции на липидной поверхности.
БИОФИЗИКА том 66
№ 1
2021
АДСОРБЦИЯ ФИБРИНОГЕНА НА ЛИПИДНОЙ ПОВЕРХНОСТИ
89
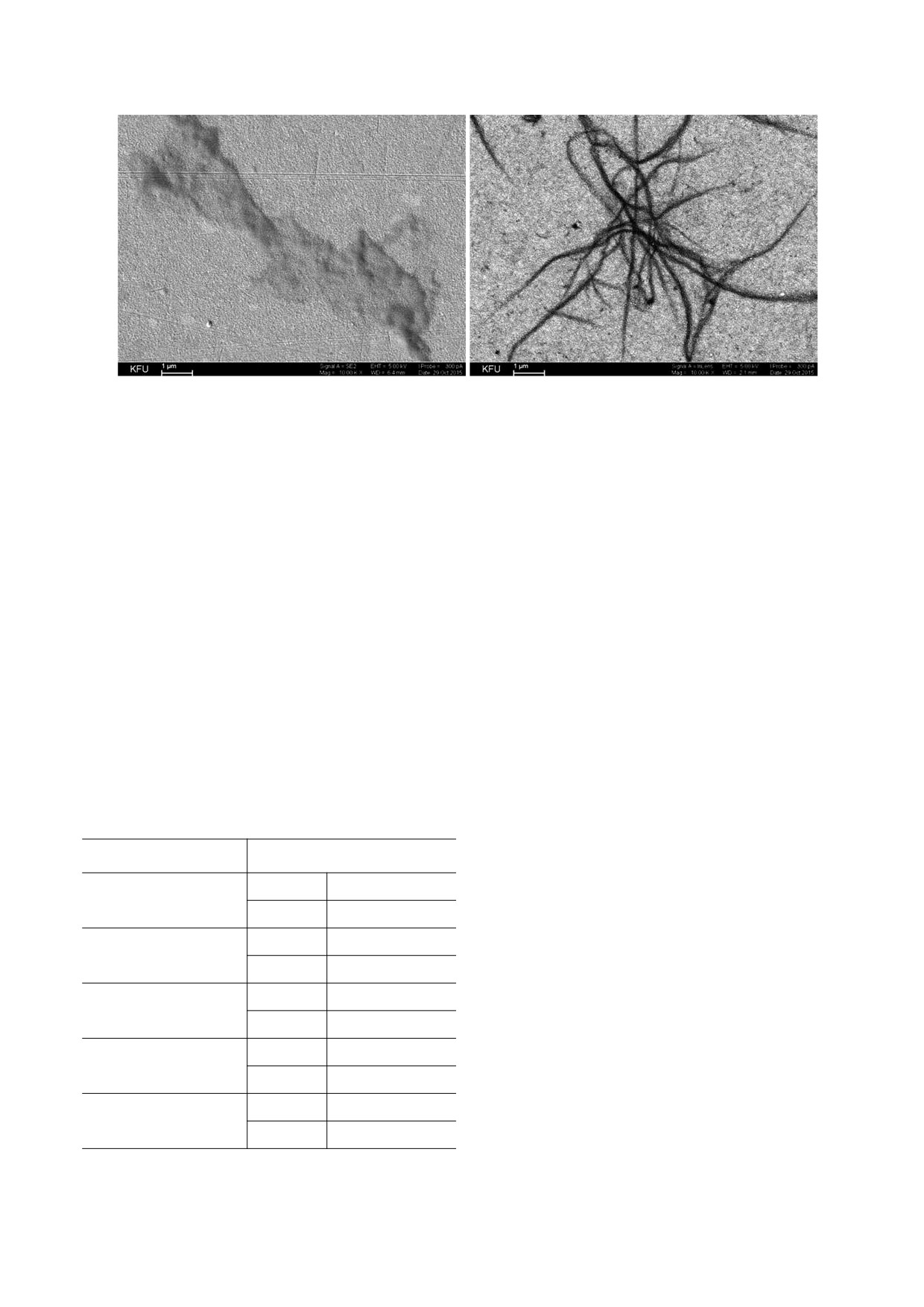
Рис. 6. Поверхность металлического золота после адсорбции фибриногена из раствора с концентрацией белка
4 мкг/мл (слева) и 1 мг/мл (справа) и обработки его тромбином. Изображение получено методом сканирующей элек-
тронной микроскопии.
Степень влияния адсорбированного фибриноге-
длительности лаг-периода и более медленного
на на формирование структуры объемного сгуст-
образования пространственной сети на примере
ка, таким образом, зависит от доли адсорбиро-
липосом из ДПФХ / 20% ПОФХ (рис.
1,
ванного белка и в нашем случае максимальна для
кривая 4).
липосом из ДПФХ. Наличие прочно связанного с
Довольно специфичной выглядит кинетика
поверхностью фибриногена способствует удер-
фибринообразования в суспензии с добавкой от-
жанию и включению липидных частиц в состав
рицательно заряженного ПОФГ (рис.
1,
фибриновой сети [2, 6].
кривая 5). Низкий уровень рассеяния на плато
Другим очевидным фактором, влияющим на
обусловлен образованием более тонких фибрилл
пространственную структуру сгустка, является
[6]. По-видимому, электростатические взаимо-
само присутствие в растворе объемных липидных
действия одноименно заряженных фибриногена
частиц в достаточно высокой концентрации.
и ПОФГ в объеме раствора также играют роль,
модифицируя процесс фибриллообразования
При низкой доле адсорбированного фибриноге-
на эффекты пространственного ограничения
[39], однако конкретный механизм такого взаи-
модействия пока неясен и требует дальнейшего
на диффузию и фибриллообразование начинают
изучения.
преобладать, что проявляется в виде увеличения
ВЫВОДЫ
Таблица 2. Параметры аппроксимации сорбционных
зависимостей моделью Ленгмюра (y = (kxA) / (1 + kx))
Основываясь на полученных результатах,
Липид
Значение
можно заключить, что особенности кинетики по-
лимеризации фибриногена в суспензии липосом
A
0.75 ± 0.06
Яичный лецитин
могут быть в значительной мере обусловлены ре-
k
7.77 ± 2.33
активностью белка, адсорбированного на поверх-
ности липосом. Адсорбция максимальна на по-
A
3.73 ± 0.82
верхности бислоя из ДПФХ и уменьшается при
ДПФХ
k
8.64 ± 4.61
добавлении липидов с ненасыщенными жирно-
кислотными остатками или несущих отрицатель-
A
0.93 ± 0.03
ный заряд, что связано с ростом гидратированно-
ДПФХ/10%ПОФГ
сти поверхности. Фибриноген адсорбируется в
k
17.63 ± 2.70
виде рыхлого гидратированного слоя, сохраняя
A
0.30 ± 0.07
способность к коагуляции под действием тром-
ДПФХ/20%ПОФГ
бина. Участие адсорбированного фибриногена в
k
3.48 ± 1.72
коагуляции проявляется в сокращении лаг-пери-
A
0.91 ± 0.06
ода и увеличении скорости фибринообразования,
ДПФХ/20%ПОФХ
что позволяет охарактеризовать такой белок, как
k
45.22 ± 14.26
более тромбогенный.
БИОФИЗИКА том 66
№ 1
2021
90
ФАЙЗУЛЛИН и др.
БЛАГОДАРНОСТИ
17. Yu. F. Zuev, R. I. Litvinov, A. E. Sitnitsky, et al., J.
Phys. Chem. B 121, 7833 (2017).
Исследования с применением сканирующей
электронной микроскопии выполнены в Меж-
18. T. Ueda, D. Murakami, and M. Tanaka, Front. Chem.
дисциплинарном центре «Аналитическая микро-
6, 542 (2018).
скопия» Казанского федерального университета
(Казань).
19. K. Sankaranarayanan, Biointerphases
10,
021009
(2015).
ФИНАНСИРОВАНИЕ РАБОТЫ
20. B. C. Cook and G. S. Retzinger, J. Colloid Interface
Sci. 162 (1), 171 (1994).
Работа выполнена в рамках государственного
задания ФИЦ КазНЦ РАН.
21. G. S. Retzinger, B. C. Cook, A. P. DeAnglis, J. Colloid
Interface Sci. 168, 514 (1994).
КОНФЛИКТ ИНТЕРЕСОВ
22. Z. Adamczyk, J. Barbasz, and M. Cieśla, Langmuir 27,
6868 (2011).
Авторы заявляют об отсутствии конфликта
интересов.
23. L. Zhang, B. Casey, D. K. Galanakis, et al., Acta Bio-
mater. 54, 164 (2017).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
24. J. W. Weisel and C. Nagaswami, Biophys. J. 63, 111
Настоящая работа не содержит описания ис-
(1992).
следований с использованием людей и животных
25. T. Sugo, H. Endo, M. Matsuda, et al., J. Thromb. Hae-
в качестве объектов.
most. 4, 1738 (2006).
26. J. W. Weisel and R. I. Litvinov, Cardiovasc. Hematol.
СПИСОК ЛИТЕРАТУРЫ
Agents Med. Chem. 6, 161 (2008).
1. R. M. Nabiullina, D. A. Faizullin, C. Nagaswami,
et al., Blood 124, 2807 (2014).
27. A. I. Greenwood, S. Tristram-Nagle, and J. F. Nagle,
Chem. Phys. Lipid. 143(1-2), 1 (2006).
2. Р. М. Набиуллина, И. Г. Мустафин, Ю. Ф. Зуеви
др., Докл. РАН 562 (1), 111 (2015).
28. Y. Okahata and H. Ebato, Anal. Chem. 63, 203 (1991).
3. L. D. Zubairova, R. M. Nabiullina, C. Nagaswami,
et al., Sci. Rep. 5, 1 (2015).
29. S. R. Tabaei, J.-H. Choi, G. H. Zan, et al., Langmuir
30(34), 10363 (2014).
4. M. T. Cunningham, B. A. Citron, and T. A. Koerner,
Thrombosis Res. 95, 325 (1999).
30. R. R. Hantgan and J. Hermans, J. Biol. Chem. 254,
5. B. Váradi, K. Kolev, K. Tenekedjiev, et al., J. Biol.
11272 (1979).
Chem. 279, 39863 (2004).
31. P. T. T. Wong, D. J. Siminovitch, and H. H. Mantsch,
6. Д. Р. Бакирова, Д. А. Файзуллин, Ю. А. Валиулли-
Biochim. Biophys. Acta 947, 139 (1988).
на и др., Бюлл. эксперим. биологии и медицины
163 (6), 687 (2017).
32. F. M. Goñi and J. L. Arrondo, Faraday Discuss. Chem.
7. A. M. Galán, M. R. Hernández, J. Bozzo, et al., Trans-
Soc. 81, 117 (1986).
fusion 38 (11-12), 1004 (1998).
33. T. Shimanouchi, M. Sasaki, A. Hiroiwa, et al., Colloids
8. B. Alving, Transfusion 38 (11-12), 997 (1998).
Surf. B: Biointerfaces 88, 221 (2011).
9. M. R. Hernández, P. Urbán, E. Casals, et al., Int. J.
Nanomedicine 7, 2339 (2012).
34. S. J. Hug, J. Colloid Interface Sci. 188, 415 (1997).
10. N. Amabile, C. Guignabert, D. Montani, et al., Eur.
35. K. Glasmästar, C. Larsson, F. Höök, and B. Kasemo,
Respir. J. 42 (1), 272 (2013).
J. Colloid Interface Sci. 246 (1), 40 (2002).
11. F. Kunz, W. D. Zwierzina, and H. Hörtnagl, Athero-
sclerosis 49 (2), 195 (1983).
36. R. Koynova and B. Tenchov, in Wiley Encyclopedia of
Chemical Biology (John Wiley & Sons, Hoboken,
12. M. F. Matus, C. Vilos, B. A. Cisterna, et al., Vasc.
2009), vol. 2, pp. 601-615.
Pharmacol. 101, 1 (2018).
13. A. S. Jakate, C. M. Einhaus, A. P. DeAnglis et al., Can-
37. P. Jia, M. He, Y. Gong, et al., ACS Appl. Mater. Inter-
cer Res. 63 (21), 7314 (2003).
faces 7 (12), 6422 (2015).
14. A. Tanka-Salamon, A. Bóta, A. Wacha, et al., BioMed
38. T. Nezu, M. Taira, S. Saitoh, et al., Int. J. Biol. Macro-
Res. Int. 2017, 5130495 (2017).
mol. 46 (4), 396 (2010).
15. Y. Hu, C. Wu, C. Zhu, et al., Int. J. Pharm. 552, 319
(2018).
39. S. R. Baker and R. A. S. Ariëns, in Cardiovascular
16. M. Shukla, U. D. Sekhon, V. Betapudi, et al., J.
Thrombus, Ed. by O. Topaz (Acad. Press, London, San
Thromb. Haemost. 15 (2), 375 (2017).
Diego, Cambridge, Oxford, 2018), рр. 31-49.
БИОФИЗИКА том 66
№ 1
2021
АДСОРБЦИЯ ФИБРИНОГЕНА НА ЛИПИДНОЙ ПОВЕРХНОСТИ
91
Fibrinogen Adsorption on the Lipid Surface
as a Factor of Regulation of Fibrin Clot Formation
D.A. Faizullin*, Yu.A. Valiullina*, V.V. Salnikov*, and Yu.F. Zuev*
*Kazan Institute of Biochemistry and Biophysics, Federal Research Center “Kazan Scientific Center of the Russian Academy
of Sciences”, ul. Lobachevskogo 2/31, Kazan, 420111 Russia
It has been established that enzymes of the coagulation cascade can interact with lipid microparticles or mi-
crovesicles of natural or artificial origin circulating in the blood. Such interactions can modulate hemostasis.
Less is known about the effects of the direct interaction of fibrinogen/fibrin with microvesicles. Using puri-
fied systems in this study, it was shown that the presence of lipid particles of various compositions in solution
may have a specific effect on the kinetics of fibrin polymerization. Experimental evidence presented here re-
veals that this effect arises from fibrinogen adsorption on the surface of the microvesicles. In particular, it was
demonstrated that the adsorption of fibrinogen in a sufficiently high concentration leads to acceleration of
the thrombin-induced fibrin polymerization due to the local concentration effect and the inclusion of mi-
crovesicles into the structure of the clot. Thus, the direct interaction of fibrinogen with microvesicles is an
essential factor in hemostasis, which should be taken into account when analyzing blood coagulation diseases
and developing an artificial lipid as drug carriers.
Keywords: lipids, fibrin, adsorption, coagulation
БИОФИЗИКА том 66
№ 1
2021