БИОФИЗИКА, 2021, том 66, № 1, с. 92-98
БИОФИЗИКА КЛЕТКИ
УДК 576.32/.36
ЛИГАНД СИГМА-1 РЕЦЕПТОРОВ ХЛОРПРОМАЗИН ПОДАВЛЯЕТ
ДЕПОЗАВИСИМЫЙ ВХОД Са2+ В ПЕРИТОНЕАЛЬНЫХ МАКРОФАГАХ
© 2021 г. Л.С. Миленина*, З.И. Крутецкая*, В.Г. Антонов**, Н.И.Крутецкая*
*Санкт-Петербургский государственный университет, 199034, Санкт-Петербург, Университетская наб., 7/9
**Военно-медицинская академия им. C.М. Кирова, 194044, Санкт-Петербург, ул. Академика Лебедева, 6
Е-mail: cozzy@mail.ru, z.krutetskaya@spbu.ru
Поступила в редакцию 21.05.2020 г.
После доработки 08.06.2020 г.
Принята к публикации 16.06.2020 г.
С использованием флуоресцентного Са2+-зонда Fura-2AM впервые показано, что антагонист
рецепторов сигма-1 - нейролептик хлорпромазин - значительно подавляет в перитонеальных
макрофагах крыс депозависимый вход Са2+, индуцируемый иммуномодуляторами глутоксимом и
моликсаном, а также ингибиторами эндоплазматических Са2+-АТФаз тапсигаргином и
циклопьязониковой кислотой. Полученные результаты свидетельствуют об участии рецепторов
сигма-1 в регуляции депозависимого входа Са2+ в макрофагах.
Ключевые слова: рецепторы сигма-1, депозависимый вход Са2+, макрофаги.
DOI: 10.31857/S0006302921010105
Депозависимый или «емкостной» вход Са2+,
кальмодулин, аденилатциклаза и Са2+-АТФаза в
впервые описанный Дж. Патни более тридцати
мембране Са2+-депо [5, 6].
лет назад, является повсеместным (ubiquitous) ме-
Важными участниками процессов Са2+-сигна-
ханизмом регулируемого входа Са2+ в клетки эу-
лизации в клетках являются рецепторы сигма-1 -
кариот, активируемым при опустошении внутри-
лигандрегулируемые молекулярные шапероны в
клеточных Са2+-депо [1, 2]. Депозависимый вход
мембране эндоплазматического ретикулума,
Са2+ участвует в регуляции широкого спектра
имеющие уникальную историю, структуру и фар-
клеточных процессов (экзоцитоз, экспрессия ге-
макологический профиль [10]. Эти рецепторы
нов, рост и пролиферация клеток и др.) в норме и
экспрессированы в клетках различных типов,
патологии [3, 4].
включая клетки иммунной системы [10]. Взаимо-
действуя с белками-мишенями, такими как ион-
Функциональной единицей депозависимого
ные каналы и рецепторы, рецепторы сигма-1 ре-
входа Са2+ является мультимолекулярный белко-
гулируют многие клеточные процессы в норме и
вый комплекс (store-operated calcium influx com-
патологии [10, 11]. Так, обнаружено, что взаимо-
plex, SOCIC), компоненты которого обладают
действуя с рецепторами инозитол-1,4,5-трифос-
высокой мобильностью, а взаимодействия между
фата, рецепторы сигма-1 модулируют процессы
ними жестко регулируются [5, 6]. Основными
Са2+-сигнализации в клетках - мобилизацию
компонентами комплекса, необходимыми и до-
Са2+ из депо и вход Са2+ из наружной среды [12].
статочными для активации депозависимого входа
Рецепторы сигма-1 имеют очень широкий
Са2+, являются Са2+-каналы Orai1 в плазмалемме
фармакологический профиль. Их лигандами яв-
и Са2+-сенсор STIM1 в мембране Са2+-депо [4].
ляются различные по химической структуре и
При опустошении Са2+-депо STIM1 олигомери-
фармакологическому действию соединения: ан-
зуется, транслоцируется в участки эндоплазмати-
тидепрессанты, нейролептики, анальгетики, про-
тивосудорожные и противокашлевые средства
ческого ретикулума, расположенные у плазма-
[13].
леммы, и прямо взаимодействует с белками Orai1,
Ранее нами было впервые показано, что анта-
вызывая депозависимый вход Са2+ [7-9]. В со-
гонист рецепторов сигма-1 нейролептик галопе-
став комплекса входят также регуляторные белки:
ридол (производное бутирофенона) значительно
подавляет мобилизацию Са2+ из депо и депозави-
Сокращениe: [Ca2+]i - внутриклеточная концентрация Са2+.
92
ЛИГАНД СИГМА-1 РЕЦЕПТОРОВ ХЛОРПРОМАЗИН
93
симый вход Са2+, вызываемые дисульфидсодер-
на (0.5 мМ) готовили в диметилсульфоксиде. Ма-
точный раствор хлорпромазина (25 мг/мл) гото-
жащими иммуномодуляторами глутоксимом®
вили в воде. Препараты глутоксим и моликсан
(динатриевая соль окисленного глутатиона с d-
были предоставлены фирмой ФАРМА-ВАМ
металлом в наноконцентрации, «ФАРМА-ВАМ»,
(Санкт-Петербург). Маточные растворы глуток-
Санкт-Петербург) и моликсаном® (комплекс
глутоксима и нуклеозида инозина, «ФАРМА-
сима (50 мг/мл) и моликсана (50 мг/мл) готовили
в воде.
ВАМ») [14] и ингибиторами эндоплазматических
Са2+-АТФаз тапсигаргином и циклопьязонико-
Измерение внутриклеточной концентрации
вой кислотой [15] в перитонеальных макрофагах
Са2+. Для измерения внутриклеточной концен-
крыс.
трации Са2+ ([Ca2+]i), использовали флуорес-
Для подтверждения участия рецепторов сиг-
центный зонд Fura-2AM (Sigma-Aldrich, США).
ма-1 в регуляции депозависимого входа Са2+ в
Макрофаги инкубировали в течение 45 мин при
макрофагах представлялось целесообразным ис-
22-24°С в физиологическом растворе, содержа-
следовать влияние другого, структурно отличного
щем 2 мкМ Fura-2AM. Стекла с окрашенными
антагониста рецепторов сигма-1 на Са2+-ответы,
клетками отмывали физиологическим раствором
индуцируемые глутоксимом и моликсаном, а так-
и переносили в экспериментальную камеру флуо-
же тапсигаргином и циклопьязониковой кисло-
ресцентного микроскопа Leica DM 4000B (Leica
той в перитонеальных макрофагах крыс, что и со-
Microsystems, Германия). Возбуждение флуорес-
ставило предмет настоящего исследования.
ценции объекта производили при длинах волн
340 и 380 нм через объектив микроскопа. Для вы-
В экспериментах использовали антагонист ре-
деления соответствующих участков спектра ис-
цепторов сигма-1 - нейролептик фенотиазино-
пользовали узкополосные оптические фильтры.
вого ряда хлорпромазин (аминазин, торазин)
Эмиссию регистрировали при длине волны
[16], широко используемый для лечения шизо-
510 нм при помощи специализированной видео-
френии.
камеры Leica DFC340FX. Для управления экспе-
риментом использовали систему обработки изоб-
МАТЕРИАЛЫ И МЕТОДЫ
ражения ImageJ (плагин Micro-Manager 1.4).
Выделение и культивирование перитонеальных
Результатом измерений являлось отношение
макрофагов. Эксперименты проводили на куль-
интенсивностей флуоресценции Fura-2AM при
тивируемых резидентных перитонеальных мак-
облучении светом с длиной волны 340 нм к ин-
рофагах крыс линии Wistar.
тенсивности флуоресценции при облучении све-
Резидентные макрофаги выделяли из перито-
том с длиной волны 380 нм (F340/F380), где F340 -
неальной полости крыс массой 180-250 г по ме-
интенсивность флуоресценции Fura-2AM, свя-
тоду, описанному ранее [17, 18]. Сразу после вы-
занного с Са2+, а F380 - интенсивность флуорес-
деления клетки имели сферическую форму (диа-
ценции Fura-2AM, не связанного с Са2+, отража-
метр 10-20 мкм). Суспензию клеток помещали в
бакпечатки, содержащие кварцевые стекла раз-
ющее изменения [Ca2+]i в клетках во время изме-
мером 10 × 10 мм. Клетки на стеклах культивиро-
рений [20, 21]. Для избежания фотовыгорания
вали в течение одних-трех суток при 37°С в среде
измерения проводили через каждые 20 с, облучая
199 (рН 7.2), содержащей 20% сыворотки крови
объект в течение 2 с. В экспериментах применяли
быка, глутамин (3%), пенициллин (100 Ед/мл) и
объектив 10× с апертурой 8 мм. Значения [Ca2+]i
стрептомицин (100 мг/мл). Тест на α-нафтилэсте-
рассчитывали по уравнению Гринкевича [22].
разу [19] показал, что по меньшей мере 96% кле-
ток в монослоях были макрофагами.
Статистический анализ проводили с примене-
нием t-критерия Стьюдента. Данные представле-
Эксперименты проводили при комнатной
ны в виде среднего и стандартного отклонения.
температуре (22-24°С) через одни-двое суток по-
Достоверными считали различия при p ≤ 0.05. На
сле начала культивирования клеток. Кварцевые
рисунках представлены результаты типичных
стекла с клетками помещали в эксперименталь-
экспериментов.
ную камеру, заполненную физиологическим рас-
твором следующего ионного состава: 140 мМ Na-
Cl, 5 мМ KCl, 1 мМ CaCl2, 1 мМ MgCl2 и 5 мМ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
HEPES-NaOH, рН 7.3-7.4. Бескальциевая среда
отличалась тем, что содержала 0 мМ CaCl2 и 1 мМ
В контрольных экспериментах было показано,
что инкубация макрофагов в течение 20 мин с
ЭГТА.
100 мкг/мл глутоксима (рис. 1а) или 100 мкг/мл
Использовали реактивы фирмы Sigma-Aldrich
моликсана (рис. 2а) в бескальциевой среде вызы-
(США). Маточные растворы Fura-2AM (1 мМ),
циклопьязоникой кислоты (10 мМ) и тапсигарги-
вает медленно нарастающее увеличение [Ca2+]i,
БИОФИЗИКА том 66
№ 1
2021
94
МИЛЕНИНА и др.
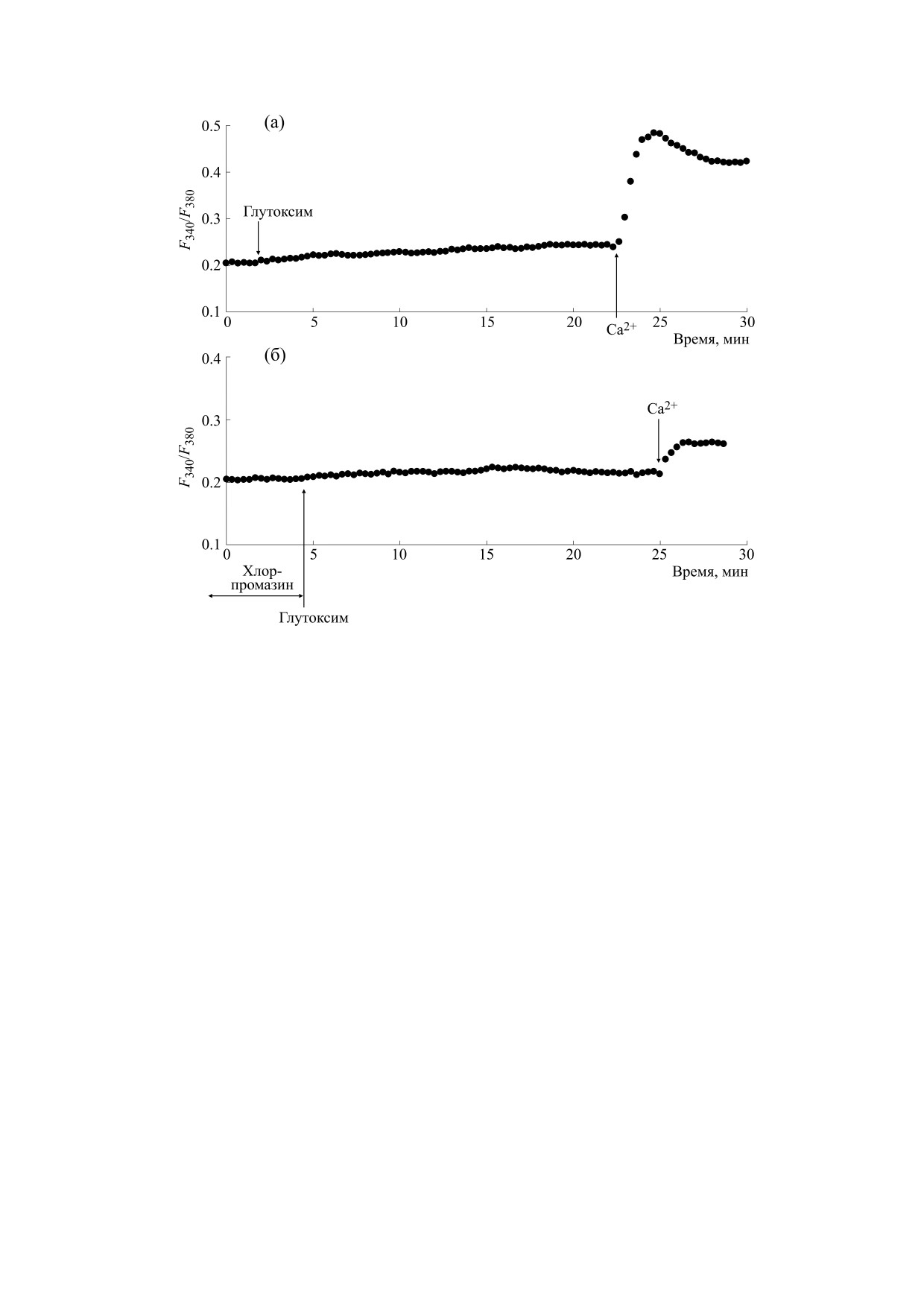
Рис. 1. Влияние хлорпромазина на увеличение [Ca2+]i в макрофагах крыс, вызываемое глутоксимом: (а) - макрофаги
инкубировали в течение 20 мин в присутствии 100 мкг/мл глутоксима в номинально бескальциевой среде, затем вход
Са2+ инициировали введением в наружную среду 2 мМ Са2+; (б) - клетки предварительно инкубировали в течение
10 мин с 25 мкг/мл хлорпромазина в бескальциевой среде, затем добавляли 100 мкг/мл глутоксима, через 20 мин вход
Са2+ инициировали введением в наружную среду 2 мМ Са2+. По оси ординат - отношение интенсивностей
флуоресценции Fura-2AM F340/F380 при длинах волн возбуждающего излучения 340 и 380 нм соответственно, по оси
абсцисс - время. Каждая регистрация получена для группы из 40-50 клеток и представляет собой типичный вариант
из шести-восьми независимых экспериментов.
мкг/мл глутоксима приводила к значительному
отражающее мобилизацию Са2+ из внутрикле-
точных депо. В среднем (n = 6 для каждого из пре-
подавлению как мобилизации Са2+ из депо (на
паратов) через 20 мин после добавления агентов
58.5 ± 4.6%, n = 7), так и последующего депозави-
величина [Ca2+]i увеличивалась от базального
симого входа Са2+ в клетку (на 59.1 ± 6.1%, n = 7),
уровня, равного 90 ± 18 нМ, до 135 ± 18 нМ для
индуцируемых глутоксимом (рис. 1б). Сходные
глутоксима и 134 ± 20 нМ для моликсана. При
данные были получены в опытах по влиянию
введении в наружную среду 2 мМ Са2+ наблюда-
25 мкг/мл хлорпромзаниа на Са2+-ответы, вызы-
ваемые 100 мкг/мл моликсана (рис. 2б). В сред-
лось дальнейшее повышение [Ca2+]i , отражаю-
нем (n = 8) хлорпромазин вызывал подавление
щее депозависимый вход Са2+ в цитозоль
мобилизации Са2+ из депо на 43.2 ± 8.9% и подав-
(рис. 1а, 2а). В среднем (n = 6) увеличение [Ca2+]i
ление депозависимого входа Са2+ в клетку на
во время входа Са2+ составило
223
± 22 и
59.2 ± 9.2%, индуцированных моликсаном.
202 ± 20 нМ для глутоксима и моликсана соответ-
ственно.
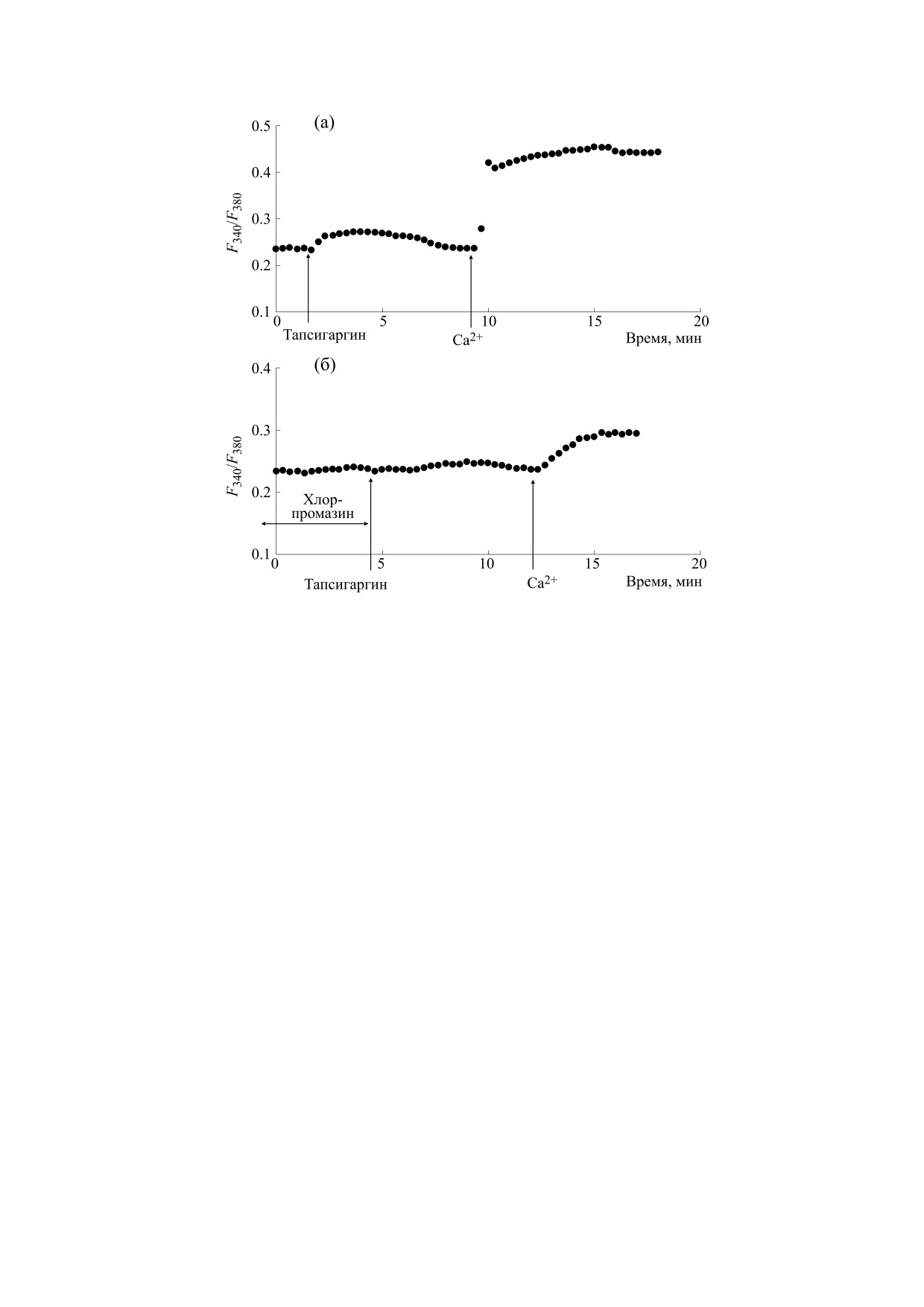
Добавление 0.5 мкМ тапсигаргина к макрофа-
гам, находящимся в бескальциевой среде, вызы-
В наших экспериментах впервые было обнару-
вает незначительное увеличение [Ca2+]i, отража-
жено, что преинкубация макрофагов с 25 мкг/мл
хлорпромазина в течение 10 мин до введения 100 ющее мобилизацию Са2+ из внутриклеточных
БИОФИЗИКА том 66
№ 1
2021
ЛИГАНД СИГМА-1 РЕЦЕПТОРОВ ХЛОРПРОМАЗИН
95
Рис. 2. Влияние хлорпромазина на увеличение [Ca2+]i в макрофагах крыс, вызываемое моликсаном: (а) - макрофаги
инкубировали в течение 20 мин в присутствии 100 мкг/мл моликсана в номинально бескальциевой среде, затем вход
Са2+ инициировали введением в наружную среду 2 мМ Са2+; (б) - клетки предварительно инкубировали в течение
10 мин с 25 мкг/мл хлорпромазина в бескальциевой среде, затем добавляли 100 мкг/мл моликсана, через 20 мин вход
Са2+ инициировали введением в наружную среду 2 мМ Са2+. По оси ординат - отношение интенсивностей
флуоресценции Fura-2AM F340/F380 при длинах волн возбуждающего излучения 340 и 380 нм соответственно, по оси
абсцисс - время.
введения 0.5 мкМ тапсигаргина вызывает значи-
Са2+-депо (рис. 3а). В среднем (n = 7) увеличение
тельное подавление обеих фаз Са2+-ответа, инду-
[Ca2+]i во время фазы мобилизации составило
цированного тапсигаргином (рис. 3б). Так, по-
26 ± 7 нМ (рис. 3а). При последующем введении в
давление фазы мобилизации Са2+ из депо соста-
наружную среду 2 мМ Са2+ наблюдался депозави-
вило 59.3 ± 8.2% (n = 7), а депозависимого входа
симый вход Са2+ в цитозоль (рис. 3а). В среднем
Са2+ - 68.2 ± 10.4% (n = 7). Сходные результаты
(n = 7) увеличение [Ca2+]i во время входа Са2+ со-
были получены в опытах с применением 10 мкМ
ставило 160.2 ± 20.5 нМ. Сходные результаты мы
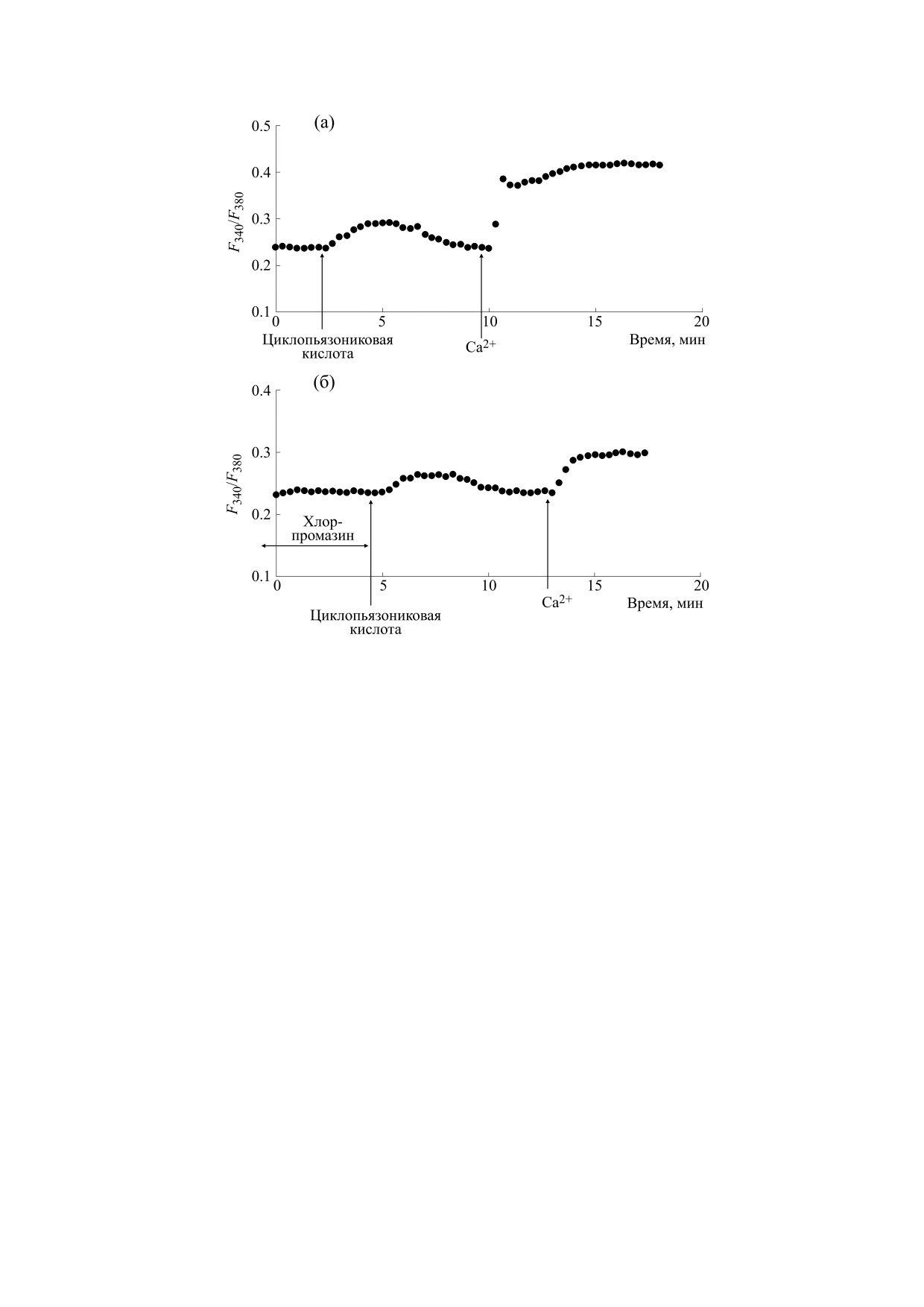
циклопьязониковой кислоты (рис. 4б). Подавле-
получили при использовании 10 мкМ циклопья-
ние хлорпромазином мобилизации Са2+ из депо
зониковой кислоты (рис. 4а). В среднем (n = 7)
составило 40.2 ± 9.1 % (n = 7), а подавление депо-
увеличение [Ca2+]i, отражающее мобилизацию
зависимого входа Са2+ - 63.4 ± 11.5 % (n = 7).
Са2+ из внутриклеточных Са2+-депо, составило
Таким образом, в настоящей работе мы впер-
вые на перитонеальных макрофагах крыс показа-
37.8 ± 9.8 нМ, а увеличение [Ca2+]i во время депо-
ли, что антагонист рецепторов сигма-1 - нейро-
зависимого входа Са2+ составило 150.2 ± 23.7 нМ.
лептик фенотиазинового ряда хлорпромазин -
подавляет мобилизацию Са2+ из депо и депозави-
Мы впервые обнаружили, что преинкубация
макрофагов с 25 мкг/мл хлорпромазина в номи-
симый вход Са2+, вызываемые глутоксимом или
нально бескальциевой среде в течение 10 мин до
моликсаном, а также тапсигаргином и циклопья-
БИОФИЗИКА том 66
№ 1
2021
96
МИЛЕНИНА и др.
Рис.
3. Влияние хлорпромазина на Са2+-ответы, вызываемые тапсигаргином в макрофагах: (а) - клетки
стимулировали 0.5 мкМ тапсигаргина в номинально бескальциевой среде, затем вход Са2+ инициировали введением
в наружную среду 2 мМ Са2+; (б) - макрофаги предварительно инкубировали в течение 10 мин с 25 мкг/мл
хлорпромазина в бескальциевой среде, затем добавляли 0.5 мкМ тапсигаргина, после чего вход Са2+ инициировали
введением в наружную среду 2 мМ Са2+. По оси ординат - отношение интенсивностей флуоресценции Fura-2AM
F340/F380 при длинах волн возбуждающего излучения 340 и 380 нм соответственно, по оси абсцисс - время.
зониковой кислотой в макрофагах. Результаты
участии рецепторов сигма-1 в комплексном сиг-
согласуются с данными других авторов, которые
нальном каскаде, запускаемом глутоксимом или
обнаружили, что хлорпромазин подавляет моби-
моликсаном и приводящем к увеличению [Ca2+]i
лизацию Са2+ из депо и последующий депозави-
в перитонеальных макрофагах крыс. Результаты
симый вход Са2+, вызываемые АТФ или тапси-
указывают также на нежелательность совместно-
гаргином, в клетках лейкоза человека (линия
го применения в клинической практике препара-
HL-60) [23] и ингибирует депозависимый вход
тов глутоксим или моликсан и нейролептика
хлорпромазина.
Са2+, индуцируемый брадикинином или тапси-
гаргином в клетках феохромоцитомы крыс (ли-
Полученные нами данные свидетельствуют
ния PC12) [24]. Обнаружено также, что антагони-
также об участии рецепторов сигма-1 в регуляции
сты сигма-1 рецепторов (BD1063 и BD1047) инги-
депозависимого входа Са2+, индуцируемого ди-
бируют вход Са2+, индуцируемый гистамином в
сульфидсодержащими иммуномодуляторами и
эндотелиальных клетках подкожной вены ноги
ингибиторами эндоплазматических Са2+-АТФаз,
человека [25]. Кроме того, известно [26], что
в перитонеальных макрофагах крыс и позволяют
хлорпромазин ингибирует потенциалзависимые
рассматривать рецепторы сигма-1 в качестве но-
Са2+-каналы в клетках разных типов.
вого регуляторного компонента сигнального
Результаты настоящей и более ранних работ
комплекса депозависимого входа Са2+ в макро-
[14, 27] о подавлении лигандами рецепторов сиг-
фагах. Рецепторы сигма-1 могут влиять на депо-
ма-1 Са2+-ответов, вызываемых глутоксимом и
зависимый вход Са2+, регулируя связывание
моликсаном в макрофагах, свидетельствуют об
между основными компонентами белкового ком-
БИОФИЗИКА том 66
№ 1
2021
ЛИГАНД СИГМА-1 РЕЦЕПТОРОВ ХЛОРПРОМАЗИН
97
Рис. 4. Влияние хлорпромазина на Са2+-ответы, вызываемые циклопьязониковой кислотой в макрофагах: (а) -
клетки стимулировали 10 мкМ циклопьязониковой кислоты в номинально бескальциевой среде, затем вход Са2+
инициировали введением в наружную среду 2 мМ Са2+; (б) - макрофаги предварительно инкубировали в течение
10 мин с 25 мкг/мл хлорпромазина в бескальциевой среде, затем добавляли 10 мкМ циклопьязониковой кислоты,
после чего вход Са2+ инициировали введением в наружную среду 2 мМ Са2+. По оси ординат - отношение
интенсивностей флуоресценции Fura-2AM F340/F380 при длинах волн возбуждающего излучения 340 и 380 нм
соответственно, по оси абсцисс - время.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
плекса депозависимого входа Са2+ - белками
STIM1 в мембране эндоплазматического ретику-
Содержание животных и все манипуляции с
лума и Orai1 в плазмалемме [28].
ними выполняли в соответствии с нормативными
документами и требованиями Приказа Минздра-
ва РФ № 267 от 19.06.03 «Об утверждении правил
ФИНАНСИРОВАНИЕ РАБОТЫ
лабораторной практики в Российской Федера-
ции».
Работа выполнена в рамках плановых тем ка-
федры биофизики Санкт-Петербургского государ-
ственного университета и кафедры клинической
СПИСОК ЛИТЕРАТУРЫ
биохимии и лабораторной диагностии Военно-
1. J. W. Putney, Cell Calcium 11, 611 (1990).
Медицинской академии им. С.М. Кирова (Санкт-
2. J. W. Putney, Adv. Exp. Med. Biol. 981, 205 (2017).
Петербург), а также Договора на выполнение науч-
3. J. W. Putney, Neurochem. Res. 36, 1157 (2011).
но-исследовательских работ № 28-12-38.
4. M. Prakriya and R. S. Lewis, Physiol. Rev. 95, 1383
(2015).
КОНФЛИКТ ИНТЕРЕСОВ
5. L. Vaca, Cell Calcium 47, 199 (2010).
6. C. Moreno and L. Vaca, in Store-operated Ca2+ entry
Авторы заявляют об отсутствии конфликта
(SOCE) pathways (Springer-Verlag, Wien,
2012),
интересов.
pp. 93-113.
БИОФИЗИКА том 66
№ 1
2021
98
МИЛЕНИНА и др.
7. R. M. Nwokonko, X. Cai, N. A. Loktionova, et al., Adv.
18. C. Randriamampita and A. Trautmann, Cell. Biol. 105,
Exp. Med. Biol. 993, 83 (2017).
761 (1987).
8. N. T. Nguyen, W. Han, W.-M. Cao, et al., Comprehen-
19. R. A. Monahan, H. F. Dvorak, and A. M. Dvorak,
sive Physiol. 8, 981 (2018).
Blood 58, 1089 (1981).
9. V. Lunz, C. Romanin, and I. Frischauf, Cell Calcium
20. J. I. E. Bruce and A. C. Elliott, Brit. J. Physiol. 131,761
77, 29 (2019).
(2000).
21. Q. Xie, Y. Zhang, C. Zhai, et al., J. Biol. Chem. 277,
10. C. G. Rousseaux and S. F. Greene, J. Recept. Signal
16559 (2002).
Transduct. 36, 327 (2016).
22. G. Grynkiewicz, M. Poenie, and R. Y. Tsien, J. Biol.
11. T.-P. Su, T. Hayashi, T. Maurice, et al., Trends Phar-
Chem. 260, 3440 (1985).
macol. Sci. 31, 557 (2010).
23. J. L. Harper and J. W. Daly, Drug Dev. Res. 47, 107
12. T. Hayashi and T.-P. Su, Cell 131, 596 (2007).
(1999).
13. E. J. Cobos, J. M. Entrena, F. R. Nieto, et al., Curr.
24. S.-Y. Choi, Y.-H. Kim, Y.-K. Lee, et al., Brit. J. Phar-
Neuropharmacol. 6, 344 (2008).
macol. 132, 411 (2001).
14. З. И. Крутецкая, Л. С. Миленина, А. А. Наумова
25. M. S. Amer, L. McKeown, S. Tumova, et al., Brit. J.
и др., Докл. РАН 472 (6), 723 (2017).
Pharmacol. 168, 1445 (2013).
15. З. И. Крутецкая, Л. С. Миленина, А. А. Наумова
26. N. C. McNaughton, P.J. Green, and A. D. Randall,
и др., Докл. РАН 480 (5), 613 (2018).
Acta Physiol. Scand. 173, 401 (2001).
16. Y. Itzhak, M. Ruhland, and H. Krahling, Neurophar-
27. З. И. Крутецкая, Л.С. Миленина, А. А. Наумова
macol. 29, 181 (1990).
и др., Докл. РАН 481 (5), 570 (2018).
17. R. E. Conrad, in Manual of macrophages methodology
28. S. Srivats, D. Balasuriya, M. Pasche, et al., J. Cell Biol.
(Marcell Dekker, New York, 1981), pp. 5-11.
213, 65 (2016).
Sigma-1 Receptor Ligand Chlorpromazine Attenuates Store-Dependent Ca2+ Entry
in Peritoneal Macrophages
L.S. Milenina*, Z.I. Krutetskaya*, V.G. Antonov**, and N.I. Krutetskaya*
*Saint-Petersburg State University, Universitetskaya nab. 7/9, Saint-Petersburg, 199034 Russia
**S.M. Kirov Military Medical Academy, ul. Akademika Lebedeva 6, Saint-Petersburg, 194044 Russia
Using Fura-2AM, a fluorescent Ca2+ indicator, we have shown for the first time that the sigma-1 receptor
antagonist - neuroleptic chlorpromazine - significantly inhibits the store-dependent Ca2+entry induced by
immunomodulators glutoxim as well as molixan and endoplasmic reticulum Са2+-ATPase inhibitors
thapsigargin and cyclopiazonic acid in rat peritoneal macrophages. The results suggest the involvement of sig-
ma-1 receptors in the regulation of store-dependent Ca2+ entry in macrophages.
Keywords: sigma-1 receptors, store-dependent Ca2+ entry, macrophages
БИОФИЗИКА том 66
№ 1
2021