БИОФИЗИКА, 2021, том 66, № 1, с. 115-125
БИОФИЗИКА КЛЕТКИ
УДК 577.3
КРИОКОНСЕРВАЦИЯ КЛЕТОК HeLa ПОД ВЫСОКИМ
ГИДРОСТАТИЧЕСКИМ ДАВЛЕНИЕМ 1.0-1.5 КБАР
© 2021 г. С.В. Уграицкая, Н.В. Шишова, Э.Р. Валеева, С.А. Каурова,
Н.Э. Швирст, Е.Е. Фесенко (мл.)
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, Институтская ул., 3
E-mail: eugeny.ef@gmail.com
Поступила в редакцию 15.07.2020 г.
После доработки 20.09.2020 г.
Принята к публикации 30.10.2020 г.
Идея использовать высокое давление для снижения криоповреждений имеет проработанное теоре-
тическое обоснование, однако экспериментальных данных по замораживанию живых объектов под
давлением крайне мало. Мы исследовали выживаемость клеток линии HeLa под давлением 1.0-
2.0 кбар, токсические эффекты пяти классических криопротекторов в этих условиях, а также выжи-
ваемость клеток HeLa в процессе медленной криоконсервации под давлением 1.0 и 1.5 кбар.
Экспериментально показана высокая устойчивость клеток HeLa к гидростатическому давлению:
100%-я выживаемость при 1.0 кбар и 60-минутной инкубации. Токсическое воздействие криопро-
текторов под давлением можно расположить в следующем ряду: глицерин < этиленгликоль < 1,2-
пропандиол = ДМСО < ДМСО + формамид. Наименьшую токсичность проявили глицерин и эти-
ленгликоль, для которых также показаны выраженные баропротекторные эффекты. При криокон-
сервации под давлением 1.0 кбар высокая выживаемость - 83 ± 16% по данным флуоресцентного
окрашивания - была достигнута при использовании 10%-го глицерина, однако она не превысила
показателей выживаемости, полученных в контрольных нормобарических экспериментах. Замора-
живание проводили по методу медленной классической криоконсервации. Использование дав-
ления для замораживания биоматериала методом витрификации может привести к другим резуль-
татам.
Ключевые слова: криоконсервация, гидростатическое давление, криопротекторы, баропротекторы,
глицерин, формамид.
DOI: 10.31857/S0006302921010130
чительного числа биологических объектов (яйце-
Криоконсервация является важным элемен-
клеток, эмбрионов и личинок рыб, эмбрионов
том современных биотехнологий, так как это
единственный метод, обеспечивающий длитель-
птиц, массивов тканей и органов животных и че-
ное - на месяцы и годы - хранение жизнеспособ-
ловека и др.).
ного биологического материала. С помощью
Большинство криоповреждений биологиче-
криоконсервации осуществляется хранение са-
ского материала при криоконсервации прямо ли-
мого разного биологического материала - клеток
бо косвенно связано с образованием кристаллов
крови, гамет, клеточных культур, эмбрионов и др.
льда в процессе замораживания. Такие парамет-
Несмотря на то что для многих объектов процеду-
ры, как количество кристаллов льда, их размер,
ры замораживания и хранения разработаны и
форма, локализация, соотношение кристалличе-
широко используются (например, для крови,
ского льда и остеклованного остаточного раство-
спермы и т.п.), продолжается поиск повышения
ра, оказывают значительное влияние на жизне-
эффективности методов криоконсервации. Изу-
способность и качество замороженно-оттаянного
чение новых подходов в дополнение к существу-
биологического материала. Перечисленные пара-
ющим традиционным методам замораживания
метры существенно зависят прежде всего от со-
необходимо также в связи с тем, что пока не раз-
става криозащитной среды и от скорости замора-
работаны протоколы криоконсервации для зна-
живания в различных температурных диапазонах,
Сокращения: ДМСО - диметилсульфоксид, ЭТС - эмбри-
однако и другие факторы могут влиять на форми-
ональная телячья сыворотка.
рование структуры замороженного раствора.
115
116
УГРАИЦКАЯ и др.
Известно, что гидростатическое давление воз-
глицерин, ацетамид, пропиленгликоль) исполь-
действует на процесс кристаллизации льда [1, 2].
зование давления в процессе замораживания, на-
В связи с тем, что вода обладает аномальными
против, проявляло негативный эффект, значи-
свойствами, при повышении давления в диапазо-
тельно ухудшая сохранность эритроцитов.
не до 2.1 кбар температура кристаллизации воды
Н. Грир [12] также замораживал эритроциты
и водных растворов понижается [1, 2]. Каждые
под высоким гидростатическим давлением. В
дополнительные 100 бар давления понижают точ-
этих экспериментах замораживание осуществля-
ку кристаллизации воды примерно на 1°С, а
лось в условиях давления от 0.7 до 2.0 кбар, в то
температуру образования зародышей кристалли-
время как оттаивание проводили при атмосфер-
ческой фазы в отсутствие примесей (точку гомо-
ном давлении. В отличие от предыдущих авторов
генной нуклеации) - на 2.0-2.5°С [1, 2]. Одно-
в данной работе была отмечена высокая эффек-
временно с этим под воздействием высокого гид-
тивность сочетания давления и проникающих
ростатического давления увеличивается вязкость
криопротекторов (ДМСО, глицерин). Было най-
растворов и несколько повышается температура
дено, что оптимальное давление для заморажива-
перехода раствора из жидкого в стеклообразное
ния эритроцитов составляет 1.2 кбар. В экспери-
состояние [3].
ментах с наиболее удачным сочетанием давления
Идея об использовании высокого гидростати-
(1.2 кбар), скорости охлаждения (35°С/мин) и
ческого давления для снижения криоповрежде-
криопротектора (7%-й глицерин) гемолиз эрит-
ний в процессе замораживания биологических
роцитов не превышал 5%.
объектов появилась достаточно давно и обсужда-
Дж. Хубингер с соавторами [13] сделали по-
лась еще в семидесятые годы прошлого века [4, 5].
пытку получить жизнеспособные замороженно-
Впоследствии было несколько исследований по-
оттаянные культуры, используя технологию
ведения растворов криопротекторов при охла-
криофиксации биообъектов под давлением, раз-
ждении под давлением [3, 6]. Ряд специалистов
работанную для электронной микроскопии. Они
полагает, что криоконсервация под высоким гид-
замораживали культуру Escherichia coli, дрожжи
ростатическим давлением может быть перспек-
Saccharomyces cerevisiae и культуру клеток HeLa.
тивным направлением криобиологии примени-
Были использованы две технологии, применяе-
тельно к объектам, плохо поддающимся процеду-
мые в электронной микроскопии: система быст-
ре обратимого замораживания [6-9].
рой заморозки под давлением (SPRF) и замора-
Концепция замораживания биологических
живание под высоким давлением (HPF). Дрожжи
объектов в условиях высокого гидростатического
Saccharomyces cerevisiae выживали приблизитель-
давления нашла применение в технологии фик-
но одинаково как в контроле (замораживание при
сации биологических образцов для исследования
атмосферном давлении), так и в эксперименталь-
клеточных структур. Замораживание под давле-
ных группах с использованием указанных мето-
нием 2.0-2.1 кбар является рутинным методом
дов. Клетки HeLa при замораживании в системе
фиксации образцов для исследований методами
SPRF продемонстрировали выживаемость 75-
электронной микроскопии [10, 11]. Отмечается,
90% (в зависимости от применяемых криопро-
что замораживание под давлением позволяет хо-
текторов и конкретной модели камеры SPRF),
рошо сохранить клеточные структуры без иска-
однако при замораживании в системе HPF выжи-
жений и возникновения артефактов.
вало не более 2-4% клеток. Нужно отметить, что
система SPRF обеспечивает давление внутри ка-
Несмотря на перечисленное, эксперименталь-
меры только в случае частичной кристаллизации
ные данные по замораживанию живых объектов
воды, однако применяемые авторами криозащит-
под высоким гидростатическим давлением край-
ные растворы и скорости замораживания были
не малочисленны. В 1976 г. А. Воротилин с соав-
близки к витрифицирующим. Если образцы пол-
торами
[5] замораживали красные кровяные
ностью витрифицировались, давление в камере
клетки под высоким гидростатическим давлени-
SPRF оставалось близким к значениям атмосфер-
ем, для достижения которого применялась техно-
ного, так что наличие высокого гидростатическо-
логия «ледяной бомбы». Точные значения давле-
го давления при указанных условиях заморажива-
ния не были указаны, но очевидно, что оно до-
ния клеток HeLa в системе SPRF остается спор-
стигало приблизительно 1.5-2.0 кбара. Авторы
ным.
отмечали, что в случае криоконсервации эритро-
цитов в присутствии непроникающих криопро-
Также необходимо упомянуть серию работ по
текторов (ПЭО-400, сахароза, поливинилпирро-
изохорическому (с сохранением постоянного
лидон) замораживание под высоким давлением
объема) сохранению биологических объектов при
позволяло уменьшить повреждения заморожен-
отрицательной температуре (Isochoric preservation
но-оттаянных клеток, снижая гемолиз в полтора-
at subfreezing temperatures) [14-17]. Метод предпо-
три раза. Однако при применении проникающих
лагает использование принципа Ле Шателье для
криопротекторов (диметилсульфоксид (ДМСО),
минимизации льдообразования ниже точки кри-
БИОФИЗИКА том 66
№ 1
2021
КРИОКОНСЕРВАЦИЯ КЛЕТОК HeLa
117
сталлизации раствора. Вода обладает свойством
увеличивать объем при замерзании. За счет этого
свойства при кристаллизации воды в замкнутой
системе с жестко фиксированным объемом, об-
разующийся лед вызывает повышение давления,
что в свою очередь сдвигает равновесную точку
льдообразования и препятствует дальнейшему
росту кристаллов льда. Хранение биологических
образцов осуществляют при небольшой отрица-
тельной температуре, в условиях частичного за-
мерзания раствора, окружающего биологический
объект. Авторы данного метода сообщают о высо-
кой выживаемости в описываемых условиях не-
матод
[14], сохранения жизнеспособности и
функциональных свойств панкреатических ост-
ровков [15] и сердца крысы [16, 17].
Для понимания перспектив использования
высокого гидростатического давления для совер-
шенствования методов криоконсервации необхо-
димо значительно расширить эксперименталь-
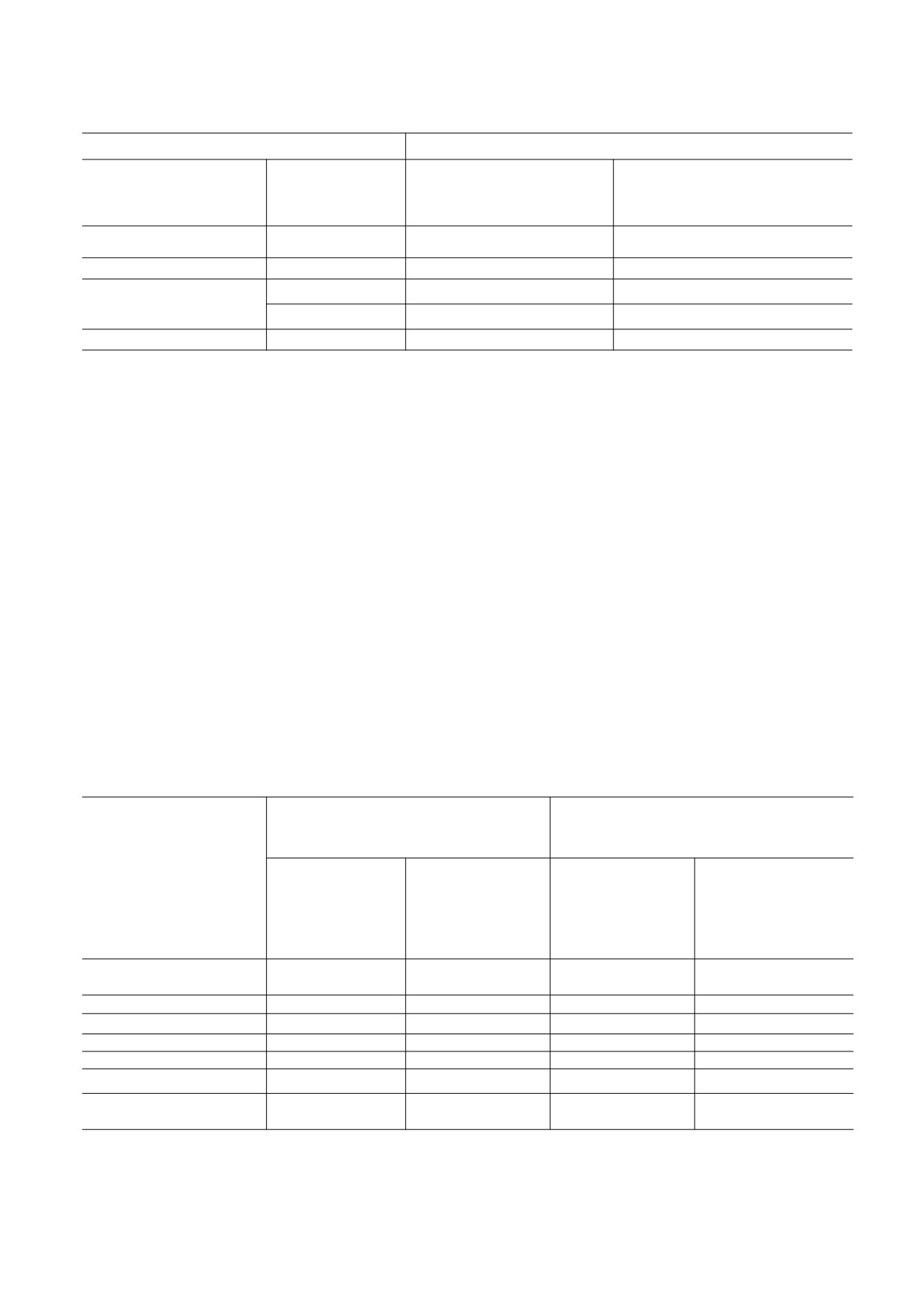
Рис. 1. Камера высокого давления для исследования
ную базу в этой области. Также необходимы ис-
поведения растворов при замораживании-оттаива-
следования по воздействию криопротекторов на
нии: 1 - металлическая емкость с внешней термоизо-
живые клетки под высоким гидростатическим
ляцией, 2 - охлаждающая (жидкий азот) или разогре-
вающая (теплая вода) жидкость, 3 - гайка обтюрато-
давлением.
ра, 4 - обтюратор, 5 - тело камеры, 6 - капсулы с
В нашей работе мы исследовали токсичность и
биологическим материалом, 7 - рабочее простран-
баропротекторные свойства ряда криопротекто-
ство камеры, заполненное 50%-м раствором глицери-
ров в условиях гидростатического давления 1.0,
на, 8 - поршень Бриджмена, 9 - гайка-фиксатор
поршня, 10 - приложение давления с помощью деци-
1.5 и 2.0 кбар в отношении клеток линии HeLa и
мального пресса.
проводили криоконсервацию этих клеток под
давлением 1.0-1.5 кбар по методу медленной
(классической) криоконсервации.
этиленгликоль, 1,2-пропандиол, ДМСО (конеч-
ная концентрация в суспензии клеток - 10%) и
смесь ДМСО/формамид в соотношении 2 : 1 (ко-
МАТЕРИАЛЫ И МЕТОДЫ
нечная концентрация 6.6% ДМСО, 3.4% форма-
Объекты исследования. В качестве тест-объек-
мида). Все криопротекторы были приобретены у
тов для криоконсервации использовали клетки
фирмы Sigma-Aldrich (США).
линии HeLa, полученные из Российской коллек-
Подготовка клеток к экспериментам. Перед
ции клеточных культур позвоночных Института
экспериментом клетки, растущие в виде моно-
цитологии РАН (Санкт-Петербург).
слоя, переводили в суспензию. Для этого моно-
Культивирование клеток проводили по стан-
слой трижды промывали
0.05%-м раствором
дартной методике
[18]. Использовали среду
трипсина-ЭДТА и выдерживали в течение 3 мин
ДМЕМ в модификации Дульбекко (Gibco, Вели-
при 37°С, после чего раствор сливали, клетки пи-
кобритания) с добавлением 10% эмбриональной
петировали несколько раз и переносили в среду
телячьей сыворотки (ЭТС, «ПанЭко», Россия),
ДМЕМ с 10% ЭТС. Количество клеток в суспен-
50 мкг/мл пенициллина, 50 мкг/мл стрептомици-
зии подсчитывали в камере Горяева. Криопро-
на. Клетки выращивали в культуральных флако-
текторы к суспензии клеток добавляли в два этапа
нах Е75 (Eppendorf, США). Культивирование
с интервалом 30 с. Концентрация клеток в экспе-
проводили в СО2-инкубаторе MCO-175 (SANYO,
риментах по определению токсичности и баро-
Япония) при 37°С во влажной атмосфере в тече-
протекторных свойств криопротекторов состав-
ние 48 ч, после чего пассировали их в расчете 30-
ляла 2 млн/мл, в экспериментах по криоконсер-
50 тыс. кл./см2. Ферментативное открепление
вации клеточной культуры - 5 млн/мл.
клеток от культуральной чашки проводили с ис-
Воздействие гидростатического давления на
пользованием
0.05%-го раствора трипсина-
клетки, определение токсичности криопротекторов
ЭДТА (Gibco, Великобритания).
под давлением. Для экспериментов по определе-
Применяемые криозащитные растворы. Раство-
нию устойчивости клеток к давлению и измене-
ры криопротекторов готовили на среде ДМЕМ в
нию токсичности криопротекторов под давлени-
модификации Дульбекко с добавлением
10%
ем использовали специализированную камеру
ЭТС. В экспериментах использовали глицерин,
(рис. 1). Суспензию клеток помещали в силико-
БИОФИЗИКА том 66
№ 1
2021
118
УГРАИЦКАЯ и др.
новые капсулы объемом 70 мкл с закрывающими-
и далее до атмосферного давления со скоростью
ся подвижными поршнями, изготовленными из
60 бар/мин. Извлекали поршень 8 и доставали
фторопласта по системе
«цилиндр плюс два
капсулы с биологическим материалом. Во втором
поршня» (см. позицию 6 на рис. 1). Данные
варианте оттаивание проводили при атмосфер-
поршни использовали с целью предотвращения
ном давлении, для этого отпускали фиксирую-
возможного повреждения капсул из-за измене-
щую гайку 9 на охлажденной камере, после чего
ния объема суспензии в процессе подачи давле-
помещали камеру в водяную баню 30°С для отта-
ния или кристаллизации воды. При заполнении
ивания. Скорость оттаивания биоматериала со-
капсул следили, чтобы в них отсутствовали пу-
ставляла 20°С/мин.
зырьки воздуха во избежание повреждения кап-
Определение жизнеспособности клеток прово-
сул под высоким давлением.
дили двумя способами: 1) подсчитывали количе-
Капсулы с подготовленным биологическим
ство живых клеток в суспензии с помощью ви-
тального красителя трипанового синего, 2) ана-
материалом помещали во внутреннее простран-
лизировали функциональное состояние клеток
ство частично собранной камеры высокого дав-
ления, заполненное 50%-м раствором глицерина
методом их культивирования in vitro.
при комнатной температуре или при температуре
Краситель трипановый синий использовали в
4°С (в зависимости от схемы эксперимента). Ка-
виде 0.4%-го раствора, приготовленного на осно-
меру собирали в рабочее положение и помещали
ве фосфатного солевого буфера (Sigma Aldrich,
под поршень децимального пресса (рис. 1, пози-
США). Для окрашивания к 20 мкл клеточной сус-
ция
10). Давление нагнетали со скоростью
пензии добавляли 20 мкл раствора красителя и
150 бар/мин до уровня, указанного в эксперимен-
выдерживали 1 мин при комнатной температуре.
те, выдерживали пробы при максимальном дав-
Подсчет окрашенных (нежизнеспособных) и не-
лении 10 или 30 мин, после чего начинали сниже-
окрашенных (живых) клеток проводили с помо-
ние давления. До 100 бар скорость снижения дав-
щью автоматического счетчика клеток Countess II
ления составляла
150 бар/мин, последующее
Fl (Life Technologies, Великобритания). Жизне-
снижение давления вплоть до атмосферного дав-
способность рассчитывали как соотношение не-
ления осуществляли со скоростью 60 бар/мин.
окрашенных (живых) клеток к общему количе-
После этого доставали капсулы из камеры, извле-
ству клеток в суспензии и выражали в процентах.
кали из них клеточную суспензию и проводили
Для культивирования размороженных клеток
анализ клеток на жизнеспособность.
использовали шестилуночные планшеты (Costar,
Криоконсервация под давлением. Для криокон-
США). В каждую лунку вносили по 50 мкл кле-
сервации образцы клеточной суспензии помеща-
точной суспензии в 2 мл среды ДМЕМ с 10% ЭТС.
ли в капсулы, затем капсулы переносили в камеру
Клетки инкубировали при 37°С в увлажненной
высокого давления, как описано в предыдущем
атмосфере с 5% СО2 в течение 5 ч, затем проводи-
разделе. После достижения необходимого давле-
ли полную смену инкубационной среды для уда-
ния фиксировали поршень 8 фиксирующей гай-
ления не прикрепившихся мертвых клеток. Далее
кой 9 и переносили камеру либо непосредственно
через 11 ч оценивали количество клеток в каждой
в низкотемпературный холодильник с температу-
лунке с помощью CloneSelect Imager (Genetix, Ве-
рой -130°С (охлаждение со средней скоростью
ликобритания).
2°С/мин), либо сначала помещали камеру в тер-
моизолирующий пенопластовый контейнер, в
РЕЗУЛЬТАТЫ
котором переносили ее в низкотемпературный
холодильник (охлаждение со средней скоростью
Влияние высокого гидростатического давления
0.5°С/мин). Скорость охлаждения замеряли в
1.0, 1.5 и 2.0 кбар на жизнеспособность клеток
пробных экспериментах в диапазоне от 20°С до -
HeLa. Прежде чем приступить к экспериментам
100°С с помощью термометра АТТ-2004
по криоконсервации, мы оценили чувствитель-
(«АКТАКОМ», Россия). Хранение при темпера-
ность клеточной культуры HeLa к воздействию
туре -130°С проходило в течение 20 ч.
высокого гидростатического давления в пределах
1.0-2.0 кбар. Результаты эксперимента представ-
Оттаивание. Процедуру оттаивания проводили
лены в табл. 1.
в двух модификациях. В первом варианте оттаи-
вание, как и замораживание, проводили под вы-
Как видно из табл. 1, давление в 1.0 кбар не
соким давлением. Камеру с зафиксированным
только не оказывало негативного воздействия на
поршнем (рис. 1, позиция 8) помещали в водяную
клетки, а, напротив, стимулировало их развитие в
баню 30°С. После разогрева камеру перемещали
культуре. Экспозиция клеток под более высоким
под пресс, нагнетали давление, соответствующее
давлением (1.5 кбар) приводила к увеличению ко-
давлению замораживания, и отпускали фиксиру-
личества клеток с поврежденными мембранами и
ющую гайку 9. С помощью пресса плавно снима-
снижению показателей развития клеток в про-
ли давление до 100 бар со скоростью 150 бар/мин
цессе культивирования. При этом негативное
БИОФИЗИКА том 66
№ 1
2021
КРИОКОНСЕРВАЦИЯ КЛЕТОК HeLa
119
Таблица 1. Жизнеспособность клеток линий HeLa после воздействия гидростатического давления
Параметры воздействия давлением
Жизнеспособность клеток
Длительность
Количество развивающихся
Окрашивание трипановым
Давление, кбар
экспозиции под
клеток в культуре через 16 ч после
синим, % живых клеток ± SD
давлением, мин
воздействия, тыс.кл/см2 ± SD
Атмосферное (контроль)
-
98 ± 2
254 ± 22
1.0
60
95 ± 5
318 ± 9
60
40 ± 17
70 ± 6
1.5
10
87 ± 12
98 ± 13
2.0
10
5 ± 5
0
Примечание. Гидростатическое давление 1.0-2.0 кбар, температура 22°С (n = 5).
воздействие давления усиливалось как при уве-
рина мы проверяли при комнатной температуре,
личении давления, так и при увеличении дли-
так как для данного криопротектора токсичность
тельности экспозиции клеток под давлением.
слабо зависит от температуры, в то время как про-
После воздействия гидростатического давления
ницаемость глицерина через клеточные мембраны
2.0 кбар даже в течение относительно короткого
кардинально снижается при охлаждении растворов
промежутка времени (10 мин) клетки в культуре
[19, 20], и в действие могут вступать негативные ос-
не развивались, а небольшое количество клеток,
мотические эффекты. Токсичность этиленгликоля
оставшихся морфологически нормальными, де-
оценивали как при комнатной температуре, так и
градировали и разрушались в течение нескольких
при температуре 0°С в связи с тем, что в соответ-
часов.
ствии с разными методиками криоконсервации до-
бавление и отмывание этого криопротектора может
Токсичность криопротекторов при давлении
происходить как при комнатной, так и при пони-
1 кбар. Давление оказывает воздействие не только
на кристаллизацию воды, но и на взаимодействие
женной температуре [21]. Остальные криопротек-
различных веществ между собой. Соответственно,
торы добавляли и отмывали при 0°С, как это при-
давление может оказывать влияние на взаимодей-
нято в практике криоконсервации. В табл. 2 пред-
ствие криопротекторов с клеточной мембраной,
ставлены результаты воздействия криопротекторов
белками и другими структурами клетки и усиливать
на клетки HeLa при нормобарии и под давлением
токсичность криопротекторов. Воздействие глице-
1 кбар, не оказывающим негативного влияния на
Таблица 2. Жизнеспособность клеток линий HeLa при нормобарии и после воздействия гидростатического
давления
Жизнеспособность клеток после
Жизнеспособность клеток после
экспозиции под давлением 1.0 кбар
экспозиции при нормобарии (Контроль)
(Опыт)
Криопротектор и
Количество
Количество
температура экспозиции,
Окрашивание
Окрашивание
развивающихся в
развивающихся в
°С
трипановым
трипановым синим,
культуре клеток
культуре клеток
синим, % живых
% живых
через 16 ч после
через 16 ч после
клеток ± SD
клеток ± SD
тыс.кл/см2 ± SD
тыс.кл/см2 ± SD
Контроль без
96 ± 4
299 ± 12
98 ± 2
260 ± 25
криопротекторов
Глицерин 10%, 22°С
95 ± 3
168 ± 19
99 ± 1
191 ± 20
Этиленгликоль 10%, 22°С
99 ± 1
88 ± 32
98 ± 1
180 ± 26
Этиленгликоль 10%, 0°С
89 ± 5
72,5 ± 16
99 ± 1
195 ± 17
1,2-Пропандиол 10%, 0°С
98 ± 1
40 ± 17
99 ± 1
152 ± 22
ДМСО 10%, 0°С
99 ± 1
44 ± 18
99 ± 1
203 ± 25
ДМСО 6.6% + формамид
81 ± 8
11 ± 3
95 ± 2
217 ± 22
3.4%, 0°С
Примечание. Гидростатическое давление 1.0 кбар в течение 10 мин при 22°С или 0°С в присутствии криопротекторов (n = 5).
БИОФИЗИКА том 66
№ 1
2021
120
УГРАИЦКАЯ и др.
Таблица 3. Жизнеспособность клеток линий HeLa после воздействия гидростатического давления в присутствии
криопротекторов глицерина и этиленгликоля
Жизнеспособность клеток после экспозиции под давлением
Криопротектор
Давление, кбар
Количество развивающихся в
Окрашивание трипановым
культуре клеток через 16 ч после
синим, % живых клеток ± SD
воздействия, тыс.кл/см2 ± SD
Контроль (без
Нормобария
98 ± 2
224 ± 41
криопротекторов)
Контроль (без
90 ± 10
102 ± 14
криопротекторов )
1,5
Глицерин 10%
95 ± 4
168 ± 39
Этиленгликоль 10%
90 ± 9
87 ± 30
Контроль (без
7 ± 6
0
криопротекторов)
2,0
Глицерин 10%
88 ± 5
51 ± 12
Этиленгликоль 10%
90 ± 6
47 ± 9
Примечание. Время воздействия 10 мин при температуре 22°С (n = 5).
жизнеспособность интактных клеток. Глицерин,
сутствии этиленгликоля суспензия содержала
известный как ма-лотоксичный криопротектор, не
90% живых клеток, при этом в культуре часть кле-
проявил токсичности и в условиях давления
ток прикреплялась к субстрату, в то время как в
1.0 кбар. Экспозиция клеток в растворе прочих
контроле при приложении аналогичного давле-
криопротекторов под давлением приводила к за-
ния в отсутствие криопротекторов наблюдали
метному угнетению последующего роста клеток в
только 7% живых клеток, а при помещении их в
культуре. В целом токсическое воздействие крио-
культуру через 16 ч культивирования живых кле-
протекторов под давлением можно расположить в
ток в культуре не обнаруживали. Однако при экс-
следующем ряду: глицерин < этиленгликоль < 1,2-
позиции клеток под давлением 1.5 кбар этилен-
пропандиол = ДМСО < ДМСО + формамид.
гликоль не оказывал какого-либо влияния на
Баропротекторные свойства глицерина и эти-
жизнеспособность клеток (см. табл. 3).
ленгликоля при давлении 1.5 и 2.0 кбар. Для оцен-
Криоконсервация клеток под давлением. Для
ки баропротекторных свойств криопротекторов
экспериментов по криоконсервации клеток под
мы оценивали влияние 10%-го глицерина и 10%-
давлением были отобраны криопротекторы гли-
го этиленгликоля на состояние клеток HeLa по-
церин и этиленгликоль в связи с тем, что эти ве-
сле экспозиции под давлением 1.5 и 2.0 кбар в те-
щества проявили наиболее низкую токсичность в
чение 10 мин при комнатной температуре (без
условиях высокого гидростатического давления
охлаждения и замораживания). Результаты пред-
1 кбар и проявляли баропротекторные свойства
ставлены в табл. 3.
при 1.5 и 2.0 кбар. Мы тестировали два режима за-
Глицерин существенно повышал выживае-
мораживания под давлением со скоростью замо-
мость клеток, подвергшихся воздействию давле-
раживания 0.5°С/мин и 2°С/мин и два режима от-
ния, при этом достоверно улучшалось как состо-
таивания - под высоким гидростатическим дав-
яние клеточных мембран, так и развитие клеток в
лением и в условиях нормального атмосферного
культуре после экспозиции под давлением. Баро-
давления. Последний вариант криоконсервации
протекторное действие глицерина отмечалось
(замораживание под давлением, оттаивание при
при разном уровне давления.
нормобарии) был включен в схему эксперимен-
Проявление баропротекторных свойств эти-
тов на основании работы [12], так как именно при
ленгликоля зависело от уровня приложенного
такой схеме авторы получили наиболее высокую
давления. Добавление этиленгликоля при крити-
сохранность замороженно-оттаянных эритроци-
ческом давлении 2.0 кбар, которое вызывало ги-
тов. Однако скорость замораживания в нашей ра-
бель клеток без криопротекторов, приводило к
боте отличалась, так как для клеточных культур
повышению выживаемости клеток. Так после
оптимальными являются более медленные ско-
экспозиции клеток под давлением 2.0 кбар в при-
рости замораживания, чем для эритроцитов [22,
БИОФИЗИКА том 66
№ 1
2021
КРИОКОНСЕРВАЦИЯ КЛЕТОК HeLa
121
Таблица 4. Жизнеспособность клеток HeLa после криоконсервации под гидростатическим давлением
Выживаемость культуры
Выживаемость клеток
клеток
контрольной группы
экспериментальной
(замораживание и
группы
размораживание при
нормобарии по
идентичному
Скорость
температурному
охлажде-
Давление
протоколу)
Давление
ния при
при замора-
Криопротектор
при размора-
замора-
живании,
Окраши-
Количество
Тест на
Количество
живании, кбар
живании,
кбар
вание
развивающи
окрашивание
разви-
°С/мин
трипано-
хся клеток
трипановым
вающихся
вым синим,
через 16 ч
синим, %
клеток
% живых
культивиров
живых клеток
через 16 ч
клеток ± SD
ания,
культиви-
тыс.кл/см2
рования,
± SD
тыс.кл/см2
± SD
Контроль без
2
1.0
1.0
0
0
53 ± 15
26 ± 20
криопротектора
Этиленгликоль,
1.0
1.0
0
0
10%
0.5
99 ± 1
185 ± 40
1.5
1.5
0
0
Этиленгликоль,
2
1.0
1.0
0
0
99 ± 1
162 ± 10
10%
Глицерин, 10%
1.0
1.0
30 ± 10
41 ± 30
0.5
99 ± 1
174 ± 27
1.5
1.5
78 ± 6
20 ± 18
Глицерин, 10%
2
1.0
1.0
28 ± 25
10 ± 10
90 ± 5
181 ± 30
Глицерин, 10%
1.0
Нормобария
80 ± 20
60 ± 19
0.5
99 ± 1
169 ± 37
1.5
Нормобария
10 ± 9
0
Глицерин, 10%
2
1.0
Нормобария
83 ± 16
165 ± 27
99 ± 1
147 ± 60
Примечание: n = 5.
23]. Результаты экспериментов по криоконсерва-
скоростью замораживания
0.5°С/мин. После
ции клеточной культуры представлены в табл. 4.
криоконсервации под давлением 1.5 кбар тест с
трипановым синим выявлял 70-80% живых кле-
Криоконсервация клеток линии HeLa по мед-
ток, при этом клетки частично сохраняли способ-
ленному протоколу замораживания под давлени-
ность прикрепляться к субстрату и пролифериро-
ем 1.0 и 1.5 кбар не привела к повышению выжи-
вать - через 16 ч культивирования замороженно-
ваемости клеток HeLa по сравнению с классиче-
оттаянных проб наблюдали морфологически
ской криоконсервацией при атмосферном
нормальную развивающуюся культуру с плотно-
давлении. При испытании режимов, предусмат-
ривающих как замораживание, так и разморажи-
стью 20 ± 18 тыс. кл./см2. Тем не менее эти пока-
вание под давлением, наиболее высокую степень
затели были значительно ниже в сравнении с раз-
жизнеспособности демонстрировали клетки, за-
витием клеток, криоконсервированных по анало-
мороженные в присутствии 10%-го глицерина со
гичному протоколу под атмосферным давлением.
БИОФИЗИКА том 66
№ 1
2021
122
УГРАИЦКАЯ и др.
ентном давлении (рис. 2). В экспериментах мы
зафиксировали, что развитие клеток линии HeLa
в культуре после замораживания под давлением
1.0 кбар со скоростью 2°С/мин и оттаивании без
приложения давления была несколько выше, чем
в контрольной группе с аналогичным режимом
замораживания/оттаивания без применения дав-
ления. Однако улучшение выживаемости клеток
при применении давления было небольшим и
статистически недостоверным. При этом хотя
развитие клеток в культуре было сопоставимо с
контролем, тест на целостность клеточных мем-
бран по окрашиванию с трипановым синим вы-
явил негативное влияние давления на состояние
клеточных мембран.
ОБСУЖДЕНИЕ
Наши эксперименты показали, что клетки ли-
нии HeLa обладают довольно высокой устойчи-
востью к воздействию высокого гидростатиче-
ского давления. Толерантность животных клеток
разного происхождения к давлению порядка
1.0 кбар может довольно существенно отличать-
ся. Например, воздействие давлением выше 700-
800 бар даже в течение нескольких минут вызыва-
ет необратимые изменения в культуре фибробла-
стов эмбриональной ткани сердца цыпленка [24].
В то же время ряд других клеточных культур
(клетки эндотелия пупочной вены, клетки глад-
кой мускулатуры, культура 3NIH/3T3) легко пе-
реносит давление до 1.0 кбар при условии, что
экспозиция под высоким давлением длится не
более 10 мин [25]. Давление 1,0 кбар может ини-
циировать клеточный апоптоз, что приводит к
угнетению или гибели клеточной культуры при
дальнейшем культивировании. Такое воздей-
ствие зафиксировано для ряда клеточных линий,
включая лимфобласты человека и ганглионарные
клетки сетчатки [26-28].
В наших экспериментах давление 1.0 кбар не
только не угнетало клетки HeLa, но и оказывало
на них стимулирующее воздействие. Повышение
же давления до более высоких значений (1.5 кбар)
вызывало в процессе культивирования снижение
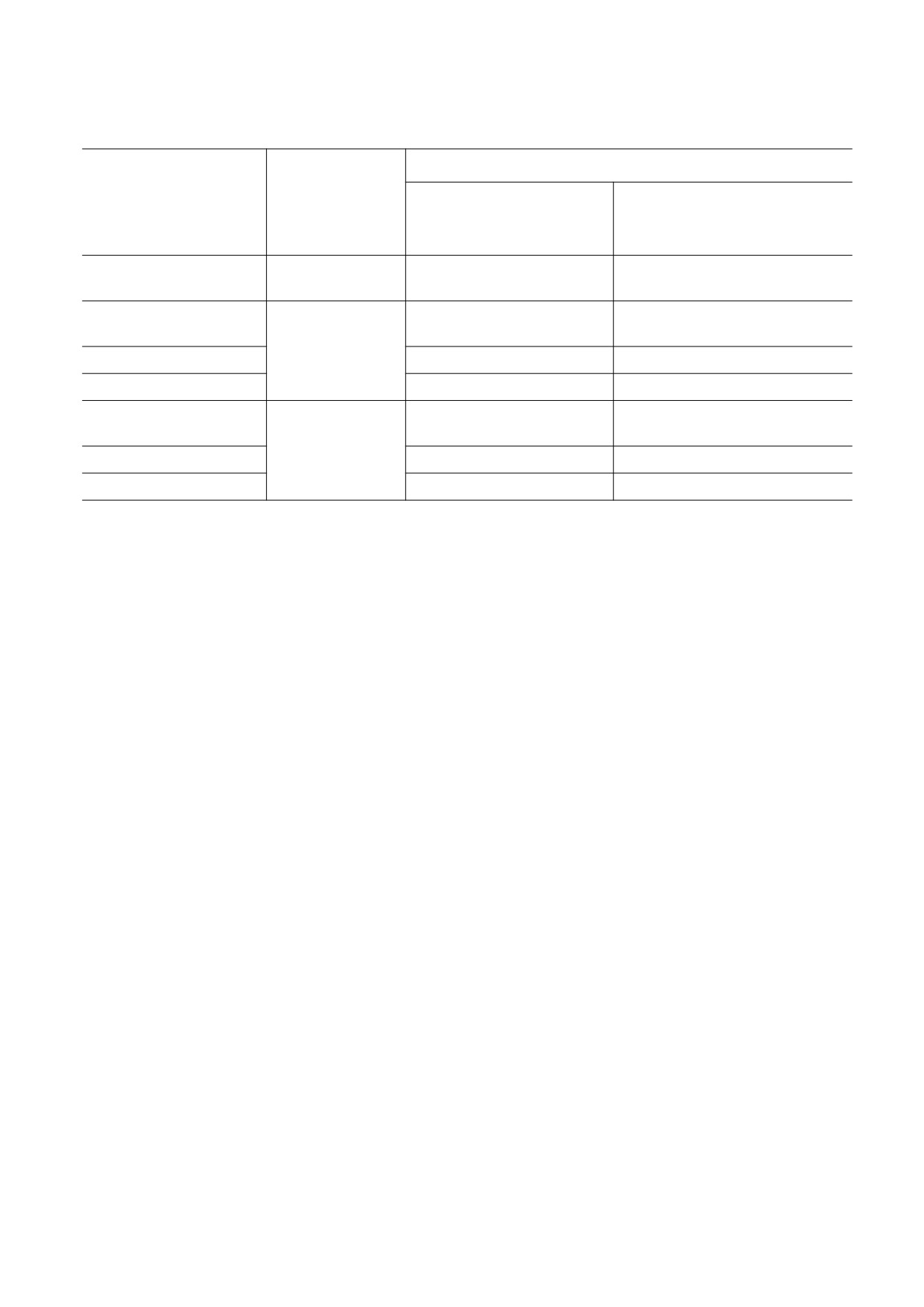
Рис. 2. Культура HeLa через 16 ч культивирования:
скорости прикрепления клеток к субстрату и за-
(а) - нативная культура; (б) - после криоконсерва-
держку роста клеточной культуры (табл. 1).
ции под давлением с 10%-м глицерином, заморажи-
Исследование воздействия криопротекторов в
вание под давлением 1 кбар со скоростью 2°С/мин,
размораживание при нормобарии; (в) - после крио-
условиях высокого гидростатического давления
консервации при нормобарии, другие параметры
на клетки HeLa выявило, что высокое гидроста-
протокола замораживания/оттаивания аналогичны
группе «б».
тическое давление оказывает существенное влия-
ние на проявление токсичности. После экспози-
ции клеточной культуры с криопротекторами под
Наиболее высокая выживаемость клеток
давлением 1.0 кбар, которое само по себе не ока-
HeLa была выявлена при их криоконсервации
зывало негативного воздействия на клетки HeLa
под защитой 10% глицерина по гибридному про-
(см. эксперимент 1), выживаемость клеток в це-
токолу: замораживание под высоким гидростати-
лом оказалась значительно ниже, чем при экспо-
ческим давлением, размораживание при амби-
зиции с криопротекторами при нормобарии
БИОФИЗИКА том 66
№ 1
2021
КРИОКОНСЕРВАЦИЯ КЛЕТОК HeLa
123
(табл. 2). При этом токсичность криопротекторов
гидростатического давления, что согласуется с
под давлением изменялась в разной степени. При
литературными данными [34-36]. Этиленгли-
нормобарии такие криопротекторы, как глице-
коль в качестве баропротектора проявил себя не-
рин, ДМСО и этиленгликоль, проявляли прибли-
однозначно. Этот криопротектор способствовал
зительно одинаковую токсичность в отношении
выживанию клеток HeLa при воздействии давле-
клеток HeLa. Однако при экспозиции под давле-
ния 2.0 кбар, но не оказал защитного воздействия
нием 1.0 кбар выживаемость клеточной культуры
при экспозиции клеток под давлением 1.5 кбар
в присутствии этиленгликоля была вдвое хуже,
(табл. 3). Это говорит о том, что, вопреки мнению
чем в присутствии глицерина, а в присутствии
некоторых авторов [34], не всегда криопротекто-
ДМСО и 1,2-пропандиола - почти вчетверо. Ин-
ры проявляют защитный эффект при воздей-
тересно, что негативное воздействие этиленгли-
ствии высокого давления на животные клетки.
коля на клетки практически не зависело от темпе-
Для экспериментов по криоконсервации под
ратуры. Экспозиция с этим криопротектором под
давлением мы отобрали глицерин и этиленгли-
давлением при температуре 22°С и 0°С приводила
коль как самые перспективные в связи с низкой
к последующему замедлению роста клеточной
токсичностью, которую эти криопротекторы
культуры приблизительно в равной степени
проявили под давлением без замораживания.
(табл. 2).
Кроме того, глицерин обладает выраженным ба-
Следует обратить особое внимание на смесь
ропротекторным действием, что делает примене-
криопротекторов ДМСО и формамида. Считает-
ние этого криопротектора для криоконсервации с
ся, что эти два криопротектора обладают свой-
использованием высокого гидростатического
ством частично нейтрализовать токсическое воз-
давления особенно привлекательным. Криокон-
действие друг друга на клетки млекопитающих
сервацию проводили либо под давлением
[29-31]. Такое сочетание криопротекторов часто
1.0 кбар, т.е. применяли тот уровень давления,
применяют в витрифицирующих растворах, где
который в предварительных экспериментах не
требуется крайне высокая концентрация стеклу-
оказал негативного воздействия на клетки, либо
ющих агентов [30, 32, 33]. Действительно, в на-
под давлением 1.5 кбар. Криоконсервация под
ших экспериментах при атмосферном давлении
давлением по медленному протоколу в наших
такое сочетание криопротекторов не оказывало
экспериментах не привела к повышению выжи-
токсического воздействия на клетки HeLa. Одна-
ваемости биологического материала по сравне-
ко в условиях повышенного гидростатического
нию с традиционной криоконсервацией при ам-
давления смесь ДМСО и формамида оказала
биентном давлении. Более того, замораживание
крайне негативное воздействие на жизнеспособ-
под давлением чаще всего приводило к резкому
ность клеток. Выживаемость после экспозиции
ухудшению выживаемости клеток по сравнению
под давлением в присутствии смеси 6.6% ДМСО
с контролем. Исключением оказался вариант,
и 3.4% формамида была вчетверо хуже, чем после
предусматривающий смешанный протокол при-
экспозиции под давлением в присутствии 10%
менения давления (замораживание под давлени-
ДМСО (табл. 2). В последующих работах по ис-
ем 1.0 кбар, размораживание при атмосферном
следованию криоконсервации биоматериала под
давлении) и глицерин в качестве криопротектора.
высоким гидростатическим давлениеми необхо-
Выживаемость клеток HeLa при криоконсерва-
димо с особой осторожностью вводить в состав
ции по такому протоколу была сравнима с выжи-
криозащитных сред формамид, а возможно, и
ваемостью в контроле, после криоконсервации
другие карбоксамиды.
без применения высокого давления. Следует от-
Считается, что все или большинство криопро-
метить, что этот режим наиболее близок к тому,
текторов обладают баропротекторными свой-
что использовался в работе [12] для заморажива-
ствами [34] и могут повышать выживаемость
ния эритроцитов. В этой работе использование
биологических объектов под высоким гидроста-
высокого гидростатического давления в техноло-
тическим давлением. В связи с высокой толе-
гии криоконсервации эритроцитов существенно
рантностью клеток HeLa к высокому гидростати-
повысило их сохранность после замораживания-
ческому давлению мы исследовали баропротек-
оттаивания. Возможно, это объясняется тем, что
торные свойства криопротекторов только при
эритроциты являются безъядерными клетками и
давлении 1.5 и 2.0 кбар. Для исследований были
по физиологии существенно отличаются от ис-
отобраны криопротекторы, показавшие низкую
пользованной нами культуры клеток HeLa. Един-
токсичность под давлением. Глицерин проявлял
ственная известная из литературных данных по-
баропротекторные свойства и способствовал вы-
пытка замораживания клеток HeLa под давлени-
живанию клеток после воздействия высокого
ем [13], так же как и в наших экспериментах, не
БИОФИЗИКА том 66
№ 1
2021
124
УГРАИЦКАЯ и др.
выявила положительного эффекта от примене-
11. D. Vanhecke, W. Graber, and D. Studer, Methods Cell
ния высокого гидростатического давления в про-
Biol. 88, 151 (2008).
цессе криоконсервации клеток.
12. N. Greer, Cryobiology 70, 66 (2015).
В целом можно заключить, что в наших экспе-
13. J. Huebinger, H. M. Han, and M. Grabenbauer, PLoS
риментах использование высокого гидростатиче-
One 11 (10), e0164270 (2016).
ского давления при криоконсервации не привело
14. H. Mikus, A. Miller, G. Nastase, et al., Biochem. Bio-
к повышению выживаемости биологического ма-
phys. Res. Commun. 477 (3), 401 (2016).
териала после замораживания-оттаивания. В то
15. M. J. Powell-Palm, Y. Zhang, J. Aruda, and B. Rubin-
же время нужно отметить, что мы работали по ме-
sky, Cryobiology 86, 130 (2019).
тоду медленной или классической криоконсерва-
16. L. Wan, M. J. Powell-Palm, C. Lee, A. Gupta,
ции. Механизмы, обеспечивающие сохранность
B. P. Weegman, M. G. Clemens, B. Rubinsky, Bio-
биологического материала при медленной крио-
chem. Biophys. Res. Commun. 496 (3), 852 (2018).
консервации и при витрификации существенно
17. L. Wan, M. J. Powell-Palm, M. G. Clemens, and
отличаются. Использование высокого гидроста-
B. Rubinsky, CryoLett. 40 (1), 64 (2019).
тического давления для замораживания биомате-
риала методом витрификации практически не ис-
18. R. I. Freshney, Culture of Animal Cells: A Manual of Ba-
следовано и может привести к другим резуль-
sic Technique (5th Ed.), (Hoboken, John Wiley & Sons,
татам.
Inc, New York, 2005).
19. S. Jackowski, S. P. Leibo, and P. Mazur, J. Exp. Zool.
212 (3), 329 (1980).
КОНФЛИКТ ИНТЕРЕСОВ
20. J. Wang, K. Zhu, G. Zhao, et al., PLoS One. 8 (9),
Авторы заявляют об отсутствии конфликта
e72836 (2013).
интересов.
21. E. C. Rivas Leonel, C. M. Lucci, and C. A. Amorim,
Transfus. Med. Hemother. 46 (3), 173 (2019).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
22. C. Philippeos, R. D. Hughes, A. Dhawan, and
R. R. Mitry, Methods Mol. Biol. 806, 1 (2012).
Настоящая работа не содержит описания ис-
следований с использованием людей и животных
23. J. M. Baust, G. C. Buehring, L. Campbell, et al., In Vi-
в качестве объектов.
tro Cell Dev. Biol. Anim. 53 (8), 669 (2017).
24. J. V. Landau, Exp. Cell Res. 21, 78 (1960).
СПИСОК ЛИТЕРАТУРЫ
25. A. Mahara, N. Morimoto, T. Sakuma, et al., Biomed.
Res. Int. 2014, 379607 (2014).
1. H. Kanno, R. J. Speedy, and C. A. Angell, Science 189,
880 (1975).
26. K. J. Takano, T. Takano, Y. Yamanouchi, and T. Satou,
Exp. Cell Res. 235, 155 (1997).
2. H. Kanno and C. A. Angell, J. Phys. Chem. 81, 2639
(1977).
27. A. Agar, S. Li, N. Agarwal, et al., Brain Res. (2006)
1086, 191 (2006).
3. K. Miyata, S. Hayakawa, K. Kajiwara, and H. Kanno,
Cryobiology 65, 113 (2012).
28. T. Yamaguchi, K. Hashiguchi, S. Katsuki, et al., Cell
Mol. Biol. Lett. 13, 49 (2008).
4. M. D. Persidsky, Cryobiology 8, 380 (1971).
5. А. М. Воротилин, С. Д. Корчиков и Л. В. Гор-
29. S. Baxter and G. Lathe, Biochem. Pharmacol. 30, 1079
диенко, Криобиология и криомедицина 2,
65
(1971).
(1976).
30. G. M. Fahy, T. H. Lilley, H. Linsdell, et al., Cryobiol-
6. X. Yu Zhang, Z. Chen, and G. Chen, Cryobiology 66,
ogy 27, 247 (1990).
186 (2013).
31. G. M. Fahy, Cryobiology. 60 (Suppl. 3), S45 (2010).
7. G. M. Fahy, D. I. Levy, and S. E. Ali, Cryobiology 24,
32. G. M. Fahy, B. Wowk, J. Wu, and S. Paynter, Cryobi-
196 (1987).
ology 48, 22 (2004).
8. A. Aertsen, F. Meersman, M. E. Hendrickx, et al.,
33. G. M. Fahy and B. Wowk, Methods Mol. Biol. 1257, 21
Trends Biotechnol. 27 (7), 434 (2009).
(2015).
9. А. В. Карнаухов, Э. Н. Гахова и Е. В. Карнаухова, в
34. А. Е. Крисс, Жизненные процессы и гидро-
кн. Консервация генетических ресурсов. Материалы
статическое давление (Наука, М., 1973).
XV рабочего совещания, под ред. Э. Н. Гаховой,
В. Н. Карнаухова и В. К. Утешева. (Пущино, 1998),
35. L. F. Onuchic and F. Lacaz-Vieira, Cryobiology 22 (5),
сс.104-111.
438 (1985).
10. R. Dahl and L. A. Staehelin, J. Electron. Microsc.
36. A. C. Oliveira, L. P. Gaspar, A. T. Da Poian, and
Tech. 13 (3), 165 (1989).
J. L. Silva, J. Mol. Biol. 240, 184 (1994).
БИОФИЗИКА том 66
№ 1
2021
КРИОКОНСЕРВАЦИЯ КЛЕТОК HeLa
125
Cryopreservation of HeLa Cells under High Hydrostatic Pressure of 1.0-1.5 kbar
S.V. Ugraitskaya, N.V. Shishova, E.R. Valeeva, S.A. Kaurova,
N.E. Shvirst, and E.E. Fesenko (Jr.)
Institute of Cell Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
The idea of using high pressure to reduce the freezing damage has been thoroughly theorized thus far, but
there is little experimental evidence on cryopreservation of living systems under high hydrostatic pressure. We
investigated the viability of HeLa cells under pressure of 1.0-2.0 kbar, the toxic effects of five classical cryo-
protectants under these conditions, as well as the viability of HeLa cells during slow (conventional) cryopres-
ervation under pressure of 1.0 and 1.5 kbar. High resistance of HeLa cells to hydrostatic pressure was experi-
mentally shown: 100% cell survival upon exposure to 1.0 kbar of pressure for 60 min of incubation. The toxic
effects of cryoprotectants under pressure can be arranged in the following order: glycerol < ethylene glycol <
1,2-propanediol = DMSO < DMSO+formamide. Glycerol and ethylene glycol were the least toxic agents,
which also exerted pronounced baroprotective effects. During cryopreservation under pressure of 1.0 kbar a
high survival rate of 83 ± 16% according to fluorescent staining data was achieved using 10% glycerol, but it
did not exceed the survival rates obtained in control normobaric experiments. Freezing was carried out by the
method of slow conventional cryopreservation. Using high pressure to freeze biomaterial by vitrification may
lead to different results.
Keywords: cryopreservation, hydrostatic pressure, cryoprotectants, baroprotectors, glycerol, formamide
БИОФИЗИКА том 66
№ 1
2021