БИОФИЗИКА, 2021, том 66, № 1, с. 137-146
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 57-013
РОЛЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ КЛЕТОЧНЫХ СТЕНОК
КОРНЕЙ В ПОГЛОЩЕНИИ МЕДИ РАСТЕНИЯМИ ВИКИ НАРБОНСКОЙ
© 2021 г. Н.Р. Мейчик, Ю.И. Николаева, О.В. Никушин, М.А. Кушунина
Биологический факультет Московского государственного университета имени М.В. Ломоносова,
119234, Москва, Ленинские горы, 1/12
E-mail: mkushunina@gmail.com
Поступила в редакцию 29.11.2019 г.
После доработки 08.06.2020 г.
Принята к публикации 14.09.2020 г.
Проведен сравнительный анализ накопления меди корнями растений вики нарбонской (Vicia nar-
bonensis L.) и изолированными из них клеточными стенками. Установлено, что основным местом
накопления ионов меди у интактных растений является корневая система, а клеточные стенки
корней характеризуются высоким содержанием карбоксильных групп полигалактуроновой
кислоты, что обуславливает их высокую связывающую способность в отношении ионов меди.
Полученные результаты показывают, что основной стратегией защиты растений вики нарбонской
от повышенных концентраций меди в окружающей среде является предотвращение накопления
ионов этого металла в цитоплазме клеток корня путем депонирования их в клеточную стенку.
Ключевые слова: клеточная стенка, адсорбция, ионообменные группы, тяжелые металлы
DOI: 10.31857/S0006302921010154
тели полагают, что в ответе на Ме-стресс внутри-
В настоящее время загрязнение почв тяжелы-
клеточные механизмы защиты играют главен-
ми металлами (ТМ) является серьезной экологи-
ствующую роль. Эти механизмы включают
ческой проблемой. Для растений ТМ в высоких
метаболическую инактивацию ионов ТМ путем
концентрациях становятся мощными ингибито-
их хелатирования и/или компартментализации в
рами жизненных процессов, вызывают множе-
вакуоли [6]. Как правило, в подобного рода ис-
ственные нарушения метаболизма, снижение
следованиях растения помещают на среду с повы-
продукционного потенциала и даже гибель. Из-
шенной концентрацией металла и исследуют от-
быток ТМ в растительных клетках вызывает ши-
веты растений на действие Me-стресса, избавля-
рокий спектр токсических реакций: деструкцию
ясь каким-либо способом от клеточной стенки,
клеточных мембран, нарушение организации ци-
чтобы устранить ее влияние.
тоскелета и ингибирование ферментов и, как
следствие, ингибирование процессов фотосинте-
В то же время проблема детоксикации меди в
за, дыхания, клеточного деления, ионного транс-
апопласте изучена недостаточно, хотя клеточная
порта и т.д. [1-3]. В то же время некоторые из ТМ
стенка (КС) клеток корня первой вступает в кон-
являются необходимыми для жизнедеятельности
такт с ионами ТМ почвенного раствора и являет-
растений элементами. Так, медь является микро-
ся первым барьером на пути их проникновения в
элементом для всех растений. В качестве кофак-
протопласт. Наличие у КС способности к связы-
тора она входит в состав многих ферментов и бел-
ванию ионов ТМ, зависящей от физико-химиче-
ков, таких как цитохромоксидаза электрон-
ских свойств этого компартмента клетки, может
транспортной цепи митохондрий, пластоцианин,
быть движущей силой их поступления в корень из
некоторые формы супероксиддисмутаз.
почвенного раствора и создавать конкуренцию
Внутриклеточные защитные механизмы, реа-
поглощению симпластом, особенно при низких
лизуемые у растений в ответ на «металл-стресс»
концентрациях металла [7, 8].
(Ме-стресс), широко изучаются и обсуждаются
Для оценки роли апопласта корней в поглоще-
научным сообществом, и освещены в достаточ-
нии ТМ растениями используются различные ме-
ном количестве обзоров [4, 5]. Многие исследова-
тоды, включая физико-химическое фракциони-
рование ионов ТМ [7, 9], энергодисперсионную
Сокращения: ТМ - тяжелые металлы, Ме-стресс - металл-
стресс, КС - клеточная стенка, ПГК - полигалактуроно-
рентгеновскую спектроскопию [10], дифферен-
вая кислота.
циальное поглощение при разных температурах
137
138
МЕЙЧИК и др.
[11] и метод сравнительной оценки поглощения
где Gк и GКС, соответственно, сухая масса корней
металла корнями транспирирующих растений и
и выделенных из них КС, г.
выделенной из них КС при одинаковых условиях
Исследование ионогенных групп в составе кле-
внешней среды [12].
точных стенок корней проводили методом потен-
Как было показано ранее, изолированная КС
циометрического титрования, как описано ранее
корней вики нарбонской характеризуется самым
[16], при постоянной ионной силе раствора
(100 мМ), которую создавали добавлением NaCl.
высоким содержанием карбоксильных групп в
Число типов ионообменных групп в КС (j), а так-
составе пектинов [13] по сравнению с другими бо-
же их количество (ΔSj) определяли по дифферен-
бовыми, однако роль КС в поглощении Cu2+ эти-
циальным кривым (dSi/dpHi) = f(pHi), как описа-
ми растениями не установлена.
но ранее [16]. Степень ионизации (αi) для каждой
Цель работы состояла в определении ионооб-
группы рассчитывали по формуле:
менной способности клеточных стенок, изолиро-
ванных из корней вики нарбонской, в отношении
αi = Sij/ΔSj,
(2)
ионов меди при разных концентрациях металла в
среде и в оценке роли апопласта в поглощении
где Sij - количество диссоциированных групп j-го
Cu2+ этими растениями.
типа при рНi.
Чтобы рассчитать константу ионизации для каж-
дой ионообменной группы, использовали моди-
МАТЕРИАЛЫ И МЕТОДЫ
фицированное Грегором уравнение Хендерсона-
Хассельбаха:
Объектом исследования служили растения ви-
ки нарбонской (Vicia narbonesis L.) сорта Sel2384.
pH = pKa+nlg(α/(1-α)),
(3)
Растения выращивали в водной культуре в клима-
где pKa - кажущаяся константа ионизации ионо-
тической камере
(24°С, интенсивность света
обменной группы полимера, α - степень ее иони-
~110 мкмоль/м2×с, 14-часовой световой день)
зации, n - константа, зависящая от строения по-
при постоянной аэрации растворов и их замене
лимерной матрицы и природы противоиона [17].
каждые семь суток. В экспериментах использова-
Используя установленные значения парамет-
ли 9(10)-дневные растения, выращенные на рас-
творе с низким содержанием элементов мине-
ров (ΔSj, рКaj, nj), рассчитывали Siрас по суммар-
рального питания (~0.2 мМ K+, NO3- и PO43-) и
ному уравнению [16]:
14(15)-дневные растения, выращенные на 0.1 сре-
k,m
j
рас
кат
ΔS
ды Прянишникова (в мМ: NH4NO3
- 3.0,
S
=S
–
,
i
о
j
(4)
pK
a
-pH
i
MgSO4 - 0.5, KCl - 2.0, CaSO4 ⋅ 2H2O - 2.0,
ji=1
j
n
1+10
CaHPO4 ⋅ 2H2O - 1.0, FeCl3 - 0.15).
где Siрас - расчетное значение ионообменной
Выделение полимерного матрикса клеточных
способности КС при соответствующем значении
стенок. Проводили из интактных корней по опи-
санному ранее методу [14]. Навески корней (~1 г)
pHi; Sокат - максимальная катионообменная спо-
помещали в колбы и промывали последовательно
собность КС; ΔSj - количество ионообменных
1%-м раствором NaОН (~0.3 л, в течение 24 ч, при
постоянном перемешивании), H2O (~2 л), 1%-м
групп j-го типа; Sокат, ΔSj и Siрас выражены в
раствором HCl (~0.3 л, в течение 24 ч, при посто-
мкмоль/г сухой массы КС; pKaj - кажущаяся кон-
янном перемешивании) и дистиллированной во-
станта ионизации ионообменных групп j-го типа;
дой до исчезновения в промывных водах хлорид-
nj - константа уравнения (3) для ионообменных
ионов. Затем определяли сырую и сухую (после
высушивании при 60°С) массу препарата КС.
групп j-го типа; k - число точек на потенциомет-
Данный метод стандартизации, т.е. переведения
рической кривой, m - число типов ионообмен-
всех имеющихся в структуре КС катионообмен-
ных групп.
ных групп в Н+-форму, а анионообменных - в
Адекватность примененного подхода к описа-
форму свободного амина, позволяет проводить
нию кислотно-основного равновесия оценивали
сравнительное исследование сорбционных
методом регрессионного анализа, определяя па-
свойств ионообменных материалов с различной
раметры уравнения:
структурой функциональных групп [14, 15]. Долю
сухой массы КС (GКС) в сухой массе корней (%)
Siрасч=B×Siэксп + A,
(5)
определяли по формуле:
где Siрасч и Siэксп - рассчитанная по уравнению
GКС = (GКС/Gк)×100,
(1)
(4) и экспериментально определенная ионооб-
БИОФИЗИКА том 66
№ 1
2021
РОЛЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ
139
менная способность при соответствующем значе-
(С
−C
)×V
0
i
S
=
,
(7)
нии pHi, мкмоль/г сухой массы КС; A и B - пара-
Cu
g
метры регрессии.
где SCu - сорбционная способность КС в отно-
Поглощение ионов меди транспирирующими
шении ионов Cu2+, мкмоль/г сухой массы КС; C0
растениями. Растения вики 9- или 14-дневного
возраста, выращенные как указано выше, пере-
и Ci - исходная и конечная концентрации Cu2+ в
носили в сосуды объемом 150 мл (по три растения
растворе, мМ; V - объем раствора, мл; g - сухая
в каждом сосуде) с растворами CuCl2 с концен-
навеска образца КС, г.
трацией 10, 50 или 100 мкМ (рН 5.0 ± 0.1) и выдер-
Статистическая обработка данных. Опыты про-
водили в трех-шести биологических повторно-
живали в климатической камере 24 ч при непре-
стях для каждой концентрации CuCl2. Обработку
рывной аэрации растворов (опытные растения).
Контрольные растения выдерживали 24 ч на ис-
данных проводили с помощью программ Micro-
soft Excel и IBM SPSS Statistics. Приведены сред-
ходных питательных растворах без добавления
ние значения и их стандартные отклонения или
CuCl2 (концентрация Cu2+ ≤ 0.5 мкМ).
ошибки. Достоверность различий между изучае-
По истечении 24 ч половину опытных и кон-
мыми показателями определяли с помощью двух-
выборочного t-критерия Стьюдента. Различия
трольных растений извлекали из раствора, разде-
считали достоверными при p < 0.05.
ляли на надземную часть и корни, взвешивали, а
затем высушивали в термостате при температуре
60°С до постоянного веса, после чего определяли
РЕЗУЛЬТАТЫ
сухую массу частей растений и рассчитывали
Исследование ионогенных групп в составе кле-
оводненность корней и надземной части (КН2О)
точных стенок корней. Экспериментальные кри-
по формуле:
вые потенциометрического титрования имели
сложную полисигмоидную форму, что свидетель-
ствует о наличии нескольких типов ионообмен-
(m
сыр
−
m
сух
K
=
),
(6)
ных групп в составе структурных полимеров КС.
Н2О
m
сух
При рН 10.8 значения катионообменной способ-
ности КС по Na+ достигали максимального уров-
где mсыр и mсух - соответственно сырая и сухая
масса (г) корней или поебга.
ня (Sкат, табл. 1). Это означает, что все ионоген-
Затем сухие навески измельчали, помещали в
ные группы заняты Na+. Sокат характеризует об-
фарфоровые тигли, смачивали концентрирован-
щее количество кислотных групп, которые
ной азотной кислотой и озоляли в муфельной пе-
имеются в полимерной структуре КС исследуе-
чи при 420°C в течение 10-15 ч. Золу растворяли в
мых растений. Эти группы могут включаться в ре-
концентрированной соляной кислоте, затем рас-
акции ионного обмена при соответствующих зна-
чениях рН среды. Следует отметить, что анионо-
твор разбавляли дистиллированной водой и опре-
обменные группы, которые, как правило,
деляли в нем концентрацию Cu2+ колориметри-
обнаруживаются на потенциометрических кри-
ческим методом [18].
вых КС корней растений других видов [16], не вы-
Другую половину опытных и контрольных
явлены у растений вики, что может быть обуслов-
растений использовали для выделения из корней
лено большим содержанием карбоксильных
групп полигалактуроновой кислоты в стенках,
клеточной стенки, как описано выше, при этом
которые экранируют диссоциацию аминогрупп.
корни и полученные из них препараты КС не
подвергали термообработке.
Расчеты кривых потенциометрического тит-
рования препаратов изолированных КС свиде-
Поглощение ионов меди изолированными кле-
тельствуют, что у растений 10- и 15-дневного воз-
точными стенками. Препараты клеточных стенок,
раста качественный (рКаj) и количественный
изолированных из корней трех опытных или кон-
(ΔSj) состав ионообменных групп не отличаются
трольных растений вики 10- или 15-дневного воз-
(табл. 1), а также показывают, что рассчитанные
раста, переносили в сосуды объемом 150 мл с рас-
(уравнение 4) значения полностью соответствуют
творами CuCl2 с концентрацией CuCl2 10, 50 или
полученным экспериментальным данным, о чем
100 мкМ, рН 5.0 ± 0.1 и выдерживали в течение
свидетельствуют величины коэффициентов кор-
24 ч при постоянном перемешивании. Затем об-
реляции (r2) и коэффициенты регрессии B, близ-
разцы КС отделяли от раствора, определяли в нем
кие к единице (уравнение 5) и для 10-дневных
концентрацию ионов Cu2+ и рассчитывали ионо-
(B = 1.03; r2 = 0.991), и для 15-дневных (B = 1.04;
обменную способность КС по формуле:
r² = 0.990) растений.
БИОФИЗИКА том 66
№ 1
2021
140
МЕЙЧИК и др.
Таблица 1. Параметры модифицированного Грегором уравнения Хендерсона-Хассельбаха (уравнение 3) для
ионогенных групп в полимерном матриксе клеточных стенок корней растений вики разного возраста
Возраст
кат
растений,
j
pKaj
nj
(rjcorr)2
ΔSj
Sо
сутки
1
4.09 ± 0.04
1.08
0.996
600 ± 10
15
2
7.40 ± 0.15
0.99
0.931
550 ± 11
1620 ± 35
3
10.0 ± 0.35
0.93
0.908
470 ± 14
1
4.06 ± 0.03
1.27
0.997
610 ± 20
10
2
7.26 ± 0.20
1.11
0.925
550 ± 10
1645 ± 45
3
10.3 ± 0.20
0.83
0.960
485 ± 15
Примечание. j - Тип группы (1 - карбоксильные группы полигалактуроновой кислоты, 2 - карбоксильные группы
гидроксикоричных кислот, 3 - фенольные ОН-группы); Sокат - суммарное количество катионообменных групп; nj -
константа уравнения (3); (rjcorr)2
- коэффициент корреляции зависимости pHi = f(lg[αi/(1-αi)]); ΔSj - количество
ионогенных групп j-го типа. Sокат, Sjвыражены в мкмоль/г сухой массы клеточных стенок. Приведены средние значения трех
биологических повторностей и их стандартные отклонения.
Ростовые характеристики растений при разных
15-дневных контрольных растений и составляла
концентрациях меди в растворах. В исследуемом
47.5 ± 0.4 и 51.8 ± 1.6%, соответственно (табл. 3).
диапазоне концентраций ионов меди в растворе
Независимо от возраста растений значение этого
сухая масса корня и 10-, и 15-дневных растений
показателя возрастало в ответ на присутствие ме-
не изменялась в ответ на увеличение концентра-
ди в среде, при самой высокой обработке оно до-
ции меди в среде, при этом сухая масса побега де-
стигало 59.3 ± 2.2 и 61.7 ± 0.3% у 10- и 15-дневных
растений соответственно.
сятидневных растений увеличивалась на
10%
(р < 0.05, табл. 2). Токсическое действие меди на
Накопление Cu2+ в органах растений вики при
растения вики проявлялось только в изменении
различной концентрации Cu2+ в среде. С увеличе-
содержания воды: у 10-дневных растений этот по-
казатель снижался как в корнях, так и в побегах, а
нием концентрации Cu2+ в среде от 10 до 100 мкМ
у
15-дневных
- только в надземной части
содержание меди в корнях и 10-, и 15-дневных
(табл. 2). Массовая доля клеточной стенки кор-
растений возрастало от 10 до 65 мкмоль/г сухой
ней достоверно различалась (р < 0.05) у 10- и массы (табл. 4). При этом уже при 10 мкМ Cu2+ в
Таблица 2. Cухая масса корня и побега и содержание воды в органах (КН
корень и КН
побег) растений вики
2О
2О
разного возраста после 24 ч экспозиции на растворах с разной исходной концентрацией CuCl2
Возраст
Сухая масса
КН
корень, г Н2О/г
Сухая масса
КН
побег, г Н2О/г
2О
2О
CCu, мкM
растений, дни
одного корня, мг
одного побега, мг
сухой массы
сухой массы
0.5 (контроль)
16.6 ± 0.9a
15.7 ± 0.2c
32.8 ± 1.2g
11.1 ± 0.3a
10
18.6 ± 0.5a
13.9 ± 0.2d
41.6 ± 1.5h
10.4 ± 0.4ab
10
50
17.1 ± 1.1a
13.3 ± 0.1d
38.2 ± 1.9h
10.3 ± 0.3ab
100
16.5 ± 0.6a
14.0 ± 0.2d
38.7 ± 1.4h
10.2 ± 0.2b
0.5 (контроль)
26.4 ± 1.8b
17.6 ± 0.3f
56.2 ± 1.9j
11.4 ± 0.1a
10
27.3 ± 1.4b
17.0 ± 0.3f
59.7 ± 2.3j
11.0 ± 0.2ab
15
50
25.7 ± 4.3b
16.6 ± 0.2f
58.9 ± 5.5j
10.8 ± 0.2b
100
29.1 ± 3.3b
17.8 ± 0.4f
63.0 ± 2.6j
10.7 ± 0.1b
Примечание. Приведены средние значения из трех-десяти биологических повторностей и их стандартные ошибки. Значения
с одинаковыми буквами не отличаются в соответствии с t-критерием для независимых выборок с уровнем вероятности
p < 0.05. Значения с разными буквами достоверно различаются при p < 0.05.
БИОФИЗИКА том 66
№ 1
2021
РОЛЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ
141
Таблица 3. Массовая доля (в %) клеточных стенок от сухой массы корней вики в зависимости от возраста
растений и концентрации Cu в экспериментальном растворе
CCu, мкM
10-дневные растения
15-дневные растения
Контроль
1 (0.5 мкМ)
47.5 ± 0.4a
51.8 ± 1.6c
2 (СCu 10 мкМ)
49.0 ± 0.6a
58.3 ± 0.8c
Опыт
2 (СCu 50 мкМ)
55.7 ± 1.4b
56.0 ± 1.0c
2 (СCu 100 кМ)
59.3 ± 2.2b
61.7 ± 0.3d
Примечание. Контроль - клеточную стенку выделяли из корней растений, которые не подвергались действию Cu2+; опыт -
клеточную стенку выделяли из корней растений после 24 ч экспозиции на растворах с разной исходной концентрацией CuCl2
(CCu). Приведены средние значения из трех (опытные растения) и пятнадцати (контрольные растения) биологических
повторностей и их стандартные ошибки. Значения с одинаковыми буквами не отличаются в соответствии с t-критерием для
независимых выборок с уровнем вероятности p < 0.05. Значения с разными буквами достоверно различаются при p < 0.05.
среде оно было почти в 40 раз больше по сравне-
± 0.060 мкмоль/г сухой массы побега соответ-
нию с содержанием Cu в корнях контрольных
ственно.
растений.
Независимо от концентрации меди в растворе
увеличение содержания меди в корнях было на-
При всех обработках в надземных частях
много значительнее, чем в побегах (табл. 4). Эти
10-дневных растений вики содержание меди так-
результаты согласуются с известными данными о
же увеличивалось, однако отличия от контроль-
том, что большинство видов растений накаплива-
ных растений были незначительными: при
ют Cu в тканях корня с незначительной трансло-
100 мкМ Cu2+ в среде содержание меди в
кацией в надземную часть [3, 19]. Отсутствие сни-
побегах было лишь в полтора раза больше по
жения массы корней и надземных органов по
сравнению с побегами контрольных растений
сравнению с контролем предполагает, что погло-
(табл. 4). У 15-дневных растений содержание ме-
щенные за 24 ч ионы меди не оказывают значи-
ди в надземных органах опытных и контрольных
тельного токсического действия на растения ви-
растений было приблизительно одинаковым
ки, хотя и наблюдается небольшое снижение
(p < 0.05) и составляло 0.574 ± 0.037 и 0.520 ±
оводненности тканей корня и побега (табл. 2).
Таблица 4. Содержание меди в корнях (SCuкорни) и побегах (SCuпобег) в зависимости от возраста растений и
концентрации Cu2+ в растворе
SCuкорни, мкмоль/г сухой
SCuпобег, мкмоль/г сухой массы
Возраст, дни
CCu, мкМ
массы корней
побегов
0.5
1.57 ± 0.18
0.523 ± 0.030c
10
10.8 ± 0.3
0.604 ± 0.040c
10
50
39.1 ± 1.4
0.683 ± 0.071d
100
68.1 ± 3.4
0.798 ± 0.037d
0.5
1.57 ± 0.18
0.529 ± 0.032a
10
9.71 ± 1.12
0.416 ± 0.023b
15
50
32.1 ± 3.45
0.652 ± 0.052a
100
65.7 ± 8.90
0.622 ± 0.042a
Примечание. Приведены средние значения из трех-десяти биологических повторностей и их стандартные ошибки. Значения
с одинаковыми буквами не отличаются в соответствии с t-критерием для независимых выборок с уровнем вероятности
p < 0.05. Значения с разными буквами указывают на значительные различия с p < 0.05.
БИОФИЗИКА том 66
№ 1
2021
142
МЕЙЧИК и др.
Таблица 5. Содержание меди в клеточной стенке, изолированной из корней 10- и 15-дневных растений вики в
зависимости от концентрации Cu2+ в растворе
SCuКС, мкмоль/г сухой массы корня
SCuКС, мкмоль/г сухой массы КС
CCu, мкM
10-дневные
15-дневные
10-дневные
15-дневные
растения
растения
растения
растения
1
19.8 ± 0.5
18.6 ± 2.0
41.3 ± 1.2
35.8 ± 4.2
10
2
19.4 ± 0.6
15.5 ± 1.1
43.0 ± 2.3
27.7 ± 1.2
1
91.5 ± 4.8a
85.1 ± 5.8
181 ± 7
165 ± 13
50
2
120 ± 9b
80.5 ± 8.5
188 ± 7
143 ± 14
1
130 ± 5c
140 ± 4
285 ± 10
273 ± 5
100
2
166 ± 6d
156 ± 9
289 ± 16
253 ± 12
Примечание. SCuКС - содержание меди в клеточной стенке. 1 - Контроль, КС выделяли из корней растений, которые не
подвергались действию Cu2+; 2 - опыт, КС выделяли из корней растений после Cu-обработки с разными начальными
концентрациями Cu2+ в течение 24 ч. Приведены средние значения из трех-шести биологических повторностей
и их стандартные ошибки. Значения с разными буквами указывают на достоверные различия в соответствии с t-критерием
для независимых выборок с уровнем вероятности p < 0.05. Отсутствие букв - нет достоверных отличий между контролем и
опытом (p < 0.05).
Связывание Cu2+ изолированными клеточными
коричневый цвет корней, угнетение роста корней
стенками при разной концентрации Cu2+ в среде.
и побегов) у родственного растения Vigna unguicu-
Сравнительный анализ адсорбирующей способ-
lata при концентрации меди ≥ 1.7 мкM [19]. Несо-
ности в отношении ионов меди КС, изолирован-
ответствие известных данных и наших результа-
ных из контрольных и опытных растений, пока-
тов о токсическом действии Cu2+ в определенных
зывает, что у 15-дневных растений нет отличий в
концентрационных пределах обусловлено разны-
этом показателе (табл. 5) ни в расчете на единицу
ми условиями постановки эксперимента. Имеет
сухой массы корня, ни в расчете на единицу сухой
значение не только концентрация меди в раство-
массы КС. У 10-дневных растений при 10 мкМ
ре, но и соотношение количества используемых
Cu2+ в среде Cu-связывающая способность КС
растений к объему раствора, содержащего ток-
опытных растений не отличалась от значений для
сичный металл, а также продолжительность ток-
контрольных растений (p < 0.05, табл. 5), однако
сического действия Cu2+. Так, например, авторы
при повышении концентрации меди в растворе
работы [19] использовали в эксперименте четыре
до 50 и 100 мкМ она увеличивалась в расчете на
проростка V. unguiculata, которые выращивали в
единицу сухой массы корня, но оставалась неиз-
течение 14 дней в сосуде, содержащем 21 л раство-
менной в расчете на единицу сухой массы КС.
1.7 мкМ (СCu), при этом
ра с концентрацией Cu2+
концентрацию меди поддерживали на постоян-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ном уровне в течение всего эксперимента. Таким
образом,
токсическая
нагрузка
(объем
В исследованном диапазоне концентраций
раствора × СCu/количество растений) без учета
медь не оказывает значительного ингибирующе-
го действия на рост растений вики десяти- и пят-
продолжительности обработки составляла
надцатидневного возраста, так как не наблюда-
9.5 мкмоль Cu2+ на одно растение. В наших экс-
лось снижения сухой массы как корней, так и по-
периментах мы использовали три растения вики,
бегов относительно контроля. Токсическое
объем раствора с концентрацией Cu2+ 10, 50 или
действие меди выражалось в некотором сниже-
100 мкМ составлял 0.15 л, а начальная токсиче-
нии содержания воды в корнях у 10-дневных рас-
ская нагрузка на одно растение - 0.5, 2.5 или
тений и побегах у растений обоих возрастов. Сле-
дует также отметить, что в наших условиях экспе-
5.0 мкмоль Cu2+ соответственно. При этом ток-
римента отсутствовали внешние проявления
сическая нагрузка не была постоянной и умень-
токсичности меди, которые наблюдали другие ав-
шалась к концу опыта на 90-99%. Таким обра-
торы (развитие межжилкового хлороза листьев,
зом, в наших экспериментах начальная токсиче-
БИОФИЗИКА том 66
№ 1
2021
РОЛЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ
143
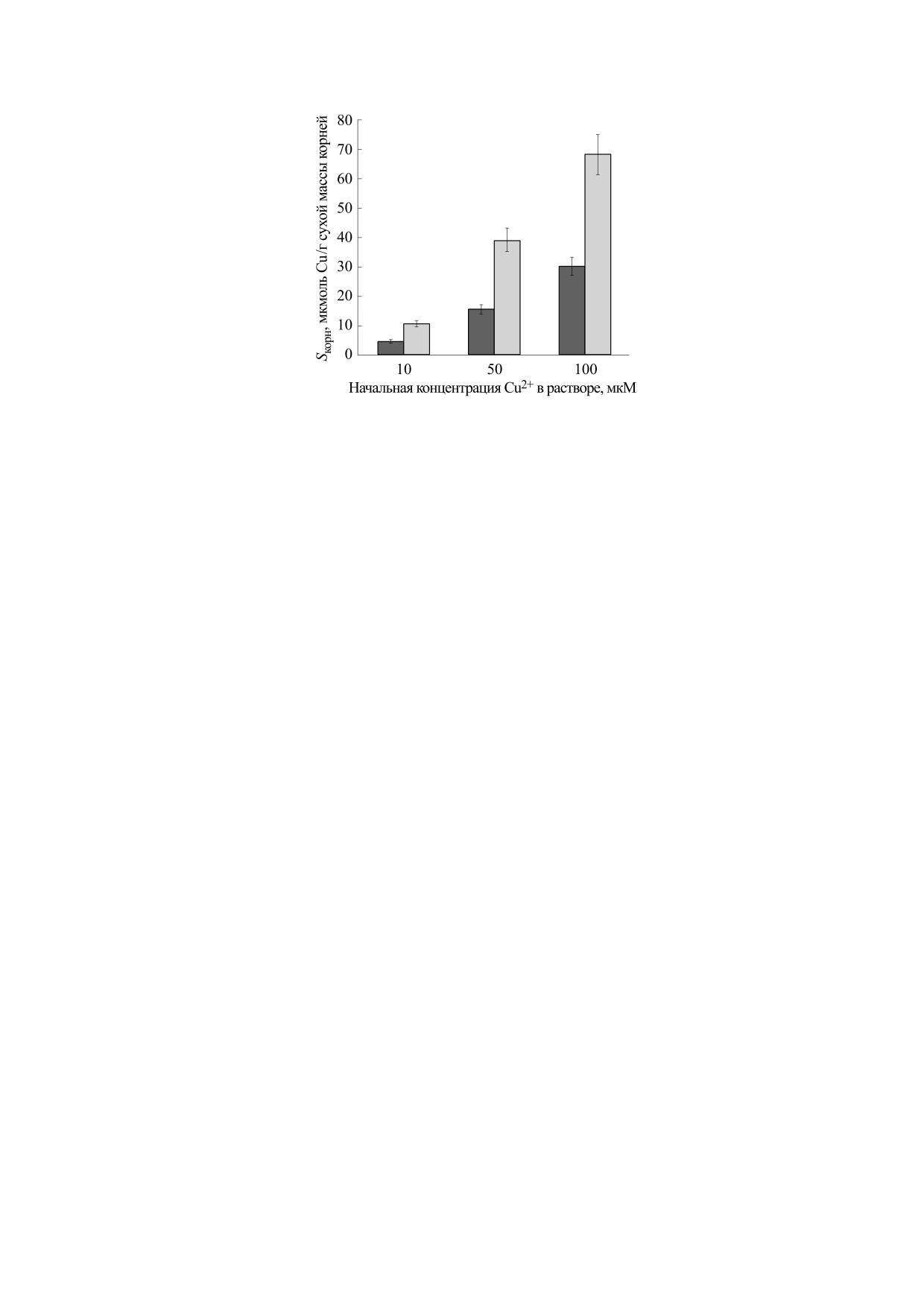
Рис. 1. Содержание меди в корнях (Sкорни, мкмоль/г сухой массы корней) десятидневных растений вики при разных на-
чальных концентрациях Cu2+ в растворе и разном количестве растений в эксперименте: темные столбики - семь расте-
ний; светлые столбики - три растения в объеме раствора 150 мл. Приведены средние значения из трех биологических по-
вторностей и их стандартные ошибки.
ская нагрузка на одно растение даже при самой
зывании меди при 10 мкM Cu в среде, а при
высокой концентрации меди была в два раза
100 мкМ этот показатель возрастает до 90%.
меньше, чем в цитированном выше исследо-
Известно, что в ответ на избыток ТМ в среде
вании.
растения могут реализовывать две стратегии из-
Эксперименты с разным количеством расте-
менения содержания и состава пектинов в КС
ний вики подтверждают эти рассуждения (рис. 1).
корня. Первая из них заключается в увеличении
С увеличением количества растений, находящих-
массовой доли деметилированных пектинов в КС
при воздействии таких ТМ, как Pb, Cd и Cu [20-
ся в одинаковом объеме раствора Cu2+, от трех до
22], а также алюминия [23]. Вторая, напротив, за-
семи уменьшается содержание металла в корнях
ключается в увеличении степени метилирования
во всем исследуемом дискретном концентраци-
пектинов в КС в ответ на избыток металла в среде
онном диапазоне, т.е. токсическое действие Cu2+
[20, 23]. В зависимости от вида, экотипа или сорта
снижается. Так, при увеличении количества рас-
растения каждая из стратегий может являться ли-
тений в 2.33 раза содержание меди в корнях
бо механизмом устойчивости к воздействию ТМ,
уменьшилось приблизительно во столько же: в
либо, наоборот, приводить к развитию Ме-стрес-
2.23, 2.52 и 2.27 раза при концентрации Cu2+ в
са. Так, в клетках корней растений Silene paradoxa
растворе 10, 50 и 100 мкМ соответственно.
из устойчивой популяции в ответ на Cu-стресс
было обнаружено усиление синтеза пектинов с
Клеточные стенки корней растений V. narbo-
высокой степенью метилирования. Формирова-
nensis характеризуются высоким содержанием
ние таких «исключающих» металл клеточных сте-
карбоксильных групп полигалактуроновой кис-
нок является одним из факторов, гарантирующих
лоты (табл. 1), что обуславливает их высокую свя-
низкое апопластное накопление меди и, вероят-
зывающую способность в отношении ионов меди
но, ограничивающих также и симпластное погло-
(табл. 5). Известно, что в КС растений имеется
щение меди клетками корня [20]. Напротив, у
два типа сайтов связывания ионов меди: карбок-
Elsholtzia splendens возрастание доли деметилиро-
сильные группы полигалактуроновой кислоты
ванных пектинов в КС корня являлось механиз-
(ПГК) и карбоксильные группы гидроксикорич-
мом устойчивости к Ме-стрессу [24].
ных кислот [13]. Можно полагать, что у вики ос-
новным сайтом связывания меди являются
Ранее было показано, что у бобовых Cu-связы-
карбоксильные группы ПГК, так как pKa этих
вающая способность КС увеличивается или
групп ниже, чем карбоксильных групп гидрокси-
уменьшается в соответствии с содержанием в ней
коричных кислот (табл. 1), а количество адсорби-
карбоксильных групп ПГК, которые являются
рованной в КС меди меньше, чем содержание
основными сайтами связывания Cu2+ у этих рас-
карбоксильных групп ПГК. Расчеты показывают,
тений [13]. На этом основании возможно пола-
что всего лишь 10% групп ПГК участвуют в свя-
гать, что изменения Cu-связывающей способно-
БИОФИЗИКА том 66
№ 1
2021
144
МЕЙЧИК и др.
сти КС в ответ на воздействие Cu2+ отражают раз-
ствовать поглощению металла корнями рас-
личия в содержании карбоксильных групп ПГК
тений.
Полученные нами данные об адсорбирующей
и/или степени их метилирования между кон-
способности изолированных КС (табл. 5), о срав-
трольными и обработанными Cu (опытными)
растениями.
нительной оценке Cu-связывающей способности
КС и корней растений (табл. 4 и 5) дают нам осно-
Тот факт, что в расчете на единицу сухой мас-
вания полагать, что депонирование меди в КС
сы КС ее Cu-связывающая способность у опыт-
корня является физиологическим ответом расте-
ных растений не изменяется по сравнению с кон-
ний вики нарбонской на повышенные концен-
трольными, свидетельствует о том, что присут-
трации этого металла в окружающей среде,
ствие меди в среде в повышенной концентрации
предотвращающим поступление ионов Cu2+ в
не приводит к изменению степени метилирова-
симпласт корня, а на уровне целого растения - в
ния пектиновых полимеров. Однако увеличение
надземные органы. Наши данные о преимуще-
Cu-связывающей способности КС в расчете на
единицу сухой массы корня (табл. 5) при концен-
ственной локализации Cu2+ в КС корня согласу-
трации меди в растворе 50 мкМ, а также данные
ются с результатами других авторов, которые ис-
об увеличении массовой доли стенки в общей
пользовали другие методы исследования и пока-
массе корня (табл. 3) дают основание полагать,
зали, что апопласт корней играет важную роль в
поглощении и накоплении металлов как у чув-
что в корнях вики в ответ на действие Cu2+ стра-
ствительных, так и у устойчивых видов растений.
тегия защиты с участием КС обусловлена усиле-
Так, например, используя физико-химическое
нием в равной мере биосинтеза всех компонентов
фракционирование содержащегося в корнях Ni
КС, в том числе и пектинов с таким же содержа-
после экспозиции растений на растворах с избы-
нием свободных карбоксильных групп, как у кон-
точной концентрацией Ni, исследователи показа-
трольных растений, так как Cu-связывающая
ли, что апопластное поглощение ответственно за
способность КС в расчете на единицу ее сухой
81.3-88.0% и 90.6-95.5% от общего поглощения
массы не изменяется (табл. 5). Такая же стратегия
корнями кукурузы и Leptoplax emarginata (гипер-
защиты была выявлена у растений маша (Vigna ra-
накопителя Ni) соответственно [9]. Более того,
diata) в аналогичных условиях эксперимента при
поскольку данные виды растений сильно разли-
≥50 мкМ Cu2+ в среде [12].
чаются по способности к накоплению никеля,
Сравнительная оценка Cu-связывающей спо-
эти авторы полагают, что симпластное поглоще-
собности КС и корней растений показывает
ние не является основным фактором гиперна-
(табл. 4 и 5), что в исследуемом дискретном диа-
копления. В работе [27] было показано, что депо-
нирование Cu в КС у твердой пшеницы ответ-
пазоне концентраций Cu2+ изолированные КС
ственно за 50-80% от общего поглощения Cu
корней связывают в два раза больше металла, чем
корнями. Аналогично, ~60% от общего количе-
корни интактных растений. Этот результат может
ства Cu в корнях Lolium multiflorum и Trifolium
быть обусловлен несколькими причинами: 1) не-
pratense [7] было связано клеточными стенками.
которая часть Cu2+ проходит в побеги растений. В
Однако некоторые исследования предполагают
соответствии с результатами, действительно, при
преобладающую роль внутриклеточных механиз-
≥50 мкМ Cu2+ в среде мы наблюдали некоторое
мов в поглощении и накоплении Cu и других ТМ
увеличение в содержании Cu в надземной части
[28, 29]. Например, было обнаружено, что Cu-
опытных растений (в 1.2 (15-дневные растения) и
связывающая способность корней пшеницы и то-
в 1.5 раза (10-дневные растения, табл. 4) по срав-
матов в 3.4 раза выше, чем у изолированных КС
нению с контрольными); 2) используемый в на-
корня [29]. В данном случае Cu-связывающая
стоящей работе метод выделения КС приводит к
способность КС могла быть недооценена из-за
получению препарата, в котором не нарушена ар-
малой продолжительности поглощения металла
хитектура полимерной сети [16], но значительно
(30 мин). Различия также могут обусловлены
облегчена диффузия к ионообменным группам
применением разных экспериментальных мето-
полимеров по сравнению с КС в интактном кор-
дов, а также видом и возрастом растений, количе-
не; 3) часть сайтов связывания металлов в КС в
ством металла в растворе на одно растение, объе-
интактном корне может быть занята ионами
мом раствора с токсичной концентрацией метал-
Ca2+, Mg2+, Fe2+ и т.д. [25], которые отсутствуют
ла и т.д.
в препаратах изолированной стенки и экспери-
ментальных растворах; 4) корни растений в при-
ВЫВОДЫ
сутствии повышенных концентраций тяжелых
металлов могут выделять в среду органические хе-
Наши исследования показали, что КС корней
латоры, главным образом, аминокислоты (гисти-
растений V. narbonensis характеризуются высоким
дин, глутамин) и фитосидерофоры (производные
содержанием карбоксильных групп полигалакту-
мугеновой кислоты), образующие прочные ком-
роновой кислоты, что обуславливает их высокую
плексы с ионами меди [26], что может препят-
связывающую способность в отношении ионов
БИОФИЗИКА том 66
№ 1
2021
РОЛЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ
145
Cu2+. Было установлено, что в исследованном
СПИСОК ЛИТЕРАТУРЫ
диапазоне концентраций медь не оказывает ток-
1. G. Ouzounidou, M. Ciamporova, M. Moustakas, and
сического действия на рост растений десяти- и
S. Karataglis, Env. Exp. Bot. 35, 167 (1995).
пятнадцатидневного возраста, так как не проис-
2. E. Gajewska, M. Sklodowska, M. Slaba, and J. Mazur,
ходит снижения сухой биомассы ни корней, ни
Biol. Plant. 50, 653 (2006).
побегов относительно контроля. Токсическое
3.
H. Lequeux, C. Hermans, S. Lutts, and N. Verbruggen,
действие меди проявляется только в некотором
Plant Physiol. Biochem. 48, 673 (2010).
снижении оводненности, что свидетельствует о
4.
J. L. Burkhead, K. A. Reynolds, S. E. Abdel-Ghany,
том, что накопление Cu в КС корней у вики мо-
et al., New Phytol. 182, 799 (2009).
жет являться механизмом защиты от неблагопри-
ятного воздействия этого металла. Основным ме-
5.
S. Klaumann, S. D. Nickolaus, S. H. Fürst, et al., New
стом накопления Cu в интактных растениях явля-
Phytol. 192, 393 (2011).
ется корневая система. При этом содержание Cu
6.
J. L. Hall, J. Exp. Bot. 53, 1 (2002).
в тканях корня зависит не только от концентра-
7.
K. Iwasaki, K. Sakurai, and E. Takahashi, Soil Sci.
ции металла в среде выращивания, но и от коли-
Plant Nutr. 36, 431 (1990).
чества растений, используемых в экспериментах,
8.
V. P. Kholodova, E. M. Ivanova, and V. V. Kuznetsov,
из чего следует, что при оценке токсического дей-
in Detoxification of Heavy Metals, Ed. by I. Sherameti
ствия металла на растительный организм важно
and A. Varma (Springer, Berlin, Heidelberg, 2011),
принимать во внимание соотношение объема
pp. 143-167.
раствора к количеству растений.
9.
T. Redjala, T. Sterckeman, S. Skiker, and G. Echevar-
Используемый в нашей работе подход к иссле-
ria, Env. Exp. Bot. 68, 99 (2010).
дованию поглощения Cu растениями позволяет
10.
P. M. Kopittke, N. W. Menzies, M. D. de Jonge, et al.,
оценить вклад как вне- так и внутриклеточных
Plant Physiol. 156, 663 (2011).
механизмов накопления металла [12]. Однако в
11.
F. J. Zhao, R. E. Hamon, E. Lombi, et al., J. Exp. Bot.
выбранных условиях эксперимента накопления
53, 535 (2002).
меди в симпласте не было обнаружено даже при
12.
N. Meychik, Y. Nikolaeva, M. Kushunina, and I. Yer-
самой высокой концентрации этого металла в
makov, Funct. Plant Biol. 43, 403 (2016).
среде. Полученные нами данные об адсорбирую-
13.
N. Meychik, Y. Nikolaeva, M. Kushunina, and I. Yer-
щей способности изолированных КС дают нам
makov, Plant Soil. 381, 25 (2014).
основания полагать, что основной стратегией за-
14.
N. R. Meychik and I. P. Yermakov, Plant Soil. 217, 257
щиты растений вики нарбонской от повышенных
(1999).
концентраций меди в окружающей среде являет-
15.
Н. Р. Мейчик, С. И. Степанов и Ю. И. Николаева,
ся предотвращение поступления ионов этого ме-
Журн. физ. хим. 92, 251 (2018).
талла в клетку путем депонирования их в клеточ-
16.
N. R. Meychik and I. P. Yermakov, Plant Soil. 234, 181
ные стенки корня, а также, возможно, выделения
(2001).
хелаторов в среду выращивания, что снижает по-
17.
Л. А. Шатаева, Н. Н. Кузнецова и Г. Е. Елькин,
ступление ионов меди в корни.
Карбоксильные иониты в биологии (Наука, Л., 1979).
18.
З. Марченко, Фотометрическое определение
элементов (Мир, М., 1971).
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
19.
P. M. Kopittke and N. W. Menzies, Plant Soil. 279, 287
(2006).
Работа поддержана грантом МГУ имени
20.
I. Colzi, M. Arnetoli, A. Gallo, et al., Env. Exp. Bot.
М.В. Ломоносова для поддержки ведущих науч-
78, 91 (2012).
ных школ МГУ «Депозитарий живых систем
21. L. Parrotta, G. Guerriero, K. Sergeant, et al., Front.
Московского университета» в рамках Программы
Plant Sci. 6, 1 (2015).
развития МГУ и выполнена в соответствии с НИР
22. M. Wierzbicka, Plant Sci. 133, 105 (1998).
кафедры физиологии растений МГУ (№ АААА-
А16-116021660106-0).
23. D. Eticha, A. Stass, and W. J. Horst, Plant Cell Env. 28,
1410 (2005).
24. T. Liu, C. Shen, Y. Wang, et al., PLoS One 9, e109573
КОНФЛИКТ ИНТЕРЕСОВ
(2014).
25. H. Marschner, Mineral nutrition of higher plants, 2nd
Авторы заявляют об отсутствии конфликта
ed. (Acad. Press, London, 1995).
интересов.
26. R. Qin, Y. Hirano, and I. Brunner, Tree Physiol. 27, 313
(2007).
27. M. Bravin, B. Le Merrer, L. Denaix, et al., Plant Soil.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
331, 91 (2010).
Настоящая работа не содержит описания ис-
28. D. Liu and I. Kottke, Cell Biol. Toxicol. 19, 299 (2003).
следований с использованием людей и животных
29. S. Guigues, M. Bravin, C. Garnier, et al., Plant Soil.
в качестве объектов.
381, 367 (2014).
БИОФИЗИКА том 66
№ 1
2021
146
МЕЙЧИК и др.
The Role of Physochemical Properties of the Root Cell Walls in Copper Uptake
by Narbon Vetch (Vicia narbonensis L.)
N.R. Meychik, Yu.I. Nikolaeva, O.V. Nikushin, and M.A. Kushunina
Faculty of Biology, Lomonosov Moscow State University, Leninskiye Gory 1/12, Moscow, 119234 Russia
The comparative analysis of copper accumulation in narbon vetch (Vicia narbonensis L.) roots and isolated
root cell walls is presented. Our results demonstrate that intact plants accumulate Cu predominantly in the
root system. The root cell walls are characterized by high content of polygalacturonic acid carboxyl groups,
which determines their high Cu-binding capacity. We conclude that copper sequestration in the root cell walls
is the main defense strategy employed by narbon vetch plants in response to Cu excess in the medium, which
prevents Cu accumulation in the cytoplasm.
Keywords: cell wall, adsorption, ion-exchange groups, heavy metals
БИОФИЗИКА том 66
№ 1
2021