БИОФИЗИКА, 2021, том 66, № 1, с. 183-194
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
ГАЗООБРАЗНЫЙ ОКСИД АЗОТА И ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ
ЖЕЛЕЗА С ТИОЛСОДЕРЖАЩИМИ ЛИГАНДАМИ
КАК ПРЕДПОЛАГАЕМЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА,
СПОСОБНЫЕ КУПИРОВАТЬ СOVID-19
© 2021 г. А.Ф. Ванин*, **, А.В. Пекшев***, А.Б. Вагапов***, Н.А. Шарапов***,
В.Л. Лакомкин****, А.А. Абрамов****, А.А. Тимошин****, В.И. Капелько****
*Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН, 119334, Москва, ул. Косыгина, 4
**Институт регенеративной медицины Первого Московского государственного медицинского университета
имени И.М. Сеченова МЗ РФ, 119991, Москва, ул. Трубецкая, 8/2
***«Московский государственный технический университет имени Н.Э. Баумана»
(национальный исследовательский университет)», 105005, Москва, 2-я Бауманская ул., 5/1
****Национальный медицинский исследовательский центр кардиологии МЗ РФ,
121552, Москва, ул. 3-я Черепковская, 15а
E-mail: vanin.dnic@gmail.com
Поступила в редакцию 02.12.2020 г.
После доработки 02.12.2020 г.
Принята к публикации 03.12.2020 г.
Показано, что ингаляционное введение животным и человеку газообразного NO или распыленных
водных растворов биядерных динитрозильных комплексов железа с глутатионом или N-ацетил-L-
цистеином не оказывает на них заметного гипотензивного действия, что делает возможным их
предполагаемое использование при лечении СOVID-19. Установлено, что по мере повышения кон-
центрации NO в газовом потоке, создаваемым аппаратом «ПЛАЗОН», с 100 до 2100 ррm уровень
NO, включавшегося в комплексы с гемоглобином в крови, начинал снижаться, так что при
2000 ppm более половины этого газа включалось в динитрозильные комплексы, возникавшие в тка-
ни легких и дыхательных путей. Таким образом ингаляционное введение газообразного NO может
приводить к тому же, что и аналогичное введение растворов динитрозильных комплексов железа -
к появлению в тканях легких и дыхательных цепей динитрозильных комплексов железа с тиолсо-
держащими лигандами. Поскольку эти комплексы как доноры катионов нитрозония могут (как это
было предположено ранее - Биофизика, т. 65, с. 818, 2020) подавлять репликацию коронавируса, не
исключено, что газообразный NO и синтезированные химическим путем биядерные динитрозиль-
ные комплексы железа с тиолсодержащими лигандами могут оказаться полезными при лечении
COVID-19. При испытаниях на добровольцах (соавторах статьи) максимальная безопасная концен-
трация вдыхаемого в течение 15 мин газообразного NO составляла ~2000 ppm, при испытаниях на
крысах при вдыхании ими распыленных водных растворов динитрозильных комплексов железа ис-
пытанная в опытах максимальная безопасная доза этих комплексов составляла ~0.4 ммоля/кг мас-
сы животного.
Ключевые слова: оксид азота, динитрозильные комплексы железа, COVID-19.
DOI: 10.31857/S0006302921010208
хозяина уровня одного из универсальных регуля-
К настоящему времени показано, что для
торов метаболических процессов - оксида азота
большинства патологий, вызванных в организме
(NO), а также активных форм кислорода и разно-
животных и человека вирусной инфекцией, ха-
рактерно резкое повышение в клетках и тканях
образных цитокинов [1-7]. При этом именно по-
вышение уровня NO обеспечивает в большинстве
Сокращения: ДНКЖ - динитрозильные комплексы желе-
случаев защиту клеток и тканей хозяина от этой
за, М-ДНКЖ и Б-ДНКЖ - моноядерные и биядерные инфекции (2, 5-12). В частности, эта защита до-
NAC - N-ацетил-L-цистеин, Б-ДНКЖ-GSH - биядерные стигается дезактивацией важнейших вирусных
ДНКЖ с глутатионом, Б-ДНКЖ-NAC
- биядерные
белков, необходимых для репликации вирусов,
ДНКЖ с N-ацетил-L-цистеином.
таких как вирусные протеазы, обратные тран-
183
184
ВАНИН и др.
скриптазы, факторы транскрипции и др., причем
с COVID-19 распыленных водных растворов этих
в большинстве случаев подавление активности
комплексов [22].
всех этих белков вызывается S-нитрозированием
В пользу того, что ДНКЖ с тиолсодержащими
в них функционально важных тиоловых групп [2,
лигандами могут подавлять репликацию вирусов,
4-12]. Вместе с тем при некоторых вирусных ин-
причем именно как доноры катионов нитрозо-
фекциях, например при гриппе или вирусном им-
ния, в работе [22] приводится ссылка на результа-
мунодефиците человека, NO может усиливать за-
ты работы [29], в которой было продемонстриро-
болевание [13, 14].
вано такого рода действие ДНКЖ с цистеином на
Интерес к роли NO в вирусных инфекциях
репликацию вируса Coxsackie-B, инфицирующе-
резко возрос в условиях пандемии СOVID-19.
го ткани миокарда у крыс. Катионы нитрозония,
Было предположено, что ингаляция газообразно-
высвобождающиеся из ДНКЖ, вызывали S-нит-
го NO может явиться спасительной терапией в
розирование тиоловых групп вирусной протеазы
преодолении этой патологии [15-20]. Действи-
2А, что приводило к подавлению активности это-
тельно, такой результат был получен при лечении
го формента и как следствие этого к блокирова-
шести беременных женщин с COVID-19 путем их
нию репликации вируса Coxsackie-B [29, 30].
ежедневной 30- и 60-минутной ингаляции пото-
Аналогичное цитотоксическое действие на опу-
ком газообразного NO при концентрации 160-
холевые клетки Jurkat, обусловленное S-нитрози-
200 ppm в течение соответственно пятнадцати
рованием тиолсодержащих белков, расположен-
первых и пятнадцати последующих суток [20].
ных на клеточной поверхности этих клеток, при
При меньшей концентрации газообразного NO
их обработке ДНКЖ с тиосульфатом было проде-
(30 ppm), использованной в работе [21], при лече-
монстрировано в работе [31].
нии больных с COVID-19 отмечалось только
Таким образом, не исключено, что подавление
улучшение функционирования кровеносных со-
репликации коронавируса может быть обеспече-
судов из-за вазодилатирующего действия на них
но ингаляцией пациентов распыленными водны-
NO, а также из-за блокирующего действия по-
ми растворами ДНКЖ с тиолсодержащими ли-
следнего на агрегацию тромбоцитов. Таким обра-
гандами при соответствующем выборе оптималь-
зом, есть основание предполагать, что ингаляция
ной дозы этих комплексов, оптимальном выборе
пациентам газообразного NO при повышенных
тиолсодержащих лигандов и времени ингаляции.
дозах этого агента может оказаться одним из под-
ходов к лечению COVID-19.
Препятствием для использования газообраз-
ного NO и распыленных водных растворов ДН-
Наряду с возможностью использования газо-
КЖ с тиолсодержащими лигандами может ока-
образного NO при лечении коронавирусной ин-
заться следующее. При повышенной дозе этих
фекции вполне естественным представляется
агентов в ходе их ингаляции пациентам с СOVID-
возможность использования с той же целью со-
19 поступление в организм газообразного NO мо-
единений-доноров нейтральных молекул NO. Та-
жет приводить как к значительному снижению
кого рода предположение о целесообразности
артериального давления в малом и большом кру-
проверки противовирусного действия широкого
ге, так и к окислению значительной части гемо-
класса производных оксида азота - динитрозиль-
глобина до метгемоглобина [32-36], тогда как
ных комплексов железа (ДНКЖ) с тиолсодержа-
при введении ДНКЖ, характеризующихся чрез-
щими лигандами - было высказано недавно од-
вычайно высокой гипотензивной активностью
ним из авторов настоящего сообщения [22]. Эти
[37-40], их поступление в кровь может приводить
комплексы, моноядерные и биядерные формы
к выраженной гипотонии. В связи с этим цель на-
которых (М- и Б-ДНКЖ) характеризуются резо-
стоящей работы состояла в том, чтобы выяснить,
насными структурами [(RS-)2Fe2+(NO+)(NO)]+
действительно ли эти факторы могут существен-
но затруднить использование газообразного NO и
и [(RS-)2Fe2+2(NO+)2(NO)2]4+, способны в соот-
распыленных водных растворов ДНКЖ с тиолсо-
ветствии с этими структурами выступать в живых
держащими лигандами для лечения СOVID-19?
организмах не только в качестве доноров ней-
тральных молекул NO, но и в качестве доноров
окисленной формы NO - катионов нитрозония
МАТЕРИАЛЫ И МЕТОДЫ
(NO+) [23-28]. Тем самым ДНКЖ с тиолсодер-
жащими лигандами могут воздействовать на раз-
Материалы. В экспериментах использовали
нообразные метаболические процессы, ответ-
ферросульфат (FeSO4⋅7H2O) (Fluka, Швейцария),
ственные за проникновение коронавирусов во
восстановленный глутатион (GSH) и N-ацетил-
внутриклеточную среду и репликацию в ней этих
L-цистеин (NAC) (Sigma, США). Газообразный
вирусов. Что касается доставки ДНКЖ до тканей,
NO, использовавшийся при синтезе ДНКЖ, по-
инфицированных коронавирусом, наиболее оп-
лучали в реакции ферросульфата с нитритом на-
тимальной представляется ингаляции пациентам
трия в 0.1 М HCl с последующей очисткой газооб-
БИОФИЗИКА том 66
№ 1
2021
ГАЗООБРАЗНЫЙ ОКСИД АЗОТА И ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
185
разного NO методом низкотемпературной субли-
тического монитора кровяного давления OM-
мации в вакуумированной камере [25].
RON M3 Expert (OMRON Healthcare Co., Япо-
ния), позволяющим определять систолическое и
Синтез биядерных ДНКЖ с глутатионом или N-
дистолическое давление в диапазоне 0-299 мм рт.
ацетил-L-цистеином. Оба типа Б-ДНКЖ (Б-ДН-
ст. с абсолютной погрешностью ±3 мм рт. ст. и
КЖ-GSH и Б-ДНКЖ-NAC соответственно) син-
частоту пульса в диапазоне 40-180 ударов/мин с
тезировали в аппарате Тунберга в реакции ферро-
относительной погрешностью ±5%.
сульфата и глутатиона или N-ацетил-L-цистеина
Уровни насыщения крови кислородом у доб-
с газообразным NO при давлении 150 мм рт. ст. и
ровольца при ингаляции оксидом азота опреде-
молярном соотношении Fe2+
:
GSH или
ляли оксиметром C101A2 (Medical Technology
Fe2+ : NAC, равным 1 : 2, в соответствии с мето-
Co., Китай), позволяющим измерять насыщение
дом, описанным в работе [25]. После растворения
гемоглобина кислородом (сатурацию SpO2) в
ферросульфата в 0.5 мл дистиллированной воды и
диапазоне 70-100% с точностью 2%.
глутатиона или N-ацетил-L-цистеина в 4.5 мл
Ингаляция газообразного NO добровольцам.
15 мМ раствора HEPES-буфера при рН 7.4 приго-
При ингаляции двух здоровых добровольцев (со-
товленные растворы помещали соответственно в
авторов настоящей статьи - А.В.П. и А.Б.В., воз-
верхнюю и нижнюю часть аппарата Тунберга с
раст 45 и 55 лет соответственно) использовали ап-
последующей его откачкой и напуском в него
парат «ПЛАЗОН» с заводским номером 492, для
NO. После этого оба раствора смешивали в при-
получения различных концентраций оксида азо-
сутствии NO и встряхивали в течение 5 мин с по-
та в ингаляционной области NO-содержащего га-
следующей откачкой NO из аппарата. Концен-
зового потока, снабженный двумя различными
трацию синтезированных таким путем Б-ДНКЖ
типами манипуляторов. Использование манипу-
оценивали оптическим методом по интенсивно-
лятора, описанного в работе [42], позволяло при
сти характерных для этих комплексов полос по-
изменении расстояния от выходного канала ма-
глощения на 310 и 350 нм с коэффициентами экс-
нипулятора от 120 до 400 мм получать в области
тинкции, равными соответственно
4600 и
дыхания на оси потока концентрацию оксида
3700 M-1 см-1 (при расчете на один железо-ди-
азота соответственно от 600 до 100 ppm с темпера-
нитрозильный фрагмент в Б-ДНКЖ) [25]. Кон-
турой в диапазоне 50-20°С. Использование ма-
центрация полученных Б-ДНКЖ определялась
нипулятора, описанного в работе [43], позволяло
уровнем ферросульфата (5 мМ), использованным
при изменении расстояния от 60 до 100 мм полу-
при синтезе этих комплексов.
чать в области дыхания на оси потока концентра-
ции оксида азота соответственно от 1000 до
Получение NO-содержащего газового потока и
2100 ppm с температурой в диапазоне 50-25°С.
мониторинг NO, NO2, O2, давления крови, степени
Доброволец, удерживая манипулятор на опре-
насыщения (сатурации) крови (гемоглобина) кисло-
деленном расстоянии от носа, осуществлял вдох
родом у добровольцев. Потоки газообразного NO,
через нос, а выдох через рот в гофрированную
использовавшиеся для ингаляции животных
трубку с внутренним диаметром 16 мм, содержа-
(крыс) и добровольцев, получали на серийных
щую внутри себя датчик газового анализатора
образцах аппарата «ПЛАЗОН» c заводскими но-
OPTIMA 7. Измерения содержания оксида азота
мерами 450 и 492 производства компании ООО
«ЦВТМ при МГТУ имени Н.Э. Баумана»
(Cout), двуокиси азота и кислорода в выдыхае-
(Москва). Формирование NO-содержащих газо-
мой газовой смеси производилось в течениt 3 мин
вых потоков осуществлялось из атмосферного
через каждые 30 с. Измерение содержания оксида
воздуха манипуляторами - плазмохимическими
азота (C
n ), двуокиси азота и кислорода во вды-
генераторами оксида азота, конструкции которых
хаемой газовой смеси проводили на работающем
описаны в работах [41-43].
манипуляторе до и после ингаляции. Таким обра-
Для измерения параметров NO-содержащей
зом было проведено девять процедур в диапазоне
газовой среды при ингаляционном воздействии
изменения содержания оксида азота C
n от
использовали газовый анализатор OPTIMA
7
100 до 2100 ppm.
производства компании MRU GmbH (Герма-
Интенсивность поглощения оксида азота в
ния), позволяющий измерять в газовых потоках
дыхательной системе при частоте дыхания 12 вдо-
температуру в диапазоне 0-650°С (погрешность
хов/мин и объеме вдыхаемого воздуха 1 литр/вдох
1%), содержание оксида азота CNO и двуокиси
определяли по формуле:
азота C
в диапазоне 0-5000 ppm и 0-1000 ppm
NO2
соответственно с погрешностью 5%, а также со-
-4
in
out
m
= 2.89·10
(C
−
C
),
(1)
NO
NO
NO
держание в потоке кислорода в диапазоне 0-
21.0 об. % с погрешностью ±0.2% об. %.
in
in
гдеC
NO
иC
NO
измерены в ppm, - в мг/с [43].
Измерение артериального давления и пульса у
До и после ингаляции в течение 15 мин при
добровольцев осуществляли с помощью автома-
содержании оксида азота во вдыхаемой газовой
БИОФИЗИКА том 66
№ 1
2021
186
ВАНИН и др.
смеси 500 и 1000 ppm у добровольцев было прове-
Б-ДНКЖ в дыхательные пути животных и в ткань
дено измерение артериального давления и пуль-
легких. В таком объеме, т.е. в дозе 50 микромо-
са. Измерения сатурации крови кислородом у
лей, животным в течение часа вводили Б-ДНКЖ-
добровольца проводили в восьми экспериментах
NAC, тогда как Б-ДНКЖ-GSH вводили в дозе
при длительности ингаляции 4 и15 мин и при со-
100 микромолей в течение 2 ч (дважды по 10 мл
держании оксида азота во вдыхаемом NO-содер-
раствора этого комплекса).
жащем газовом потоке, равном 164, 500, 1008 и
ЭПР-измерения на тканях животных. Спектры
2090 ppm. Измерения проводили каждую минуту
ЭПР замороженных препаратов тканей крыс ре-
закрепленным на среднем пальце левой руки доб-
гистрировали на ЭПР радиоспектрометре Model
ровольца пульсоксиметром до (в течениt
5-
109E (Varian, США) Х-диапазона при 77 К. Об-
6 мин), во время (4 и 15 мин) и после ингаляции в
разцы крови, печени и почек крыс перед замора-
течение времени, при котором величина сатура-
живанием помещали в ампулы диаметром 4 мм с
ции возвращалась к начальному значению.
последующим быстрым замораживанием в жид-
Ингаляция NO животным. Ингаляцию газооб-
ком азоте. Для оценки концентрации парамаг-
разным оксидом азота животных (крыс) осу-
нитных центров, ответственных за регистрируе-
ществляли NO-содержащим газовым потоком,
мые в этих образцах сигналы ЭПР, применяли
формируемым стандартным манипулятором [42]
метод двойного интегрирования этих сигналов, в
аппарата «ПЛАЗОН» с заводским номером 450.
качестве стандартного образца использовали за-
Ингаляцию проводили в течении 1 ч областью
мороженный раствор парамагнитного М-ДНКЖ
NO-содержащего газового потока, находившейся
с глутатионом с известной концентрацией, харак-
на расстоянии 180-200 мм от выходного канала
теризующийся сигналом ЭПР со значениями g-
манипулятора до экспериментального животного,
фактора g⊥ = 2.04, g = 2.014 и gср = 2.03 - сигна-
осевые параметры ингаляционного потока в этой
лом 2.03 [25], на котором мы остановимся ниже.
области: содержание оксида азота CNO = 400 ppm,
Спектры ЭПР некоторых образцов регистрирова-
содержание двуокиси азота CNO
= 30 ppm, тем-
ли при комнатной температуре.
2
пература 38°С.
Статистический анализ результатов проводили,
используя t-критерий Стьюдента с представлени-
Ингаляция животных распыленными водными
ем экспериментальных данных как среднее ± SEM.
растворами Б-ДНКЖ с глутатионом или с NAC.
Эксперименты проводили на нормотензивных
крысах-самцах Вистар массой 300-400 г. Живот-
РЕЗУЛЬТАТЫ
ных анестезировали путем внутривенного введе-
ния им 5%-го раствора кетамина (100 мг/кг мас-
Ингаляция добровольцев газообразным NO со-
сы). Поскольку кетамин оказывает анестезирую-
провождалась почти 90%-м поглощением этого
щее действие лишь на сравнительно короткое
газа в организме человека, о чем свидетельствуют
время, крысам через каждые 30-40 мин этот ане-
приведенные в табл. 1 данные эксперименталь-
стетик вводили дополнительно в дозе 5-10 мг/кг.
ной оценки соотношения между концентрация-
ми вдыхаемого и выдыхаемого оксида азота при
Среднее артериальное давление измерялось с
содержании NO во вдыхаемом воздухе 500 и
использованием катетера, вводившегося в ярем-
1700 ppm в течение 3 мин.
ную артерию, с последующим его подключением к
электроманометру P23 Db (Gould Statham, США),
Измеренное соотношение между содержани-
на котором регистрировали среднее артериальное
ем оксида азота во вдыхаемом и в выдыхаемом
давление на полиграфе Biograph-4 (Санкт-Петер-
воздухе в диапазоне содержания NO во вдыхае-
бургский госуниверситет аэрокисмического при-
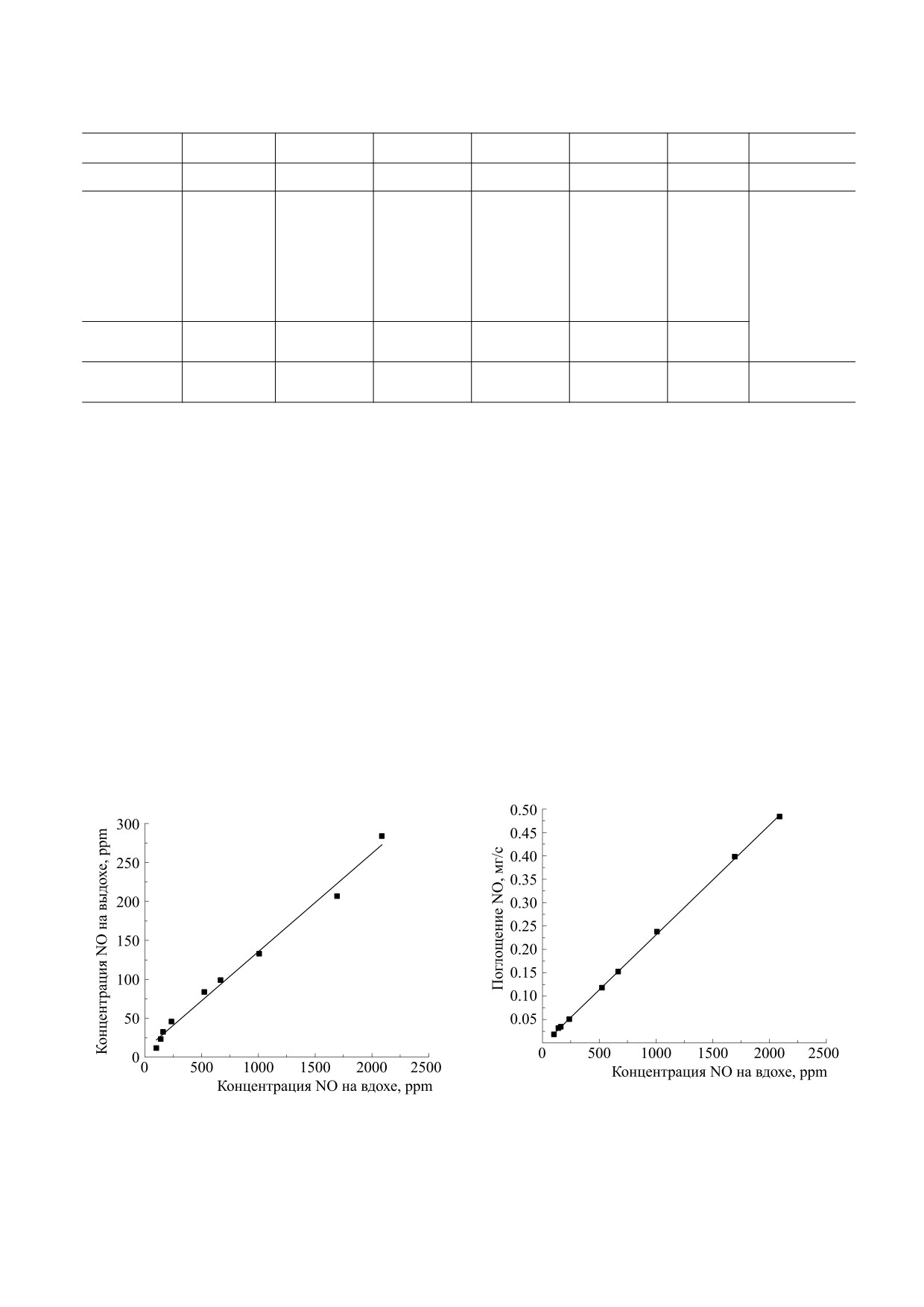
мом воздухе от 100 до 2100 ppm показано на рис. 1,
боростроения, Санкт-Петербург). Запись на ком-
а на рис. 2 приведен пересчет по формуле (1) со-
пьютер выполняли с помощью аналого-цифрового
отношения между количеством вдыхаемого окси-
преобразователя USB 6210 (National Instruments,
да азота и интенсивностью его поглощения в ды-
США) и программы Data Acquisition, модифици-
хательной системе добровольца.
рованной д.б.н. Е.В. Лукошковой для обработки
Оценка степени насыщения крови кислоро-
физиологических сигналов.
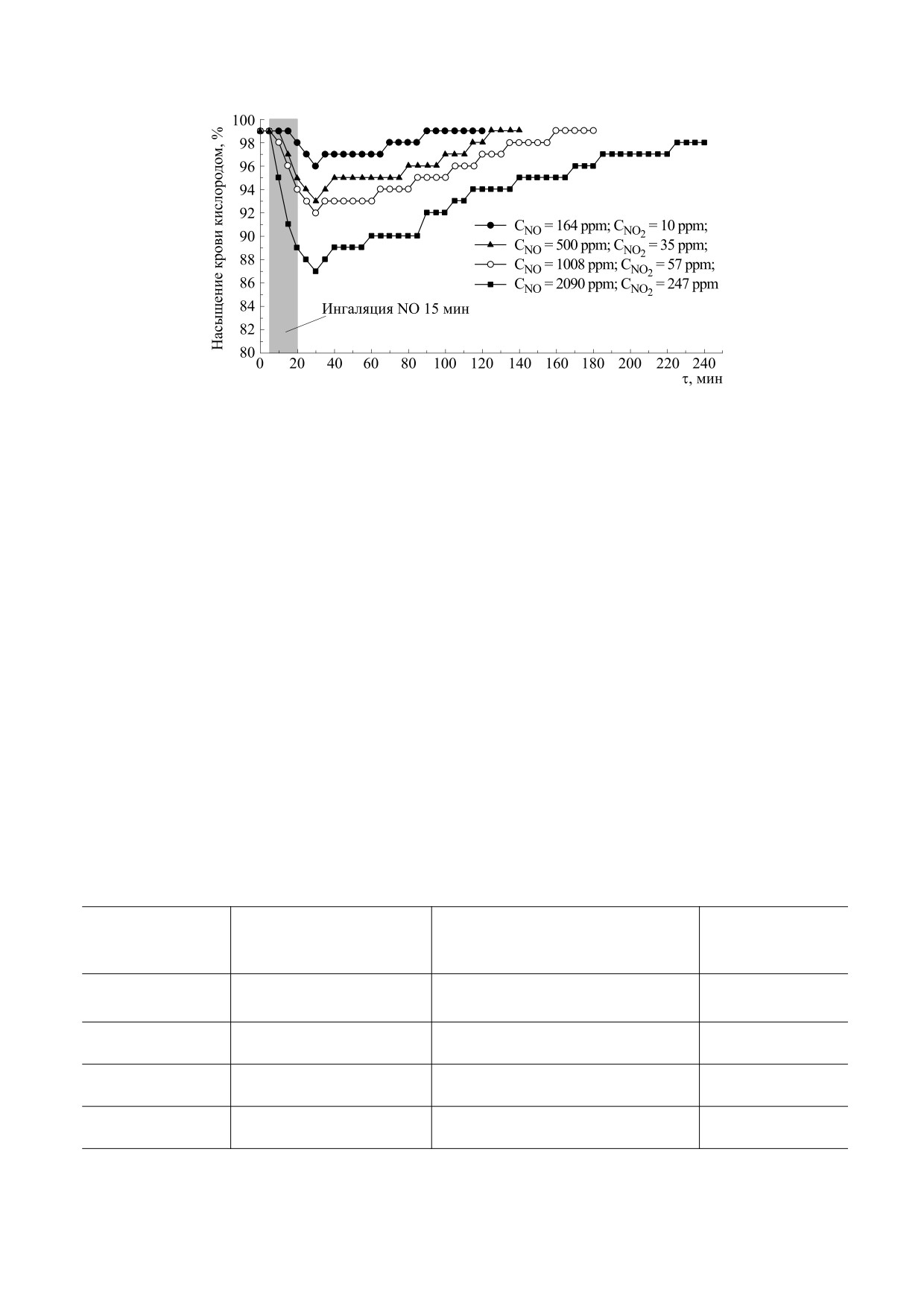
дом у добровольцев при вдыхании ими газообраз-
Ингаляцию распыленных растворов Б-ДНКЖ
ного NO в диапазоне концентраций
164-
с GSH или с NAC проводили, используя для этой
2090 ppm в течение 15 мин показала (рис. 3), что
цели небулайзер фирмы Micrilife (Италия), кото-
эта процедура приводила к быстрому снижению
рый заполняли 10 мл 5 мМ раствора этих комлек-
на несколько процентов содержания кислорода в
сов. Получаемый при этом поток этого распылен-
крови, которое начинало повышаться до нор-
ного раствора, включавший в себя микрокапли
мальных значений только через час и более. Об-
диаметром 2-3 мкм, направляли через специаль-
наруженное снижение, очевидно, было обуслов-
ную иглу в носовую полость животных, что и при-
лено превращением гемоглобина в метгемогло-
водило к поступлению всего
10-мл раствора
бин в результате окисления гемового железа в его
БИОФИЗИКА том 66
№ 1
2021
ГАЗООБРАЗНЫЙ ОКСИД АЗОТА И ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
187
Таблица 1. Результаты измерений содержания газов на вдохе (через нос) и выдохе (через рот)
Время, с
NO, ppm
NO2, ppm
O2, %
NO, ppm
NO2, ppm
O2, %
Локализация
0
500
45
20.9
1700
211
20.8
На вдохе
30
74
0
17.6
166
3
17.8
60
68
0
17.7
184
3
17.8
90
63
0
17.7
202
4
18.1
120
64
0
17.7
215
4
18.2
В выдохе
150
65
0
17.9
231
4
18.2
180
67
0
17.8
243
5
18.2
Средние
66.83
0
17.73
206.83
3.83
18.05
значения
Поглощение,
В дыхательной
86.61
100
3.17
87.79
98.18
2.75
%
системе
нитрозильном комплексе до трехвалентного со-
цу в течение 15 мин газообразного NO в концен-
стояния. Последущее восстановление гемового
трации соответственно 2090-164 ppm.
железа до двухвалентного состояния, в котором
Встает вопрос - в какой мере эти величины со-
оно было способно оксигенироваться, происхо-
ответствовали общему количеству газообразного
дило, судя по результатам, приведенным на
NO, поглощенного организмом добровольцев,
рис. 3, в течение нескольких часов (в зависимости
которое можно было оценить, используя приве-
от степени насыщения крови кислородом).
денное на рис. 2 соотношение между концентра-
цией вдыхавшегося NO и количеством погло-
Если учесть, что количество гемоглобина в 5 л
щенного за одну секунду NO в мг. Как следует из
крови взрослых мужчин составляет ∼12 ммолей, а
данных, представленных в табл. 2, количество
количество гемовых групп, способных связывать
NO, поглощенного организмом добровольцев, по
по одной молекуле NO, равно ∼50 ммолей, то по
мере повышения концентрации NO в газовом по-
степени снижения насыщения крови кислородом
токе начинало существенно превышать количе-
можно оценить количество нитрозильных ком-
ство этого агента, включавшегося в комплексы с
плексов гемоглобина, возникавших в крови доб-
гемоглобином - в 2.3 раза при наибольшей кон-
ровольцев, в зависимости от концентрации NO в
центрации NO (2090 ppm). И только при наи-
газовом потоке и времени его вдыхания. Как сле-
меньшей концентрации NO в газовом потоке
дует из табл. 2, количество NO, связавшегося в
(164 ppm) весь поглощенный организмом NO
крови добровольцев с гемоглобином, варьирова-
оказывался связанным с гемоглобином.
ло от 6.5 до 1.5 ммолей при ингаляции доброволь-
Рис. 2. Интенсивность поглощения оксида азота в
Рис. 1. Соотношение между содержанием оксида азо-
дыхательной системе в зависимости от его содержа-
та во вдыхаемом и в выдыхаемом воздухе.
ния во вдыхаемом воздухе.
БИОФИЗИКА том 66
№ 1
2021
188
ВАНИН и др.
Рис. 3. Типичная кинетика изменения степени насыщения крови (гемоглобина) кислородом у добровольцев после
вдыхания ими NO в течение 15 мин в диапазоне концентраций 164-2090 ppm.
Характерно, что, как показали соответствую-
снижения у них системного давления (табл. 3).
щие измерения, при понижении времени вдыха-
При концентрации NO, равной 500 ppm, и темпе-
ния газообразного NO до 4 мин различие между
ратуре газового потока 50°С артериальное давле-
количеством этого агента, поглощенного орга-
ние у первого добровольца после 15-минутной
низмом и включенным в гемоглобин, полностью
ингаляции снижалось в среднем не более чем на
нивелировалось даже при максимальной концен-
10%, а у второго при той же NO и температуре га-
трации NO в газовом потоке, составлявшей
зового потока 30°С оно практически не изменя-
2100 ррm, - в обоих случаях оно снижалось до
лось, тогда как при концентрации 1000 ppm и
одинаковой величины ∼4 ммоля.
температуре газового потока 25-30°С снижение
Ясно, что молекулы NO, связавшиеся с гемо-
артертального давления у обоих добровольцев не
глобином с последующим их окислением до нит-
обнаруживалось (табл. 3).
рата, не могли вызывать снижения артериального
Ингаляционное введение крысам газообразного
давления. Оно могло быть обусловлено только не
NO, продуцируемого плазмохимическим генера-
связанным с гемоглобином NO, количество кото-
тором в течение 1 ч при содержании NO в газовой
рого составляло при этом 8.5, 3.5 и 1.5 ммоля со-
фазе ∼400 ppm, также практически не сказыва-
ответственно при вдыхании NO в концентрации
лась на артериальном давлении у животных (фик-
2000, 1000 и 500 ppm (табл. 2). Тем не менее оцен-
сировалось снижение менее чем на 5%). При этом
ка уровня артериального давления у доброволь-
в крови методом ЭПР обнаруживалось значи-
цев при таких сравнительно высоких концентра-
тельное количество нитрозильных комплексов
циях вдыхаемого NO не показала существенного
гемоглобина (Hb-NO), обнаруживаемых по ха-
Таблица 2. Соотношение между полным количеством NO, поглощенным организмом добровольца, и
количеством NO, связавшегося в крови добровольца с гемоглобином (в миллимолях) при 15-минутной
ингаляции газообразным NO
Концентрация
Полное количество
Количество NO, связавшегося с
Соотношение А/В
вдыхаемого NO
поглощенного NO (A)
гемоглобином (B)
2000 ррm
15
6.5
2.3
1000 ppm
7
3.5
2.0
500 ppm
4
2.5
1.6
160 ppm
1.5
1.5
1.0
БИОФИЗИКА том 66
№ 1
2021
ГАЗООБРАЗНЫЙ ОКСИД АЗОТА И ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
189
Таблица 3. Артериальное давление у добровольцев до и после 15-минутной ингаляции NO в концентрации 500 и
1000 ppm
Доброволец 1
Артериальное давление и пульс
Измерение
1
2
3
Среднее
До ингаляции CNO = 500 ppm, t = 50°C
131/86, 66
127/87, 67
127/84, 66
128/85, 66
После ингаляции сразу
128/76, 65
113/77, 68
118/74, 68
120/76, 67
После ингаляции через 20 мин
108/76, 66
118/77, 67
116/78, 66
114/77, 66
После ингаляции через 60 мин
134/87, 65
134/88, 65
128/87, 66
132/87, 65
До ингаляции CNO = 1000 ppm, t = 30°C
127/83, 64
128/82, 63
129/86, 63
128/84, 63
После ингаляции сразу
125/80, 64
125/79, 64
123/81, 64
124/80, 64
После ингаляции через 20 мин
121/80, 64
123/80, 65
124/84, 65
122/81, 65
После ингаляции через 60 мин
131/90, 65
134/87, 64
128/86, 65
131/87, 65
Доброволец 2
Артериальное давление и пульс
Измерение
1
2
3
Среднее
До ингаляции CNO = 500 ppm, t = 25°C
155/96, 65
151/95, 65
146/93, 65
151/95, 65
После ингаляции сразу
149/92, 62
149/90, 62
150/91, 62
149/91, 62
После ингаляции через 20 мин
143/91, 64
142/89, 63
143/93, 63
143/91, 63
После ингаляции через 60 мин
148/95, 63
148/94, 63
147/91, 63
148/93, 63
До ингаляции CNO = 1000 ppm, t = 30°C
154/94, 63
154/97, 63
153/96, 65
154/96, 64
После ингаляции сразу
145/87, 60
146/89, 63
148/89, 61
146/88, 61
После ингаляции через 20 мин
144/90, 62
149/91, 63
150/92, 62
147/91, 62
После ингаляции через 60 мин
156/93, 62
155/96, 65
153/95, 65
155/95, 64
Примечание: t - температура NO-содержащего газового потока в области ингаляции.
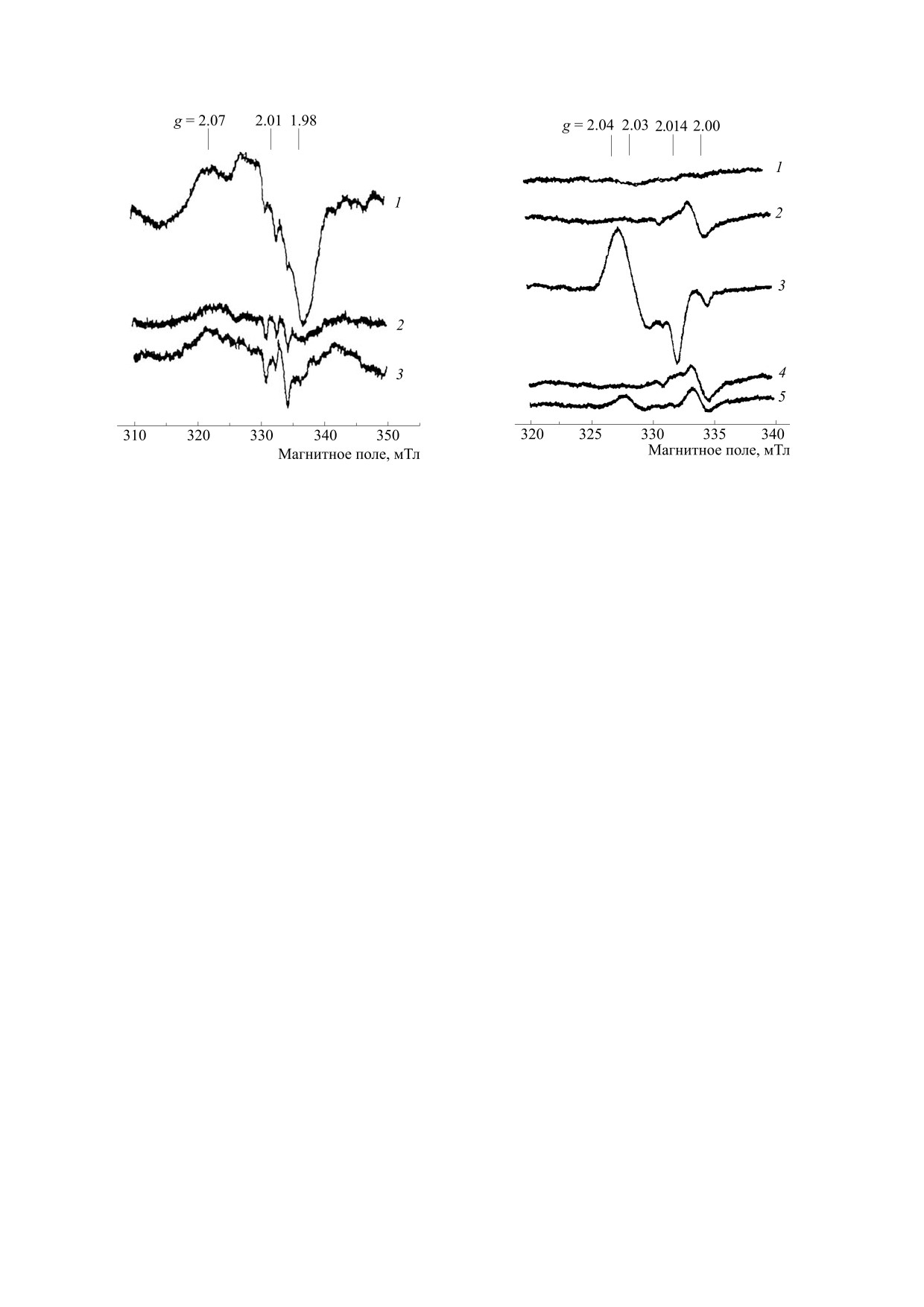
рактерному для них сигналу ЭПР со значениями
скольку заметного снижения системного артери-
g-фактора g1 =2.07, g2 = 2.01 и g3 = 1.98 с триплет-
ального давления при этом не обнаруживалось,
ной сверхтонкой структурой с центром при
есть основание утверждать, что подавляющая
g2 = 2.01 (рис. 4a). Концентрация этих комплек-
часть газообразного NO, поступавшего через лег-
сов достигала 75 микромолей/л крови или 6 мик-
кие в кровь, связывалась с гемоглобином, так что
ромолей на кг массы животных.
оставшейся части NO (несвязавшейся в крови с
гемоглобином) было недостаточно для иниции-
Этот стационарный по своему происхожде-
рования снижения артериального давления.
нию уровень определялся соотношением скоро-
стей поступления газообразного NO в кровь, с од-
Сигнал ЭПР Hb-NO, обусловленный сохране-
ной стороны, и, с другой стороны, скоростью
нием в органах животных остаточной крови, ре-
окисления NO в составе нитрозильных комплек-
гистрировался практически во всех органах жи-
сов Hb кислородом воздуха, приводившего к ис-
вотных, прошедших процедуру ингаляции газо-
чезновению этих комплексов [35, 36].
образным NO. На рис. 4 приведены такого рода
сигналы, зарегистрированные в легких и почках
Появление значительного количества ком-
крыс. Образование других парамагнитных нитро-
плексов Hb-NO в крови показывает, что газооб-
зильных комплексов железа, а именно М-ДНКЖ
разный NO при ингаляционном введении доста-
точно легко проникал в кровь и далее в эритоци-
с тиолсодержащими лигандами, характеризую-
ты, в которых, связываясь с гемовыми группами
щихся сигналом ЭПР с gср =2.03, приводимым
гемоглобина, образовывал ЭПР-регистрируемые
ниже на рис. 5 и 6, в исследованных препаратах
мононитрозильные комплексы Hb-NO. По-
крыс обнаружено не было.
БИОФИЗИКА том 66
№ 1
2021
190
ВАНИН и др.
Рис. 5. Спектры ЭПР замороженных препаратов крови
(1), сердца (2), легких (3), печени (4) и почек (5) крысы
Рис. 4. Спектры ЭПР замороженных препаратов
при ингаляционном введении ей в течение двух часов
крови (1), легких (2) и почек (3) крысы, взятых после
одночасовой ингаляции животного газообразным
распыленного водного раствора Б-ДНКЖ с глутатио-
NO. Условия записи: Т = 77 К, амплитуда модуляции
ном. Условия записи: Т = 77 К, амплитуда модуляции
0.4 мТл, усиление радиоспектрометра ×104.
0.4 мТл, усиление радиоспектрометра ×104.
дившего к превращению Б-ДНКЖ в белок-свя-
Ингаляция крыс распыленными водными рас-
занные М-ДНКЖ, была выше для Б-ДНКЖ-
творами Б-ДНКЖ-NAC или Б-ДНКЖ-GSH соот-
ветственно в количестве 50 или 100 микромолей
NAC. Не исключено, что это было обусловлено
на животное в течение одного или двух часов при-
способностью NAC как тиолсодержащего лиган-
водила к появлению в ткани легких этих живот-
да более легко, чем GSH, проникать сквозь кле-
ных белок-связанных М-ДНКЖ, обнаруживае-
точные мембраны.
мых по характерному для них сигналу ЭПР со
Сигнал 2.03 с интенсивностью, соответствую-
значениями g-фактора g = 2.04, g = 2.014,
щей 10 ± 5 и 30 ± 10 мкM/кг влажной ткани у
gср = 2.03, о котором упоминалось выше (называ-
крыс, ингалированных соответственно Б-ДНКЖ
емому в соответствии со средним значением
с GSH и с NAC, был зарегистрирован также в тка-
g-фактора сигналом 2.03) (рис. 5, спектр 3; рис. 6,
ни почек (рис. 5, спектр 5; рис. 6, спектр 2). Появ-
спектр 1). О белковой природе М-ДНКЖ свиде-
ление М-ДНКЖ в почках свидетельствует о том,
тельствовал факт сохранения такой же анизо-
что небольшая часть Б-ДНКЖ могла через легкие
тропной формы сигнала 2.03 при повышении
поступать в кровь и затем аккумулироваться в
температуры его регистрации до комнатной: низ-
кая подвижность белковой глобулы, включавшей
почках с последующим удалением образовавших-
М-ДНКЖ, была недостаточна при этой темпера-
ся М-ДНКЖ из организма. Что касается крови,
туре для усреднения анизотропии g-фактора
то судя по едва регистрируемому в ней сигналу
2.03 с интенсивностью, соответствующей не бо-
Судя по интенсивности сигнала 2.03, реги-
лее 1-2 мкM/л, стационарный уровень белок-
стрируемого в легких, концентрация М-ДНКЖ в
связанных М-ДНКЖ был незначителен и не мог
ткани этого органа при ингаляции животным
инициировать заметного снижения артериально-
Б-ДНКЖ c GSH или с NAC составляла соответ-
го давления у животных. Действительно, при ин-
ственно 70 ± 20 и 90 ± 20 мкM/кг влажной ткани.
галяции крысам Б-ДНКЖ-GSH никакого замет-
Поскольку по отношению к исходному количе-
ного снижения артериального давления у этих
ству Б-ДНКЖ, поступавшему в организм живот-
животных не обнаруживалось. Небольшое (не
ных (соответственно 100 и 50 микромолей на жи-
вотное), стационарная концентрация М-ДНКЖ
более чем 5%-е) снижение артериального давле-
в легких у животных, вдыхавших Б-ДНКЖ-NAC,
ния у животных наблюдалось при введении им
была примерно в два раза выше, есть основание
Б-ДНКЖ-NAC. Судя по результатам работ [38,
полагать, что эффективность взаимодействия
39], заметное снижение артериального давления у
этих комплексов с белковым материалом, приво-
крыс (на ∼20%) имело место при внутривенном
БИОФИЗИКА том 66
№ 1
2021
ГАЗООБРАЗНЫЙ ОКСИД АЗОТА И ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
191
Рис. 6. Спектры ЭПР замороженных препаратов легких (1), почек (2), крови (3), сердца (4), печени (5) и скелетной
мышцы (6) крысы после одночасового ингаляционного введения ей распыленного водного раствора Б-ДНКЖ с
Nрацетил-L-цистеином. Условия записи: Т = 77 К, амплитуда модуляции 0.4 мТл, усиление радиоспектрометра ×104.
введении им ∼30 мкM/л Б-ДНКЖ с GSH или ци-
ляции газообразного NO на добровольцах, - что
стеином.
при высоких дозах этого агента, поступающего в
организм человека, значительная его часть (более
Что касается интенсивности сигнала 2.03 в
половины - до 8.5 ммолей при концентрации NO
других тканях - в тканях печени и сердца, она,
в газовом потоке 2100 ppm) оставалась не вклю-
как и в крови, была незначительной и соответ-
ченной в комплексы с гемоглобином. Встает во-
ствовала не более 2-3 мкM/кг влажной ткани
прос - почему молекулы NO, поступающие в лег-
(рис. 5, 6). Характерно, что ни в легких и почках,
кие, начинали задерживаться в ткани легких и,
ни в крови, ни в других тканях крыс при введении
очевидно, в ткани дыхательных путей, не посту-
им Б-ДНКЖ с GSH или с NAC появление Hb-NO
пая в кровь, где они могли бы связаться с молеку-
не обнаруживалось, судя по спектрам ЭПР. Это
лами гемоглобина как ловушками NO? И второй
означает, что не имело места заметное высвобож-
вопрос - почему, как это следует из табл. 2, за-
дение нейтральных молекул NO из вводимых
держка NO в ткани легких усиливалась по мере
ДНКЖ.
повышения дозы NO, поступавшего в эти ткани?
Таким образом ингаляционное введение кры-
Ответы на эти вопросы можно получить исхо-
сам в течение 1 или 2 ч в составе распыленных вод-
дя из данных, полученных в работах [44, 45], в ко-
ных растворов 50 или 100 микромолей ДНКЖ с
торых изучалось действие газообразного NO на
тиолсодержащими лигандами (0.2 или 0.4 ммо-
культуры клеток животных. В работе [44] было
ля/кг веса животных) не оказалось опасным в от-
достаточно убедительно показано, что ДНКЖ с
ношении снижения артериального давления. По-
тиолсодержащими лигандами по своему количе-
давляющая часть этих комплексов локализовалась
ству доминируют среди других продуктов, обра-
в легких. При этом их концентрация в легких -
зующихся в реакции NO с внутриклеточным со-
0.07-0.09 ммоля/кг массы ткани - была суще-
держимым - S-нитрозотиолами, органическими
ственно ниже токсической дозы использованных
и неорганическими нитритами и нитратами. Этот
комплексов согласно данным, приводимым в ра-
результат указывает на то, что именно включение
боте [37]. Величина LD50 для Б-ДНКЖ с глутатио-
NO в эти комплексы могло определять задержку
ном для крыс при внутривенном введении им этих
NO в тканях легких и дыхательных путей при
комплексов оказалась равной 3.8 ммолей ДНКЖ
вдыхании этого агента добровольцами. Что каса-
/кг массы животного [37].
ется работы [45], то в ней было обнаружено зна-
чительное повышение уровня слабосвязанного
(«свободного») железа при понижении содержа-
ОБСУЖДЕНИЕ
ния кислорода в среде культивирования клеток
Неожиданный и наиболее интересный резуль-
животных, т.е. в условиях гипоксии, которое при-
тат, полученный при изучении последствий инга- водило к резкому повышению количества ДНКЖ
БИОФИЗИКА том 66
№ 1
2021
192
ВАНИН и др.
с тиолсодержащими лигандами, образующимися
крыс (рис. 4) сигнала 2.03 не означает, что в лег-
в реакции NO и тиолов со «свободным» железом.
ких у крыс, обработанных газообразным NO, не
Таким образом, исходя из этих результатов, мож-
возникали ДНКЖ в их биядерной форме.
но предположить, что обнаруженное нами усиле-
Тем не менее ясно, что вопрос о возникнове-
ние задержки NO в ткани легких и дыхательных
нии ДНКЖ с тиолсодержащими лигандами в ор-
путей по мере повышения дозы вдыхаемого доб-
ганах животных (и человека) при ингаляции газо-
ровольцами газообразного NO могло быть обу-
образным NO остается открытым и требует даль-
словлено повышением содержания ДНКЖ в этих
нейших исследований.
органах, естественно, в соответствии с законом
действующих масс, а также из-за повышения в
Полученные нами результаты свидетельству-
них уровня свободного железа. Последнее, в свою
ют о том, что преимущественная локализация
очередь, могло определяться ослаблением окси-
ДНКЖ с тиолсодержащими лигандами в тканях
генации тканей легких и дыхательных путей, т.е.
легких и дыхательных путей при введении живот-
их гипоксией в результате включения кислорода,
ным этих комплексов как предварительно синте-
поступавшего в них из воздуха, в реакцию с газо-
зированных, так и (как это предполагается) воз-
образным NO с образованием диоксида азота
никающих в этих тканях при введении газообраз-
(NO2).
ного NO приводит к тому, что заметное снижение
Таким образом, ингаляция добровольцев газо-
артериального давления у этих животных не име-
образным NO могла приводить к поглощению
ет места. Этот результат снимает возражение про-
значительной части этого агента в тканях легких и
тив проведения ингаляционного введения газо-
дыхательных путей в результате его включения в
образного NO или низкомолекулярных ДНКЖ с
ДНКЖ с тиолсодержащими лигандами. Тем са-
тиолсодержащими лигандами пациентам с
мым реализовалась ситуация, аналогичная инга-
СOVID-19 c целью возможного купирования это-
ляционному введению распыленных растворов
го заболевания.
этих комплексов, исследованному в нашей рабо-
Как предполагается в работе [22], цитотокси-
те. В обоих случаях как у добровольцев, так и у
ческое действие ДНКЖ с тиолсодержащими ли-
животных не обнаруживалось заметного влияния
гандами на короновирус может определяться
исходно вводимых газообразного NO и ДНКЖ с
способностью этих комплексов выступать в каче-
GSH или с NAC на системное артериальное дав-
ление: ДНКЖ, образующиеся после введения
стве доноров NO+, обеспечивающих S-нитрози-
рование важнейших для репликации SARS-CoV-2
добровольцам NO или те же комплексы, исходно
вируса и тем самым способных вызывать купиро-
вводившиеся животным, локализовались в ос-
новном в легких.
вание COVID-19. Не исключено, что накопление
ДНКЖ с тиолсодержащими лигандами в тканях
Из результатов экспериментов на животных
легких и дыхательных путей, т.е. основных мест
следует, что ингаляционно вводимые им ДНКЖ
локализации коронавируса в организме человека,
не переходили в заметном количестве в кровь.
при контакте этих тканей как с газообразным NO,
Наибольшая их концентрация в крови крыс со-
так и с экзогенными низкомолекулярными
ставляла 1-2 мкM/л, что было существенно ниже
ДНКЖ может оказать существенное положитель-
концентрации этих комплексов (30-40 мкM/л),
ное действие на процесс устранения короновиру-
вводившихся нормотензивным крысам внутри-
са из организма человека.
венно, при которой системное артериальное дав-
ление снижалось на 20% [38, 39].
Следует отметить, что в опытах с ингаляцией
ФИНАНСИРОВАНИЕ РАБОТЫ
крысам газообразного NO в легких и печени этих
животных были зарегистрированы сигналы ЭПР,
Работа выполнена в рамках Государственного
характерные только для комплексов Hb-NO
задания Министерства образования и науки РФ
(рис. 4). Сигнал 2.03, характерный для М-ДНКЖ
(00008202014-00018, № АААА-А17-117040810310-
с тиолсодержащими лигандами, даже в легких не
8, 0082-2014-0008, и AAAA-A17-1170403100008-5),
наблюдался, что, казалось бы, не согласуется с
спонсирована Российским академическим про-
высказанным выше предположением о возмож-
ектом «5-100», а также финансирована в рамках
ности образования этих комплексов у таких жи-
грантов Российского фонда фундаментальных
вотных. Это несоответствие снимается, если
исследований No. 18-04-00059a и 18-015-00027.
учесть, что в тканях животных ДНКЖ с тиолсо-
держащими лигандами существуют преимуще-
ственно не в ЭПР-активной, т.е. парамагнитной
КОНФЛИКТ ИНТЕРЕСОВ
мономерной форме (М-ДНКЖ), а в ЭПР-неак-
тивной, т.е. диамагнитной форме - Б-ДНКЖ [46,
Авторы заявляют об отсутствии конфликта
47]. Поэтому отсутствие в спектре ЭПР легких
интересов.
БИОФИЗИКА том 66
№ 1
2021
ГАЗООБРАЗНЫЙ ОКСИД АЗОТА И ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
193
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
24. A. F. Vanin and D. Sh. Burbaev, J. Biophys. 2011,
878236 (2011). DOI: 10.1155/2011/878236
Все применимые международные, националь-
ные и институциональные принципы ухода и ис-
25. A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
пользования животных при выполнении работы
tric Oxide Biol. Chem. 23, 136 (2011).
были соблюдены. Процедуры, выполненные в
26. A. F. Vanin, Dinitrosyl Iron Complexes as a “Working
исследовании с участием людей, соответствовали
Form” of Nitric Oxide in Living Organisms (Cambridge
этическим стандартам Хельсинкской декларации
Scholars Publishing, Cambridge, UK, 2019).
1964 г. и ее последующим изменениям. От участ-
27. A. F. Vanin, Cell Biochem. Biophys. 77, 279 (2019).
ников исследования было получено информиро-
28. A. F. Vanin, Appl. Magn. Res. 51, 851 (2020). DOI:
ванное добровольное согласие.
10.1007/s00723-020-01270-6
29. C. F. Badorff, B. Fichtlscherer, A.Mülsch, et al., Nitric
СПИСОК ЛИТЕРАТУРЫ
Oxide Biol. Chem. 6, 305 (2002).
1. Н. О. Быкова, Н. В. Горбунов, А. А. Волгарев и др.,
30. C. F. Badorff, B. Fichtlscherer, R. E. Roads, et al., Cir-
Бюлл. эксп. биол. мед. 112, 617 (1991).
culation 102, 182 (2000).
2. G. Karupian and N. Harris, J. Exp. Med. 181, 2171
31. A. L. Kleschyov, S. Strand, S. Schmitt, et al., Nitric
(1995).
Oxide Biol. Chem. 40, 1340 (2006).
3. E. Peterhans, Biol. Trace Element Res. 56, 107 (1997).
32. M.-D. Fratacci, C. G. Frostell, et al., Anesthesiology
4. T. Akaike and H. Maeda, Immunology 101, 300 (2000).
75, 990 (1991).
5. S. Akerstrom, M. Mousavi-Jazi, J. Klingstrom, et al., J.
33. C. Frostell, M.-D. Fratacci, J. C. Wain, et al., Circula-
Virol. 78, 1966 (2005).
tion 83, 2038 (1991).
6. C. J. Lowenstein, S. L. Hill, A. Lafond-Walker, et al, J.
34. B. Yu, F. Iscinose, D. B. Bloch, et al., Br. J. Pharmacol.
Clin. Invest. 97, 1837 (1996).
176, 246 (2019).
7. C. S. Reiss and T. Kamatsu, J. Virol. 72, 4547 (1998).
35. A. Wennmalm, G. Benthin, A. Edlund, et al., Circ.
8. E. Keyaerts, L. Vijgen, L. Chen, et al., Int. J. Infect.
Res. 73, 1121 (1993).
Dis. 8, 223 (2004).
36. C. Miller, M. Miller, G. Regev, et al., J. Cystic Fibrosis
9. W. Xu, S. Zheng, R.A. Dweik, et al., Free Radic. Biol.
11, 324 (2012).
Med. 41, 19 (2006).
37. E. I. Chazov, O. V. Rodnenkov, A. V. Zorin, et al., Ni-
10. G. Regev-Shoshani, S. Vimalanathan, B. McMullin, et
tric Oxide Biol. Chem. 26, 148 (2012).
al., Nitric Oxide Biol. Chem. 31, 48 (2015).
38. V. L. Lakomkin, A. F. Vanin, A. A. Timoshin, et al., Ni-
11. E. U. Uehara, B. de Stefano Shida, and C. A. de Brito,
tric Oxide Biol. Chem. 16, 413 (2007).
Inflamm. Res. 64, 845 (2015).
39. A. A. Timoshin, V. L. Lakomkin, A. A. Abramov, et al.,
12. M. Colosanti, T. Persichini, G. Venturini, et al.,
Eur. J. Pharmacol. 765, 525 (2015).
IUBMB Life, 48, 25 (1999).
40. T. Liu, M. Zhang, M. H. Terry, et al., Mol. Pharmacol.
13. L. A. Perrone, J. A. Belser, D. A. Wadford, et al, J. In-
93, 427 (2018).
fect. Dis. 207, 1576 (2013)
41. А. В. Пекшев, Н. П. Козлов, А. Б. Вагапов и др., в кн.
14. D. Torre and G. Ferrario, Med. Hypothesis 47, 405
NO-терапия: теоретические аспекты, клинический
(1996).
опыт и проблемы применения экзогенного оксида азо-
15. L. J. Ignarro, Br. J. Pharmacol. 177, 3848 (2020).
та в медицине, под ред. С. В. Грачева, А. Б. Шехтера
16. J. Zhang, B. Xie, and K. Hashimoto, Brain, Behavior,
и Н. П. Козлова (Издательский дом «Русский врач»,
and Immunity 87, 59 (2020).
М., 2001), с. 192.
17. A. Cavezzi, E, Troiani, and S. Corrao, Clinics and
42. A.V. Pekshev, A.B. Shekhter, A.V. Vagapov, et al., Ni-
Practice 10, 1271 (2020).
tric Oxide Biol. Chem. 73, 74 (2018).
18. J. Kobayashi and I. Murata, Ann. Intensive Care 10, 61
43. A. B. Shekhter, A. V. Pekshev, A. B. Vagapov, et al,
(2020).
Clin. Plasma Med.
19-20,
100101
(2020).
doi.org/10.1016/j.cpme.2020.100101
19. N. A. Adusumilli, D. Chang, J. M. Friedman, et al.,
Nitric Oxide Biol. Chem. 103, 4 (2020).
44. J. R. Hickok, S. Sahni, H. Shen, et al., Free Rad. Biol.
20. B. S. Fakhr, S. B. Wiegand, R. Pinkiroli, et al., Obstet-
Med. 51, 1558 (2011).
rics & Gynecology
135
(6),
1109
(2020). DOI:
45. Q. Li, C. Li, H. K. Mahtani, et al., J. Biol. Chem. 289,
10.1097/AOG.0000000000004128
19917 (2014).
21. R. Parikh, C. Wilson, J. Weinberg, et al., Ther. Adv.
46. V. D. Mikoyan, E. N. Burgova, R. R. Borodulin, et al.,
Respir. Dis. 14, 1 (2020).
Nitric Oxide Biol. Chem. 62, 1 (2017).
22. А. Ф. Ванин, Биофизика 65, 818 (2020).
47. В. Д. Микоян, Е. Н. Бургова, Р. Р. Бородулин и
23. 23. A. F. Vanin, Nitric Oxide Biol. Chem. 21, 1 (2009).
А. Ф. Ванин, Биофизика 65, 1142 (2020).
БИОФИЗИКА том 66
№ 1
2021
194
ВАНИН и др.
Gaseous Nitrogen Oxide and Dinitrosyl Iron Complexes with Thiol-Containing Ligands
as Potential Medicines that Can Relieve COVID-19
A.F. Vanin*, **, A.V. Pekshev***, A.B. Vagapov***, N.A. Sharapov***, V.L. Lakomkin****,
A.A. Abramov****, A.A. Timoshin****, and V.I. Kapelko****
*Semenov Federal Research Center of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Institute of Regenerative Medicine, Sechenov First Moscow State Medical University, Ministry of Health of the Russian
Federation, Trubetskaya ul. 8/2, Moscow, 119991 Russia
***Bauman Moscow State Technical University, 2-ya Baumanskaya ul. 5/1, Moscow, 105005 Russia
****National Medical Research Center of Cardiology, Ministry of Health of the Russian Federation,
ul. 3-ya Chrepkovskaya 15a, Moscow, 121552 Russia
It has been shown that administration of inhaled gaseous nitric oxide (gNO) or sprayed aqueous solutions of
binuclear dinitrosyl iron complexes with glutathione or N-acetyl-L-cysteine to animals and humans was not
associated with the noticeable hypotensive effects in subjects. Potentially, these attributes may be useful in
treatment of COVID-19. It was found that increasing the NO concentration from 100 to 2100 ppm in the gas
flow created by the Plazon system caused a decrease in the NO level in complexes with hemoglobin in the
blood, so that at 2000 ppm, more than half of this gas was included into dinitrosyl complexes formed in tissues
of the lungs and respiratory tract. Thus, inhalation of gNO may lead to effects similar to those observed after
analogous administration of solutions of dinitrosyl iron complexes, namely, to the presence of dinitrosyl iron
complexes with thiol-containing ligands in lung and respiratory tissues. Taking into account the hypothesis
posited earlier (Biophysics 65, 818, 2020) that these complexes as donors of the nitrosonium cation are able
to suppress coronavirus replication, it is not unlikely that usage of gaseous NO and chemically synthesized
dinitrosyl iron complexes with thiol-containing ligands may help treat COVID-19.
Keywords: nitric oxide, dinitrosyl iron complexes, COVID-19
БИОФИЗИКА том 66
№ 1
2021