БИОФИЗИКА, 2021, том 66, № 2, с. 230-239
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.352
ВЛИЯНИЕ СВЯЗЫВАНИЯ КОФАКТОРА НА ВНУТРИМОЛЕКУЛЯРНУЮ
ДИНАМИКУ ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТДЕГИДРОГЕНАЗЫ
© 2021 г. А.А. Кошкаров, О.Н. Макшакова
Казанский институт биохимии и биофизики ФИЦ «Казанский научный центр РАН»,
420111, Казань, ул. Лобачевского, 2/31
E-mail: olga.makshakova@kibb.knc.ru
Поступила в редакцию 02.12.2019 г.
После доработки 26.07.2020 г.
Принята к публикации 09.11.2020 г.
Глицеральдегид-3-фосфатдегидрогеназа является одним из ключевых ферментов гликолиза, кроме
того, белок вовлечен в регуляцию широкого ряда клеточных функций, включая индукцию апопто-
за. Глицеральдегид-3-фосфатдегидрогеназа также участвует в развитии ряда патологических состо-
яний, нейродегенеративных и раковых заболеваний. Новые подходы к регуляции активности
фермента требуют детального понимания организации его пространственной и динамической
структуры. В данной работе проведено исследование взаимодействия кофактора никотинамидаде-
ниндинуклеотида с димерами, составляющими тетрамер соматического глицеральдегид-3-фосфат-
дегидрогеназы человека, методом молекулярной динамики. Охарактеризовано влияние связывания
кофактора на внутримолекулярную динамику белка. Показано, что димеры связывают кофактор с
разными энергиями, что связано с подвижностью S-петли и ее способностью взаимодействовать с
молекулой кофактора. В димере ОР, стабилизированном обширными контактами протяженных бе-
та-структур, обнаружены группы остатков в смежных субъединицах, которые движутся согласован-
но, при этом показано, что связывание кофактора модулирует характер коррелированных движе-
ний в димере.
Ключевые слова: глицеральдегид-3-фосфатдегидрогеназа, связывание лиганда, кооперативность, алло-
стерия, молекулярная динамика.
DOI: 10.31857/S0006302921020034
Глицеральдегид-3-фосфатдегидрогеназа (ГАФД,
рые вовлечен ГАФД, актуальной задачей стано-
вится поиск способов регуляции его активно-
КФ 1.2.1.12) является одним из ключевых фер-
сти [3, 6].
ментов гликолиза, который катализирует окис-
лительное фосфорилирование глицеральдегид-
Основные успехи и неудачи в поисках ингиби-
3-фосфата в 1,3-дифосфоглицерат при восста-
торов ГАФД, в том числе селективных ингибито-
новлении кофактора НАД+ до НАД(Н). Кроме
ров изоферментов из разных источников, отраже-
того, белок задействован в широком ряде дру-
ны в недавнем обзоре [6]. С 90-х годов прошлого
века стратегия селективного ингибирования
гих клеточных функций, включая такие про-
ГАФД, направленная на некоторые паразитарные
цессы, как клеточная адгезия, экспорт тРНК,
и спермо-специфические белки млекопитающих
репарация ДНК и регуляция экспрессии генов
(ГАФДс), была основана на конкурентном связы-
[1, 2]. К тому же ГАФД вовлечен в процессы ин-
вании ингибиторов в области активного центра
дукции апаптоза [3] и развития нейродегенера-
белка [7-9]. Селективность по отношению к целе-
тивных заболеваний, включая болезни Альц-
вому ферменту достигалась за счет слабых разли-
геймера и Паркинсона [4]. При отклонениях от
чий в НАД-связывающем кармане этого белка по
нормы, например в клетках меланомы, наблю-
сравнению с соматическим ГАФД человека. Одна-
дается
экспрессия
тканенеспефицичной
ко высокая консервативность активного центра
формы ГАФД, что сопряжено с развитием
ГАФД серьезно ограничивает такой подход, что
злокачественных образований [5]. В связи с
подталкивает исследователей к поиску новых пу-
разнообразием дисфункций организма, в кото-
тей решения этой проблемы [6]. В качестве альтер-
нативного подхода в разработке ингибиторов
Сокращения: ГАФД - глицеральдегид-3-фосфатдегидроге-
предлагается использование удаленных участков
наза, rmsf - среднеквадратичная флуктуация (root mean
square fluctuation). .
белка, которые аллостерически связаны с актив-
230
ВЛИЯНИЕ СВЯЗЫВАНИЯ КОФАКТОРА
231
Рис. 1. (а) - Тетрамер глицеральдегид-3-фосфатдегидрогеназы с кофактором НАД (указаны сферами). Буквенные
обозначения субъединиц соответствуют их конвенциональной аннотации в pdb файле, оси симметрии Q и R указаны
линиями и подписаны курсивом. (б) - Домены субъединицы ГАФД со связанным кофактором (показан зеленым
цветом) и остатки каталитического центра (атомы углерода - серым, азота - синим, кислорода - красным и серы -
желтым цветом).
ным центром ГАФД; рациональное развитие тако-
асимметрии в тетрамере до индуцированных изме-
го подхода требует детального понимания особен-
нений конформации при связывании кофактора,
ностей динамической структуры изоферментов
согласованных или последовательных
[11-17].
ГАФД [10]. В данной работе мы попытались при-
Позже данные рентгеноструктурного анализа по-
близиться к пониманию организации динамиче-
казали, что субъединицы в составе тетрамера
ской структуры соматического ГАФД человека.
ГАФД имеют одинаковую пространственную ор-
ганизацию, причем она слабо меняется при связы-
ГАФД - природный гомотетрамер (рис. 1).
вании кофактора [9, 18]. Одним из подходов для
Каждая его субъединица состоит из двух доменов,
каталитического (аа 151-316) и НАД-связывающе-
определения вклада межсубъединичных контак-
тов в кооперативность ГАФД является изучение
го (аа 1-150 и 317-335). ГАФД имеет три оси дву-
кратной симметрии. Ось Р определяет область
этого явления в димерах белка. Экспериментально
контакта между О- и Р- (Q- и R-) субъединицами.
было показано, что из трех возможных типов ди-
Этот контакт имеет наибольшую площадь среди
меров ГАФД из Bacillus stearothermophilus только
трех типов димеров и образуется протяженными
два формируют стабильные надмолекулярные
участками β-слоев каталитических доменов сосед-
структуры, а именно димеры типа OP и OR [19].
них субъединиц. Ось R определяет НАД-связыва-
Оба димера оставались способными связывать
ющую бороздку между О- и R- (P- и Q-) субъеди-
НАД, но кооперативность проявлял только димер
ницами, которые взаимодействуют главным обра-
типа ОР. Понимания механизмов кооперативно-
зом посредством S-петли. Контакты по оси Q
сти ГАФД на атомном уровне добавляют данные,
являются самыми слабыми, поэтому ГАДФ может
полученные с помощью сайт-направленного мута-
быть представлен как димер димеров относитель-
генеза на примере человеческого ГАФДс [20]. Бы-
но оси Q.
ло установлено, что кооперативность тетрамера
Известно, что в зависимости от источника
можно «выключить» путем замены лишь одного
аминокислотного остатка (D311N), который рас-
ГАФД обладает отрицательной или положитель-
ной кооперативностью по связыванию кофактора.
полагается вблизи ОР-контакта. Это указывает на
В частности, соматический ГАФД демонстрирует
ключевую роль данного остатка в передаче сигнала
отрицательную кооперативность [11, 12]. Коопера-
между активными центрами субъединиц. Метода-
тивность изучалась с помощью различных экспе-
ми молекулярной динамики было показано, что
риментальных подходов на протяжении десятиле-
данный остаток вовлечен в динамическую сеть, в
тий, предлагались модели от предсуществующей
которой остатки движутся коррелировано [10]. В
БИОФИЗИКА том 66
№ 2
2021
232
КОШКАРОВ, МАКШАКОВА
рамках концепции динамически-управляемой ал-
нии. Для поддержания постоянной температуры
лостерии [21] можно предположить, что внутри-
300 К использовали термостат V-rescale [23], где ре-
молекулярная динамика ГАФД играет ключевую
гуляция температуры была распределена меж-
роль в регуляции передачи сигнала как между
ду двумя группами или так называемыми «ванна-
субъединицами, так и по молекуле белка в целом.
ми», а именно воды с ионами и белка с кофактором
(если последний присутствовал в системе) с вре-
Метод молекулярной динамики позволяет оха-
менной константой 0.1 пс. Поддержание давления
рактеризовать эволюцию энергетических и гео-
в 1 бар контролировали баростатом Берендсена
метрических характеристик молекулярной систе-
[24], значение сжимаемости задавалось равным
мы во времени и получить описание взаимодей-
ствий всех ее компонент на атомном уровне с
3 ⋅ 10-4 бар-1, а период релаксации давления - рав-
учетом динамики, что делает метод незаменимым
ным 5 пс. Осцилляции ковалентных связей с уча-
для решения обозначенной задачи. Однако, на-
стием атомов водорода ограничивали по алгоритму
сколько нам известно, коррелированность движе-
Lincs, благодаря чему временной шаг интегрирова-
ний остатков в ГАФД до сих пор изучалось лишь
ния при численном решении уравнений движения
для небольшого фрагмента белка, не более семи
составлял 2 фс. Использовали интегратор leap-frog.
остатков [10, 22], а исследований влияния связы-
Электростатические взаимодействия рассчитыва-
вания кофактора на динамику белка расчетными
ли с помощью алгоритма Particles Mesh Ewald, об-
методами не проводилось вовсе. Поскольку задача
резку взаимодействий проводили на расстоянии 1
исследования динамической организации тетра-
нм, расчет соседей проводили каждые 20 фс. Тра-
мера ГАФД комплексная, рационально разбить ее
ектории молекулярной динамики были получены в
на подзадачи. В данной работе мы исследовали ор-
npt-ансамбле, длина одной траектории составляла
ганизацию динамической структуры ГАФД, изу-
от 300 до 600 нс. Все расчеты траекторий молеку-
чая отдельные димеры, составляющие тетрамер, а
лярной динамики были выполнены в программ-
именно OP и OR; мономер белка использовали в
ном пакете GROMACS (Groningen Machine for
качестве референсной системы.
Chemical Simulations) с использованием силового
поля GROMOS. Оценку кулоновских и вандерва-
Полученные результаты будут способствовать
альсовых компонентов энергии парных взаимо-
пониманию влияния связывания НАД на динами-
действий, а также анализ значений среднеквадра-
ческую структуру ГАФД и заложит базис для раз-
тичного отклонения и среднеквадратичных флук-
работки аллостерических ингибиторов белка.
туаций (root-mean-squared fluctuations, rmsf) Ca-
атомов белка проводили с помощью инструментов
МЕТОДЫ
GROMACS. Динамические кросс-корреляцион-
ные матрицы строили в программе Carma [25].
Исходные
3D-структуры белка. Исходные
структуры мономера и OP- и OR-димеров со свя-
занным кофактором НАД были получены с ис-
РЕЗУЛЬТАТЫ
пользованием координат кристаллической струк-
В таблице приведены расчетные значения
туры тетрамерного белка соматического ГАФД че-
энергии взаимодействия кофактора с мономером
ловека, доступных в базе данных Кембриджского
и двумя димерами ГАФД. Результаты показывают,
университета (pdb код: 1znq). Апо-формы соответ-
что энергия взаимодействия молекулы кофактора
ствующих моно- и олигомеров были получены пу-
с субъединицей в димере зависит от типа про-
тем удаления молекул кофактора из холо-формы
странственной организации последнего. Так, для
белка. Всего было получено шесть исходных си-
димера типа ОР энергии связывания кофактора
стем: мономер, ОР-димер и OR-димер, каждый в
сравнимы с энергиями связывания молекулы НАД
апо-форме и в холо-форме. В случае холо-формы
с мономером. Однако для димера типа OR величи-
каждая субъединица содержала одну молекулу ко-
ны этих энергий существенно выше (по абсолют-
фактора.
ному значению), т.е. связывание энергетически
Расчет траекторий молекулярной динамики и их
более выгодно, чем с мономером и димером ОР.
анализ. Системы помещали в прямоугольный бокс
Подобные различия связаны с пространственной
с водой с периодическими граничными условиями
организацией S-петли и ее динамикой в димерах.
по всем трем направлениям, граница бокса распо-
Как видно из рис. 1б, молекула кофактора лока-
лагалась на удалении как минимум 1 нм от края
лизуется в области НАД-связывающего домена, а
белка. Воду задавали в явном виде. Для нейтрали-
также стабилизируется взаимодействиями с S-пет-
зации заряда добавляли необходимое для каждой
лей. S-петля представляет собой неструктуриро-
системы количество ионов Cl-. Далее проводили
ванный участок цепи длиной 27 остатков (аа 180-
минимизацию энергии системы. Фаза уравнове-
206). В мономере петля обладает высокой подвиж-
шивания состояла из двух последовательных про-
ностью, что демонстрирует диаграмма средне-
цедур - уравновешивание при постоянной темпе-
квадратичных флуктуаций (rmsf > 1.2 нм), пред-
ратуре и уравновешивание при постоянном давле-
ставленная на рис. 2. Сравнение значений rmsf Са-
БИОФИЗИКА том 66
№ 2
2021
ВЛИЯНИЕ СВЯЗЫВАНИЯ КОФАКТОРА
233
Электростатическая (Еэл) и вандерваальсова (Евдв) компоненты энергии взаимодействия субъединиц ГАФД с
кофактором в мономере и димерах
Еэл, кДж/моль
Евдв, кДж/моль
O
P(R)
О
P(R)
мономер
-443 ± 43
-197 ± 23
ОР-димер
-345 ± 56
-447 ± 61
-167 ± 21
-207 ± 23
OR-димер
-1144 ± 67
-1304 ± 100
-206 ± 19
-33 ± 5
Примечание. Значения энергии усреднены по траектории молекулярной динамики, первые 100 нс не учитывались.
атомов белка в апо- и холо-форме показывает, что
слоев. S-петля частично вовлечена во взаимодей-
связывание кофактора уменьшает подвижность
ствия через фрагмент аа 196-206. Однако большая
ряда остатков НАД-связывающего домена и остат-
часть S-петли, включая фрагменты, которые могут
ков S-петли (рис. 2б). Однако подвижность по-
взаимодействовать с кофактором, остается значи-
следней все еще остается довольно высокой
тельно подвижной, rmsf > 0.6 нм (рис. 4). Связыва-
(rmsf > 0.6 нм). Энергия взаимодействия кофакто-
ние кофактора не приводит к существенной стаби-
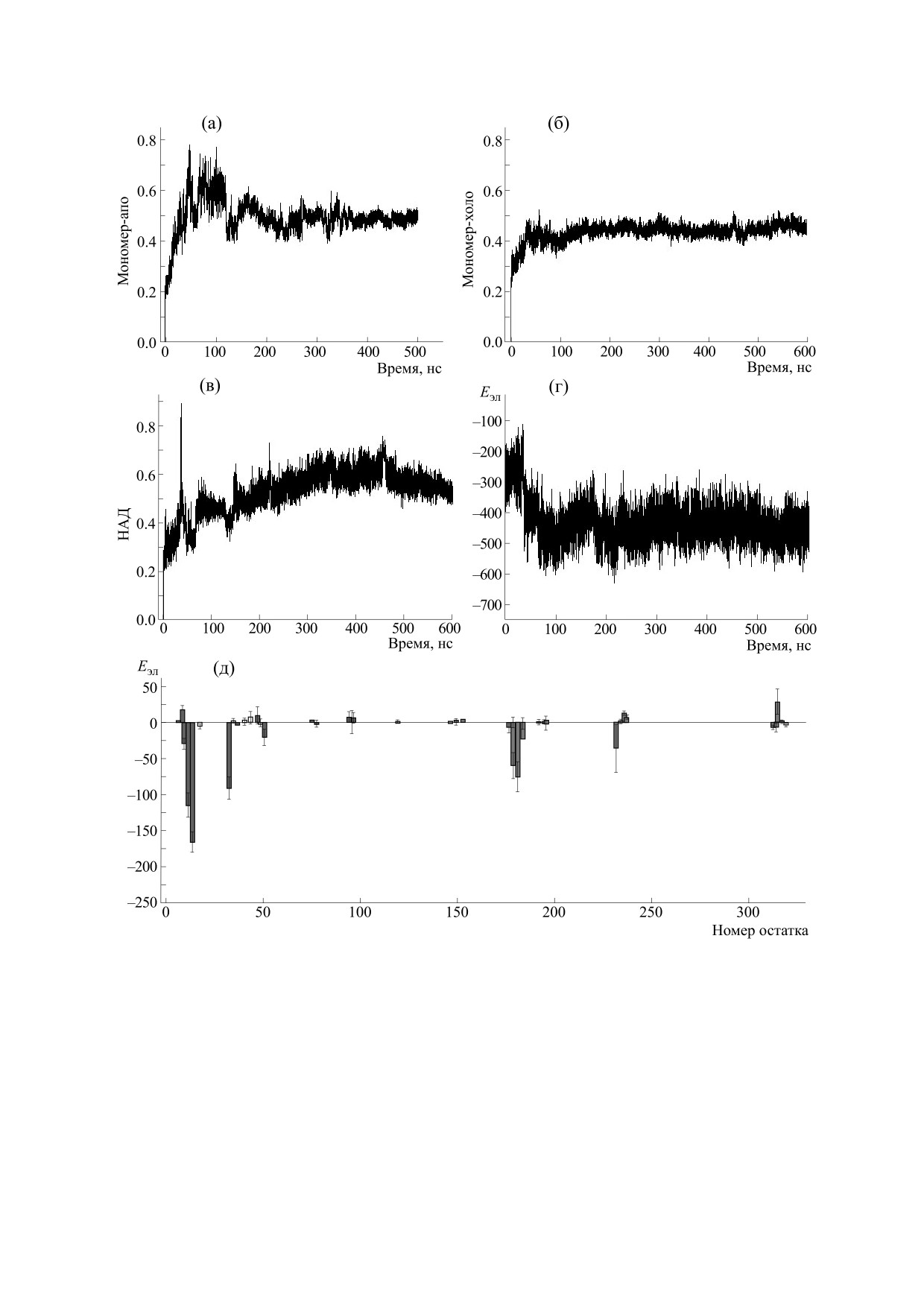
ра с мономером ГАФД выходит на насыщение в
лизации петли, на что указывает сохранение высо-
первые 100 нс траектории, на плато наибольший
ких значений rmsf в холо-форме димера. В димере
вклад в стабилизацию комплекса дают остатки
OR, в отличие от ОР-димера и мономера, субъеди-
НАД-связывающего кармана Arg13, Arg16 и Asp35
ницы ориентированы таким образом, что форми-
и остатки S-петли Ile181, Thr182, Thr184 и Gln185
руется максимальное количество контактов между
(рис. 3).
S-петлями двух субъединиц (для более детального
В ОР-димере межсубъединичные контакты об-
описания взаимодействующих остатков в димере
разованы взаимодействием протяженных бета- см. работу [10]). При такой взаимной ориентации
Рис. 2. Среднеквадратичные флуктуации (rmsf) Са-атомов в холо-форме (а) и апо-форме (б) мономера ГАФД, а также
их разностные значения (в) как функция от номера остатка. Пространственная структура мономера ГАФД со
связанной молекулой кофактора НАД (показан зеленым цветом), остатки с пониженной подвижностью в холо-форме
белка окрашены в синий цвет.
БИОФИЗИКА том 66
№ 2
2021
234
КОШКАРОВ, МАКШАКОВА
Рис. 3. Среднеквадратичные отклонения Са-атомов мономера ГАФД в апо-форме (а) и холо-форме (б) как функция
от времени. Среднеквадратичные отклонения кофактора в холо-форме мономера ГАФД (в). Энергия взаимодействия
кофактора с мономером ГАФД как функция от времени (г). Средние значения и стандартные отклонения вклада в
энергию взаимодействия кофактора с отдельными остатками мономера ГАФД (д).
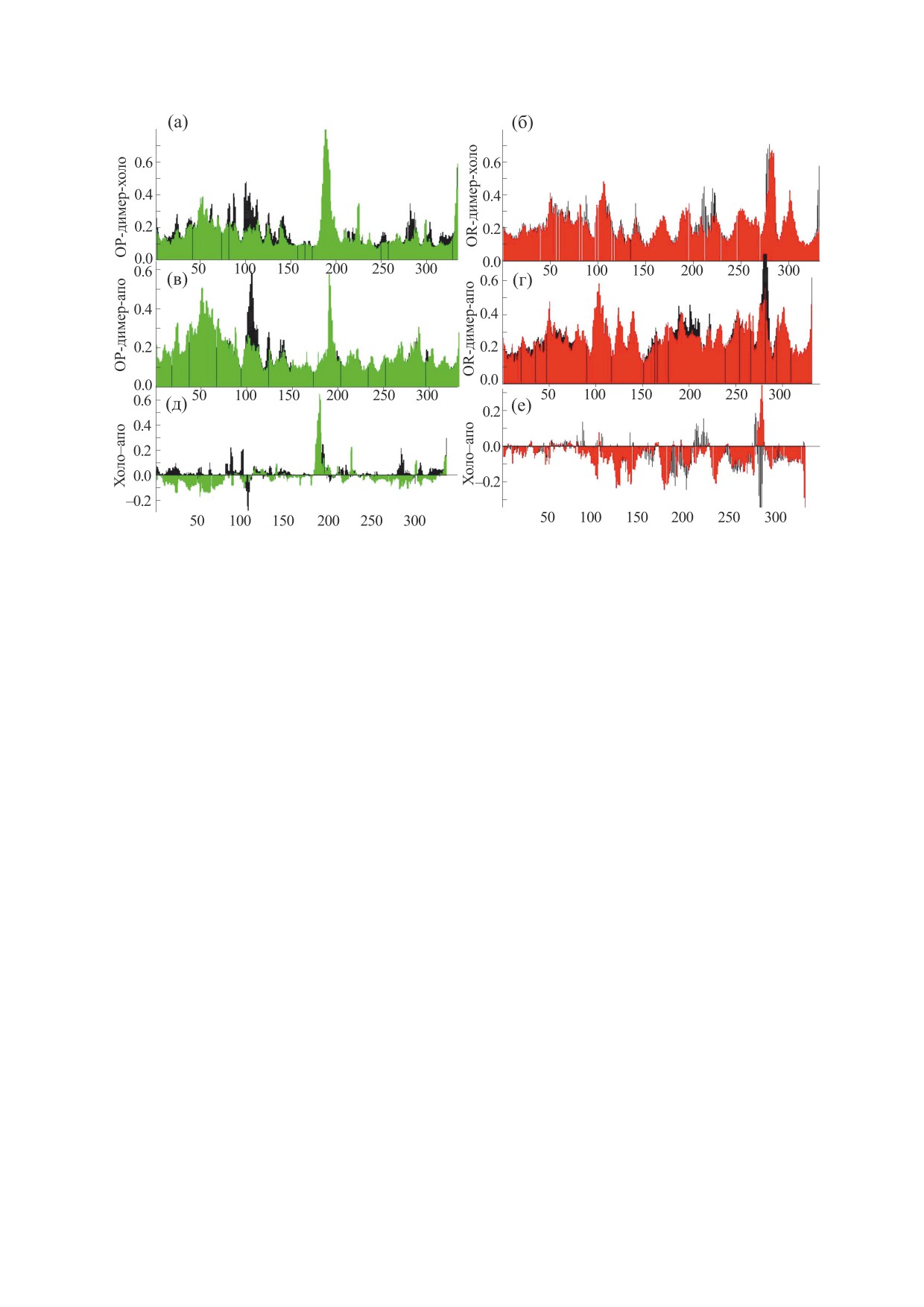
субъединиц остатки S-петли оказываются иммо-
единичном контакте влечет компенсаторное уве-
билизованы, по сравнению с мономером и ОР-ди-
личение подвижности остатков аа 270-280 OR-ди-
мером, максимальные значения rmsf остатков пет-
мера. Связывание молекул кофактора субъедини-
ли в апо-форме OR-димера находятся на уровне
цами в димере типа OR ведет к дополнительному
0.4 нм (рис. 4). Иммобилизация петли в межсубъ-
уменьшению подвижности остатков S-петли.
БИОФИЗИКА том 66
№ 2
2021
ВЛИЯНИЕ СВЯЗЫВАНИЯ КОФАКТОРА
235
Рис. 4. Среднеквадратичные флуктуации (rmsf) Са атомов OP-димеров (а, в, д) и OR-димеров (б, г, е) ГАФД в холо-
форме (а, б) и в апо-форме (в, г), а также их разностные значения (д, е) как функция от номера остатка. Цветом
обозначены данные: для субъединиц О - черным, P - зеленым, R - красным.
Таким образом, пространственная стабилиза-
вой компоненте (в первом приближении мы не
ция S-петли в межсубъединичных контактах типа
применяли масштабирующих коэффициентов).
OR способствует увеличению энергии связывания
Принимая во внимание это, а также эксперимен-
молекул кофактора (энтальпийной части свобод-
тальные свидетельства о том, что в бациллярном
ной энергии) за счет возможности установления
ГАФД кооперативность сохраняется именно в ОР-
более обширных и более стабильных контактов с
димере, мы проанализировали динамическую
остатками петли в дополнение к взаимодействиям
структуру димера ОР с привлечением метода
с остатками связывающего кармана. Следует отме-
кросс-корреляционных динамических матриц.
тить, что наблюдаемая разница в энергии связыва-
Сравнивая кросс-корреляционные матрицы
ния кофактора димерами OP и OR, видимо, не
для апо- и холо-формы ОР-димера (рис. 5а,б),
будет столь драматичной в тетрамере ГАФД, по-
можно отметить, во-первых, обеднение общего
скольку там S-петля принимает участие в стабили-
количества кросс-пиков при связывании кофакто-
зации всего комплекса межсубъединичных кон-
ра. Это свидетельствует об уменьшении доли
тактов и обладает меньшей подвижностью.
остатков, движущихся согласованно. Кстати, та-
В ОР-димере расчетная энергия связывания
кая же тенденция наблюдалась и для мономера
молекул кофактора как в части электростатиче-
при связывании молекулы кофактора (данные не
ской энергии, так и в части вандерваальсовых вза-
показаны). Вторая серия отличий заключается в
имодействий меньше (по абсолютному значению)
изменении межсубъединичных корреляционных
для субъединицы О, чем для субъединицы Р на
кросс-пиков. На кросс-корреляционной карте со-
протяжении всей траектории молекулярной дина-
ответствующие коэффициенты корреляции сред-
мики. При этом энергии связывания кофактора с
неквадратичных отклонений для остатков из раз-
Р-субъединицей сравнимы с теми, что наблюда-
ных субъединиц вдоль молекулярно-динамиче-
ются в мономере, а связывание кофактора с
ской траектории представлены в верхнем левом и
О-субъединицей в димере оказывается менее вы-
симметричном нижнем правом квадрантах. Обла-
годным. Такое отклонение в меньшую сторону яв-
сти, которые соответствуют изменениям, вызван-
ляется ожидаемым в связи с отрицательной коопе-
ным связыванием кофактора, на карте обведены в
ративностью соматического ГАФД. В то же время
синие рамки. При связывании кофактора серия
в димере OR разница в электростатической энер-
кросс-пиков, присутствующих в апо-форме
гии компенсируется различиями в вандерваальсо-
(рис. 5а в синей рамке), пропадает, а другая серия
БИОФИЗИКА том 66
№ 2
2021
236
КОШКАРОВ, МАКШАКОВА
Рис. 5. Динамические кросс-корреляционные матрицы, построенные по Са-атомам ОР-димера ГАФД в апо- (а) и
холо- (б) форме. Пространственная структура ОР-димера ГАФД со связанными молекулами кофактора (показаны
зеленым цветом) и остатки, коррелированность движений которых меняется при связывании кофактора. Красным
цветом обозначены остатки, которые соответствуют кросс-пикам, заключенным рамкой синего цвета на матрице апо-
формы, а синим цветом отмечены остатки, которые соответствуют кросс-пикам, заключенным рамкой синего цвета
на матрице холо-формы (в). Пространственная структура ОР-димера ГАФД со связанными молекулами кофактора
(зеленым цветом) и остатки, коррелированность движений которых не меняется при связывании кофактора,
пурпурным цветом обозначены остатки, которые соответствуют кросс-пикам, заключенным рамками красного цвета
на матрицах апо- и холо-формы белка.
пиков на картах холо-формы (рис. 5б в синей рам-
ных контактов в ОР-димере связывает остатки
ке) появляется. Остатки, соответствующие дан-
двух субъединиц и приводит к их согласованному
ным областям кросс-пиков и зависящие от связы-
динамическому поведению независимо от того,
вания кофактора, отмечены на трехмерной струк-
связана молекула кофактора или нет. Однако при
туре ОР-димера (рис.
5в). Данные остатки
связывании кофактора меняется интенсивность
располагаются преимущественно на поверхности
этих кросс-пиков. Эти кросс-пики оконтурены на
глобулы, причем остатки, движущиеся согласо-
обеих картах красной рамкой. Данные остатки на-
ванно в апо-форме, локализованы в районе S-пет-
ли, а остатки, приобретающие согласованность
ходятся внутри глобулярной структуры субъеди-
при связывании молекул кофактора, находятся на
ниц (рис. 5г). Данная согласованность в динамике
поверхности глобулярной части в области OP-
остатков может лежать в основе кооперативности,
контакта субъединиц и НАД-связывающего кар-
передавая сигнал от связывания кофактора одной
мана.
субъединицей через межсубъединичный контакт
на другую субъединицу. Однако это утверждение
В то же время, существуют кросс-пики, кото-
рые присутствуют на обеих матрицах как апо-, так
требует более детального анализа, который нахо-
и холо-формы ОР-димера. Область субъединич-
дится за пределами задач данной статьи.
БИОФИЗИКА том 66
№ 2
2021
ВЛИЯНИЕ СВЯЗЫВАНИЯ КОФАКТОРА
237
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
диссоциации тетрамера или же это следствие му-
таций. Микроскопическая константа диссоциа-
Олигомерная организация ферментов широко
ции К1 увеличивается на порядок в ряду тетра-
распространена в природе, благодаря этому увели-
мер - димер OR - димер ОР (среднее значение
чивается стабильность белка и осуществляется ре-
0.06 - 0.6 - 5.5 мкМ); качественно такая же зависи-
гуляция его биологической активности. Регуляция
мость наблюдается и для константы К2. Таким об-
активности может осуществляться через изменяе-
разом, связывание кофактора в димере ОR проис-
мое сродство к лиганду изначально структурно эк-
ходит более выгодно, чем в ОР. Это согласуется с
вивалентных субъединиц олигомера, т. е. коопера-
оценками, сделанными на основании наших рас-
тивность. При отрицательной кооперативности
четов, где энергии связывания кофактора в димере
связывание лиганда одной субъединицей приво-
OR выше, чем в димере ОР и мономере. Результа-
дит к менее выгодному связыванию лиганда
ты расчетов показывают, что эта разница объясня-
остальными субъединицами, примером чего явля-
ется, главным образом, вкладом S-петли. В OR-
ется соматический ГАФД из ряда источников [11,
димере S-петля зафиксирована в межсубъединич-
12, 26]. При положительной кооперативности по-
ном контакте и взаимодействует со связанным
следовательное связывание лиганда становится
НАД. В ОР-димере, как и в мономере, S-петля по-
более выгодным, как, например, происходит в
движна и слабо взаимодействует с кофактором.
дрожжевой ГАФД [27, 28] и в сперматозоидном
S-петля участвует во взаимодействии не только с
ГАФД млекопитающих [20]. Неэквивалентность
кофактором, но также может быть вовлечена во
субъединиц олигомера по отношению к связыва-
взаимодействия с другими лигандами и белками.
нию лиганда может быть описана в рамках предло-
Роль S-петли в активности белка обсуждалась в ра-
женных моделей. Концепция «induced fit» [17]
боте [32] в отношении ГАФД из Escherichia coli. По
предполагает последовательные изменения струк-
данным рентгеноструктурного анализа, петля тет-
туры субъединиц и, как следствие, сродства к ли-
рамера в апо-форме обладает относительно высо-
ганду при связывании НАД. Аллостерическая (со-
кой подвижностью, тогда как связывание НАД
гласованная) модель [13, 16] предполагает наличие
или трегалозы стабилизирует ее. Также автор рабо-
в апо-форме белка конформационного равнове-
ты [32] отмечает, что связывание трегалозы S-пет-
сия, которое сдвигается при связывании лиганда,
лей сопровождается конформационными измене-
увеличивая населенность состояния с большим
ниями в активном центре, которые будут предот-
или меньшим сродством к лиганду. Считается, что
вращать связывание НАД, хотя центры
положительная кооперативность поддерживает
связывания двух молекул различаются [32].
последовательную модель, а отрицательная - со-
гласованную модель [29]. Тем не менее положи-
Современные методы исследования, основан-
тельная кооперативность может укладываться в
ные на подходе сайт-направленного мутагенеза,
рамки согласованной модели, что было продемон-
показывают, что регуляция кооперативности до-
стрировано при описании кривых связывания
стигается тонкой подстройкой взаимодействий
НАД с ГАФДс [20].
между субъединицами. Так, например, единичная
замена остатка D311N устраняет кооперативность
Четвертичная структура не является необходи-
ГАФДс. Примечательно, что при этом константа
мым условием для активности ГАФД, что было по-
диссоциации комплекса ГАФДс и НАД уменьша-
казано на иммобилизованных димерах [30] и мо-
номерах белка [31]. Более того, димерной органи-
ется на порядок (с 10-6 до 10-7 М), что приводит ее
зации ГАФД достаточно для проявления
в соответствие с минимальным значением кон-
кооперативности. На примере ГАФД из Bacillus
станты диссоциации для фермента дикого типа
stearothermophilus было продемонстрировано, что
[20]. Остаток D311 находится на небольшом удале-
OP- и OR-димеры, переведенные в водораствори-
нии от межсубъединичных контактов и от актив-
мую форму посредством одиночных или двойных
ного центра (~10 Å), но не принимает прямого уча-
мутаций в области межсубъединичных контактов,
стия в образовании контактов или в связывании
связывают кофактор, но кооперативность сохра-
кофактора. Несмотря на это, его замена приводит
няется только у первого из них [19]. В димере OR
к блокировке передачи сигнала между субъедини-
(D282G) две субъединицы имеют одинаковые
цами. Ранее нами было показано, что данная заме-
константы диссоциации НАД. Однако в тетрамере
на в ГАФДс влияет на коррелированность флукту-
того же мутанта (D282G) вновь появляется отри-
аций ближнего окружения остатка [10]. В сомати-
цательная кооперативность, как и в ферменте ди-
ческом ГАФД этому остатку соответствует N239.
кой формы. Примечательно, что димер ОР, для ко-
Как показывают кросс-корреляционные матрицы
торого представлено несколько вариантов с пар-
димера ОР, N239 попадает в область остатков, ко-
ными мутациями Y46G/S48G, D186G/ E276G и
торые движутся коррелированно с остатками со-
Y46G/R52G [19], проявляет положительную ко-
седней субъединицы, а также с остатками актив-
оперативность. Однако остается неясным, про-
ного центра собственной субъединицы. В целом
исходит ли смена типа кооперативности из-за
эти согласованно флуктуирующие остатки форми-
БИОФИЗИКА том 66
№ 2
2021
238
КОШКАРОВ, МАКШАКОВА
руют путь, соединяющий остатки активного цен-
ние кофактора в OR-димере оказывается более
тра двух субъединиц через ОР-контакт (рис. 5г).
энергетически выгодным из-за прямого участия S-
петли во взаимодействиях с кофактором. Показа-
Как показывают расчеты, связывание кофакто-
но, что связывание кофактора существенно моди-
ра ОР-димером ГАФД сопряжено с существенны-
фицирует характер коррелированных движений в
ми изменениями в динамике белка. В целом свя-
обеих субъединицах и приводит к образованию об-
зывание НАД приводит к уменьшению доли остат-
ластей на поверхности белка флуктуирующих со-
ков флуктуирующих коррелированно. В то же
гласованно с участком НАД-связывающего карма-
время некоторые остатки в периферической обла-
на. Понимание структурно-динамических особен-
сти ОР контакта начинают двигаться коррелиро-
ностей, лежащих в основе связывания кофактора,
ванно с остатками НАД-связывающего кармана
усилит фундамент понимания организации дина-
(остатки синего цвета на рис. 5в). Динамическая
мической структуры белка и послужит базой для
согласованность остатков ГАФД может лежать в
разработки новых способов регуляции активности
основе передачи информации между активными
ГАФД.
центрами субъединиц, как это было ранее показа-
но, например, для галектина-7 [33], и между актив-
ным и аллостерическим центром белка [21]. В ли-
БЛАГОДАРНОСТИ
тературе имеются сообщения об ингибирующем
влиянии НАД на связывание РНК, для чего была
Исследование выполнено при использовании
предложена гипотеза об аллостерическом меха-
оборудования Центра коллективного пользования
сверхвысокопроизводительными вычислительны-
низме действия. РНК предположительно связыва-
ми ресурсами Московского государственного уни-
ется вдоль ОР-контакта. Однако на сегодняшний
день прямых подтверждений этому нет, поэтому
верситета имени М.В. Ломоносова и оборудова-
гипотеза об аллостерическом влиянии остается
ния Центра коллективного пользования вычисли-
равновероятной гипотезе о конкурентном связы-
тельными ресурсами МСЦ РАН - филиала ФНЦ
НИИСИ РАН.
вании [34].
Таким образом, сложная динамическая органи-
зация олигомера ГАФД может в дальнейшем спо-
ФИНАНСИРОВАНИЕ РАБОТЫ
собствовать разработкам аллостерических регуля-
Работа выполнена при частичной финансовой
торов связывания кофактора. Ингибирование гли-
поддержке Российского фонда фундаментальных
колиза с помощью аллостерических регуляторов
исследований и правительства Республики Татар-
представляет особый интерес. Известно, что в опу-
стан в рамках научного проекта № 18-44-160026 (в
холевых тканях увеличивается экспрессия ГАФД
части анализа связывания кофактора и согласо-
[35], а, например, в клетках меланомы происходит
ванных движений остатков). Получение траекто-
тканенеспецифичная экспрессия ГАФДс [5]. Ак-
рий молекулярной динамики для ОR-димеров
тивный центр и НАД-связывающий карман изо-
осуществлено за счет государственного задания
ферментов ГАФД и ГАФДс практически идентич-
ФИЦ КазНЦ РАН.
ны, следовательно, различия в остатках, которые
формируют аллостерический центр на периферии
белка, могут использоваться для селективного воз-
КОНФЛИКТ ИНТЕРЕСОВ
действия на определенный тип изофермента
Авторы заявляют об отсутствии конфликта ин-
ГАФД, что будет предметом наших дальнейших
тересов.
исследований.
Настоящая работа вносит вклад в понимание
организации динамической структуры димеров
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ГАФД. В то же время следует иметь в виду, что в
Настоящая работа не содержит описания ис-
тетрамере обоюдное влияние субъединиц стано-
следований с использованием людей и животных в
вится более сложным [30], и чтобы определить, в
качестве объектов.
какой степени обнаруженные в димерах корреля-
ции могут быть перенесены на тетрамер, предсто-
ит провести дополнительные исследования.
СПИСОК ЛИТЕРАТУРЫ
1. L. Zheng, R. G. Roeder, and Y. S. Luo, Cell 114, 255
(2003).
ЗАКЛЮЧЕНИЕ
2. S. Kim, J. Lee, and J. Kim, Biochem. J. 404, 197
Проведено молекулярно-динамическое иссле-
(2007).
дование связывания кофактора структурными
3. M. Sirover, Glyceraldehyde-3-Phosphate Dehydrogenase
единицами ГАФД, а именно двумя типами диме-
(GAPDH): The Quintessential Moonlighting Protein in
ров - ОР и OR. Результаты анализа внутримолеку-
Normal Cell Function and in Human Disease (Academic
лярной динамики in silico показали, что связыва-
Press, MA (Massachusettes), USA, 2017).
БИОФИЗИКА том 66
№ 2
2021
ВЛИЯНИЕ СВЯЗЫВАНИЯ КОФАКТОРА
239
4. V. I. Muronetz, K. V. Barinova, Y. Y. Stroylova, et al.,
20. M. L. Kuravsky, K. V. Barinova, R. A. Asryants, et al.,
Int. J. Biol. Macromol. 100, 55 (2017).
Biochimie 115, 28 (2015).
5. I. A. Sevostyanova, K. V. Kulikova, M. L. Kuravsky, et
21. N. Popovych, S. Sun, R. H. Ebright, et al., Nat. Struct.
al., Biochem. Biophys. Res. Commun. 427, 649 (2012).
Mol. Biol. 13, 831 (2006)
6. В. И. Муронец, А. К. Мельникова, К. В. Баринова
22. A. T. P. Machado, M. Silva, and J. Iuleka, Biochim.
и др., Биохимия 84, 1578 (2019).
Biophys. Acta - Proteins and Proteomics 1866, 581
7. D. H. F. Souza, R. C. Garratt, A. P. U. Araújo, et al.,
(2018).
FEBS Lett. 424, 131 (1998).
23. G. Bussi, D. Donadio, and M. Parrinello, J. Chem.
8. S. Van Calenbergh, C. L. Verlinde, J. Soenens, et al., J.
Phys. 126, 014101 (2007)
Med. Chem. 38, 3838 (1995).
24. H. J. C. Berendsen, J. P. M. Postma, A. Di Nola, et al.,
9. P. V. Danshina, W. Qu, B. R. Temple, et al., Mol.
J. Chem. Phys. 81, 3684 (1984).
Hum. Reprod. 22, 410 (2016).
25. N. M. Glykos, J. Comput. Chem. 27, 1765 (2006).
10. O. N. Makshakova, P. I. Semenyuk, M. L. Kuravsky,
26. F. Seydoux, S. Bernhard, O. Pfenninger, et al., Bio-
et al., J. Struct. Biol. 190, 224 (2015).
chemistry 12, 4290 (1973).
11. J. J. de Vijlder and E. C. Slater, Biochim. Biophys. Acta
27. K. Kirschner, E. Gallego, I. Schuster, et al., J. Mol.
167, 23 (1968).
Biol. 58, 29 (1971).
12. A. Conway and D. E. Jr. Koshland, Biochemistry 7,
28. K. Kirschner, J. Mol. Biol. 58, 51 (1971)
4011 (1968).
29. N. W. Seidler, in Advances in Experimental Medicine and
13. K. Kirschner, M. Eigen, R. Bittman, et al., Proc. Natl.
Biology, Ed. by I. R. Cohen, I. A. Lajtha, J. D. Lambris
Acad. Sci. USA 56, 1661 (1966).
and R. Paoletti (Springer, Dordrecht, 2013), v. 985,
14. Y. I. Henis and A. Levitzki, Proc. Natl. Acad. Sci. USA
pp.1-293.
77, 5055 (1980).
30. Н. К. Наградова, Биохимия 51, 2030 (1986).
15. A. Levitzki and D. E. Koshland, Curr. Top. Cell. Regul.
31. И. В. Дуженкова, Р. А. Асриянц, В. И. Муронец
10, 140 (1976).
и др., Биохимия 51, 1899 (1986).
16. J. Monod, J. Wyman, and J.-P. Changeux, J. Mol. Biol.
12, 88 (1965).
32. Y. Ju Kim, Acta Cryst. F74, 277 (2018).
17. D .E. Jr. Koshland, G. Nemethy, and D. Filmer, Bio-
33. E. E. Ermakova, M. C. Miller, I. V. Nesmelova, et al.
chemistry 5, 365 (1966).
Glycobiology 23, 508 (2013).
18. W. J. Cook, O. Senkovich, and D. Chattopadhyay,
34. E. D. Garcin, Seminars in Cell & Developmental Biol-
BMC Struct. Biol. 9, 9 (2009)
ogy 86, 162 (2019).
19. O. Roitel, P. Vachette, S. Azza, et al., J. Mol. Biol. 326,
35. F. Revillion, V. Pawlowski, L. Hornez, et al., Eur. J.
1513 (2003).
Cancer 36, 1038 (2000).
The Influence of Cofactor Binding on the Intramolecular Dynamics
of Glyceraldehyde-3-Phosphate Dehydrogenase
A.A. Koshkarov and O.N. Makshakova
Kazan Institute of Biochemistry and Biophysics, Federal Research Center “Kazan Scientific Center
of the Russian Academy of Sciences”, ul. Lobachevskogo 2/31, Kazan, 420111 Russia
Glyceraldehyde-3-phosphate dehydrogenase is one of the key enzymes of glycolysis and, also, this protein is
implicated in the regulation of a wide range of cellular functions, including induction of apoptosis. Glyceral-
dehyde-3-phosphate dehydrogenase is also involved in the development of a number of pathological states,
neurodegenerative and cancerous diseases. Novel approaches to regulating enzyme activity require detailed
knowledge of enzyme spatial organization and structural dynamics. In this work, we have performed molec-
ular dynamics simulations to study the interaction of nicotinamide adenine dinucleotide which served as a co-
factor with dimers assembled into the tetrameric form of human somatic glyceraldehyde-3-phosphate dehy-
drogenase. The effect of cofactor binding on the intramolecular dynamics of the protein is described. It was
shown that dimers can bind the cofactor in different interaction energies; this occurs due to the mobility and
ability of the S-loop to interact with the cofactor molecule. Some groups of residues in the adjacent subunits
that concordantly move have been found in the OP dimmer. Furthermore, it was shown that cofactor binding
modulates the nature of correlated motions in the dimer.
Keywords: glyceraldehyde-3-phosphate dehydrogenase, ligand binding, cooperativity, allostery, molecular dy-
namics simulations
БИОФИЗИКА том 66
№ 2
2021