БИОФИЗИКА, 2021, том 66, № 2, с. 240-247
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.346
ИССЛЕДОВАНИЕ ПОВРЕЖДЕНИЙ МОЛЕКУЛЫ ДНК,
ВЫЗВАННЫХ ОБЛУЧЕНИЕМ ПРОТОНАМИ И ГАММА-КВАНТАМИ
© 2021 г. О.М. Котб*, **, Д.С. Брожик***, В.Н. Вербенко***, Е.П. Гулевич***,
В.Ф. Ежов***, Д.Л. Карлин***, Ф.А. Пак***, С.В. Пастон*, А.М. Поляничко*,
А.И. Халиков***, Е.В. Чихиржина****
*Физический факультет Санкт-Петербургского государственного университета,
198504, Санкт-Петербург, Старый Петергоф, ул. Ульяновская, 1
**Faculty of Science, Zagazig University, Sharkia Gov Zagazig, Egypt
***Петербургский институт ядерной физики им. Б.П. Константинова Национального исследовательского центра
«Курчатовский институт», 188300, Гатчина Ленинградской области, мкр. Орлова роща, 1
****Институт цитологии РАН, 194064, Санкт-Петербург, Тихорецкий просп., 4
E-mail: s.v.paston@spbu.ru
Поступила в редакцию 30.11.2019 г.
После доработки 30.11.2019 г.
Принята к публикации 24.09.2020 г.
Проведено сравнение радиационного эффекта гамма-излучения и протонов высоких энергий
(1000 МэВ) при облучении ДНК дозами 30 и 50 Гр в водно-солевых растворах (5 и 150 мМ NaCl). Ис-
пользовали спектральные методы (спектроскопия УФ-поглощения, метод Спирина, спектрофото-
метрическое плавление ДНК, круговой дихроизм), которые позволяют оценить количество разру-
шенных азотистых оснований и повреждение вторичной структуры ДНК. Обнаружено, что при ука-
занных условиях протонное излучение вызывает более сильные разрушения азотистых оснований
и вторичной структуры ДНК, чем такая же доза гамма-излучения. В ДНК, облученной протонами,
предположительно образуются сшивки; вероятность их появления увеличивается с ростом ионной
силы облучаемого раствора.
Ключевые слова: радиационная онкология, протонная терапия, ДНК, гамма-излучение, разрушение
оснований, плавление ДНК.
DOI: 10.31857/S0006302921020046
ационной нагрузки на здоровые ткани [2-4].
Ионизирующие излучения вызывают повре-
Применяются, например, инкорпорированные
ждения в структуре ДНК, которые запускают кас-
источники ионизирующего гамма-излучения,
кад биологических процессов в клетке. Результа-
которые внедряются непосредственно в опухоль
том может быть мутация и/или гибель клетки.
(брахитерапия) [2]. При внешнем облучении па-
Еще на раннем этапе развития радиобиологии
циента очень важно учитывать зависимость ли-
был сформулирован закон радиочувствительно-
нейной передачи энергии (ЛПЭ) излучения от
сти клеток: клетки тем более радиочувствитель-
глубины проникновения в организм. Эта зависи-
ны, чем менее они дифференцированы и чем
мость определяется природой излучения. Для фо-
интенсивнее они делятся (правило Бергонье и
тонов она имеет максимум в самом начале пробе-
Трибондо) [1]. Именно по этим параметрам и от-
га частицы (для излучения 60Co с энергией фото-
личаются клетки злокачественной опухоли от
нов 1.3 МэВ на глубине около 2 см в воде) [1, 2, 5]
окружающих здоровых клеток, и именно повы-
и затем медленно спадает. Такое распределение
шенная радиочувствительность опухолевых кле-
поглощенной энергии неблагоприятно для лече-
ток дает возможность применять ионизирующее
ния опухолей, локализованных глубоко внутри
излучение для лечения рака. В настоящее время
организма, так как доза радиации, полученная
разработано множество методик лучевой тера-
здоровыми тканями, оказывается выше, чем по-
пии, направленных на усиление избирательности
лученная опухолью. Для преодоления этой про-
повреждения раковых клеток и ослабления ради-
блемы используются разнообразные варианты
стереотаксического облучения (3D-, радиохирур-
Сокращения: ЛПЭ - линейная передача энергии, КД -
круговой дихроизм.
гия), например, гамма-нож [2, 6-8]. В случае же
240
ИССЛЕДОВАНИЕ ПОВРЕЖДЕНИЙ МОЛЕКУЛЫ ДНК
241
тяжелых заряженных частиц (протонов, α-ча-
лет в «Комплексе лучевой терапии «на пролет» на
стиц, ядер углерода) зависимость ЛПЭ от длины
базе ускорителя протонов СЦ-1000» в Петербург-
пробега в ткани имеет характерный максимум в
ском институте ядерной физики им. Б.П. Кон-
конце трека (пик Брэгга), положение которого
стантинова НИЦ «Курчатовский институт» (так
можно подобрать, варьируя начальную энергию
называемый «Гатчинский метод») [4, 17, 18]. На
частицы, чтобы максимальная плотность иониза-
счету специалистов «Комплекса лучевой тера-
ций пришлась на опухоль [1-5]. В этом случае ра-
пии» - более 1300 излеченных больных. Протоны
диационная нагрузка на окружающие здоровые
высоких энергий имеют низкую ЛПЭ, сравни-
ткани оказывается существенно меньше. На этом
мую с ЛПЭ гамма-излучения [2]. Однако взаимо-
эффекте основана адронная терапия - весьма
действие этих ионизирующих частиц с веществом
перспективное, интенсивно развивающееся на-
существенно различается: гамма-кванты вызыва-
правление радиационной онкологии. Дополни-
ют первичную ионизацию атомов в результате
тельным преимуществом терапевтического воз-
фотоэффекта и комптоновского эффекта, воз-
действия излучения с высокой ЛПЭ является то,
никшие при этом быстрые электроны в свою оче-
что в этом случае значительная часть поврежде-
редь производят ионизацию и возбуждение окру-
ний ДНК возникает за счет так называемого пря-
жающих атомов за счет электромагнитного взаи-
мого действия радиации: инактивация происхо-
дит в результате поглощения энергии излучения
модействия с электронными оболочками. Треки
самой молекулой ДНК [1]. При этом снижается
этих электронов в веществе искривлены, длина
коэффициент кислородного усиления и нивели-
пробега варьирует от 1 до 1000 мкм в зависимости
руется повышенная резистентность опухолевой
от энергии фотона, переданной электрону. Про-
ткани вследствие ее гипоксии [2-5]. Существен-
тоны высоких энергий непосредственно вызыва-
ными недостатками метода адронной терапии,
ют множественные ионизации и возбуждение
которые тормозят его внедрение в широкую ле-
атомов в результате электромагнитного взаимо-
чебную практику, являются большой размер и
действия с электронными оболочками [1]. Повре-
весьма высокая стоимость установок - ускорите-
ждения ДНК в организме, клетках и модельных
лей заряженных частиц [2-4, 8-15]. В ряде случа-
системах, вызванные гамма-облучением, иссле-
ев оказывается возможным использовать в меди-
дуются очень давно, и в целом эти эффекты и их
цинских целях исследовательские ускорители [4,
биологические последствия очень подробно изу-
10, 11, 13].
чены [1, 19, 20]. Воздействие адронов, в частно-
Пучок заряженных частиц с точки зрения ле-
сти, протонов высоких энергий на биологические
чебного применения имеет и другие преимуще-
системы изучено гораздо меньше, однако в по-
ства по сравнению с потоком фотонов, а именно
следние годы наблюдается рост числа исследова-
возможность более точной фокусировки. В ради-
ний на эту тему, связанный с развитием адронной
ационной терапии широко применяются линей-
терапии [21-24]. Кроме того, протоны высоких
ные ускорители электронов [2-4, 6-8]. Они су-
энергий - основная составляющая космических
щественно дешевле и компактнее адронных уско-
лучей, действию которых подвергаются космо-
рителей. Для облучения пациента может
навты [25], и это также делает проблему повре-
применяться как непосредственно пучок элек-
ждения генетического аппарата протонным излу-
тронов, так и тормозное рентгеновское излучение
чением весьма актуальной.
[2, 3]. Индивидуальный подбор системы колли-
маторов, принцип стереотаксического облучения
В настоящей работе проводится сравнение
с прецизионным позиционированием луча под
повреждений ДНК в водно-солевых растворах,
контролем рентгеновской или томографической
вызванных воздействием одинаковых доз гам-
визуализации опухоли позволяют добиваться
ма-излучения и протонного излучения с энерги-
весьма удовлетворительной избирательности по-
ей протонов 1000 МэВ. Исследовали количество
ражения опухолевой ткани [2, 3, 8, 16]. Однако
разрушенных азотистых оснований, используя
при прохождении в тканях пучок электронов за-
метод Спирина [26-28], степень нативности
метно рассеивается, повреждая здоровые клетки.
ДНК - по значениям молярного коэффициента
Пучок адронов высокой энергии (вдали от пика
экстинкции и гиперхромного эффекта [29], кри-
Брэгга) также может быть очень точно сфокуси-
вые плавления ДНК, а также спектры кругового
рован и, в отличие от электронов, траектория
дихроизма, которые позволяют получить ин-
массивных адронов в биологических тканях не
формацию о вторичной структуре макромолеку-
искривляется, а пучок не рассеивается, даже
пройдя насквозь через тело пациента [1-4]. Это
лы [29-31]. Изучение спектральных параметров
свойство может быть использовано для пораже-
ДНК позволяет в ряде случаев оценить радиаци-
ния неоперабельных (либо труднооперабельных)
онный эффект и определить влияние радиомо-
опухолей небольшого размера. Подобный метод
дифицирующих агентов в процессе облучения
лечения успешно применяли в течение десятков
[32-34].
БИОФИЗИКА том 66
№ 2
2021
242
КОТБ и др.
МАТЕРИАЛЫ И МЕТОДЫ
D
260
(25°*)
−
D
260
(25°)
ϑ
R
=
1−
100%.
В работе использовали натриевую соль ДНК
D
(95°)
−
D
(25°)
260
260
из тимуса теленка (Sigma, США) с молекулярной
Концентрацию азотистых оснований ДНК в не-
массой М = (6.3 ± 0.5) ⋅ 106 Да, химически чистые
облученных и облученных растворах определяли,
NaCl, HClO4, деионизированную воду. Растворы
пользуясь методом Спирина [26]. Для этого про-
NaCl необходимой концентрации готовили из
водили гидролиз ДНК: к 1 мл раствора ДНК до-
насыщенного раствора.
бавляли 3 мл 6%-й HClO4, затем выдерживали на
водяной бане при 100°С в течение 20 мин с после-
Условия облучения. Облучение протонами с
дующим быстрым охлаждением при 0°С. Спектр
энергией 1000 МэВ проводили в аэробных усло-
гидролизованного раствора регистрировали при
виях при комнатной температуре в Петербург-
комнатной температуре. Концентрацию азоти-
ском институте ядерной физики им. Б.П. Кон-
стых оснований (C) определяли по формуле [26]:
стантинова НИЦ «Курчатовский институт» в
«Комплексе лучевой терапии «на пролет» на базе
10.1(D
−
D
)V
270
290
2
C
=
,
ускорителя протонов СЦ-1000». Интенсивность
0.19
V
1
пучка составляла 4 Гр/мин. Гамма-облучение
проводили в аэробных условиях при комнатной
где D270 и D290 - оптические плотности гидроли-
температуре на установке «Исследователь» (60Co)
зата при λ1 = 270 нм и λ2 = 290 нм, V1 - объем ис-
в Отделении молекулярной и радиационной био-
ходного раствора ДНК, V2 - объем гидролизата.
физики Петербургского института ядерной физи-
Используя полученное значение С и интенсив-
ки им. Б.П. Константинова. Мощность дозы со-
ность в максимуме спектра поглощения исходно-
ставляла 85 Гр/мин. Концентрация ДНК в облу-
го раствора ДНК D260(25°), измеренную перед на-
чаемых растворах составляла
1.39⋅10-4 М
чалом эксперимента по плавлению, определяли
нуклеотидов.
молярный коэффициент экстинкции ДНК [29]:
Спектрофотометрическое плавление. Измере-
31
D
260
(25°)
ε260(P)
=
,
ния кривых плавления ДНК в исследуемых рас-
0.099Cl
творах проводили на приборе Specord 200 plus
где l - длина оптического пути (1 см), 0.099 - со-
(Analytik Jena, Германия) с приставкой Пельтье, с
держание фосфора в ДНК (9.9%), 31 г/моль - мо-
шагом 1°, скорость нагрева 1°/мин. Использова-
лярная масса фосфора.
ли кварцевые кюветы с длиной оптического пути
1 см. В экспериментах измеряли оптическое по-
Круговой дихроизм (КД) ДНК регистрировали
глощение раствора в максимуме поглощения
на дихрографе Mark V (Jobin Ivon, Франция) при
комнатной температуре в кварцевых кюветах с
ДНК (D260) в зависимости от температуры (T).
длиной оптического пути 0.5 см. Спектры снима-
Сбор данных и управление экспериментом осу-
ли в диапазоне от 220 до 320 нм с шагом в 1 нм. На
ществляли с помощью программы WinASPECT
каждой длине волны проводили усреднение сиг-
(Analytik Jena, Германия). Обработку данных про-
нала КД по 1000 измерений. Для устранения вли-
водили в пакете OriginPro. Значение температуры
яния низкочастотных случайных процессов спек-
плавления ДНК (Тпл) определяли по положению
тры образца записывали три раза с последующим
максимума на дифференциальной кривой плав-
усреднением. Сглаживание спектров проводили
ления dD260(T)/dT [31]. Прежде чем приступить к
методом Савитского-Голея с рамкой сглажива-
плавлению, регистрировали спектр поглощения
ния в пять точек. Спектры КД представлены в ра-
ДНК в ультрафиолетовой области при температу-
боте в виде разницы поглощений лево- и право-
ре 25°С Dλ(25°). После завершения плавления ре-
поляризованного света, ΔA = AL - AR.
гистрировали спектр при максимальной темпера-
туре Dλ(95°). Далее проводили охлаждение рас-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
твора до 25°С в течение 10 мин и регистрировали
спектр ДНК Dλ(25°*). Используя полученные
В работе изучали спектральные параметры вы-
спектры поглощения, определяли величину ги-
сокомолекулярной ДНК, облученной гамма-из-
перхромного эффекта [35]:
лучением и протонами с энергией 1000 МэВ в
растворах с двумя ионными силами - μ1 = 5 мМ
D
260
(95°)
−
D
260
(25°)
NaCl и μ2 = 150 мМ NaCl. На рис. 1 приведены
δ
=
100%,
D
(25
°)
примеры спектров поглощения ДНК в ультрафи-
260
олетовой области в контрольных (необлученных)
а также степень спиральности ДНК после плавле-
растворов и в растворах, облученных в дозе 50 Гр.
ния и последующего охлаждения (степень рена-
Спектры были зафиксированы при разных тем-
турации) [30]:
пературах в процессе плавления ДНК и после
БИОФИЗИКА том 66
№ 2
2021
ИССЛЕДОВАНИЕ ПОВРЕЖДЕНИЙ МОЛЕКУЛЫ ДНК
243
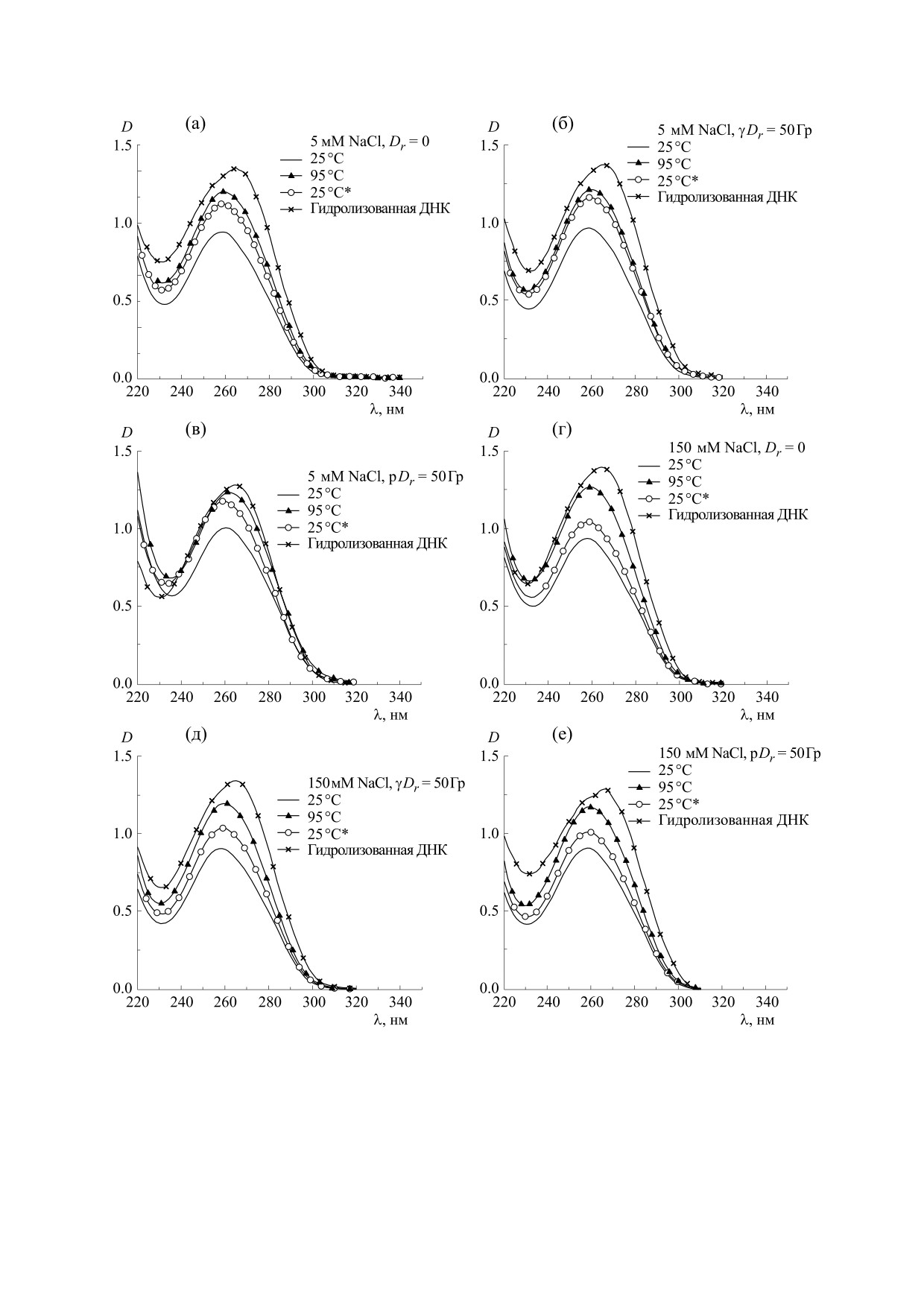
Рис. 1. Спектры УФ-поглощения ДНК в растворах с разной ионной силой (μ1 = 0.005, μ2 = 0.150), необлученной и об-
лученной в дозе 50 Гр протонным и гамма-излучением. Ионная сила раствора, вид излучения и температура, при ко-
торой измерялись спектры, указаны на графиках. 25°C* - спектры, измеренные после плавления и быстрого охлажде-
ния раствора ДНК.
БИОФИЗИКА том 66
№ 2
2021
244
КОТБ и др.
Рис. 2. Кривые плавления ДНК (а, в) и их первые производные (б, г), в растворах, облученных протонным и гамма-
излучением в дозах 30 Гр и 50 Гр. Ионная сила раствора и условия облучения указаны на графиках.
охлаждения раствора, а также после гидролиза.
исходит не только полное разделение цепей ДНК,
При нагревании раствора ДНК от 25°С до 95°С
но и их частичная фрагментация [26], поэтому
возникает хорошо известный гиперхромный эф-
спектры поглощения гидролизованной ДНК де-
фект вследствие денатурации двойной спирали.
монстрируют более сильный гиперхромный эф-
При последующем охлаждении раствора ДНК на-
фект, чем спектры ДНК при 95°С (рис. 1). Кроме
блюдается неполное восстановление поглоще-
того, в спектрах гидролизованной ДНК наблюда-
ется батохромный сдвиг вследствие протониро-
ния, которое объясняется частичной ренатураци-
вания азотистых оснований в кислой среде [36].
ей комплементарных участков ДНК, принадле-
жащих как разным одноцепочечным молекулам,
Кривые плавления нативной и облученной
так и одной нити (в последнем случае образуются
ДНК приведены на рис. 2. Основные структур-
«шпильки») [29-31]. Для высокомолекулярной
ные параметры ДНК, определенные из спектров,
ДНК полная ренатурация не происходит даже
представленных на рис. 1, и кривых плавления
при очень медленном отжиге из-за трудности вза-
(рис. 2) приведены в таблице. С ростом ионной
имного проникновения двух одноцепочечных
силы раствора вторичная структура нативной
клубков и сближения комплиментарных после-
ДНК стабилизируется, что отражается в росте ги-
довательностей [29]. В результате частичной ре-
перхромного эффекта, увеличении температуры
натурации ДНК в растворе образуются двухспи-
плавления ДНК и сужении интервала перехода
ральные участки, перемежающиеся одноцепо-
«спираль-клубок» [29, 30]. Степень ренатурации
чечными, причем они могут принадлежать
ДНК (ϑR), которая выражает степень спирально-
нескольким разным нитям. При гидролизе про-
сти ДНК, восстановленную при отжиге, также
БИОФИЗИКА том 66
№ 2
2021
ИССЛЕДОВАНИЕ ПОВРЕЖДЕНИЙ МОЛЕКУЛЫ ДНК
245
Параметры ДНК, облученной разными видами излучения (гамма- и протонного) в растворах с разной ионной
силой
Вид и доза
(ε260 ± 50),
(ΔС ± 0.02) ⋅ 10-5, M
(Tm ± 1), °C
(ϑR ± 0.5), %
(δ ± 0.5), %
излучения
M-1 cм-1
μ = 5 мМ NaCl
0
0
61
31.1
28.2
6340
γ, 30 Гр
0.30
51
22.4
30.0
6980
γ, 50 Гр
0.91
47
20.7
26.2
6990
p, 30 Гр
1.21
50
40.5
24.3
7790
p, 50 Гр
1.52
47
23.0
22.5
7660
μ = 150 мМ NaCl
0
0
84
67.8
36.7
6300
γ, 30 Гр
0.61
78
56.6
35.6
6360
γ, 50 Гр
0.61
73
54.3
33.1
6390
p, 30 Гр
0.91
81
63.0
29.4
7010
p, 50 Гр
2.12
78
90.9
30.2
7190
увеличивается с ростом ионной силы вследствие
Для выяснения характера и степени поврежде-
более эффективной экранировки отрицательно
ния структуры ДНК ее температура плавления
заряженных фосфатных групп противоионами.
является неоднозначным параметром [28]. Раз-
ные виды радиационных повреждений могут ока-
Облучение протонами и гамма-квантами вы-
зывать на Тпл противоположное влияние. Одно-
зывает разрушение хромофоров (азотистых осно-
и двухнитевые разрывы, разрушение, модифика-
ваний) и снижение температуры плавления (см.
ция и отрыв азотистых оснований приводят к де-
таблицу). По спектру поглощения ДНК при 25°С
стабилизации вторичной структуры и понижают
и скорректированной концентрации хромофоров
температуру плавления ДНК [1, 19, 28-30], тогда
был определен молярный коэффициент экстинк-
как межнитевые сшивки повышают Тпл [38].
ции ДНК (ε260), по величине которого можно су-
Сравнивая Тпл ДНК, облученной протонами и
дить о степени нативности макромолекулы.
гамма-квантами (см. таблицу), можно заметить,
Сравнение величин ΔС, ε260 и гиперхромного эф-
что при μ1 = 5 мМ NaCl эти значения при равных
фекта для необлученных и облученных систем
поглощенных дозах совпадают в пределах по-
(см. таблицу) показывает, что протонное облуче-
грешности эксперимента, а при μ2 = 150 мМ NaCl
ние более эффективно разрушает основания и
Тпл ДНК, облученной протонами, выше, чем Тпл
вторичную структуру ДНК при μ1 = 5 мМ NaCl и
ДНК, облученной гамма-квантами в той же дозе.
μ2 = 150 мМ NaCl.
При этом в ДНК, подвергнутой протонному об-
лучению, количество разрушенных азотистых ос-
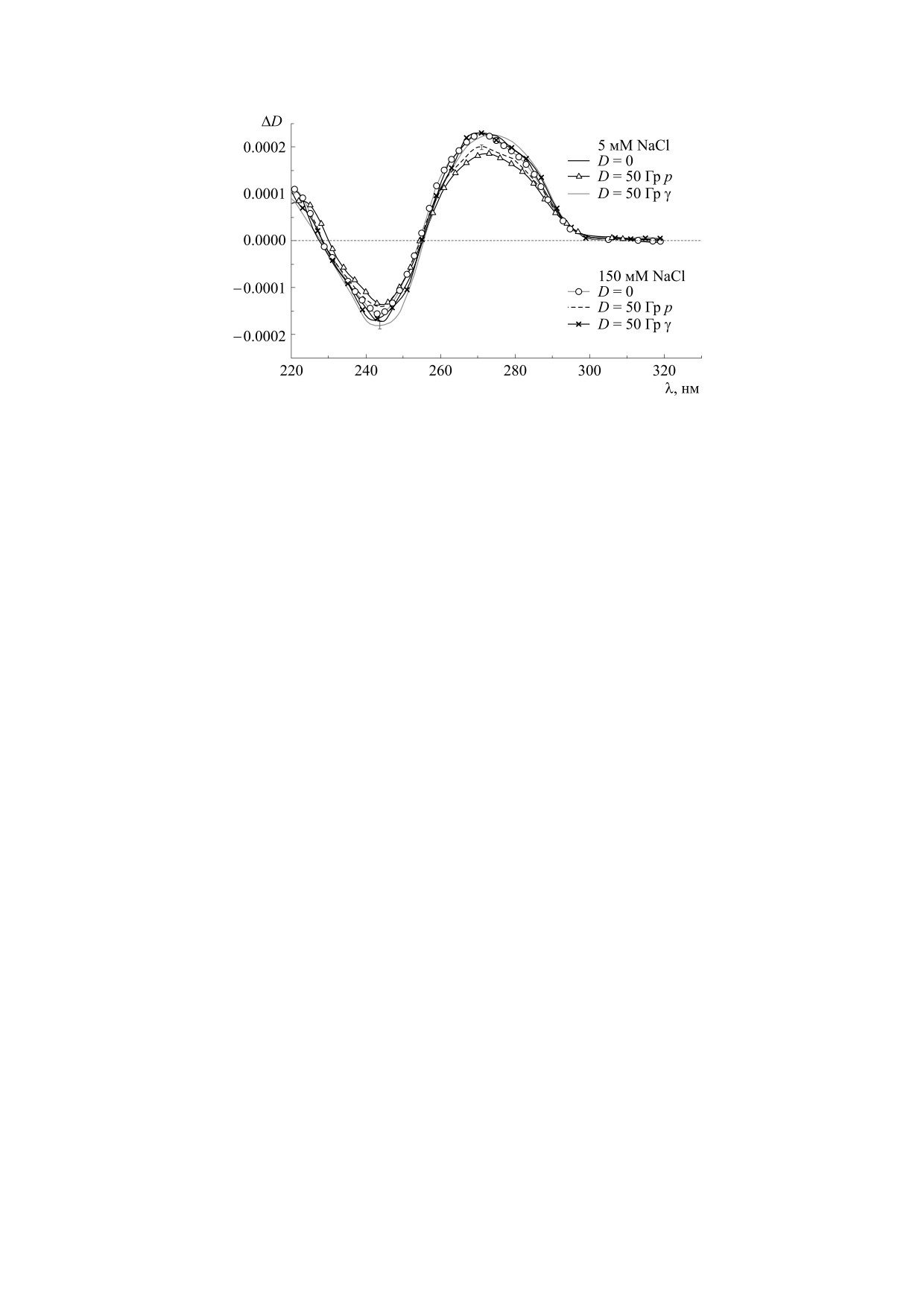
КД-спектры ДНК в изучаемых системах пока-
нований больше и степень спиральности ниже,
заны на рис. 3. Видно, что облученная ДНК со-
чем в ДНК, облученной гамма-радиацией в той
храняет В-форму. Гамма-облучение в дозе 50 Гр
же дозе. Можно предположить, что повышенные
практически не влияет на вид КД-спектра ДНК,
значения Тпл ДНК, облученной протонами, объ-
тогда как протонное облучение в той же дозе вы-
зывает снижение интенсивности положительной
ясняются появлением сшивок. Отметим, что ве-
роятность межнитевых сшивок удаленных по це-
и отрицательной полос. Подобный эффект может
быть следствием разрушения хромофоров, а так-
пи участков ДНК повышается с ростом ионной
силы (при μ2 = 150 мМ NaCl), так как вследствие
же дестабилизации вторичной структуры ДНК
[37]. Аналогичные изменения в спектре КД на-
более эффективной экранировки фосфатных
блюдаются и при облучении ДНК гамма-радиа-
групп противоионами объем клубка ДНК в этих
цией, но в дозах, в несколько раз больших, чем
условиях существенно меньше, чем при μ1 = 5 мМ
использованные в настоящей работе [28, 34].
NaCl [39].
Данные, полученные методом КД, также указы-
Степень ренатурации ϑR ДНК после гамма-
вают, что при равных поглощенных дозах высо-
коэнергетичные протоны производят более силь-
облучения понижается монотонно с ростом дозы
ные повреждения в структуре ДНК, чем гамма-
при μ1 и μ2 (см. таблицу). Действительно, разру-
излучение.
шение азотистых оснований должно препятство-
БИОФИЗИКА том 66
№ 2
2021
246
КОТБ и др.
Рис. 3. Спектры кругового дихроизма ДНК, облученной в дозе 50 Гр протонным и гамма-излучением в растворах с
разной ионной силой (μ1 = 5 мМ, μ2 = 150 мМ).
вать восстановлению вторичной структуры при
ФИНАНСИРОВАНИЕ РАБОТЫ
отжиге. Однако в растворах, облученных прото-
Работа выполнена при финансовой поддержке
нами, значения ϑR ДНК выше, чем в растворах,
Российского фонда фундаментальных исследова-
получивших такую же дозу гамма-облучения. Бо-
ний (грант № 18-08-01500).
лее того, в большинстве случаев степень ренату-
рации ДНК после протонного облучения оказы-
КОНФЛИКТ ИНТЕРЕСОВ
вается выше, чем для необлученной ДНК (см.
Авторы заявляют об отсутствии конфликта
таблицу). Этот эффект, который, как и повышен-
интересов.
ные значения Тпл ДНК, более ярко выражен в
растворах большой ионной силы, также можно
объяснить, предположив, что протонное облуче-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ние вызывает сшивки в молекуле ДНК.
Настоящая работа не содержит описания ис-
следований с использованием людей и животных
в качестве объектов.
ВЫВОДЫ
Гамма-кванты и протоны высоких энергий от-
СПИСОК ЛИТЕРАТУРЫ
носятся к излучениям с низкими значениями
1. Ю. Б. Кудряшов, Радиационная биофизика (иони-
ЛПЭ, однако первичные процессы передачи
зирующие излучения) (Физматлит, М., 2004).
энергии веществу-поглотителю у них различны.
2. H. Murshed, Fundamentals of radiation oncology,
Сравнение радиационного эффекта этих двух ви-
physical, biological and clinical aspects (Elsevier Inc.,
London, 2019).
дов излучения на ДНК в водно-солевых растворах
показало, что при дозах до 50 Гр протоны вызыва-
3. M. Beyzadeoglu, G. Ozyigit, and C. Ebruli, Basic Ra-
diation Oncology (Springer-Verlag, Berlin-Heidel-
ют более сильные разрушения азотистых основа-
berg, 2010).
ний и вторичной структуры ДНК. Кроме того, в
4. Г. Е. Труфанов, М. А. Асатурян и Г. М. Жаринов,
ДНК, облученной протонами, наблюдаются при-
Лучевая терапия (ГЭОТАР-Медиа, М., 2010), т. 2.
знаки межнитевых сшивок, вероятность которых
5. O. Desouky and G. Zhou, J. Taibah University for Sci-
повышается с ростом ионной силы раствора.
ence 10, 187 (2016).
6. C. Cao, D. Wang, C. Chung, et al., J. Thoracic Cardio-
vasc. Surg. 157 (1), 362 (2019).
БЛАГОДАРНОСТИ
7. R. W. Gao, K. R. Olivier, S. S. Park, et al., Adv. Radiat.
Oncol. 4, 314 (2019).
Часть исследований проведена с использова-
8. S. Falk, Surgery 27, 4 (2009).
нием оборудования ресурсных центров Научного
9. А. П. Черняев, Г. И. Клёнов, А. Ю. Бушманов
парка СПбГУ «Оптические и лазерные методы
и др., Мед. радиология и радиац. безопасность
исследования вещества» и «Нанофотоника».
64 (2), 11 (2019).
БИОФИЗИКА том 66
№ 2
2021
ИССЛЕДОВАНИЕ ПОВРЕЖДЕНИЙ МОЛЕКУЛЫ ДНК
247
10. А. С. Самойлов, Ж. Ж. Смирнова, В. А. Климанов
26. А. С. Спирин, Биохимия 23, 656 (1958).
и др., Мед. радиология и радиац. безопасность 64
27. S. A. Tankovskaia, O. M. Kotb, O. A. Dommes, and
(2), 41 (2019).
S. V. Paston, J. Physics: Conf. Series 1038, 012027
11. В. С. Хорошков, Мед. радиология и радиац. без-
(2018).
опасность 64 (2), 52 (2019).
28. S. A. Tankovskaia, O. M. Kotb, O. A. Dommes, and
12. И. А. Гулидов, Радиац. онкология и ядерная меди-
S. V. Paston, Spectrochim. Acta Part A: Mol. Biomol.
цина 1, 34 (2013).
Spectroscopy 200, 85 (2018).
13. V. E. Balakin, A. E. Shemyakov, S. I. Zaichkina, et al.,
29. C. R. Cantor and P. R. Schimmel, Biophysical Chem-
Biophysics 62 (1), 138 (2017).
istry (W. H. Freeman and Company, San Francisco,
14. L. L. Gol’din, V. P. Dzhelepov, M. F. Lomanov, et al.,
1980), Part 2 and 3.
Soviet Physics Uspekhi 16 (3), 402 (1973).
30. А. А. Веденов, А. М. Дыхне и М. Д. Франк-Каме-
15. M. Durante and H. Paganetti, Rep. Prog. Phys. 79,
нецкий, Успехи физ. наук 107 (3), 479 (1971).
096702 (2016).
31. D. Y. Lando, A. S. Fridman, C.-L. Chang, et al., Anal.
16. 16. L. Brewster, R. Mohan, G. Mageras, et al., Int. J.
Biochem. 479, 28 (2015).
Radiat. Oncol. Biol. Phys. 33, 1081 (1995).
32. D. S. Ershov, S. V. Paston, L. A. Kartsova, et al., Struct.
17. Н. К. Абросимов, А. А. Воробьев, В. А. Елисеев
Chem. 22 (2), 475 (2011).
и др., Мед. радиология 32 (8), 10 (1987).
33. S. V. Paston and V. V. Zamotin, J. Struct. Chem. 50 (5),
18. N. K. Abrosimov, Yu. A. Gavrikov, E. M. Ivanov, et al.,
970 (2009).
J. Phys.: Conf. Ser. 41, 424 (2006).
34. S. V. Paston, O. A. Dommes, and A. E. Tarasov, in Cir-
19. Н. И. Рябченко, Радиация и ДНК (Атомиздат, М.,
cular Dichroism: Theory and Spectroscopy, Ed. by D.
1979).
S. Rodgers (Nova Science Publishers, Inc., New York,
20. J. E. Coggle, Biological Effects of Radiation (Taylor &
2011), pp. 301-319.
Francis Ltd., London, 1983).
35. E. V. Chikhirzhina, T. Yu. Starkova, E. I. Kostyleva,
21. C. Allen, T. B. Borak, H. Tsujii, and J. A. Nickoloff,
et al., Cell Tissue Biol. 5, 536 (2011).
Mutat. Res. 711, 150 (2011).
36. Н. А. Касьяненко, С. Ф. Бартошевич и Э. В. Фри-
22. E. Surdutovich, E. Scifoni, and A. V. Solov’yov, Mutat.
сман, Молекуляр. биология 19 (5), 13, (1985).
Res. 704, 206 (2010).
37. E. I. Ramm, V. I. Vorob’ev, T. M. Birshtein, et al., Eur.
23. R. A. Mitteer Jr, Y. Wang, J. Shah, and S. Gordon, Sci.
J. Biochem. 25, 245 (1972).
Rep. 5, 13961 (2015).
38. D. Y. Lando, A. S. Fridman, A. G. Kabak, and
24. J. Kobierski and E. Lipiec, J. Mol. Struct. 1178, 162
A. A. Akhrem, J. Biomol. Structure and Dynamics 15,
(2019).
141 (1997).
25. T. K. Gaisser, Astroparticle Phys. 35, 801 (2012).
39. N. A. Kas’yanenko, J. Struct. Chem. 47, 163 (2006).
Investigation of DNA Damage Induced by Proton and Gamma Radiation
О.М. Kotb*, **, D.S. Brozhik***, V.N. Verbenko***, E.P. Gulevich***, V.F. Ezhov***,
D.L. Karlin***, F.A. Pak***, S.V. Paston*, A.M. Polyanichko*,
A.I. Khalikov***, and E.V. Chikhirzhina****
*Faculty of Physics, St. Petersburg State University, Ulyanovskaya ul. 1, Stary Peterhof, St. Petersburg, 198504 Russia
**Faculty of Science, Zagazig University, Sharkia Gov Zagazig, Egypt
***Petersburg Nuclear Physics Institute named by B.P.Konstantinov of National Research Center «Kurchatov Institute»,
mkr. Orlova roshcha 1, Gatchina, Leningrad Region, 188300 Russia
****Institute of Cytology, Russian Academy of Sciences, Tikhoretsky prosp. 4, St. Petersburg, 194064 Russia
In this study, we compared the effects of gamma and high-energy proton (1000 MeV) radiation on DNA in
aqueous saline solutions (5 mM and 150 mM NaCl) at doses of 30 Gy and 50 Gy. We used spectral methods
(ultraviolet absorption method, spectrophotometric methods for nucleic acid quantification, spectrophoto-
metric DNA melting, circular dichroism) for the estimation of the number of damaged nitrogenous bases and
damage of a secondary DNA structure. It was found that under these conditions, proton radiation causes
more severe destruction of nitrogenous bases and the secondary DNA structure than an exposure to gamma
rays at the same dose. In DNA irradiated with protons, the formation of crosslinks is possible, the probability
for crosslinking increases with the rise of the ionic strength of the irradiated solution.
Keywords: radiation oncology, proton therapy, DNA, gamma radiation, destruction of nucleobases, DNA melting
БИОФИЗИКА том 66
№ 2
2021