БИОФИЗИКА, 2021, том 66, № 2, с. 277-284
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ВОЗДЕЙСТВИЕ ИНДУКТОРОВ ФЕРРОПТОЗА НА МЕМБРАНЫ
МИТОХОНДРИЙ СЕРДЦА КРЫСЫ
© 2021 г. А.С. Фефлер*, М.В. Иванова**, К.Б. Шумаев**, ***, Э.К. Рууге*, **
*Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
**ФГБУ «Национальный медицинский исследовательский центр кардиологии» МЗ РФ,
121552, Москва, 3-я Черепковская ул., 15а
***ФИЦ «Фундаментальные основы биотехнологии» РАН, 119071, Москва, Ленинский просп., 33/2
E-mail: ruuge@mail.ru
Поступила в редакцию 30.12.2020 г.
После доработки 30.12.2020 г.
Принята к публикации 15.01.2021 г.
С помощью оптической спектроскопии проведено исследование моделей окисления липидов мем-
бран митохондрий сердца крысы. Эффективность окислительного действия тестируемых железосо-
держащих комплексов оценивали по уровню образующихся в пробах ТБК-реактивных соединений
как основных вторичных продуктов перекисного окисления. За изменением структурно-конфор-
мационных характеристик липидов митохондриальных мембран под действием инициаторов окис-
ления следили с помощью ЭПР-спектроскопии спиновых меток. Для наблюдения за изменениями
суспензии митохондрий некоторое время выдерживали с прооксидантами (как правило, миоглобин
с гидропероксидом кумола). В качестве спиновых меток были использованы 5-доксилстеариновая
и 16-доксилстеариновая кислоты, парамагнитные NO-фрагменты которых прикреплены к разным
участкам углеводородной цепи. Использованные модели окисления позволили получить препара-
ты мембран митохондрий с разной степенью окислительной модификации. Установлено, что ини-
циаторы окисления гидропероксид кумола (или трет-бутила) с миоглобином приводили к потере
парамагнетизма встроенных в мембраны спиновых меток
Ключевые слова: ферроптоз, сердце, митохондрии, окисление липидов, спиновые метки, электронный
парамагнитный резонанс.
DOI: 10.31857/S0006302921020083
кислот фосфолипидов, которые являются основ-
Термин ферроптоз для описания нового меха-
ными субстратами летальных для клеток процес-
низма регулируемой клеточной гибели был впер-
сов свободнорадикального перекисного окисле-
вые предложен в 2012 г. [1]. Ферроптоз - это про-
ния липидов [3, 4]. Ферроптоз является основ-
цесс гибели клеток, зависящий от железа и актив-
ным механизмом гибели клеток, связанным с
ных форм кислорода. Среди цитологических
повреждением органов в условиях гипоксии,
изменений при ферроптозе отмечают уменьше-
включая ишемические заболевания сердца, по-
ние или исчезновение митохондриальных крист
вреждение головного мозга и почечную недоста-
и разрыв внешней мембраны митохондрий [2].
точность [5].
Эти внутриклеточные аномалии являются ре-
Ряд исследований продемонстрировал, что
зультатом потери селективной проницаемости
митохондрии играют решающую роль в фер-
плазматической мембраны из-за интенсивного
роптозе, вызванном истощением цистеина, но не
перекисного окисления липидов и развития
при ингибировании GPX4 [5]. Снижение уровня
окислительного стресса. Гибель ферроптотиче-
цистеина приводит к повышению потенциала
ских клеток может быть остановлена липофиль-
(гиперполяризации) митохондриальной мембра-
ными антиоксидантами, хелаторами железа и ис-
ны и накоплению липидных пероксидов. Инги-
тощением полиненасыщенных ацилов жирных
бирование митохондриального цикла трикарбо-
новых кислот или цепи переноса электронов сни-
Сокращения: CumOOH - гидропероксид кумола, t-BuOOH -
жает гиперполяризацию митохондриальной
трет-бутилгидропероксид, МДА - малоновый альдегид,
ТБК - тиобарбитуровая кислота, 5DS - 5-доксилстеарино-
мембраны, накопление перекисей липидов и
вая кислота, 16DS - 16-доксилстеариновая кислота.
ферроптоз [5]. Повышение потенциала митохон-
277
278
ФЕФЛЕР и др.
дриальной мембраны отражает увеличение ак-
лись митохондрии, фильтровали и снова центри-
тивности митохондриальной цепи переноса элек-
фугировали в течение 10 мин при 14000 g. Осадок,
тронов и последующее образование АФК, что
суспендировали в 0,2 мл среды выделения с бы-
объясняет его роль в ферроптозе [5].
чьим сывороточным альбумином (3 мг/мл), пере-
носили в маленькую пробирку и хранили во льду.
Митохондрии являются органеллами, играю-
Концентрация белка в митохондриальной сус-
щими ключевую роль в окислительном метабо-
пензии, определенная по методу Лоури, состав-
лизме. В связи с этим важно, что ферроптоз свя-
ляла 30-35 мг/мл.
зан с морфологическими изменениями митохон-
дрий и окислением основного фосфолипида этих
Окисление митохондрий. Окисление митохон-
органелл - кардиолипина [4, 6], причем мишеня-
дрий (0.4 мг белка/мл) проводили в условиях ин-
ми действия некоторых мощных ингибиторов
тенсивного перемешивания при комнатной тем-
ферроптоза, по-видимому, являются митохон-
пературе в стеклянных пробирках (d = 25 мм,
дрии [4, 5].
h = 80 мм). Среда инкубирования содержала
0.15 М KCl и 50 мМ К-фосфатный буфер, рН 7.4.
Целью настоящей работы было выяснение ме-
Конечная концентрация инициатора окисления,
ханизмов воздействия железосодержащих соеди-
гидропероксида кумола (CumOOH) или трет-
нений - возможных индукторов ферроптоза - на
бутилгидропероксида (t-BuOOH), составляла
мембраны митохондрий. С использованием оп-
1.6 мМ. Для приготовления исходного водного
тической спектроскопии были изучены несколь-
раствора трет-бутилгидропероксида добавляли
ко моделей окисления липидов мембран мито-
30 мкл 70% t-BuOOH в 1 мл H2O. Для приготовле-
хондрий сердца крысы. В качестве окислителей
ния исходного спиртового раствора гидроперок-
использовали железосодержащие белки (миогло-
сида кумола растворяли 50 мкл 80% CumOOH в
бин, гемоглобин, ферритин) или ионы Fe2+ в со-
1 мл этанола. Для запуска окисления к препара-
четании с органическими гидропероксидами,
там митохондрий добавляли различные комплек-
гидропероксидом кумола или трет-бутил гидро-
сы железа: 7 мкМ метмиоглобина, 1.9 мкМ метге-
пероксидом. С помощью спектроскопии ЭПР
моглобина,
2.8 мкМ ферритина,
38.1 мкМ
спиновых меток было изучено взаимодействие
Fe(NH4)2(SO4)2 (соли Мора). Концентрацию ма-
5-доксил- и 16-доксилпроизводных стеариновой
лонового альдегида (МДА) определяли по методу,
кислоты с липидами в митохондриальных мем-
описанному в работе [8], с незначительными мо-
бранах под действием инициаторов окисления.
дификациями. Отбирали по 1 мл смеси до введе-
ния инициаторов окисления, сразу после введе-
МАТЕРИАЛЫ И МЕТОДЫ
ния гидропероксида кумола (или трет-бутилгид-
ропероксида), затем через 5, 10, 20, 30 мин после
Получение изолированных митохондрий. Мито-
начала окисления, к отобранным образцам до-
хондрии выделяли из сердец крыс линии Wistar
бавляли 1 мл 20% трихлоруксусной кислоты, 1 мл
(масса животных 250-300 г) методом дифферен-
0.67% раствора тиобарбитуровой кислоты (ТБК)
циального центрифугирования. Среда выделения
и 10 мкл 5 мМ бутилгидрокситолуола. Далее об-
содержала 70 мМ сахарозы, 50 мМ HEPES,
разцы перемешивали на вортексе, 45 мин выдер-
220 мМ маннитола, 1 мМ EDTA, pH 7.4. Все эта-
живали в кипящей водяной бане, охлаждали и
пы выделения митохондрий проводили при тем-
центрифугировали 5 мин при 3000 g. В надосадоч-
пературе 0-4°С. После анестезии крысы внутри-
ной жидкости измеряли оптическую плотность
брюшинным введением уретана (1.8 г/кг массы
при λ = 532 нм (максимум поглощения тримети-
животного) сердце вырезали и помещали в ста-
нового комплекса ТБК-МДА). Концентрацию
канчик с охлажденной средой выделения. Сердце
МДА вычисляли, используя коэффициент мо-
перекладывали в охлажденную чашку Петри,
лярной экстинкции для комплекса ТБК-МДА
освобождали от предсердий и надрезали с боков
ε = 1.56·105 М-1см-1 [7]. Измерения проводили
четыре раза (для лучшей отмывки от крови). По-
на cпектрофотометре Cary
60 (Agilent, Ав-
сле этого сердце измельчали ножницами, снова
стралия).
промывали раствором среды выделения и про-
пускали через сито из нержавеющей стали с диа-
Спектроскопия ЭПР спиновых меток 5-доксил-
метром отверстий 0.8 мм. Далее измельченную
и
16-доксилпроизводных стеариновой кислоты.
ткань переносили в гомогенизатор (стекло-те-
Ферроптоз приводит к повреждению внешней и
флон), добавляли 25-30 мл среды выделения до
внутренней митохондриальных мембран [3]. Ме-
соотношения ткань/среда выделения 1:8 и гомо-
тод спиновых меток является одним из способов,
генизировали две-три минуты до превращения
который позволяет следить за изменением струк-
суспензии в гомогенную. Осаждение митохон-
турно-конформационных характеристик липи-
дрий производили в два этапа на центрифуге К-24
дов митохондриальных мембран под действием
(ГДР). После первого центрифугирования
инициаторов окисления. Для наблюдения за ука-
(10 мин, 700 g), супернатант, в котором содержа-
занными изменениями суспензии митохондрий
БИОФИЗИКА том 66
№ 2
2021
ВОЗДЕЙСТВИЕ ИНДУКТОРОВ ФЕРРОПТОЗА НА МЕМБРАНЫ
279
выдерживали некоторое время с прооксидантами
(как правило, миоглобин с гидропероксидом ку-
мола).
Регистрацию и анализ спектров ЭПР проводи-
ли на малогабаритном автоматизированном
спектрометре ESR 70-03 XD/2 (УП «КБСТ» БГУ,
Беларусь). Реакционную смесь вводили в газо-
проницаемую PTFE Sub-Lite-Wall капиллярную
трубку (внутренний диаметр 0.635 мм, толщина
стенки 0.051 мм) фирмы Zeus Industrial Products,
Inc. (США). Капиллярная трубка дважды склады-
вали и вставляли в кварцевую трубку диаметром
~4 мм, открытую с обоих концов. Это обеспечи-
вало доступ воздуха (содержит ~21% O2) к образцу
в резонаторе спектрометра ЭПР во время реги-
страции спектра.
Характерные спектры 5-доксил- (5DS) и 16-док-
силпроизводных (16DS) стеариновой кислоты в
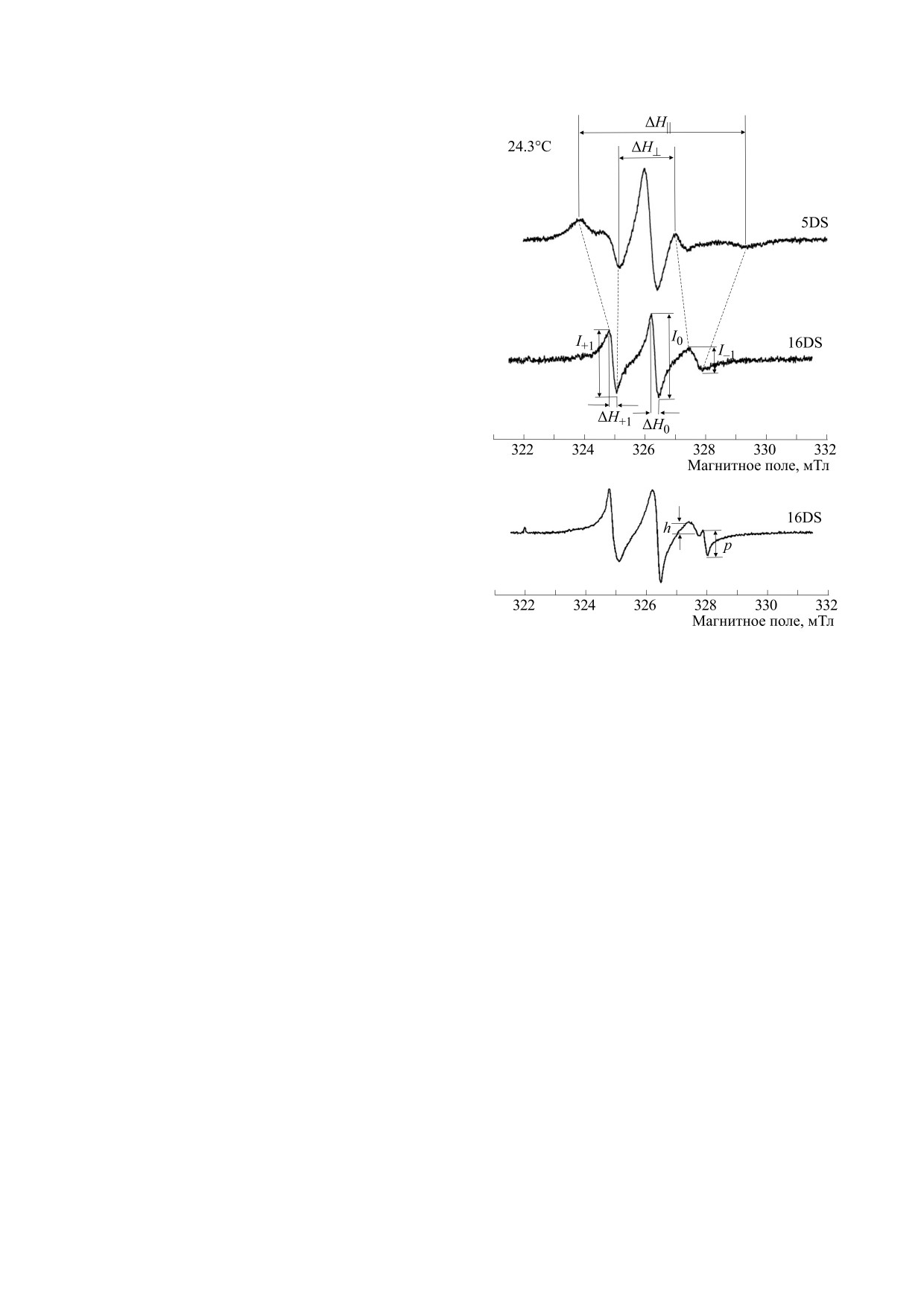
биологических мембранах представлены на рис. 1.
Cпектры ЭПР нитроксильных радикалов чув-
ствительны к изменениям их молекулярной по-
движности и физико-химических свойств окру-
жающей среды [9]. 5DS и 16DS характеризуются
разной глубиной погружения своего парамагнит-
ного NO-фрагмента в липидный бислой и соот-
ветственно разными скоростями вращательной
диффузии. На рис. 1 показаны необходимые
для анализа спектров ЭПР 5DS и 16DS параметры
[8, 9]:
1) параметр порядка S, определяемый по фор-
муле
Рис. 1. Спектры ЭПР 5-доксил- и 16-доксилпроиз-
водных стеариновой кислоты в биологических мем-
S = (A'∥ - A'⊥) / [Azz - 1/2(Axx + Ayy)]⋅a/a'
бранах.
где A'∥ = 1/2ΔH∥ и A'⊥ ≈ 1/2ΔH⊥,
a' = 1/3(A'∥ + 2A'⊥),
вертки 10 мТл. Выбор параметров определялся
требованием достижения максимальной чувстви-
a = 1/3(Azz + Axx + Ayy);
тельности при неискаженной форме сигнала.
2) время корреляции вращательной диффузии,
Реактивы. В работе использовали реактивы
оцениваемое по формулам
фирм Sigma (США), ICN (США), Serva (ФРГ),
Aldrich (США) и других.
τ+1 = 6.5 ⋅ 10-10⋅ΔH+1[(I+1/I-1)1/2-1], с,
Статистический анализ. Эксперименты с каж-
дой концентрацией исследуемых веществ прово-
или τ0 = 6.65 ⋅ 10-10⋅ΔH0[(I0/I-1)1/2-1], с;
дили в трех-пяти повторах. Для эксперименталь-
3) параметр p/h, позволяющий оценить соот-
ных групп вычисляли среднее арифметическое и
ношение метки, растворенной в полярной среде,
стандартное отклонение. Для сравнения средних
к метке, встроенной в липиды биологических
значений использовали однофакторный диспер-
мембран.
сионный анализ с последующим применением
критерия Даннета для оценки достоверности от-
В качестве объекта исследования использова-
личий между группами, различия между группа-
ли спин-меченую суспензию митохондрий серд-
ми считали значимыми при P < 0.05.
ца крысы, содержавшую
100 мкМ
5DS или
100 мкМ 16DS. Запись спектров ЭПР 5-доксил- и
16-доксилпроизводных стеариновой кислоты про-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
водили при комнатной температуре и нормаль-
ном атмосферном давлении. Условия записи
Взаимодействие окислителей с изолированными
спектров ЭПР: ослабление СВЧ-мощности 5-
митохондриями. В качестве окислителей в работе
10 дБ, амплитуда ВЧ-модуляции 0.1-0.2 мТл, ко-
использовали белки, содержащие редокс-актив-
эффициент усиления 100-1000, диапазон раз-
ное железо (миоглобин или гемоглобин) и ионы
БИОФИЗИКА том 66
№ 2
2021
280
ФЕФЛЕР и др.
Концентрации инициаторов окисления в среде инкубации
Миоглобин
Гемоглобин
Соль Мора
Ферритин
CumOOH
t-BuOOH
7 мкМ
1.9 мкМ
38.1 мкМ
2.84 мкМ
1.6 мМ
1.6 мМ
ропероксида [12]. Гидропероксид кумола нахо-
Fe2+ (соль Мора) в сочетании с органическими
дится в основном в липидной фазе, а трет-бути-
гидропероксидами: миоглобин + CumOOH, мио-
лгидропероксид - в водной фазе. Этим можно
глобин + t-BuOOH, ферритин + CumOOH, фер-
объяснить больший эффект гидропероксида ку-
ритин + t-BuOOH, гемоглобин + CumOOH,
мола на окисление мембран митохондрий по
Fe2++ t-BuOOH, Fe2++ CumOOH. Концентра-
сравнению с трет-бутилгидропероксидом.
ции соединений в среде инкубации митохондрий
указаны в таблице.
Различие в действии гемопротеидов, исполь-
Эффективность окислительного действия те-
зованных для инициации окисления, возможно,
стируемых железосодержащих комплексов оце-
вызвано отличием редокс-потенциалов ионов
нивали по образованию ТБК-реактивных соеди-
железа в составе миоглобина и гемоглобина. Со-
нений (МДА и другие карбонильные вторичные
гласно литературным данным [13], Е0', измерен-
продукты перекисного окисления).
ные при рН 7.0 по отношению к Ag/AgCl-элек-
Данные о накоплении продуктов перекисного
троду, равны -155 мВ и -52 мВ для миоглобина и
окисления мембран митохондрий в присутствии
тетрамерного гемоглобина А соответственно.
различных инициаторов окисления представле-
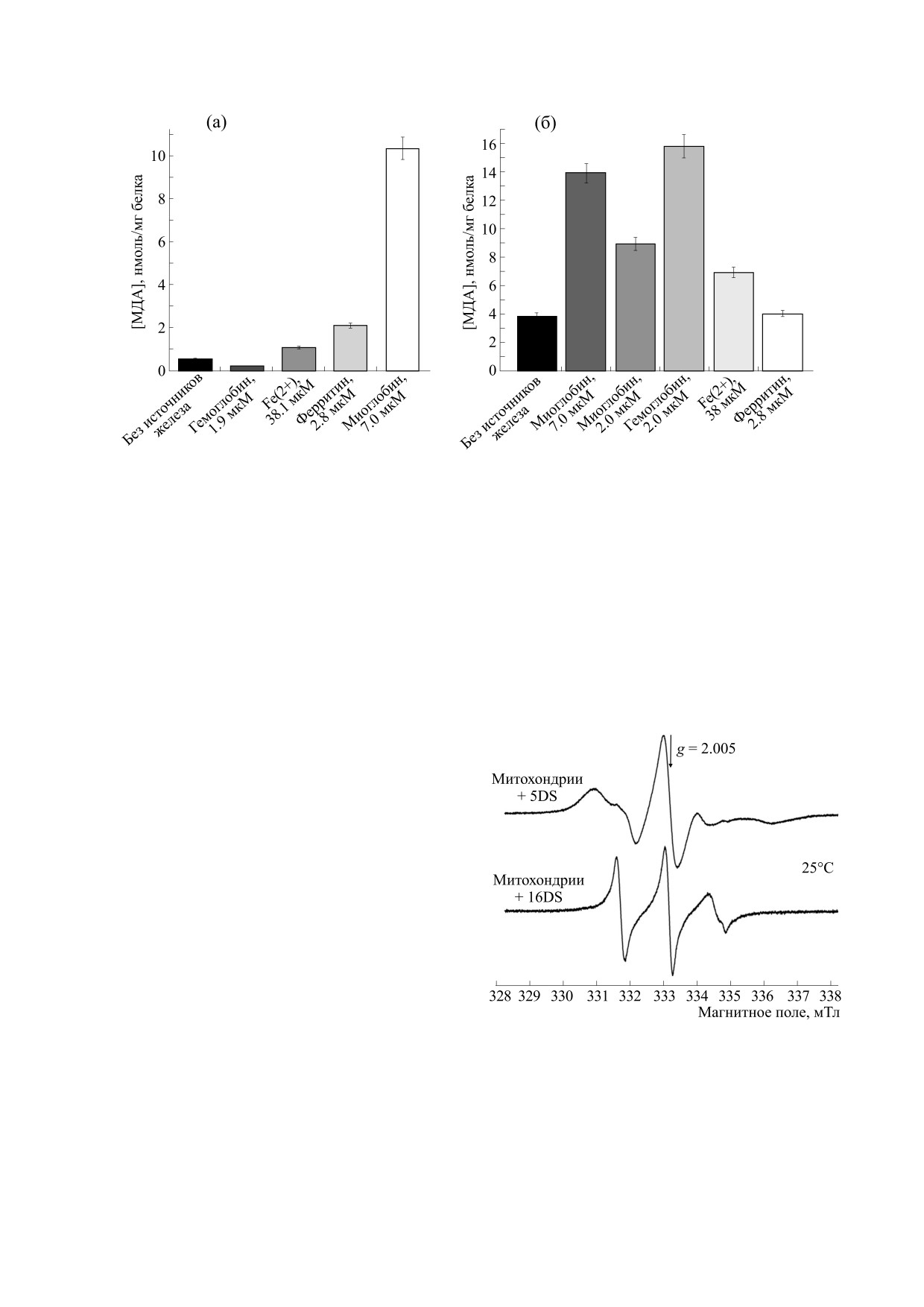
ны на рис. 2. Из этого рисунка видно, что комби-
Следует отметить, что в реакциях ионов Fe+2 с
нация гидропероксида кумола с миоглобином и
различными гидропероксидами (так называемых
гемоглобином оказывала наибольшее влияние на
реакциях Фентоновского типа) образуются
свободные радикалы [4, 14]. Эти реакции играют
мембраны митохондрий: за 30 мин окисления в
ключевую роль в цепных процессах перекисного
суспензии митохондрий образовывался МДА в
количестве 14-16 нмоль/мг белка, т. е. в три раза
окисления липидов, в том числе при ферроптозе
больше, чем при добавлении других использован-
[14]. Из ферритина железо также высвобождается
ных в работе прооксидантов.
в виде ионов двухвалентного железа [15]. Вместе с
тем при взаимодействии органических гидро-
Следует отметить, что CumOOH более липо-
перксидов с метгемом (порфирин-Fe+3) кроме
фильное соединение, чем t-BuOOH. Логарифмы
коэффициентов распределения этих соединений
алкоксильных (RO•) и алкилпероксильных ради-
в системе «1-октанол - вода» равны 2.6 для гидро-
калов (ROO•) формируется оксоферрильная фор-
пероксида кумола [11] и -1.3 для трет-бутилгид-
ма гема (порфирин-FeIV+4=O) [16, 17]:
порфирин-Fe+3 + ROOH → порфирин•-FeIV+4=O + ROH,
(1)
порфирин·- FeIV+4=O + ROOH → порфирин-FeIV+4=O + RO• + H+,
(2)
порфирин-FeIV+4=O + ROOH → порфирин-FeIII-OH + ROO•.
(3)
Известно, что оксоферрильные формы гемо-
лы стеариновой кислоты. Спектральные пара-
протеидов являются чрезвычайно сильными
метры 5DS свидетельствуют также о локализации
окислителями, участвующими в окислительной
NO-фрагмента метки вблизи поверхности липид-
модификации важных биомолекул [16].
ного бислоя мембран митохондрий. Вращатель-
ную диффузию 5DS в мембране можно характе-
Взаимодействие спин-меченых производных
ризовать расстоянием между крайними экстре-
стеариновой кислоты с мембранами митохондрий.
мумами и/или параметром порядка S (см.
На рис. 3 представлены спектры ЭПР 5-доксил-
Материалы и методы). Эти параметры следую-
стеариновой кислоты и 16-доксилстеариновой
щие:
кислоты в суспензии митохондрий сердца крысы,
записанные при комнатной температуре (~25°С)
ΔH∥ = 5.31 мТл, ΔH⊥ = 1.81 мТл, S = 0.65.
до добавки в реакционную смесь окислителей -
Вращательная диффузия 16DS в мембранах
индукторов ферроптоза.
митохондрий характеризуется временами корре-
Приведенные на рис. 3 спектр 5DS характерен
ляции и степенью анизотропии вращательного
для медленной вращательной диффузии спино-
движения:
вой метки при наличии более быстрого анизо-
тропного вращения вокруг длинной оси молеку- τ0 = 1.36 ⋅ 10-9 с, τ+1 = 1.04 ⋅ 10-9 с, τ+1/τ0 = 0.76.
БИОФИЗИКА том 66
№ 2
2021
ВОЗДЕЙСТВИЕ ИНДУКТОРОВ ФЕРРОПТОЗА НА МЕМБРАНЫ
281
Рис. 2. Накопление МДА в суспензии митохондрий через 30 мин после добавления инициаторов окисления: (а) -
соединений железа и 1.6 мМ трет-бутилгидропероксида; (б) - соединений железа и 1,6 мМ гидропероксида кумола.
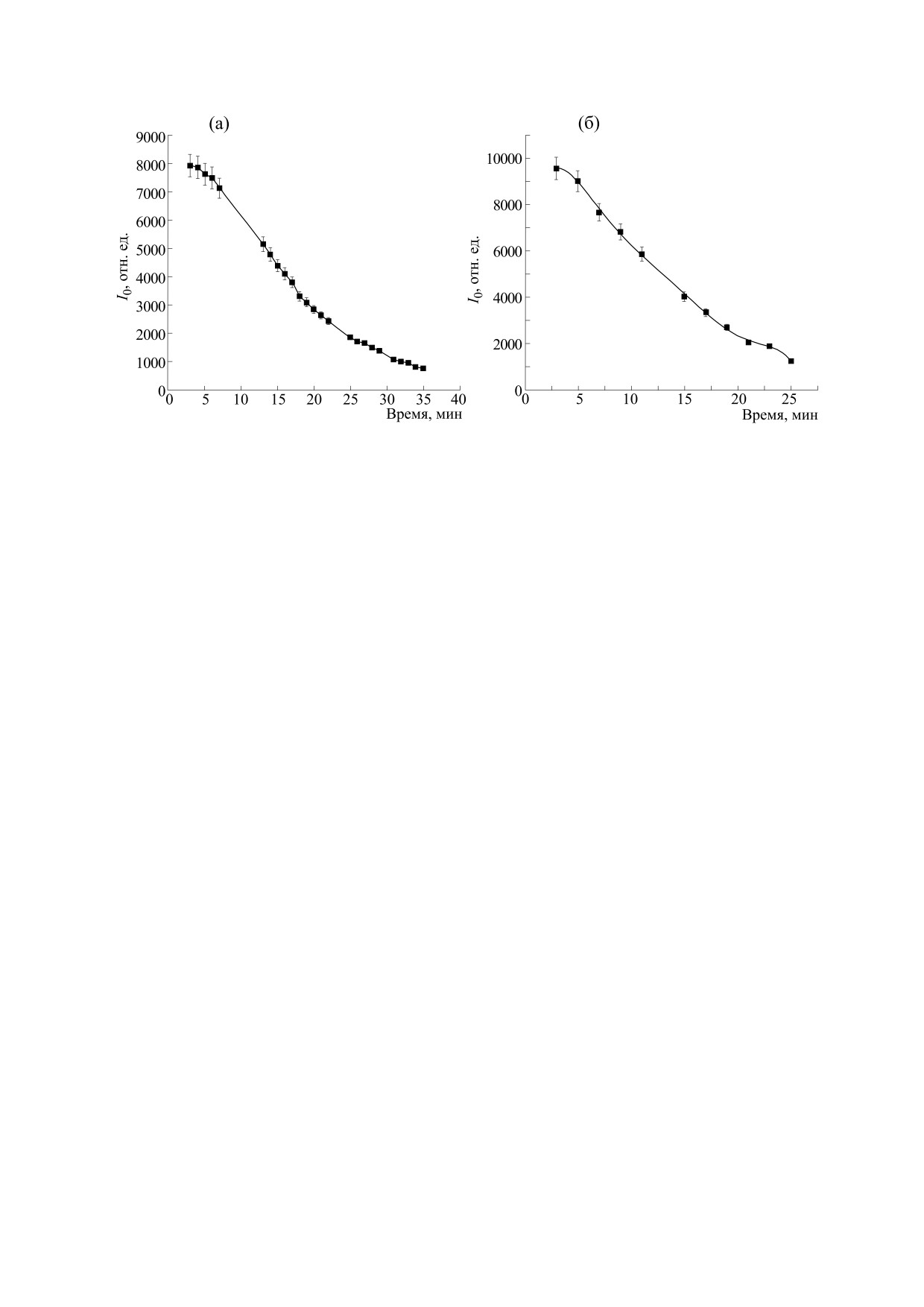
Приведенные выше спектральные параметры
окисление, в результате чего формируется нитрон
являются весьма характерными для многих спин-
>N=O, причем оба продукта диамагнитны. Соот-
меченых радикалами 5DS и 16DS биологических
ветствующие кинетические кривые образования
мембран.
предполагаемых диамагнитных продуктов, по-
строенные по убыли амплитуды центральной
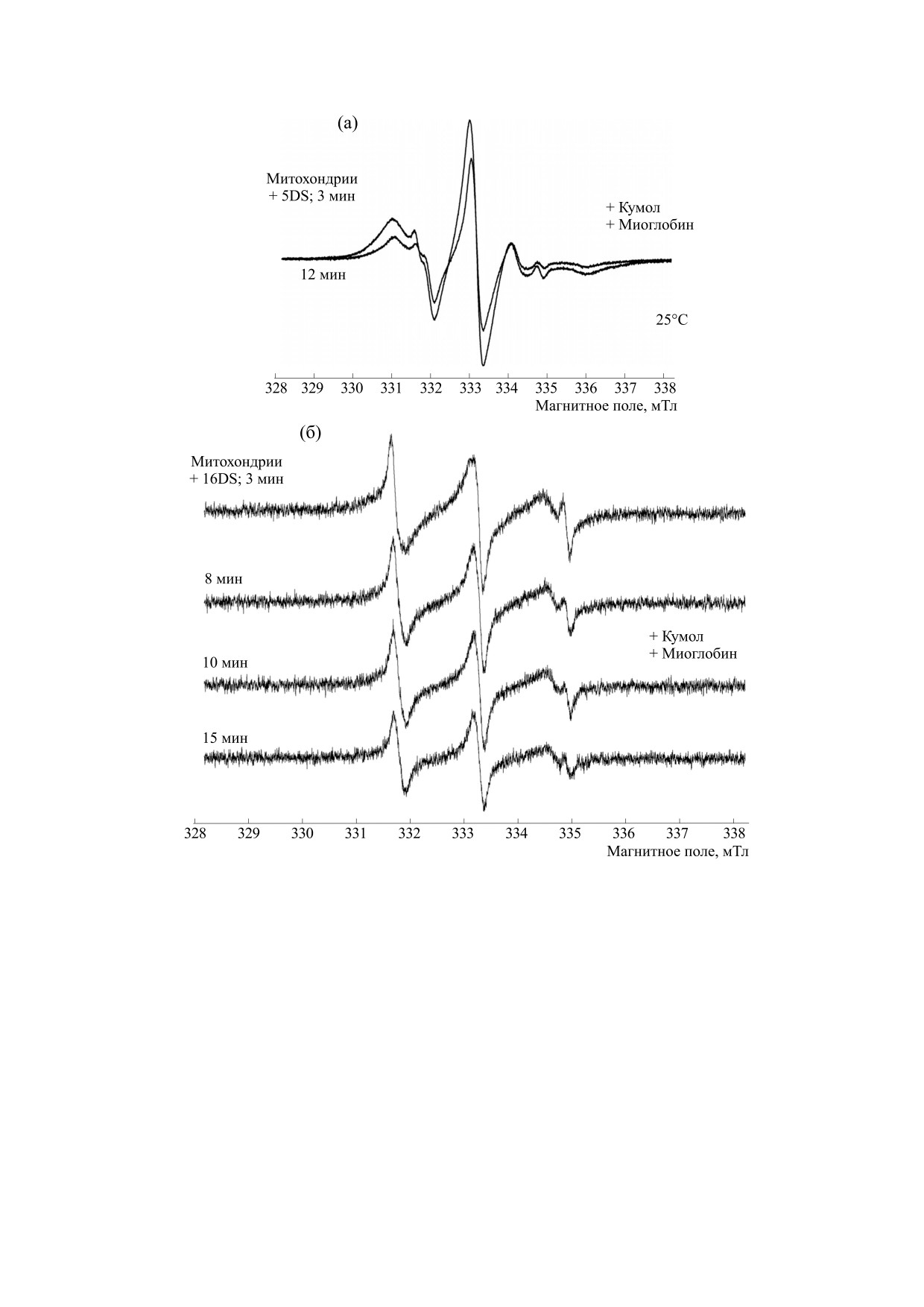
На рис. 4а,б представлены спектры ЭПР 5DS
компоненты (I0) спектров обеих спиновых меток,
и 16DS, записанные после добавления в инкуба-
ционную смесь возможных индукторов фер-
приведены на рис. 5а,б. Нами установлено, что
роптоза - соединений, вызывающих окисление
скорость процесса зависела как от доступности
липидов митохондриальных мембран. Добавлен-
парамагнитного фрагмента метки для окислите-
ные инициаторы окисления (гидропероксид ку-
мола или смесь гидропероксида кумола с миогло-
бином) приводили к небольшому изменению
спектральных параметров использованных спи-
новых меток. Эти изменения свидетельствовали
об уменьшении микровязкости (увеличении жид-
костности) липидов митохондриальных мем-
бран, однако выявленные экспериментальные
различия оказались недостаточными для доказа-
тельства статистической достоверности.
Хорошо известно, что многие железосодержа-
щие соединения в сочетании с органическими
гидропероксидами способны восстанавливать
нитроксильные радикалы, вызывая потерю их па-
рамагнетизма. Эти соединения растворимы в по-
лярной среде, однако способны также проникать
внутрь биологических мембран. Действительно,
из рис. 4а,б видно, что после введения в суспен-
зию митохондрий компонентов использованной
окислительной смеси - гидропероксида кумола и
Рис. 3. Спектры ЭПР 5DS и 16DS в суспензии мито-
миоглобина - спектры 5DS и 16DS постепенно
хондрий сердца крысы, записанные при комнатной
температуре (~25°С) до добавки в реакционную смесь
теряют свою интенсивность, по-видимому, в ре-
окислителей (индукторов ферроптоза), Образцы на-
зультате редокс-реакций парамагнитной >N-O
ходились (при pH 7.4) в газопроницаемых PTFE Sub-
группы [18]. Это может быть как восстановление
Lite-Wall капиллярах фирмы Zeus Industrial Products,
с образованием гидроксиламина >N-OH, так и
Inc. (США), обдуваемых воздухом (21% O2).
БИОФИЗИКА том 66
№ 2
2021
282
ФЕФЛЕР и др.
Рис. 4. Спектры ЭПР 5DS и 16DS в суспензии митохондрий сердца крысы, записанные при комнатной температуре
(~25°С) до добавки в реакционную смесь окислителей (индукторов ферроптоза), Образцы находились (при pH 7.4) в
газопроницаемых PTFE Sub-Lite-Wall капиллярах фирмы Zeus Industrial Products, Inc. (США), обдуваемых воздухом
(21% O2).
ля, так и от концентрации последнего. При до-
реакций (1)-(3) можно предположить, что в усло-
бавлении 5DS или 16DS вместе с окислителем не-
виях наших экспериментов в основном происхо-
посредственно в среду инкубации без митохон-
дит окисление парамагнитной >N-O группы спи-
новых зондов. Хотя нельзя исключить восстанов-
дрий потеря парамагнетизма спиновых меток
ление этой группы с участием цепи переноса
происходила практически мгновенно. В случае
электронов митохондрий.
длительной инкубации митохондрий (≥30 мин) с
окислителями перед добавлением спиновых ме-
Введение в спин-меченую радикалами 5DS
ток 5DS или 16DS их спектральные параметры
или 16DS суспензию митохондрий только мио-
оказались стабильными. Исходя из этих данных и
глобина не приводило к спаду интенсивности их
БИОФИЗИКА том 66
№ 2
2021
ВОЗДЕЙСТВИЕ ИНДУКТОРОВ ФЕРРОПТОЗА НА МЕМБРАНЫ
283
Рис. 5. Кинетические кривые образования диамагнитных производных спиновых меток в суспензии митохондрий с
миоглобином и гидропероксидом кумола: (а) - для 5-DS, концентрация гидропероксида кумола 10 мМ, миоглобина
22 мкМ; (б) - для 16-DS, концентрация гидропероксида кумола 2.26 мМ, миоглобина 4.8 мкМ.
спектров ЭПР. В то же время при использовании
ЗАКЛЮЧЕНИЕ
в качестве инициатора окисления только гидро-
Было обнаружено, что ионы железа и гемовое
пероксида кумола спектры обоих радикалов так-
железо приводят к усилению перекисного окис-
же постепенно теряли свою интенсивность. Этот
ления липидов митохондрий в присутствии орга-
факт согласуется с тем, что окисление мембран
нических гидроперекисей. Упомянутые соедине-
митохондрий происходит и в отсутствие внешних
ния рассматриваются в качестве индукторов фер-
источников железа (рис. 2), в качестве которых
роптоза, действие которых связано с продукцией
могут выступать различные митохондриальные
свободных радикалов липидов и оксоферрильной
железосодержащие белки [15].
формы гемовой группы.
С помощью ЭПР-спектроскопии, применяя в
Следует отметить, что при увеличении кон-
качестве спиновых меток 5-доксил- и 16-доксил-
центрации и/или времени действия окислителей
производных стеариновой кислоты, получены
(гидропероксида кумола и миоглобина) всегда
данные о воздействии на липиды мембран мито-
наступил момент, когда спектры ЭПР 5DS или
хондрий сердца крысы инициаторов окисления
16DS в мембранах митохондрий больше не реги-
(индукторов ферроптоза). Использованные окис-
стрировались. Это свидетельствовало о том, что в
лители (гидропероксид кумола и трет-бутила с
наших экспериментах NO-фрагменты всех моле-
миоглобином) приводили к постепенной потере
кул 5-доксилстеариновой кислоты или 16-док-
парамагнетизма встроенных в мембраны мито-
силстеариновой кислоты оказались доступными
хондрий спиновых меток, при этом скорость про-
для окислителей независимо от места их локали-
цесса зависела от доступности парамагнитного
зации в митохонлриях. Ранее нами были проведе-
фрагмента метки и концентрации окислителя.
ны эксперименты с аскорбиновой кислотой -
Этот процесс, по-видимому, связан с редокс-ре-
восстановителем нитроксильных радикалов. По-
акциями, происходящими в мембранах митохон-
скольку аскорбиновая кислота не может реагиро-
дрий при перекисном окислении.
вать с 5DS- и 16DS-радикалами, локализованны-
ми во внутренней мембране митохондрий, спек-
ФИНАНСИРОВАНИЕ РАБОТЫ
тры ЭПР этих спиновых зондов частично
сохраняют свою интенсивность. В случае дей-
Работа выполнена при поддержке Российско-
ствия гидропероксида кумола и миоглобина в ка-
го фонда фундаментальных исследований (гран-
честве окислителей, по-видимому, происходит
ты №№ 18-015-00125 и 19-015-00444).
изменение упаковки липидов митохондрий и
свободнорадикальные реакции перекисного
КОНФЛИКТ ИНТЕРЕСОВ
окисления липидов распространяются и на внут-
реннюю мембрану, что позволяет окислителям
Авторы заявляют об отсутствии конфликта
добраться до NO-фрагмента 5DS и 16DS.
интересов.
БИОФИЗИКА том 66
№ 2
2021
284
ФЕФЛЕР и др.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
9. M. A. Hemminga I, Chem. Phys. Lipids 32, 323 (1983).
10. H. M. McConnell, J. Chem. Phys. 25 (4), 709 (1956).
Настоящая работа не содержит описания ис-
следований с использованием людей и животных
11. International Programme on Chemical Safety (IPCS)
в качестве объектов.
ments/icsc/icsc/eics0761.htm. (Дата обращения
20.05.20)
СПИСОК ЛИТЕРАТУРЫ
12. International Programme on Chemical Safety (IPCS)
1. B. Zhou, J. Liu, R. Kang, et al., Semin. Cancer Biol.
ments/icsc/icsc/eics0842.htm. (Дата обращения
66, 89 (2020).
20.05.20)
2. Y. Xie, W. Hou, X. Song, et al., Cell Death Differ. 23,
13. S. C. Dorman, C. F. Kenny, L. Miller, et al., Artif.
369 (2016).
Cells. Blood Substit. Immobil. Biotechnol. 30 (1), 39
3. S. Doll and M. Conrad, IUBMB Life 69 (6), 423
(2002).
(2017).
14. R. Shah, M. S. Shchepinov, and D. A. Pratt, ACS Cent.
4. M. M. Gaschler, B. R. Stockwell, Biochem. Biophys.
Sci. 4 (3), 387 (2018).
Res. Commun. 482, 419 (2017).
15. K. B. Shumaev, A. L. Dudylina, M. V. Ivanova, et al.,
5. M. Gao, J. Yi, J. Zhu, et al., Mol. Cell 73 (2), 354
Biofactors 44 (3), 237 (2018).
(2019).
6. S. J. Dixon, K. M. Lemberg, M. R. Lamprecht, et al.,
16. К. Б. Шумаев, Н. Э. Петрова, И. В. Заббарова и др.,
Cell 149 (5), 1060 (2012).
Биохимия 69 (5) 699 (2004).
7. H. Ohkawa, N. Ohishi, and K. Yagi, Anal. Biochem.
17. K. B. Shumaev, A. A. Gubkin, V. A. Serezhenkov, et al.,
95, 351 (1979).
Nitric Oxide 18 (1), 37 (2008).
8. R. O. Sinnhuber, T. C. Yu, Food Technol. 12 (1), 9
18. G. Bačić, A. Pavićević, and F. Peyrot, Redox Biology 8,
(1958).
226 (2016).
Effect of Ferroptosis Inductors on Rat-Heart Mitochondrial Membranes
A.S. Fefler*, M.V. Ivanova**, K.B. Shumaev**, ***, and E.K. Ruuge*, **
*Faculty of Physics, Lomonosov Moscow State University, Leninskie Gory 1/2, Moscow, 119991 Russia
**National Medical Research Centre for Cardiology, Ministry of Healthcare of the Russian Federation,
3-ya Cherepkovskaya ul. 15a, Moscow, 121552 Russia
***Federal Research Center “Fundamentals of Biotechnology”, Russian Academy of Sciences, Moscow, Leninskiy prosp. 33/2
Using optical spectroscopy, we have studied the models of lipid oxidation in mitochondrial membranes iso-
lated from rat heart. The oxidative efficiency of the tested iron-containing complexes was assessed by the level
of TBA-reactive compounds formed in the samples as the main secondary products of peroxidation. Site-di-
rected spin labeling in combination with EPR spectroscopy was used to trace changes in the structural and
conformational characteristics of mitochondrial membrane lipids in the presence of oxidation initiators.
Therefore, mitochondrial suspensions were incubated with prooxidants (it was generally a reaction mixture
containing myoglobin and cumene hydroperoxide) for a while. In this study, we used the spin labeled mole-
cules of 5-doxylstearic and 16-doxylstearic acid, whose paramagnetic NO-fragments are attached to different
side chain positions of the hydrocarbon chain. With the use of oxidation models, it was possible to obtain
preparations of mitochondrial membranes with different degrees of oxidative modification. It was found that
combination of the initiators of the oxidation - cumene (or tert-butyl hydroperoxide) and myoglobin results
in the failure of paramagnetiс centers of the spin labeled membrane protein to serve as the probes of changes.
Keywords: ferroptosis, heart, mitochondria, lipid oxidation, spin labels, electron paramagnetic resonance
БИОФИЗИКА том 66
№ 2
2021