БИОФИЗИКА, 2021, том 66, № 2, с. 294-301
БИОФИЗИКА КЛЕТКИ
УДК 616.153; 576.311.347.4+ 615.277.3
РЕСВЕРАТРОЛ ПРЕДОТВРАЩАЕТ ДИСФУНКЦИЮ МИТОХОНДРИЙ
В УСЛОВИЯХ СТРЕССА
© 2021 г. В.И. Бинюков*, И.В. Жигачева*, Е.М. Миль*, Н.И. Крикунова*, М.М. Расулов**
*Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
E-mail: zhigacheva@mail.ru
**Государственный научно-исследовательский институт химии и технологии элементоорганических соединений,
105118 Москва, ш. Энтузиастов, 38
E-mail: rasulovmaksud@gmail.com
Поступила в редакцию 25.01.2020 г.
После доработки 12.07.2020 г.
Принята к публикации 08.07.2020 г.
На моделях острой гипобарической гипоксии и острого алкогольного отравления исследованы ан-
тистрессовые свойства природного полифенола ресвератрола. Острая гипобарическая гипоксия и
острое алкогольное отравление приводили к росту интенсивности перекисного окисления липидов
в мембранах митохондрий печени мышей. Активация перекисного окисления липидов сопровож-
далась набуханием и изменениями в содержании жирных кислот С18 и С20-22 в составе общей ли-
пидной фракции мембран митохондрий. Индекс ненасыщенности С18-жирных кислот снижался на
7.5% (с 1.69 ± 0.01 до 1.52 ± 0.01. При этом соотношение (20:3ω6 + 20:5ω3)/22:6ω3 для жирных кислот
в условиях острой гипобарической гипоксии уменьшалось с 0.23 ± 0.02 до 0.13 ± 0.01, что свидетель-
ствовало о снижении метаболизма в эйкозаноидном цикле. Введение животным в течение пяти су-
ток 2 · 10-5 моль/кг ресвератрола предотвращало изменения жирнокислотного состава, активацию
перекисного окисления липидов и набухание митохондрий, что влияло на физиологические пока-
затели. Предполагается, что адаптогенные свойства ресвератрола могут быть обусловлены предот-
вращением перекисного окисления липидов в мембранах митохондрий, что, вероятно, отражается
на функциональном состоянии этих органелл, способствуя сохранению энергетического метабо-
лизма клетки в условиях стресса.
Ключевые слова: адаптогены, митохондрии, перекисное окисление липидов, гипоксия, острое алкоголь-
ное отравление.
DOI: 10.31857/S0006302921020101
диолипина, и набухание митохондрий. Следстви-
Стрессовые воздействия влекут за собой сме-
ем «перекисного» набухания митохондрий (или
щение антиоксидантно-прооксидантного равно-
образования больших пор во внешней мембране)
весия в сторону увеличения содержания актив-
является высвобождение апоптогенных белков из
ных форм кислорода (АФК) в клетке [1]. При
межмембранного пространства в цитоплазму и
этом одним из основных источников АФК могут
активация митохондриального пути апоптоза.
быть митохондрии [2]. Митохондрии являются
Поскольку наиболее общим проявлением стресс-
как источником, так и мишенью для этих интер-
реакции является увеличение генерации АФК
медиатов. Избыточная генерация АФК приводит
митохондриями, то, можно предположить, что
к окислению белков по остаткам тирозина, ци-
препараты-адаптогены, вероятно, должны сни-
стеина и серина, повреждению ДНК митохон-
жать генерацию АФК этими органеллами. В каче-
дрий и смещению редокс-потенциала клетки из-
стве адаптогенов, вероятно, можно использовать
за окисления глутатиона и НАД(Ф)Н [3]. Кроме
антиоксиданты, в частности антиоксиданты при-
того, увеличение генерации АФК вызывает пе-
родного происхождения. К таким антиоксидан-
роксидацию липидов мембран, прежде всего кар-
там относится ресвератрол (транс-3,4,5-тригид-
роксистилбен).
Сокращения: АФК - активные формы кислорода, ТМФД -
N,N,N',N'-тетраметил-п-фенилендиамин, ПОЛ
- пере-
Ресвератрол (рис. 1) был выделен в 1940 г. из
кисное окисление липидов, МЭЖК - метиловые эфиры
корня белого морозника (Veratrum album), а затем
жирных кислот, ЖК - жирные кислоты, АСМ - атомно-
силовая микроскопия, ОГГ - острая гипобарическая ги-
найден в корнях японского спорыша (Polygonum
поксия, ОАО - острое алкогольное отравление.
cuspidatum) [4]. В настоящее время ресвератрол
294
РЕСВЕРАТРОЛ ПРЕДОТВРАЩАЕТ ДИСФУНКЦИЮ МИТОХОНДРИЙ
295
обнаружен как минимум в 72 видах растений [5].
Он обладает антиоксидантными и противовоспа-
лительными свойствами [6]. Кроме того, ресвера-
трол предотвращает возрастные заболевания, рак
кожи и осуществляет защиту от сердечно-сосуди-
стых заболеваний [7].
Несмотря на низкую биодоступность, ресвера-
трол проявляет активность in vivo [8]. Активность
ресвератрола in vivo можно объяснить повторным
Рис. 1. Структурная формула ресвератрола.
превращением как сульфатов, так и глюкурони-
дов ресвератрола в свободный ресвератрол в орга-
нах-мишенях, таких как печень [9, 10]. Также воз-
глутатионпероксидазы, NADPH-хинон-оксидо-
можно, что комплексы ресвератрола с альбуми-
редуктазы и глутатион-S-трансферазы. При этом
ном и липопротеинами могут взаимодействовать
ресвератрол повышал уровень Nrf2, регулирую-
с клеточными мембранами, которые имеют ре-
шего экспрессию антиоксидантных генов, и ин-
цепторы для альбумина и липопротеинов низкой
дуцировал его транслокацию в ядро [17]. В высо-
плотности. По-видимому, комплексы диссоции-
ких концентрациях препарат вызывал нарушение
руют, оставляя ресвератрол свободным и позво-
окислительно-восстановительного статуса клет-
ляя ему проникать в клетки. Другим возможным
ки, увеличение генерации АФК митохондриями,
объяснением может быть биологическая актив-
а также открытие митохондриальной неспецифи-
ность его метаболитов.
ческой поры, что вело к снижению жизнеспособ-
ности клеток [19]. Эти результаты подчеркивают
Основной мишенью для ресвератрола являют-
важность баланса между про- и антиоксидантны-
ся митохондрии. Точный механизм влияния ре-
свератрола на функциональное состояние мито-
ми эффектами ресвератрола в зависимости от его
хондрий еще не известен. С одной стороны, ре-
дозы и возраста животных. В связи с этим целью
свератрол проявляет антиоксидантный эффект
исследования было изучение влияния ресвера-
трола и стрессовых воздействий на функциональ-
при патологиях и стрессе, с другой стороны - он
ное состояние митохондрий.
проявляет прооксидантные свойства и активиру-
ет апоптоз [11]. В работах [12, 13] авторы in vitro и
in vivo выявили дозовые эффекты ресвератрола.
МАТЕРИАЛЫ И МЕТОДЫ
Так, была установлена стимуляция активности
комплекса I ресвератролом в низких (<5 мкМ)
Работу проводили на митохондриях печени
дозах, и наоборот - подавление активности этого
мышей линии Balb/c.
комплекса ресвератролом в больших (50 мкМ)
Регулирующие стандарты. Исследования вы-
дозах. Препарат предотвращал высвобождение
полняли согласно Правилам лабораторной прак-
цитохрома с и снижал генерацию супероксидного
тики в Российской Федерации и в соответствии с
анион-радикала за счет активации в мембранах
правилами, принятыми Европейской Конвенци-
митохондрий разобщающего белка UCP2 [11].
ей по защите позвоночных животных, используе-
Однако ресвератрол в зависимости от концентра-
мых для экспериментальных и иных научных це-
ции (12-28 мкМ) может ингибировать актив-
лей [20], согласно утвержденному письменному
ность F0F1-ATФазы/ATФ-синтазы митохондрий
протоколу, в соответствии со стандартными опе-
[13]. По мнению авторов, влияние ресвератрола
рационными процедурами исследователя, а так-
на F0F1-АТФазу/АТФ-синтазу связано с его спо-
же с Руководством по лабораторным животным и
альтернативным моделям в биомедицинских ис-
собностью взаимодействовать с частью F1 белка.
следованиях [21].
Нарушение активности F0F1-АТФаз может при-
Мышам опытной группы внутрибрюшинно
вести к гибели клеток в результате апоптоза или
некроза, в зависимости от степени ингибирова-
вводили 2 ⋅ 10-5 моль/кг ресвератрола в течение
ния. Ингибирование активности F0F1-ATФа-
5 суток. Раствор ресвератрола готовили разведе-
зы/ATФ-синтазы наблюдалось лишь при исполь-
нием препарата в бидистиллированной воде. Ис-
зовании препарата в довольно высоких концен-
ходный раствор (1 мл) препарата (2 ⋅ 10-4 М) до-
трациях. В более низких концентрациях (от
водили водой до 40 мл и вводили животным пре-
пикомолярных до наномолярных) ресвератрол
парат в объеме 0.1 мл (исходя из средней массы
стимулировал активность F0F1-АТФазы [14, 15].
мышей 25 г). Контрольной группе животных вну-
Необходимо отметить, что препарат повышал
трибрюшинно вводили 0.1 мл бидистиллирован-
активность антиоксидантных ферментов и акти-
ной воды.
вировал экспрессию антиоксидантных генов [16,
Выделение митохондрий печени проводили ме-
18]. Так в опытах in vitro на гепатоцитах он повы-
тодом дифференциального центрифугирования
шал активность каталазы, супероксиддисмутазы,
[22]. Первое центрифугирование - при 600 g в те-
БИОФИЗИКА том 66
№ 2
2021
296
БИНЮКОВ и др.
чение 10 мин, второе - при 9000 g, 10 мин. Осадок
использованием программ Microsoft Excel и Sig-
ресуспендировали в среде выделения. Соотноше-
ma Plot 10.
ние ткань : среда - 1 : 0.25. Среда выделения со-
Идентификацию метиловых эфиров жирных
держала 0.25 М сахарозы, 10 мМ HEPES, pH 7.4.
кислот в образцах осуществляли также на основе
Скорости дыхания митохондрий определяли с
масс-спектров, полученных после разделения
помощью закрытого электрода типа Кларка на
МЭЖК в условиях, аналогичных газохроматора-
полярографе LP-7Е (Чехия). Среда инкубации
фическому анализу, на приборе Hewlett Packard-
содержала: 0.25 M сахарозы, 10 мМ трис-HСl,
6890 (США). Масс-спектры получали в режиме
2 мМ MgSO4, 2 мМ КН2РО4, 10 мM КСl, 2 мM ас-
электронного удара при ионизирующем напря-
жении 70 эВ и скорости сканирования 1 с на дека-
корбата, 5 мкМ ротенона, 0.9 мкM антимицина А,
0.5 мкM FCCP (карбонилцианид-п-трифторме-
ду масс в области 40-400 дальтон.
токсифенилгидразона) и 400 мкM N,N,N',N'-тет-
Индекс ненасыщенности жирных кислот (или
раметил-п-фенилендиамина (ТМФД), pH 7.4.
индекс двойных связей) рассчитывали по формуле
ИДС = ∑Pj n/100, где Pj - относительное процент-
Уровень перекисного окисления липидов (ПОЛ)
оценивали флуоресцентным методом [23]. Липи-
ное содержание жирных кислот (ЖК) в общей
ды экстрагировали смесью «хлороформ : мета-
липидной фракции мембран митохондрий, n -
нол» = 2 : 1 (по объему) из митохондрий, содержа-
число двойных связей в молекуле ЖК.
щих 3-5 мг белка. Соотношение митохондрии :
Коэффициент ненасыщенности (К) жирных
смесь «хлороформ-метанол» = 1:10. Регистрацию
кислот определяли, как отношение ∑ ненасы-
флуоресценции проводили в десятимиллиметро-
щенных ЖК / ∑ насыщенных ЖК.
вых кварцевых кюветах на спектрофлуориметре
FluoroMax (Horiba Yvon GmbH, Япония). В кон-
Морфологию митохондрий исследовали мето-
трольную кювету добавляли 3 мл хлороформа, а
дом атомно-силовой микроскопии (АСМ). Об-
затем 0.3 мл метанола. Длина волны возбуждения
разцы митохондрий фиксировали 2%-м глутаро-
флуоресценции составляла 360 нм, испускания -
вым альдегидом в течение 1 ч с последующей
420-470 нм. Результаты выражали в условных
промывкой водой и осаждением методом центри-
единицах флуоресценции, пересчитанных на мг
фугирования. Митохондрии наносили на поверх-
белка.
ность кремниевой подложки и подсушивали на
воздухе. Исследование проводили на приборе
Исследование жирных кислот мембран митохон-
SOLVER P47 SMENA на частоте 150 кГц в полу-
дрий печени мышей проводили методом газо-
контактном режиме с использованием кантиле-
жидкостной хроматографии и хромато-масс-
вера NSG11 с радиусом кривизны 10 нм. Некото-
спектрометрии.
рые геометрические параметры имиджа митохон-
Метиловые эфиры жирных кислот (МЭЖК) по-
дрий определяли, используя программный пакет
лучали кислотным метанолизом липидов мем-
«Image Analysis». Сечение проводили на высоте
бран митохондрий [24, 25]. МЭЖК экстрагирова-
30 нм. Объем имиджа митохондрий исследуемых
ли гексаном и полученные растворы анализиро-
препаратов соответствовал произведению пло-
вали.
щади сечения имиджа митохондрии на среднюю
высоту данного имиджа в области сечения.
Определение количественного состава метило-
вых эфиров жирных кислот проводили на хрома-
Набухание выделенных митохондрий оценива-
тографе марки Кристалл 2000М (Россия) с пла-
ли по оптической плотности суспензии митохон-
менно-ионизационным детектором и кварцевой
дрий (D) при длине волны 540 нм на спектрофо-
капиллярной колонкой DB-1 (60 м × 0.32 мм,
тометре СФ-26 (Россия). Измерение проводили в
слой 0.25 мкм, J&W Scientific, США). Анализ
кювете объемом 2 мл при температуре 28°С. Сре-
МЭЖК выполняли при программировании тем-
да инкубации митохондрий содержала: 0.25 М са-
пературы от 120 до 270°С со скоростью 4°С/мин.
харозы, 10 мМ трис-HCl, рН 7.5. Концентрация
Температура инжектора и детектора - 270°С; ско-
белка в пробе составляла 0.3 мг/мл.
рость газа-носителя гелия составляла 2.0 мл/мин,
Протекторную активность препарата исследо-
деление потока на входе в колонку - 1 : 40. Иден-
вали, используя модели острой гипобарической
тификацию МЭЖК осуществляли по величинам
гипоксии, острой гемической гипоксии, острой
индексов удерживания [26]. Содержание МЭЖК
цитотоксической гипоксии и острого алкоголь-
в образцах рассчитывали как площадь пика соот-
ного отравления.
ветствующей кислоты к сумме площадей пиков,
соответствующих найденным МЭЖК. Стандарт-
Модель «старения» митохондрий. Выделенные
ное отклонение средних значений площадей пи-
митохондрии (2-3 мг белка) помещали в 0.5 мл
ков, полученных в трех измерениях, не превыша-
среды, содержащей 65 мМ KCl, 10 мМ HEPES и
1 мМ КН2PО4, pH 7.4. Митохондрии инкубиро-
ло 5% (относительное значение). Математиче-
скую обработку результата проводили с
вали 20-25 мин при комнатной температуре.
БИОФИЗИКА том 66
№ 2
2021
РЕСВЕРАТРОЛ ПРЕДОТВРАЩАЕТ ДИСФУНКЦИЮ МИТОХОНДРИЙ
297
Острую гипобарическую гипоксию (ОГГ) у мы-
шей Balb/c моделировали в стеклянной барока-
мере в атмосфере низкого давления (230.40 мм рт.
ст.), что соответствует высоте 9000 м над уровнем
моря. В первые минуты в камере создавали разре-
жение, соответствующее 5 тысячам метров (дав-
ление 405 мм рт. ст.) над уровнем моря. В каждую
последующую минуту проводили «подъем» еще
на одну тысячу метров. Время пребывания крыс
на «высоте» 9000 м над уровнем моря - 5.0 мин.
Острое алкогольное отравление (ОАО) вызыва-
ли введением мышам линии Balb/c массой 20-
25 г перорально этанол в дозе 8 г/кг.
Острую гемическую гипоксию вызывали внут-
рибрюшинным введением мышам линии Balb/c
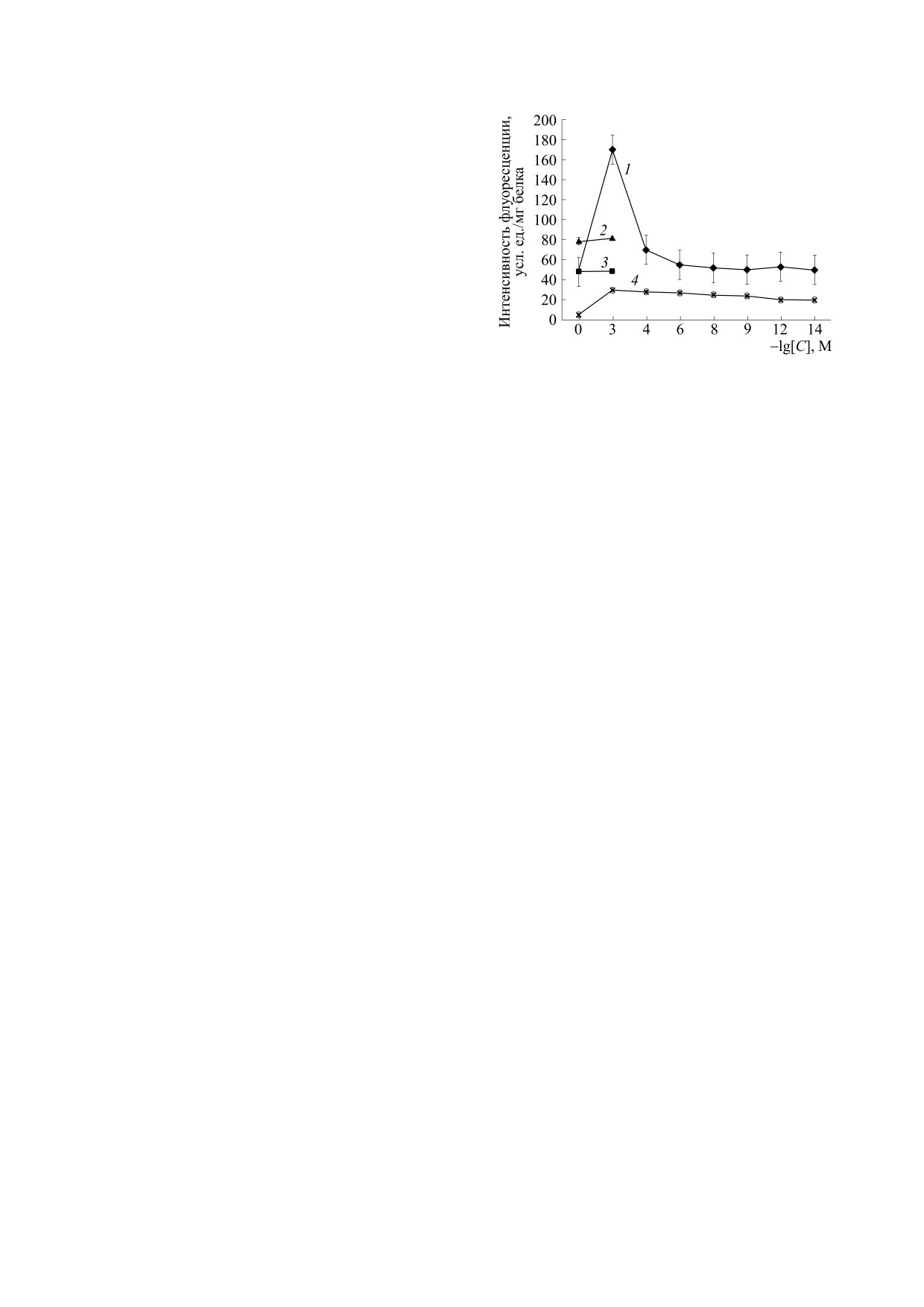
Рис. 2. Влияние «старения» митохондрий и различ-
нитрита натрия в дозе 250 мг/кг.
ных концентраций ресвератрола на интенсивность
флуоресценции конечных продуктов ПОЛ (основа-
Острую цитотоксическую гипоксию вызывали
ний Шиффа). По оси абсцисс отрицательный лога-
внутрибрюшинным введением мышам линии
рифм концентрации ресвератрола; по оси ординат -
Balb/c азида натрия из расчета 20 мг/кг.
интенсивность флуоресценции продуктов ПОЛ в усл.
ед./мг белка; 1 - «старение» митохондрий с ресвера-
Протекторную активность препарата определя-
тролом; 2 - уровни флуоресценции продуктов ПОЛ в
ли при введении мышам течение 5 суток 2 ⋅ 10-5 М
мембранах «стареющих» митохондрий; 3 - уровни
ресвератрола.
флуоресценции продуктов ПОЛ в мембранах мито-
хондрий группы «контроль» (без введения в среду ин-
Использовали следующие реактивы: метанол,
кубации ресвератрола); 4 - раствор ресвератрола,
хлороформ, карбонат калия (Merck, Германия),
приготовленный в среде выделения (0.25 М сахарозы,
10 мМ HEPES, pH 7.4). Нулевая точка на кривой 4 -
сахарозу, трис, ротенон, антимицин A, ТМФД
флуоресценция среды выделения.
(Sigma, США), бычий сывороточный альбумин
(свободный от жирных кислот), глутаровый аль-
дегид (Sigma, США), HEPES (МР Biomedicals,
Для исследования антистрессовых свойств
Германия), гексан (Panreac, Испания), ацетил-
препарата была выбрана концентрация 10-5 М.
хлорид (Acros, Бельгия).
Поскольку выбор данной концентрации был сде-
лан исходя из результатов изучения прямого вли-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
яния ресвератрола на изолированные митохон-
дрии, необходимо было выяснить, окажет ли пре-
Поиск концентраций ресвератрола, эффек-
парат в данной концентрации защитный эффект
тивно снижающих интенсивность ПОЛ, прово-
при введении его животным. Для этого ресвера-
дили, используя модель «старения» митохондрий
трол вводили мышам в течение 5 суток в концен-
печени (инкубация митохондрий в гипотониче-
ской солевой среде при комнатной температуре).
трации 2 ⋅ 10-5 моль/кг. Последнюю инъекцию
«Старение» митохондрий печени мышей приво-
проводили за 45 мин до выделения митохондрий.
дило к активации ПОЛ в мембранах митохон-
Проверку защитного действия препарата осу-
дрий. При этом интенсивность флуоресценции
ществляли на модели «старения» митохондрий,
продуктов ПОЛ (оснований Шиффа) в мембра-
исследуя АСМ-изображения митохондрий раз-
нах митохондрий возрастала в 2.5 раза (рис. 2).
личных групп животных. АСМ-изображения ми-
Введение ресвератрола в среду инкубации мито-
тохондрий печени мышей, инкубируемых в гипо-
хондрий снижало интенсивность флуоресценции
тонической среде, существенно отличались от
продуктов ПОЛ и имело дозовую зависимость. В
контрольных образцов, инкубируемых в изото-
концентрации 10-4 М препарат не влиял на ин-
нической среде, где наблюдали митохондрии со
тенсивность ПОЛ в мембранах «стареющих» ми-
средним объемом V = 0.295 ± 0.003 мкм3, (рис. 3).
тохондрий. При этом в концентрации 10-3 М ре-
В то время в условиях гипотонии объем митохон-
свератрол проявлял прооксидантную активность.
дрий составлял V = 0.555 ± 0.003 мкм3. Ресвера-
В интервале 10-5-10-14 М ресвератрол снижал
трол предотвращал набухание митохондрий:
интенсивность флуоресценции продуктов ПОЛ
средний размер митохондрий почти не отличался
почти до контрольных значений. Эти данные
от контрольных образцов. В следующей серии
свидетельствуют о возможности использования
опытов проверку протекторных свойств препара-
10-5-10-14 М препарата для защиты от оксида-
та проводили на моделях острой ОГГ и ОАО. Вы-
тивного стресса.
бор данных моделей обусловлен активацией пе-
БИОФИЗИКА том 66
№ 2
2021
298
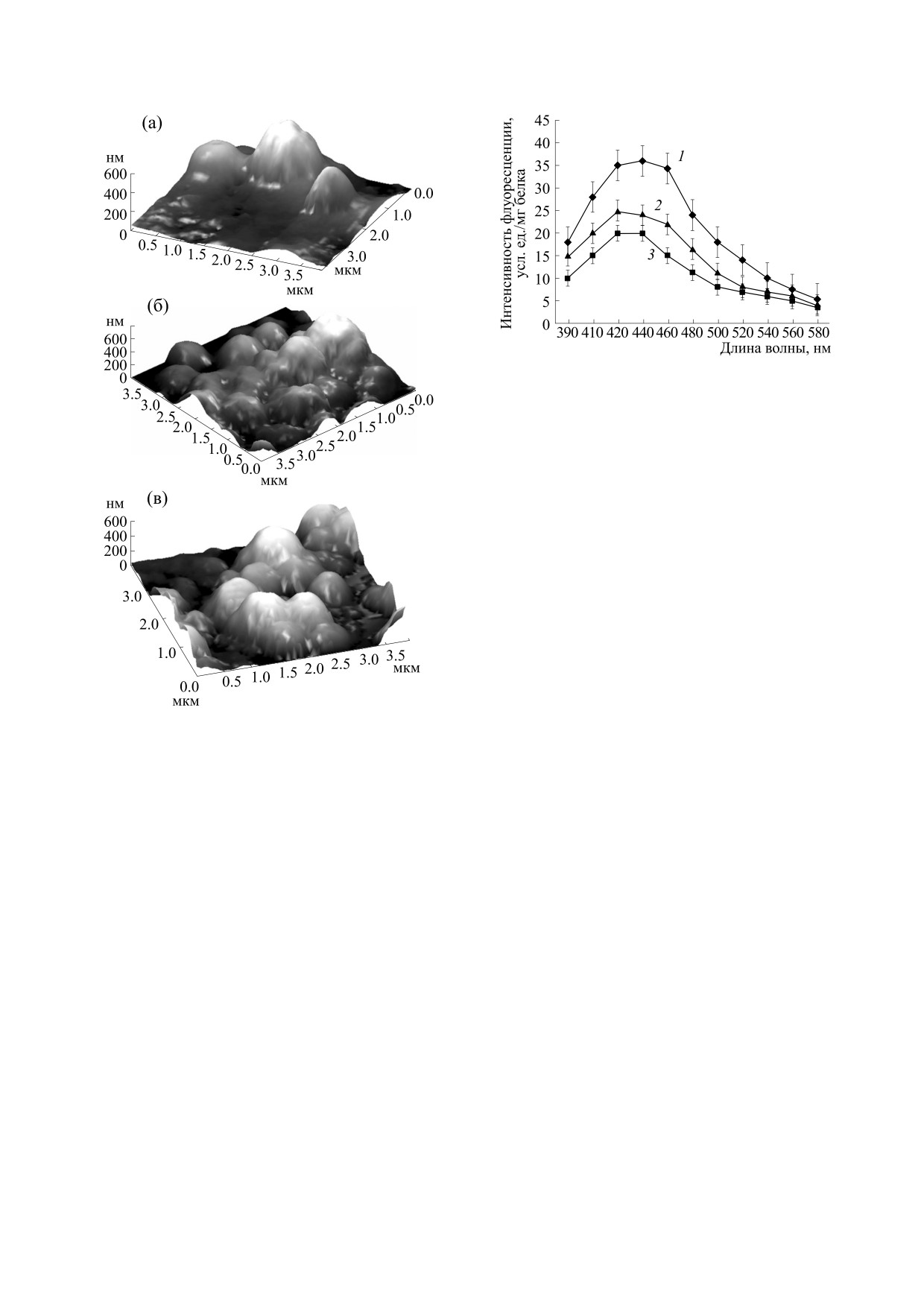
БИНЮКОВ и др.
Рис. 4. Влияние острой гипобарической гипоксии и
ресвератрола на спектры флуоресценции продуктов
ПОЛ. По оси абсцисс - длина волны в нм; по оси ор-
динат - интенсивность флуоресценции в усл. ед./мг
белка; 1 - ОГГ; 2 - введение в течение пяти суток
2 ⋅ 10-5 М ресвератрола, последнее введение за 45 мин
до воздействия + ОГГ; 3 - контроль.
чем свидетельствовало снижение оптической
плотности суспензии митохондрий в 1.15 раза.
Введение животным в течение пяти суток
2 ⋅ 10-5 М ресвератрола до стрессовых воздей-
ствий (ОГГ или ОАО) предотвращало активацию
ПОЛ и набухание митохондрий (рис. 4 и 5).
Рост интенсивности ПОЛ в условиях ОГГ при-
водил к изменениям в жирнокислотном составе
общей липидной фракции мембран митохон-
дрий. Изменения наблюдались в содержании
ЖК, содержащих 18 и 20-22 углеродных атома.
Так, индекс ненасыщенности С18 ЖК снижался
Рис. 3. АСМ-изображения (3Д) изолированных мито-
на 7.5% (табл. 1), а коэффициент ненасыщенно-
хондрий печени мышей (мкм3): (а) - контроль; (б) -
сти С18 ЖК - с 1.69 ± 0.01 до 1.52 ± 0.01. При этом
ОГГ; (в) - введение в течение пяти суток 2 ⋅ 10-5 М ре-
содержание линолевой кислоты, одной из основ-
свератрола, последнее введение за 45 мин до воздей-
ствия + ОГГ.
ных ЖК в составе кардиолипина - фосфолипида,
который входит в состав внутренней мембраны
митохондрий и обеспечивает эффективную рабо-
рекисного окисления липидов и дисфункцией
ту дыхательной цепи митохондрий, уменьшалось
митохондрий в условиях ОГГ и острого алкоголь-
на 6%. На 27% снижалось содержание метаболита
ного отравления [27]. ОГГ вызывала увеличение
арахидоновой кислоты (22:4ω6) и на 28.4% - до-
интенсивности флуоресценции продуктов ПОЛ в
козапентаеновой кислоты (22:5ω3) (табл. 1).
мембранах митохондрий печени мышей в
Соотношения между ЖК - предшественника-
1.75 раза (рис. 4). При этом острое алкогольное
ми и ингибитором синтеза эйкозаноидов
отравление в 1.4 раза повышало интенсивность
20:4ω6/22:6ω3 и (20:3ω6+20:5ω3) /22:6ω3 - в
флуоресценции продуктов ПОЛ в мембранах ми-
условиях ОГГ снизились с 2.11 ± 0.12 до 1.61 ± 0.10
тохондрий печени (рис. 5). Это согласуется с ли-
и - с 0.23 ± 0.02 до 0.13 ± 0.01 соответственно, что
тературными данными, поскольку одним из ос-
свидетельствовало о снижении метаболизма в эй-
новных гепатотоксических эффектов ацетальде-
козаноидном цикле (рис. 6). Известно, что эйко-
гида, образующегося в печени из этанола в
заноиды являются сигнальными молекулами и
результате активации алкогольдегидрогеназы,
имеют широкий спектр биологических функций,
является инициация перекисного окисления ли-
включая усиление или подавление воспалитель-
пидов [28]. Увеличение генерации АФК митохон-
ных и аллергических реакций, контроль артери-
дриями, сопровождающееся активацией ПОЛ,
ального давления, сокращения или расслабления
способствовало набуханию митохондрий [29], о
гладких мышц и многое другое [30].
БИОФИЗИКА том 66
№ 2
2021
РЕСВЕРАТРОЛ ПРЕДОТВРАЩАЕТ ДИСФУНКЦИЮ МИТОХОНДРИЙ
299
Рис.
6. Соотношение
20:3ω6
+ 20:5ω3/22:6ω3 в
Рис. 5. Влияние острого алкогольного отравления и
мембранах митохондрий печени.
ресвератрола на спектры флуоресценции продуктов
ПОЛ. По оси абсцисс - длина волны в нм; по оси
ординат - интенсивность флуоресценции продуктов
ПОЛ в усл. ед./мг белка; 1 - ОАО; 2 - введение в
окислением этого фосфолипида во внутренней
течение пяти суток 2 ⋅ 10-5 М ресвератрола, последнее
мембране митохондрий, что могло отразиться на
введение за 45 мин до воздействия + ОАО; 3 -
биоэнергетических хапактеристиках [31]. Дей-
контроль.
ствительно, ОГГ почти в 1.3 раза снижала скоро-
сти транспорта электронов на конечном цитохро-
моксидазном участке дыхательной цепи мито-
Снижение содержания этих ЖК, возможно,
хондрий. При этом скорости окисления
так же как и снижение содержания линолевой
аскорбата в присутствии ТМФД сократились с
кислоты, влияло на устойчивость организма к
68.4 ± 2.5 до 53.1 ± 1.8 нг моль O2/(мг белка мин).
стрессовым воздействиям
Сокращение пула ненасыщенных С18 ЖК,
Введение в среду инкубации этих митохон-
входящих в состав кардиолипина, главным обра-
дрий 5 ⋅ 10-6 М цитохрома с вызывало восстанов-
зом линолевой кислоты, вероятно, обусловлено
ление скоростей окисления пары «аскорбат +
Таблица 1. Влияние ОГГ на жирнокислотный состав общей липидной фазы митохондрий печени мышей
ЖК
Контроль, отн. %
ОГГ, отн. %
ОГГ + ресвератрол, отн. %
16:1ω9
0.50 ± 0.20
1.00 ± 0.50
0.45 ± 0.35
16:1ω1
0.75 ± 0.05
0.85 ± 0.35
0.75 ± 0.35
16:0
21.35 ± 1.25
21.41 ± 1.16
21.7 ± 0.8
18:2ω6
13.50 ± 0.15
12.71 ± 0.16
14.35 ± 0.19
18:1ω9
11.0 ± 2.5
9.50 ± 2.13
9.55 ± 0.95
18:1ω7
2.90 ± 0.04
2.13 ± 0.60
2.60 ± 0.10
18:0
16.75 ± 1.30
15.98 ± 1.27
16.85 ± 1.65
20:4ω6
20.3 ± 1.0
20.93 ± 0.76
20.15 ± 1.35
20:3ω6
1.90 ± 0.02
1.56 ± 0.38
2.05 ± 0.55
20:5ω3
0.30 ± 0.00
0.17 ± 0.04
0.45 ± 0.15
22:6ω3
9.6 ± 1.0
13.01 ± 2.04
10.0 ± 0.50
22:4ω6
0.55 ± 0.50
0.40 ± 0.13
0.50 ± 0.00
22:5ω3
0.60 ± 0.00
0.43 ± 0.11
0.60 ± 0.00
∑С18ненас/С18
1.69
1.52
1.57
БИОФИЗИКА том 66
№ 2
2021
300
БИНЮКОВ и др.
Таблица 2. Антистрессовая активность ресвератрола
Воздействие
Измеряемый параметр
Контроль
Ресвератрол
Время жизни, мин
2.3 ± 0.5
6.2 ± 1.5
Инъекция азида натрия 20 мг/кг
(цитотоксическая гипоксия)
Доля выживших, %
0
30
Время жизни, мин
20.5 ± 3.1
38.7 ± 5.4
Инъекция нитрита натрия 250
мг/кг (гемическая гипоксия)
Доля выживших, %
0
15
Время жизни, мин
35.4 ± 6.1
127.4 ± 41.1
Пероральное введение этанола
(8 г/кг)
Доля выживших, %
0
12
Примечание. Представлены результаты пяти повторов по десять животных.
ТМФД» до контрольных значений, что свиде-
КОНФЛИКТ ИНТЕРЕСОВ
тельствует о потере митохондриями части цито-
Авторы заявляют об отсутствии конфликта
хрома с, обусловленной окислением кардиолипи-
интересов.
на [31].
Отметим, что ресвератрол предотвращал изме-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
нения в жирнокислотном составе мембран мито-
Исследования выполняли согласно Правилам
хондрий. Предотвращая ПОЛ, ресвератрол, по-
лабораторной практики в Российской Федера-
видимому, предупреждал потери цитохрома с ми-
ции, а также в соответствии с правилами, приня-
тохондриями. При этом скорости окисления па-
тыми Европейской Конвенцией по защите по-
ры «аскорбат + ТМФД» не отличались от кон-
звоночных животных, используемых для экспе-
трольных величин. Изменения физико-химиче-
риментальных и иных научных целей.
ских свойств мембран митохондрий, приводящие
к изменениям в энергетическом метаболизме, от-
разились и на физиологических показателях, а
СПИСОК ЛИТЕРАТУРЫ
именно на устойчивости организма к действию
1. N. L. Tailor, D. A. Day, and A. H. Millar, J. Exp. Bot-
стрессовых факторов. Действительно, введение
any 55 (394), 1 (2003).
2 ⋅ 10-5 М ресвератрола в течение пяти суток в
2. E. Plotnikov, A. Chupyrkina, A. Vasileva, et al., Bio-
1.89-2.70 раза увеличивало продолжительность
chim. Biophys. Acta 1777, S58 (2008).
жизни в условиях цитотоксической и гемической
3. M. P. Murphy, Biochem. Soc. Trans. 32 (6), 1011
гипоксии и в 3.6 раза - в условиях острого алко-
(2004).
гольного отравления. При этом на 15-30% повы-
4. S. Nonomura, H. Kanagawa, and A. Makimoto,
шалась выживаемость мышей в условиях различ-
Yakugaku Zasshi 83, 988 (1963).
ных видов гипоксии и на 12% - в условиях остро-
5. W. Dercks and L. L. Creasy, Physiol. Mol. Plant
Pathol. 34, 203 (1989).
го алкогольного отравления (табл. 2).
6. V. Cucciolla, A. Borriello, A. Oliva, et al., Cell Cycle 6
(20), 2495 (2007). DOI: 10.4161/cc.6.20.4815
7. J. A. Baur and D. A. Sinclair, Nature Rev. Drug Dis-
ВЫВОДЫ
covery 5, 493 (2006).
Основываясь на полученных результатах,
8. S. Saxena and A. Srivastava, J. Pharmaceut. Technol.,
Research and Management
2,
145,
(2014) DOI:
можно прийти к заключению, что адаптогенные
10.15415/jptrm.2014.22010
свойства ресвератрола могут быть обусловлены
9. E. Wenzel and V. Somoza, Mol. Nutrition Food Res. 49
предотвращением перекисного окисления липи-
(5), 472 (2005).
дов в стрессовых условиях. Предупреждение пе-
10. X. Vitrac, A. Desmoulière, B. Brouillaud, et al., Life
роксидации фосфолипидов в мембранах мито-
Sci. 72 (20), 2219 (2003).
хондрий, вероятно, отразилось и на функцио-
11. A. C. Moreira, A. M. Silva, M. S. Santos, and
нальном состоянии этих органелл, способствуя
V. A. Sardão, Food Chem. Toxicol. 53, 18 (2013). DOI:
сохранению энергетического метаболизма клет-
10.1016/j.fct.2012.11.031
ки. Таким образом ресвератрол, вероятно, повы-
12. N. Gueguen, V. Desquiret-Dumas, G. Leman, et al.,
шал устойчивость организма к действию стрессо-
PloS One 10 (12), e0144290 (2015). DOI: 10.1371/jour-
вых факторов.
nal.pone.0144290
БИОФИЗИКА том 66
№ 2
2021
РЕСВЕРАТРОЛ ПРЕДОТВРАЩАЕТ ДИСФУНКЦИЮ МИТОХОНДРИЙ
301
13. V. Desquiret-Dumas, N. Gueguen, G. Leman, et al., J.
22. E. N. Mokhova, V. P. Skulachev, and I. V. Zhigacheva,
Biol. Chem. 288, 6662 (2013).
Biochim. Biophys. Acta 501, 415 (1977).
14. J. Zheng and V. D. Ramirez, Br. J. Pharmacol. 130,
23. B. I. Fletcher, C. D. Dillard, and A. L. Tappel, Anal.
1115 (2000).
Biochem.
52,
1
(1973). DOI:
10.1016/0003-
15. J. L. Kipp and V. D. Ramirez, Endocrine 15, 165
2697(73)90327-811
(2001).
24. J. P. Carreau and J. P. Dubacq, J. Chromatogr. 151 (3),
384 (1979). DOI: 10.1016/S0021-9673(00)88356-9Get
16. M. Inglés, J. Gambini, M. G. Miguel, et al., BioMed
Res. Int. (3), Article ID 580852, 6 (2014).
25. J. Wang, H. Sunwoo, G. Cherian, and I. S. Sim, Poult
Sci. 79 (8), 1168 (2000). DOI: 10.1093/ps/79.8.1168
17. J. A. Rubiolo, G. Mithieux, and F. V. Vega, Eur. J.
Pharmacol. 591 (1-3), 66 (2008).
26. R. V. Golovina and T. E. Kuzmenko, Сhromatography
10 (9), 545 (1977).
18. G.-S. Liu, Z.-S. Zhang, B. Yang, and W. He, Life Sci.
91 (17-18), 872 (2012).
27. Л. Д. Лукьянова, Бюл, эксперим. биологии и меди-
цины 124 (9), 244 (1997).
19. W. Gadacha, M. Ben-Attia, D. Bonnefont-Rousselot,
et al., Redox Rep.
14
(4),
154
(2009) DOI:
28. Е. Г Доркина, Эксперим. клинич. фармакология
10.1179/135100009X46613112
73 (4), 35 (2010).
20. Protection of Vertebrate Animals Used for Experimen-
29. I. Scott and D. C. Logan, New Phytologist 177, 90
tal and other Scientific Purposes (ETS 123), (Stras-
(2008).
burg, 1986).
30. C. C. C. R. de Carvalho and M. J. Caramujo, Mole-
21. Н. Н. Каркищенко и С. В. Грачевой. Руководство
cules
23
(10),
2583
(2018). DOI: 10.3390/mole-
по лабораторным животным и альтернативным мо-
cules23102583
делям в биомедицинских исследованиях (Профиль,
31. J. Petereit, K. Katayama, Ch. Lorenz, et al., Front.
М., 2010).
Plant Sci. 8, 72 (2017). DOI: 10.3389/fpls.2017.00072.
Resveratrol Prevents Stress-Related Dysfunction of Mitochondria
V.I. Binyukov*, I.V. Zhigacheva*, E.M. Mil’*, N.I. Krikunova*, and M.M. Rasulov**
*Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**State Scientific Research Institute of Chemistry and Technology of Organoelement Compounds,
shosse Entuziastov 38, Moscow, 105118 Russia
This study was conducted to investigate the antistress potential of resveratrol, a natural polyphenol, in models
that reproduce the conditions of acute hypobaric hypoxia and acute alcohol intoxication. Acute alcohol in-
toxication and acute hypobaric hypoxia induced an increase in the intensity of lipid peroxidation in the mem-
branes of liver mitochondria from mice. Activation of lipid peroxidation was accompanied by swelling and
variations in the levels of fatty acids with C18 and C20-22n in the composition of the total lipid fraction of mi-
tochondrial membranes. The index of the unsaturation of fatty acids with C18 was decreased by 7.5% (from
1.69 ± 0.01 to 1.52 ± 0.01). Moreover, the index (20:3ω6+20:5ω3)/22:6ω3 was decreased from 0.23 ± 0.02 to
0.13 ± 0.01 for fatty acids under acute hypobaric hypoxia conditions, suggesting a decrease in eicosanoid me-
tabolism. The administration of 2 ⋅ 10-5 mol/kg of resveratrol in animals for five days prevented changes in
fatty acid composition, inhibiting activation of lipid peroxidation and swelling of mitochondria, thereby af-
fecting physiological parameters. Thus, the adaptogenic properties of resveratrol may be ascribed to the pre-
vention of lipid peroxidation in mitochondrial membranes, that probably affect functional state of these or-
ganelles, contributing to the maintenance of cell energy metabolism under stress conditions.
Keywords: adaptogens, mitochondria, lipid peroxidation, hypoxia, acute alcohol intoxication
БИОФИЗИКА том 66
№ 2
2021