БИОФИЗИКА, 2021, том 66, № 2, с. 312-322
БИОФИЗИКА КЛЕТКИ
УДК 577.3
МЕМБРАННАЯ ПРОНИЦАЕМОСТЬ, ВЫЗВАННАЯ ПЕРЕМЕННЫМ
МАГНИТНЫМ ПОЛЕМ, В МАГНИТОЛИПОСОМАХ ЭРИТРОМИЦИНА:
ПОТЕНЦИАЛЬНОЕ РЕШЕНИЕ ПРОБЛЕМЫ УСТОЙЧИВОСТИ
К АНТИБИОТИКАМ
© 2021 г. Б.М. Салах*, М Ради**, М. Абдель-Халим***, Х.М. Фахми****,
Н.С. Эль-Дин*, М.Х. Габер****, *****
*Физический факультет Немецкого университета в Каире, Каир, Египет
**Отдел фармацевтических технологий Немецкого университета в Каире, Каир, Египет
***Отдел фармацевтической химии Немецкого университета в Каире, Каир, Египет
****Факультет науки, Каирский университет, Гиза, Египет
*****Инженерный факультет Британского университета в Египте (BUE), Каир, Египет
E-mail: bassantmoustapha@gmail.com
Поступила в редакцию 11.03.2020 г.
После доработки 11.03.2020 г.
Принята к публикации 13.05.2020 г.
Антибиотикоустойчивость является серьезной проблемой, стоящей перед человечеством и возрас-
тающей с каждым годом из-за чрезмерного или неправильного использования антибиотиков, что
ведет к развитию новых механизмов лекарственной устойчивости бактерий. Для данного исследо-
вания были разработаны магнитолипосомы, нагруженные препаратом эритромицина. Их подвер-
гали воздействию переменного магнитного поля (5 и 15 мТл, 100 кГц) в течение 30 мин, чтобы про-
верить влияние поля на скорость высвобождения лекарственного средства за пределы сопротивля-
емости бактерий. Было показано повышение температуры на 4 и 24°C в случае воздействия на
инкапсулированные эритромицином магнитолипосомы переменным магнитным полем в 5 и
15 мТл соответственно. Кроме того, наблюдалось увеличение количества высвобожденного эритро-
мицина (0.83 ± 0.1 мкг/мл и 1.33 ± 4 мкг/мл при воздействии в 5 и 15 мТл соответственно) по срав-
нению с контролем (0.24 ± 0.06 мкг/мл). Воздействие переменного магнитного поля на инкапсули-
рованный в магнитолипосомы эритромицин ускоряло скорость его высвобождения из-за механи-
стического воздействия на наночастицы. Результаты позволяют предположить, что можно
запускать и контролировать высвобождение лекарств, совмещая целевую систему доставки ле-
карств с нанотехнологиями и магнитным полем. При увеличении интенсивности переменного маг-
нитного поля скорость высвобождения значительно возрастала.
Ключевые слова: переменное магнитное поле, высвобождение лекарств, доставка лекарств, эритроми-
цин, магнитолипосомы.
DOI: 10.31857/S0006302921020125
сочетании с длительным периодом циркуляции.
Употребление лекарства всегда является ком-
Контроль проницаемости липосомной мембраны
промиссом между его терапевтическим эффек-
и избегание, таким образом, нецелевого высво-
том и побочными эффектами. Липосомные
бождения лекарств должны уменьшать негатив-
системы доставки лекарств позволяют не только
ные побочные эффекты свободного движения
доставлять лекарства в более высоких концентра-
молекул лекарств [3].
циях, но и воздействовать на конкретные клетки
Новые липосомы были разработаны для обес-
или органы [1]. Следовательно, использование
печения разумного лечения организма человека
липосом в качестве контролируемой целевой си-
путем высвобождения инкапсулированного со-
стемы доставки лекарств связано с замедленным
держимого в ответ на различные раздражители,
высвобождением капсулированных лекарств [2] в
такие как температура, pH, свет, ультразвук, маг-
нитное поле и так далее [2]. Такие специфические
Сокращения: ПМП - переменное магнитное поле, ПЭМ -
просвечивающая электронная микроскопия, СПЖХ -
стимулы используются в качестве движущей си-
сверхпроизводительная жидкостная хроматография.
лы в механизмах высвобождения лекарств, осно-
312
МЕМБРАННАЯ ПРОНИЦАЕМОСТЬ, ВЫЗВАННАЯ ПЕРЕМЕННЫМ МАГНИТНЫМ ПОЛЕМ
313
ванных на взаимодействии стимулов и липосом
ментировано, что он вызывает желудочно-ки-
[4]. Магнитно-срабатывающий механизм стал од-
шечные проблемы, а также токсичен для печени
ной из наиболее эффективных стратегий в каче-
из-за его нестабильности и химической конвер-
стве стимула высвобождения и точного нацели-
сии в кислых условиях [19, 20]. Пожилые пациен-
вания [5].
ты часто неспособны переносить активность пе-
ристальтики кишечника под воздействием пре-
При уменьшении размеров материалов до на-
парата, тогда как дети считают совершенно
норазмерного диапазона их уникальные и инте-
неприемлемым неприятный вкус. Устойчивость
ресные физические и химические свойства могут
к антибиотикам растет с угрожающей скоростью,
быть улучшены [6], что вдохновляет на универ-
что может быть обусловлено ростом потребления
сальный дизайн и захватывающие разработки
антибиотиков [21]. Для устранения устойчивости
традиционных и новых наноразмерных материа-
к антибиотикам были разработаны некоторые
лов для биомедицинских применений [7, 8]. Один
подходы, такие как разработка новых соедине-
из таких примеров - наночастицы оксида железа.
ний, ингибирование их устойчивости к фермен-
Поскольку как липосомы, так и наночастицы ок-
там. Нанотехнологии могут играть важную роль в
сида железа одобрены Управлением по санитар-
предотвращении устойчивости к антибиотикам
ному надзору за качеством пищевых продуктов и
путем избегания эффлюксных насосов и с помо-
медикаментов США (FDA - Food and Drug Ad-
щью некоторых других механизмов [22, 23]. Маг-
ministration), их комбинация может применяться
нитолипосомы, содержащие эритромицин, могут
в медицинских целях [9, 10]. Помимо адресной
быть потенциальной системой наноносителей,
доставки самих липосом, контролируемое высво-
которая может служить возможным решением
бождение лекарств из липосом является еще од-
для преодоления устойчивости к антибиотикам.
ним важным предметом изучения для их терапев-
тического применения [11, 12].
Расширенную регуляцию активности высво-
бождения липосомного лекарственного средства
Контроль профиля высвобождения лекарств
можно получить с помощью переменного маг-
является одним из достижений систем доставки
нитного поля (ПМП) [24]. ПМП может быть сти-
лекарств [2, 13]. Система доставки с участием маг-
мулом для запуска высвобождения лекарственно-
нитных наночастиц может помочь контролиро-
го средства из магнитолипосомы [12, 25]. Кроме
вать способность высвобождения лекарств в ли-
того, электромагнитное поле при дистанционном
посомах [14], которые имеют различную структу-
срабатывании наночастиц улучшает проницае-
ру, в первую очередь, определяемую структурой
мость фосфолипидной мембраны [25]. Авторы
липидного бислоя или мембраной, которая окру-
работы [26] использовали DOX-инкапсулирован-
жает водный объем [15]. Варьирование структуры
ные магнитолипосомы и подвергали их воздей-
мембраны может создать огромное количество
ствию высокочастотного ПМП (≈1 МГц). Выде-
липосом с различными характеристиками и при-
ленное тепло привело к высвобождению препа-
менениями [15].
рата из магнитолипосом [18, 26, 27]. В то же время
Многие препараты подобного типа действия
в работе [28] авторы продемонстрировали уси-
имеют серьезные побочные эффекты и токсич-
ленное высвобождение декстрана путем приме-
ность, либо обладают очень высокой антимик-
нения низкочастотного ПМП к магнитным кол-
робной активностью, но слабой фармакокинети-
лагеновым нанокомпозитам. Авторы работы [11]
кой и фармакодинамикой, которые ограничива-
продемонстрировали, что воздействие ПМП не-
ют их использование. Инкапсуляция в липосоме
инвазивно ведет к нагреву внедренных наноча-
улучшает доставку лекарственного средства к ме-
стиц оксида железа и вызывает высвобождение
сту высвобождения [16-18].
лекарственного средства из термочувствительных
Эритромицин, использованный в настоящем
липосом у крыс.
исследовании, являлся модельным относительно
Цель настоящей работы состоит в том, чтобы
гидрофобным препаратом, он представляет со-
исследовать роль ПМП в инициировании дей-
бой антибиотик, который ингибирует синтез не-
ствия наночастиц для ускорения высвобождения
заменимых белков в восприимчивых бактериях и
лекарственного средства из компартмента нано-
используется при лечении инфекций горла, пнев-
везикул, а также сравнить результаты воздей-
монии, в дополнение к лечению широкого спек-
ствия на магнитолипосомы ПМП одинаковой ча-
тра бактериальных инфекций. Среди болезне-
стоты, но различной низкой интенсивности.
творных агентов, чувствительных к эритромици-
ну,
- Staphylococcus aureus, многие виды
Streptococcus, виды Mycoplasma, Legionella pneu-
МЕТОДЫ
mophila (бактерия, вызывающая болезнь легионе-
ров) и Corynebacterium diphtheriae (возбудитель
Приготовление магнитных наночастиц (Fe3O4).
дифтерии). Как правило, эритромицин обладает
Магнитные наночастицы были синтезированы
низкой цитотоксичностью, однако было задоку-
путем щелочного соосаждения с использованием
БИОФИЗИКА том 66
№ 2
2021
314
САЛАХ и др.
Рис. 1. Система воздействия переменным магнитным полем.
метода, описанного в работе [29]. Раствор, содер-
магнитными наночастицами, процедура была той
же самой, что и выше, за исключением того, что
жащий 0.07 моль/л Fe2+ и 0.14 моль/л Fe3+, меха-
магнитные наночастицы, диспергированные в
нически перемешивали (1000 об/мин) и нагрева-
дистиллированной воде, добавляли к этанольно-
ли до 80°С, затем добавляли к 50 мл NH4OH и
му раствору фосфатидилхолина, эмульгатора и
раствор перемешивали в течение 40 мин. После
эритромицина. Полученные нановезикулы обра-
этого раствор оставляли для охлаждения при тем-
батывали ультразвуком в ультразвуковой ванне с
пературе окружающей среды. Затем магнитные
водяными банями в течение 30 мин [31].
частицы отделяли центрифугированием при
6000 об/мин. После промывали дистиллирован-
Исследование приготовленных композиций.
Определение распределения по размерам. Размер
ной водой с последующей обработкой ультразву-
приготовленных композиций анализировали ме-
ком на ультразвуковой водяной бане в течение
тодом динамического рассеяния света с исполь-
30 мин.
зованием Zeta Sizer Nano ZS (Malvern Instruments
Получение инкапсулированных эритромицином
ZS, Великобритания).
липосом и инкапсулированных эритромицином маг-
Просвечивающая электронная микроскопия ли-
нитолипосом холодным методом. Этосомы были
посом (ПЭМ). Для определения формы синтези-
получены в соответствии с методом, предложен-
ным в работе [30], с простыми модификациями.
рованных липосом использовали просвечиваю-
Фосфатидилхолин (ФХ) (80 мг) из соевых бобов,
щий электронный микроскоп Jeol-2100 (Jeol,
10 мг эмульгатора (Цетеарет-25) и 10 мг эритро-
Япония).
мицина растворяли в этаноле (20% по объему) и
Эффективность захвата. Инкапсулированную
нагревали до 30 ± 1°С в закрытом сосуде на водя-
эритромицином липосому и инкапсулированную
ной бане. Дистиллированную воду, предвари-
эритромицином магнитолипосому центрифуги-
тельно нагретую до 30 ± 1°C, медленно добавляли
ровали при 15889 g, 4°С в течение 90 мин и отде-
тонкой струей к вышеуказанному раствору липи-
ляли надосадочную жидкость. Абсорбцию цен-
да в этаноле при непрерывном перемешивании с
трифугата измеряли методом жидкостной хрома-
использованием магнитной мешалки при
тографии с масс-спектроскопией. Следующее
700 об/мин в течение 30 мин, затем хранили при
уравнение было использовано для расчета эф-
4°C. Что касается нановезикул эритромицина с
фективности инкапсуляции.
Всe лекарство - Свободное лекарство
EE%=
×100.
Всe лекарство
Система воздействия переменным магнитным
L = 0.35 мГн), которая была подключена к гене-
полем. Как показано на рис. 1, система воздей-
ратору сигналов DDS-частотного генератора се-
ствия переменным магнитным полем состояла из
рии MHS-5200A и усилителю мощности NEVA
круглой магнитной катушки (N = 200, r = 3 см,
Dr. Vatter Gmbh & Co. Тип 7220 № 384. Сенсоры
БИОФИЗИКА том 66
№ 2
2021
МЕМБРАННАЯ ПРОНИЦАЕМОСТЬ, ВЫЗВАННАЯ ПЕРЕМЕННЫМ МАГНИТНЫМ ПОЛЕМ
315
Cassy, тесламетр и инфракрасный термометр бы-
ем дифенгидрамина в качестве внутреннего эта-
ли использованы для оценки напряженности
лона. Анализы были получены на системе Waters
магнитного поля и температуры соответственно.
ACQUITY Xevo TQD, которая состояла из хрома-
тографической системы ACQUITY UPLC H-Class
Температурные эксперименты. Частотный гене-
и трехквадрупольного масс-спектрометра Xe-
ратор был установлен на 100 кГц в течение
voTQD с интерфейсом электрораспылительной
10 мин, чтобы подтвердить стабильность магнит-
ионизации (ESI) (Waters Corp., Milford, США).
ного поля, генерируемого в катушке. Затем кюве-
Для разделения аналитов использовали колонку
ту объемом 1.5 мл, заполненную инкапсулиро-
Aquity UPLC BEH C18 50 × 2.1 мм (размер частиц
ванными эритромицином магнитолипосомами,
1.7 мкм) (Waters, Wexford, Ирландия). Работу си-
помещали в центр катушки, которая генерирует
стемы и сбор данных контролировали с помощью
ПМП. Кювету изолировали пенопластовой обо-
программного обеспечения MassLynx 4.1 (Waters,
лочкой, чтобы не было прямого контакта с прово-
Milford, США). Все данные были обработаны с
дами катушки. Это необходимо для того, чтобы
помощью программы количественной оценки
убедиться, что повышение температуры в образ-
TargetLynx (Waters, Milford, США). Градиентное
цах происходит из-за магнитной энергии, переда-
элюирование при скорости потока 0.2 мл/мин
ваемой ПМП магнитолипосоме, а не из-за прово-
проводили для хроматографического разделения
димости от теплового внутреннего сопротивле-
с использованием 0.1% муравьиной кислоты в во-
ния проводов катушки или любых других
де (А) и 0.1% муравьиной кислоты в ацетонитриле
изменений температуры окружающей среды. По-
(Б). Градиент работал следующим образом:
вышение температуры непрерывно контролиро-
0 мин, 95% A, 5% Б; 1.0 мин, 5% А, 95% Б; 3 мин,
вали в течение 30 мин с использованием инфра-
5% А, 95% Б; 4 мин, 95% А, 5% Б; 6 мин, 95% A,
красного термометра, расположенного точно над
5% Б. Объем инъекции составлял 10 мкл, выпол-
кюветой. Температуру регистрировали каждую
ненный путем частичной инъекции в петлю с ис-
минуту. Каждый эксперимент проводили три-
пользованием переполнения иглы в качестве
жды, представленные данные представляют со-
техники инъекции. Температура колонки была
бой среднее значение ± стандартное отклонение.
установлена на 40°С. В качестве газа для десольва-
In vitro исследование высвобождения инкапсу-
тации и для конуса использовали азот при скоро-
лированной эритромицином липосомы и инкапсули-
сти потока 800 и 1000 мл/ч соответственно. Аргон
рованной эритромицином магнитолипосомы до и
использовали в качестве «collision gas» при давле-
после воздействия переменного магнитного поля.
нии приблизительно 3.67 ⋅ 10-3 мбар. Оптималь-
Наносуспензию с магнитными наночастицами
ные параметры МС были следующими: капилляр-
(0.5 мл) помещали в диализный мешок (MWCO:
ное напряжение 3.9 кВ, радиочастотное напряже-
12000-14000), наполненный дополнительно 5 мл
ние линзы 2.5 В, температура источника 150°C и
фосфатно-солевого буфера, pH 7.4. Был взят 1 мл
температура десольватационного газа 300°C. На-
образцов. Образцы анализировали на эритроми-
пряжение на конусе составляло 23 и 38 В для
цин методом ЖХ/МС [1]. Для каждого испыта-
эритромицина и дифенгидрамина соответствен-
ния были подготовлены два набора образцов и
но. Резервный источник энергии работал в поло-
подвергнуты воздействию ПМП с частотой
жительном режиме. Количественную оценку
100 кГц, но с различной интенсивностью - 5 и
проводили с использованием множественного
15 мТл соответственно, в течение получаса, затем
мониторинга реакций переходов m/z 734.55 >
проводили исследования высвобождения in vitro.
> 158.15 с энергией столкновения 32 В для эрит-
Были созданы две группы инкапсулированных
ромицина и m/z 256.14 > 167.04 с энергией столк-
эритромицином магнитолипосом: группа А, ко-
новения 10 В для дифенгидрамина соответствен-
торая была контрольной группой, не подвергав-
но. Время задержки автоматически устанавлива-
шейся воздействию ПМП, и группа B, подвергав-
лось программным обеспечением MassLynx 4.1.
шаяся воздействию 5 мТл ПМП в течение 30 мин.
Приготовление образцов серийного разведения
Приблизительно 1 мл каждого образца липо-
эритромицина. Для калибровки готовили исход-
сом отбирали через определенные интервалы
ный раствор с концентрацией 1 мг/мл эритроми-
времени в 1, 2, 3, 4, 5, 6, 7, 8 и 24 ч и заменяли рав-
цина в метаноле и разбавляли центрифугатом чи-
ными объемами свежего фосфатно-солевого бу-
стых липосом/магнитолипосом или фосфатно-
фера буфера. Одновременно были созданы две
солевым буфером для получения рабочих раство-
другие группы инкапсулированных эритромици-
ров с концентрацией 0.1, 0.3, 0.7, 2, 5 и 10 мкг/мл.
ном магнитолипосом для воздействия ПМП
Готовили исходный раствор (1 мг/мл) дифенгид-
15 мТ с той же частотой.
рамина (внутренний эталон) в метаноле, затем
Условия эксперимента с применением сверхпро-
разбавляли до 1 мкг/мл. Образцы калибровочной
изводительной
жидкостной хроматографии
кривой готовили путем добавления
100 мкл
(СПЖХ-МС/МС). СПЖХ-МС/МС для опреде-
1 мкг/мл внутреннего эталона к 1 мл раствора
ления эритромицина проводили с использовани-
эритромицина в каждом из разведений. Образцы
БИОФИЗИКА том 66
№ 2
2021
316
САЛАХ и др.
Рис. 2. ПЭМ-изображения липосом (а), магнитолипосом (б), липосом после обработки ПМП (в) и магнитолипосом
после обработки ПМП (г).
калибровочной кривой фильтровали с использо-
РЕЗУЛЬТАТЫ
ванием мембранных фильтров 0.22 мкм (Waters,
Исследование приготовленных композиций.
США) и анализировали с использованием опи-
Средний размер приготовленных композиций липо-
санного выше метода СПЖХ-МС/МС.
сом. Рассчитанный средний размер частиц раз-
личных композиций составлял 254 ± 10 нм для
Проверка метода. Впервые предложенный ме-
липосом, инкапсулированных эритромицином, и
тод СПЖХ-МС/МС был утвержден в соответ-
473 ± 40 нм для магнитолипосом, инкапсулиро-
ствии с руководящими принципами ICH в следу-
ванных эритромицином. Распределение индекса
ющем контексте: специфичность, линейность,
полидисперсности составляло 0.35 и 0.32 для ин-
порог чувствительности, предел количественного
капсулированных эритромицином липосом и ин-
определения, воспроизводимость (в разные дни и
капсулированных эритромицином магнитолипо-
сом соответственно.
внутрисуточная) и достоверность.
Зета-потенциал. Было установлено, что средний
Порог чувствительности был определен как
зета-потенциал для инкапсулированных эритроми-
концентрация образца, дающая ответ, в три раза
цином липосом составляет 47.9 ± 0.35 мВ, тогда как
превышающий базовый шум. Предел количе-
для инкапсулированных эритромицином магнито-
ственного определения рассчитывали, как кон-
липосом он составляет 47.5 ± 0.85 мВ.
центрацию образца, дающего сигнал, в десять раз
Эффективность захвата. Эффективность загруз-
превышающий базовый шум. Воспроизводи-
ки лекарственного средства составляла 87.9 + 2.2%
мость в течение суток определяли в течение одних
для инкапсулированной эритромицином липосомы
суток путем анализа трех образцов калибровоч-
и 97.8 + 1.5% для инкапсулированной эритромици-
ной кривой. Межсуточную воспроизводимость
ном магнитолипосомы, что указывает на высокую
эффективность инкапсуляции лекарственного
определяли в течение трех суток подряд при оди-
средства.
наковых концентрациях. Достоверность опреде-
ляли путем введения четырех различных концен-
Подтверждение влияния переменного магнитно-
го поля морфологически. Изменение морфологии
траций, которые не использовались при построе-
простых липосом и магнитолипосом наблюда-
нии калибровочной кривой (образцы для
лось на изображениях, полученных с помощью
контроля качества: 0.2, 0.5, 1, 3 мкг/мл), точность
ПЭМ, с размером частиц 111.21 нм и 114.67 нм со-
метода определяли как абсолютное значение от-
ответственно (показаны на рис. 2, по одной ча-
ношения среднего от найденных значений образ-
стице в поле зрения). Таким образом, подтвер-
цов калибровочной кривой к их теоретическим
ждается успешное приготовления липосом и маг-
значениям, выраженные в процентах. Критерии
нитолипосом, захват магнитных наночастиц и
приемлемости данных включали точность в пре-
разрыв композитов после обработки ПМП.
делах ±15% и точность в пределах ±15% отклоне-
Температурные результаты. Магнитолипосо-
ния (85-115%) от номинального.
мы, подвергшиеся воздействию ПМП 5 мТл при
БИОФИЗИКА том 66
№ 2
2021
МЕМБРАННАЯ ПРОНИЦАЕМОСТЬ, ВЫЗВАННАЯ ПЕРЕМЕННЫМ МАГНИТНЫМ ПОЛЕМ
317
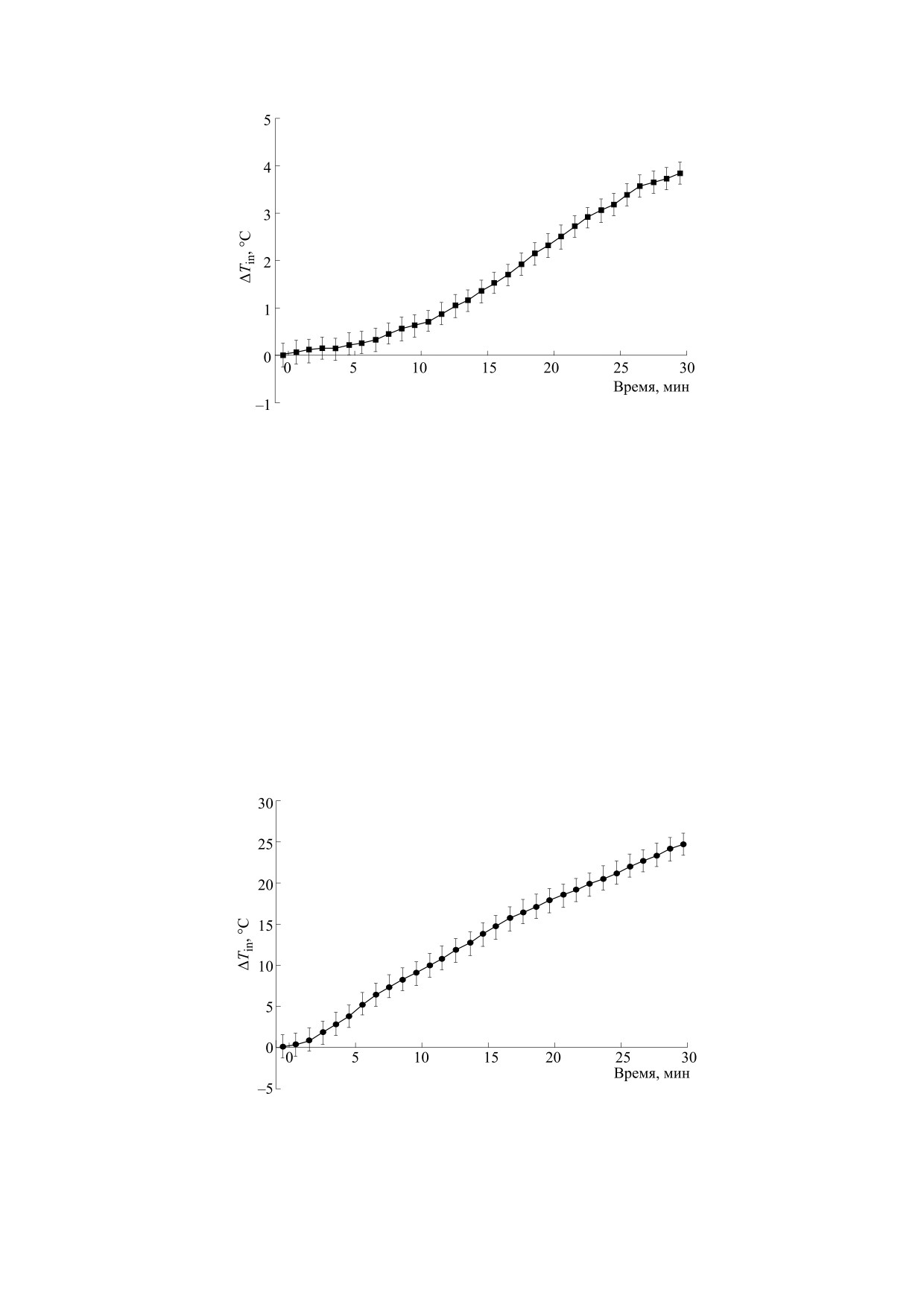
Рис. 3. Повышение разницы в температуре магнитолипосомы при увеличении продолжительности воздействия
переменного магнитного поля при 100 кГц, 5.6 мТл.
100 кГц в течение получасового времени воздей-
m/z 256.14 > 167.04 с энергией столкновения 10 В
ствия, демонстрировали повышение температу-
для дифенгидрамина, как показано на рис. 6 со-
ры с 23 до 27°C (почти 4°C) (рис. 3). Для воздей-
ответственно.
ствия ПМП 15 мТл повышение температуры - с
30 до 55°С (почти 24°С) (рис. 4).
Предложенный метод СПЖХ-МС/МС был
подтвержден с точки зрения линейности, специ-
Результаты высвобождения препарата in vitro.
фичности, порога чувствительности, предела ко-
Измерения эритромицина с помощью метода
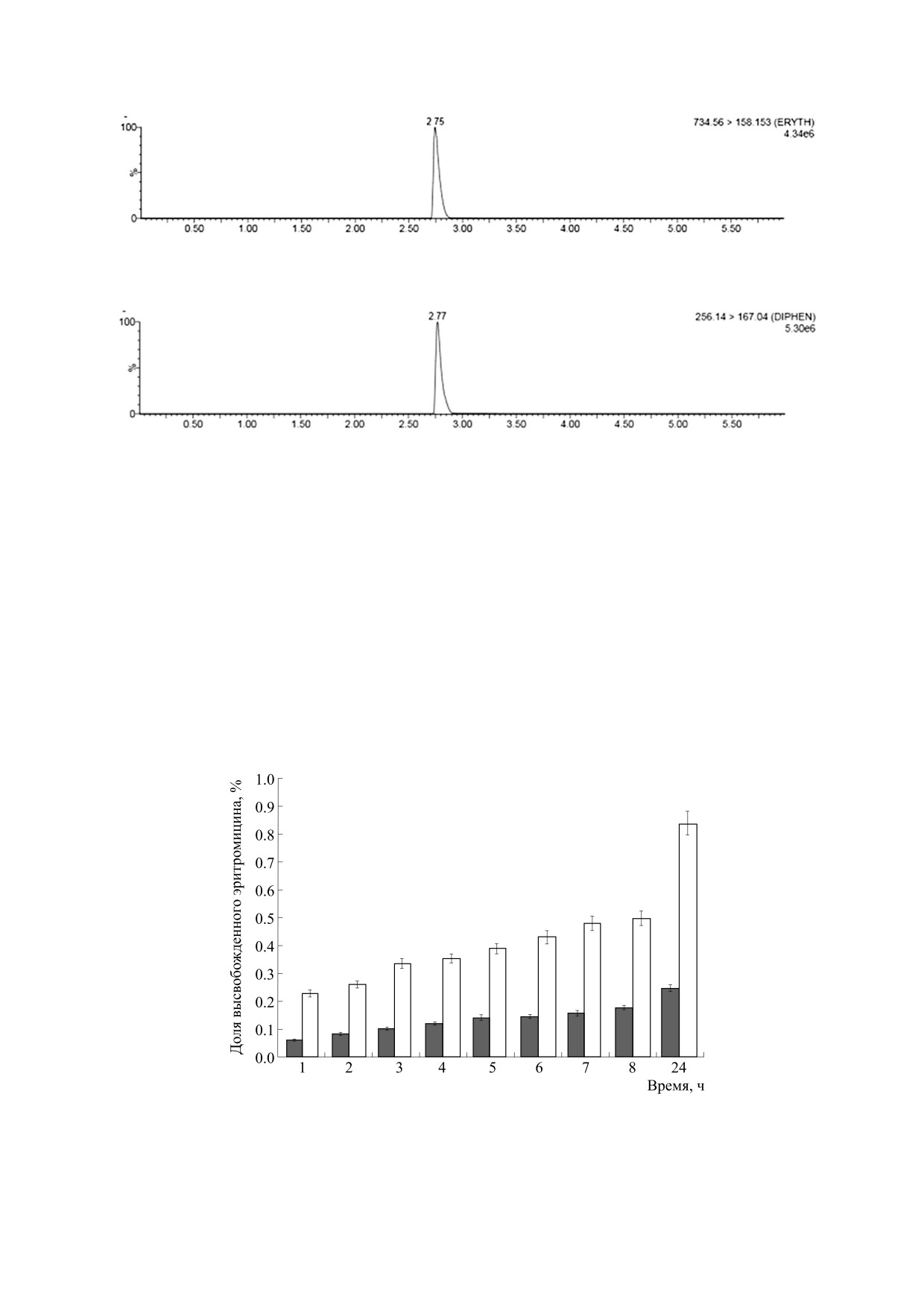
личественного определения, воспроизводимости
СПЖХ-МС/МС. Впервые разработанный метод
(однодневной и многодневной) и достоверности.
СПЖХ-МС/МС определения эритромицина был
Отклик каждого образца калибровочной
выполнен с использованием дифенгидрамина в
кривой (у) наносили на график в зависимости от
качестве внутреннего эталона. Количественное
его концентрации (х). Получено уравнение ли-
определение было выполнено с использованием
мониторинга множественных реакций переходов
нейной корреляции у = 1.204х - 0.021 с R2 = 0.994.
m/z 734.55 > 158.15 с энергией столкновения 32 В
Обнаружено, что порог чувствительности состав-
для эритромицина, как показано на рис. 5, и
ляет 0.5 нг/мл, а предел количественного опреде-
Рис. 4. Повышение разницы в температуре магнитолипосомы за счет увеличения продолжительности воздействия
переменного магнитного поля при 100 кГц, 15 мТл.
БИОФИЗИКА том 66
№ 2
2021
318
САЛАХ и др.
Рис. 5. СПЖХ-МС/МС-хроматограмма эритромицина в режиме множественного мониторинга реакций.
Рис. 6. СПЖХ-МС/МС-хроматограмма дифенгидрамина в режиме множественного мониторинга реакций.
ления - 1.6 нг/мл. Суточная повторяемость, оце-
шению к 0.24 ± 0.06 мкг/мл в контрольной группе
ниваемая как % КП, варьировала от 0.90 до 4.71%,
через 24 ч после воздействия (рис. 7). В то же время
тогда как для межсуточной воспроизводимости %
у магнитолипосом, подвергшихся воздействию
КП варьировал от 0.55% до 4.94%. Для оценки
ПМП 15 мТл, эритромицин высвобождался с содер-
точности были подготовлены четыре образца
жанием (1.33 ± 0.04) ⋅ 10-7 мкг/мл по отношению к
контроля качества, и измеренный с этой целью
0.24 ± 0.06 мкг/мл в контрольной группе через 24 ч
процент выхода составлял от 92 до 101%.
после воздействия (рис. 8).
Выход препарата in vitro после воздействия пере-
менного магнитного поля с различной интенсивно-
ОБСУЖДЕНИЕ
стью. Магнитолипосомы, подвергшиеся воздей-
ствию ПМП 5 мТл, 100 кГц в течение получасового
Магнитолипосомы тщательно оценивались с
времени воздействия, продемонстрировали высво-
точки зрения контролируемого высвобождения
бождение эритромицина 0.83 ± 0.1 мкг/мл по отно-
лекарств. Движение магнитных наночастиц
Рис. 7. Разница в высвобождении лекарственного средства из не подвергавшихся воздействию (темные столбики) и
экспонированных в 5 мТл ПМП магнитолипосом (светлые столбики) в различные интервалы времени.
БИОФИЗИКА том 66
№ 2
2021
МЕМБРАННАЯ ПРОНИЦАЕМОСТЬ, ВЫЗВАННАЯ ПЕРЕМЕННЫМ МАГНИТНЫМ ПОЛЕМ
319
Рис. 8. Разница в высвобождении лекарственного средства из не подвергавшихся воздействию (темные столбики) и
подвергавшихся воздействию 15 мТл магнитолипосом (светлые столбики) в течение 8 ч, а также через 24 ч.
вследствие воздействия магнитного поля доста-
перименты по высвобождению эритромицина
точной интенсивности и частоты действует как
при наличии и отсутствии магнитного поля при
основной триггер для высвобождения лекарств
комнатной температуре из магнитолипосом, за-
[3, 32]. Описанный здесь эффект проницаемости
груженных пассивно и дистанционно.
свидетельствует о том, что изменения в мембра-
Повышение температуры непрерывно отсле-
нах магнитолипосом могут быть вызваны воздей-
живалось каждую минуту в течение 30 мин. По-
ствием относительно слабых магнитных полей
вышение температуры почти на 4°С указывает на
при температурах, близких или равных Tc.
процесс прироста тепла (рис. 7). Способность
магнитных наночастиц нагреваться зависит от ха-
Наши ранние результаты показывают, что для
рактеристик магнитных частиц, таких как раз-
изменения проницаемости бислоя достаточно на
мер, намагниченность насыщения, когда выделя-
поверхность липидной мембраны приложить си-
ется тепло в результате потери гистерезиса, бро-
нусоидальное магнитное поле 100 кГц (пик в
уновской релаксации или релаксации по Нелю на
5 мТл). ПЭМ-изображения также показали, что
основе размера частиц и частоты ПМП [12, 25].
воздействие магнитного поля привело к измене-
ниям в целостности поверхности липосом и даже
Высвобождение отслеживалось в предположе-
к фрагментации мембраны, что доказывает за-
нии о полном механическом разрыве магнитоли-
метное влияние ПМП на систему высвобождения
посом, который также визуализировали с помо-
лекарственного средства в присутствии магнит-
щью ПЭМ. Эритромицин высвобождался в коли-
ных наночастиц.
честве
0.83
± 0.1 мкг/мл по отношению к
0.24 ± 0.06 мкг/мл в контрольной группе через
Магнитолипосомы были исследованы в каче-
24 ч после воздействия. Это существенное высво-
стве возможных носителей для систем доставки
бождение эритромицина из магнитных везикул,
лекарств, зависящих от магнитного поля. Магни-
подверженных воздействию поля, по сравнению
толипосомы формировались из суперпарамаг-
с неэкспонированными, происходит из-за воз-
нитных гидрофобных наночастиц на основе ок-
действия механического воздействия и тепла, вы-
сида железа, заключенных в двухслойную липид-
деляемого липидным бислоем. Использование
ную мембрану этих везикул
[33,
34]. Наши
поля с частотой 100 кГц вызывает вращение и
эксперименты с применением атомно-силовой
вибрацию частиц оксида железа, которые созда-
микроскопии показали, что присутствие гидро-
ют механические силы, вызывающие деформа-
фобных наночастиц, встроенных в липидную
цию в фосфолипидной мембране липосомы.
мембрану, приводит к общему усилению жестко-
Основная тенденция, которая вытекает из на-
сти и увеличению морфологической неоднород-
ности, что должно способствовать механическо-
ших данных, говорит о том, что в наших экспери-
му разрыву магнитолипосом во внешнем пере-
ментальных условиях при воздействии 5 мТл вы-
менном магнитном поле низкой интенсивности.
свобождение лекарственного средства происхо-
Чтобы подтвердить этот вывод, мы провели экс-
дит через разрыв магнитолипосом, вызванный
БИОФИЗИКА том 66
№ 2
2021
320
САЛАХ и др.
Рис. 9. Сравнение высвобождения эритромицина из магнитолипосом, подвергавшихся воздействию 5 и 15 мТл ПМП
в течение 8 ч, а также через 24 ч.
механической вибрацией магнитных наночастиц,
бождение нагрузки из магнитолипосом под дей-
а не через локальный нагрев магнитной наноча-
ствием ПМП было обусловлено контролируемым
стицы. Таким образом происходит активация
механическим приведением в действие магнит-
мембранной проницаемости, как наблюдали ав-
ных наночастиц с помощью ненагревающего маг-
торы работы [35].
нитного поля, что дает возможность преодолеть
Чтобы подтвердить влияние ПМП на контро-
недостаток включения нагрева (рис. 7, 8) и пока-
лируемое высвобождение лекарственного сред-
зывает заметную разницу в высвобождении эрит-
ства из магнитолипосом, высвобождение инкап-
ромицина из магнитолипосом до и после воздей-
сулированного эритромицина осуществляли в
ствия ПМП с различными частотами (5 и 15 мТл).
различных условиях путем увеличения напря-
Результаты показали увеличение процента вы-
женности магнитного поля до 15 мТл, где повы-
свобождения лекарственного средства при увели-
шение температуры непрерывно контролировали
чении напряженности магнитного поля с 5 до
ежеминутно до 30 мин. Эритромицин высвобож-
15 мТл (рис. 9). Эта низкая интенсивность поля
на частоте 100 кГц вызывает вращение и вибра-
дался с содержанием (1.33 ± 0.04) ⋅ 10-7 мкг/мл по
цию частиц оксида железа, которые создают ме-
отношению к 0.24 ± 0.06 мкг/мл в контрольной
ханические силы, которые вызывают деформа-
группе через 24 ч после воздействия. Это повыше-
цию в фосфолипидной мембране липосомы.
ние температуры на почти 24°C (рис. 8) сопро-
вождало процесс получения тепла, указывая на
В общем увеличение высвобождения лекар-
то, что поглощение энергии электромагнитного
ственного средства из липосомы возникает в ре-
поля может привести к новой конфигурации фос-
зультате применения ПМП, вызывающего меха-
фолипида, что, в свою очередь, может привести
нические силы, которые приводят к большему
к изменениям проницаемости липидной мем-
высвобождению лекарственного средства без раз-
браны.
рыва фосфолипидной структуры липосомы. Кро-
Сравнение данных по высвобождению эрит-
ме того, преимущество эффекта нагревания воз-
ромицина при воздействии 5 и 15 мТл при одной
никает в результате релаксации Нееля колеблю-
и той же частоте подчеркивает прямо пропорцио-
щихся магнитолипосом, которые локализуют
нальную взаимосвязь между магнитной энерги-
эффект нагревания в липосоме, не вызывая на-
ей, передаваемой магнитолипосомам перемен-
гревания окружающей среды. Дополнительным
ным генерируемым электромагнитным полем, и
преимуществом использования магнитолипосо-
проницаемостью мембраны.
мы является возможность отслеживать ее внутри
Таким образом, свойства триггерного высво-
человеческого тела до желаемого места высво-
бождения ПМП продемонстрировали, что высво-
бождения, что гарантирует максимальную полу-
БИОФИЗИКА том 66
№ 2
2021
МЕМБРАННАЯ ПРОНИЦАЕМОСТЬ, ВЫЗВАННАЯ ПЕРЕМЕННЫМ МАГНИТНЫМ ПОЛЕМ
321
ченную дозу. Несмотря на то что необходимы до-
15. A. Laouini, C. Jaafar-Maalej, I. Limayem-Blouza,
полнительные исследования, чтобы прояснить
et al., J. Colloid Sci. Biotechnol. 1 (2), 147 (2012).
DOI: 10.1166/jcsb.2012.1020
процесс высвобождения и применения магнито-
липосом in vivo, гидрофобные МНЧ в мембране
16. S. Nappini, S. Fogli, B. Castroflorio, et al., J. Mater.
обеспечивают эффективный подход для реализа-
Chem. B 4, 716 (2016).
ции инициируемого высвобождения груза из ли-
17. Y. I. Golovin, S. L. Gribanovsky, D. Y. Golovin, et al.,
посом в контролируемом объеме и месте.
J. Control. Release 219, 43 (2015).
В дальнейшем запланированы работы по кон-
тролю количества лекарственного средства, вы-
18. W. Zhan and C. H. Wang, J. Control. Release 285, 212
пущенного с использованием различных частот-
(2018). doi: 10.1016/j.jconrel.2018.07.006
ных диапазонов магнитного поля при безопасной
19. T. Hirsch, F. Jacobsen, H.-U. Steinau, and L. Stein-
для биологических систем напряженности.
straesser, Prot. Peptide Lett. 15 (3), 238 (2008).
20. L. S. Tavares, M. D. O. Santos, L. F. Viccini, et al.,
КОНФЛИКТ ИНТЕРЕСОВ
Peptides 29 (10), 1842 (2008).
Авторы заявляют об отсутствии конфликта
21. S. B. Zaman, M. A. Hussain, R. Nye, et al., Cureus 9
интересов.
(6), e1403 (2017).
22. U. Shimanovich and A. Gedanken, J. Mater. Chem. B
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
4 (5), 824 (2016).
Настоящая работа не содержит описания ис-
23. A. Gupta, S. Mumtaz, C.-H. Li, et al., Chem. Soc.
следований с использованием людей и животных
Rev. 48 (2), 415 (2019).
в качестве объектов.
24. D. Belc, C. Chen, R. Roberts, et al., In Proc. NSTI
Nanotechnology Conf. and Trade Show - NSTI Nano-
СПИСОК ЛИТЕРАТУРЫ
tech 2005 (2005), pp. 23-26.
1. A. Hardiansyah, L.-Y. Huang, M.-Ch. Yang, et al., Na-
noscale Rese. Lett. 9, 497 (2014).
25. R. Spera, F. Apollonio, M. Liberti, et al., Colloids Surf.
B Biointerfaces 131, 136 (2015).
2. P. R. Kulkarni, J. D. Yadav, and K. A. Vaidya, Int. J.
Curr. Pharm. Res. 3, 10 (2011).
26. M. Babincová, P. Čičmanec, V. Altanerová, Bioelec-
3. R. P. Liburdy and T. S. Tenforde, Rad. Res.108, 102
trochemistry 55 (1-2), 17 (2002). DOI: 10.1016/S1567-
(1986)
5394(01)00171-2
4. Y. Wang and D. S. Kohane, Nature Rev. Materials 2,
27. A. Joniec, S. Sek, and P. Krysinski, Chemistry - Eur.
17020 (2017). DOI: 10.1038/natrevmats.2017.20
J.
22
(49),
17715
(2016).
DOI:
10.1002/
5. A. Akbarzadeh, M. Samiei, and S. Davaran, Nanoscale
chem.201602809
Res. Lett. 7, 144 (2012).
28. V. M. De Paoli, S. H. Lacerda De Paoli, L. Spinu,
6. S. Laurent, D. Forge, M. Port, et al., Chem. Rev. 110
et al., Langmuir 22, 5894 (2006).
(4), 2574 (2010). DOI.10.1021/cr900197g
7. Ch. Tapeinos, in Smart Nanoparticles for Biomedicine
29. N. C. C. Lobato, Â. de Mello Ferreira, and M. B. Man-
(Elsevier, 2018), pp. 131-142. DOI: 10.1016/B978-0-
sur, Separat. Purif. Technol. 168, 93 (2016).
12-814156-4.00009-4
30. E. Touitou, L. Bergelson, B. Godin, and M. Eliaz, J.
8. S. L. Pal, U. Jana, P. K. Manna, et al., J. Appl. Phar-
Control. Release 65, 403 (2000).
maceut. Sci. 1 (6), 228 (2011).
9. T. Neuberger, B. Schopf, H. Hofmann, et al., J. of
31. M. Rady, I. Gomaa, N. Afifi, and M. Abdel-Kader, Int.
Magnetism and Magnet. Mater. 293, 483 (2005).
J. Pharmaceut. 548 (1), 480 (2018).
10. J. Estelrich, E. Escribano, J. Queralt, and M. A. Bus-
32. G. Podaru, R. Dani, H. Wang, et al., J. Phys. Chem. B
quets, Int. J. Mol. Sci. 16 (4), 8070 (2015). DOI:
118 (40), 11715 (2014). doi: 10.1021/jp5022278
10.3390/ijms16048070
33. C. A. Monnier, D. Burnand, B. Rothen-Rutishauser,
11. L. A. Tai, P. J. Tsai, Y. C. Wang, et al., Nanotechnology
et al., Eur. J. Nanomedicine 6 (4), 201 (2014). DOI:
20 (13) (2009). DOI: 10.1088/0957-4484/20/13/135101
10.1515/ejnm-2014-0042
12. D. Qiu, and X. An, Colloids Surfaces B: Biointerfaces
104, 326 (2013). DOI: 10.1016/j.colsurfb.2012.11.033
34. A. R. O. Rodrigues, B. G. Almeida, J. M. Rodrigues,
13. R. I. Blumenthal, J. Nanomed. Biotherapeutic Discov.
et al., RSC Advances 7 (25), 15352 (2017). DOI:
4
(3),
1000130
(2014).
DOI:
10.4172/2155-
10.1039/c7ra00447h
983x.1000130
35. K. Y. Vlasova, A. Piroyan, I. M. Le-Deygen, et al., J.
14. S. Nappini, M. Bonini, F. Ridi, and P. Baglioni, Soft
Colloid Interface Sci.
552,
689
(2019). DOI:
Matter 7 (10), 4801 (2011). DOI: 10.1039/c0sm01264e
10.1016/j.jcis.2019.05.071.
БИОФИЗИКА том 66
№ 2
2021
322
САЛАХ и др.
Alternating Magnetic Field-Induced Membrane Permeability in Erythromycin
Magnetoliposomes: a Potential Solution to Antibiotic Resistance
Bassant M. Salah*, Mai Rady**, Mohammad Abdel-Halim***, Heba M. Fahmy****,
Nermeen S. El-Din*, and Mohamed H. Gaber****, *****
*Physics Department, German University in Cairo, Cairo, Egypt
**Pharmaceutical Technology Department, German University in Cairo, Cairo, Egypt
***Pharmaceutical Chemistry Department, German University in Cairo, Cairo, Egypt
****Faculty of Science, Cairo University, Giza, Egypt
*****Faculty of Engineering, British University in Egypt, Cairo, Egypt
Antibiotic resistance is a serious problem facing the world; it is increasing every year due to overuse or misuse
of antibiotics which leads to the development of new mechanisms of drug resistance by bacteria. For this
study, erythromycin-loaded magnetoliposomes have been prepared and subjected to alternating magnetic
field (5 and 15 mT, 100 KHz) for 30 min to test the effect of exposure on the rate of drug export out of the cell
behind the resistance mechanism of bacteria. Results showed temperature increases of 4 and 24 degrees Cel-
sius after exposure of erythromycin-loaded magnetoliposomes to 5mT and 15mT, respectively. Moreover, it
was found that the percentage of erythromycin exported was greater after exposure to alternating magnetic
field (0.83 ± 0.1 μg/ml and 1.33 ± 4 μg/ml in 5 mT and 15mT AMF, respectively) than that in the control
group (0.24 ± 0.06 μg/ml). Exposure to alternating magnetic field induced higher rate of erythromycin re-
lease from magnetoliposomes via mechanical actuation of the nanoparticles. These findings suggest that it is
possible to trigger and control the drug release by merging the targeted drug delivery system with the nano-
technology and magnetic field. Upon increasing the intensity of the alternating magnetic field, the release
rate increased significantly.
Keywords: alternating magnetic field, drug release, drug delivery, erythromycin, magnetoliposomes
БИОФИЗИКА том 66
№ 2
2021