БИОФИЗИКА, 2021, том 66, № 2, с. 323-328
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ФОТОТОКСИЧЕСКОЕ ДЕЙСТВИЕ ВОДОРАСТВОРИМЫХ
ПОРФИРИНОВ НА КЛЕТКИ СВЕТЛОКЛЕТОЧНОЙ КАРЦИНОМЫ
ПОЧКИ ЧЕЛОВЕКА Сaki-1
© 2021 г. А.Ф. Арутюнян, Л.Л. Тевонян, А.Д. Бениаминов, Е.Е. Егоров, Д.Н. Калюжный
Институт молекулярной биологии им. В.А. Энгельгардта РАН, 119991, Москва, ул. Вавилова, 32
E-mail: uzhny@mail.ru
Поступила в редакцию 04.12.2020 г.
После доработки 04.12.2020 г.
Принята к публикации 11.12.2020 г.
В рамках разработки и поиска фотосенсибилизаторов с возможно более узкой направленностью
рассмотрены два типа тетрапиридиновых порфиринов: катионный порфирин P4 (TMPyP4) и его
амфифильное производное порфирин P1, содержащее карбоксильные группы, а также их цинк-
содержащие аналоги ZnP4 и ZnP1. Проведено сравнение физико-химических свойств двух классов
молекул и исследовано их воздействие на клетки светлоклеточной карциномы почек Caki-1 в
культуре. Соединения в микромолярных концентрациях не вызывали морфологических изменений
клеток в отсутствие облучения светом. Обработка клеток порфирином P4 под действием синего
света вызывала быстрое проявление цитотоксичности. Клетки начинали открепляться от субстрата,
а на мембранах появлялись вздутия (блебы). Скорость этих изменений согласуется с прямым
повреждением мембран, вызываемым порфирином P4. В аналогичных условиях соединение ZnP1
не вызывало никаких видимых изменения морфологии клеток Caki-1. Полученные результаты
могут быть объяснены различной липофильностью соединений и, как следствие, их различной
локализацией в клетке. Преимущественно мембранная локализация должна преобладать для более
липофильного соединения P4 по сравнению с ZnP1, что может служить объяснением быстрого
цитопатического эффекта.
Ключевые слова: порфирин, активные формы кислорода, клетки.
DOI: 10.31857/S0006302921020137
Фотодинамическая терапия опухолей одно из
Тетрапиридилпорфирины рассматриваются
как класс молекул, способных к взаимодействию
активно развивающихся направлений в настоя-
с различными клеточными мишенями, одной из
щее время. Порфирины - перспективные моле-
которых является ДНК. Для повышения раство-
кулы для применения в фотодинамической
римости соединений и лучшей доставки в клетки
терапии опухолей благодаря специфичному вза-
преимуществом обладают катионные формы.
имодействию с клеточным структурами и способ-
Для катионного порфирина TMPyP4 в малой
ности генерировать активные формы кислорода
концентрации (0.5 мкМ) изучено изменение экс-
[1, 2]. Фотохимическое действие приводит к на-
прессии генов, при помощи полногеномного
правленному повреждению клеточных мишеней,
анализа последовательности РНК. Было обнару-
тем самым вызывая гибель опухолевых клеток. В
жено, что высокая доля измененных генов были
настоящее время ведется разработка и поиск фо-
функционально связаны с клеточной адгезией. В
тосенсибилизаторов с определенной мишенью
высокой же концентрации (2 мкМ) соединение
действия. Порфирины являются классом соеди-
TMPyP4 вызывало клеточную гибель [4]. TMPyP4
нений, которые удобны для химической модифи-
проявляет высокое сродство к ДНК, в частности к
кации с целью достижения целевых характери-
неканоническим G-квадруплексным структурам,
стик. Для доставки фотосенсибилизаторов в
образующимся теломерной последовательностью
клетки и преодоления факторов гипоксии опухо-
ДНК [5], тем самым являясь потенциальным
лей предлагаются различные носители, в том чис-
агентом, снижающим активность теломеразы по-
средством конкуренции во взаимодействии с суб-
ле способные наряду с соединениями переносить
стратом.
кислород [3].
При выборе фотосенсибилизаторов, имеющих
Сокращениe: DPBF - 1,3-дифенилисобензофуран.
направленное действие на ДНК, необходимо изу-
323
324
АРУТЮНЯН и др.
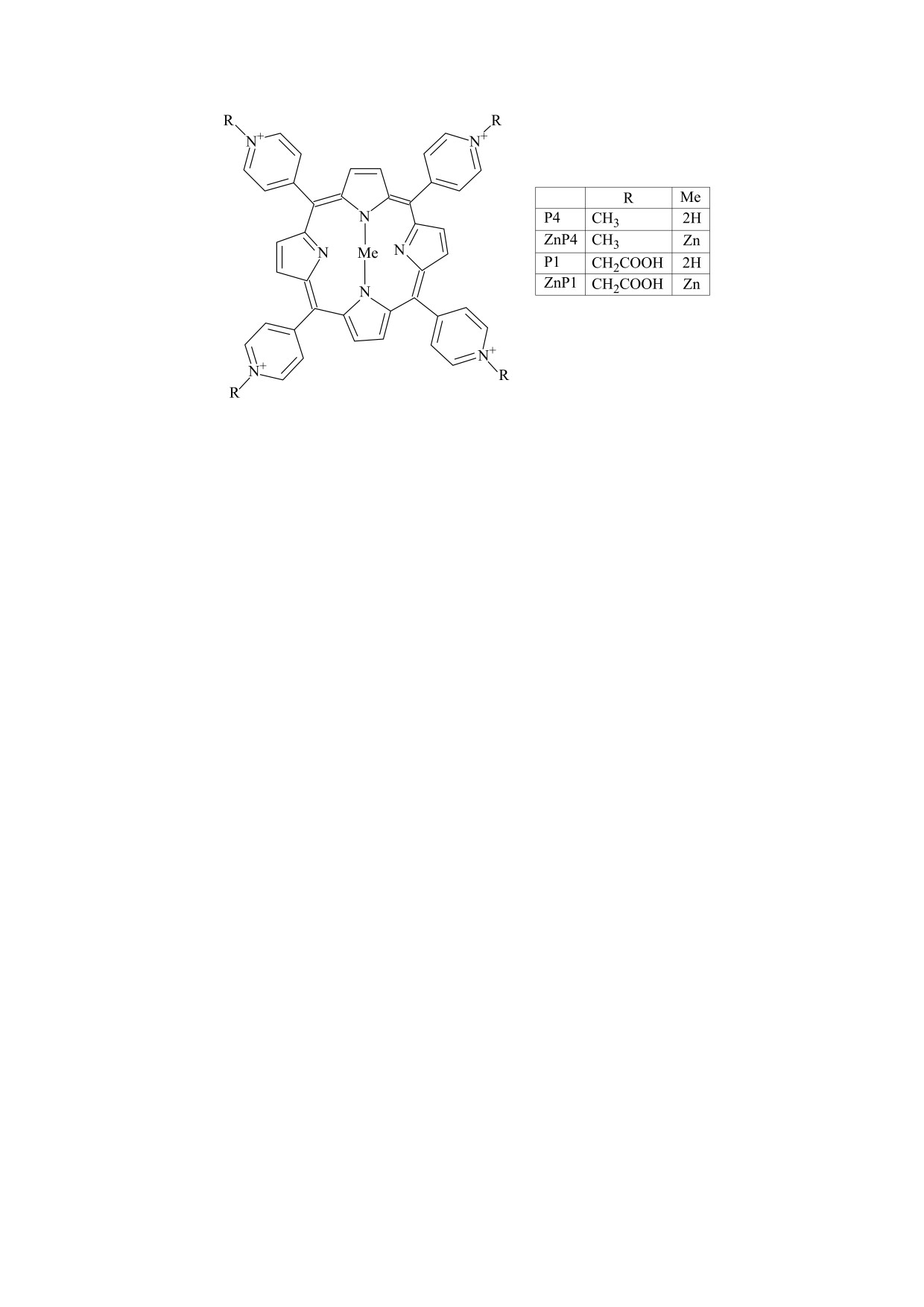
Рис. 1. Химическая структура порфиринов P1 (5,10,15,20-tetrakis(N-carboxymethyl-4-pyridinium)porphyrin) и P4
(5,10,15,20-tetrakis(1-methyl-4-pyridinium)porphyrin), а также их цинк-содержащих аналогов ZnP1 и ZnP4.
чение возможного побочного эффекта на альтер-
как отношение равновесных концентраций со-
нативные клеточные мишени. Первой потенци-
единения в октаноле и в воде. Соответствующие
альной мишенью амфифильных фотосенсибили-
концентрации определены спектрофотометриче-
заторов является клеточная мембрана. В данной
ски по поглощению порфиринов в полосе Соре в
работе исследовано индуцируемая светом генера-
октаноле до и после добавления воды.
ция АФК несколькими катионными порфирина-
Спектры поглощения регистрировали в раз-
ми и фотоиндуцируемое действие на линию клеток
личных растворителях (вода, диметилсульфок-
светлоклеточного рака почки человека Сaki-1.
сид, октанол) в кварцевой кювете с длиной опти-
ческого пути 10 мм с использованием спектрофо-
тометра V-550 (Jasco, США).
МАТЕРИАЛЫ И МЕТОДЫ
Caki-1 - культура, полученная из светлокле-
Производные тетрапиридилпорфиринов, ис-
точного рака почки человека. Она сохраняет ряд
следованные в работе, показаны на рис. 1. Соеди-
характеристик первичной культуры. Клетки
нение ZnP4 получено кипячением порфирина P4
культивировали при 37°С в атмосфере 5% угле-
(TMPyP4, Sigma Aldrich, США) в присутствии
кислого газа в среде DMEM («ПанЭко», Россия)
Zn(OH)2. Соединение P1 получено, как описано
с содержанием глюкозы 4.5 г/л, с добавлением
в работе [6], путем реакции 2-бромуксусной кис-
глютамина, гентамицина (40 мкг/мл) и 10% эм-
лоты с тетрапиридинпорфирином (Sigma Aldrich,
бриональной телячьей сыворотки
(«Биолот»,
США). Аналогичным образом, порфирин ZnP1
Россия).
получен кипячением P1 в присутствии Zn(OH)2
Клетки Caki были посажены в шестилуночные
[7]. Структуры полученных соединений подтвер-
планшеты (Costar, США) за 24 ч до опыта. Далее в
ждены методами ЯМР и масс-спектрометрии.
полную среду были добавлены порфирины до
Способность производных порфирина гене-
концентраций 1 или 10 мкМ (стоковые растворы
рировать синглетный кислород под действием
порфиринов составляли 10 мМ в диметилсуль-
света качественно оценена путем разложения 1,3-
фоксиде). Через час после добавления порфири-
дифенилисобензофурана (DPBF) [7]. Растворы,
нов клетки освещали светодиодным синим све-
содержащие 100 мкМ DPBF и 1 мкМ соединений,
том (λmax = 470 нм). Длительность облучения со-
освещали в течение 15 мин с помощью синего
ставляла 5 мин.
света светодиода. Изменение концентрации
DPBF определяли по поглощению при 415 нм в
диметилсульфоксиде. Зависимость поглощения
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
от времени облучения аппроксимировали экспо-
Введение модификаций в молекулы порфири-
ненциальным затуханием для определения харак-
нов потенциально позволяет направлять их на
терного времени разложения DPBF в присут-
различные мишени в клетке. Однако те же хими-
ствии фотосенсибилизаторов.
ческие модификации влияют на проницаемость
Коэффициэнт распределения соединений в
этих молекул в клетку, их растворимость, оптиче-
бинарной системе «октанол/вода» был рассчитан
ские свойства и т.д. В данной работе мы рассмот-
БИОФИЗИКА том 66
№ 2
2021
ФОТОТОКСИЧЕСКОЕ ДЕЙСТВИЕ ВОДОРАСТВОРИМЫХ ПОРФИРИНОВ
325
рели два типа тетрапиридиновых производных
порфирина - P4 и P1, а также их цинксодержа-
щие аналоги (рис. 1). Эти соединения зарекомен-
довали себя как лиганды ДНК. Как показано ра-
нее in vitro, они имеют высокую аффинность к
различным структурам нуклеиновых кислот. Что-
бы ответить на вопрос, возможно ли их использо-
вание в качестве зондов для связывания нуклеи-
новых кислот in cellulo, необходимо подробно ис-
следовать взаимодействие этих молекул с
культурами эукариотических клетками: проница-
емость, фототоксическое действие, возможную
локализацию. Для этих целей была выбрана кле-
точная линии светлоклеточной карциномы почек
человека Caki-1 и определены фототоксические
повреждения, вызываемые данными порфирина-
ми. Предварительно исследованы физико-хими-
ческие свойства молекул порфирина: спектраль-
ные характеристики, липофильность и способ-
ность генерировать активные формы кислорода.
Спектральные свойства и растворимость тетрапи-
ридилпорфиринов. Порфириновые производные P4
и Р1 отличались заместителями на пиридиновом
кольце. В порфирине P1 гидрофобная метильная
группа в P4 модифицирована введением отрица-
тельно заряженной карбоксильной группы. Про-
ведено сравнение спектров поглощения порфири-
нов Р4, Р1 и их цинксодержащих аналогов ZnP4 и
ZnP1 в различных растворителях - воде, диметил-
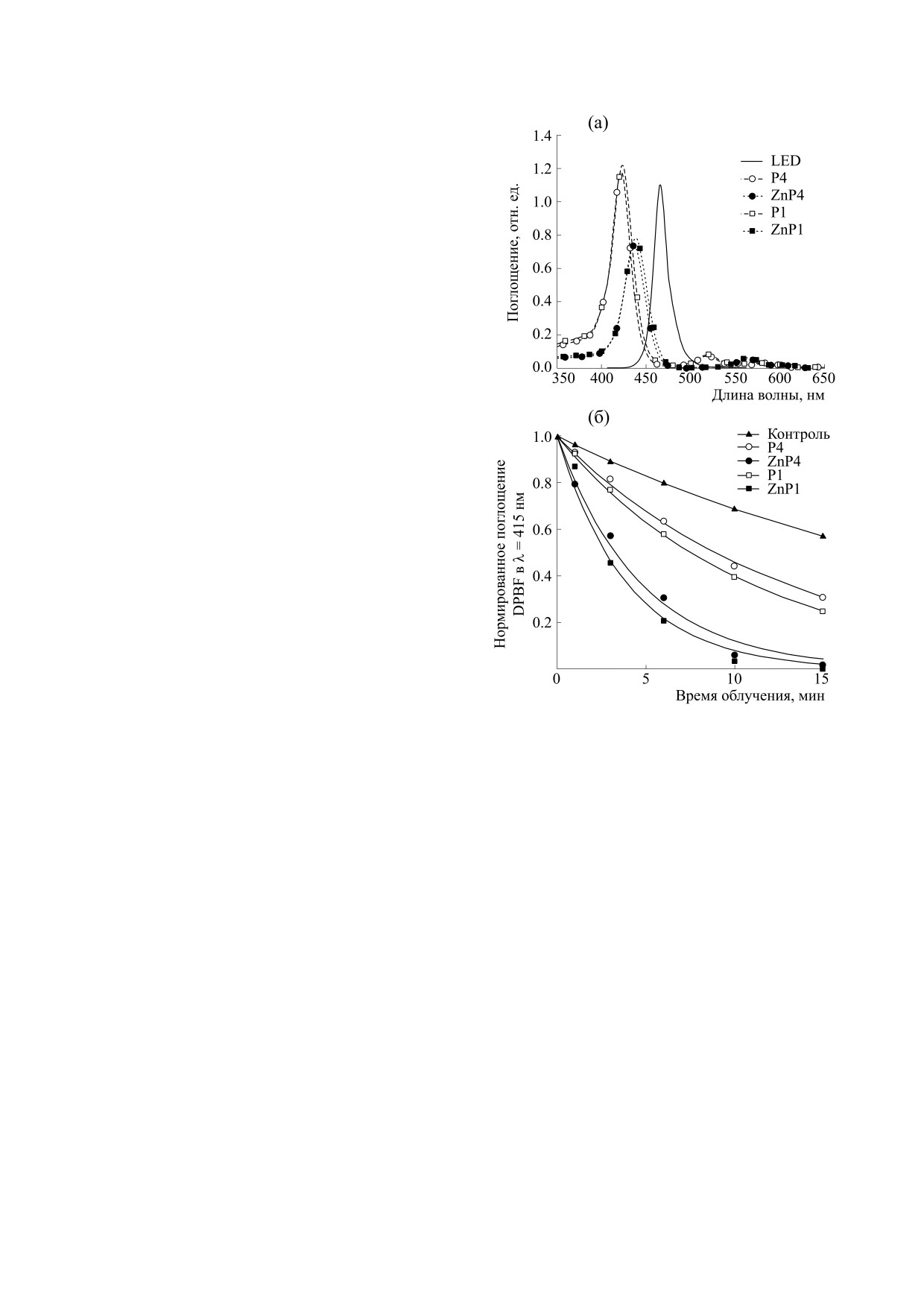
сульфоксиде, октаноле. На рис. 2а приведены
спектры поглощения порфириновых производных
в воде. Максимум поглощения в полосе Соре зави-
сит от присутствия цинка в порфириновом макро-
цикле. В металлопорфиринах ZnP4 и ZnP1 макси-
мум сдвинут в длинноволновую область примерно
Рис. 2. (а) - Спектры поглощения порфиринов (P4,
на 20 нм относительно безметальных производных
ZnP4, P1, ZnP1) в сравнении со спектром излучения
P4 и P1. Спектр поглощения изученных соедине-
светодиода (LED); (б) - фотодеградация DPBF в
ний в растворителе диметилсульфоксиде практи-
присутствии соединений.
чески не отличается от спектра водного раствора.
При изменении растворителя на октанол наблю-
дался значительный сдвиг поглощения в длинно-
сильных групп значительно снижало раствори-
волновую область. Положение максимумов погло-
мость соединения ZnP1 в октаноле.
щения в октаноле и воде приведено в таблице.
Длинноволновые сдвиги полосы поглощения
характерны при изменении окружения соедине-
Растворимость соединений в октаноле значи-
ний на менее полярное. Аналогичные сдвиги на-
тельно зависит как от боковых заместителей на
блюдаются при взаимодействии порфириновых
периферии макроцикла, так и от присутствия
соединений с потенциальными клеточными ми-
иона цинка внутри порфиринового ядра. Пре-
шенями (ДНК, белки, клеточные мембраны). Для
дельную концентрацию растворимости соедине-
направленного действия на клеточные мишени
ний в октаноле определяли после приготовления
необходимо, чтобы спектр возбуждения фотосен-
насыщенных растворов в комнатной температуре
сибилизатора совпадал со спектром источника
спектрофотометрически. Максимальная концен-
света, ввиду этого мы использовали синий свето-
трация в октаноле соединения P4 с метильными
диод, для исследования воздействий на клетки
заместителями составила порядка 70 мкМ. Оказа-
индукции активных форм кислорода в растворе.
лось, что предельная концентрация растворимо-
сти в октаноле в несколько раз падает как для
Сравнение липофильности соединений по коэф-
цинкового производного ZnP4, так и при замене
фициенту распределения в системе «октанол/вода».
метильных групп на метилкарбоксильные (P1).
Коэффициент распределения в системе «окта-
Одновременное введение цинка и метилкарбок-
нол/вода» определен по уменьшению концентра-
БИОФИЗИКА том 66
№ 2
2021
326
АРУТЮНЯН и др.
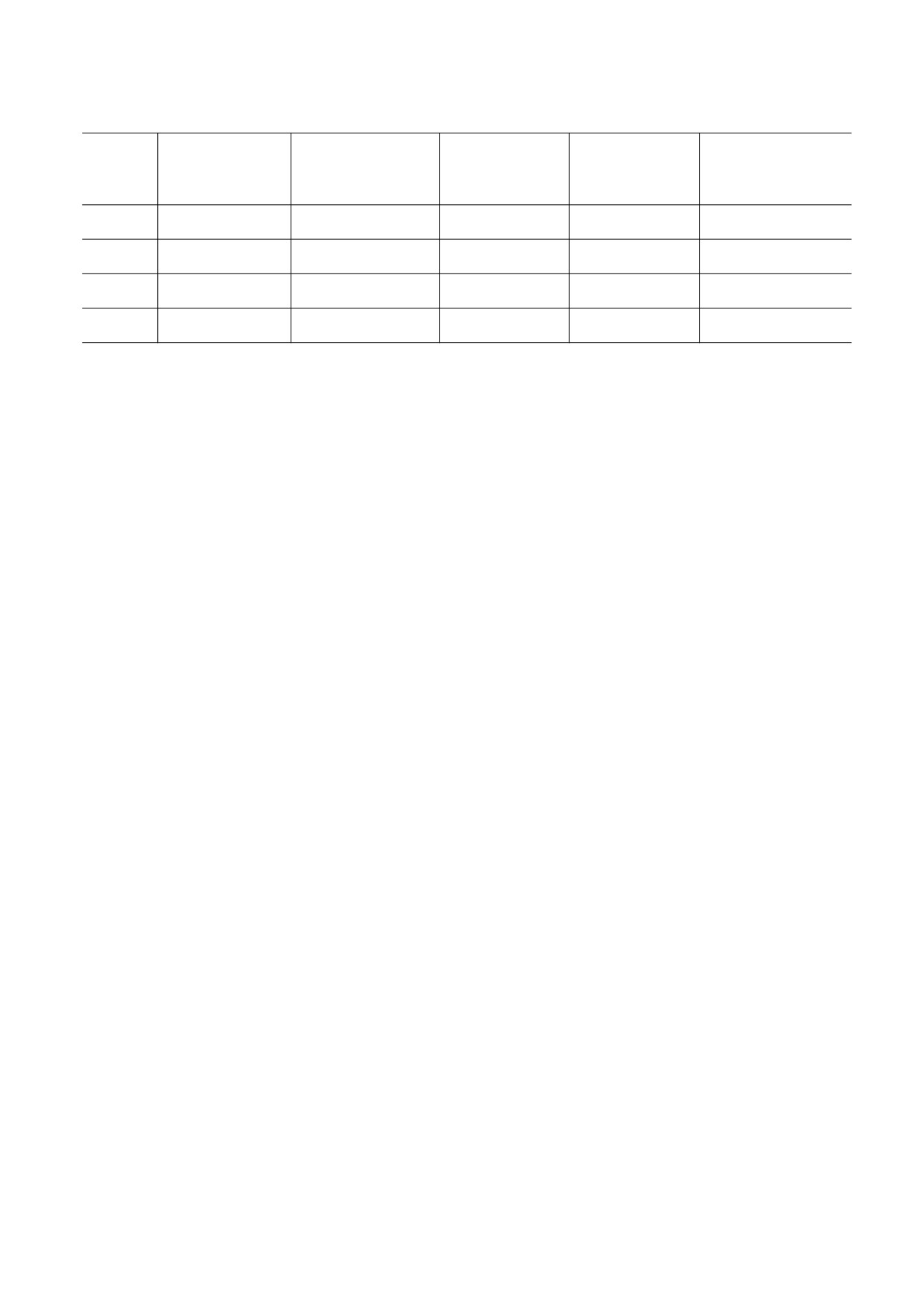
Физико-химические параметры производных порфирина
Характерное время
Максимум полосы
Максимум полосы
Растворимость в
logP (октанол :
разложения DPBF,
Соре в воде, нм
Соре в октаноле, нм
октаноле, мкМ
вода)
мин
P4
422 ± 1
430 ± 1
68.0 ± 0.8
-1.4
12.8 ± 0.5
ZnP4
440 ± 1
457 ± 1
18.7 ± 1.5
-0.8
4.7 ± 0.3
P1
423 ± 1
435 ± 1
20.0 ± 0.9
-1.6
10.9 ± 0.3
ZnP1
441 ± 1
458 ± 3
2.7 ± 0.8
-2.4
3.9 ± 0.5
ции соединений в октаноле при добавлении воды
порфиринов на клетки Caki-1 проводили через
к насыщенному раствору соединений в октаноле.
30 мин после облучения синим светом светодио-
Десятичный логарифм отношения концентраций
да, спектр которого представлен на рис. 2а. Преж-
в октаноле и воде для изученных соединений
де всего, стоит отметить, что мы не наблюдали
приведен в таблице. Найденный коэффициент
никаких видимых изменений во всех случаях
распределения показывает, что соединения пред-
применения порфиринов в концентрации до
почтительно находятся в водной фазе, однако ме-
10 мкМ без освещения синим светом (рис. 3а,б,г).
тилзамещенные соединения более липофильны.
Клетки сохраняли обычную морфологию, наблю-
Для соединения ZnP1 наблюдалась самая малень-
далась митотическая активность.
кая концентрация в гидрофобной среде.
Мы также не смогли увидеть изменений, вы-
Генерация синглетного кислорода. Мы сравни-
званных порфирином ZnP1 после освещения
ли возможность индуцировать активные формы
(рис. 3в). В отличие от этого, через 30 мин после
кислорода при возбуждении порфиринов синим
освещения клеток, которые инкубировали с пор-
светом. Способность порфиринов генерировать
фирином P4, произошли заметные изменения
синглетный кислород можно оценить по измере-
(рис. 3д,е).
нию поглощения на длине волны 415 нм при де-
Все клетки начали округляться и терять кон-
градации DPBF в диметилсульфоксиде. Этим
такт с подложкой. Это напоминало процесс нача-
методом исследованы фотофизические свойства
ла митоза, когда до этого широко распластанные
водорастворимых производных порфирина, от-
клетки, не теряя связь с субстратом (оставались
личающихся включением металла в порфирино-
контакты в виде тяжей), приобретали почти ша-
вое ядро макроцикла и боковыми заместителями
ровидную форму (рис. 3е, черные стрелки). Од-
на перефирии. Раствор, содержащий DPBF
новременно на поверхности клеток появлялись
(100 мкМ) и порфирин (1 мкМ), облучали в тече-
выпячивания цитоплазмы («блебы»), имеющие
ние 15 мин светом синего светодиода. На рис. 2б
разный размер (рис. 3е, белые стрелки), свиде-
представлены нормированные кривые фотоде-
тельствующие о нарушении мембраны. Были об-
градации DPBF. Фотодеградация DPBF значи-
наружены и уже погибшие клетки (рис. 3е, чер-
тельно усиливается в присутствии порфиринов,
ные головки стрелок).
подтверждая, что они являются хорошими гене-
раторами синглетного кислорода, который играет
Обнаруженные морфологические изменения
ключевую роль в ФДТ. Константа скорости фото-
похожи на те, которые происходят в начале про-
деградации DPBF (таблица) коррелирует с пере-
граммируемой гибели клеток - апоптозе. Однако
крыванием спектров поглощения соединений и
несмотря на схожесть, связать данные изменения
спектром излучения светодиода, представленном
с апоптозом сложно по нескольким причинам.
на рис. 2а. Это согласуется с полученными ранее
Во-первых, на сроке 30 мин никакой апоптоз по-
данными [7], что интенсивность генерации син-
добных клеток не может успеть завершиться
глетного кислорода соединениями P4 и ZnP1
(длительность апоптоза измеряется часами). По-
примерно одинакова при возбуждении белым
этому в любом случае на этом сроке было невоз-
светом. При этом растворимость в непополярном
можно увидеть вызванную апоптозом фрагмента-
растворителе октаноле у этих двух соединений
цию ядер - довольно позднее событие для апо-
значительно отличалась, что может указывать на
птоза прикрепленных клеток. Отличие состояло
различную аккумуляцию соединений в клеточ-
также в том, что на столь раннем сроке появля-
ной мембране.
лись уже разрушенные клетки (рис. 1е, головки
Цитотоксический эффект порфиринов под дей-
стрелок). Вероятнее всего, эти клетки погибли в
ствием облучения светом. Наблюдение эффекта
результате повреждения мембраны и некроза.
БИОФИЗИКА том 66
№ 2
2021
ФОТОТОКСИЧЕСКОЕ ДЕЙСТВИЕ ВОДОРАСТВОРИМЫХ ПОРФИРИНОВ
327
Рис. 3. Морфологические изменения клеток Caki под влиянием порфиринов и освещения: (а) - контрольные клетки,
(б) - клетки через 30 мин инкубации с порфирином ZnP1, (в) - клетки с ZnP1 через 30 мин после освещения, (г) -
клетки с P4 через 30 мин, (д) и (е) - клетки с P4 через 30 мин после освещения. На (е) белые стрелки - выпячивания
плазмалеммы, черные стрелки - остатки клеточных креплений, головки от стрелок - остатки погибшей клетки. Фа-
зовый контраст, цифровое контрастирование.
Также округлению клеток при апоптозе обычно
ринов мы видим более сильное, а главным обра-
предшествует потеря клеткой контактов с под-
зом более быстрое действие более липофильного
ложкой. В нашем случае контакты по большей
порфирина P4. Прямое повреждение мембран
мере сохранялись. Таким образом, морфологиче-
проявляется сразу, оно не нуждается в исполне-
ские изменения свидетельствуют в пользу того,
нии каких-либо предварительных химических
что наблюдаемые процессы были неуправляемы-
реакциях.
ми и их исходной причиной было резкое измене-
ние барьерных функций плазмалеммы.
ЗАКЛЮЧЕНИЕ
Большинство порфиринов в процессах фото-
динамической терапии оказывают цитотоксиче-
Из рассмотренных производных пиридиновых
ское действие, что обычно является следствием
порфиринов ZnP1 является наиболее перспек-
взаимодействия порфиринов с множественными
тивным внутриклеточным зондом для направ-
мишенями в клетке, в том числе повреждением
ленного исследования структуры нуклеиновых
мембран. Одиночные акты окисления в мембра-
кислот в клетке, в то время как быстрая цитоток-
нах способны вызвать лавины реакций перекис-
сичность порфирина P4 обусловлена поврежде-
ного окисления липидов, оказывающие суще-
нием мембраны клеток.
ственное действие на свойства мембран.
Порфирин P4 обладает более липофильными
ФИНАНСИРОВАНИЕ РАБОТЫ
свойствами, чем порфирин ZnP1, поэтому можно
ожидать, что его распределение в клетках сдвину-
Работа выполнена пpи финансовой поддержке
то в сторону мембран, а не цитозоля. Поэтому
Российcкого научного фонда (гpант № 20-14-
вполне логично, что при сравнении двух порфи-
00332).
БИОФИЗИКА том 66
№ 2
2021
328
АРУТЮНЯН и др.
КОНФЛИКТ ИНТЕРЕСОВ
2. Y. Lin, T. Zhou, R. Bai, and Y. Xie, J. Enzyme Inhibi-
tion & Med. Chem.
35,
1080
(2020). DOI:
Авторы заявляют об отсутствии конфликта
10.1080/14756366.2020.1755669
интересов.
3. E. V. Belyaeva, A. A. Markova, D. N. Kaluzhny, et al.,
Anti-Cancer Agents in Med. Chem. 18, 617 (2018).
DOI: 10.2174/1871520617666170719150834
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
4. X.-H. Zheng, X. Nie, H.-Y. Liu, et al., Sci. Rep. 6,
26592 (2016). DOI: 10.1038/srep26592.
Настоящая работа не содержит описания ис-
5. N. Konieczna, A. Romaniuk-Drapała, N. Lisiak,
следований с использованием людей и животных
et al., Int. J. Mol. Sci.
20,
2670
(2019). DOI:
в качестве объектов.
10.3390/ijms20112670
6. M. B. Berezin, N. M. Berezina, A. S. Semeikin, and
A. I. V’yugin, Rus. J. Gen. Chem. 77, 1955 (2007).
DOI: 10.1134/S1070363207110199
СПИСОК ЛИТЕРАТУРЫ
7. O. A. Kovaleva, V. B. Tsvetkov, O. K. Mamaeva, et al.,
1. N. Malatesti, I. Munitic, and I. Jurak, Biophys. Rev. 9,
Eur. Biophys. J. 43, 545 (2014). DOI: 10.1007/s00249-
149 (2017). DOI: 10.1007/s12551-017-0257-7
014-0984-7.
Phototoxic Effect of Water-Soluble Porphyrins on Caki-1 Cells of Human Clear Cell
Renal Cell Carcinoma
A.F. Arutyunyan, L.L. Tevonyan, A.D. Beniaminov, Y.E. Yegorov, and D.N. Kaluzhny
Engelhard Institute of Molecular Biology, Russian Academy of Sciences,
ul. Vavilova 32, Moscow, 119991 Russia
In order to develop and find photosensitizers which could be more suitable for target tissue, two types of tet-
rapyridine porphyrins were used: cationic porphyrin P4 (TMPyP4) and its amphiphilic derivative porphyrin
P1 containing carboxyl groups, and also their zinc-containing analogs ZnP4 and ZnP1. The physicochemical
properties of these two classes of molecules were compared and their effects on clear cell renal cell carcinoma
Caki-1 cells in the culture were investigated. Compounds in micromolar concentrations did not cause mor-
phological changes in cells in the absence of light irradiation. The treatment of cells with porphyrin P4 under
blue light led to rapid appearance of cytotoxicity. The cells began to detach from the substrate, and swellings
(blebs) appeared on the membranes. The rate of these changes is consistent with direct membrane damage
caused by porphyrin P4. Under similar conditions, compound ZnP1 did not cause any visible changes in the
morphology of Caki-1 cells. The results obtained show that cells give different lipophilicity for the com-
pounds and, as a consequence, they have different locations in the cell. On the whole, more lipophilic com-
pound P4 unlike ZnP1 should be predominately located in a membrane, this may explain the rapid cytopathic
effect.
Keywords: porphyrin, reactive oxygen species, cells
БИОФИЗИКА том 66
№ 2
2021