БИОФИЗИКА, 2021, том 66, № 2, с. 329-337
БИОФИЗИКА КЛЕТКИ
УДК 615.451.232
ЛИПОСОМАЛЬНЫЙ ПРЕПАРАТ С КАРНОЗИНОМ И ЛИПОЕВОЙ
КИСЛОТОЙ: ПОЛУЧЕНИЕ, АНТИОКСИДАНТНЫЕ
И АНТИАГРЕГАНТНЫЕ СВОЙСТВА
© 2016 г. В.А. Щелконогов*, **, ***, Е.С. Дарнотук*, А.В. Чеканов**, ***, О.А. Баранова**, ***,
К.Д. Казаринов***, Н.С. Шастина*, С.Л. Стволинский****, Т.Н. Федорова****,
Э.Ю. Соловьева**, А.И. Федин**,
*
Г.М. Сорокоумова
*МИРЭА - Российский технологический университет, 119571, Москва, просп. Вернадского, 86
E-mail: vasiliy9999@yandex.ru
**Российский национальный исследовательский медицинский университет имени Н.И. Пирогова МЗ РФ,
117997, Москва, ул. Островитянова, 1
***Институт радиотехники и электроники имени В.А. Котельникова РАН,
141190, Фрязино Московской области, пл. Введенского, 1
****Научный центр неврологии, Москва, 125367, Волоколамское шоссе, 80
Поступила в редакцию 15.11.2019 г.
После доработки 23.11.2020 г.
Принята к публикации 30.11.2020 г.
Подобраны условия для получения фосфатидилхолиновых липосом, содержащих одновременно
липоевую кислоту и карнозин. Полученные липосомы представляют собой сферические частицы
размером 180-250 нм, характеризующиеся эффективностью включения липоевой кислоты, равной
50-70%, и карнозина - 17-33%. На модели окисления фосфатидилхолина пероксидом водорода
показано антиоксидантное действие карнозина, липоевой кислоты или липоевой кислоты с
карнозином совместно, заключающееся в торможении процесса липидной пероксидации, которое
проявляется в уменьшении образования продуктов перекисного окисления липидов, реагирующих
с тиобарбитуровой кислотой. Установлено, что липоевая кислота (5 мМ) и карнозин (0.1-10 мМ) в
липосомах проявляют антиоксидантное действие. При этом было показано, что содержание
соответствующих продуктов липидной пероксидации в липосомах с антиоксидантами (липоевая
кислота + карнозин) было в 15 раз меньше, чем в контрольных липосомах (без антиоксидантов).
Оценено влияние полученных липосомальных препаратов на агрегацию тромбоцитов,
индуцированную арахидоновой кислотой. Обнаружено, что липосомальный препарат, содержащий
липоевую кислоту (1.5 мМ) и карнозин (2.1 мМ), подавляет агрегацию тромбоцитов на 50-55%
относительно контроля (тромбоциты и арахидоновая кислота), в то время как липосомы без
антиоксидантов и водорастворимые формы препаратов карнозина и липоевой кислоты
практически не влияют на агрегацию тромбоцитов, обусловленную арахидоновой кислотой.
Ключевые слова: липосомы, карнозин, липоевая кислота, ТБК-активные продукты, арахидоновая
кислота.
DOI: 10.31857/S0006302921020149
нейронов. Наиболее значимыми являются нару-
Цереброваскулярные заболевания занимают
второе место среди всех причин инвалидизации и
шения сосудисто-тромбоцитарного и коагуляци-
смертности населения во всем мире, уступая сер-
онного гемостаза, возникновение и прогрессиро-
дечно-сосудистым патологиям и опережая онко-
вание окислительного стресса, воспалительные
логические заболевания. Нарушение кровоснаб-
процессы, аутофагия и деструкция гематоэнце-
жения головного мозга является пусковым меха-
фалического барьера, что сопровождается очаго-
низмом развития комплекса патобиохимических
вым повреждением ткани мозга в области ише-
реакций, приводящих к дегенерации и гибели
мии [1]. При этом окислительный стресс является
основным молекулярным механизмом, лежащим
Сокращения: ЛК - липоевая кислота, АК - арахидоновая
фосфатидилхолин, ЭВ - эффективность включения, ТБК- в основе гибели ткани мозга и развития невроло-
АП - тиобарбитурат-активные продукты.
гического дефицита.
329
330
ЩЕЛКОНОГОВ и др.
Патогенетическая значимость окислительного
и Bcl-2, а также уменьшению активации киназы
стресса при развитии ишемического поражения
Akt, регулирующей соотношение и активность
мозга обусловливает целесообразность примене-
данных белков [11-14].
ния нейропротекторных препаратов антиокси-
Нейропротекторное действие карнозина, по-
дантного действия [2]. Среди низкомолекуляр-
казанное на различных моделях глобальной и фо-
ных антиоксидантов представляют интерес липо-
кальной ишемии головного мозга, открывает
евая кислота (ЛК) и карнозин.
перспективу для создания лекарственных препа-
ЛК способна перехватывать активные формы
ратов на его основе [15].
кислорода и восстанавливать эндогенные анти-
В пилотном исследовании, выполненном
оксиданты - глутатион, витамины Е и С. Благо-
двойным слепым плацебо-контролируемым ме-
даря такому сочетанию свойств ее рассматривают
тодом, было показано, что включение карнозина
как перспективный терапевтический препарат [3,
в схему лечения пациентов с хронической ише-
4]. На экспериментальных моделях ишемии у
мией мозга оказывает стабилизирующее действие
крыс и мышей было выявлено нейропротектор-
на форменные элементы крови, усиливает эндо-
ное действие ЛК, проявившееся в улучшении
генную антиоксидантную систему организма на
неврологических функций, уменьшении площа-
фоне улучшения когнитивных функций мозга у
ди очага ишемического повреждения, обуслов-
пациентов [16].
ленного подавлением окислительного стресса и
Однако эффективность действия карнозина в
каспазо-зависимых процессов апоптоза [5, 6].
организме ограничена низкой липофильностью,
В медицинской практике препараты ЛК при-
а также его гидролизом, катализируемым карно-
меняются при диабетической полинейропатии,
зиназой [17]. Повысить эффективность карнози-
интоксикации тяжелыми металлами, при цирро-
на можно путем синтеза его производных [18] или
зах печени. Имеются сведения об эффективности
включив его в наноструктурные конструкции
применении ЛК при комплексной терапии хро-
[19].
нической ишемии головного мозга в третьей ста-
Одним из основных звеньев гемостатической
дии заболевания, в том числе с последствиями
активации, сопровождающей острые нарушения
ишемического инсульта [7, 8].
мозгового кровообращения, является уменьше-
ние атромбогенных свойств эндотелия сосуди-
Существенным недостатком ЛК является ее
стой стенки. У пациентов с ишемическим ин-
очень низкая растворимость в воде, быстрое свя-
сультом выявляется нарушение антиагрегацион-
зывание с различными белками и быстрая биоде-
ной, антикоагулянтной и фибринолитической
градация под действием различных ферментов
активности сосудистой стенки, максимально вы-
[9], что приводит к уменьшению антиоксидант-
раженные в острейшем периоде ишемического
ного и терапевтического действия. Полная дегра-
инсульта [20, 21]. В настоящее время антиагре-
дация в кровотоке происходит менее чем за час. В
гантная терапия является ключевым фармаколо-
результате для достижения терапевтического эф-
гическим подходом к профилактике и лечению
фекта препараты, содержащие ЛК, вводят в боль-
острого ишемического инсульта [22].
ших дозах и в течение длительного времени.
В экспериментах in vitro было показано, что
Другим эффективным антиоксидантом явля-
ЛК подавляет агрегацию тромбоцитов, снижает
ется карнозин - β-алaнил-L-гистидин. Карнозин
уровень кальция и тромбоксана В2 при актива-
содержится в больших количествах в мышечной и
ции их коллагеном и арахидоновой кислотой
нервной ткани. Он обладает не только свойства-
(АК) [23]. Также было обнаружено, что липосо-
ми прямого антиоксиданта-перехватчика радика-
мальная форма ЛК способна эффективно подав-
лов, но является и антигликирующим агентом,
лять агрегацию тромбоцитов, обусловленную АК
хелатором ионов металлов, молекулярным шапе-
[24]. Антиагрегантное действие карнозина было
роном и индуктором антиоксидантных систем в
описано в условиях АДФ-индуцированной агре-
условиях окислительного стресса [10]. На различ-
гации тромбоцитов [25].
ных моделях ишемии головного мозга было пока-
Совокупность свойств, присущих ЛК и карно-
зано, что карнозин проявляет прямое нейропро-
текторное действие, ограничивая размеры фор-
зину, делает актуальной задачу создания новых
мирующегося очага некроза, предотвращает
лекарственных форм на основе этих соединений.
развитие неврологической симптоматики, сни-
Одним из подходов к решению этой проблемы
является создание препарата, содержащего ЛК и
жает смертность животных. Ключевые молеку-
карнозин, путем включения их в липосомы. Спо-
лярные механизмы нейропротекторного дей-
ствия карнозина обусловлены его способностью
собность липосом проникать через гематоэнце-
уменьшать эксайтотоксичность глутамата, пре-
фалический барьер имеет важное значение для
пятствовать развитию окислительного стресса,
доставки этих препаратов в мозг [26].
изменению соотношения про- и антиапоптоти-
Целью данной работы является получение но-
ческих белков семейства Bcl-2, в особенности Bax
вой липосомальной формы, включающей карно-
БИОФИЗИКА том 66
№ 2
2021
ЛИПОСОМАЛЬНЫЙ ПРЕПАРАТ С КАРНОЗИНОМ
331
зин и ЛК, и исследование ее физико-химических
4. Липосомы, содержащие липоевую кислоту с
свойств с оценкой влияния на функциональную
карнозином, получали аналогично методике 1):
активность тромбоцитов.
упариванием раствора ЛК
(5 мг/мл) и ФХ
(40 мг/мл) в хлороформе. Для приготовления сус-
пензии липосом, содержащих ЛК (5мг/мл) и кар-
МАТЕРИАЛЫ И МЕТОДЫ
нозин (20 мг/мл), полученную липидную пленку
диспергировали в 1 мл 0.9% физиологического
Материалы. В работе использовали фосфати-
раствора с карнозином (рН 7.4) с последующей
дилхолин Lipoid S-100 (Lipoid GmbH, Германия)
экструзией полученной дисперсии.
94%-й чистоты, выделенный из бобов сои; карно-
зин, липоевую кислоту, дипальмитоилфосфати-
Отделение одноламеллярных везикул с вклю-
дилхолин (ДПФХ), холестерин, фосфатно-соле-
ченными в них субстанциями от свободных пре-
вой буферный раствор (Sigma-Aldrich, США);
паратов проводили методом гель-хроматографии
арахидоновую кислоту (Helena Biosciences,
на колонке illustra NAP-5 с сорбентом Sephadex
США); хлороформ, физиологический раствор
G25 Medium (Великобритания). Содержание ин-
(0.9% NaCl), этиловый спирт, сульфат аммония
капсулированных препаратов определяли после
(«Химмед», Россия). Для проведения диазореак-
разрушения липосом этанолом: ЛК - спектрофо-
ции использовали следующие вещества: сульфа-
тометрическим методом [24], карнозин - по ди-
ниловую кислоту, соляную кислоту, нитрит на-
азореакции [27].
трия, карбонат натрия, дезоксихолат натрия
Получение липосом методом активной загрузки.
(«Химмед», Россия).
Раствор ЛК (5 мг/мл) и ФХ (40 мг/мл) в хлоро-
Получение липосом методом пассивной загруз-
форме (1 мл) упаривали при температуре 40°С.
ки. 1. Фосфатидилхолиновые липосомы. Раствор
Для приготовления суспензии липосом получен-
фосфатидилхолина (ФХ, 40 мг/мл) в хлороформе
ную липидную пленку диспергировали в 1 мл
(1 мл) упаривали при температуре 40°С. Для при-
0.3 M буферного раствора сульфата аммония (с
готовления суспензии липосом с концентрацией
сахарозой или без нее, pH 7.4) с последующей
ФХ (40 мг/мл) полученную липидную пленку
экструзией полученной дисперсии. Затем липо-
диспергировали 0.9% физиологическим раство-
сомы отделяли от сульфата аммония методом
ром (рН 5.7, 1 мл) или 0.3 M буферным раствором
гель-фильтрации, к липосомам (0.75 мл) добавля-
сульфата аммония (pH 7.4, 1 мл). Полученную
ли водный раствор карнозина (20 мг/мл, 0.25 мл)
суспензию подвергали пятикратному циклу замо-
при нагревании при 60°С и перемешивали в тече-
раживания и оттаивания. Одноламеллярные ве-
ние 30 мин. Степень включения ЛК в липосомы
зикулы получали методом экструзии с помощью
определяли спектрофотометрическим методом,
миниэкструдера LiposoFast basic (Avestin, США)
содержание карнозина - с помощью диазореак-
при многократном пропускании полученной
ции. Размер полученных липосом определяли ме-
дисперсии (50 раз) через ядерный поликарбонат-
тодом динамического светорассеяния на приборе
ный фильтр Whatman (США) с размером пор 100
Delsa Nano C (Beckman Coulter Inc., США).
и 200 нм.
Реакция карнозина с диазореактивом. Раствор
2. Липосомы, содержащие липоевую кислоту,
сульфаниловой кислоты (0.5 мМ, 6 мл) и свеже-
получали аналогично методике 1): упариванием
приготовленный раствор нитрита натрия (0.6 М,
раствора ЛК (5 мг/мл) и ДПФХ (40 мг/мл) или ЛК
6 мл) перемешивали в течение 5 мин при охла-
(5 мг/мл) и ФХ (40 мг/мл) в хлороформе (1 мл).
ждении на ледяной бане. Затем прибавляли еще
Для приготовления суспензии липосом, содержа-
24 мл раствора нитрита натрия, перемешивали в
щих ЛК, полученную липидную пленку диспер-
течение 5 мин, доливали дистиллированную воду
гировали в 1 мл 0.9% физиологического раствора
до 100 мл. Далее строили калибровочный график
(рН 5.7) или 1 мл 0.3 M буферного раствора суль-
зависимости концентрации карнозина от оптиче-
фата аммония (с сахарозой или без нее, pH 7.4).
ской плотности. Для этого отбирали различные
При использовании ДПФХ полученную суспен-
аликвоты стандартного раствора карнозина
зию нагревали до 40°С с последующей экстру-
(1 мM: 12, 24 и 48 мкл и 10 мM: 12 и 24 мкл) и до-
зией.
водили дистиллированной водой до 1 мл. Потом
добавляли диазореактив (1.5 мл), перемешивали
3. Липосомы, содержащие карнозин, получали
и оставляли на 5 мин, добавляли раствор Na2CO3
аналогично методике а): упариванием раствора
(0.9 М, 1.5 мл) и перемешивали, через 10 мин из-
ФХ (40 мг/мл) или ФХ (28 мг/мл) и холестерина
меряли оптическую плотность на спектрофото-
(12 мг/мл) в хлороформе (1 мл). Для приготовле-
метре UV-1601 (Shimadzu, Япония) в диапазоне
ния суспензии липосом, содержащих карнозин
длин волн от 400 до 550 нм.
(20 мг/мл), полученную липидную пленку дис-
пергировали в 1 мл 0.9% физиологического рас-
Одноламеллярные везикулы пропускали через
твора с карнозином (рН 8.2) с последующей экс-
эксклюзионную колонку для разделения липо-
трузией полученных дисперсий.
сом с карнозином от свободного карнозина, от-
БИОФИЗИКА том 66
№ 2
2021
332
ЩЕЛКОНОГОВ и др.
бирали фракции и проводили диазореакцию. Для
(1 ⋅ 106 кл./мл, 225 мкл) добавляли липосомы без
этого из полученных фракций отбирали в про-
антиоксидантов, или комбинированный липосо-
бирку по 75 или 25 мкл образца (при этом фрак-
мальный препарат (ЛК и карнозин), или липосо-
цию с липосомами разрушали детергентом дезок-
мы с ЛК или с карнозином, или их водораствори-
сихолатом натрия (0.1 М, 1 мл)), добавляли ди-
мые формы (растворы ЛК и карнозина в фосфат-
стиллированную воду до 1 мл. Затем добавляли
но-солевом буферном растворе с рН 7.4, 20 мкл),
диазореактив (1.5 мл), перемешивали и оставляли
инкубировали в течение 5 мин при температуре,
на 5 мин. Далее добавляли раствор Na2CO3
равной 37°С. Затем добавляли индуктор агрега-
(0.9 М, 1.5 мл) и перемешивали. Через 10 мин из-
ции тромбоцитов
- арахидоновую кислоту
меряли оптическую плотность на спектрофото-
(1 мг/мл, 25 мкл). Агрегатограмму регистрирова-
метре в диапазоне длин волн от 400 до 550 нм.
ли на четырехканальном агрегометре Helena
К фосфатидилхолиновым липосомам, содер-
AggRAM (Helena Biosciences, США) в течение
жащим карнозин, ЛК, или ЛК (5 мМ) с карнози-
10 мин.
ном в различных концентрациях (0.1 М-10 мМ),
Cтатиcтичеcкий анализ. Статистическую обра-
добавляли H2O2 (1 мМ), затем инкубировали при
ботку результатов проводили с использованием
температуре 37°С в течение 60 мин и определяли
пакета прикладных программ STATISTICA 6.0
содержание продуктов, взаимодействующих с
(StatSoft Corporation, США). Для анализа разли-
тиобарбитуровой кислотой (ТБК-активных про-
чий количественных признаков в трех и более не-
дуктов, ТБК-АП). В качестве контролей исполь-
связанных группах использовали статистический
зовали липосомы из ФХ, не содержащие данных
критерий Краскелла-Уоллиса ANOVA. Досто-
антиоксидантов (в отсутствие H2O2, а также в его
верными считались различия при р < 0.05. Ре-
зультаты в табл. 1-3 и на рис. 1 и 2 представлены
присутствии до и после инкубации).
в виде средней величины и стандартной ошибки
Определение ТБК-активных продуктов
[28].
среднего значения.
Использовали свежеприготовленный реагент,
который получали путем растворения трихлорук-
сусной кислоты (0.9 М) и тиобарбитуровой кис-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
лоты (4.6 мМ) в дистиллированной воде при на-
ЛК хорошо растворима в органических рас-
гревании (50°С) на водяной бане. К 0.5 мл анали-
творителях и щелочных растворах и мало раство-
зируемого образца липосом добавляли
3 мл
рима в воде, тогда как карнозин хорошо раство-
указанного выше реагента и кипятили в течение
рим в воде при разных значениях рН.
30 мин. Затем реакционную смесь охлаждали, до-
бавляли 1 мл хлороформа, встряхивали и центри-
На первом этапе работы подбирали оптималь-
фугировали в течение 20 мин при 540 g при ком-
ные условия для максимально возможного вклю-
натной температуре на центрифуге СМ-6МТ
чения карнозина и ЛК в липосомы, в том числе
(ELMI, Латвия). Измеряли оптическую плот-
путем подбора метода загрузки и липидного со-
ность раствора в верхней водной фазе относи-
става липосом.
тельно реагента при 580 и 532 нм и рассчитывали
Одноламеллярные везикулы, содержащие кар-
концентрацию ТБК-активных продуктов (в
нозин, получали методом пассивной загрузки,
нмоль/мл) в образце по формуле:
диспергируя высушенную липидную пленку вод-
ным раствором карнозина (20 мг/мл, рН 8.2) с по-
(OD
532
−OD
580
)× 6 ×1000
C
TБК-AП
=
следующей экструзией.
155
В результате проведенных исследований было
(Коэффициент экстинкции малонового альде-
установлено, что степень включения карнозина в
гида при 532 нм - 155 мМ-1 см-1; коэффициент
липосомы из ФХ составила 28%, что на 10% боль-
разведения липосом в реакционной среде - 6).
ше, чем для образцов липосом, состоящих из ФХ
Подготовка образцов крови для исследования
и холестерина (табл. 1). При этом размер полу-
процесса агрегации тромбоцитов. Эксперименты
ченных наночастиц был одинаков и составил
проводили in vitro на образцах крови, взятых у
235 нм, что позволяет судить о том, что липидный
здоровых доноров мужского пола в возрасте 20-
состав не влиял на размер получаемых липосом.
25 лет (n = 15). Для забора венозной крови ис-
Такое небольшое включение карнозина в липо-
пользовали стандартные пробирки Improvacuter®
сомы можно объяснить, вероятно, быстрым вы-
с антикоагулянтом (цитрат натрия, 3.8%). Обога-
ходом карнозина из водного пространства липо-
щенную тромбоцитами плазму получали центри-
сом при проведении гель-хроматографии. Поэто-
фугированием крови в течение 10 мин при 135 g
му при получении комплексного липосомального
при комнатной температуре.
препарата, содержащего карнозин и ЛК, исполь-
Исследование процесса агрегации тромбоцитов,
зовали активную загрузку карнозина в липосомы.
индуцированной арахидоновой кислотой. В образ-
На следующем этапе работы получали липосо-
цы с обогащенной тромбоцитами плазмой
мы с ЛК. Мультиламеллярные везикулы получа-
БИОФИЗИКА том 66
№ 2
2021
ЛИПОСОМАЛЬНЫЙ ПРЕПАРАТ С КАРНОЗИНОМ
333
Таблица 1. Липосомальный препарат, содержащий карнозин
Состав липосом (40
Карнозин, мг/мл
pH среды
ЭВ, %
Размер частиц, нм
мг/мл)
ФХ
20
8.2
28 ± 7
235 ± 5
ХС/ФХ (1/1)
20
8.2
18 ± 5
235 ± 5
Примечание. Карнозин - исходная концентрация карнозина для получения липосом; ЭВ - эффективность включения
карнозина в липосомы - отношение массы карнозина, включенного в липосомы, к исходной массе карнозина, которую
брали для получения липосом; ХС/ФХ - молярное отношение холестерина к фосфатидилхолину.
Таблица 2. Липосомальный препарат, содержащий липоевую кислоту
Состав липосом
ЛК, мг/мл
pH среды
ЭВ, %
Размер частиц, нм
(40 мг/мл)
ФХ
5
5.7
52 ± 10
245 ± 5
ФХ/(NH4)2SO4
5
7.4
70 ± 10
245 ± 5
ФХ/(NH4)2SO4/
5
7.4
33 ± 10
219 ± 5
сахароза
ДПФХ
5
6.3
44 ± 10
210 ± 5
Примечание. ЛК - исходная концентрация липоевой кислоты для получения липосом; ЭВ - эффективность включения ЛК
в липосомы - отношение массы ЛК, включенной в липосомы, к исходной массе ЛК, которую брали для получения липосом.
ли путем диспергирования высушенной липид-
В результате проведенных исследований было
ной пленки буферными растворами (рН 5.7-7.4).
обнаружено, что при совместном включении ЛК
Одноламеллярные везикулы получали из мульти-
и карнозина в липосомы из ФХ методом пассив-
ламеллярных везикул путем экструзии через
ной загрузки происходило уменьшение степени
ядерный поликарбонатный фильтр с диаметром
включения в липосомы как карнозина
пор 100-200 нм. Таким образом, были получены
(ЭВ = 12%), так и ЛК (ЭВ = 50%). Однако получе-
липосомы с ЛК, характеристики которых пред-
ние липосом с ЛК и карнозином методом актив-
ставлены в табл. 2.
ной загрузки привело к увеличению эффективно-
сти включения карнозина в липосомы
Анализ полученных результатов показал, что в
(ЭВ = 33%) по сравнению с использованием ме-
зависимости от липидного состава и рН среды об-
тода пассивной загрузки. Более того, добавление
разовывались наночастицы с различной эффек-
криопротектора сахарозы к липосомам привело к
тивностью включения (ЭВ) ЛК в липосомы. Мак-
незначительному уменьшению степени включе-
симальная степень включения ЛК в липосомы
ния карнозина в наночастицы (ЭВ = 24%) по
наблюдалась при использовании ФХ и буферного
сравнению с липосомами без сахарозы. При этом
раствора сульфата аммония (рН 7.4, ЭВ составила
эффективность включения ЛК в липосомы из ФХ
70%). Также можно предположить, что в данном
при использовании метода активной загрузки
препарате часть ЛК распределена в водной фазе,
практически не изменилась (ЭВ = 50%). Размеры
а часть - в липидном бислое, что хорошо корре-
полученных наночастиц находились в диапазоне
лирует с амфифильными свойствами ЛК. При ис-
180-250 нм и не отличались при вариации мето-
пользовании ДПФХ (рН 6.3) и добавлении саха-
розы для получения липосом с ЛК происходило
дов их получения.
значительное уменьшение степени включения
С целью исследования антиоксидантного дей-
ЛК в наночастицы. Размер полученных нано-
ствия карнозина, ЛК, или ЛК и карнозина сов-
форм колебался в диапазоне 210-250 нм.
местно, входящих в состав липосом, на процесс
В продолжение работы получали липосомы с
перекисного окисления липидов на следующем
совместным включением ЛК и карнозина в нано-
этапе работы определяли содержание ТБК-АП в
частицы, используя метод пассивной и активной
образцах наносуспензий, содержащих антиокси-
загрузки. Результаты проведенных эксперимен-
данты. Результаты проведенных исследований
тов представлены в табл. 3.
представлены на рис. 1.
БИОФИЗИКА том 66
№ 2
2021
334
ЩЕЛКОНОГОВ и др.
Таблица 3. Липосомальный препарат, содержащий липоевую кислоту и карнозин
Действующее вещество
ЭВ, %
Состав липосом
pH среды
Размер частиц, нм
(40 мг/мл)
Карнозин,
ЛК, мг/мл
ЛК
Карнозин
мг/мл
Пассивная загрузка
ФХ
5
20
8.2
50 ± 10
12 ± 5
245 ± 5
Активная загрузка
ФХ
5
20
7.4
47 ± 10
33 ± 10
245 ± 5
ФХ/сахароза
5
20
7.4
53 ± 10
24 ± 10
183 ± 5
Примечание. ЛК - исходная концентрация липоевой кислоты для получения липосом; Карнозин - исходная концентрация
карнозина для получения липосом; ЭВ - эффективность включения антиоксидантов в липосомы - отношение массы
антиоксидантов, включенных в липосомы, к исходной массе антиоксидантов, которые брали для получения липосом.
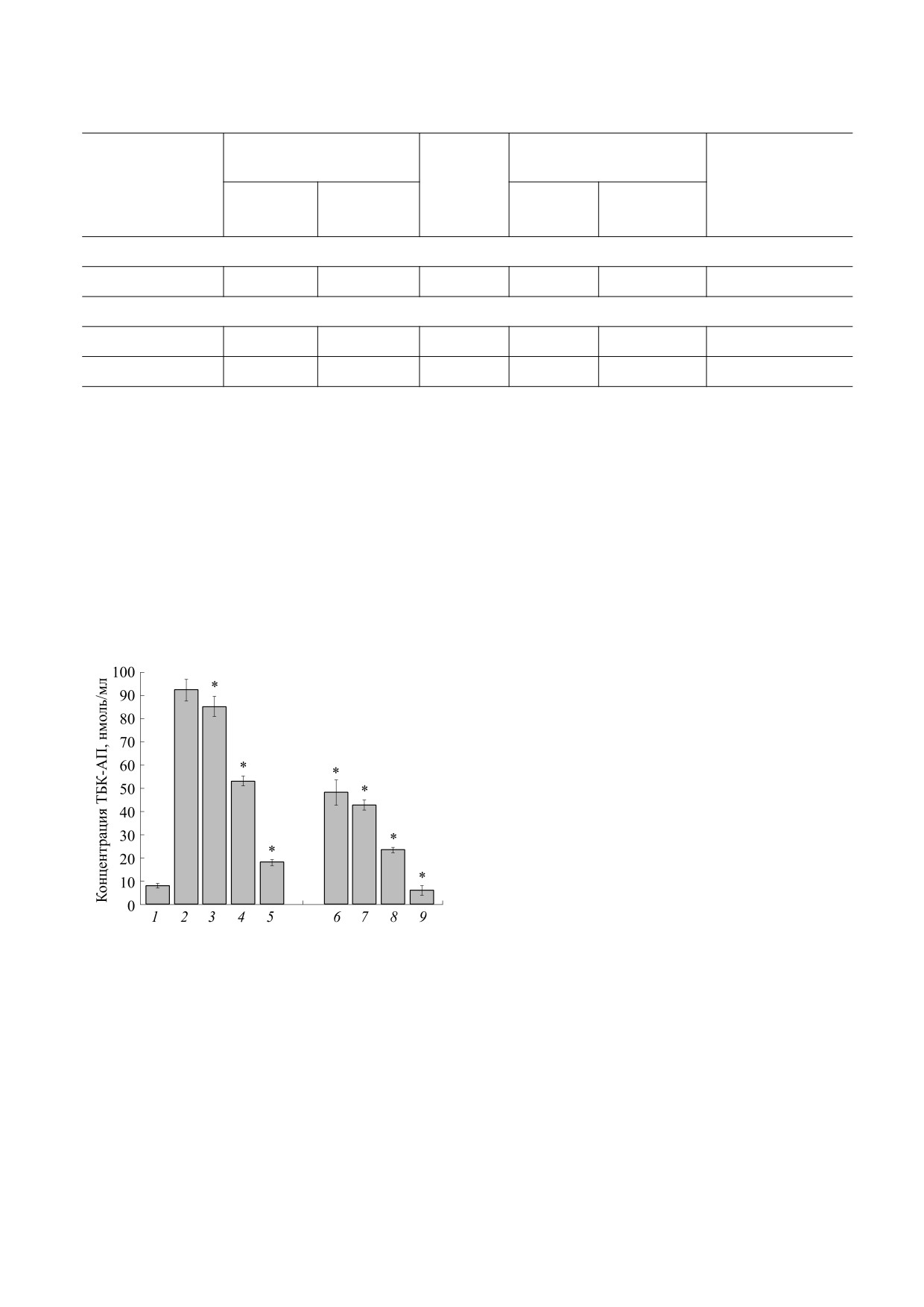
Было обнаружено, что при добавлении H2O2 к
дикалы, которые в результате дальнейшей транс-
формации и β-расщепления превращаются в про-
фосфатидилхолиновым липосомам происходило
дукты перекисного окисления липидов
повышение концентрации ТБК-АП (рис. 1, 2) по
(малоновый альдегид, акролеин, 4-гидрокси-2-
сравнению со спонтанным уровнем ТБК-АП
ноненаль и другие). Добавление пероксида водо-
(рис. 1, 1). Известно, что при взаимодействии пе-
рода к липосомам, содержащим карнозин (1 и
роксида водорода с фосфолипидами образуются
10 мМ; рис. 1, 4,5) или ЛК (5 мМ; рис. 1, 6), при-
пероксильные, алкоксильные, эпоксипероксиль-
водило к значительному уменьшению (в два-че-
ные, эпоксиалкильные и гидроксиалкильные ра-
тыре раза) содержания ТБК-АП (рис. 1, 4,5,6;
р < 0.05). Наиболее эффективно антиоксидант-
ные свойства проявляли оба антиоксиданта (ЛК,
5 мМ, и карнозин, 10 мМ) при окислении липи-
дов липосом пероксидом водорода. При этом бы-
ло показано, что содержание соответствующих
продуктов липидной пероксидации в липосомах с
антиоксидантами (ЛК и карнозин; рис. 1, 9) было
в 15 раз меньше, чем в контрольных липосомах
(без антиоксидантов; рис. 1, 2; р < 0.05). Вероят-
нее всего, антиоксидантные свойства ЛК и кар-
нозина в данной биологической системе связаны
с их окислением в процессе липидной пероксида-
ции. В условиях in vitro и in vivo при липидной пе-
роксидации в работах [29-32] было показано, что
ЛК и карнозин могут нейтрализовать различные
свободные радикалы (гидроксильный, перок-
сильные, алкоксильные, гидроксиалкильные и
другие радикалы), при этом подвергаться окисле-
Рис. 1. Влияние ЛК и карнозина на концентрацию
ТБК-АП, образующихся в процессе перекисного
нию, тем самым уменьшая образование продук-
окисления липидов липосом, индуцированного пе-
тов перекисного окисления липидов.
роксидом водорода. Окисление липосом проводили в
присутствии пероксида водорода (1 мМ) при темпе-
На завершающем этапе работы оценивали
ратуре 37°С в течение 60 мин. 1 - Исходная концен-
влияние полученных липосомальных форм анти-
трация ТБК-АП в липосомах в отсутствие пероксида
водорода; 2 - липосомы без антиоксидантов в при-
оксидантов на функциональную активность
сутствии пероксида водорода (контроль); 3, 4, 5 - ли-
тромбоцитов в условиях индукции агрегации
посомы с карнозином (концентрация карнозина -
тромбоцитов арахидоновой кислотой. Экспери-
соответственно 0.1, 1, 10 мМ); 6 - липосомы с ЛК
менты проводили in vitro на образцах крови, полу-
(5 мМ); 7, 8, 9 - липосомы с ЛК (5 мМ) и карнозином
ченных от условно здоровых доноров. Оценивали
(концентрация карнозина - соответственно 0.1, 1,
10 мМ). * - р < 0.05 относительно контроля.
влияние полученных липосом с ЛК и карнозином
БИОФИЗИКА том 66
№ 2
2021
ЛИПОСОМАЛЬНЫЙ ПРЕПАРАТ С КАРНОЗИНОМ
335
тературе имеются данные о том, что липосомы
могут эффективно взаимодействовать с клетка-
ми, за счет их слияния с плазматической мембра-
ной, в процессе эндоцитоза или с помощью дру-
гих механизмов [37]. Поэтому можно предполо-
жить, что липосомы, содержащие ЛК или
карнозин, а также липосомальный препарат с ЛК
и карнозином способны проникать через клеточ-
ную мембрану за счет слияния липосом с мембра-
ной тромбоцитов.
ЗАКЛЮЧЕНИЕ
С использованием методов пассивной и ак-
тивной загрузки были получены липосомы, со-
держащие карнозин и ЛК, с различной эффек-
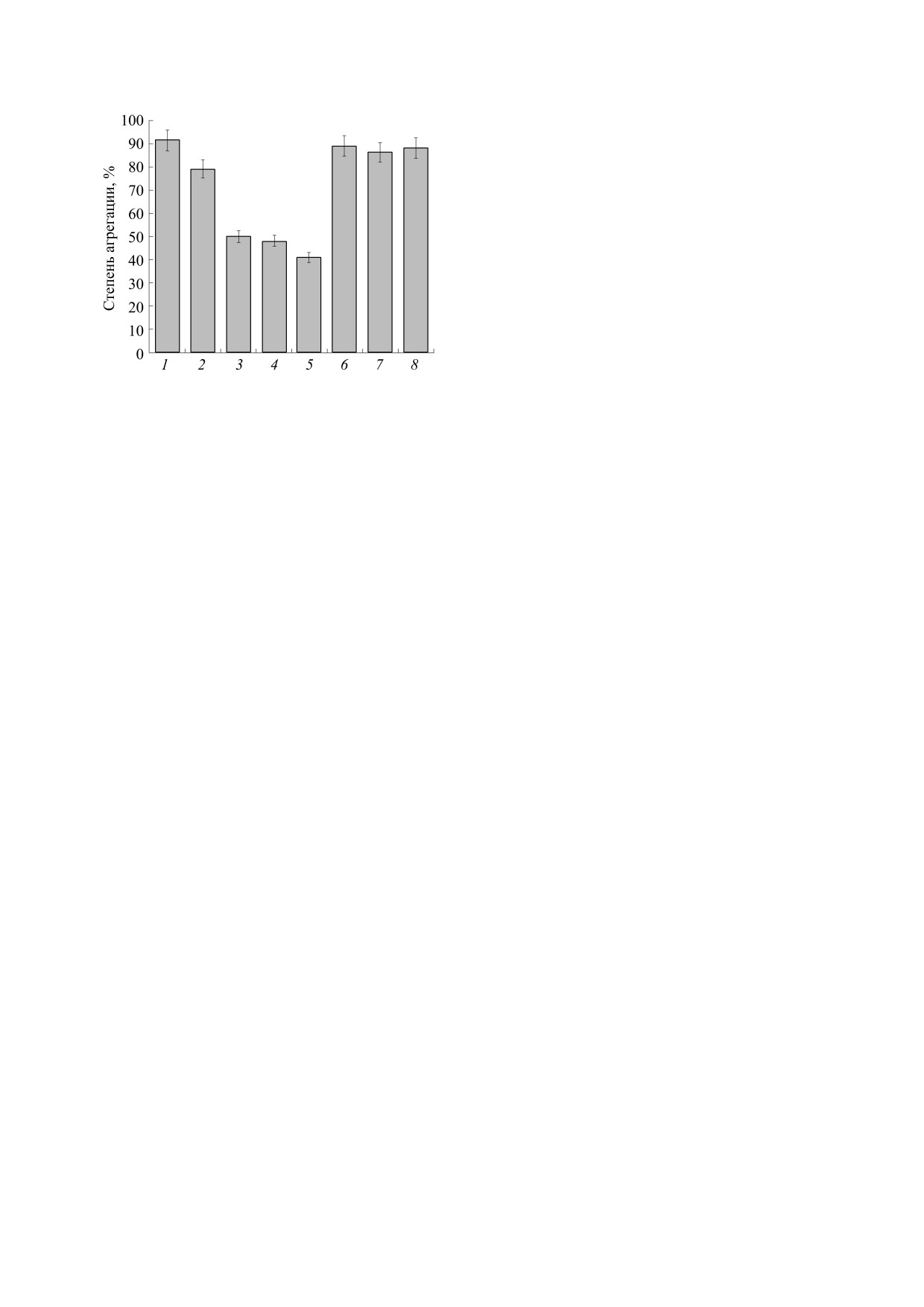
Рис. 2. Влияние липосомальных и водорастворимых
тивностью включения субстанций в наночасти-
препаратов (ЛК, карнозин, ЛК и карнозин) на агрега-
цы. Методом пассивной загрузки были получены
цию тромбоцитов человека, обусловленную АК (здо-
как липосомы с ЛК или с карнозином, так и ли-
кл./мл): 1 - Контроль:
ровые доноры, n = 15, 1 · 106
посомальный препарат, содержащий ЛК и карно-
тромбоциты и АК; 2 - тромбоциты, липосомы без ан-
зин совместно, характеризующиеся 50-70% сте-
тиоксидантов, АК; 3 - тромбоциты, липосомы с кар-
нозином (2.1 мМ), АК; 4 - тромбоциты, липосомы с
пенью включения ЛК и 15-30% включения кар-
ЛК (1.5 мМ), АК; 5 - тромбоциты, липосомы с ЛК
нозина в липосомы. При совместном включении
(1.5 мМ) и карнозином (2.1 мМ), АК; 6 - тромбоциты,
ЭВ составляла 50% для ЛК и 12% для карнозина.
карнозин (2.1 мМ), АК; 7 - тромбоциты, ЛК (1.5 мМ),
При использовании метода активной загрузки
АК; 8 - тромбоциты, ЛК (1.5 мМ) и карнозин
были получены липосомальные формы ком-
(2.1 мМ), АК.
плексного препарата, содержащего ЛК и карно-
зин, при этом удалось в два раза повысить степень
на функциональную активность тромбоцитов в
включения карнозина в липосомы (25-33%). Од-
сравнении с контролями: тромбоцитами и АК,
нако эффективность включения ЛК в липосомы
липосомами без антиоксидантов, липосомами с
при использовании данного метода загрузки не
ЛК или с карнозином, или растворами с ЛК и
изменилась (ЭВ = 50%).
карнозином в фосфатно-солевом буферном рас-
При изучении процесса торможения липид-
творе (рН 7.4). Результаты проведенных исследо-
ной пероксидации липосом, проявляющейся в
ваний представлены на рис. 2.
уменьшении образования продуктов перекисно-
Было показано (рис. 2), что липосомы, содер-
го окисления липидов, реагирующих с тиобарби-
жащие ЛК (1.5 мМ) и карнозин (2.1 мМ), подав-
туровой кислотой, было показано, что при ис-
пользовании концентрации ЛК (5 мМ) и карно-
ляют агрегацию тромбоцитов, вызванную АК, на
зина (0.1-10 мМ) эти субстанции в липосомах
50% относительно контроля (тромбоциты и АК).
проявляют антиоксидантное действие, вероятнее
При этом было обнаружено, что липосомы с ЛК
(1.5 мМ) и липосомы с карнозином (2.1 мМ) ин-
всего, вследствие окисления этих антиоксидан-
гибируют агрегацию тромбоцитов, индуцирован-
тов [29-32], тем самым уменьшая концентрацию
ТБК-АП. При этом было показано, что содержа-
ную АК, на 62 и 42% соответственно. Также было
ние соответствующих продуктов липидной пе-
обнаружено, что как липосомы без антиоксидан-
роксидации в липосомах с антиоксидантами (ЛК
тов, так и водорастворимые формы препаратов
карнозина (2.1 мМ) и ЛК (1.5 мМ) практически не
и карнозин) было в 15 раз меньше, чем в кон-
оказывали влияния на агрегацию тромбоцитов,
трольных липосомах (без антиоксидантов). Та-
ким образом, можно заключить, что полученный
обусловленную индуктором АК. Вероятнее всего,
липосомальный препарат с ЛК и карнозином яв-
это связано с плохой способностью водораство-
ляется более эффективным антиоксидантом по
римых препаратов ЛК и карнозина проникать в
клетку. Имеются сведения о том, что транспорт в
сравнению с ЛК или карнозином.
цитоплазму клеток (через клеточную мембрану)
Оценка антиагрегационных свойств липосо-
ЛК и карнозина в свободном виде затруднен [33-
мальных форм карнозина, ЛК или липосомаль-
35]. В исследованиях in vitro было обнаружено,
ного препарата, содержащего ЛК и карнозин сов-
что карнозин проникает в клетку через клеточ-
местно, в сравнении с их водорастворимыми
ную мембрану с помощью пептидного транспор-
формами показала, что комбинированный липо-
тера PEPT2 [36]. Поэтому с целью улучшения
сомальный препарат, содержащий ЛК (1.5 мМ) и
транспорта препаратов через плазматические
карнозин (2.1 мМ), подавляет агрегацию тромбо-
мембраны могут использоваться липосомы. В ли-
цитов на 50-55% относительно контроля (тром-
БИОФИЗИКА том 66
№ 2
2021
336
ЩЕЛКОНОГОВ и др.
боциты и АК), в то время как липосомы без анти-
6.
H. Deng, X. Zuo, J. Zhang, et al., Mol. Med. Rep. 11
оксидантов и водорастворимые формы препара-
(5), 3659 (2015).
тов ЛК и карнозин в тех же концентрациях не
7.
Э. И. Сайфуллина, Л. Б. Новикова, Г. Р. Иксанова
снижали агрегацию тромбоцитов, обусловлен-
и Э. М. Колчина, Клин. неврология 2, 17 (2017).
ную индуктором агрегации АК.
8.
Л. Б. Новикова, Г. Р. Иксанова, Э. М. Колчина и
Ш. Н. Галимов, Неврологич. журн. 11 (3), 42
На основании полученных результатов можно
(2006).
сделать заключение о том, что новый липосо-
9.
S. Akiba, S. Matsugo, L. Packer, and T. Konishi, Anal.
мальный препарат с ЛК и карнозином является
Biochem. 258 (2), 299 (1998).
перспективным для дальнейших исследований
10.
А. А. Болдырев, Биохимия 77 (4), 403 (2012).
по оценке его нейропротекторного действия на
11.
Y. I. Shen, P. He, Y. Y. Fan, et al., Free Radic. Biol.
различных экспериментальных моделях.
Med. 48 (5), 727 (2010). DOI: 10.1016/j.freeradbio-
med.2009.12.021
БЛАГОДАРНОСТИ
12.
Т. Н. Федорова, С. А. Гаврилова, М. П. Морозова
и др., Вопр. биологической, медицинской и фар-
Авторы выражают благодарность Абдулджаб-
мацевтической химии 20 (4), 25 (2017).
бар Балсам Тарек за получение липосомальных
13.
А. А. Девятов, Т. Н. Фёдорова, С. Л. Стволинский
препаратов; руководителю Представительства
и др, Бюл. эксперим. биологии и медицины 163
компании «ЛИПОИД АГ» (Германия) в Москве
(2), 156 (2017).
к.х.н. А.В. Сымону за предоставление фосфати-
14.
О. М. Лопачева, А. В. Лопачев, К. Н. Куличенкова
дилхолина Lipoid S-100; д.б.н., проф. РНИМУ
и др., Анналы клин. эксперим. неврологии 12 (1),
им. Н. И. Пирогова Минздрава России Ю.О. Те-
38 (2018).
селкину за ценные замечания и помощь в написа-
15.
D. S. Berezhnoy, S. L. Stvolinsky, A. V. Lopachev,
нии данной статьи.
et al., Amino Acids 51 (1), 139 (2019).
16.
Т. Н. Федорова, М. С. Беляев, О. А. Трунова и др.,
Биол. мембраны 25 (6), 458 (2008).
ФИНАНСИРОВАНИЕ РАБОТЫ
17.
J. F. Lenny, R. P. George, A. M. Weiss, et al., Clin.
Работа выполнена в рамках Государственных
Chim. Acta 123 (3), 221 (1982).
заданий РНИМУ им. Н.И. Пирогова (№ гос. ре-
18.
S. L. Stvolinsky, E. R. Bulygina, T. N. Fedorova, et al.,
гистрации АААА-А19-100390063-9) и Научного
Cell. Mol. Neurobiol. 30 (3), 395 (2010).
центра неврологии (№ гос. регистрации АААА-
19.
Н. А. Антонова, Г. М. Сорокоумова, Т. Н. Федоро-
А19-119111290050-6).
ва и др., Тонкие химические технологии 11 (6), 55
(2016).
20.
З. А. Суслина, М. М. Танашян и В. Г. Ионова,
КОНФЛИКТ ИНТЕРЕСОВ
Ишемический инсульт: кровь, сосудистая стенка,
Авторы заявляют об отсутствии конфликта
антитромботическая терапия (Медицина, М.,
интересов.
2005).
21.
З. А. Суслина, А. В. Ерофеева, М. М. Танашян и
В. Г. Ионова, Неврологич. вестн. 3-4, 5 (2005).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
22. М. А. Домашенко и М. М. Танашян, Рус. мед.
Все процедуры, выполненные в исследовании
журн. 19 (9), 562 (2011).
с участием людей, соответствовали этическим
23. Y. S. Lai, C. Y. Shih, Y. F. Huang, and T. C. Chou, J.
стандартам Хельсинкской декларации 1964 г. и ее
Agric. Food Chem.
58
(15),
8596
(2010). DOI:
последующим изменениям. У всех участников
10.1021/jf101518p
было получено информированное добровольное
24. В. А. Щелконогов, Г. М. Сорокоумова, О. А. Бара-
согласие на взятие биоматериала.
нова и др., Биомед. химия 62 (5), 577 (2016).
25. Н. Ю. Никитенко, В. Х. Шаврацкий, А. А. Болды-
рев и др., Вопр. мед. химии 41 (1), 41 (1995).
СПИСОК ЛИТЕРАТУРЫ
26. Т. Н. Федорова, С. Л. Стволинский, О. И. Кулико-
1. Е. И. Гусев и В. И. Скворцова, Ишемия головного
ва и др., Анналы клин. эксперим. неврологии 10
мозга (Медицина, М., 2001).
(1), 47 (2016).
2. Э. Ю. Соловьева, О. П. Миронова, О. А. Баранова
27. Е. Ю. Канюка и С. Г. Зиновьев, Биохимия 9 (1), 110
и др., Журн. неврологии и психиатрии
(2014).
им. С. С. Корсакова 108 (6), 34 (2008).
28. M. Uchiyama and M. Mihara, Analyt. Biochem. 86
3. G. P. Biewenga, G. R. Haenen, and A. Bast, Gen.
(1), 271 (1978).
Pharmacol. 29 (3), 315 (1997).
29. K. P. Shay, R. F. Moreau, E. J. Smith, et al., Biochim.
4. A. Goraca, H. Huk-Kolega, A. Piechota, et al., Phar-
Biophys. Acta
1790
(10),
1149
(2009). DOI:
macol. Rep. 63 (4), 849 (2011).
10.1016/j.bbagen.2009.07.026
5. W. M. Clark, L. G. Rinker, N. S. Lessov, et al., Stroke
30. B. J. Lee and D. G. Hendricks, J. Food Sci. 62 (5), 931
32 (4), 1000 (2001).
(1997). DOI: 10.1111/j.1365-2621.1997.tb15009.x
БИОФИЗИКА том 66
№ 2
2021
ЛИПОСОМАЛЬНЫЙ ПРЕПАРАТ С КАРНОЗИНОМ
337
31. C. V. Krishnan and M. Garnett, Int. J. Electrochem.
34. K. P. Shay, R. F. Moreau, E. J. Smith, and T. M. Ha-
Sci., 6, 3607 (2011).
gen, IUBMB Life 60 (6), 362 (2008).
35. G. J. Handelman, D. Han, H. Tritschler, and L. Pack-
32. A. R. Smith, S. V. Shenvi, M. Widlansky, et al., Curr.
er, Biochem. Pharmacol. 47, 1725 (1994).
Med. Chem.
11
(9),
1135
(2004).
DOI:
36. A. V. Lopachev, O. M. Lopacheva, D. A. Abaimov, et al.,
10.2174/0929867043365387
Biochemistry 81 (5), 511 (2016).
33. H. Ihara, Y. Kakihana, A. Yamakage, et al., J. Biol.
37. N. Duzgunes and S. Nir, Adv. Drug Delivery Rev. 40, 3
Chem. 294 (4), 1279 (2019).
(1999).
A Liposomal Drug with Carnosine and Lipoic Acid:
Preparation, Antioxidant and Antiplatelet Properties
V.A. Shchelkonogov*, **, ***, E.S. Darnotuk*, A.V. Chekanov**, ***, O.A. Baranova**,
K.D. Kazarinov****, N.S. Shastina*, S.L. Stvolinsky****, T.N. Fedorova****, E.Y. Solovieva**,
A.I. Fedin**, and
*
G.M. Sorokoumova
*MIREA - Russian Technological University, prosp. Vernadskogo 86, Moscow, 119571 Russia
**Pirogov Russian National Research Medical University, ul. Ostrovityanova 1, Moscow, 117997 Russia
***Kotelnikov Institute of Radioengineering and Electronics, Russian Academy of Sciences,
pl. Vvedenskogo 1, Fryazino, Moscow Region, 141190 Russia
****Research Center of Neurology, Volokolamskoye Shosse, 80, Moscow, 125367 Russia
The conditions have been created to produce phosphatidylcholine liposomes containing both lipoic acid and
carnosine. The obtained liposomes are spherical particles with a size of 180-250 nm, characterized by the ef-
ficiency of the lipoic acid (50-70%) and carnosine (17-33%) inclusion. The oxidation of phosphatidylcho-
line by hydrogen peroxide was used as a model to show the antioxidant effects of carnosine, lipoic acid or the
combined effects of lipoic acid and carnosine: the inclusion of carnosine and lipoic acid led to inhibition of
lipid peroxidation process through a decrease in the formation of lipid peroxidation products to react with
thiobarbituric acid. The study found antioxidant activity of lipoic acid (5 mM) and carnosine (0.1-10 mM)
in liposomes. Also, it was shown that the amount of the relevant products of lipid peroxidation in liposomes
with antioxidants (lipoic acid and carnosine in common) was 15 times lower than that in control liposomes
(without antioxidants). The effects of the obtained liposomes on platelet aggregation induced by arachidonic
acid were assessed. Results have indicated that liposomes with lipoic acid (1.5 mM) together with carnosine
(2.1 mМ) suppress platelet аggregation by 50%, while liposomes without antioxidants and water-soluble
forms of carnosine and lipoic acid have virtually no effect on platelet aggregation, caused by arachidonic acid.
Keywords: liposomes, carnosine, lipoic acid, TBA-active products, arachidonic acid
БИОФИЗИКА том 66
№ 2
2021