БИОФИЗИКА, 2021, том 66, № 3, с. 421-428
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 57.012, 57.012.5
МЕТОДЫ ОПРЕДЕЛЕНИЯ ЗНАКА ХИРАЛЬНОСТИ СПИРАЛЬНЫХ
И СУПЕРСПИРАЛЬНЫХ СТРУКТУР БЕЛКОВ
© 2021 г. А.Э. Сидорова, А.О. Луценко, Д.К. Шпигун, Е.В. Малышко, В.А. Твердислов
Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
E-mail: sky314bone@mail.ru
Поступила в редакцию 29.12.2020 г.
После доработки 04.01.2021 г.
Принята к публикации 11.01.2021 г.
Предложен и разработан метод описания спиральных структур разного уровня организации в бел-
ках. Метод позволяет охарактеризовать знак хиральности/спиральности и выполнить количествен-
ную оценку для α-спиралей, 310-спиралей и coiled-coil-суперспиралей, что существенно для разви-
тия разработанной ранее концепции о знакопеременных иерархиях хиральных структур в белках и
нуклеиновых кислотах. Достаточным условием метода является взаимное расположение α-углеро-
дов в спирали, что позволяет на порядок снизить количество обрабатываемой информации и явля-
ется значительным преимуществом при обработке больших массивов данных.
Ключевые слова: белки, хиральность, спирали, суперспирали, карта хиральности.
DOI: 10.31857/S0006302921030017
Белковые полипептидные цепи сложены ис-
вается в пространство между четырьмя остатками
ключительно остатками L-аминокислот [1]. В хо-
другой спирали («hole»). Последовательности,
де их укладки образуются, в частности, спираль-
входящие в состав суперспиралей, составляют до
ные и суперспиральные структуры. Наиболее
10% протеома организма [11, 12]. Самой простой
распространенной и энергетически выгодной ре-
конструкцией суперспирали является димер, при
гулярной белковой вторичной структурой явля-
этом ориентация α-спиралей может быть как па-
ется правая α-спираль [2, 3]. α-Спирали возника-
раллельной, так и антипараллельной. Встречают-
ют лишь на тех участках первичной структуры,
ся суперспирали, состоящие из семи и более
где имеются аминокислоты, способные последо-
α-спиралей [13]. Для суперспиралей из двух α-спи-
вательно образовать водородные связи с каждым
ралей шаг суперспирали составляет около 140 Å,
четвертым аминокислотным остатком.
для суперспиралей из трех-четырех α-спиралей -
Другой тип спиральных структур, спирали 310,
около 200 Å [14]. Каноническая последователь-
ность суперспирали состоит из гептад - повторя-
составляет 15-20% всех белковых спиралей [4].
ющихся семи аминокислотных остатков [15]. По-
Характерная длина спирали 310 - три-пять ами-
зиции остатков в гептаде принято обозначать как
нокислотных остатков [5, 6], и полный виток та-
a-b-c-d-e-f-g, где, как правило, в позициях a и
кой спирали образован ровно тремя аминокис-
d находятся гидрофобные остатки, формирую-
лотными остатками. Часто данный тип спиралей
щие гидрофобное ядро, а в позициях e и g - по-
локализуется на концах регулярных α-спиралей.
лярные аминокислотные остатки и имеют место
Существуют и другие типы спиральных вторич-
ионные взаимодействия [16]. Чередование гидро-
ных структур, но они встречаются гораздо реже.
фобных остатков попеременно с тремя и четырь-
Образование несколькими α-спиралями не-
мя остатками дает сдвиг периодичности: идеаль-
тривиальных конструкций заинтересовало иссле-
ная правая α-спираль имеет периодичность око-
дователей в результате исследований Л. Полинга
ло 3.65 остатка на оборот, а левая суперспираль с
и Ф. Крика [7, 8]: Полинг разработал модель
гептадным повтором - до 3.5 остатка на оборот
α-спирали, а Крик - модель «coiled coil», супер-
относительно оси пучка [15].
спирали из α-спиралей. Согласно концепции
Крика [8-10], для данного типа суперспирали ха-
В иерархичных структурах белков переходы с
рактерен особый тип упаковки боковых цепей -
нижнего на высший уровень сопровождаются че-
«knobs into holes». При такой упаковке аминокис-
редованием знака хиральности структурных
лотный остаток одной спирали («knob») уклады-
уровней L-D-L-D для белков и D-L-D-L для
421
422
СИДОРОВА и др.
ДНК, что связано не только с изменением про-
странственных характеристик, но и с изменением
механизмов их формирования, физических
свойств и молекулярно-биологические функций
[17, 18]. В развитии данной концепции суще-
ственным представляется получение количе-
ственных оценок хиральности белковых структур
разных иерархических уровней. Решению вопро-
са оценки хиральности спиральных и суперспи-
ральных структур белков посвящена настоящая
работа.
МЕТОД ОЦЕНКИ ЗНАКА ХИРАЛЬНОСТИ
СПИРАЛЬНЫХ СТРУКТУР БЕЛКОВ
Плоский характер и фиксированная длина
пептидных связей предопределяют практически
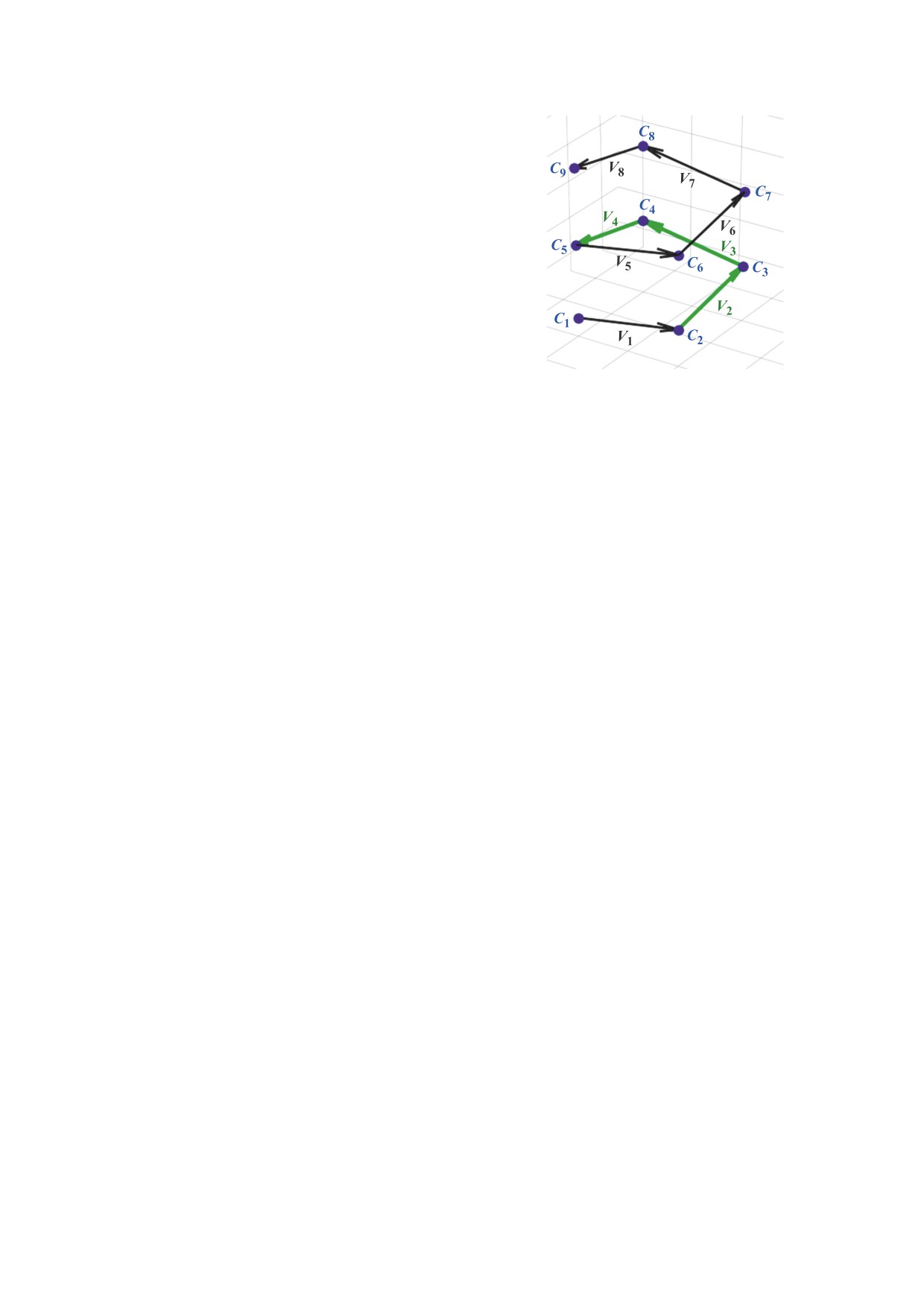
Рис. 1. Модельное изображение полипептидной цепи
правой спирали.
единственную возможность для сворачивания
пептидной цепи путем поворота плоскостей пеп-
тидных связей относительно их связей с α-угле-
рим на модели полипептидной цепи, состоящей
родными атомами Сα. Такое вращение было опи-
из n аминокислотных остатков и имеющей соот-
сано двугранными углами, значения которых ле-
ветственно n атомов Сα в качестве опорных точек.
жат в основе оценки хиральности белков методом
Между каждыми двумя соседними опорными
Рамачандрана, позволяющим увидеть преоблада-
точками строится вектор vi. Для n опорных точек
ющую конформацию элементов вторичной
получаем (n-1) векторов (рис. 1).
структуры биомолекул [19]. Однако оказалось,
что возможно существование конформаций по-
Далее для каждых трех последовательных век-
липептидной цепи и вне разрешенных областей
торов рассчитываем их смешанное произведение
карты Рамачандрана. (Подробный анализ раз-
(с учетом их координат):
личных методов оценки хиральности приведен в
работе [20].)
([v1,v2],v3) = (y1z2 - y2z1)x3 +
В ранее представленном нами методе оценки
+ (z1x2 - z2x1)y3 + (x1y2 - x2y1)z3.
(1)
степени хиральности в иерархических структурах
белков [20, 21] для определения знака хирально-
Сумма всех смешанных произведений позво-
сти вторичной структуры достаточным условием
ляет оценивать знак хиральности
анализа является только взаимное расположение
n-3
Сα. Для оценки знака хиральности было предло-
χ
([
v
,v
],
v
)
(2)
total
=∑
i
i+1
i+2
жено использовать значение косинуса угла между
i=1
вектором направления (суммой векторов между
соседними атомами Сα) и вектором произведения
Результат смешанного произведения - число,
(суммой всех векторных произведений). Этот ме-
знак которого определяет взаимное расположе-
тод был нами усовершенствован по следующим
ние векторов: для правой тройки векторов знак
причинам. Во-первых, в качестве меры хирально-
положительный, для левой - отрицательный.
сти бралась длина вектора произведений, что
Смешанные произведения не зависят друг от дру-
приводило к неправильной оценке хиральности.
га, любое изменение положения каждого атома
Например, для двух последовательных правых
влияет на несколько смешанных произведений
спиралей, соединенных разными способами, по-
(от одного до четырех, в зависимости от порядко-
лучаются кардинально разные результаты. Во-
вого номера атома в цепи).
вторых, для оценки знака хиральности использо-
Исследована возможность нормировки хи-
вался знак косинуса угла между вектором направ-
ральности спиральных белковых структур с со-
ления и вектором произведения. Это могло
блюдением следующего принципа: величина хи-
привести к неверному определению знака хи-
ральности должна стремиться к некоторому зна-
ральности.
чению при увеличении числа опорных точек,
В качестве экспериментальных объектов были
расположенных на том же объекте (т.е. при уве-
использованы структуры белков, представленные
личении плотности точек). Поэтому каждое сме-
в международной базе данных PDB [22].
шанное произведение нормировалось на опреде-
Сущность предлагаемого метода оценки хи-
ленную степень k средней длины используемых в
ральности спиральных структур белков рассмот-
нем векторов:
БИОФИЗИКА том 66
№ 3
2021
МЕТОДЫ ОПРЕДЕЛЕНИЯ ЗНАКА ХИРАЛЬНОСТИ
423
k
яся посредине между кривой, соединяющей геп-
2
⎛
⎞
1
тадные остатки в двух позициях. Хиральность
C
i
=⎜
i+ j
⎟
,
(3)
⎜
∑v
⎟
3
рассчитывается в зависимости от периодичности
⎝
j=0
⎠
спирали (число остатков в повторе), угла между
где Ci - нормировочный множитель.
соседними остатками и сдвигом вдоль оси в рас-
Подбор степени k осуществлялся исходя из
чете на аминокислоту. Знак хиральности опре-
следующего: поскольку основными объектами
деляется по знаку τ - для правых структур τ по-
ложительно, для левых - отрицательно. При
исследования являются белковые структуры с
последующем расчете поверхностная кривая по-
четко определенным расположением атомов уг-
лучилась левой. Следует отметить, что в представ-
лерода, в качестве эталона была взята цилиндри-
ческая винтовая линия с равномерно располо-
ленных методах не учитывалась возможность то-
женными точками. Исследование показало, что
го, что суперспираль может быть правозакручен-
ной. Таким образом, данные подходы не дают
для сохранения конечной ненулевой хиральности
адекватной оценки знака хиральности суперспи-
при неограниченном увеличении числа точек
ральных структур.
следует взять степень, равную пяти.
Окончательное выражение для нормирован-
В предлагаемом нами методе для оценки знака
ной хиральности имеет вид:
хиральности суперспиральных белковых струк-
тур типа «coiled coil» в качестве начальных усло-
n-3
([
,v
i+1
],
v
i+2
)
вий используется информация о взаимном рас-
i
χ
norm
(4)
=∑v
положении α-углеродов аминокислотных остат-
C
i=1
i
ков цепи. В основе метода лежит определение
Метод реализован в виде компьютерной про-
направления закрутки каждой отдельной α-спи-
граммы на языке Python 3.7.
рали относительно оси всей суперспирали. В ка-
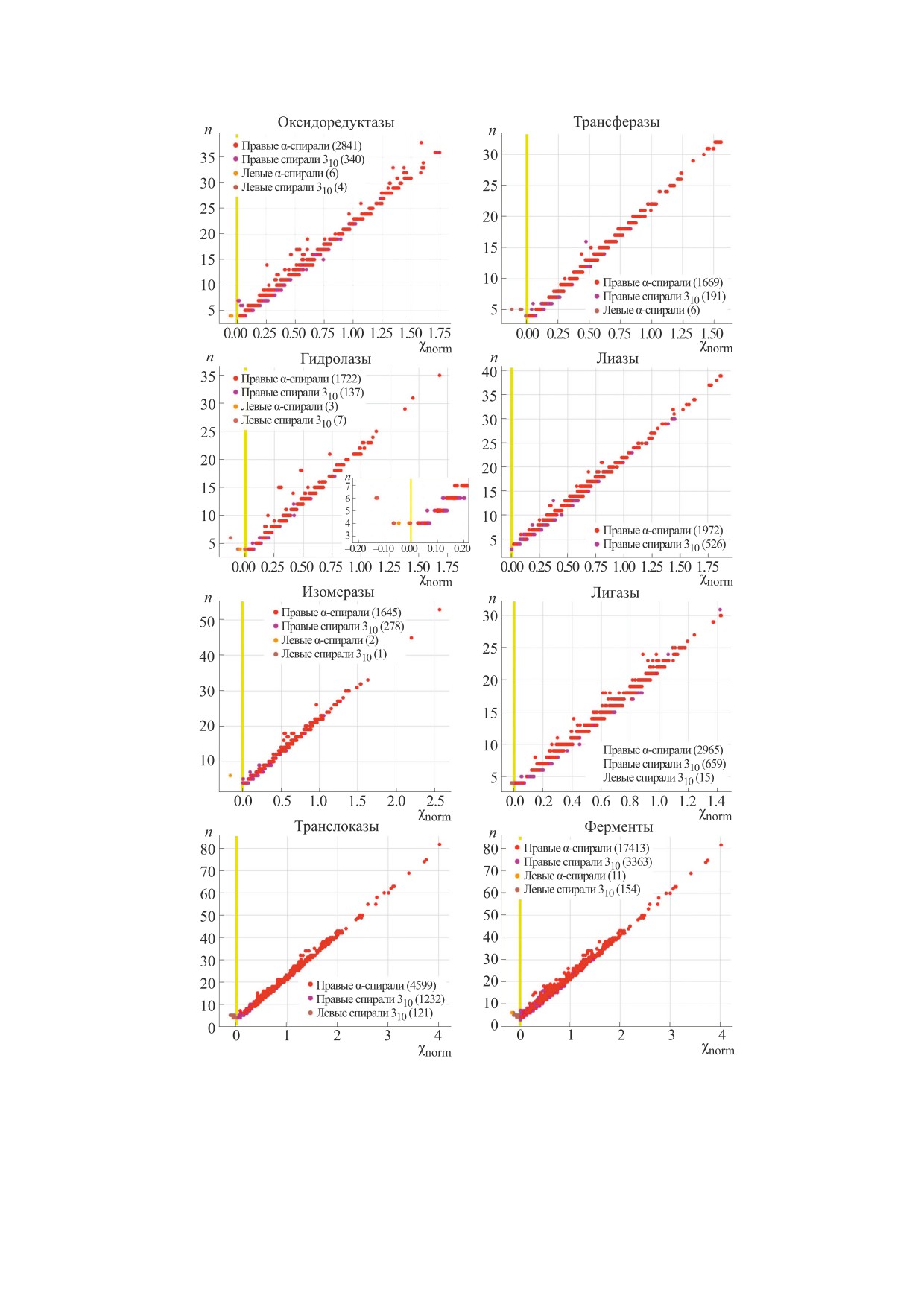
Посредством разработанного метода получе-
честве критерия для определения этого направле-
ны карты хиральности для белков-ферментов,
ния выбран угол между осью суперспирали и ося-
представленных в базе данных PDB (рис. 2).
ми образующих ее спиралей. Ориентация этого
угла относительно оси суперспирали (по часовой
Анализ представленных данных свидетельству-
или против часовой стрелки) служит показателем
ет о том, что, во-первых, α-спирали и 310-спирали
для определения знака хиральности суперспира-
представлены в основном правыми структурами
ли. Для определения ориентации угла использу-
(левые α-спирали составляют 0.06% от общего ко-
ется свойство векторного произведения образо-
личества α-спиралей, а левые спирали 310 - 4.38%
вывать правые тройки векторов.
от общего количества спиралей 310), что адекватно
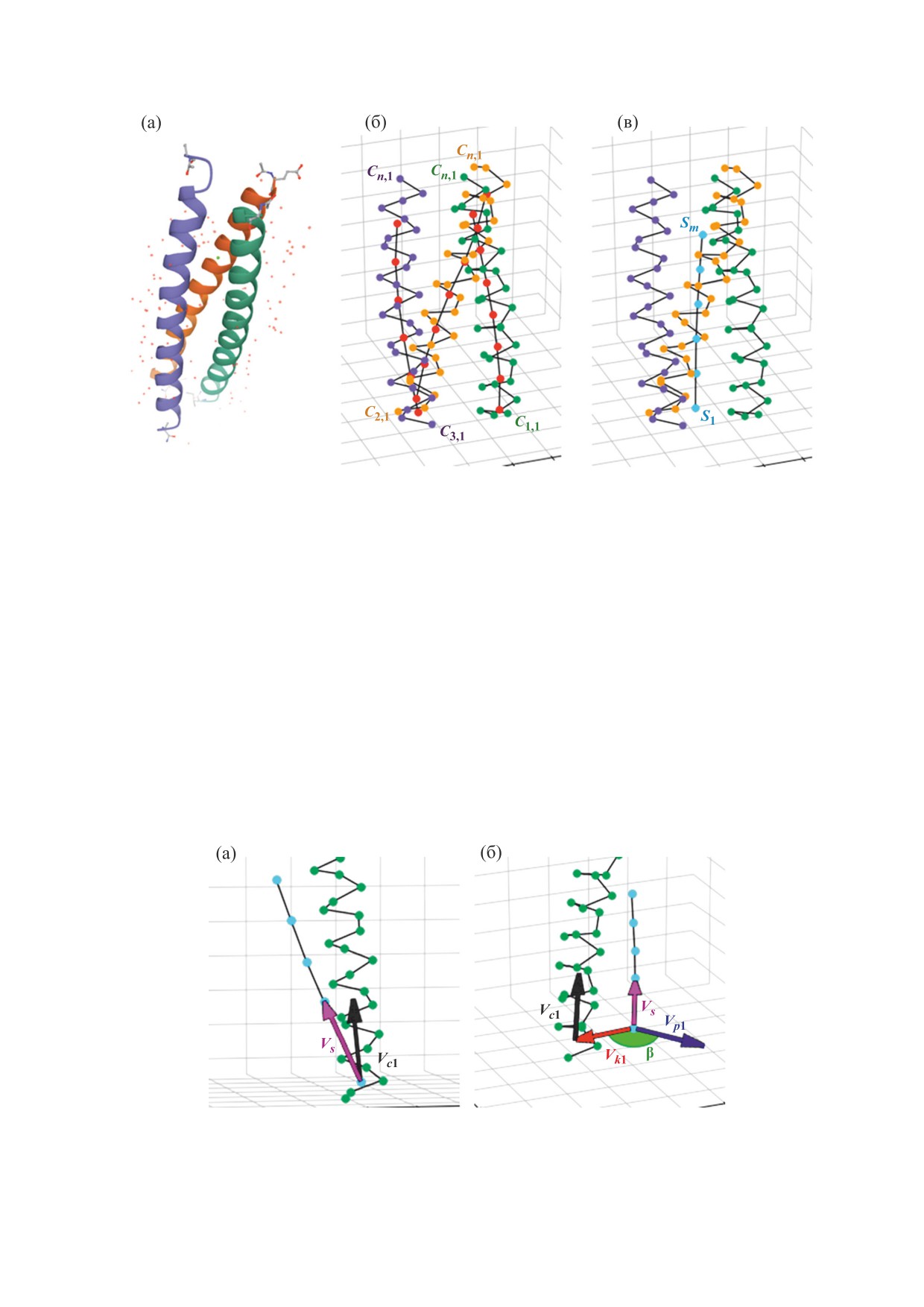
В качестве примера рассмотрен белок 1BB1
отражает данные, представленные в научной лите-
ратуре. Нормированное значение хиральности ли-
из трех α-спиралей (на рис. 3а показано его отоб-
нейно зависит от числа атомов в спирали.
ражение в базе данных PDB). Поскольку в α-спи-
рали на один виток в среднем приходится 3.6 ами-
МЕТОД ОЦЕНКИ ЗНАКА ХИРАЛЬНОСТИ
нокислотных остатка, в качестве условного цен-
СУПЕРСПИРАЛЬНЫХ СТРУКТУР БЕЛКОВ
тра витка спирали взят геометрический центр
четырех последовательных атомов (для первого
Со времени открытия структур типа «coiled
витка - точки С1, С2, С3, С4 и т.д.) - точки осей
coil» предпринимались попытки их математиче-
спиралей А1, А2, …, An, через которые проводится
ского описания. Согласно работе [23], шаг супер-
спирали является ключевым фактором, опреде-
ось α-спирали (рис. 3б). Далее строятся «средняя
ляющим внутри- и межмолекулярные взаимо-
спираль», где геометрический центр первых ато-
действия. В соответствии с экспериментальными
мов каждой α-спирали (С1,1, С2,1, С3,1) является
данными для суперпиральных структур, состоя-
первой точкой «средней спирали» и т.д., и ось
щих из двух спиралей, среднее значение длины
«средней спирали» (рис. 3в). В общем случае как
шага составляет около 140 Å, что согласуется с на-
ось средней спирали, так и оси α-спиралей явля-
блюдаемым количеством остатков на виток в
ются ломаными линиями в трехмерном про-
α-спиралях глобулярных белков. В работе [24]
странстве. Но для данного метода достаточно ин-
была предложена математическая модель опреде-
формации о взаимных направлениях осей только
ления знака хиральности суперспиральной
в узком поперечном сечении суперспирали (два
структуры с учетом взаимосвязи между шагом и
полных витка α-спиралей), на таком интервале
радиусом. В работе [23] изучается хиральность
оси можно рассматривать как прямые линии, что
структур типа «coiled coil» и предлагается опреде-
позволяет непосредственно строить для них век-
лять хиральность (τ) «поверхностной кривой» от-
торы направления. Поскольку метод оценивает
дельных α-спиралей. Под поверхностной кривой
лишь знак хиральности, такое приближение
автором понимается некоторая линия, находяща-
вполне уместно.
БИОФИЗИКА том 66
№ 3
2021
424
СИДОРОВА и др.
Рис. 2. Карты хиральности белков-ферментов. По горизонтальной оси - нормированное значение хиральности, по
вертикальной оси - длина вторичной структуры в аминокислотных остатках.
БИОФИЗИКА том 66
№ 3
2021
МЕТОДЫ ОПРЕДЕЛЕНИЯ ЗНАКА ХИРАЛЬНОСТИ
425
Рис. 3. Схематическое изображение работы метода по определению знака хиральности структуры типа «coiled coil» на
примере белка 1BB1.
Определение знака хиральности суперспирали
т.е. по часовой стрелке (суперспираль в этом слу-
сводится к определению направления угла между
чае является левой), то векторы vki и vpi будут про-
осью суперспирали и осью составляющей спира-
тивонаправлены (рис. 4б). Если вектор vсi откло-
ли. Геометрический анализ суперспиралей пока-
нен от вектора vs влево (суперспираль правая), то
зывает, что для левой суперспирали составляю-
щие спирали будут отклонены в правую сторону
векторы vki и vpi будут сонаправлены. Величина
относительно оси суперспирали и угол между
угла между vki и vpi определяется с помощью ска-
векторами vs и vсi будет отсчитываться против ча-
лярного произведения, которое для тупых углов
совой стрелки (рис. 4а). Воспользуемся свой-
отрицательно, для острых - положительно.
ством векторного произведения образовывать
правые тройки векторов. Обозначим вектор от
Оценка знака хиральности суперспирали рас-
оси суперспирали к оси i-й спирали через vki, а
считывается с помощью усреднения значения ко-
векторное произведение векторов vсi и vs - через
синуса соответствующего угла для всех спиралей,
vpi. Если вектор vсi отклонен от вектора vs вправо,
образующих суперспираль:
Рис. 4. Определение знака хиральности структуры типа «coiled coil» по углу между векторами на примере белка 1BB1.
БИОФИЗИКА том 66
№ 3
2021
426
СИДОРОВА и др.
Расчетные параметры структур типа «coiled coil»
Направле-
PDB ID
Количество
Номера
Средний
Средний
Цепи
ние
Происхождение
белка
спиралей
структур
косинус угла
угол
закрутки
1BB1
3
A,B,C
1,2,3
-0,86544
151,61627
L
Искусственный
1COI
3
A
1,2,3
-0,95287
164,27641
L
Искусственный
1D7M
2
A,B
1,2
-0,89340
153,30395
L
Природный
1L8D
2
A
1,2
-0,83381
146,49241
L
Природный
1L8D
2
B
3,4
-0,79023
142,20691
L
Природный
1NYH
2
A
1,2
-0,70155
134,55180
L
Природный
1P9I
2
A
1,2
-0,79532
142,68591
L
Неизвестно
1RH4
4
A
1,2,3,4
0,97138
12,60585
D
Искусственный
1T6F
2
A,B
1,2
-0,94825
161,48665
L
Природный
1WT6
3
A,B,D
1,2,3
-0,82796
146,74953
L
Природный
2HY6
7
A,B,C,D,E,F,G
1,2,3,4,5,6,7
-0,93137
160,34975
L
Природный
2V71
2
A,B
1,2
-0,50522
120,34623
L
Природный
2XU6
2
A,B
1,2
-0,92664
157,91675
L
Природный
3QH9
2
A
1,2
-0,99355
173,48756
L
Природный
4BRY
2
A,B
1,2
-0,89581
153,61220
L
Природный
4BWD
2
A,B
1,2
-0,97126
166,23026
L
Природный
4FXX
2
A
1,2
-0,80737
143,83989
L
Природный
4JBZ
3
A,B,C
19,37,55
-0,93823
162,33884
L
Природный
4YTO
2
A,B
1,4
-0,91952
156,85593
L
Природный
5Al6
4
A
1,2,3,4
-0,96225
166,96110
L
Природный
5D3A
2
A,B
1,2
-0,85570
148,83745
L
Природный
5JXC
3
A,B,C
1,2,3
-0,78597
142,28240
L
Природный
5JXC
3
D,E,F
4,5,6
-0,82593
147,97427
L
Природный
5LXN
2
A,B
1,2
-0,77531
140,83288
L
Природный
5LXO
2
A,B
1,2
-0,69884
134,33381
L
Природный
5M48
3
A
1,2,3
-0,87375
151,17191
L
Природный
5NFD
2
A
1,2
-0,95346
162,45090
L
Природный
5T1Y
2
A
1,2
-0,95321
162,40315
L
Природный
5UXT
3
A,B,C
1,2,3
-0,92353
160,90101
L
Неизвестно
1FB1
5
A,B,C,D,E
9,17,26,34,42
-0,32922
110,45772
L
Природный
1H12
6
A
4,7,10,12,14,17
-0,70685
141,34958
L
Природный
Для расчетов использовали координаты ато-
q
мов из файлов PDB. Метод опробован на 30 су-
1
χ
=
∑cos(β
),
(5)
norm
i
перспиралях, из которых 29 были идентифициро-
q
i=1
ваны как левые, а суперспираль из искусственно-
го белка 1RH4 определилась как правая. Данные
где βi
— угол между направлением оси i-й
α-спирали и направлением оси суперспирали,
расчетных параметров оценки хиральности
т.е. между векторами vki и vpi; q - число спиралей в
структур типа «coiled coil» представлены в табли-
суперспирали.
це. Анализ 30 различных суперспиралей показал,
БИОФИЗИКА том 66
№ 3
2021
МЕТОДЫ ОПРЕДЕЛЕНИЯ ЗНАКА ХИРАЛЬНОСТИ
427
что такие структуры является в абсолютном боль-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
шинстве левыми, что полностью согласуется с из-
Настоящая работа не содержит описания ис-
вестными из научной литературы данными, а так-
следований с использованием людей и животных
же с концепцией хиральной иерархии белковых
в качестве объектов.
структур [17, 18].
Представленные нами методы оценки спи-
СПИСОК ЛИТЕРАТУРЫ
ральных и суперспиральных структур отличаются
1.
А. В. Финкельштейн и О. Б. Птицын, Физика бел-
небольшим количеством необходимой для его
ка: курс лекций с цветными и стереоскопическими
использования информации, а также простотой
иллюстрациями и задачами, 3е изд. (КДУ, М., 2012).
вычислений. На основе методов реализованы
2.
L. Pauling and R. B. Corey, Proc. Natl. Acad. Sci. USA
компьютерные программы на языке Python 3.7.
37, 256 (1951).
Графический интерфейс реализован с помощью
3.
L. Pauling and R. B. Corey, Proc. Natl. Acad. Sci. USA
библиотеки tkinter. Среднее время расчета струк-
37, 729 (1951).
туры - 50 мс.
4.
D. J. Barlow and J. M. Thornton, J. Mol. Biol. 201, 601
(1988).
ЗАКЛЮЧЕНИЕ
5.
M. N. Fodje and S. Al-Karadaghi, Protein Eng. 15, 353
(2002).
Представлены методы идентификации знака
6.
J. S. Richardson and D. C. Richardson, Science 240,
хиральности спиральных структур белков и су-
1648 (1988).
перспиралей «coiled coil». Достаточным условием
7.
L. Pauling, R. B. Corey, and H. R. Branson, Proc. Natl.
методов является взаимное расположение α-угле-
Acad. Sci. USA 37, 205 (1951).
родов в спирали, что позволяет на порядок сни-
8.
F. H. C. Crick, Nature 170, 882 (1952).
зить количество обрабатываемой информации и
является явным преимуществом при обработке
9.
F. H. C. Crick, Acta Crystallogr. 6, 685 (1953a).
больших массивов данных. На основе методов ре-
10.
F. H. C. Crick, Acta Crystallogr. 6, 689 (1953b).
ализованы компьютерные программы на языке
11.
A. Rose, S. J. Schraegle, E. A. Stahlberg, and I. Meier,
Python 3.7.
BMC Evol Biol. 5, 66 (2005).
Анализ представленных карт хиральности α- и
12.
O. J. Rackham, M. Madera, C. T. Armstrong, et al.,
310-спиралей свидетельствует о том, что α-спира-
J. Mol. Biol. 403, 480 (2010).
ли и 310-спирали представлены в основном пра-
13.
E. Moutevelis and D. N. Woolfson, J. Mol. Biol. 385,
726 (2009).
выми структурами, а суперспирали «coiled coil» -
левыми. Полученные результаты соответствуют
14.
J. Seo and C. Cohen, Proteins 15, 223 (1993).
теории знакопеременных хиральных структур и
15.
A. Lupas and M. Gruber, Adv. Prot. Chem. 70, 37
адекватно отражает данные, представленные в
(2005)
научной литературе. Нормированное значение
16.
Y. B. Yu. Adv. Drug Deliv. Rev. 54 (8), 1113 (2002)
хиральности линейно зависит от числа атомов в
17.
В. А. Твердислов, Биофизика 58 (1), 159 (2013).
спирали.
18.
В. А. Твердислов и Е. В. Малышко, Успехи физ.
наук 189, 375 (2019).
ФИНАНСИРОВАНИЕ РАБОТЫ
19.
G. N. Ramachandran, C. Ramakrishnan, and V. Sa-
sisekharan, J. Mol Biol. 7, 95 (1963).
Исследование выполнено при поддержке
20.
A. E. Sidorova, E. V. Malyshko, A. R. Kotov, et al.,
Междисциплинарной научно-образовательной
Biophysics 64 (2), 155 (2019).
школы Московского университета «Фундамен-
21.
A. E. Sidorova, N. T. Levashova, E. V. Malyshko, and
тальные и прикладные исследования космоса» и
V. A. Tverdislov, Moscow Univ. Phys. Bull. 74 (3), 213
частичной финансовой поддержке Российского
(2019).
научного фонда (проект № 19-74-00082).
22.
(accessed on 15 December 2020).
23.
G. N. Phillips, Proteins 14, 425 (1992).
КОНФЛИКТ ИНТЕРЕСОВ
24.
R. D. B. Fraser and T. P. MacRae, Conformation in Fi-
Авторы заявляют об отсутствии конфликта
brous Proteins and Related Synthetic Polypeptides (Aca-
интересов.
demic Press, Lond., 1973).
БИОФИЗИКА том 66
№ 3
2021
428
СИДОРОВА и др.
Methods for Determining the Chirality Sign of Helical
and Superhelical Protein Structures
A.E. Sidorova, A.O. Lutsenko, D.K. Shpigun, E.V. Malyshko, and V.A. Tverdislov
Faculty of Physics, Lomonosov Moscow State University,
Leninskie Gory 1/2, Moscow, 119991 Russia
A method for describing helical structures of different levels of organization in proteins has been developed. The
proposed method can be used to characterize the sign of chirality/helicity and quantify α-helices, 310-helices
and coiled coil structures; it is important for the development of the previously developed concept of sign-alter-
nating chiral hierarchies of DNA and protein structures. A sufficient condition for this method is the relative lo-
cation of α-carbons in the helix. Satisfying this condition ensures that the amount of processed information can
be reduced by an order of magnitude thereby offering an evident benefit for processing large data sets.
Keywords: proteins, chirality, helices, superhelices, chirality map
БИОФИЗИКА том 66
№ 3
2021