БИОФИЗИКА, 2021, том 66, № 3, с. 429-439
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.325
ТЕРМИЧЕСКАЯ ИНАКТИВАЦИЯ ЦИСТЕИНОВЫХ ПРОТЕАЗ:
«КЛЮЧЕВЫЕ СТАДИИ»
© 2021 г. В.А. Королева, С.С. Ольшанникова, М.Г. Холявка, В.Г. Артюхов
Воронежский государственный университет, 394018, Воронеж, Университетская пл., 1
E-mail: holyavka@rambler.ru
Поступила в редакцию 30.11.2019 г.
После доработки 17.06.2020 г.
Принята к публикации 04.02.2021 г.
Изучены процессы термоинактивации фицина, бромелина и папаина в растворенном состоянии и
иммобилизованных на матрицах среднемолекулярного (200 кДа) и высокомолекулярного (350 кДа)
хитозанов. Показано, что нативный фицин инактивировался при 70°С после 10 мин нагревания,
бромелин в растворе сохранял до 40% активности после 60 мин инкубации при 60 и 70°С, свобод-
ный папаин был устойчив при 70°С в течение всего времени экспозиции (60 мин). Для растворимых
образцов фицина, бромелина и папаина характерна полная инактивация при 80 и 90°С после 10 мин
инкубации. Иммобилизация фицина на матрицах обоих типов хитозанов увеличила его термоста-
бильность (при 70°С каталитическая способность фермента составляла не менее 20%). Фицин, им-
мобилизованный на среднемолекулярном и высомолекулярном хитозанах, полностью инактивиро-
вался при 80 и 90°С после 10 мин инкубации, тогда как сорбированные на матрице хитозана папаин
и бромелин при названных условиях сохраняли более 10% каталитической способности от ее на-
чального уровня.
Ключевые слова: фицин, бромелин, папаин, иммобилизация, термическая инактивация, хитозан.
DOI: 10.31857/S0006302921030029
Протеазы растительного происхождения ис-
турах по сравнению с теми, которые используют-
пользуются в различных сферах производства. В
ся в промышленных реакторах [14].
пищевой промышленности эти ферменты выпол-
Фицин (КФ 3.4.22.3) получают из высушенно-
няют роль смягчения мяса, в пивоварении их
го латекса растений рода Ficus [15]. Известно, что
применяют для осветления напитков, использу-
фицин встречается в природе во множественных
ют в гидролизе глютена, для выделки кожи и дру-
формах [16], разделяемых ионообменной хрома-
гих целей. Протеазы входят в состав различных
тографией [17]. Оптимальный диапазон pH для
детергентов, в медицине и ветеринарии на их ос-
фермента составляет от 5.0 до 8.0, а оптимальная
нове изготавливают ранозаживляющие препара-
температура - от 45 до 55°C [18].
ты [1-13].
Папаин (КФ 3.4.22.2) выделяют из латекса
Особый интерес представляют цистеиновые
Carica papaya [19, 20]. Помимо своей протеазной
протеолитические ферменты, а именно фицин,
активности папаин также проявляет амидазную,
бромелин и папаин, из-за их широкой субстрат-
эстеразную, трансамидазную, трансэстеразную и
ной специфичности и высокой активности в об-
тиолэстеразную активность [21, 22]. Оптималь-
ласти повышенных температур. Общеизвестно,
ный диапазон рН для проявления каталитиче-
что высокие температуры предотвращают риск
ской способности папаина варьирует в зависимо-
заражения нежелательной микрофлорой целевых
сти от природы субстрата в пределах 5.0-7.0. Этот
продуктов и самих биокатализаторов, улучшают
фермент более термоустойчив по сравнению с
растворимость некоторых субстратов. Вместе с
другими протеазами [23].
тем повышение температуры не только интенси-
фицирует процесс образования фермент-суб-
Бромелин экстрагируют из стеблей (КФ
стратного комплекса, но также может приводить
3.4.22.32) и незрелых плодов (КФ 3.4.22.33) Anan-
к денатурации фермента и снижению его катали-
as comosus из семейства Bromeliaceae. Оптималь-
тической функции. Следовательно, необходимо
ный уровень pH для активности бромелина 6.0-
получать препараты на основе природных биока-
8.5 для большинства субстратов при температуре
тализаторов, которые будут подвержены терми-
50-60°C. Бромелин из плодов имеет более высо-
ческой инактивации при более высоких темпера-
кую протеолитическую активность по сравнению
429
430
КОРОЛЕВА и др.
с ферментом из стеблей и более широкую специ-
мобилизован в полимерные нановолокна [39], на
фичность для пептидных связей [18, 24].
глиоксил-агарозе [40], что существенно повыси-
ло стабильность фермента.
Несмотря на широкий спектр применения ци-
стеиновых протеаз, растворимые ферменты су-
Изучение процессов термической инактива-
щественным образом подвергаются воздействию
ции ферментов является одной из центральных
экстремальных факторов (в том числе высоких
проблем биофизики и позволяет выявить меха-
температур и автолизу), приводящих к их инакти-
низмы регулирования этими процессами. В связи
вации посредством нарушения нативной кон-
с вышесказанным целью нашей работы было ис-
формации и агрегации.
следование «ключевых стадий» процессов терми-
ческой инактивации свободных и иммобилизо-
Иммобилизация на нерастворимом носителе
ванных на матрице хитозана фицина, папаина и
позволяет повысить термостабильность фермен-
бромелина.
та: его молекулы закрепляются на матрице поли-
мера, что затрудняет разворачивание его глобулы
и препятствует тепловой денатурации, при этом
МАТЕРИАЛЫ И МЕТОДЫ
также ограничиваются межмолекулярные кон-
В качестве объектов исследования были вы-
такты и предотвращается процесс автолиза про-
браны фицин, папаин и бромелин фирмы Sigma
теолитических биокатализаторов [25].
(США). В качестве носителя использовали кис-
Хитозан получают путем деацетилирования хи-
лоторастворимые хитозаны, синтезированные
тина. Он представляет собой неразветвленный по-
ЗАО «Биопрогресс» (Щелково Московской обла-
лимер, образованный β-(1,4)-связанными глюко-
сти), - среднемолекулярный (Mr = 200 кДа, сте-
заминовыми мономерами; гидроксильные и ами-
пень деацетилирования - 82.0%) и высокомоле-
ногруппы являются мишенями для химических
кулярный (Mr = 350 кДа, степень деацетилирова-
модификаций, направленных на получение подхо-
ния - 94.85%).
дящих материалов для различных целей. Хитозан
характеризуется высокой гидрофильностью, не-
Иммобилизацию фицина, папаина и бромели-
токсичностью, биосовместимостью и биоразлагае-
на на матрице хитозана осуществляли адсорбцион-
мостью, что позволяет применять его в фармацев-
ным методом. К 50 мг хитозана добавляли 1 мл бу-
тической технологии [26]. Молекулы хитозана со-
ферного раствора фермента (в концентрации
держат катионы, представленные аминогруппами,
1 мг/мл для фицина и папаина, 5 мг/мл для броме-
и анионы в виде гидроксильных групп; следова-
лина), инкубировали в течение 4 ч (со среднемоле-
тельно, хитозаны могут сорбировать ферменты,
кулярным хитозаном) и 5 ч (с высокомолекуляр-
полисахариды и ионы металлов за счет электроста-
ным хитозаном) c периодическим перемешивани-
тических взаимодействий [27-31].
ем. Для иммобилизации фицина на матрицах
среднемолекулярного и высокомолекулярного хи-
Иммобилизация протеолитических фермен-
тозанов использовали 0.05 М глициновый буфер с
тов на хитозане может быть выполнена методом
рН 10.0 и 8.6 соответственно. Для сорбции папаина
простой адсорбции [32]. Есть несколько механиз-
на матрицах среднемолекулярного и высокомоле-
мов взаимодействия между белками и полисаха-
кулярного хитозанов применяли 0.05 М глицино-
ридами, основанные на электростатическом при-
вый буфер с рН 9.0; для иммобилизации бромели-
тяжении между противоположно заряженными
на на матрицах среднемолекулярного и высокомо-
группами в соответствующих условиях раствора
лекулярного хитозанов - 0.05 М трис-глициновый
[33] и/или за счет гидрофобных или ван-дер-ва-
буфер с рН 9.0 и 8.5 соответственно [41].
альсовых взаимодействий как с последующим ко-
валентным присоединением к подложке, так и
Количество белка в иммобилизованном пре-
без него [34, 35].
парате измеряли модифицированным методом
Лоури [42]. Сущность модификации заключалась
Существует множество примеров использова-
в том, что на первом этапе анализа осуществляли
ния иммобилизованных протеаз [36]. В частно-
разрушение связей и взаимодействий между мат-
сти, была проведена иммобилизация папаина на
рицей носителя и молекулой фермента. Для этого
композитных гранулах, модифицированных во-
обрабатывали иммобилизованный препарат рас-
локнистым полимером хитозан/глина. Папаин
твором K,Na-тартрата, приготовленном на 1 М
обладает металлсвязывающими свойствами, бла-
NaOH при 50°С в течение 10 мин.
годаря присутствию сульфгидрильных групп в его
В качестве субстрата для определения актив-
активном центре, поэтому после иммобилизации
ности ферментов применяли азоказеин [43] и N-
фермент был использован для удаления ртути из
ее водного раствора. [37]. Хитозан служил матри-
бензол-DL-аргинин-пара-нитроанилид [44]. Для
цей для иммобилизации бромелина и папаина.
активации ферментов в данном исследовании
Полученные биокатализаторы были использова-
применяли раствор 1 мМ L-цистеина [45].
ны в реакторе непрерывного действия для стаби-
Активность фермента выражали в абсолютных
лизации белков белого вина [38]. Фицин был им-
(ед/мг) и относительных (%) величинах.
БИОФИЗИКА том 66
№ 3
2021
ТЕРМИЧЕСКАЯ ИНАКТИВАЦИИ ЦИСТЕИНОВЫХ ПРОТЕАЗ
431
явления каталитической активности фермента
температуре - при 37°С для фицина, при 60°С для
бромелина и папаина. После инкубации добавля-
ли 800 мкл 5% раствора трихлоруксусной кисло-
ты, инкубировали 5 мин при -4°C, а затем цен-
трифугировали в течение 3 мин при 13000 об/мин
для удаления негидролизованного азоказеина. К
1200 мкл супернатанта добавляли 240 мкл 3% рас-
твора NaOH для нейтрализации кислоты, после
чего измеряли оптическую плотность опытной
пробы при длине волны 410 нм в кювете с длиной
оптического пути 1 см. Контрольная проба содер-
жала 400 мкл азоказеина, 800 мкл трихлоруксус-
ной кислоты; 50 мг образца и 200 мкл буфера вно-
сили последними: после проведения всех
перечисленных выше манипуляций, т.е. непо-
средственно перед измерением оптической плот-
ности контрольных образцов.
Определение каталитической активности проте-
аз при использовании N-бензол-DL-аргинин-пара-
нитроанилида в качестве субстрата. К 400 мкл рас-
твора фермента в 50 мМ трис-HCl-буфере с рН 7.5
(или к суспензии 50 мг иммобилизованного об-
разца в 400 мкл 50 мМ трис-HCl-буфера с рН 7.5)
добавляли 400 мкл раствора N-бензол-DL-арги-
нин-пара-нитроанилида (1 мг/мл) и 400 мкл 1 мМ
раствора L-цистеина в 50 мМ трис-HCl-буфере с
рН 7.5. Инкубировали раствор 30 мин при 37°С
для фицина, при 60°С - для бромелина и папаи-
на. Далее останавливали реакцию 800 мкл 1 М
HCl. Измеряли оптическую плотность образцов
при длине волны 410 нм.
Процесс термической инактивации нативных
и иммобилизованных цистеиновых протеиназ
изучали при температурах 60, 70, 80 и 90°С в тече-
ние 10, 20, 30, 40, 50 и 60 мин с последующим из-
мерением каталитической активности.
Все экспериментальные исследования осу-
ществляли минимум в восьмикратной повторно-
сти. Статистическую обработку результатов про-
водили с помощью пакета прикладных программ
«Stadia 8.0 (Professional)». Статистическую значи-
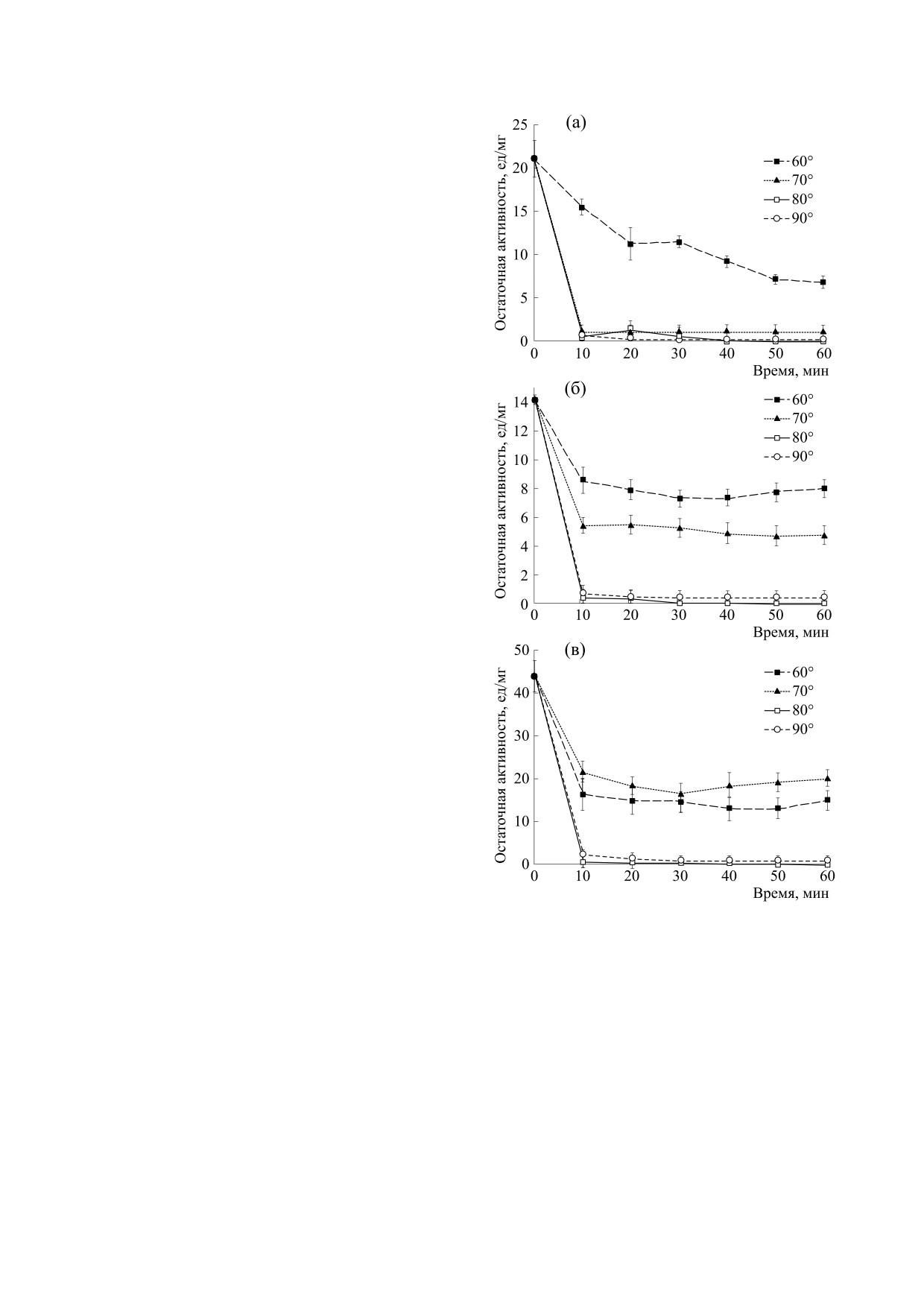
Рис. 1. Зависимости каталитической активности фи-
цина (а), бромелина (б) и папаина (в) от температуры
мость различий величин контрольных и опытных
инкубации: 1 - нативный фермент, 2 - фермент, им-
показателей определяли по t-критерию Стьюден-
мобилизованный на среднемолекулярном хитозане,
та (при p < 0.05), поскольку все показатели харак-
3 - фермент, иммобилизованный на высокомолеку-
теризовались нормальным распределением.
лярном хитозане. Время инкубации 30 мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определение каталитической активности проте-
аз при использовании азоказеина в качестве суб-
Изучение зависимости каталитической активно-
страта. К 200 мкл раствора свободного фермента
сти фицина, бромелина и папаина от температуры.
в 50 мМ трис-HCl-буфере с рН 7.5, содержащему
Каталитическая активность свободного и иммо-
1 мМ раствор цистеина (или к суспензии 50 мг
билизованного на матрицах хитозана фицина в
иммобилизованного образца в 200 мкл 50 мМ
зависимости от температуры представлена на
трис-HCl-буфера с рН 7.5, содержащей 1 мМ рас-
рис. 1а. В ходе наших экспериментов было уста-
твор L-цистеина), добавляли 400 мкл 1% раствора
новлено, что для всех трех образцов диапазон ра-
азоказеина (в 50 мМ трис-HCl-буфере, рН 7.5) и
бочих температур находится между 37 и 60°С, од-
инкубировали 30 мин при оптимальной для про-
нако при 70°С свободный фермент был полно-
БИОФИЗИКА том 66
№ 3
2021
432
КОРОЛЕВА и др.
стью термически инактивирован, в то время как
сорбированный фермент на двух видах хитозана
сохранял порядка 50% активности от нативного.
По сообщениям других авторов фицин проявляет
свои каталитические свойства в диапазоне от 40
до 60°С [46, 47]. В этом случае при 70°С происхо-
дит термоинактивация фицина [48].
Оптимальная температура для бромелина ва-
рьирует в пределах 55-60°С [3]. В нашей работе
диапазон рабочих температур бромелина нахо-
дится между 50 и 70°С, а для иммобилизованного
на хитозане фермента - от 40 до 70°С (рис. 1б).
Однако при 80°С свободный фермент был терми-
чески инактивирован на 76%, в то время как сор-
бированный на среднемолекулярном хитозане
фермент сохранял 69% активности от максималь-
ного значения, а иммобилизованный на высоко-
молекулярном хитозане - 79%.
Для растворимого и сорбированного папаина
характерна высокая активность при температурах
соответственно 50 и 70°С (рис. 1в). Однако при
80°С свободный фермент был термически инак-
тивирован на 32%, в то время как при иммобили-
зации на среднемолекулярном хитозане сохранял
порядка 80% активности от максимального зна-
чения. Препарат фермента и высокомолекуляр-
ного хитозана проявлял стабильную активность
независимо от температуры инкубации в диапа-
зоне температур 50-80°С. По данным других ис-
следователей папаин высоко активен при темпе-
ратурах 50-75°С [37, 49, 50].
Исследование закономерностей процессов
термической инактивации фицина, бромелина и па-
паина. В следующей серии экспериментов мы
исследовали процесс термической инактивации
нативных фицина, бромелина, папаина при тем-
пературах 60, 70, 80 и 90°С. Для этого растворы
белков инкубировали в интервале времени 10-
60 мин при различных температурах (60-90°С) с
последующим определением каталитической ак-
тивности. На рис. 2 показана динамика процес-
сов инактивации ферментов.
Каталитическая способность фицина, прогре-
ваемого при температуре 60°С, снижалась сразу
после 10 мин инкубации, далее плавно уменьша-
лась и после 60 мин составляла 32%. При 70, 80 и
Рис. 2. Зависимости каталитической активности фи-
90°С фермент был полностью термически инак-
цина (а), бромелина (б) и папаина (в) от времени тер-
тивирован после 10 мин нагревания (рис. 2а).
мической инактивации.
Для бромелина было характерно сохранение
ферментативной активности на 56 и 34% при ин-
кубации соответственно при 60 и 70°С в течение
времени нагревания практически не изменялась.
60 мин. После 10 мин нагревания при 80 и 90°С
После 10 мин при 80 и 90°С фермент утрачивал
фермент был полностью инактивирован
практически 100% своей ферментативной спо-
(рис. 2б).
собности (рис. 2в).
Для папаина мы наблюдали потерю более 60%
Далее мы определили процент сохранения ак-
каталитической способности от первоначального
уровня после 10 мин инкубации при 60 и 70°С,
тивности фицина, бромелина и папаина по срав-
при этом остаточная активность при увеличении
нению с ферментами, не подвергнутыми нагрева-
БИОФИЗИКА том 66
№ 3
2021
ТЕРМИЧЕСКАЯ ИНАКТИВАЦИИ ЦИСТЕИНОВЫХ ПРОТЕАЗ
433
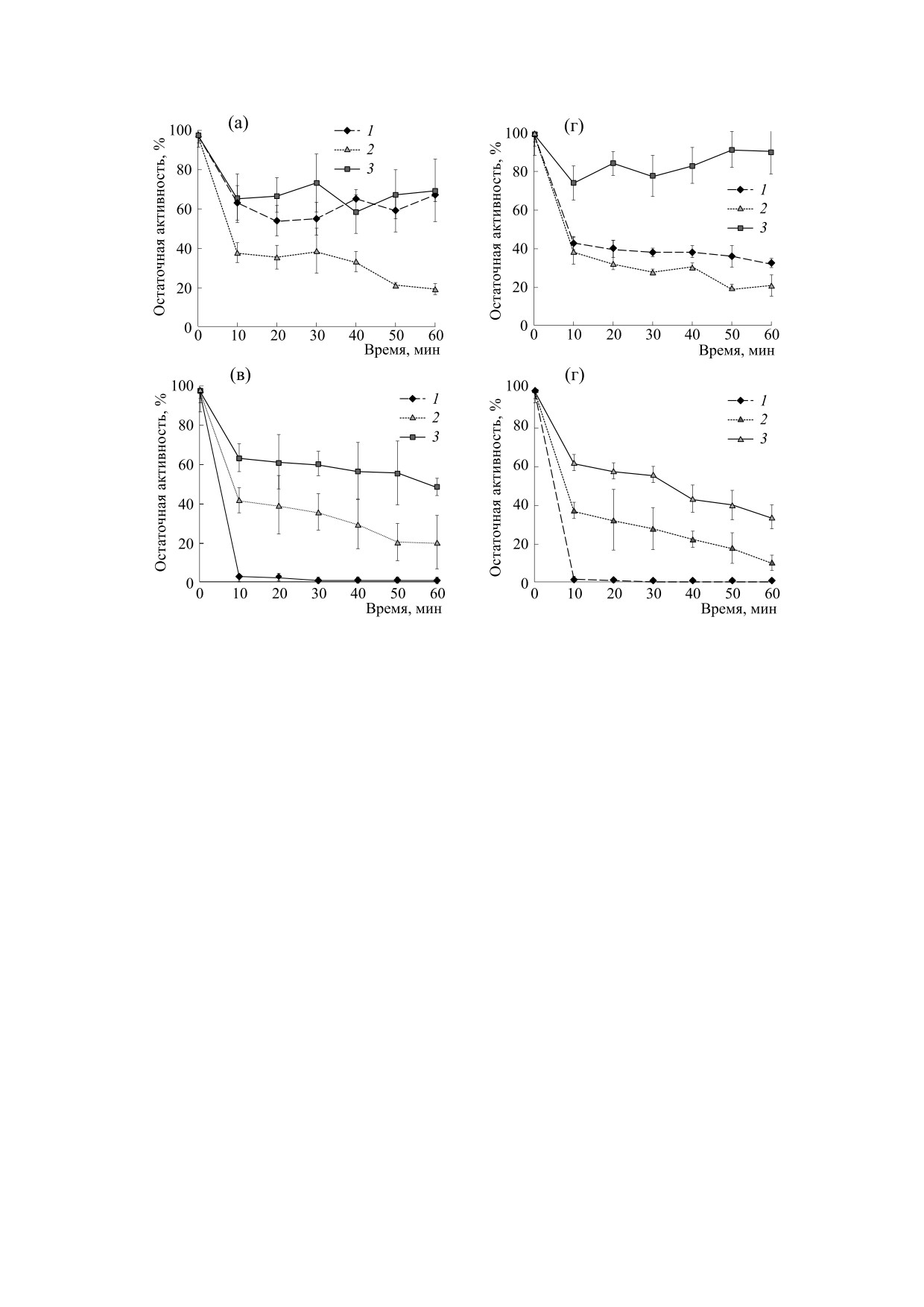
Рис. 3. Сохранение каталитической активности ферментов в различные промежутки времени в ходе инкубации при
60°С (а), 70°С (б), 80°С (в), 90°С (г): 1 - фицин, 2 - бромелин, 3 - папаин. За 100% принята максимальная
ферментативная активность сорбированного образца, наблюдаемая без предварительной инкубации и при
оптимальных условиях гидролиза.
нию, при инактивации в диапазоне температур
60 и 70°С (до 40%); 2) фицин быстро инактивиро-
60-90°С (рис. 3).
вался в случае нагревания при 70°С; 3) папаин
был достаточно устойчив при температуре 70°С;
Динамика потери каталитической способно-
4) фицин, бромелин и папаин полностью инакти-
сти в ходе инкубации при 60°С для всех исследуе-
вировались при нагревании в условиях 80 и 90°С.
мых ферментов сходна: кривые инактивации сов-
падали по форме. Наибольший процент сохране-
Следует отметить, что кривые термопревраще-
ния активности (порядка 60%) после 60 мин
ния бромелина и папаина при 60-90°С, а также
прогревания был характерен для бромелина.
фицина при 70, 80 и 90°С имеют два отчетливо
Динамика потери ферментативной способно-
выраженных участка (две «ключевые стадии»):
сти при 70°С для бромелина и папаина также
первый (время инкубирования менее 10 мин) от-
сходна: кривые термической инактивации совпа-
личается высокой скоростью снижения катали-
дали по форме и были близки по значениям. По-
тической способности. Для второго (время инку-
сле часового прогревания бромелин сохранял бо-
бирования от 20 до 60 мин) характерна стабилиза-
лее 30% первоначальной активности, папаин -
ция остаточной активности фермента. Наличие
45%. Фицин инактивировался практически пол-
излома и двухфазный характер кривой термои-
ностью уже после 10-минутной инкубации.
нактивации названных цистеиновых протеаз сви-
детельствуют, возможно, о последовательном
Для фицина, бромелина и папаина была ха-
развитии как минимум двух стадий сложного
рактерна полная инактивация при 80 и 90°С по-
процесса термомодификации белка и о наличии в
сле 10-минутной инкубации их растворов.
изучаемой системе двух форм фермента, характе-
Из всего вышеизложенного можно сделать
ризующихся различной устойчивостью к денату-
следующие выводы: 1) бромелин сохранял высо-
рирующему воздействию. Интересен тот факт,
кий процент активности в диапазоне температур
что излом на кривой инактивации фицина одина-
БИОФИЗИКА том 66
№ 3
2021
434
КОРОЛЕВА и др.
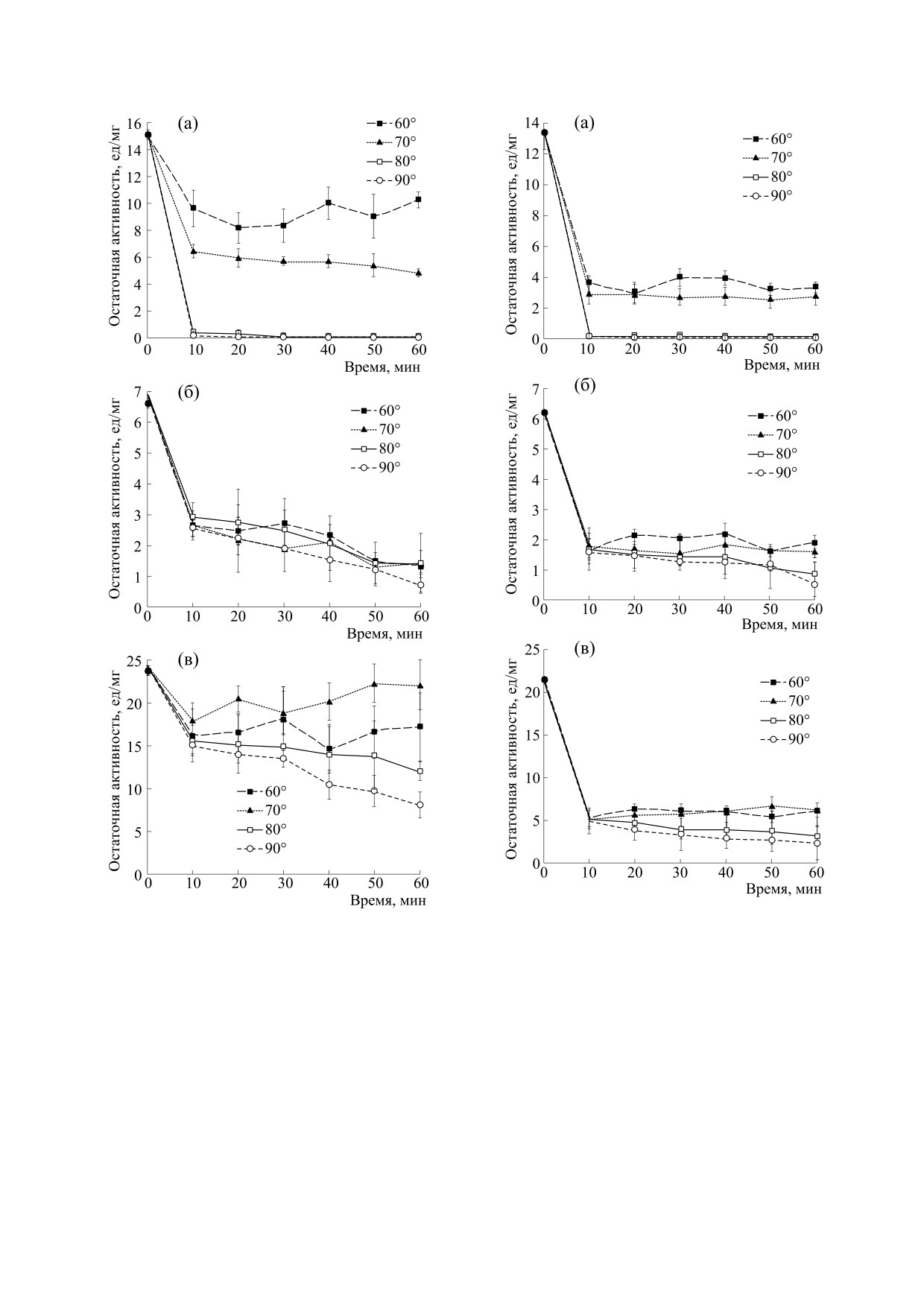
Рис.
5. Зависимости каталитической активности
иммобилизованных на высокомолекулярном хитоза-
Рис. 4. Зависимости каталитической активности им-
не фицина (а), бромелина (б) и папаина (в) от време-
мобилизованных на среднемолекулярном хитозане
ни термической инактивации.
фицина (а), бромелина (б) и папаина (в) от времени
термической инактивации.
Иммобилизация ферментов на нерастворимых
ков при 70, 80 и 90°С, а у бромелина и папаина он
носителях способствует повышению их термоста-
бильности. Этот эффект обусловлен тем, что при
более выражен при 80 и 90°С по сравнению с 60 и
присоединении молекул фермента к матрице
70°С.
подложки происходит стабилизация их каталити-
Исследование закономерностей процессов тер-
чески активной конформации.
мической инактивации фицина, бромелина и папаи-
На рис. 4 и 5 изображены кривые термической
на, иммобилизованных на матрицах хитозанов. инактивации протеаз, иммобилизованных на
БИОФИЗИКА том 66
№ 3
2021
ТЕРМИЧЕСКАЯ ИНАКТИВАЦИИ ЦИСТЕИНОВЫХ ПРОТЕАЗ
435
матрицах среднемолекулярного и высокомолеку-
что адсорбция бромелина на спорах пробиотика
лярного хитозанов.
Bacillus sp. повысила его термостабильность при
80°C по сравнению с растворимой формой: сво-
Иммобилизация фицина на среднемолекуляр-
бодный бромелин потерял полностью свою ак-
ном хитозане увеличила его термостабильность
тивность, в то время как иммобилизованный
по сравнению с нативным белком: после инкуба-
ции при 70°С каталитическая способность гете-
фермент потерял только ~ 47% от своей первона-
чальной каталитической способности.
рогенного препарата сохранилась на 32% от пер-
воначальной. Ферментативная активность при
Кривые инактивации иммобилизованного на
60°С после 10 мин уменьшилась на 35% и далее
среднемолекулярном хитозане папаина при 60,
практически не претерпевала изменений. Кри-
70, 80 и 90°С до 30 мин инкубации не различались
вые инактивации фицина, сорбированного на
по форме и значениям параметров: активность
матрице высокомолекулярного хитозана, по фор-
препарата снижалась до 70%. После 50 мин инку-
ме были одинаковы и близки по значениям после
бации при 60°С фермент сохранял активность на
нагревания при 60 и 70°С, активность препарата
уровне более 60%, а после 10 мин нагрева при
составила более 20% от исходной как после
90°С плавно терял свою каталитическую способ-
10 мин, так и после одночасовой инкубации. Фи-
ность, которая в конце эксперимента составляла
цин, иммобилизованный на среднемолекуляр-
33% от исходной. Кривые инактивации папаина,
ном и высокомолекулярном хитозанах, полно-
сорбированного на матрице высокомолекуляр-
стью терял свою активность после нагревания
ного хитозана, по форме были одинаковы и близ-
при 80 и 90°С (рис. 4а и 5а). Авторы работы [51]
ки по значениям параметров после нагревания
произвели иммобилизацию фицина на глиоксил-
при 60, 70, 80 и 90°С, активность препарата со-
агарозе с сохранением 30% активности от натив-
ставляла не более 28% от исходной (рис. 4в и 5в).
ного фермента, что значительно увеличило ста-
Напротив, при иммобилизации папаина на хлоп-
бильность биокатализатора. Препарат продемон-
чатобумажной ткани не было продемонстрирова-
стрировал повышенную активность при рН 10 и
но значительного улучшения термостабильности
при 80°С по сравнению со свободным фермен-
фермента по сравнению с его растворимой
том. Другая группа исследователей получила фер-
формой [54]. Авторы работы [50] продемонстри-
ментные препараты на основе иммобилизован-
ровали заметное повышение термостабильности
ных тиоловых протеаз, такие как папаин, фицин
при 70°С папаина, иммобилизованного на маг-
и бромелин, на пористых гранулах поливинило-
нитных композитных микросферах, что можно
вого спирта путем ковалентной фиксации. Ста-
объяснить сниженным автолизом за счет фикса-
бильность в условиях щелочных значений рН
ции фермента на подложке.
среды и высоких температур, а также при хране-
Анализируя не абсолютные значения активно-
нии у иммобилизованных ферментов оказалась
сти иммобилизованных на хитозанах протеоли-
выше, чем у свободных. Например, остаточная
активность иммобилизованного папаина после
тических ферментов, а степень ее сохранения по
сравнению с нативными препаратами при инак-
инкубации при 60°С в течение 60 мин практиче-
тивации в диапазоне температур 60-90°С (рис. 6
ски не изменилась (осталась на уровне 95-99%),
и 7), можно высказать следующие соображения.
тогда как активность свободного папаина снизи-
Динамика потери ферментативной способности
лась до 70% от исходного значения [52].
при инкубации при 60°С фицина и папаина,
Кривые зависимости каталитической актив-
иммобилизованных на среднемолекулярном хи-
ности иммобилизованного на среднемолекуляр-
тозане, близка по форме: ферменты снижали
ном хитозане бромелина от времени термической
свою активность уже после 10 мин нагревания.
инактивации при температурах 60 и 70°С до
Бромелин, иммобилизованный на среднемолеку-
40 мин инкубации практически совпадали по
лярном хитозане, сохранял 19% каталитической
значениям: активность препарата снижалась до
способности после 60 мин инкубации при 60°С,
50%. После 40 мин нагревания ферментных об-
что приблизительно в три раза меньше, чем у дру-
разцов при 60 и 70°С их активность падала до 26%
гих протеаз. Иммобилизованный на среднемоле-
в сравнении с интактным препаратом. После ин-
кулярном хитозане папаин оказался наиболее
кубации фермента в течение 1 ч при 80 и 90°С
устойчивым при 70°С и сохранял 90% своей ак-
остаточная энзиматическая способность состав-
тивности. Фицин, иммобилизованный на сред-
ляла 10 и 20% от исходной. Кривые зависимости
немолекулярном хитозане, полностью инактиви-
активности бромелина, сорбированного на мат-
ровался при 80 и 90°С, тогда как папаин и броме-
рице высокомолекулярного хитозана, от времени
лин сохраняли более
10% каталитической
термической инактивации совпадали по форме и
способности от ее начального уровня.
значениям при 60, 70, 80 и 90°С. После 60-минут-
ного прогревания образцы сохраняли не более
Кривые инактивации, полученные при нагре-
25% первоначальной каталитической способно-
вании при 60°С, были одинаковы по форме и зна-
сти (рис. 4б и 5б). Авторы работы [53] показали,
чениям параметров (не более 37% активности во
БИОФИЗИКА том 66
№ 3
2021
436
КОРОЛЕВА и др.
Рис. 6. Сохранение активности иммобилизованных на среднемолекулярном хитозане ферментов в различные
промежутки времени в ходе инкубации при 60°С (а), 70°С (б), 80°С (в), 90°С (г): 1 - фицин, 2 - бромелин, 3 - папаин.
За
100% принята максимальная ферментативная активность сорбированного образца, наблюдаемая без
предварительной инкубации и при оптимальных условиях гидролиза.
всем диапазоне времени) для фицина, бромелина
ность участия процессов ассоциации в регуляции
и папаина. При 70°С мы наблюдали практически
их каталитической активности. В связи с тем, что
полное совпадение кривых инактивации для фер-
после иммобилизации двухфазный характер кри-
ментов, иммобилизованных на высокомолеку-
вых термопревращения цистеиновых протеаз
лярном хитозане, они теряли каталитическую
стал менее выраженным, можно сделать предпо-
способность гораздо быстрее, чем при температу-
рах 60°С и ниже. Иммобилизованные на высоко-
ложение, что сорбция на обоих типах хитозанов
молекулярном хитозане бромелин и папаин ока-
препятствует протеканию названных выше про-
зались более термостойкими по сравнению с им-
цессов, стабилизируя тем самым каталитически
мобилизованным на том же носителе фицином,
активную конформацию молекул ферментов при
который полностью инактивировался после
повышении температуры.
10 мин инкубации при 80 и 90°С.
Следует отметить, что после иммобилизации
В настоящем исследовании было показано,
на обоих типах хитозанов изменилась форма кри-
что сорбция ферментов на хитозане способство-
вых термопревращения цистеиновых протеаз, по
вала повышению их термостабильности. Можно
сравнению с результатами, полученными для
сделать вывод о том, что адсорбция на среднемо-
растворимых ферментов: при сохранении двух-
лекулярном (200 кДа) и высокомолекулярном
фазного характера кривых инактивации излом на
них при 80 и 90°С стал менее глубоким.
(350 кДа) хитозане позволяет расширить спектр и
возможности применения цистеиновых протеаз
Форма кривых термической инактивации фи-
цина, бромелина и папаина в растворе при темпе-
(фицин, папаин, бромелин) за счет протекторных
ратурах 60, 70, 80 и 90°С указывает на возмож-
свойств его матрицы.
БИОФИЗИКА том 66
№ 3
2021
ТЕРМИЧЕСКАЯ ИНАКТИВАЦИИ ЦИСТЕИНОВЫХ ПРОТЕАЗ
437
Рис. 7. Сохранение активности иммобилизованных на высокомолекулярном хитозане ферментов в различные
промежутки времени в ходе инкубации при 60°С (а), 70°С (б), 80°С (в), 90°С (г): 1 - фицин, 2 - бромелин, 3 - папаин.
За
100% принята максимальная ферментативная активность сорбированного образца, наблюдаемая без
предварительной инкубации и при оптимальных условиях гидролиза.
ЗАКЛЮЧЕНИЕ
КОНФЛИКТ ИНТЕРЕСОВ
Нативный фицин инактивировался после
Авторы заявляют об отсутствии конфликта
10 мин нагревания при 70°С, иммобилизация
интересов.
фермента на матрице хитозана способствовала
увеличению его термостабильности при той же
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
температуре. Свободный бромелин терял катали-
тическую способность после инкубации при
Настоящая работа не содержит описания ис-
80°С, сорбированная форма фермента проявляла
следований с использованием людей и животных
свою активность при 80 и 90°С. Растворимый па-
в качестве объектов.
паин был термически инактивирован при 80°С,
иммобилизация фермента на хитозане частично
предотвратила потерю его каталитической спо-
СПИСОК ЛИТЕРАТУРЫ
собности при 80 и 90°С.
1. M. Esmaeilpour, M. R. Ehsani, M. Aminlari, et al.,
Полученные результаты следует учитывать
Comp. Clin. Pathol. 25 (3), 599 (2016).
при разработке ферментных препаратов про-
2. M. A. Shah, S. A. Mir, and M. A. Paray, Dairy Sci.
мышленного назначения на основе фицина, бро-
Technol. 94, 5 (2014).
мелина и папаина, так как иммобилизация цисте-
3. Z. I. M. Arshad, A. Amid, F. Yusof, et al., Appl. Micro-
иновых протеаз на матрице хитозана частично за-
biol. Biotechnol. 98, 7283 (2014).
щищает их молекулы от денатурирующего
действия высоких температур, что позволит ис-
4. M. Faccia, G. Picariello, A. Trani, et al., Eur. Food
пользовать подобные гетерогенные биокатализа-
Res. Technol. 234, 527 (2012).
торы в реакторах периодического и непрерывно-
5. Z. Pietrasik, J. L. Aalhus, L. L. Gibson, and
го действия.
P. J. Shand, Meat Sci. 84, 512 (2010).
БИОФИЗИКА том 66
№ 3
2021
438
КОРОЛЕВА и др.
6. B. Gerelt, Y. Ikeuchi, and A. Suzuki, Meat Sci. 56, 311
32.
T. Jesionowski, J. Zdarta, and B. Krajewska, Adsorp-
(2000).
tion 20, 801 (2014).
7. S. Ketnawa and S. Rawdkuen, Food Nutrition Sci. 2,
33.
B. Hua and Q. Huangb, Chin. J. Polymer Sci. 31 (9),
393 (2011).
1190 (2013).
8. I. Benucci, K. Liburdi, A. M. V. Garzillo, and M. Esti,
34.
G. R. Castro, R. R. Kamdar, B. Panilaitis, and
Food Chem. 124, 1349 (2011).
D. L. Kaplan, J. Control Release 109, 149 (2005).
9. L. P. Hale, P. K. Greer, C. T. Trinh, and C. L. James,
35.
V. E. Bosio, G. A. Islan, Y. N. Martínez, et al., Crit.
Int. Immunopharmacol. 5, 783 (2005).
Rev. Biotechnol. 36 (3), 447 (2016).
10. G. A. Sullivan and C. R. Calkins, Meat Sci. 85, 730
36.
O. L. Tavano, A. Berenguer-Murcia, F. Secundo, and
(2010).
R. Fernandez-Lafuente, Comprehensive Rev. Food
11. O. Diaz, M. Fernandez, G. D. Garcia de Fernando,
Sci. Food Safety 17 (2), 412, (2018).
et al., Sci. Food Agric. 71, 13 (1996).
37.
A. Ü. Metin and E. Alver, Bioprocess. Biosyst. Eng. 39,
12. L. Feijoo-Siota and T. G. Villa, Food Bioprocess.
1137 (2016).
Technol. 4, 1066 (2011).
13. D. R. Baidamshina, E. Y. Trizna, F. S. Akhatova, et al.,
38.
I. Benucci, C. Lombardelli, K. Liburdi, et al., Food Sci.
Sci. Rep. 7, 46068 (2017).
Technol. 53 (2), 1130 (2016).
14. В. Г. Артюхов, Т. А. Ковалёва, М. Г. Холявка и др.,
39.
A. S. Rojas-Mercado, I. E. Moreno-Cortez, R. Lucio-
Прикл. биохимия и микробиология 46 (4), 422
Porto, and L. L. Pavon, Int. J. Biol. Macromolecules
(2010).
118, 2287 (2018).
15. V. C. Sgarbieri, S. M. Gupte, D. E. Kramer, and
40.
E. Siar, R. Morellon-Sterling, M. N. Zidoune, and
J. R. Whitaker, J. Biol. Chem. 239, 2170 (1964).
R. Fernandez-Lafuente, Int. J. Biol. Macromolecules
16. I. K. Jones and A. N. Glazer, J. Biol. Chem. 245, 2765
133, 412 (2019).
(1970).
41.
М. Г. Холявка, В. Г. Артюхов и В. А. Королева,
17. D. C. Williams and J. R. Whitaker, Plant Physiol. 44,
Патент на способ получения гетерогенного
1574 (1969).
препарата различной дисперсности на основе
18. J. Polaina and A. P. MacCabe, Industrial Enzymes:
бромелайна и хитозана, дата подачи заявки:
Structure, Function and Applications (Springer, N. Y.,
03.07.2017, дата публикации заявки:
10.01.2019,
2007).
Бюл. № 1, опубликовано: 16.01.2019, Бюл. № 2.
19. J. Drenth, J. N. Jansonius, R. Koekoek, et al., Nature
42.
O. H. Lowry, N. J. Rosebrough, A. L. Farr, and R.J.
218, 929 (1968).
Randall, J. Biol. Chem. 193, 265 (1951).
20. I. G. Kamphuis, K. H. Kalk, M. B. Swarte, and
43.
A. R. Sabirova, N. L. Rudakova, N. P. Balaban, et al.,
J. Drenth, J. Mol. Biol. 179 (2), 233 (1984).
FEBS Lett. 584 (21), 4419 (2010).
21. C. F. Barbas and C. H. Wong, J. Chem. Soc. 1987, 533
44.
D. F. Erlanger, N. Kokowski, and W. Cohen, Arch.
(1987).
Biochem. Biophys. 95, 271 (1961).
22. R. B. Johnston, J. Biol. Chem. 221 (2), 1037 (1956).
45.
L. R. Singh, Th. P. Devi, and S. K. Devi, Prepar. Bio-
23. Enzymes in Food Technology, Ed. by R. J. Whitehurst
chem. Biotechnol. 34 (1), 25 (2004).
and M. Van Oort (Wiley-Blackwell, West Sussex,
46.
D. Baeyens-Volant, A. Matagne, R. El Mahyaoui,
2010).
et al., Phytochemistry 117, 154 (2015).
24. A. D. Napper, S. P. Bennett, M. Borowski, et al., Bio-
chem. J. 301 (Pt 3), 727 (1994).
47.
S. Fadýloğlu, Nahrung/Food 45 (2),143 (2001).
25. C. Garcia-Galan, A. Berenguer-Murcia, R. Fernan-
48.
K. B. Devaraj, P. R. Kumar, and V. Prakash, J. Agric.
dez-Lafuente, and R. C. Rodrigues, Adv. Synth. Catal.
Food Chem. 56, 11417 (2008).
353, 2885 (2011).
49.
P. Alpay and D. Aktas Uygun, Mol. Catalysis B 111, 56
26. A. Fini and I. Orienti, Am. J. Drug Deliv. 1 (1), 43
(2015).
(2003).
50.
H. Lei, W. Wang, L.-L. Chen, et al., Enzyme Microbial
27. M. Alatorre-Meda, P. Taboada, J. Sabin, et al., Colloid
Technol. 35 (1), 15 (2004).
Surf. A 339, 145 (2009).
51.
E. Siar, H. Zaak, J. F. Kornecki, et al., Process. Bio-
28. B. Krajewska, P. Wydro, and A. Jańczyk, Biomacro-
chem. 58, 98 (2017).
molecules 12, 4144 (2011).
52.
T. Hayashi, S.-H. Hyon, W.-I. Cha, and Y. Ikada,
29. B. Krajewska, P. Wydro, and A. Kyzioł, Colloid Surf. A
Polymer J. 25 (5), 489 (1993).
434, 349 (2013).
30. B. Krajewska, A. Kyzioł, and P. Wydro, Colloid Surf. A
53.
T. N. Nwagu and C. J. Ugwuodo, Int. J. Biol. Macro-
434, 359 (2013).
molecules 127, 406 (2019).
31. A. Kilinç, M. Teke, S. Önal and A. Telefoncu, Prep.
54.
F.-Y. Li, Y.-J. Xing, and X. Ding, Enzyme Microbial
Biochem. Biotechnol. 36 (2), 153 (2006).
Technol. 40 (7), 1692 (2007).
БИОФИЗИКА том 66
№ 3
2021
ТЕРМИЧЕСКАЯ ИНАКТИВАЦИИ ЦИСТЕИНОВЫХ ПРОТЕАЗ
439
Thermal Inactivation of Cysteine Proteases: “Key Stages”
V.A. Koroleva, S.S. Olshannikova, M.G. Holyavka, and V.G. Artyukhov
Voronezh State University, Universitetskaya pl. 1, Voronezh, 394018 Russia
The processes of thermal inactivation of ficin, bromelain and papain in a dissolved state and immobilized on
matrices of medium-molecular (200 kDa) and high-molecular (350 kDa) chitosans were studied. It was
shown that native ficin was inactivated at 70°C after 10 min of heating, bromelain in solution retained up to
40% of its activity after 60 min of incubation at 60°C and 70°C, the enzymatic activity of free papain remained
constant at 70°C over the whole period of exposure (60 min). Soluble samples ofs ficin, bromelain and papain
are characterized by complete inactivation at 80°C and 90°C after 10 min of incubation. The ficin immobili-
zation on matrices of both types of chitosans increased its thermal stability (at 70°C, the catalytic ability of
the enzyme was at least 20%). Ficin, immobilized on medium and high molecular weight chitosans, was com-
pletely inactivated at 80°C and 90°C after 10 min of incubation, while papain and bromelain adsorbed on the
chitosan matrix retained more than 10% of their catalytic ability from its initial level under these conditions.
Keywords: ficin, bromelain, papain, immobilization, thermal inactivation, chitosan
БИОФИЗИКА том 66
№ 3
2021