БИОФИЗИКА, 2021, том 66, № 3, с. 447-453
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577. 3: 577.15: 577.151.33
РОЛЬ АНИОНОВ ФОСФАТА В АВТО- И ФОТОИНДУЦИРОВАННОМ
ОКИСЛЕНИИ NADH
© 2021 г. О.Н. Бржевская*, Е.Н. Дегтярев**, С.Н. Холуйская**
*Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
**Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН,
119991, Москва, ул. Косыгина, 4
E-mail: s_n_khol@mail.ru
Поступила в редакцию 29.11.2019 г.
После доработки 22.07.2020 г.
Принята к публикации 18.12.2020 г.
Методом ЭПР исследовано влияние моно- и двузамещенных фосфатов на реакцию фотолиза вос-
становленного никотинамидадениндинуклеотида (NADH) в замороженном (77 К) водном раство-
ре. Установлена зависимость выхода парамагнитных интермедиатов реакции - катион-радикала
NADH+ и атомарного водорода от концентрации фосфатов. Полученные результаты интерпретиро-
ваны с точки зрения основности и электроноакцепторных свойств фосфатов. По данным электрон-
ной спектроскопии обнаружено значительное ускорение авто- и фотоиндуцированного окисления
NADH в нормальных условиях (20°С, водная среда, фосфатный буфер, рН 6.3). Скорость темновой
реакции прямо пропорциональна суммарной концентрации орто- и гидрофосфатов и нечувстви-
тельна к кислороду. На основании экспериментов с использованием нитроксильной ловушки сде-
лан вывод о нерадикальной природе реакции.
Ключевые слова: автоокисление NADH, фосфат, ЭПР-спектроскопия.
DOI: 10.31857/S0006302921030042
7]; на изучении редокс-свойств - создание новых
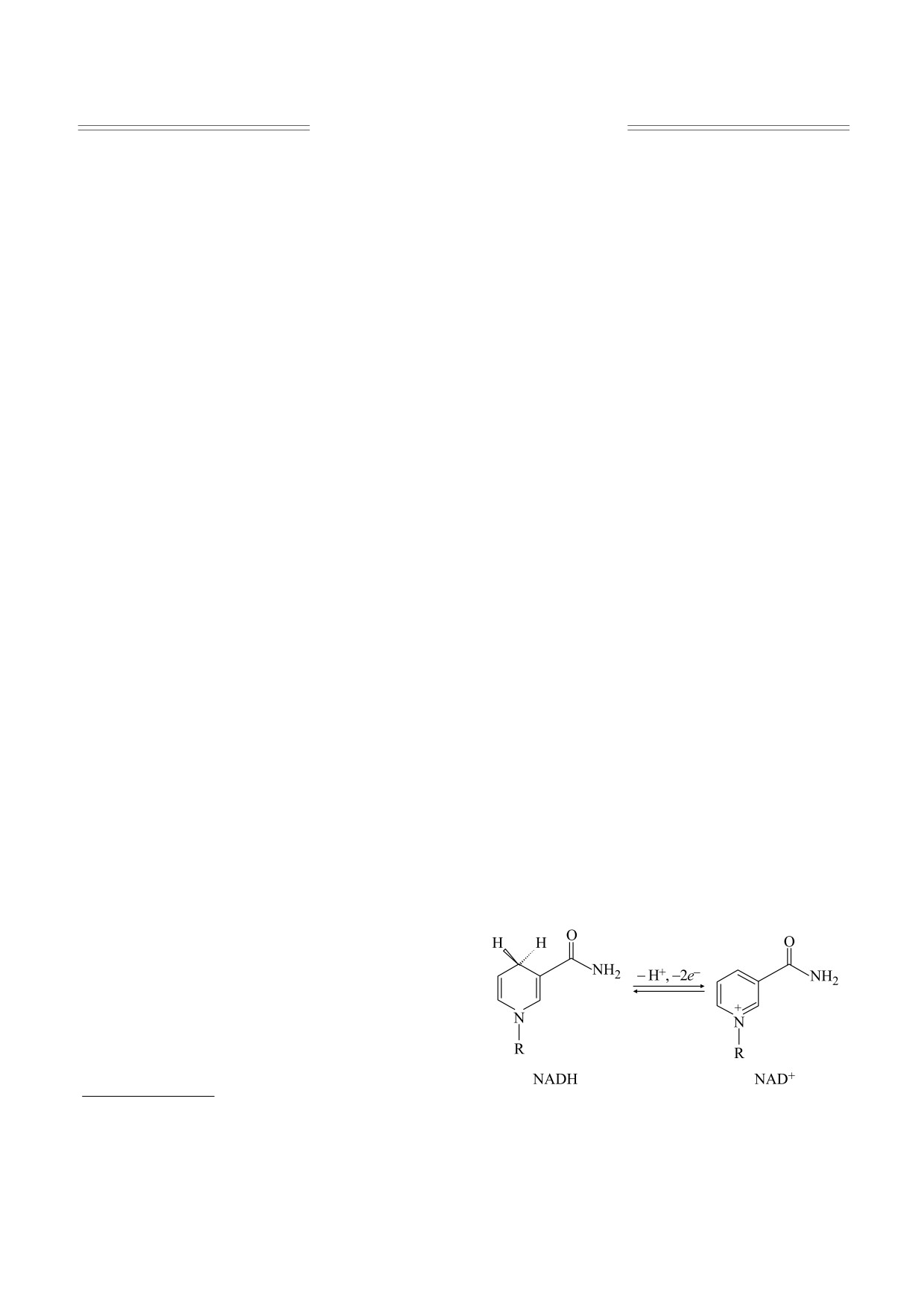
NADH и его окисленная форма NAD+ (рис. 1) -
важные коферменты редокс-превращений в био-
процессов органического синтеза, создание дат-
химическом синтезе. Изучению их действия по-
чиков для определения загрязняющих примесей в
священо огромное число исследований, напри-
воде [8] и т. д. Результатом многочисленных ис-
мер [1-5]. В контролируемых ферментами реак-
следований стала гипотеза о двух механизмах
циях молекула NADH выступает либо как
трансформации кофермента NADH: первый ме-
источник протона и двух электронов, либо как
ханизм представляет собой одностадийный пере-
донор иона гидрида, который переносится на
подходящий субстрат. Основную химическую
нос гидридного иона. Второй - включает не-
роль в этих процессах играет фрагмент молекулы
сколько стадий: две, когда последовательно про-
NADH - 1,4-дигидроникотинамид.
исходит перенос электрона и атома водорода на
Окислительно-восстановительные превраще-
ния аналогов NADH, содержащих никотинамид-
ный фрагмент, интенсивно изучаются в реакциях
без участия ферментов, поскольку данные мо-
дельные реакции могут прояснить механизм дей-
ствия NADH и, кроме того, представляют прак-
тический интерес. Так, на антипролиферативных
и цитотоксических свойствах кофермента и его
модельных соединений основаны разработки ан-
тиопухолевых фармацевтических препаратов [6,
Сокращения: TEMPOL - 4-гидрокси-2,2,6,6-тетраметил-
пиперидин-1-оксил, Pi - моно- и двузамещенные фос-
Рис. 1. NADH и его окисленная форма NAD+; R -
фаты.
фрагмент, включающий рибозу и аденин.
447
448
БРЖЕВСКАЯ и др.
молекулу окислителя A+, либо три - с постадий-
нии монохромным светодиодом (λ = 365 нм) при
ным переносом второго электрона и протона по
комнатной температуре в атмосфере аргона в кю-
ветах специальной конструкции, позволяющих
следующей схеме:
провести предварительный барботаж раствора
Одностадийный перенос:
инертным газом. Погрешность измерения опти-
NADH + A+ → [NADδ+…Hδ-…Aδ+] → NAD+ + HA;
ческой плотности составляет ± 0.001, общая по-
грешность определения константы скорости не
Многостадийный перенос:
превышает 5%.
(а) электрон - атом водорода (e· - H·)
Фотоиндуцированное окисление NADH в за-
NADH + A+ → [NADH+…A·] → NAD+ + HA;
мороженных жидким азотом образцах осуществ-
ляли при облучении лампой ДРШ-1000 с филь-
(б) электрон - протон - электрон (e· - H+ - e·)
тром БС6 с пропусканием λ > 320 нм. Растворен-
NADH + A+ → [NADH+...A·] → [NAD·…AH+·] →
ный кислород удаляли вакуумированием.
Времена экспозиции варьировали от 8 до 40 мин.
NAD+ + HA.
Регистрацию сигналов ЭПР проводили на спек-
Доказательством второго механизма служит
трометре EMX (Bruker, США) в Центре коллек-
регистрация различными физико-химическими
тивного пользования ИБХФ РАН. Спектры атома
методами промежуточных частиц - радикалов и
водорода и катион-радикала NADH регистриро-
ион-радикалов, в частности катион-радикала
вали соответственно при мощности микроволно-
NADH. Примеров реализации второго механизма
вого поля 2 мкВт (в отсутствие насыщения) и
для NADH и его моделей немного, так как на-
200 мкВт, при 77 K и амплитуде модуляции 3 Гс.
чальный перенос электрона - сильно эндотерми-
Двойное интегрирование сигнала, пропорцио-
ческая реакция и для ее осуществления требуется
нальное концентрации парамагнитных центров,
дополнительная энергия, что достигается в усло-
проводили с помощью программы WinEPR
виях фотоиндуцирования или при введении ката-
(Bruker, США). Измерение интенсивности сигна-
лизаторов.
лов проводили троекратно, различие в получен-
С другой стороны, известно, что эффектив-
ных значениях составляло <10%. Для построения
ность редокс-процессов повышается в присут-
графиков использовали усредненные значения.
ствии посредников передачи электрона таких,
как молекулярные анионы, а именно анионы
фосфата. Фосфатные анионы участвуют во мно-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
гих биохимических процессах, исследование их
На рис. 2а представлены ЭПР-спектры про-
взаимодействия с гидратированным электроном
дуктов фотоиндуцированного окисления NADH.
стало предметом многочисленных публикаций
При 77 К зарегистрирован характерный пятиком-
[9-11].
понентный сигнал, впервые описанный в работах
Целью настоящей работы было исследование
[12, 13] и относящийся к парамагнитному интер-
влияния анионов фосфата на процесс автоокис-
медиату реакции - катион-радикалу NADH+. Ре-
ления NADH, в том числе фотоиндуцированного.
гистрация катион-радикала свидетельствует о
В условиях фотоокисления методом ЭПР также
многостадийном механизме окисления NADH,
изучены свободнорадикальные интермедиаты ре-
который, как правило, реализуется в условиях
акции.
фотоиндуцированного процесса. Второй про-
дукт, образующийся в одном элементарном акте с
МАТЕРИАЛЫ И МЕТОДЫ
катион-радикалом - гидратированный электрон
e
aq имеет время жизни около 120 нс и не обнару-
В работе использовали (без дополнительной
живается методом ЭПР. Вместе с тем при фото-
очистки) NADH фирмы Serva (Германия), соли
окислении NADH в фосфатном буфере в спектре
NaH2PO4 2H2O, Na2HPO4, NaCl и KBr фирмы
ЭПР появляется сигнал атома водорода (дублет с
Panreac (Испания) и 4-гидрокси-2,2,6,6-тетраме-
расщеплением ~506 Гс).
тилпиперидин-1-оксил (TEMPOL) фирмы Merck
Превращение мобильного электрона в атом
(Германия).
водорода в присутствии фосфатов обнаружено
Кинетику автоокисления NADH изучали по
достаточно давно
[13]. Впервые эта реакция
изменению полосы поглощения его электронно-
наблюдалась при γ-радиолизе замороженных
го спектра с λmax = 339 нм (έ = 6200 М-1см-1).
растворов ортофосфатов. Оказалось, что взаимо-
Спектры регистрировали на спектрофотометре
действие eaq с анионами ортофосфата приводит к
СФ-2000 в диапазоне 225-400 нм в кварцевых
образованию атомарного водорода, стабилизиро-
кюветах с длиной оптического пути 1 см. Кинети-
ванного полем оксианиона (реакция 1).
ку фотоокисления NADH в воде и фосфатном бу-
фере (Со = 0.5 М, рН 6.3) исследовали при облуче-
eaq + H2PO4- → HPO42- + H·.
(1)
БИОФИЗИКА том 66
№ 3
2021
РОЛЬ АНИОНОВ ФОСФАТА
449
Рис. 2. (а) - Спектры ЭПР парамагнитных продуктов фотолиза NADH (77 К, ([NADH]o = 5.0 мМ, время облучения
8 мин, вакуум): 1 - спектр катион-радикала NADH+, 2 и 3 - спектры катион-радикала NADH+ и атомарного водоро-
да, полученные в присутствии фосфатов (pH 6,3) в концентрации 0.125 M (2) и 0.5 M (3). (б) - Зависимости интенсив-
ностей сигналов ЭПР катион-радикала NADH+ (1) и атомарного водорода (2) от концентрации фосфатов. Звездочками
обозначен относительный выход гидратированных электронов по данным наносекундного лазерного фотолиза [15].
Впоследствии захват и стабилизация eaq фос-
ла атомов водорода от концентрации буфера
фатами обнаружены для электронов с низкой
представляет собой кривую с насыщением (кри-
энергией <4.5 эВ в условиях, исключающих появ-
вая 1 на рис. 2б), наибольшая интенсивность сиг-
ление продуктов радиолиза воды. Свободные
нала H· достигается при концентрации [Pi] ≥ 0.5
электроны генерировали путем фотоионизации
M, и плато на экспериментальной кривой соот-
различных соединений (триптофан, пирен, фе-
ветствует условиям, когда все свободные элек-
нотиазин, хлорофилл и другие) при облучении с
троны взаимодействуют с фосфатом.
длинами волн 240 нм < λ < 700 нм, т. е., в том чис-
Напротив, максимальное образование пер-
ле, видимым светом. Предполагается, что
вичного продукта фоторазделения зарядов - ка-
при взаимодействии eaq с фосфатом в заморожен-
тион-радикала NADH+ - происходит в отсут-
ном водном растворе образуется молекулярный
ствие фосфатов (кривая 2 на рис. 2б). В фосфат-
анион - аддукт электрона, метастабильная части-
ном буфере с ростом концентрации
[Pi]
ца, способная передавать электрон акцептору при
интенсивность сигнала NADH+ снижается и
его наличии (О2, NO3-), либо распадаться, при-
стремится к постоянному значению, которое
чем характерным продуктом фрагментации явля-
устанавливается также при концентрации
ется атом водорода. Прекурсором атома H· высту-
[Pi] ≥ 0.5 M (рис. 2б), т. е. зависимости интенсив-
пает протон фосфата, что однозначно доказано
ностей сигналов NADH+ и H· от концентрации Pi
по появлению спектра ЭПР атомарного дейтерия
антибатны. Существует несколько причин, спо-
в экспериментах с D2PO4- [11].
собных вызвать снижение интенсивности сигна-
Полученные нами результаты также указыва-
ла катион-радикала. Во-первых, эффективность
ют на определяющую роль моно- и двузамещен-
реакции фотолиза может понизиться в результате
ных фосфатов (Pi) в образовании атома водорода.
увеличения ионной силы раствора, приводящей к
изменению поляризации связей в молекуле
Действительно, мы наблюдали сигнал H· исклю-
NADH. Однако мы не обнаружили влияния соли
чительно в присутствии фосфатного буфера, при-
Na2SO4 на выход катион-радикала при ее введе-
чем интенсивность сигнала коррелировала с кон-
нии в концентрации 1.0 M в раствор NADH.
центрацией фосфатов (рис. 2б). Суммарную кон-
центрацию Pi изменяли от 1 мМ до 1.5 М -
Во-вторых, авторами работы [2] была выдви-
значения, близкого к предельной растворимости
нута гипотеза об образовании комплекса с пере-
ортофосфата натрия. Соотношение моно- и дву-
носом заряда между NADH и анионом фосфата
замещенного фосфатов подбиралось таким обра-
[NADH…Pi]. У молекулы NADH в таком ком-
зом, чтобы pH растворов имел постоянное значе-
плексе могут изменяться поляризуемость, ди-
ние (pH 6.3). Зависимость интенсивности сигна-
польный момент, магнитные свойства. В работе
БИОФИЗИКА том 66
№ 3
2021
450
БРЖЕВСКАЯ и др.
[2] было высказано предположение об увеличе-
нии реакционной способности координирован-
ного фосфатом NADH в условиях термической
реакции. Однако при фотолизе NADH мы наблю-
дали обратное: в присутствии фосфатов не только
снижается концентрация катион-радикала, но,
как было показано ранее [11] методом наносе-
кундного лазерного фотолиза, снижается также
выход гидратированных электронов, т. е. эффек-
тивность (квантовый выход) реакции падает.
Рис. 2б дополнен данными нашей работы [15]:
двумя звездочками обозначены относительные
величины выхода eaq в отсутствие фосфатов и при
[Pi] = 0.5 M. Видно, что выходы eaq и катион-ра-
дикала для [Pi] = 0.5 M не совпадают, хотя обе
частицы образуются эквимолекулярно в одном
элементарном акте. Значительно меньшая кон-
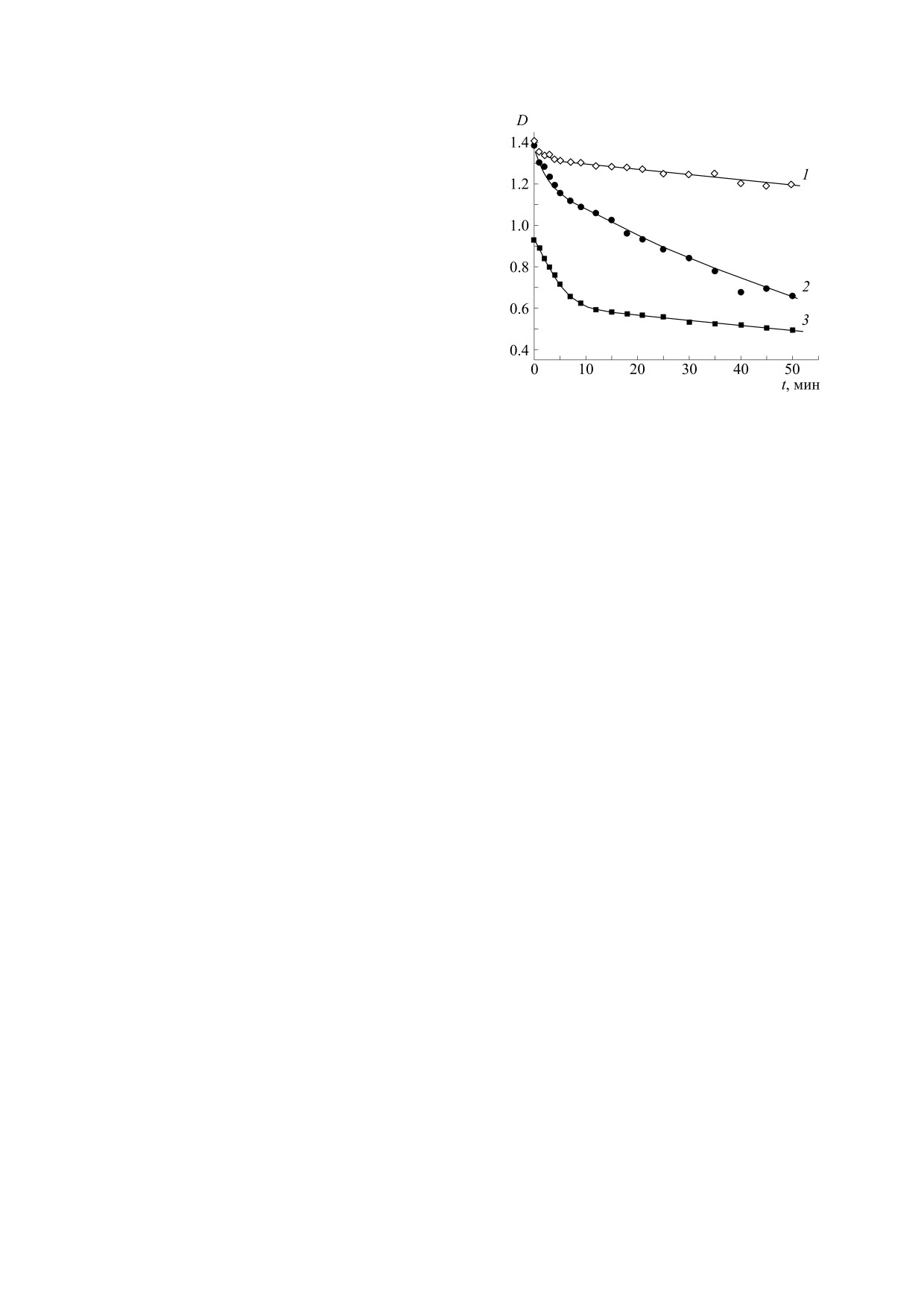
Рис. 3. Кинетика фотоокисления NADH при облучении
центрация катион-радикала говорит о существо-
с λ = 365 нм в водном растворе (20°C): 1 - в аргоне, 2 - в
аргоне в присутствии фосфатов в концентрации 0.5 M
вании канала его расходования. Следовательно,
(pH 6.3), 3 - на воздухе.
действие фосфата на фотоокисление NADH но-
сит двойственный характер: с одной стороны,
снижает квантовый выход реакции, с другой -
окисленной формы NAD+ - и в целом увеличи-
стимулирует вторичные превращения ее продук-
вают общую скорость фотолиза.
тов, eaq и катион-радикала NADH+.
Образующийся после депротонирования ра-
Известно, что катион-радикал NADH+ вслед-
дикал NAD· также нестабилен. Его гибель проис-
ствие более кислого характера в сравнении с ис-
ходит в основном по двум направлениям - в ре-
ходной молекулой обладает высокой реакцион-
зультате быстрой димеризации [21] и экзотерми-
ной способностью и легко депротонируется, пе-
ческой реакции одноэлектронного окисления
реходя в нейтральный радикал NAD· [16, 17],
[22]. Нельзя исключить влияние ортофосфата на
причем эта реакция практически необратима.
окисление NAD· как частицы, обладающей элек-
Несмотря на высокие значения константы скоро-
тронакцепторными свойствами:
сти реакции депротонирования NADH+ при нор-
NAD· - e- (+ H2PO4-) → NAD+.
(3)
мальных (20°С) условиях k ≈ 106 c-1 [18], при 77 K
катион-радикал устойчив (спектр 1 на рис. 2а),
Описанный механизм фотоокисления NADH
что, очевидно, обусловлено довольно большой
включает обратимые стадии, в частности, авторы
энергией активации, которая составляет около
работы [23] методами флуоресценции исследова-
60 кДж/моль [19]. Однако ситуация изменяется в
ли рекомбинацию катион-радикала NADH+ с
присутствии акцептора протона (спектры 2 и 3 на
гидратированным электроном. Катион-радикал
рис. 2а). Так, по оценке, сделанной в работе [17],
NADH+ и eaq - первичные продукты разделения
взаимодействие NADH+ с гидроксильным анио-
зарядов, и наблюдаемое нами акцептирование
ном увеличивает скорость депротонирования по
электрона ортофосфатом предотвращает их ре-
сравнению с молекулой H2O на два порядка; зна-
комбинацию и смещает равновесие реакции в
чения констант составляют 2.9 · 108 М-1 с-1 и
сторону образования NAD+. Отсюда можно пред-
положить увеличение общей скорости окисления
3.5 · 106 с-1 соответственно. В нашей системе
NADH, даже несмотря на незначительное умень-
наиболее вероятной частицей, связывающей про-
шение квантового выхода фотолиза, отмеченное
тон, выступает гидрофосфат HPO2- (рКа = 7.21)
выше.
и превращение катион-радикала происходит по
На рис. 3 представлены результаты экспери-
реакции (2):
ментов по фотоиндуцированному окислению
NADH в нормальных условиях с добавками фос-
NADH+ + HPO2- → NAD· + H2PO4-.
(2)
фатов и в их отсутствие. Кинетические кривые на
Полученные данные также хорошо согласуют-
рис. 3 показывают сильное ускоряющее действие
ся с результатами исследований [16, 20], где обна-
Pi на реакцию. В этом отношении влияние фос-
ружено, что акцепторы протона и атома водорода
фатов подобно действию кислорода, который,
повышают выход конечного продукта реакции -
как показано в работе [24], выступает в качестве
БИОФИЗИКА том 66
№ 3
2021
РОЛЬ АНИОНОВ ФОСФАТА
451
медиатора передачи электронов, образующихся
при фотолизе NADH. Однако эндотермическая
реакция присоединения к кислороду реализуется
только при достаточной энергии электронов, на-
пример, в условиях фотогенерации. Поэтому мы
исследовали влияние фосфатов и кислорода на
автоокисление NADH без инициирования облу-
чением.
Темновой процесс автоокисления NADH изу-
чали по изменению электронного спектра кофер-
мента в нормальных условиях (20°С). При отсут-
ствии добавок спектр NADH практически стаби-
лен в атмосфере аргона и воздуха, введение Pi
значительно ускоряет реакцию (рис. 4б). В спек-
тре не проявляются признаки образования ком-
плексов кофермента с фосфатами: трансформа-
ция NADH в окисленную форму происходит с
четко выраженной изобестической точкой
(рис. 4а), что говорит о существовании только
двух форм кофермента. Ускорение реакции не
связано с изменением ионной силы раствора.
Так, введение добавок солей (NaCl, KBr) в кон-
центрациях, соответствующих ионной силе фос-
фатного буфера, не влияет на реакцию (рис. 4б).
Автоокисление NADH - рН-зависимая реакция,
при смещении в более щелочную область от зна-
чения pH 6.4 процесс сильно замедляется и при
pH ≥ 8 практически останавливается. Начальные
участки кинетических кривых расходования
NADH линейны (зависимость 3 на рис. 4б), ско-
рость реакции постоянна, оценка значения эф-
фективной константы скорости дает величину
kэф = 1.0 ⋅ 10-4 с-1 ([Pi] = 0.5 М). Зависимость ско-
рости окисления NADH от [Pi] имеет сложный
характер (рис. 3в): она прямо пропорциональна
суммарной концентрации NaH2PO4 и Na2HPO4 в
диапазоне концентраций [Pi] ≤ 0,5 M, с прибли-
жением к пределу растворимости NaH2PO4 ско-
рость падает.
Следует отметить отсутствие влияния кис-
лорода на реакцию, что косвенно может свиде-
тельствовать о нерадикальном процессе. Для
идентификации природы реакции использовали
радикальную ловушку - водорастворимый нит-
роксильный радикал TEMPOL. Нитроксильный
радикал в концентрации 0.2 мМ вводили в раствор
с концентрацией реагентов [NADH]o = 1.0 мМ;
[Pi] = 0.5 M (pH 6.43). Выяснилось, что вне зави-
Рис. 4. (а) - Изменение во времени электронного спектра
поглощения NADH (С0 = 0.25 мМ) в присутствии фосфат-
симости от наличия кислорода TEMPOL не ока-
ного буфера (С0 = 1,0 M, pH 6,43), Ar, 23°C. (б) - Кинети-
зывает действия на реакцию: скорость автоокис-
ческие кривые автоокисления NADH (С0 = 0.25 мМ,
ления не изменяется, значение эффективной
23°C): 1 - в инертной атмосфере аргона (кружки) и на воз-
духе (треугольники); 2 - с добавкой NaCl (C0 = 2.0 M, в ар-
константы скорости практически совпадает с ве-
гоне); 3 - в присутствии фосфатного буфера (С0 = 0.5 M,
личиной, определенной без ловушки, наконец,
pH 6.43) в аргоне (квадраты) и на воздухе (ромбы). (в) - За-
ЭПР-спектр радикала TEMPOL в реакционной
висимость начальной скорости W0автоокисления NADH
смеси стабилен во времени. Таким образом, не
(С0 = 0.25 мМ) от концентрации Piфосфатного буфера.
было получено аргументов в пользу радикального
БИОФИЗИКА том 66
№ 3
2021
452
БРЖЕВСКАЯ и др.
процесса при автоокислении NADH в присут-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ствии фосфатов. Данный факт легко объясняется
Настоящая работа не содержит описания ис-
в рамках одностадийного механизма переноса
следований с использованием людей и животных
гидридных анионов, который более характерен
в качестве объектов.
для темновых процессов. Стимулирование фос-
фатами темновой реакции может быть вызвано
СПИСОК ЛИТЕРАТУРЫ
активацией NADH при его координации фосфа-
том. В данном случае, вероятно, имеет место не-
1.
U. Eisner and J. Kuthan, Chem. Rev. 72, 1 (1972).
ковалентное взаимодействие, поскольку мы не
2.
S. G. A. Alivisatos, F. Ungar, and G. Abraham, Nature
обнаружили в электронном спектре NADH изме-
203, 973 (1964).
нений, характерных для образования комплекса.
3.
D. M. Stout and A. I. Meyers, Chem. Rev. 82, 223
В настоящий момент нами проводятся исследо-
(1982).
вания комплексообразования методом ЯМР, по-
4.
D. G. Nicholls and S. J. Ferguson, Bioenergetics (Aca-
скольку он позволяет выявить слабые некова-
demic Press, 2002).
лентные ваимодействия по изменению времен
спин-решеточной релаксации атомов молекулы
5.
T. Bugg, Introduction to Enzyme and Coenzyme Chemis-
NADH.
try (Blackwell Publishing Ltd., 2004).
6.
S. Boulton, S. Kyle, and D. W. Durkacz, Br. J. Cancer
76, 845 (1997).
ЗАКЛЮЧЕНИЕ
7.
E. Ciesielska, K. Studzian, E. Zyner, at al., Cell. Mol.
Biol. Lett. 5, 441 (2000).
Неорганические фосфаты оказывают двой-
8.
M. Zhang, Y. Zhang, L. Zhengwen, et al., J. Environ.
ное действие на фотоиндуцированное окисле-
Manag. 232, 197 (2019).
ние NADH. С одной стороны, незначительно
9.
П. П. Левин, О. Н. Бржевская и О. С. Неделина,
снижают выход первичных продуктов разделе-
Изв. РАН. Сер. хим. 56 (7), 1277 (2007).
ния зарядов - электрона и катион-радикала
10.
О. Н. Бржевская, Е. Н. Дегтярев, Т. С. Журавлева и
NADH+, с другой - вступают с ними во вторич-
др., Докл. РАН 420 (3), 1 (2008).
ные реакции, предотвращая рекомбинацию и
11.
О. С. Неделина, О. Н. Бржевская, Е. Н. Дегтярев и
повышая общую скорость фотолиза NADH.
др., Докл. РАН 428 (4), 474 (2009).
Ускоряющее действие фосфатов обусловлено их
свойствами - основностью и сродством к элек-
12.
А. А. Красновский и Г. П. Брин, Докл. АН СССР
трону; первое приводит к увеличению скорости
158 (1),225 (1964).
депротонирования NADH+ под действием гид-
13.
А. В. Умрихина, А. Н. Луганская и А. А. Краснов-
рофосфата, второе имеет своим следствием ак-
ский, Докл. АН СССР 304 (6),1485 (1989).
цептирование гидратированного электрона ор-
14.
J. Jortner, M. Ottolenghi, J. Rabani, et al., J. Chem.
тофосфатом с образованием атомарного водо-
Phys. 37, 2488 (1962).
рода.
15.
О. Н. Бржевская, Е. Н. Дегтярев, П. П. Левин и др.,
Докл. РАН 405 (2), 259 (2008).
Темновая реакция автоокисления NADH
16.
A. Anne, P. Hapiot, J. Moiroux, et al., J. Am. Chem.
ускоряется фосфатами и предположительно про-
Soc. 114, 4694 (1992).
исходит по одностадийному механизму гидрид-
ного переноса, поскольку в экспериментах с ис-
17.
J. Zielonka, A. Marcinek, J. Adamus, et al., J. Phys.
пользованием радикальных ловушек (молекуляр-
Chem. A 107 (46), 9860 (2003).
ный О2, TEMPOL) не обнаружено признаков
18.
B. Czochralska and L. Lindquist, Chem. Phys. Lett.
радикальной природы реакции.
101, 297 (1983).
19.
J. Moiroux and P. Elving, J. Am. Chem. Soc. 108, 6533
(1980).
ФИНАНСИРОВАНИЕ РАБОТЫ
20.
J. Gebicki, A. Marcinek, and J. Zielonka, Acc. Chem.
Res. 37(6), 379 (2004).
Работа выполнена при бюджетном финанси-
21.
C. O. Schmakel, K. S. V. Santhanam, and P. J. Elving,
ровании
(№ темы ФАНО:
0082-2014-0009,
J. Am. Chem. Soc. 97, 5083 (1975).
№ гос. регистрации: АААА-А17-117040610309-0).
22.
P. J. Elving, W.T. Bresnahan, J. Moiroux, et al., Bio-
electrochem. Bioenerg. 9, 365 (1982).
23.
J. Tornmalm, E. Sandberg, M. Rabasovic, et al., Sci.
КОНФЛИКТ ИНТЕРЕСОВ
Rep. 9, 15070 (2019). DOI: 10.1038/s41598-019-51526-w
Авторы заявляют об отсутствии конфликта
24.
B. Czochralska, W. Kawczynski, D. Bartosz, et al., Bio-
интересов.
chim. Biophys. Acta 801 (3), 40
БИОФИЗИКА том 66
№ 3
2021
РОЛЬ АНИОНОВ ФОСФАТА
453
The Role of Phosphate Anions in Photoinduced Auto-Oxidation of NADH
O.N. Brzevskaya*, E.N. Degtyarev**, and S.N. Kholuiskaya**
*Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Semenov Federal Research Center for Chemical Physics, Russian Academy of Sciences,
ul. Kosygina 4, Moscow, 119334 Russia
The EPR technique was used to study the effect of mono- and disubstituted phosphates on photolysis of re-
duced nicotinamide adenine dinucleotide (NADH) in frozen aqueous solution at 77°K. The dependence of
the yield of paramagnetic reaction intermediates - cation radical of NADH + and hydrogen atom on phos-
phate concentration was determined. The results obtained have been interpreted in terms of basicity and elec-
tron-withdrawing properties of phosphates. According to electron spectroscopy, a significant acceleration of
photoinduced auto-oxidation of NADH was detected under normal conditions (20°C, aqueous solution,
phosphate buffer, pH 6.3). The speed of the dark reaction is directly proportional to the total concentration
of ortho- and hydrophosphates, it is insensitive to oxygen. Experiments with nitroxyl trapping led to the con-
clusion that the reaction proceeds through the non-radical mechanism.
Keywords: NADH auto-oxidation, phosphate, EPR spectroscopy
БИОФИЗИКА том 66
№ 3
2021