БИОФИЗИКА, 2021, том 66, № 3, с. 454-465
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ИССЛЕДОВАНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ ВРЕМЕНИ
ЖИЗНИ ФЛУОРЕСЦЕНЦИИ ТРИПТОФАНА
В ДИАПАЗОНЕ -170°С - +20°С В РАЗЛИЧНЫХ РАСТВОРИТЕЛЯХ
© 2021 г. В.З. Пащенко, В.В. Горохов, Б.Н. Корватовский, П.П. Нокс,
Н.П. Гришанова, С.Н. Горячев
Биологический факультет Московского государственного университета имени М.В. Ломоносова,
119234 Москва, Ленинские горы, 1/12
E-mail: vz.paschenko@gmail.com
Поступила в редакцию 26.11.2019 г.
После доработки 25.02.2020 г.
Принята к публикации 20.02.2021 г.
Исследованы температурные зависимости (-170°С - +20°С) длительности флуоресценции молекул
триптофана в водном растворе, в растворах глицерина (50 и 75% по объему), диметилсульфоксида
(50 и 75% по объему) и в 1 М водном растворе трегалозы. В этом температурном диапазоне во всех
образцах кинетика флуоресценции наилучшим образом аппроксимируется тремя экспонентами с
характерными временами при комнатных температурах τ1 ~ 3 нс, τ2 ~ 4 нс и τ3 ~ 15 нс. Наблюдается
антибатный (противофазный) характер температурных зависимостей длительности флуоресцен-
ции наиболее быстрой и средней компонент в температурном диапазоне от -60°C до 10°C. Для объ-
яснения такого характера данных температурных зависимостей нами предложена новая модель
природы многокомпонентного свечения, учитывающая переход молекулы триптофана из возбуж-
денного состояния в состояние с разделением заряда, обратный переход в возбужденное состояние,
а также излучательный и безызлучательный переходы состояния с разделенными зарядами в основ-
ное состояние. Полученные результаты могут служить основой для интерпретации эксперимен-
тальных зависимостей длительности триптофановой флуоресценции от температуры в белках.
Ключевые слова: триптофан, флуоресценция, кинетика затухания флуоресценции, температурная
зависимость.
DOI: 10.31857/S0006302921030054
пользуется в качестве показателя, отражающего
Флуоресцентная спектроскопия триптофани-
состояние внутримолекулярной динамики белка,
лов в составе белков широко используется в каче-
в том числе при изменении температуры [5, 6].
стве природного внутреннего индикатора кон-
Сложнее ситуация с интерпретацией влияния со-
формационного состояния этих белков, их дина-
мики, а также процессов межмолекулярных
стояния окружения на длительность флуоресцен-
ции белковых триптофанилов. Особенно это от-
взаимодействий. Известно, что динамические
носится к малоисследованным температурным
(спектрально-кинетические) характеристики мо-
зависимостям длительности триптофановой бел-
лекул триптофана (Trp) сильно зависят от свойств
ковой флуоресценции в диапазоне от криогенных
окружающей среды [1, 2]. Собственная флуорес-
ценция индольного хромофора чувствительным
температур до комнатной. Очевидно, что деталь-
ное выяснение природы локальных изменений
образом реагирует на состояние окружающей
окружения триптофановых остатков в структуре
среды, а длительность и квантовый выход флуо-
белка, влияющих на регистрируемые в экспери-
ресценции являются индикатором даже неболь-
ших изменений в этом окружении [3, 4]. Так,
менте зависимости от температуры длительности
положение максимума спектра флуоресценции
флуоресценции (τ), требует комплексных иссле-
дований, включая различные модели, описываю-
белковых триптофанилов, определяемое релакса-
щие особенности изменения τ молекул Trp от
ционными характеристиками полярного окруже-
температуры в различных растворителях.
ния возбужденного хромофора, уже давно ис-
Наблюдаемый в экспериментах многокомпо-
Сокращения: Trp - триптофан, CTS - состояние с перено-
сом заряда (Charge Transfer State), ДМСО - диметилсуль-
нентный характер кинетики затухания флуорес-
фоксид, HB - водородные связи (Hydrogen Bonds).
ценции Trp в растворе, а также в составе пептидов
454
ИССЛЕДОВАНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ
455
и белков можно связать, в том числе, с наличием
В последнее время в литературе обсуждается
трех возможных ротамеров индольных колец во-
другой механизм возникновения двухкомпонент-
круг связи Сα-Сβ, возникающих в результате
ного характера кинетики затухания флуоресцен-
электростатических взаимодействий в молекуле
ции, который основан на возможности переноса
электрона с индольного кольца возбужденной
Trp [7-10]. При этом обычно удельное содержа-
ние одного из ротамеров существенно выше, чем
молекулы триптофана на амидные остатки или
двух других. В свою очередь, среди этих двух наи-
пептидные группы ближайшего окружения трип-
менее выраженных по содержанию ротамеров
тофана. Более того, в работе [12] с помощью мето-
дов молекулярной динамики и теории функцио-
также преобладает один. В случае, когда трипто-
нала электронной плотности (density functional
фаны находятся в составе белковой матрицы, в
дополнение к явным ротамерам боковой цепи Trp
theory - DFT) показана возможность образова-
специфическим источником гетерогенности ки-
ния в водном окружении трипофана упорядочен-
ной системы водородных связей, которая приво-
нетики регистрируемого сигнала флуоресценции
дит к появлению квазизоны для переноса элек-
являются микроконформационные состояния
трона от индольного кольца возбужденной
белков в локальном окружении индольного коль-
ца. Поэтому для белков правильнее говорить о
молекулы триптофана на водородные связи. В ре-
зультате возникает состояние с переносом заряда,
конформерах вместо ротамеров [10]. Наличие не-
которое переходит в основное состояние с более
скольких компонент в кинетике затухания флуо-
высокой (в два-три раза) скоростью, чем возбуж-
ресценции молекул Trp в белках связывают, в
денное состояние триптофана.
частности, с разными скоростями переноса элек-
трона в ротамерах к пептидным связям при воз-
В настоящей работе были исследованы темпе-
буждении триптофановых остатков [8, 9]. Удель-
ратурные зависимости кинетик затухания флуо-
ное содержание различных ротамеров, а также
ресценции водных растворов молекул Trp в при-
скорости дезактивации возбужденного состояния
сутствии таких агентов, как глицерин, трегалоза и
Trp в разных растворителях отличаются, поэтому
диметилсульфоксид. При этом, так же как и в ра-
и наблюдается различие в длительностях и кван-
боте [11], наблюдался антибатный характер тем-
товых выходах флуоресценции Trp в зависимости
пературных зависимостей длительности флуорес-
от растворителя [8, 9].
ценции быстрой и средней компонент в темпера-
турном диапазоне от
-60°C до
10°C. Для
В нашей предыдущей работе [11] были иссле-
объяснения антибатного характера наблюдаемых
дованы температурные зависимости кинетик за-
температурных зависимостей мы использовали
тухания флуоресценции молекул Trp в растворе
новую модель, описывающую переход молекулы
глицерина (50% по объемуу) и в 1 M водном рас-
Trp из возбужденного состояния в состояние с
творе трегалозы. Флуоресценцию измеряли в
разделенными зарядами (Trp* → CTS, где CTS -
спектральной области 292-417 нм с субнаносе-
состояние с переносом заряда (Charge Transfer
кундным временным разрешением. Оказалось,
State)), обратный переход CTS→ Trp*, а также из-
что при комнатной температуре кинетика флуо-
лучательный и безызлучательный переход CTS в
ресценции в обоих случаях хорошо аппроксими-
основное состояние. Физический смысл процес-
ровалась тремя экспонентами с временами τ1 ~ 4
сов перехода в новой модели совершенно иной,
нс, τ2 ~ 6 нс и τ3 ~ 12.5 нс. Было определено спек-
чем в ротамерной модели, использованной нами
тральное распределение амплитуд (Decay Associ-
ранее в работе [11]. Суть отличий состоит в том,
ated Spectra - DAS) этих компонент и установлен
что в ротамерной модели трехкомпонентное све-
антибатный (противофазный) характер темпера-
чение Trp объясняется присутствием трех разных
турных зависимостей длительности флуоресцен-
центров свечения, тогда как в новой модели три
ции быстрой и средней компонент в температур-
компоненты в кинетике затухания флуоресцен-
ном диапазоне от -60°C до 10°C. Третья (медлен-
ции являются следствием иных физических про-
ная) компонента давала незначительный вклад в
цессов, описывающих дезактивацию Trp* с уча-
сигнал флуоресценции и показывала слабую за-
стием промежуточного состояния с переносом
висимость от температуры во всем исследован-
заряда. Анализируемые нами эффекты, очевид-
ном диапазоне от -170°С до 20°C. В работе [11]
но, могут дать новый полезный материал для ин-
мы предположили, что наблюдаемое антибатное
терпретации экспериментальных зависимостей
поведение времен затухания флуоресценции двух
длительности триптофановой флуоресценции от
компонент в определенном температурном ин-
температуры в белках.
тервале обусловлено переходом части молекул
Trp, находящихся в возбужденном состоянии, из
МАТЕРИАЛЫ И МЕТОДЫ
коротковолновой формы, обладающей коротким
временем жизни флуоресценции, в длинновол-
В работе использовали триптофан, трегалозу и
новую форму с промежуточным значением дли-
диметилсульфоксид (ДМСО) фирмы Sigma
тельности флуоресценции.
(США), глицерин фирмы Merck (США). Измере-
БИОФИЗИКА том 66
№ 3
2021
456
ПАЩЕНКО и др.
ния кинетики флуоресценции проводили на уста-
нетик мы ограничились тремя экспонентами, так
новке с коррелированным по времени и длине
как дальнейшее увеличение числа компонент не
волны счетом единичных фотонов PML-16 (Beck-
приводило к снижению χr2. На первом этапе про-
водили свободное варьирование параметров ai и
becker-hickl.de/pdf/pml16c21.pdf2006).
Данная
τ
установка оборудована 16-канальной мультиа-
i для каждого спектрального канала. Затем полу-
нодной трубкой Hamamatsu R5900, содержащей
ченные значения τi (i = 1,…,3) усреднялись по
16 раздельных входных анодных элементов и об-
всем спектральным каналам. Полученные усред-
щую катодную и динодную систему. Получаемый
ненные значения τi подставляли в программу гло-
сигнал флуоресценции направляется в полихро-
бального анализа по всем спектральным каналам
матор с дифракционной решеткой 600 штри-
Globals Unlimited (Illinois University, США) как
хов/мм, обеспечивающей ширину спектральной
неварьируемые параметры для окончательного
полосы измерительной системы 200 нм с разре-
определения предэкспоненциальных коэффици-
шением 12.5 нм/канал. Это позволяет регистри-
ентов ai(λ), которые затем использовали для по-
ровать трехмерную картину флуоресценции, от-
лучения спектрального распределения этих ко-
ражающую изменения длительности (τ), длины
эффициентов:
волны (λ) и интенсивности (I) свечения. Флуо-
F(t, λ) = Σiai(λ)exp(-t/τi) (i = 1,…,3).
(1)
ресценцию образца возбуждали при 280 нм с по-
мощью пикосекундного полупроводникового ди-
Здесь ai(λ) представляет собой зависящий от
ода EPLED 280 (Edinburg Photonics, Шотландия),
длины волны сигнала флуоресценции предэкспо-
длительность импульса света составляла 870 пс,
ненциальный множитель компоненты с време-
спектральная ширина - 10 нм, частота следова-
нем жизни τi. Среднеквадратичное отклонение
ния импульсов 10 МГц. Для получения хорошего
2
отношения сигнал/шум время накопления сиг-
экспериментальной кривой от теоретической χr
нала было выбрано равным 30 с. Таким образом,
рассчитывалось по формуле: χr2 = 1/(N - p -
регистрируя трехмерное (τ, λ, I) изображение све-
чения триптофанилов, мы могли измерять кине-
1)Σj(dj - fj)2/sj2 (j = 1, … ,4096), где dj - экспери-
тики затухания флуоресценции в любом спек-
ментальные значения кинетики затухания флуо-
тральном канале. В эксперименте образец нахо-
ресценции в j-й момент времени, fj - значение
дился в охлаждаемой жидким азотом кювете,
рассчитанной для данного момента времени тео-
температуру которой контролировали с помощью
ретической кривой, равной свертке функции (1) с
термопары. Время охлаждения до -170°C состав-
аппаратной функцией (f = F⊗АФ), sj - дисперсия
ляло около 10 мин, скорость последующего на-
экспериментальной кривой в j-й точке, N - число
гревания была равной 5-7 град/мин.
экспериментальных точек, p - число параметров
Получаемый в результате измерений массив
теоретической кривой.
спектрально-кинетических данных представляет
собой набор кинетик затухания флуоресценции,
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
зарегистрированных при разных λ в области све-
чения Trp 292 - 425 нм с интервалом 12.5 нм. Чис-
В настоящей работе мы сопоставили темпера-
ло экспериментальных точек при регистрации
турные зависимости различных параметров, ха-
каждой кинетики составляло 4096. Для каждого
рактеризующих спектры флуоресценции Trp и
спектрального канала измеряли также число фо-
кинетики затухания флуоресценции в чистом
тонов, зарегистрированных в данной области
водном растворе, а также водных растворах гли-
спектра.
церина (50 и 75% по объему), ДМСО (50 и 75% по
объему) и 1 M водном растворе трегалозы. Мето-
Спектры поглощения в образцах измеряли с
дика обработки температурной зависимости этих
использованием спектрофотометра Hitachi-557
параметров во всех экспериментах была одинако-
(Hitachi Ltd., Япония), спектры флуоресценции
вой, поэтому детальный анализ данных мы при-
препаратов (λвозб = 280 нм) - на спектрофлуори-
водим только для водного раствора Trp.
метре Hitachi-850.
На рис. 1 и 2 представлены спектры поглоще-
Аппроксимацию экспериментальных кинетик
ния и флуоресценции раствора Trp в воде при
проводили для каждого спектрального канала
комнатной температуре. Из рис. 1 видно, что
при помощи программы SPCImage (Bekker &
спектр поглощения Trp в водном растворе обла-
Hickl, Germany) по формуле (1), позволяющей
дает сложной структурой и имеет длинноволно-
разлагать кинетики по методу Марквардта-Ле-
вое монотонно уменьшающееся по интенсивно-
венберга на сумму от одной до пяти экспонент,
сти крыло. Очевидно, что такой спектр поглоще-
свернутых с аппаратной функцией системы реги-
ния является суперпозицией нескольких центров
страции, измеряемой для каждого спектрального
поглощения, отличающихся положением их мак-
канала. При разложении экспериментальных ки-
симумов. Для детального анализа этот спектр был
БИОФИЗИКА том 66
№ 3
2021
ИССЛЕДОВАНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ
457
Рис. 1. Спектр поглощения триптофана в водном рас-
Рис. 2. Спектр флуоресценции триптофана в воде при
творе при комнатной температуре. Цифрами 1-5
комнатной температуре. Символами S1 и S2 обозна-
обозначены гауссовы компоненты разложения спек-
чены компоненты разложения спектра на гауссовы
тра поглощения на составляющие.
составляющие, а также их площади. На врезке пока-
зана зависимость отношения площадей гауссовых
компонент разложения спектра S2/S1 от темпера-
туры.
разложен на гауссовы компоненты. Видно, что в
спектре поглощения присутствуют две основных
(1 и 2) и две минорных компоненты (3 и 4), а так-
гоживущей ротамерной формы. Спектральная
же широкая полоса (5) в длинноволновой обла-
компонента (4) по своим характеристикам (поло-
сти. В литературе уже давно было отмечено, что
жение λmax, полуширина) близка к спектру по-
Trp в воде имеет две-три отчетливых компоненты
флуоресценции в зависимости от рН и три време-
глощения несольватированной или частично
ни жизни в присутствии органических раствори-
сольватированной формы Trp с длинным време-
нем затухания флуоресценции [21]. Широкая
телей типа метанола, этанола или диметилсуль-
длинноволновая компонента (5) спектра погло-
фоксида. Это объясняется наличием ротамеров
щения Trp связана, предположительно, с прямым
вокруг связи Cα-Cβ [7, 13]. При этом наблюдение
переходом молекулы Trp, окруженной сеткой во-
двух, а не трех компонентов может быть обуслов-
дородных связей (HB), при возбуждении из ос-
лено близкими временами жизни двух компонен-
новного состояния системы Trp + HB в состояние
тов и незначительным квантовым выходом од-
ного из них. Также понижение температуры,
с переносом заряда Trp+HB-, образующееся в ре-
согласно работе [14], может приводить к «вымо-
зультате перехода электрона с индольного кольца
раживанию» определенных ротамеров. Данная
на систему водородных связей, окружающих мо-
точка зрения впоследствии подтверждалась во
лекулу Trp. При понижении температуры ампли-
многих исследованиях [10, 15-18].
туда широкой компоненты уменьшается до нуля
при -60°C.
Ротамерная модель прямо подтверждается
данными ЯМР-спектроскопии, а также измере-
Несмотря на достаточно сложный спектр по-
ниями времени жизни триптофановой флуорес-
глощения Trp в водном растворе, его спектр флу-
ценции индивидуальных белковых кристаллов с
оресценции (рис. 2) характеризуется только дву-
единственным триптофановым остатком [19, 20].
мя компонентами, причем более слабая компо-
До настоящего времени в литературе нет све-
нента S2 является существенно уширенной по
дений о принадлежности центров поглощения
сравнению с основной полосой S1. Очевидно, что
(1 - 4) конкретным формам Trp в водном раство-
компонента S2 соответствует более короткому
ре. Отнесение полос к тем или иным формам Trp
времени жизни возбужденного состояния Trp,
можно сделать исходя из известных представле-
чем S1. Из данных спектров флуоресценции мож-
ний о связи вкладов и спектральной ширины
но сделать вывод, что основные ротамерные фор-
компонент в спектре поглощения с интенсивно-
мы триптофана (рис. 1, 1,2), в водном растворе ха-
стью и длительностью компонент в кинетике за-
рактеризуются близкими временами жизни флу-
тухания флуоресценции [8]. Мы считаем, что две
оресценции, а широкая полоса связана с
основных компоненты представляют собой поло-
процессами тушения флуоресценции и является
сы поглощения двух ротамеров, присутствующих
причиной немоноэкспоненциального характера
в водном растворе триптофана, одна из минор-
кинетики затухания флуоресценции. На рис. 3а,б
ных полос (3) соответствует спектру третьей дол-
приведено спектральное распределение амплитуд
БИОФИЗИКА том 66
№ 3
2021
458
ПАЩЕНКО и др.
Рис. 3. Спектральные распределения амплитуд для трех компонент флуоресценции триптофана в воде при
температуре 10°C (а) и -170°C (б); a1, a2, a3 - амплитуды этих компонент.
для трех компонент флуоресценции триптофана в
нагревания выше -20°С снова происходит изме-
воде с временами τ1 ≈ 3.1 нс, τ2 ≈ 4.5 нс , τ3 ≈ 15.4 нс
нение температурной зависимости вкладов A1 и
при температуре 10°С (рис. 3а) и τ1 ≈ 4.8 нс,
A2, т.е. вновь растет вклад от быстрой компонен-
τ2 ≈ 7.0 нс , τ3 ≈ 15.5 нс при -170°С (рис. 3б). Вид-
ты и падает вклад медленной компоненты. В дан-
но, что вклад третьей компоненты незначителен
ном температурном диапазоне противополож-
и практически не зависит от температуры. Такая
ным образом меняются и характерные длитель-
же картина наблюдалась и для третьей компонен-
ности компонент τ1 и τ2. В работе [11] эти
ты кинетики флуоресценции в других раствори-
изменения мы связали с индуцируемыми темпе-
телях. Поэтому во всех кинетических измерениях
ратурой переходами между двумя ротамерами Trp
мы представляли кинетику затухания флуорес-
ценции в трехэкспоненциальном приближении,
с максимальным значением скорости этого пере-
а дальнейший анализ данных проводили, учиты-
хода при температуре около -20°С. В окрестно-
вая только две наиболее быстрые экспоненты с
сти этой температуры (-20°С) происходит также
амплитудами a1 и a2. Отчетливо видно, что при
сдвиг длины волны (λmax) максимума в спектре флу-
комнатной температуре вклад быстрой компо-
оресценции первой компоненты (рис. 5). В то же
ненты (амплитуда a1) существенно меньше вкла-
да компоненты с амплитудой a2, а при -170°C
картина меняется на противоположную. Очевид-
но, необходимо было проанализировать поведе-
ние длительностей и вкладов этих компонент во
всем температурном диапазоне от -170°C до
20°C. Ход зависимости от температуры длитель-
ности (τ1,2) двух основных компонент флуорес-
ценции, а также их вкладов (площади A1 = a1τ1 и
A2 = a2τ2) в суммарную интенсивность флуорес-
ценции показаны на рис. 4.
Видно, в частности, что изменение параметров
A1 и A2 от температуры происходит антибатно (в
противофазе). Обращают на себя внимание два
температурных диапазона: от -150°C до -110°С и
от -90°С до 10°С, где отчетливо проявляется «пе-
рекачка» интенсивности флуоресценции первой
компоненты во вторую. Действительно, в диапа-
Рис. 4. Зависимости от температуры длительности
зоне температур от -170°С до -110°С вклад
(τ1, τ2) двух основных компонент флуоресценции, а
A1 > A2, затем наблюдается инверсия кривых
также вкладов данных компонент A1 = a1τ1 и A2 = a2τ2
A1(T) и A2(T) в диапазоне от -90°С до 10°С. После
в суммарную интенсивность флуоресценции.
БИОФИЗИКА том 66
№ 3
2021
ИССЛЕДОВАНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ
459
ных областей антибатного поведения короткого и
длинного времен затухания флуоресценции Trp).
Действительно, если смещение спектра люми-
несценции происходит в результате увеличения
подвижности растворителя, то в разных раство-
рителях это смещение должно наблюдаться в раз-
ных областях температур, а именно там, где про-
исходит активизация молекулярной динамики в
окружении флуоресцирующих хромофоров. Для
проверки этого предположения мы провели ис-
следование температурного сдвига λmax для вод-
ных растворов Trp в 50%-м и 75%-м глицерине, в
50%-м и 75%-м ДМСО и 1 М растворе трегалозы.
Результаты приведены в таблице.
Отметим прежде всего, что изменение состава
растворителя само по себе меняло исходное соот-
ношение «весов» А1 и А2 двух основных компо-
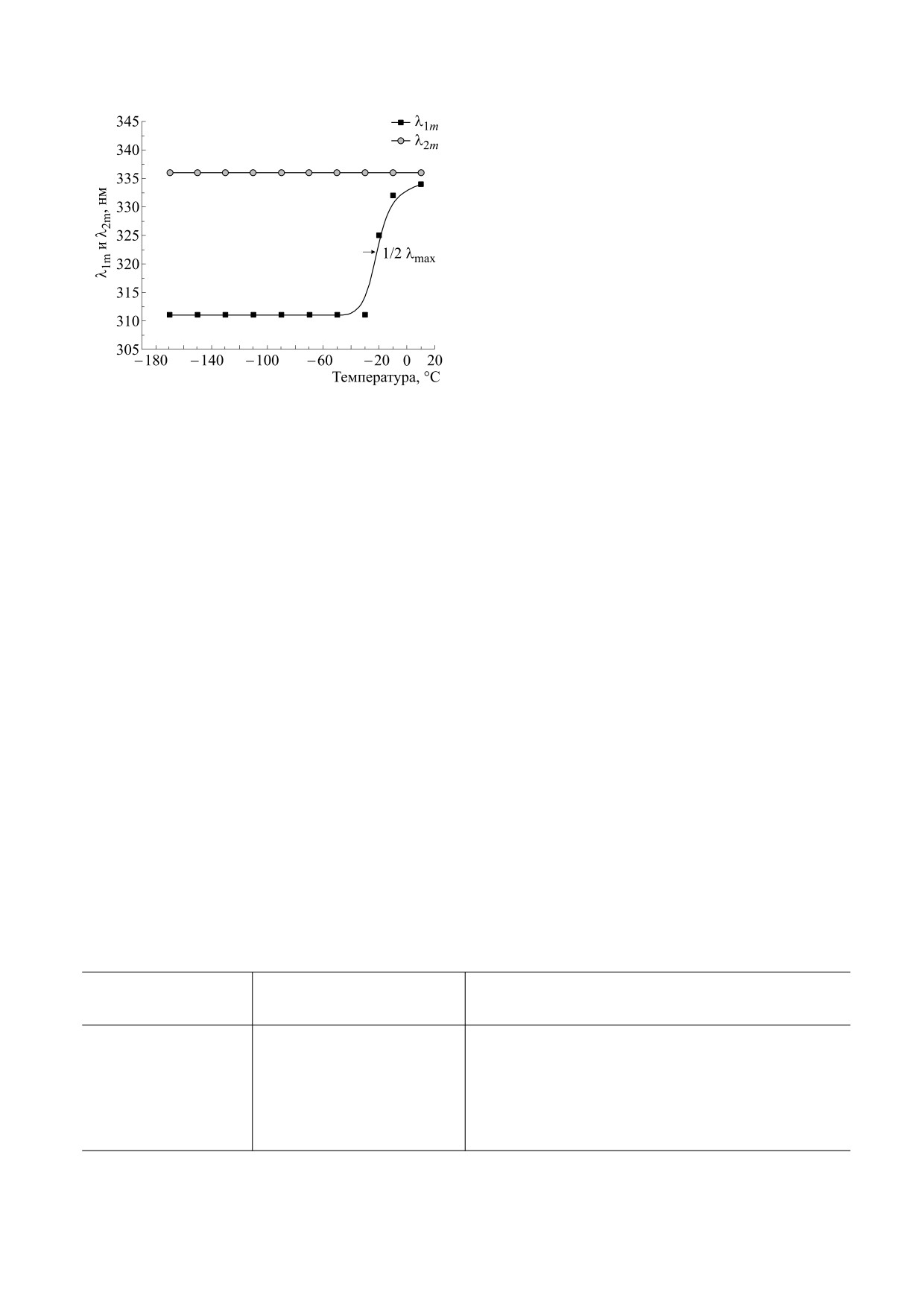
Рис. 5. Температурные зависимости длины волны
(λmax) максимального значения в спектральном рас-
нент флуоресценции в замороженных до -170°С
пределении первой и второй компонент флуоресцен-
образцах. Амплитуда третьей компоненты во всех
указывает на температу-
ции от температуры; 1/2 λmax
случаях продолжала оставаться незначительной.
первой компоненты флу-
ру половинного сдвига λmax
По сравнению с чисто водным раствором Trp со-
оресценции.
отношение весов А1 и А2 в растворе глицерина
увеличивалось, а в растворах ДМСО и трегалозы
время видно, что значение λmax второй компоненты
уменьшалось (см. таблицу).
флуоресценции остается постоянным во всем диапа-
Очевидно, что состав растворителя, определя-
зоне измеряемых температур: λmax ≈ 336 нм. Отме-
ющий детали его взаимодействия с индольным
ядром и аланильной боковой цепью молекулы
тим также, что λmax первой компоненты сохраняет
Trp, явным образом влияет на величину конкрет-
постоянное значение, равное 311 нм в диапазоне
ных соотношений популяций разных ротамеров,
температур от -170°С до ≈ -40°С, а при даль-
фиксируемых низкой температурой. Из таблицы
нейшем повышении температуры сдвигается к
также видно, что по сравнению с чисто водным
значениям, близким для таковых у второй компо-
раствором температурная точка половинного
ненты.
сдвига первой компоненты λmax, характеризую-
Известно, что сдвиг спектра люминесценции
щегося длительностью флуоресценции τ1, смеща-
флуоресцирующего хромофора при повышении
ется к ≈ -30°С и ≈ -40°С в растворах с 50% глице-
температуры связан с увеличением подвижности
рина и 50% ДМСО соответственно. Однако в рас-
его окружения [5, 8], в данном случае - диполей
творах с 75% глицерина и 75% ДМСО эта точка
воды. Полученная температура (около -20°С)
снова смещается к более высоким температурам:
скорее всего отвечает температуре затвердевания
к -12°С и -22°С соответственно. Этот факт явля-
(кристаллизации) 1 М раствора Trp в воде. Оче-
ется дополнительным подтверждением связи
видно, что в разных растворителях температура
температурной области регистрируемых нами пе-
затвердевания должна меняться. Соответственно,
реходов между ротамерами Trp с молекулярной
должны наблюдаться и разные значения темпера-
динамикой окружающего растворителя. Дей-
тур перехода между ротамерами Trp (температур-
ствительно, температуры затвердевания водных
Зависимость отношения спектральных вкладов и температуры половинного сдвигa λmax спектра первой
компоненты кинетики флуоресценции Trp от растворителя
Растворитель
А1/А2 (-170°С)
Температура половинного сдвига λmax первой
компоненты флуоресценции
Н2О
1.54
-20
50% глицерина
1.86
-30
75% глицерина
2.3
-12
50% ДМСО
≈ 1
-40
75% ДМСО
≈ 1
-22
1 М трегалоза
1.27
-5
БИОФИЗИКА том 66
№ 3
2021
460
ПАЩЕНКО и др.
растворов как глицерина, так и ДМСО немоно-
ции Trp в работе [12] выдвинуто предположение,
тонно зависят от соотношения глицерин/Н2О и
что при возбуждении молекул Trp происходит де-
ДМСО/Н2О. При смешивании двух чистых ком-
локализация электронной плотности между ин-
дольным кольцом и соседними молекулами воды.
понентов растворителя - глицерина и Н2О - тем-
При этом происходит напряжение сети водород-
пература затвердевания (замерзания) раствора
ных связей, приводящее к сильному красному
понижается по мере увеличения массовой доли
сдвигу спектра флуоресценции Trp в водном рас-
глицерина вплоть до -38°С при 70% содержании
творе. Как следует из наших экспериментальных
глицерина. При дальнейшем же увеличении кон-
данных, это предположение справедливо только в
центрации глицерина эта температура замерза-
определенном температурном диапазоне (-50°С÷
ния резко повышается. Аналогичная картина на-
10°С), в котором регистрируются широкие поло-
блюдается и с водными растворами ДМСО, с тем
сы с длинным крылом как в спектре поглощения,
уточнением, что минимальные температуры за-
так и в спектре флуоресценции, а также происхо-
твердевания смеси ДМСО/Н2О еще более низ-
дит сдвиг спектра флуоресценции быстрой ком-
кие, чем у смесей глицерина с водой [22-24].
поненты на ~20 нм. В остальной области темпера-
Что касается раствора трегалозы, то на основа-
тур перенос электрона может происходить на
нии второго закона Рауля [25] можно оценить, на
амидные группы основного скелета молекулы
какую величину должна понизиться температура
Trp, либо на обладающие электрон-акцепторны-
замерзания чистой воды в присутствии 1 М трега-
ми свойствами боковые пептидные связи. Кроме
того, мы предположили, что состояние с перено-
лозы. Оказывается, что эта температура составля-
сом заряда CTS может переходить обратно в воз-
ет ~ -3°С, что практически совпадает с величи-
бужденное состояние триптофана, а также в
ной 1/2 сдвига λmax первой компоненты флуорес-
основное состояние за счет излучательного и
ценции Trp в растворе трегалозы: -5°С (см.
безызлучательного процессов. В этом случае мо-
таблицу).
ноэкспоненциальная кинетика затухания флуо-
Многокомпонентный характер кинетик зату-
ресценции Trp приобретает двухкомпонентный
хания флуоресценции Trp обычно связывают с
характер. Процессы, происходящие при возбуж-
переходами между его различными ротамерами
дении Trp в водном окружении, можно предста-
[8]. В нашей работе [11] антибатный характер тем-
вить в виде модельной схемы, показанной на
пературной зависимости короткого (τ1) и длин-
рис. 6. Эта схема использовалась для проведения
ного (τ2) времени жизни кинетики затухания
целевого анализа («Target analysis») кинетики за-
флуоресценции Trp в растворе мы объяснили пе-
тухания флуоресценции Trp и определения пара-
метров, характеризующих динамику процессов
реходом между двумя ротамерными формами Trp
при возбуждении Trp в водной среде. При разло-
в возбужденном состоянии. При этом каждой
жении кинетики согласно модели рис. 6 опреде-
форме Trp приписывалась свое время жизни флу-
ленные параметры приходилось задавать априо-
оресценции.
ри из известных спектроскопических данных:
Однако возможен и альтернативный подход к
например, константа скорости затухания флуо-
объяснению особенностей зависимости длитель-
ресценции Trp полагалась равной обратному вре-
ностей и квантовых выходов флуоресценции Trp
мени затухания флуоресценции формы 4, состав-
от температуры, основанный на иных физиче-
лявшей (14.5 нс)-1, константа скорости излуча-
ских механизмах возникновения многокомпо-
тельного перехода CTS в основное состояние
нентной кинетики затухания флуоресценции. В
молекулы триптофана оценивалась по ширине
последнее время в ряде работ появились сведе-
полосы минорной формы (S2) спектра флуорес-
ния, что кинетики флуоресценции собственно
ротамерных форм Trp моноэкспоненциальны,
ценции Trp (рис. 2) и принималась равной (8 нс)-1.
причем длительность флуоресценции разных ро-
Остальные параметры кинетической схемы опре-
тамеров отличается незначительно [26]. При этом
делялись в процессе аппроксимации кинетики
тушение флуоресценции какой-либо ротамерной
затухания флуоресценции. При этом существова-
формы Trp и связанный с этим многокомпонент-
ние состояния с делокализованным электроном в
ный характер кинетики затухания флуоресцен-
системе водородных связей предполагалось толь-
ции Trp в белках объясняется дополнительным
ко в области температур -50°С÷10°С. По нашему
каналом дезактивации возбужденного состояния
мнению, в области температур -170°С÷-50°С
Trp - переносом электрона с возбужденного ин-
тушение флуоресцении Trp и немоноэкспонен-
дольного кольца на амидные группы основного
циальный характер кинетики затухания флуорес-
скелета Trp либо на его электрон-акцепторные
ценции обусловлены переносом электрона с воз-
боковые связи. В белке также возможен перенос
бужденного индольного кольца молекулы Trp на
протона с ближайших аминокислот, например с
амидные группы основного скелета либо на обла-
тирозина на индольное кольцо [27]. Для объясне-
дающие электрон-акцепторными свойствами бо-
ния природы многокомпонентного свечения Trp
ковые пептидные связи. Этот процесс сопровож-
в воде, а также механизмов тушения флуоресцен-
дается образованием состояния с переносом за-
БИОФИЗИКА том 66
№ 3
2021
ИССЛЕДОВАНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ
461
ряда и обратным переходом в возбужденное
состояние индольного кольца, а также возмож-
ной релаксацией состояния с переносом заряда в
основное состояние. Описываемая схема кинети-
ческих процессов (рис. 6) применима также и для
описания переходов между ротамерными форма-
ми Trp, приводящих к антибатной температурной
зависимости времени жизни компонент в кине-
тике флуоресценции [11]. В математическом пла-
не использованная нами в работе [11] модель пере-
хода одной ротамерной формы в другую сходна с
моделью, описывающей переходы каждой ротамер-
ной формы в состояние с переносом заряда с уче-
том обратного перехода. Для ответа на вопрос, ка-
кая модель физически более адекватно описывает
переходы в возбужденном состоянии молекулы
Trp, необходимо провести измерение кинетик из-
менения оптической плотности в области погло-
щения триптофана. Это требует, однако, наличия
соответствующей экспериментальной техники.
Рис. 6. Модельная схема кинетических переходов в
триптофане: n1, n2 - населенности возбужденного со-
Модель переходов молекулы Trp с образовани-
стояния молекул Trp и состояния с переносом заряда,
ем состояния с переносом заряда CTS (рис. 6)
Trp+R- - состояние с переносом заряда (CTS), где R
описывается следующей системой дифференци-
может обозначать как систему водородных связей в
альных уравнений:
окружении молекулы Trp , так и амидные группы и
пептидные связи с электрон-акцепторными свой-
ствами, связанные с Trp, kF1 - константа скорости за-
dn
1
тухания флуоресценции возбужденного состояния
= -(k
F1
+
k
R1
+
k
12
)n
1
+
k
21 2
n,
триптофана, k12 - скорость перехода Trp* в состояние
dt
(2)
CTS; kR1 - скорость безызлучательного перехода Trp*
dn
2
=k
n
-
(k
+k
+k
)n ,
в основное состояние, k21 - скорость обратного пере-
12 1
F2
R2
21
2
dt
хода CTS → Trp*, kF2 - скорость излучательного пере-
хода CTS на основной уровень, kR2 - скорость безыз-
где n1 обозначает населенность возбужденных
лучательного перехода CTS на основной уровень Trp,
молекул Trp*, n2 - населенность состояния с пе-
ΔG - разность уровней энтальпии состояний Trp* и
реносом заряда CTS, kF1 - скорость затухания
CTS, Er - энергия реорганизации среды, связанная с
флуоресценции Trp* без учета скорости перехода
образованием CTS. Горизонтальными штрихованны-
ми линиями показаны некоторые колебательные
в состояние n2, kR1 - скорость безызлучательного
уровни основного и возбужденных состояний Trp.
перехода Trp* в основное состояние, k12 - ско-
рость перехода возбужденного состояния Trp* в
состояние с переносом заряда n2 , k21 - скорость
длительности τ1 и τ2 двух компонент разложения
обратного перехода CTS → Trp*, kF2, kR2 - скоро-
кинетики флуоресценции в виде формул:
сти излучательного и безызлучательного перехо-
k
1t
kt,
дов CTS на основной уровень, ΔG - разность
n1(t) = a1e-
+ a2e-
уровней энтальпии возбужденного состояния
триптофана Trp* и CTS.
k
t
kt,
1
n2(t) = b1e-
+ b2e-
(3)
Аппроксимацию кинетики затухания флуо-
ресценции проводили минимизацией функцио-
1
1
2
=k
=
g
+ g
±
(g
−g
)
+
4k
k
,
нала среднеквадратичной ошибки эксперимен-
1,2
(
1
2
1
2
12
21
)
τ
1,2
2
тальной кинетики и теоретической кривой при
варьировании параметров кинетической схемы
где g1 = kF1 + kR1 + k12, g2 = k21 + kF2 + kR2.
рис. 6. Теоретические кривые сворачивались с ап-
паратной функцией системы регистрации. Дан-
Для a1, a2, b1, b2 выражения имеют следующий
ная аппроксимация позволяет непосредственно
вид:
определять скорости прямого перехода k12 и об-
ратной рекомбинации k21.
g
−
k
k
−
g
1
2
1
1
a1
=
;
a2
=
;
k
−
k
k
−
k
Решение системы дифференциальных уравне-
1
2
1
2
−k
k
ний, описывающих переходы молекулы Trp (рис. 6),
12
12
b1
=
;
b
2
=
дает выражения для населенностей n1 и n2, а также
k
-
k
k
−
k
1
2
1
2
БИОФИЗИКА том 66
№ 3
2021
462
ПАЩЕНКО и др.
Рис. 8. Температурные зависимости скоростей пере-
Рис. 7. Спектральные зависимости величины кон-
хода триптофана из возбужденного состояния в со-
станты скорости перехода возбужденного состояния
стояние с переносом заряда k12 и обратного перехо-
триптофана в состояние с переносом заряда. На дан-
ном рисунке не приведен спектр при -50°С, так как
да k21.
он практически повторяет спектр при -110°С.
зависимость от длины волны уширена, что при-
Из данных выражений следует, что a1 + a2 = 1;
водит к дополнительному увеличению этой ско-
b2 = -b1;
рости и соответствующему уменьшению времени
жизни компоненты кинетики флуоресценции с
Обозначения параметров в уравнении (1) ука-
временем затухания τ1 в данном температурном
заны в подписи к рис. 6.
диапазоне. При этом, согласно уравнению (3),
При фитировании кинетик флуоресценции
время жизни компоненты кинетики флуоресцен-
согласно модели рис. 6 значение для n2(t) необхо-
ции с временем жизни τ2 увеличивается. Это при-
димо умножать на квантовый выход флуоресцен-
водит к антибатному характеру температурных
F2
k
ции этого состояния
φ
=
зависимостей времени жизни короткой и длин-
F2
k
F2
+
k
R2
ной компонент кинетики флуоресценции Trp в
Согласно полученным выражениям для k1 и
водном растворе в области -50°С÷-10°С. Таким
k2, если в некоторой области температур значе-
образом, выражение (3) позволяет естественным
образом описать антибатный характер времен
ние k1 увеличивается за счет роста подкоренного
жизни флуоресценции τ1 и τ2 при увеличении
члена (3), то значение k2 в этой же области будет
константы скорости перехода k12 из возбужден-
уменьшаться. В результате будет наблюдаться ан-
ного состояния Trp в состояние с переносом заря-
тибатный характер температурных зависимостей
да, поскольку изменение величин констант ско-
времени жизни короткой и длинной компонент
кинетики флуоресценции Trp в водном растворе в
ростей k1 и k2 происходит при этом в противопо-
соответствующей температурной области.
ложном направлении (при увеличении значения
k1 величина k2 уменьшается). Обращает на себя
Таким образом, используя теоретическую мо-
внимание существование длинноволнового вкла-
дель (3), а также схему, представленную на рис. 6,
да в константу скорости перехода при температу-
мы смогли описать экспериментальные темпера-
рах 10°С и -10°С, что коррелирует с существова-
турные зависимости длительностей компонент τ1
нием при данных температурах широкой полосы
и τ2. Кроме того, решение системы уравнений (2)
с длинноволным хвостом как в спектре поглоще-
позволило определить значения коэффициентов
ния, так и в спектре флуоресценции Trp (рис. 1
a1, a2, b1, b2 и построить зависимость величины
и 2). В остальной температурной области приве-
константы скорости перехода триптофана k12 в
денная модель позволяет объяснить тушение
состояние с переносом заряда от длины волны
флуоресценции Trp и двухкомпонентный харак-
при разных температурах, показанную на рис. 7.
тер кинетики затухания флуоресценции даже в
Видно, что в области температур от -50°С до -
предположении, что времена жизни флуоресцен-
10°С константа скорости перехода Trp из возбуж-
ции ротамерных форм в отсутствие «сольватиру-
денного состояния в состояние с переносом заря-
ющей» сетки водородных связей примерно
да k12 имеет большее значение в сравнении с дру-
одинаковы. Так, на рис. 8 показана зависимость
гими температурами (10°С, -110°С), при этом ее
констант скоростей прямого перехода из возбуж-
БИОФИЗИКА том 66
№ 3
2021
ИССЛЕДОВАНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ
463
денного состояния Trp* в состояние с переносом
в которой взаимодействие диполей водородных
заряда CTS k12 и обратного перехода k21 от темпе-
связей достаточно велико, чтобы вызвать упоря-
ратуры. Видно, что в температурной области
дочивание сетки водородных связей. При этом
-60°С÷10°С данные константы имеют большие
температура должна быть ниже некоторой крити-
значения по сравнению с таковыми при других
ческой, превышение которой может привести к
температурах. Изменения констант скоростей k21
разупорядочиванию этой сетки и исчезновению
проводимости. В нашем случае - это температур-
и k12 от температуры качественно похожи, за ис-
ная область, индикатором которой является по-
ключением того, что k21 имеет меньшие значения
явление широких полос в спектре поглощения и
во всем диапазоне температур. Это связано с ар-
спектре флуоресценции триптофана. Другим
рениусовской зависимостью константы скорости
признаком возникновения упорядоченной систе-
обратного перехода от скорости прямого перехо-
мы водородных связей и образования в ней ква-
да, энергетического зазора ΔE и температуры T
зизоны проводимости служит антибатность тем-
(k21 = k12 exp(-ΔE/kT)). В результате, согласно
пературной зависимости короткого и длинного
уравнениям (3), в данной области температур и
времени жизни флуоресценции триптофана.
наблюдается антибатное поведение времени за-
тухания флуоресценции τ1 и τ2.
ЗАКЛЮЧЕНИЕ
Отметим, что значения τ1 и τ2, рассчитанные
В использованном нами подходе к изучению
на основе модели, представленной на рис. 6,
флуоресцентных свойств триптофана в водном
близки к данным, полученным в результате гло-
растворе возникновение тушения флуоресцен-
бального анализа кинетик, а их спектры близки к
ции и переход от моноэкспоненциальной кине-
спектральному распределению амплитуд гло-
тики флуоресценции триптофана к многокомпо-
бального анализа (рис. 3а,б). Величина χ2 при ап-
нентному свечению объясняется переносом
проксимации согласно схеме на рис. 6 не превы-
электрона от индольного кольца на амидные
шала 1.5.
группы или на водородные связи окружающей
молекулу Trp воды. Данный процесс сопровожда-
Влияние водородных связей в окружении воз-
ется образованием состояния с переносом заряда.
бужденных хромофоров на их флуоресцентные
При этом возможен обратный переход из данного
свойства изучалось в ряде работ (см., например,
состояния в возбужденное состояние Trp, либо
монографию [28]). В частности, в работе [26] по-
излучательный или безызлучательный переходы
казано, что сильное влияние на вероятность пе-
на основной уровень. В температурной области
рехода молекулы Trp в состояние с переносом за-
-50°С÷-10°С главную роль в образовании состо-
ряда в белке оказывает расположение диполей
яния с переносом заряда может играть сетка
окружающей воды относительно индольного
окружающих молекулы Trp водородных связей в
кольца. В работе [29] выдвинуто предположение,
результате их частичного упорядочивания и обра-
что при возбуждении молекул Trp формируются
зования квазизоны проводимости. Как след-
эксиплексы молекул растворителя с индольным
ствие, происходит перенос электрона от возбуж-
кольцом. Последние образуются и стабилизиру-
денного индольного кольца в систему водород-
ются в результате диполь-дипольных взаимодей-
ных связей и его делокализация. В результате
ствий молекул растворителя с атомами индольно-
изменяются как спектр, так кинетика флуорес-
го кольца в возбужденном состоянии. В работе
ценции Trp в водном растворе. Отметим, что воз-
[12] показано, что возбужденное состояние Trp в
можен и прямой переход молекулы триптофана в
воде переходит в состояние с переносом заряда в
состояние с делокализованным электроном, что
результате взаимодействия индольного кольца c
приводит к возникновению широкого длинно-
молекулами воды. Этот переход сопровождается
волнового крыла в спектре поглощения (рис. 1).
образованием цвиттерионного комплекса и на-
пряжением определенных водородных связей.
Таким образом, температурные зависимости
При этом происходит частичное упорядочивание
длительности флуоресценции Trp в растворе мо-
водородных связей, в результате чего в системе
гут быть объяснены как переходами между раз-
водородных связей возникает квазизона прово-
личными формами ротамеров Trp [11], так и пере-
димости для электрона индольного кольца, в ко-
ходами между возбужденным состоянием трип-
торой электрон делокализуется. Наши данные
тофана и состоянием с переносом заряда,
указывают, что состояние с переносом заряда мо-
образующимся при переносе электрона с индоль-
жет переходить в возбужденное состояние моле-
ного кольца на обладающие электрон-акцептор-
кулы Trp, а также релаксировать в основное со-
ными свойствами амидные группы, пептидные
стояние. При этом образование квазизоны про-
связи или водородные связи ближайшего окруже-
водимости в системе водородных связей и
ния молекул Trp. Отличие этих моделей состоит в
делокализация электрона по молекулам воды
следующем: в случае ротамерной модели три ком-
происходят в определенной области температур,
поненты кинетики затухания флуоресценции
БИОФИЗИКА том 66
№ 3
2021
464
ПАЩЕНКО и др.
объясняются присутствием трех различных
3.
Y. Chen and M. D. Barkley, Biochemistry 3, 9976
центров свечения, при этом при изменении тем-
(1998).
пературы часть молекул Trp, находящихся в воз-
4.
G. Mei, A. Di Venere, A. F. Agrò, et al., J. Fluoresc. 13,
бужденном состоянии, может переходить из ко-
467 (2003).
ротковолновой короткоживущей формы в длин-
5.
Э. А. Бурштейн, Молекуляр. биология 17, 455
новолновую форму с большим временем жизни.
(1983).
Новая модель объясняет физический механизм
6.
Y. K. Reshetnyak and E. A. Burstein, Biophys. J. 81,
возникновения многокомпонентного сигнала
1710 (2001).
флуоресценции при возбуждении молекул Trp,
находящихся в идентичных условиях. При этом
7.
A. G. Szabo and D. M. Rayner, J. Am. Chem. Soc. 102,
дезактивация молекул Trp* происходит либо не-
554 (1980).
посредственно в основное состояние, либо через
8.
J. R. Lakowicz, Principles of fluorescence spectroscopy,
промежуточное состояние CTS. Выводы о пред-
3nd ed. (Springer, N. Y., 2006).
почтительном характере той или другой модели
9.
P. D. Adams, Y. Chen, K. Ma, et al., J. Am. Chem. Soc.
можно будет сделать в результате дальнейших ис-
124, 9278 (2002).
следований. Может оказаться, что для некоторых
10.
J. A. Ross and D. M. Jameson, Photochem. Photobiol.
случаев, например для триптофанов в составе
Sci. 7, 1301(2008).
белков (может быть гидрофобных) в реакцион-
ных центрах или в других системах, может быть
11.
В. В. Горохов, П. П. Нокс, Б. Н. Корватовский и
справедливым существование ротамеров, приво-
др., Биохимия 82, 1615 (2017).
дящее к двухкомпонентному характеру кинетики
12.
H. Liu, H. Zhang, and B. Jin, Spectrochim. Acta Part
флуоресценции триптофана. В других случаях, в
A: Mol. Biomol. Spectroscopy 106, 54 (2013).
частности для растворов триптофана в водной
13.
E. Gudgin, R. Lopez-Deigado, and W. R. Ware, Phys.
среде или в гидрофильных белках, более подходя-
Chem. 87, 1559 (1983).
щей окажется модель, связанная с переносом
14.
J. W. Petrich, M. C. Chang, D. B. McDonald, and
заряда и образованием состояния с переносом
G. R. Fleming, J. Am. Chem. Soc. 105, 3824 (1983).]
электрона, в том числе с образованием системы
упорядоченных водородных связей (цвиттерион-
15.
M. Hellings, M. De Maeyer, and S. Verheyden, Bio-
ного комплекса [12]) в окружении возбужденной
phys. J. 85, 1894 (2003).
молекулы триптофана.
16.
T. Liu, P. R. Callis, B. H. Hesp, and M. de Groot, J.
Совершенно ясно, однако, что результаты
Am. Chem. Soc. 127, 4104 (2005).
данного исследования необходимо учитывать
17.
C.-P. Pan, P. L. Muino, M. D. Barkley, and P. R. Cal-
при анализе температурных зависимостей време-
lis, J. Phys. Chem. B 115, 3245 (2011).
ни жизни флуоресценции Trp в составе белков.
18.
A. Kadyan, S. Juneja, and S. J. Pandey, Phys. Chem. B
123, 7578 (2019).
БЛАГОДАРНОСТИ
19.
J. B. A. Ross, H. R. Wyssbrod, R. A. Porter, and
G. P. Schwartz, Biochemistry 31, 1585 (1992).
Авторы благодарят Е.П. Лукашева за помощь в
20.
T. E. S. Dahms, K. J. Willis, and A. G. Szabo, J. Am.
измерении спектров поглощения и флуоресцен-
Chem. Soc. 117, 2321(1995).
ции триптофана в водном растворе.
21.
I. Compagnon, F. C. Hagemeister, R. Antoine, et al., J.
Am. Chem. Soc. 123, 8440 (2001).
КОНФЛИКТ ИНТЕРЕСОВ
22.
Physical properties of glycerine and its solutions (Glycer-
ine Producers' Association, N. Y., 1963).
Авторы заявляют об отсутствии конфликта
интересов.
23.
R. N. Havemeyer, J. Pharmaceutic. Sci. 55, 851(1966).
24.
J. J. Towey, A. K. Soper, and L. Dougan, J. Phys.
Chem. B 120, 4439 (2016) .
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
25.
Физическая химия, под ред. К. С. Краснова, 3-е изд.
Настоящая статья не содержит описания ка-
(Высш. школа, М., 2001), т. 1.
ких-либо исследований с использованием людей
26.
M. R. Hilairea, I. A. Ahmed, C.-W. Lina, et al., Proc.
или животных в качестве объектов.
Natl. Acad. Sci. USA 114, 6005 (2017).
27.
P. R. Callis, J. Mol. Struct. 1077, 22 (2014).
СПИСОК ЛИТЕРАТУРЫ
28.
K. L. Han and G. J. Zhao, Hydrogen Bonding and
1. J. L. Dashnau, B. Zelent, and J. M. Vanderkooi, Bio-
Transfer in the Excited State (John Wiley & Sons Ltd.,
phys. Chem. 114, 71 (2005).
Chichester, UK, 2011).
2. D. E. Schlamadinger, J. E. Gable, and J. E. Kim, J.
29.
M. V. Hershberger and R. Lumry, Photochem. Photo-
Phys. Chem. B 113, 14769 (2009).
biol. 23, 391(1976).
БИОФИЗИКА том 66
№ 3
2021
ИССЛЕДОВАНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ
465
The Study of the Temperature Dependence of Tryptophane Fluorescence Lifetime
in the Range of -170°С to +20°С in Various Solvents
V.Z. Paschenko, V.V. Gorokhov, B.N. Korvatovsky, P.P. Knox,
N.P. Grishanova, and S.N. Goryachev
Faculty of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119234 Russia
The temperature dependences of the fluorescence lifetime of tryptophan molecules in an aqueous solution,
aqueous solutions of glycerol (50 and 75%, v/v) and dimethyl sulfoxide (50 and 75%, v/v) and 1 M aqueous
trehalose solution were studied in the range of -170°С - +20°С. In this temperature range, the fluorescence
kinetics in all samples is best approximated by three exponential terms with characteristic times τ1 ~ 3 ns,
τ2 ~ 4 ns and τ3 ~ 15 ns at room temperature. Temperature dependences of fluorescence lifetimes for the fast-
est and medium components exhibited antisymbatic (antiphase) behavior in the temperature range of -60°C
to 10°C is observed. To explain the behavior of these temperature dependences, a new model of the nature of
multicomponent fluorescence kinetics was suggested. This model takes into account the transition of a tryp-
tophan molecule from the excited state to the state with separated charges—charge transfer state, the transi-
tion back to the excited state, radiative and non-radiative transitions of the charge transfer state to the ground
state. The obtained results can be used for explanation the experimental temperature dependences of trypto-
phan fluorescence lifetime in proteins.
Keywords: tryptophan, fluorescence, fluorescence decay kinetics, temperature dependence
БИОФИЗИКА том 66
№ 3
2021