БИОФИЗИКА, 2021, том 66, № 3, с. 482-488
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ИНГИБИРУЮЩАЯ ЭФФЕКТИВНОСТЬ ЛИПИДНОГО КОМПОНЕНТА
РАСТИТЕЛЬНЫХ ОБЪЕКТОВ В ЗАВИСИМОСТИ
ОТ ПОЛЯРНОСТИ ЭЛЮЕНТА
© 2021 г. Л.Н. Шишкина, Л.И. Мазалецкая, А.Н. Смирнова, В.О. Швыдкий
Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
E-mail: shishkina@sky.chph.ras.ru
Поступила в редакцию 26.01.2021 г.
После доработки 26.01.2021 г.
Принята к публикации 05.02.2021 г.
Изучены антиоксидантные свойства, спектральные характеристики и состав липидов, выделенных
из цветков календулы и плодов облепихи и из их 50%-х водно-пропиленгликолевых экстрактов.
Выявлены существенные количественные различия ингибирующей эффективности, количествен-
ного соотношения фракций липидов и присутствия в их хлороформном растворе биологически ак-
тивных веществ в зависимости от полярности элюентов, что обусловливает способность липидного
компонента растительных объектов принимать участие в регуляции окисления на разных стадиях
процесса. Это подтверждено анализом кинетических кривых накопления пероксидов с помощью
компьютерного пакета программ KINS и математической обработкой УФ-спектров растворов ли-
пидов по методу Гаусса.
Ключевые слова: ингибирующая эффективность, липиды, экстракты, низкотемпературное окисление,
УФ-спектрофотометрия, компьютерное моделирование
DOI: 10.31857/S000630292103008X
Наличие в растениях таких биологически ак-
анализа антиоксидантных свойств различных
компонентов клеток, АО и их смесей одним из
тивных веществ (БАВ), как флавоноиды и каро-
наиболее используемых в качестве модельного
тиноиды, рассматривается в качестве основной
субстрата окисления является метилолеат. В био-
причины их фармакологического действия, кото-
логических мембранах процессы перекисного
рое обычно связывают с антиоксидантными
окисления липидов преимущественно протекают
свойствами БАВ [1-5]. Существенно более низ-
в диффузионном режиме, что позволяет рассмат-
кая токсичность природных соединений для ор-
ривать модель автоокисления метилолеата в тон-
ганизма по сравнению с синтетическими препа-
ком слое как адекватную модельную систему для
ратами обусловливает необходимость детального
изучения участия компонентов различных объек-
изучения механизма антиоксидантных свойств
тов в регуляции перекисного окисления липидов
компонентов растений с целью поиска среди них
[7, 8].
новых источников для создания фармакологиче-
ских средств. Антиоксиданты (АО) принимают ак-
Для приготовления экстрактов из различных
тивное участие в регуляции окислительных про-
растительных объектов, в составе которых при-
цессов в любых системах, однако их эффектив-
сутствуют БАВ и общие липиды [9], преимуще-
ность существенно зависит как от концентрации
ственно используются водные смеси различных
кислорода, так и от состава субстрата окисления.
спиртов с разным соотношением элюентов. Де-
тальному анализу состава ФЛ растений и ряда
Основными субстратами окисления в биоло-
растительных экстрактов посвящены лишь еди-
гических системах являются фосфолипиды (ФЛ),
ничные исследования последних лет [10-14]. Не-
являющиеся одними из главных структурных
смотря на то что цветки календулы и плоды обле-
компонентов мембран и играющих важную роль
пихи широко применяются в фармакологии, све-
в регуляции метаболизма в организме [6]. Для
дения о детальном составе их ФЛ и влиянии
полярности элюентов на физико-химические
Сокращения: БАВ - биологически активные вещества, свойства липидов экстрактов единичны [14].
АО - антиоксиданты, ФЛ - фосфолипиды, ВПГ - водно-
пропиленгликолевый, ФХ - фосфатидилхолин, ФЭ -
Целью работы явилось оценить участие ли-
фосфатидилэтаноламин.
пидного компонента растений на разных стадиях
482
ИНГИБИРУЮЩАЯ ЭФФЕКТИВНОСТЬ ЛИПИДНОГО КОМПОНЕНТА
483
процесса окисления модельного субстрата на ос-
Антиоксидантные свойства липидов определяли
новании сравнительного анализа антиоксидант-
по их способности тормозить автоокисление мети-
ных свойств, наличия БАВ и состава липидов
лолеата (RH) в тонком слое при 323 K в диффузион-
цветков календулы и плодов облепихи в зависи-
ной области, когда концентрация кислорода обу-
мости от полярности элюента.
словлена скоростью его диффузии в слой метилоле-
ата. Для этого липиды после отгонки хлороформа
растворяли в метилолеате в диапазоне концентра-
МАТЕРИАЛЫ И МЕТОДЫ
ций от 7.1 ⋅ 10-4 до 3.57 ⋅ 10-3 моль/л (0.5-2.5 мг/мл).
Объектами исследования являлись липиды,
Процесс окисления контролировали по накопле-
выделенные из свежесобранных в Московской
нию гидропероксидов (ROOH), концентрацию ко-
области цветков календулы лекарственной (Ca-
торых определяли методом йодометрического тит-
lendula officinalis L.) и замороженных плодов обле-
рования (ошибка измерения не превышала 5%). За
пихи крушиновидной (Hippophoe rhamnoides L.) и
период индукции (τ) принимали время, рассчитан-
их 50%-х водно-пропиленгликолевых (ВПГ) экс-
ное из кинетических кривых накопления ROOH от
трактов. Методика приготовления ВПГ экстрак-
начала опыта до точки пересечения линейных
тов подробно изложена в работе [14].
участков кинетической кривой, соответствующих
Взвешенные цветки календулы и плоды обле-
начальной скорости окисления в периоде индукции
и максимальной скорости накопления пероксидов
пихи растирали в дистиллированной воде в соот-
[19]. Кинетические кривые анализировали с помо-
ношении 1 г сырой массы : 1.95 мл дистиллиро-
щью пакета компьютерных программ KINS [20].
ванной воды. Липиды из растительных объектов
и их экстрактов извлекали по методу Фолча в мо-
Ингибирующую эффективность оценивали по
дификации Кейтса [15]. Качественный и количе-
разности величин периода индукции окисления
ственный состав ФЛ определяли методом тонко-
RH в присутствии и отсутствие исследуемых до-
слойной хроматографии [16], используя силика-
бавок (Δτ), отнесенной к периоду индукции
гель типа H (Sigma, США), стеклянные
окисления самого RH (τRH), Антирадикальную
пластинки размером 90 × 120 мм и смесь хлоро-
активность липидного экстракта цветков кален-
форм : метанол : ледяная уксусная кислота : ди-
дулы, т.е. константу скорости его взаимодействия
стиллированная вода в объемном соотношении
с пероксирадикалами (k7), определяли на модели
12.5 : 7.5 : 2 : 1 в качестве мобильной фазы. Прояв-
инициированного динитрилом азоизомасляной
ление хроматограмм проводили в парах йода. Ко-
кислоты окисления метилолеата при 333 K при ско-
личественный анализ состава ФЛ после удаления
пятен с пластинки и сжигания до неорганическо-
рости инициирования Wi = 1 ⋅ 10-7 моль ⋅ л-1 ⋅ с-1.
го фосфата хлорной кислотой проводили на спек-
Метилолеат в смеси с инертным растворителем
трофотометре ПЭ-5400ВИ («ЭКРОС», Россия)
хлорбензолом (1 : 1) и растворенным инициато-
при длине волны 815 нм по образованию фосфо-
ром термостатировали, после чего добавляли рас-
молибденового комплекса в присутствии аскор-
твор липидного экстракта цветков календулы в
биновой кислоты. Для калибровки использовали
метилолеате. Процесс окисления контролирова-
однозамещенный фосфорнокислый калий марки
ли волюмометрическим методом по поглощению
«ос. ч.». Для каждой пробы анализировали не ме-
кислорода. Детали анализа кинетических харак-
нее четырех-пяти хроматографических дорожек.
теристик липидного экстракта даны в работе [19]
Содержание стеринов определяли по методу,
Дифференциальные УФ-спектры растворов
описанному в работе [17], на спектрофотометре
липидов в хлороформе регистрировали на спек-
ПЭ-5400ВИ при длине волны 625 нм. Помимо
трофотометре Shimadzu UV-1700 PharmaSpec
количественного содержания отдельных фрак-
(Shimadzu, Япония) в диапазоне длин волн от 250
ций ФЛ оценивали также обобщенные показате-
до 500 нм при разбавлении исходных растворов
ли состава липидов: доля ФЛ (%) и стеринов (%)
хлороформом. Полученные спектры подвергали
в составе общих липидов; отношение фосфати-
математической обработке по методу Гаусса в
дилхолин/фосфатидилэтаноламин (ФХ/ФЭ),
программе Excel solver путем минимизации сум-
которое позволяет судить о структурном состоя-
мы квадратов разности между эксперименталь-
нии липидного компонента [18], и отношение
ным и расчетным спектрами, соблюдая следую-
сумм более легкоокисляемых и более трудно-
щие условия: совпадение контура исходного
окисляемых фракций ФЛ (∑ЛОФЛ/∑ТОФЛ),
спектра с расчетным после аппроксимации на
характеризующее способность липидов к окис-
уровне 1 ⋅ 10-4-1 ⋅ 10-5.
лению [18]. Последнее вычисляли по формуле:
∑ЛОФЛ/∑ТОФЛ = (ФИ + ФС + ФЭ + КЛ +
Экспериментальные данные обрабатывали
+ ФК)/(ЛФХ + СЛ + ФХ), где ФИ - фосфатиди-
стандартными методами вариационной статисти-
линозит, ФС - фосфатидилсерин, КЛ - кардио-
ки, используя программный продукт MS Excel и
липин, ФК - фосфатидная кислота, ЛФХ - лизо-
пакет компьютерных программ KINS [20]. Досто-
формы фосфолипидов, СЛ - сфинголипиды.
верность различий оценивали по t-критерию
БИОФИЗИКА том 66
№ 3
2021
484
ШИШКИНА и др.
Рис. 1. Относительное содержание ряда фракций фос-
Рис. 2. Относительное содержание ряда фракций
фолипидов при выделении липидов из цветков ка-
фосфолипидов при выделении липидов из плодов
лендулы (1) и их 50%-х водно-пропиленгликолевых
облепихи (1) и их 50%-х водно-пропиленгликоле-
экстрактов (2).
вых экстрактов (2).
Стьюдента [21]. В таблице и на рисунках данные
данные, представленные на рис. 1 и 2. Сравни-
представлены в виде средних арифметических
тельный анализ полученных результатов показы-
значений с указанием их средних квадратичных
вает, что в липидах, выделенных из 50%-х ВПГ-
ошибок (M ± m).
экстрактов, достоверно повышена доля лизо-
форм ФЛ в 2.6 (p < 0.001) и 2.0 (p < 0.001) раза и
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
сфинголипидов в 1.9 (p < 0.01) и 3.0 (p < 0.001) раза
Сравнительный анализ состава липидов, вы-
в ФЛ цветков календулы и плодов облепихи соот-
деленных из исследованных объектов, выявил су-
ветственно. В то же время относительное содер-
щественные различия как доли ФЛ и стеринов в
жание ФЭ и ФХ в ФЛ цветков календулы в 1.8-1.9
составе общих липидов, так и количественного
(p < 0.001) раза превышает аналогичный показа-
соотношения фракций ФЛ в самих цветках ка-
тель в составе ФЛ его ВПГ-экстракта, а предвари-
лендулы и плодах облепихи и их 50%-х ВПГ-экс-
тельная обработка плодов облепихи полярным
трактах. Так, относительное содержание ФЛ в со-
элюентом уменьшает долю этих фракций ФЛ
ставе общих липидов из цветков календулы сни-
лишь на 20-50%. Разнонаправленные изменения
жается с 24.6 ± 2.4% (n = 8) до 2.6 ± 0.6% (n = 13) в
относительного содержания таких более легко-
липидах их ВПГ-экстрактов, а аналогичный по-
окисляемых фракций ФЛ, как кардиолипин и
казатель состава общих липидов плодов облепихи
фосфатидная кислота, наблюдаются в липидах,
падает с 13.5 ± 2.9% (n = 7) до 2.6 ± 0.15% (n = 13).
выделенных из исходных растительных объектов,
При этом относительно невысокая доля стеринов
по сравнению с липидами из их ВПГ-экстрактов
в составе общих липидов цветков календулы
(рис. 1 и 2). Интересно отметить, что суммарные
(3.1 ± 1.7%) и плодов облепихи (0.83 ± 0.34%) в
доли «фосфатидилинозит + фосфатидилсерин» в
липидах обоих ВПГ-экстрактов уменьшается до
ФЛ всех изученных объектов достаточно близки и
следовых количеств [14]. Следовательно, предва-
варьируют в пределах 12.0-16.1%.
рительная экстракция растительного сырья по-
лярным элюентом (для пропиленгликоля μ = 2.2 D)
Столь существенные изменения количествен-
приводит к уменьшению доли полярных фракций
ного соотношения фракций ФЛ обусловливают и
липидов в 5.2-9.5 раза.
изменения обобщенных показателей состава ФЛ,
Столь же существенные изменения наблюда-
величины которых представлены в таблице. Вид-
ются и в количественном соотношении фракций
но, что липиды из ВПГ-экстрактов характеризу-
ФЛ исследуемых объектов, что иллюстрируют
ются более высоким значением отношения
Обобщенные показатели состава фосфолипидов
Показатель
1
Экстракт 1
2
Экстракт 2
ФХ/ФЭ
0.938 ± 0.058
1.328 ± 0.059
1.831 ± 0.054
2.245 ± 0.130
(∑ЛОФЛ/∑ТОФЛ)
1.431 ± 0.088
1.173 ± 0.063
1.463 ± 0.084
0.998 ± 0.059
Примечание. Представлены соотношения сумм более легкоокисляемых и более трудноокисляемых фракций ФЛ
(∑ЛОФЛ/∑ТОФЛ) и отношение фракций фосфатидилхолин/фосфатидилэтаноламин (ФХ/ФЭ) в составе фосфолипидов
цветков календулы (1) и плодов облепихи (2) и их 50%-х ВПГ-экстрактов (экстракты 1 и 2 соответственно).
БИОФИЗИКА том 66
№ 3
2021
ИНГИБИРУЮЩАЯ ЭФФЕКТИВНОСТЬ ЛИПИДНОГО КОМПОНЕНТА
485
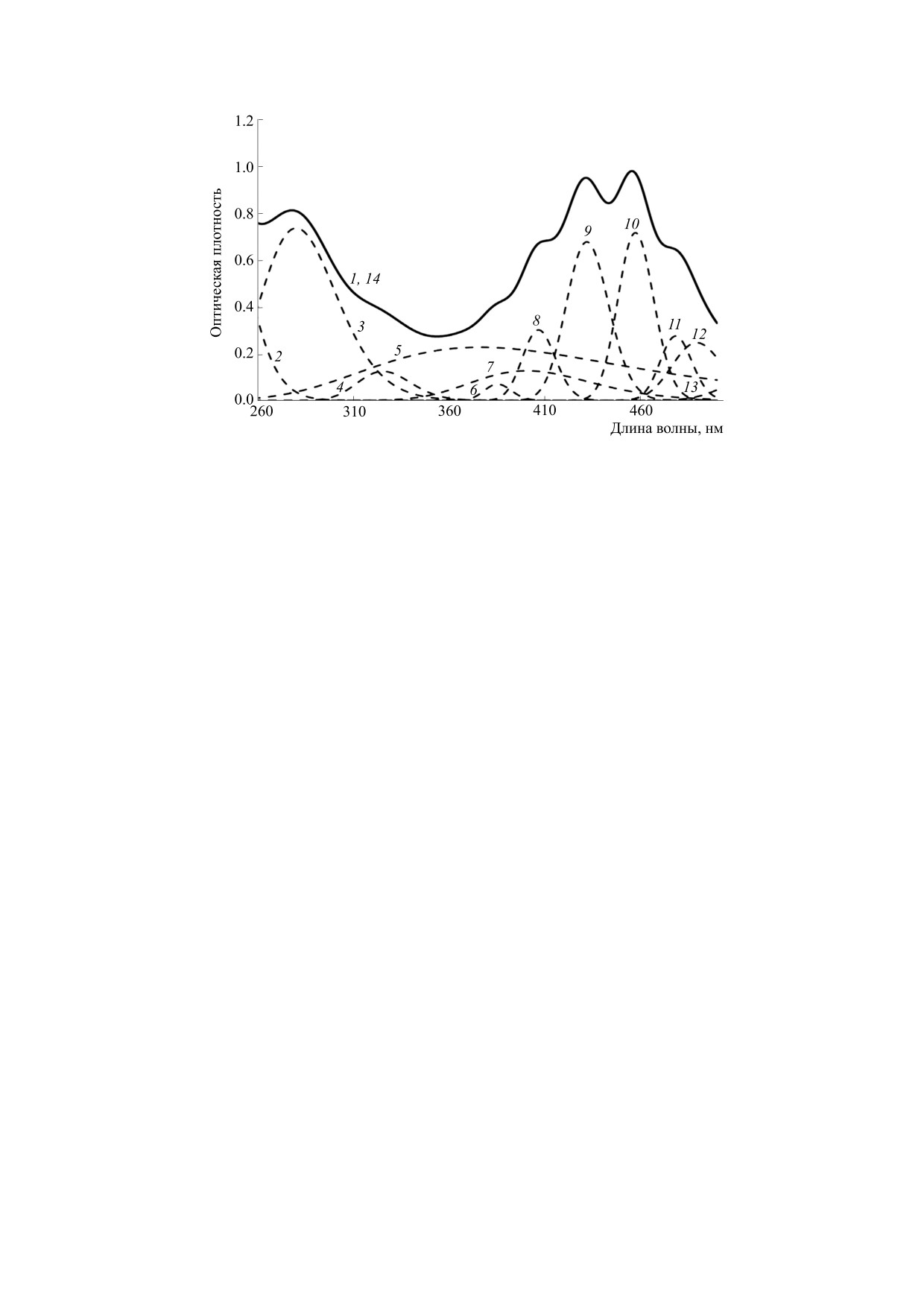
Рис. 3. УФ-спектры хлороформных растворов липидов из цветков календулы и их гауссианы (концентрация липидов
5.1⋅10-5 моль/л): 1, 14 - исходный и расчетный спектры, 2 - 238.1 нм, 3 - 280.2 нм, 4 - 325.5 нм, 5 - 376.2 нм, 6 - 385.3
нм, 7 - 400.5 нм, 8 - 406.7 нм, 9 - 431.9 нм, 10 - 457.3 нм, 11 - 478.3 нм, 12 - 489.3 нм, 13 - 529.1 нм.
ФХ/ФЭ и более низкой величиной соотношения
том, что содержащиеся в липидных экстрактах
∑ЛОФЛ/∑ТОФЛ. Следовательно, предваритель-
данных объектов компоненты, принимающие
ная обработка растительного сырья 50%-м ВПГ
участие в процессе окисления, в течение периода
обусловливает увеличение жесткости липидного
индукции преимущественно взаимодействуют с
компонента и уменьшение его способности к
пероксирадикалами. Необходимо обметить, что
окислению.
ингибирующая эффективность (Δτ/τRH) экстрак-
тов липидов из цветков календулы в 1.9 ± 0.2
Как известно, использование хлороформа в
(n = 6) раза превышает аналогичную величину
качестве растворителя в УФ-спектрофотометрии
для липидных экстрактов из плодов облепихи.
позволяет выявить наличие в пробе компонен-
Полученные данные позволяют предположить,
тов, характеризующихся максимумами полос по-
что торможение процесса окисления обусловле-
глощения в области λ > 250 нм. Сравнительный
но содержащимися в липидах АО, наличие кото-
анализ УФ-спектров и их гауссиан хлороформ-
рых подтверждает анализ УФ-спектров (рис. 3).
ных растворов липидов из цветков календулы и
Количественная оценка содержания АО и их ан-
плодов облепихи и липидов из их ВПГ-экстрак-
тирадикальной активности (k7) была проведена
тов показал определенные различия величин
максимумов полос поглощения в области флаво-
для более эффективного липидного экстракта из
ноидов в диапазоне λ от 250 нм до 380 нм. Следо-
цветков календулы. Установлено, что присут-
вательно, предварительная экстракция сырья по-
ствие добавки тормозит процесс инициирован-
лярным элюентом влияет на распределение фла-
ного окисления метилолеата, из величины пери-
воноидов. Отсутствие полос поглощения в
ода индукции и начальной скорости окисления
области λ > 400 нм, характерных для растворов
которого рассчитана концентрация АО, равная
каротионидов в хлороформе [22], свидетельствует
4.35 ⋅ 10-5 моль/л, и проведена оценка параметра
об отсутствии каротиноидов в липидах, выделен-
ингибирования k7/√k6 = 65 л ⋅ моль-1 ⋅ с-1, где
ных из ВПГ-экстрактов исследованных объектов.
k6 - это константа скорости квадратичной гибели
Эти выводы четко следуют из данных, представ-
ленных на рис. 3 и 4 на примере липидов, выде-
пероксирадикалов метилолеата. Полученное зна-
ленных из цветков календулы и их ВПГ-экс-
чение параметра k7/√k6 соответствует данным ли-
трактов.
тературы о высокой антирадикальной активности
флавоноидов [7].
Изучение антиоксидантных свойств липидов,
выделенных из цветков календулы и плодов обле-
Несмотря на более низкую способность к
пихи, показало, что они способны тормозить ав-
окислению относительно липидов из исходных
тоокисление метилолеата, а период индукции
растительных объектов (таблица) и наличию в
окисления линейно зависит от количества вве-
липидах из экстрактов БАВ (рис. 4), липиды из их
денной добавки (рис. 5). Это свидетельствует о
ВПГ-экстрактов практически не влияют на про-
БИОФИЗИКА том 66
№ 3
2021
486
ШИШКИНА и др.
Рис. 4. УФ-спектры хлороформных растворов липидов, выделенных из 50%-х водно-пропиленгликолевых экстрактов
цветков календулы и их гауссианы (концентрация липидов 1.1×10-3 моль/л): 1, 5 - исходный и расчетный спектры,
2 - 205.1 нм, 3 - 318.4 нм, 4 - 326.8 нм.
цесс окисления. Так, липиды из экстрактов пло-
субстрата окисления позволяет оценить их уча-
дов облепихи обладают слабой прооксидантной
стие на разных стадиях процесса окисления [7, 8].
активностью (Δτ/τRH = -0.035 ± 0.09, n = 6), а ли-
Анализ полученных в работе кинетических
пиды из ВПГ экстрактов цветков календулы низ-
кривых окисления липидов с помощью компью-
кой ингибирующей эффективностью (Δτ/τRH =
терного пакета программ KINS показал, что во
= 0.050 ± 0.029, n = 3) независимо от их концен-
всех вариантах экспериментов коэффициенты
трации в среде окисления.
корреляции данной экспоненциальной зависи-
Ранее было установлено, что автоокисление
мости варьируют в пределах 0.993-0.999. Величи-
RH при 323 K в диффузионной области описыва-
на предэкспоненциального множителя a досто-
ется экспоненциальной зависимостью [ROOH] =
верно уменьшается с ростом концентрации липи-
aexp(kt) с коэффициентом корреляции 0.94-1.00
дов, выделенных как из цветков календулы, так и
[8]. При этом на начальных стадиях процесса
из плодов облепихи, однако зависимости имеют
окисления, когда расходованием субстрата мож-
сложный характер (рис. 6). Величина фактора a
но пренебречь, изменение величин a и показате-
кинетических кривых накопления пероксидов
ля экспоненты k в присутствии различных доба-
обусловлена скоростью зарождения радикалов и
вок относительно соответствующих значений для
продолжения цепи автоокисления метилолеата и
Рис. 5. Зависимость периода индукции автоокисления
Рис. 6. Зависимость величины фактора a автоокисле-
метилолеата в тонком слое при 323 K от концентрации
ния метилолеата в тонком слое при 323 K от концен-
липидов, выделенных из цветков календулы (1) и
трации липидов, выделенных из цветков календулы (1)
плодов облепихи (2); RH - метилолеат.
и плодов облепихи (2).
БИОФИЗИКА том 66
№ 3
2021
ИНГИБИРУЮЩАЯ ЭФФЕКТИВНОСТЬ ЛИПИДНОГО КОМПОНЕНТА
487
уменьшается с ростом антиоксидантных свойств
словливает существенные различия как состава и
липидов [23], поэтому его уменьшение в присут-
антиоксидантных свойств выделенных из них ли-
ствии липидов из цветков календулы и плодов об-
пидов, так и разнообразия БАВ в их хлороформ-
лепихи свидетельствует об их участии на стадиях
ных растворах по сравнению с аналогичными по-
зарождения радикалов и продолжения цепи. По-
казателями липидов из исходных растений. Ли-
скольку в липидах, выделенных из ВПГ экстрак-
пиды и присутствующие в них БАВ из цветков
тов, отсутствуют каротиноиды (рис. 4) и липиды
календулы и плодов облепихи принимают уча-
практически не обладают антиоксидантными
стие в регуляции процесса автоокисления на ста-
свойствами, это позволяет сделать вывод, что ин-
диях зарождения радикалов и продолжения цепи
гибирующая эффективность липидов из исход-
окисления, обеспечивая их антиоксидантные
ных растительных объектов обусловлена присут-
свойства. Более высокая ингибирующая эффек-
ствием в них флавоноидов, что подтверждает и
тивность липидов из цветков календулы относи-
высокая антирадикальная активность липидов из
тельно липидов из плодов облепихи сопровожда-
цветков календулы. Как установлено в работе [7],
ется и снижением общей скорости окисления по-
кверцетин и дигидрокверцетин вызывают сниже-
сле окончания периода индукции окисления в их
ние величины фактора a в реакции автоокисле-
присутствии. Существенное уменьшение доли
ния метилолеата в тонком слое на несколько по-
ФЛ, основных субстратов окисления, в составе
рядков, в то время как эффект присутствующих в
общих липидов из экстрактов и изменение набо-
липидах цветков календулы и плодов облепихи
ра БАВ по сравнению с липидами исходных объ-
флавоноидов существенно ниже (рис. 6). Это обу-
ектов обусловливают их низкую ингибирующую
словлено способностью флавоноидов образовы-
эффективность. Это подтверждается как слабы-
вать комплексы с ФЛ, что существенно уменьша-
ми антиоксидантными свойствами липидов из
ет эффективность их ингибирующего действия
ВПГ-экстрактов цветков календулы, так и незна-
[24, 25].
чительным ростом скорости зарождения радика-
лов и продолжения цепи окисления в присут-
Независимо от концентрации, липиды из ВПГ
ствии липидов из экстрактов плодов облепихи.
экстрактов календулы практически не влияют
на величину фактора a (1.090 ± 0.047), в то время
Столь сложный и неоднозначный характер
как присутствие липидов из плодов облепихи
влияния липидного компонента растительного
приводит к его незначительному увеличению
сырья на регуляцию окислительных процессов в
(1.29 ± 0.10), что соответствует различию в их ан-
зависимости от полярности элюентов, использу-
емых в процессе его обработки, требует более де-
тиоксидантных свойствах.
тального анализа его состава и физико-химиче-
Так как величина показателя экспоненты k
ских свойств при оценке биологической активно-
обусловлена общей скоростью процесса окисле-
сти.
ния [23], то необходимо отметить, что эффект ли-
пидов всех исследованных объектов на величину
k не зависит от их концентрации. Липиды плодов
БЛАГОДАРНОСТИ
облепихи практически не оказывают влияния на
Авторы выражают благодарность н.с ИБХФ
величину показателя (kотн = 0.94 ± 0.03, n = 6),
РАН к.х.н. В.А. Волкову, любезно предоставив-
липиды из цветков календулы вызывают его сни-
шему ВПГ-экстракты для исследования.
жение (kотн= 0.63 ± 0.04, n = 3). При этом липиды
из ВПГ-экстрактов проявляют обратный эффект:
липиды экстрактов из цветков календулы не вли-
ФИНАНСИРОВАНИЕ РАБОТЫ
яют на общую скорость окисления (kотн = 0.95 ±
Работа выполнена в рамках государственного
± 0.04), а липиды экстрактов из плодов облепихи
задания Института биохимической физики
ее незначительно уменьшают (kотн= 0.84 ± 0.02).
им. Н.М. Эмануэля РАН (тема № 44.4, гос. № те-
Влияние липидов на общую скорость окисления
мы: 0084-2019-0014).
после выхода из периода индукции может быть
обусловлено участием липидов и содержащихся в
них БАВ в побочных реакциях, как, например, их
КОНФЛИКТ ИНТЕРЕСОВ
способностью разлагать пероксиды, что харак-
Автор заявляет об отсутствии конфликта инте-
терно для компонентов многих растительных
ресов.
объектов [8].
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ЗАКЛЮЧЕНИЕ
Настоящая статья не содержит описания ка-
Таким образом, предварительная экстракция
ких-либо исследований с использованием людей
растительного сырья полярным элюентом обу-
или животных в качестве объектов.
БИОФИЗИКА том 66
№ 3
2021
488
ШИШКИНА и др.
СПИСОК ЛИТЕРАТУРЫ
11. A. M. Cassim, P. Gougue, J. Gronnie, et al., Progr.
Lipid Res. 73, 1 (2019).
1. V. Gody, E. Middleton, and J. B. Harborne, Plant fla-
12. X. Liu, D. Ma, Zh. Zhang, et al., Environ. Exp. Botany
vonoids in biology and medicine: biochemical, pharmaco-
165, 174 (2019).
logical and structure-active relationships (Liss, N. Y.,
1986).
13. L. A, Colin and U. Jaillais, Curr. Opin. Plant Biol. 53,
2. V. K. Gupta and S. K. Sharma, Natural Product Radi-
1 (2020).
ance 5 (4), 326 (2006).
14. В. О. Швыдкий, А. Н. Смирнова, В. А. Волков и
3. N. Sirisha, M. Sreenivasulu, K. Sangeeta, and C. Mad-
Л. Н. Шишкина, Химия раст. сырья, № 1, 67
husudhana Chetty, Int. J. Pharm. Tech. Res. 2 (4), 2174
(2020).
(2010).
15. М. Кейтс, Техника липидологии (Мир, М., 1975).
4. А. А. Семенов и В. Г. Карцев, Биологическая актив-
16. Биологические мембраны. Методы, под ред.
ность природных соединений (МБФНП «Научное
Дж. Б. С. Финдлея и У. Г. Эванза (Мир, М., 1990).
Партнерство», М., 2012).
17. W. M. Sperry and M. Webb, J. Biol. Chem. 187, 97
5. Ю. С. Тараховский, Ю. А. Ким, Б. С. Абдрасилов и
(1950).
Е. Н. Музафаров, Флавоноиды: биохимия, биофизи-
18. Л. Н. Шишкина, Е. В. Кушнирева и М. А. Смотря-
ка, медицина (Synchrobook, Пущино, 2013).
ева, Радиац. биология. Радиоэкология 44 (3), 289
6. Р. Геннис, Биомембраны: Молекулярная структура
(2004).
и функции (Мир, М., 1997).
19. В. Ф. Цепалов, А. А. Харитонова, Г. П. Гладышев и
7. L. I. Mazaletskaya, N. I. Sheludchenko, and
Н М. Эммануэль, Кинетика и катализ 18, 1261
L. N. Shishkina, In Chemical Reactions in Gas, Liquid
(1977).
and Solid Phases Synthesis, Properties and Application,
20. Э. Ф. Брин и С. О. Травин, Хим. физика 10 (6), 830
Ed. by G. E. Zaikov and R. M. Kozilowsky (Nova Sci-
(1991).
ence Publisher, N. Y., 2012), pp. 11-20.
21. Г. Ф. Лакин, Биометрия, 3-е изд. (Высш. шк., М.,
8. L. N. Shishkina, M. V. Kozlov, L. I. Mazaletskaya,
1990).
et al., In Antioxidants in Systems of Varying Complexity:
22. А. Г. Курегян, Фундамен. исследования, № 2 (23),
Chemical, Biochemical, and Biological Aspects, Ed. by
5166 (2015).
L. N. Shishkina, A. N. Goloshchapov, and L. I. Weis-
feld (Apple Acad. Press, Toronto, 2020), pp. 41-59.
23. Л. Н. Шишкина и Н. В. Хрустова, Биофизика 51
(2), 340 (2006).
9. Фенольные соединения: свойства, активность, инно-
вации: сборник инновационных статей по материа-
24. Л. И. Мазалецкая, Н. И. Шелудченко и
лам X Международного симпозиума «Фенольные со-
Л. Н. Шишкина, Прикл. биохимия и микробиоло-
единения: фундаментальные и прикладные аспек-
гия 46 (2), 148 (2010).
ты», под ред. Н. В. Загоскиной (М., 2018).
25. L. Mazaletskaya, N. Sheludchenko, and L. Shishkina,
10. Yu. Nakamura, Trends Plant Sci. 22 (12), 1027 (2017).
Chemistry & Chemical Technology, 6 (1), 35 (2012).
Inhibitory Efficiency of the Lipid Component of Plant Objects in Dependence
on the Eluent Polarity
L.N. Shishkina, L.I. Mazaletskaya, A.N. Smirnova, and V.O. Shvydkiy
Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
Antioxidant properties, spectral characteristics and the composition of lipids isolated from pot marigold
f lowers and sea buckthorn berries and their 50%-water-propyleneglycol extracts were studied. Significant
quantitative differences in the inhibitory efficiency, the quantitative relations of fractions of lipids and the
presence of bioactive substances in the chloroform solution were identified according to eluent polarities,
thereby enabling the involvement of the lipid component of plant objects in the regulation of oxidation at dif-
ferent stages of this process. These data were confirmed by analysis of the kinetic curves of the peroxide ac-
cumulation performed by means of the KINS computer programs and mathematical treatment of UV-spectra
of the lipid solutions using the Gaussian Elimination method.
Keywords: inhibitory efficiency, lipids, extracts, low temperature oxidation, UV-specrtophotometry, computer
modeling
БИОФИЗИКА том 66
№ 3
2021