БИОФИЗИКА, 2021, том 66, № 3, с. 489-494
БИОФИЗИКА КЛЕТКИ
УДК 577.352.336
ВЛИЯНИЕ РЕСВЕРАТРОЛА В РАЗЛИЧНЫХ КОНЦЕНТРАЦИЯХ
НА СТРУКТУРНОЕ СОСТОЯНИЕ МЕМБРАН МИТОХОНДРИЙ,
ВЫДЕЛЕННЫХ ИЗ ЛИСТЬЕВ ГОРОХА, В НОРМЕ in vitro
© 2021 г. Н.Ю. Герасимов*, О.В. Неврова*, И.В. Жигачева*,
И.П. Генерозова**, А.Н. Голощапов*
*Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
**Институт физиологии растений им. К.А. Тимирязева РАН, 127276, Москва, ул. Ботаническая, 35
E-mail: n.yu.gerasimov@gmail.com
Поступила в редакцию 22.10.2020 г.
После доработки 08.12.2020 г.
Принята к публикации 09.12.2020 г.
Изучено действие антиоксиданта ресвератрола в различных концентрациях на микровязкость мем-
бран митохондрий, выделенных из клеток листьев гороха. Показано, что ресвератрол в физиологиче-
ских (5⋅10-6 М) и сверхмалых (5⋅10-14 М) дозах изменял микровязкость и структуру липидного бислоя
мембран. По-видимому, данный антиоксидант путем изменения структуры липидного окружения
мембранных белков изменяет их активность и таким образом влияет на активность и функции мито-
хондрий. В областях доз между физиологическими и сверхмалыми не было обнаружено никаких изме-
нений, т.е. наблюдалась «мертвая зона». Кроме того, было выявлено, что ресвератрол в физиологиче-
ских концентрациях сдвигает термоиндуцированный структурный переход в область более низких
температур, что может мешать нормальной регуляции естественных процессов.
Ключевые слова: структура мембран, микровязкость мембран, антиоксидант.
DOI: 10.31857/S0006302921030091
восстановительные процессы, аналогичные ми-
Митохондрии играют ключевую роль в энерге-
тохондриальным. Одним из наиболее распро-
тическом обмене и регулируют поток кальция в
страненных полифенольных соединений являет-
клетках [1, 2]. В настоящее время в литературе с
ся ресвератрол. Он известен как биологически
большим интересом изучаются процессы кодиро-
активный компонентов красного вина с антиок-
вания митохондриальных белков с помощью ре-
сидантной активностью, который улучшает
гуляции ядерного генома и активность митохон-
функции митохондрий [9, 10]. Показана противо-
дриальной транскрипции через регуляторы су-
раковая активность ресвератрола, которая может
точного цикла в растениях [3-5]. Все больше
быть обусловлена его способностью вызывать
информации о связи между дыхательной цепью и
апоптоз в клетках лейкемии и рака молочной же-
вводимыми белковыми комплексами [6] и о ми-
лезы человека [11]. Однако до настоящего време-
тохондриальной реакции на стресс [7]. Объем по-
ни не было информации о прямом изменении
лучаемых данных представляет собой превосход-
митохондриальной активности ресвератролом
ный инструмент для получения более полного
растений и о его механизме действия.
представления о молекулярных компонентах
сложной митохондриальной системы с целью це-
Действие антиоксидантов на биологические
лесообразного моделирования и регулирования
мембраны объясняется системой регуляции пе-
функции митохондрий.
роксидного окисления липидов [12-14], которая
напрямую связана с микровязкостью мембран. В
Интересно, что полифенольные соединения
то же время активные формы кислорода генери-
оказывают непосредственное влияние на струк-
руются, главным образом, митохондриями.
туру и функцию митохондрий. Растительные по-
Таким образом, целью нашей работы было
лифенолы взаимодействуют с белками, такими
провести исследование и оценить влияние ресве-
как сигнальные киназы, факторы транскрипции
ратрола, как сильного природного антиоксиданта
и ионные каналы [8] и регулируют окислительно-
и активатора, на митохондрии гороха в норме,
Сокращения: ЭПР - электронный парамагнитный резо-
пытаясь спрогнозировать возможную роль ресве-
нанс, Ea - энергия активации.
ратрола в качестве модулятора активности мито-
489
490
ГЕРАСИМОВ и др.
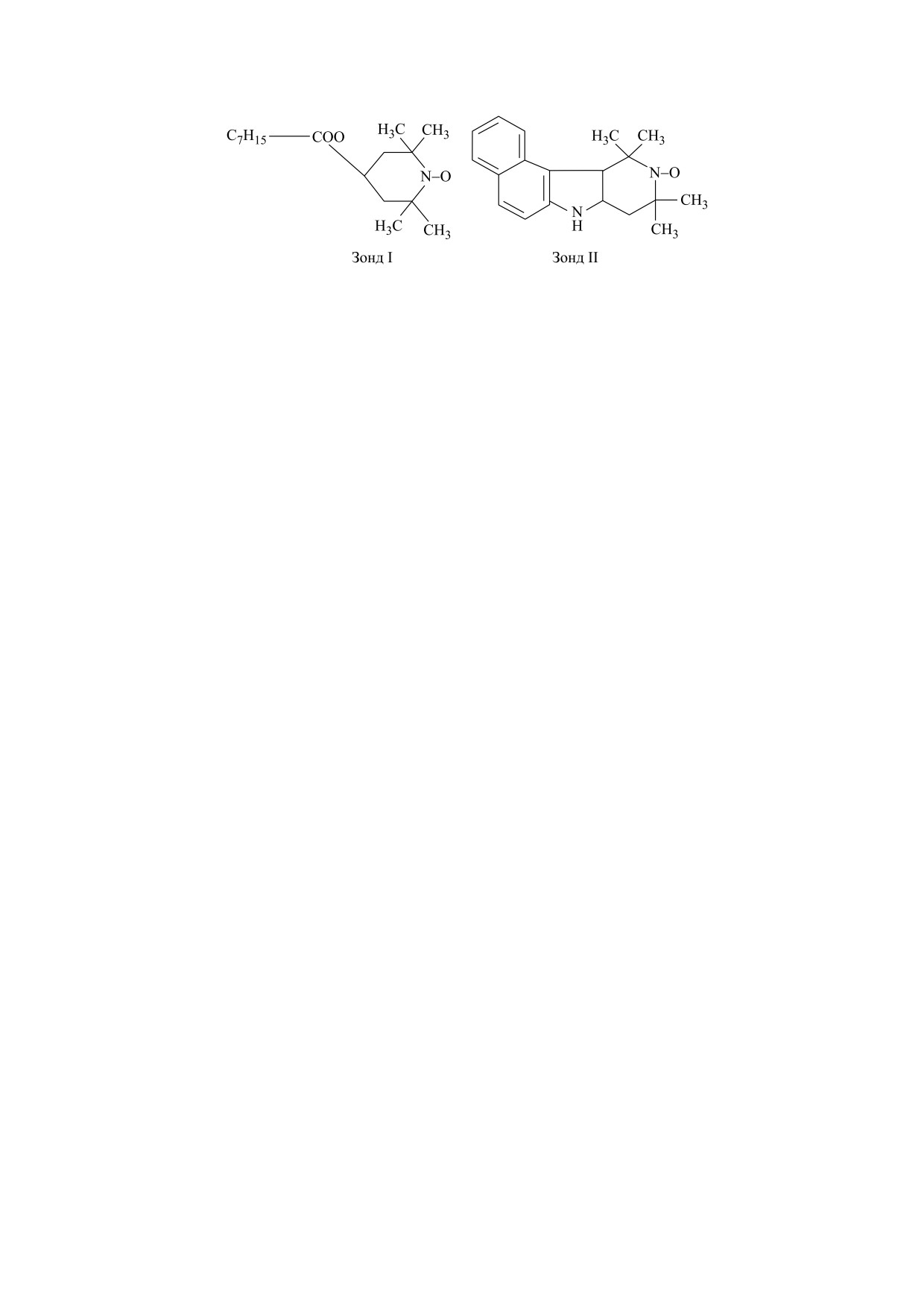
Рис. 1. Структурные формулы использованных спиновых зондов.
хондрий, что открывает новые возможности в за-
страцию спектров ЭПР проводили в диапазоне
щите растений от стресс-факторов, связанных с
температур 283-317 К (10-44°C) на радиоспек-
митохондриальной дисфункцией.
трометре ER 200D-SRC фирмы Brucker (США).
Известное соотношение Стокса-Энштейна
(см., например, работу [19]) связывает параметр τc
МАТЕРИАЛЫ И МЕТОДЫ
и вязкость среды, окружающей зонд τc = ηV/kT,
Митохондрии получали из клеток листьев го-
где V - объем радикала (его можно считать прямо
роха методом дифференциального центрифуги-
пропорциональным молекулярной массе); η -
рования в калий-фосфатном буфере. Для приго-
динамическая вязкость среды; k - постоянная
товления образца митохондрии разбавляли в сре-
Больцмана и Т - абсолютная температура. Дина-
де выделения таким образом, чтобы содержание
мическая вязкость η связана с температурой сле-
белка в конечном растворе составляло 2 мг/мл.
дующим эмпирическим соотношением η = А'eb/T
Ресвератрол готовили последовательным сто-
[20], откуда следует lnτc = А'' + b/T + ln(1/T), где
кратным разбавлением в среде выделения так,
А', А'' и b - константы. Исследуемый нами темпе-
чтобы концентрация в образцах с митохондриями
ратурный интервал (от 283 до 305 К) достаточно
при конечном разбавлении составляла 5⋅10-6,
узок, на его протяжении ln(1/T) меняется очень
5⋅10-8, 5⋅10-10, 5⋅10-12, 5⋅10-14 и 5⋅10-16 М. Методика
незначительно по сравнению со слагаемым b/T,
приготовления сверхмалых доз биологически ак-
поэтому можно считать lnτc = a + b/T.
тивного вещества показана, например, в работах
Исходя из этой точки зрения, график зависи-
[15, 16].
мости lnτc от 1/Т для таких структур должен пред-
Микровязкость липидного бислоя мембран
ставлять собой ломаную линию, точки излома ко-
определяли методом электронного парамагнит-
торой являются точками структурных переходов
ного резонанса (ЭПР) спиновых зондов. В каче-
[21]. Наклон этих прямых позволяет определить
стве зонда использовали стабильные нитроксиль-
энергию активации перехода ΔEа = bR [22], где
ные радикалы
2,2,6,6-тетраметил-4-каприлои-
b - коэффициент наклона соответствующего
локсилпиперидин-1-оксил (зонд I) и 5,6- бензо-
прямого участка, а R - универсальная газовая по-
2,2,6,6-тетраметил-1,2,3,4-тетрагидро-γ-карбо-
стоянная. Энергия активации соответствует
лин-3-оксил (зонд II) (рис. 1), синтезированные в
энергии перестройки одного моля липидов мем-
Институте химической физики им. Н.Н. Семено-
бран [22].
ва РАН.
Статистическую обработку данных осуществ-
В работе [17] показано, что зонд I преимуще-
ляли методами параметрической статистики с ис-
ственно локализуется в поверхностном слое ли-
пользованием пакетов компьютерных программ
пидных компонент мембраны, а зонд II - в липи-
Microsoft® Office Excel и Origin® 6.1 при стати-
дах, прилегающих к белкам, что позволяет по по-
стической надежности 95%.
ведению зондов I и II в липидном бислое судить о
липид-белковых взаимодействиях в мембранах.
Для удобства изложения мы в последующем бу-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
дем называть зонд I «липидным», а зонд II - «бел-
ковым».
На первом этапе работы были получены тем-
пературные зависимости времен вращательной
Из полученных спектров ЭПР рассчитывали
корреляции зондов I и II для контрольной
время корреляции вращательной подвижности
группы (рис. 2 и 3) и при действии ресвератрола в
(τс), характеризующее микровязкость компонен-
физиологической (5⋅10-6 М, рис. 2) и сверхмалой
тов мембраны, по формуле τс = 6.65⋅10-10⋅ΔH+⋅
(5⋅10-14 М, рис. 3) концентрациях. Для контроль-
⋅((I+/I-)0.5 - 1), приведенной в работе [18]. Реги-
ной группы наблюдали термоиндуцированный
БИОФИЗИКА том 66
№ 3
2021
ВЛИЯНИЕ РЕСВЕРАТРОЛА В РАЗЛИЧНЫХ КОНЦЕНТРАЦИЯХ
491
Рис. 2. Температурные зависимости микровязкости мембран митохондрий в аррениусовских координатах (lnτс от 1/T,
для удобства указаны величины Т для контрольной группы и концентрации ресвератрола 5⋅10-6 М): (а) - белковый
зонд, (б) - липидный зонд.
структурный переход в обеих областях мембран
ковой фазы мембран митохондрий (рис. 4). Этот
(липидных и прибелковых) при температурах от
факт, по-видимому, связан с уменьшением окис-
18 до 20°С (291-293 K). Введение антиоксиданта в
ления липидов вследствие введения антиокси-
концентрации 5⋅10-6 М приводило к исчезнове-
данта и накоплением ненасыщенных жирных
нию структурных перестроек в мембранах. Веро-
кислот в мембране.
ятно, ресвератрол в физиологических дозах сдви-
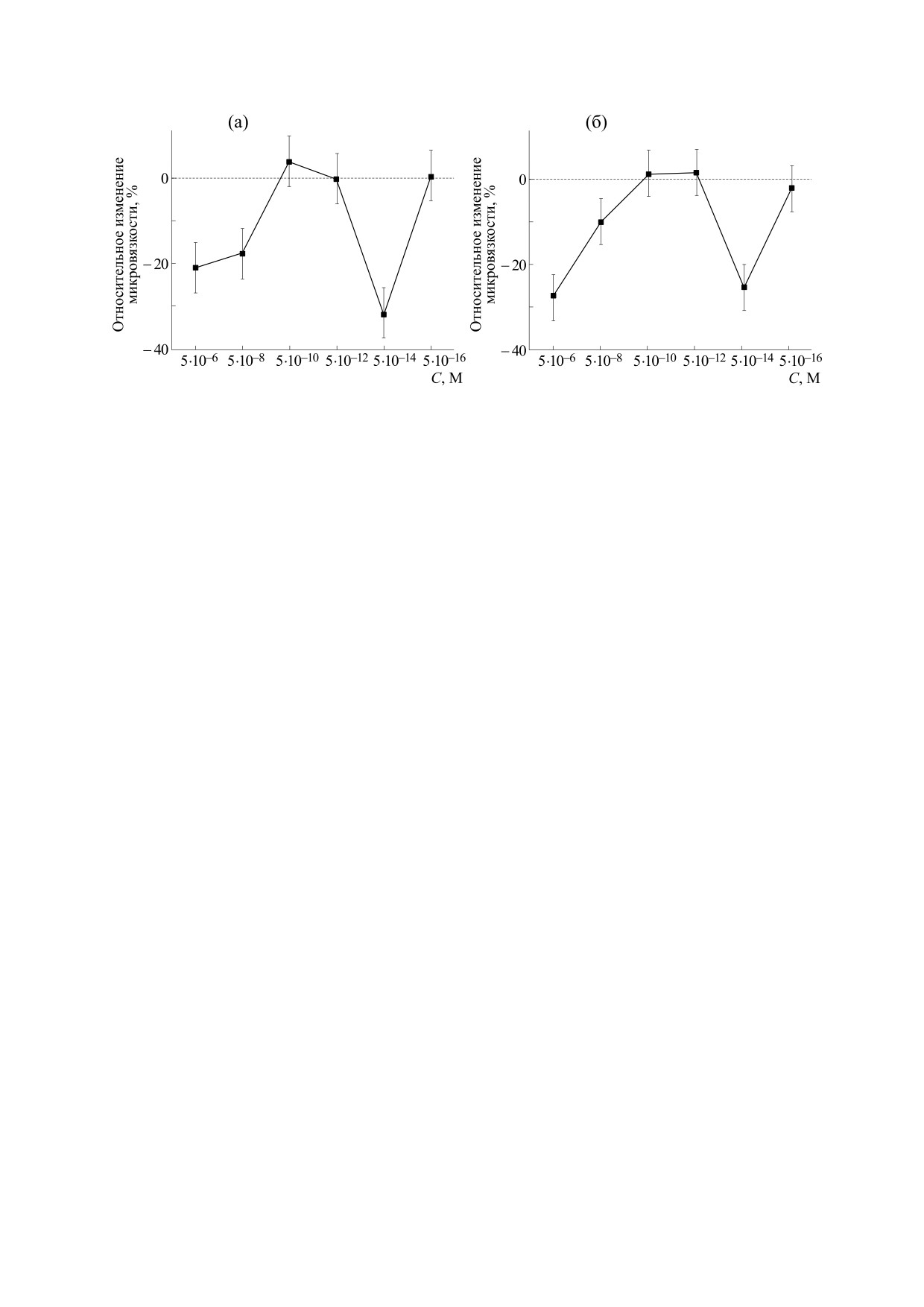
На рис. 4 представлена дозовая зависимость
гает структурный переход в область температур
эффекта ресвератрола на микровязкость мембран
вне изученной области. Напротив, введение ан-
тиоксиданта в сверхмалой концентрации не
при температуре 12°С (285 К), наиболее благо-
изменяло положение термоиндуцированных пе-
приятной для цветения гороха [23], при которой
рестроек в липидном бислое (рис. 3). Следует от-
структурные переходы не наблюдались (рис. 2
метить, что обе концентрации препарата умень-
и 3). Максимальное действие антиоксиданта на-
шали микровязкость как липидной, так и прибел-
блюдалось, по сравнению с другими дозами, для
Рис. 3. Температурные зависимости микровязкости мембран митохондрий в аррениусовских координатах (lnτс от 1/T,
для удобства указаны величины Т для контрольной группы и концентрации ресвератрола 5⋅10-14 М): (а) - белковый
зонд, (б) - липидный зонд.
БИОФИЗИКА том 66
№ 3
2021
492
ГЕРАСИМОВ и др.
Рис. 4. Зависимость изменения микровязкости (отн. изм. = (τc - τc контр)/τc контр) митохондрий гороха от
концентрации ресвератрола (T = 285 К): (а) - липидный зонд, (б) - белковый зонд.
липидных областей мембраны при низких темпе-
большой (5⋅10-6 М) и для сверхмалой (5⋅10-14 М)
ратурах (285-291 К) практически не менялась, то-
концентраций (рис. 4). В областях доз между фи-
гда как при высоких температурах (297-305 К)
зиологическими и сверхмалыми, 5⋅10-10 и 5⋅10-12 М,
уменьшалась приблизительно в два раза. В отли-
ресвератрол практически не изменял микровяз-
чие от липидных, в прибелковых областях введе-
кость мембран митохондрий по сравнению с кон-
ние антиоксиданта в сверхмалой концентрации
тролем, т.е. в данной области наблюдалась
приводило к значительным (~ в три раза ниже
(рис. 4) так называемая «мертвая» зона [24]. Дан-
контроля) изменениям энергии активации при
ный антиоксидант при 12°С (285 K) в концентра-
низких температурах (285-291 К). При высоких
ции 5⋅10-6 М приводит к уменьшению микровяз-
температурах Еа не изменялась, оставаясь на
кости липидных областей мембраны на 20% по
уровне контроля. Следовательно, можно предпо-
отношению к контролю (рис. 4а), а микровяз-
ложить, что сразу после введения ресвератрол в
кость прибелковых областей (рис. 4б) уменьша-
сверхмалых дозах приводил к изменению струк-
лась на 30%. При этом изменение микровязкости
туры прибелковых областей мембраны. При по-
в прибелковых областях даже на 10% может быть
вышении температуры липиды в мембране пере-
очень существенно, так как может привести к
страивались таким образом, что структура при-
значительным изменениям энергетики клеток.
белковых областей бислоя возвращалась к норме
Таким образом, в экспериментах in vitro ресве-
за счет миграции липидов из липидной фазы в
ратрол приводит к уменьшению микровязкости
прибелковую область мембран, что приводило к
мембран в сверхмалой и физиологической кон-
изменению структуры липидных областей бис-
лоя. Введение ресвератрола в больших дозах при-
центрации. В то же время сдвиг термоиндуциро-
водило к исчезновению термоиндуцированных
ванного структурного перехода является нежела-
структурных перестроек как в липидной, так и
тельным, так как это указывает на значительное
изменение структуры липидного бислоя. Это, в
прибелковой фазах мембран. Вероятнее всего,
свою очередь, может мешать нормальной регуля-
структурное состояние мембран митохондрий
при введении большой дозы ресвератрола соот-
ции естественных процессов при защите от
ветствует структурному состоянию мембран кон-
стресс-факторов. Поэтому ресвератрол в сверх-
трольной группы при высоких температурах, судя
малой дозе (5⋅10-14 М) при воздействии на струк-
по близким значениям их энергии активации. Из
туру мембран митохондрий обладает явным пре-
этого следует, что соответствующие переходы
имуществом перед физиологической концентра-
сместились в область более низких температур.
цией (5⋅10-6 М).
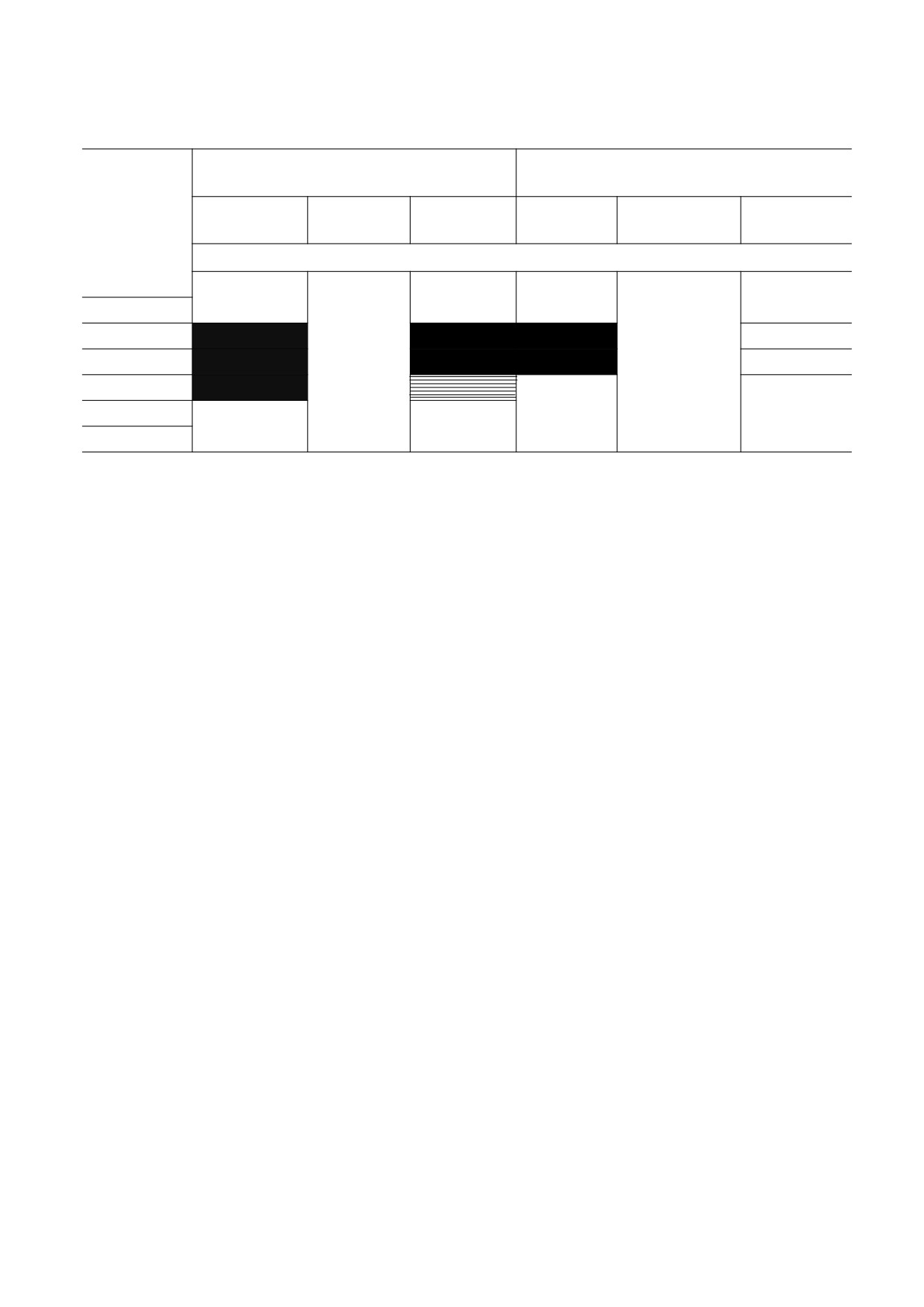
В таблице схематически изображены термоин-
ЗАКЛЮЧЕНИЕ
дуцированные структурные переходы и структур-
ные состояния мембран в разных областях темпе-
Таким образом, ресвератрол в физиологиче-
ратур с соответствующими энергиями активации
ских и сверхмалых дозах изменял структуру мем-
(Еа). При введении ресвератрола в сверхмалых
бран митохондрий, выделенных из листьев горо-
дозах энергия активации структурного состоянии
ха. Поскольку активность мембранных белков су-
БИОФИЗИКА том 66
№ 3
2021
ВЛИЯНИЕ РЕСВЕРАТРОЛА В РАЗЛИЧНЫХ КОНЦЕНТРАЦИЯХ
493
Структурные состояния липидного бислоя митохондрий листьев гороха при разных температурах с
соответствующими энергиями активации
Липидные области
Прибелковые области
Т, К
Ресвератрол,
Ресвератрол,
Ресвератрол,
Ресвератрол,
Контроль
Контроль
5⋅10-6 М
5⋅10-14 М
5⋅10-6 М
5⋅10-14 М
Еа, кДж
285
170 ± 50
150 ± 40
90 ± 20
30 ± 5
289
291
293
40 ± 7
25 ± 5
297
301
40 ± 7
40 ± 10
60 ± 10
35 ± 5
305
Примечание. Закрашенные области соответствуют термоиндуцированным структурным переходам.
щественно зависит от липидного окружения [25],
11.
S. Pervaiz, Leuk. Lymphoma 40 (5-6), 491 (2001).
данный антиоксидант путем изменения структу-
12.
С. А. Аристархова, Г. В. Архипова, Е. Б. Бурлакова
ры липидного бислоя может изменять активность
и др., ДАН СССР 228, 215 (1976).
белков и ферментов, таким образом влияя на ак-
тивность и функции митохондрий. В областях доз
13.
Е. Б. Бурлакова и Н. Г. Храпова, Успехи химии 54
между физиологическими и сверхмалыми не бы-
(9),540 (1985).
ло обнаружено никаких изменений, т.е. наблюда-
14.
Е. Б. Бурлакова, в Химическая и биологическая кине-
лась «мертвая» зона. Кроме того, было выявлено,
тика. Новые горизонты (Химия, М., 2005), т. 2,
что ресвератрол в физиологических концентра-
сс.10-45.
циях сдвигает термоиндуцированный структур-
ный переход в область более низких температур,
15.
Ф. Ф. Ниязи, Н. В. Кувардин и Е. А. Фатьянова,
что может мешать нормальной регуляции есте-
Наука и образование: новое время 1 (1), 65 (2014).
ственных процессов.
16.
Н. В. Кувардин в сб. Мат-лы Междунар. науч.-
практич. конф. «Актуальные проблемы химической
СПИСОК ЛИТЕРАТУРЫ
науки, практики и образования» (КурскГТУ, Курск,
2009), сс. 122-125.
1. А. Ленинджер, Основы биохимии (Мир, М., 1985),
т. 1.
17.
В. И. Бинюков, С. Ф. Борунова, М. Г. Гольдфельд
2. S. Stael, A. G. Rocha, A. J. Robinson, et al., FEBS
и др., Биохимия 36 (6), 1149 (1971).
Lett. 585 (24), 3935 (2011).
18.
А. М. Вассерман, А. Л. Бучаченко, А. Л. Коварский
3. Г. М. Дымшиц, Природа 6 (1042), 54 (2002).
и И. Б. Нейман, Высокомолекуляр. соединения
4. M. W. Hameed, I. Juszczak, R. Bock, and J. T. van
10А, 1930 (1968).
Dongen. Plant Methods 13, 112 (2017).
19.
А. Н. Кузнецов, Метод спинового зонда (Наука, М.,
5. S. Okada and A. Brennicke, Mol. Genet. Genomics
1976).
276 (1),71 (2006).
6. D. C. Wallace, Cell 163 (1), 33 (2015).
20.
Х. Кухлинг, Справочник по физике (Мир, М., 1983).
7. M. Picard, B. S. McEwen, E. S. Epel, and C. Sandif,
21.
D. Chapman, Quart. Rev. Biophys. 8, 185 (1975).
Front Neuroendocrinol. 49, 72 (2018).
22.
M. Shinitzky and M. Inbar, Biochim. Biophys. Acta
8. B. Dasgupta and J. Milbrandt, Proc. Natl. Acad. Sci.
433 (1), 133 (1976).
USA 104, 7217 (2007).
9. M. Lagouge, C. Argmann, Z. Gerhart-Hines, et al.,
23.
Р. Х. Макашева, Горох (Колос, Л., 1973).
Cell 127, 1109 (2006).
24.
Е. Б. Бурлакова, Вестник РАН 64 (М5), 425 (1994).
10. Z. Ungvari, N. Labinskyy, P. Mukhopadhyay, et al.,
Am. J. Physiol. Heart. Circ. Physiol. 297, H1876
25.
Р. Геннис, Биомембраны: Молекулярная структура
(2009).
и функции (Мир, М., 1997).
БИОФИЗИКА том 66
№ 3
2021
494
ГЕРАСИМОВ и др.
Effects of Various Concentrations of Resveratrol on the Structural State
of Mitochondrial Membranes Isolated from Pea Leaves in vitro
N.Yu. Gerasimov*, O.V. Nevrova*, I.V. Zhigacheva*, I.P. Generozova**, and A.N. Goloshchapov*
*Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Timiryazev Institute of Plant Physiology, Russian Academy of Sciences, Botanicheskaya ul. 35, Moscow, 127276 Russia
In this study, the effects of various concentrations of an antioxidant such as resveratrol on microviscosity of
mitochondrial membranes isolated from pea-leaf cells were investigated. It was shown that resveratrol in
physiological (5⋅10-6 M) and ultralow (5⋅10-14 M) doses changed microviscosity and altered the structure of
the membrane lipid bilayer. Apparently, this antioxidant affects the activities of membrane proteins due to al-
tered structures of lipid molecules that surround these proteins thereby influencing mitochondria activity and
function. In the range between physiological dose and ultra-low dose, there were no differences, it was a
“dead-zone” range. In addition, it was found that resveratrol in physiological concentrations shifted thermal
induced structural transition to the lower temperature region, which might interfere with the normal regula-
tion of natural processes.
Keywords: membrane structure, membrane microviscosity, antioxidant
БИОФИЗИКА том 66
№ 3
2021