БИОФИЗИКА, 2021, том 66, № 3, с. 555-566
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 592, 591.88, 591.48, 57.044
ИЗУЧЕНИЕ МЕХАНИЗМОВ ДЕЙСТВИЯ FMRF-ПОДОБНЫХ ПЕПТИДОВ
НА МЫЩЕЧНОЕ СОКРАЩЕНИЕ У ПЛАНАРИЙ (PLATYHELMINTHES)
© 2021 г. Н.Д. Крещенко
Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, Институтская ул., 3
E-mail: nkreshch@rambler.ru
Поступила в редакцию 10.08.2020 г.
После доработки 20.08.2020 г.
Принята к публикации 21.08.2020 г.
С помощью гисто- и иммуноцитохимического методов, а также флуоресцентной и конфокальной
лазерной сканирующей микроскопии изучена локализация пептидергических нейронов и мышеч-
ных волокон мускулатуры тела у планарий Girardia tigrina и Polycelis tenuis. Продемонстрировано тес-
ное пространственное взаиморасположение FMRF-иммунопозитивных нервных волокон и мио-
филаментов. Такая локализация периферических нервных волокон может указывать на важную
роль FMRF-подобных пептидов в осуществлении мышечной функции. Физиологическое исследо-
вание с использованием изолированных мышечных клеток планарий Procerodes littoralis подтверди-
ло индуцирующее влияние специфических природных FMRF-подобных нейропептидов - GYIRF
и YIRF - на мышечное сокращение у планарий. Установлено, что дигидропиридиновые блокаторы
кальциевых каналов - никардипин, нитрендипин и нифедипин, а также антагонист кальциевых ка-
налов эндоплазматического ретикулума рианодин - подавляли пептид-индуцированное сокраще-
ние мышечных клеток. Блокаторы обратного захвата ионов кальция - тапсигаргин и циклопиазо-
новая кислота - уменьшали число пептид-индуцированных мышечных ответов. Данные свидетель-
ствуют, что мышечное сокращение, вызванное FMRF-подобными пептидами, было зависимым
как от внеклеточного, так и от внутриклеточного источника ионов кальция. Результаты могут ука-
зывать на наличие разнообразных рецепторов и ионных каналов, опосредующих мышечное сокра-
щение у плоских червей.
Ключевые слова: планарии, конфокальная лазерная сканирующая микроскопия, FMRF-подобные пепти-
ды, мускулатура.
DOI: 10.31857/S0006302921030157
с кардиоактивным пептидом моллюсков Macro-
Среди регуляторных нейропептидов, выделен-
callista nimbosa, FMRFамидом, обнаруженным
ных у плоских червей (Platyhelminthes) особое
еще в 1977 г. [6]. Применение антител к этим пеп-
внимание привлекает семейство FMRF-подоб-
тидам показало широкое распространение имму-
ных пептидов [1, 2]. У плоских червей было иден-
ноокраски к FMRF-подобным пептидам в цен-
тифицировано четыре FMRF-подобныx пептида,
тральных и периферических отделах нервной систе-
три из которых выделены у свободноживущих
мы у исследованных в этом отношении видов
представителей таксона, это YIRF у наземной
плоских червей [7, 8]. Физиологическая роль FMRF-
планарии Bdelloura candida, GYIRF у планарий
подобных пептидов остается малоизученной.
Dugesia tigrina и B. candida; RYIRF, обнаруженный
у турбеллярии Arthioposthia triangulate, а также
Планарии, свободноживущие представители
GNFFRF, выделенный у паразитических цестод
типа Platyhelminthes, характеризуются высокой
Moniezia expansa [3-5]. Пептиды семейства FM-
регенерационной способностью и широко ис-
RF-подобных - это короткие молекулы, состоя-
пользуются в экспериментальной биологии как
щие из четырех-десяти аминокислотных остат-
при исследовании стволовых клеток и молеку-
ков, обладающие амидированным С-концевым
лярных механизмов их функционирования [9-
мотивом. Их характеризует структурное сходство
11], так и при изучении биофизических аспектов
регенерации [12-14]. Будучи близкими родствен-
Сокращения: PBS-буфер - 4%-й параформальдегид в 0.1 М
никами паразитических червей, планарии ис-
фосфатном буфере, PBST - PBS-буфер с добавлением
0.3% тритона X-100, FMRF-ип - FMRF-иммунопозитив-
пользуются при изучении паразито-хозяинных
ные нервные волокна.
отношений, а также поиске препаратов с антипа-
555
556
КРЕЩЕНКО
разитарными свойствами [15-18]. Использова-
ботке новых препаратов для борьбы с паразитар-
ние планарий в качестве модельного биологиче-
ными заболеваниями; во-вторых, мы можем
ского объекта имеет ряд преимуществ: их добыва-
получить важную информацию о базовых прин-
ние и содержание доступны по экономическим
ципах мышечного сокращения и его регулятор-
соображениям, на них возможна постановка
ных механизмах, формирующихся у этих простых
множественных экспериментов, удовлетворяю-
организмов, предки которых были близки к осно-
щих любую статистику.
ванию эволюционного древа всех билатерально-
симметричных животных.
Мускулатура планарий осуществляет функ-
цию поддержания формы тела, а также участвует
в различных видах двигательной активности -
МАТЕРИАЛЫ И МЕТОДЫ
плавании, поиске и захвате добычи, поглощении
Гисто- и иммуноцитохимия. Для гистохимиче-
пищи, репродуктивном поведении [19, 20]. У па-
ского определения мускулатуры и иммуноцито-
разитических червей мускулатура служит для
химического определения элементов нервной си-
проникновения в организм хозяина, а также яв-
стемы использовали планарий G. tigrina (длина 8-
ляется мишенью действия известных антипара-
9 мм) и P. tenuis (длина 11-12 мм). Для иммуноци-
зитарных агентов [21]. Несмотря на определен-
тохимической идентификации FMRF-подобных
ный интерес исследователей к изучению анато-
нейропептидов в тканях планарий готовили за-
мической организации мышечной системы у
мороженные срезы (P. tenuis) и тотальные препа-
представителей паразитических и свободноживу-
раты (G. tigrina). Образцы фиксировали PBS-бу-
щих плоских червей, физиологические аспекты
фером, содержащим 4% параформальдегида (MP
ее функционирования остаются недостаточно
Biomedicals, США) в 0.1 М фосфатном буфере
изученными. Демонстрация наличия основных
(«Helicon», Россия) при pH 7.4 в течение 4 ч при
белков, принимающих участие в мышечном со-
комнатной температуре, все последующие проце-
кращении - актина и миозина [22, 23], а также
дуры проводили при 4°С. Для приготовления то-
разработка гистохимической методики иденти-
тальных препаратов образцы промывали 24 ч в
фикации фибриллярного актина с помощью флу-
растворе, содержащем PBST (раствор PBS с до-
оресцентно-меченого фаллоидина [24] привели к
бавлением 0.3% тритона X-100 (Sigma, США),
существенному прогрессу в изучении морфоло-
0.1% азида натрия («Helicon», Pоccия) и 0.1% бы-
гического строения мускулатуры тела у предста-
чьего сывороточного альбумина (Amresco,
вителей плоских червей [25].
CША)). Затем образцы помещали на 48 ч в рас-
Задачей настоящего исследования явилось
твор (в разведении 1 : 1000) первичных поликло-
изучение структурных и функциональных харак-
нальных кроличьих антител к нейропептиду
теристик мускулатуры тела планарий. С помо-
FMRFамиду (Immunostar, США), промывали в
щью иммуноцитохимического и гистохимиче-
PBST (12 ч) и переносили во вторичные FITC-
ского методов и конфокальной лазерной скани-
(fluorescein
isothiocyanate)-коньюгированные
рующей микроскопии было показано тесное
свиные антикроличьи иммуноглобулины (Daco,
пространственное взаиморасположение FMRF-
Дания; разведение 1:50) или вторичные козьи ан-
иммунопозитивных (FMRF-ип) нервных воло-
тикроличьи AlexaFluor
488 иммуноглобулины
кон и мышечных филаментов у планарий Girardia
(Abcam, США; разведение
1:
100) на
48 ч.
tigrina и Polycelis tenuis, указывающее на возмож-
После этого препараты промывали в растворе
ное участие данных нейропептидов в регуляции
PBS (1-2 ч).
мышечного сокращения. Физиологические ис-
Для приготовления замороженных срезов
следования, проведенные на изолированных мы-
фиксированные образцы помещали на четверо-
шечных клетках планарий Procerodes littoralis,
пятеро суток в 10%-й раствор сахарозы («Heli-
продемонстрировали участие FMRF-подобных
con», Россия), затем на криотоме Shandon Cryo-
пептидов (GYIRF и YIRF) в осуществлении и ре-
matrix (Termoelectron Corporation, CША) пpи тем-
гуляции их мышечной функции. В ходе экспери-
пеpатуpе -18°C готовили срезы, поместив препа-
ментальных исследований для определения под-
раты в заливочную среду NEG
20 (Thermo
ходов к изучению механизмов мышечного сокра-
Scientific, США). Замороженные серийные сpезы
щения у плоских червей были использованы
cобиpали на обpаботанные пpедметные cтекла
агонисты и антагонисты кальциевых ионных ка-
(Polysine, Menzel-Glaser, Геpмания) и xpанили
налов.
пpи -20°C. Перед окраской препараты промыва-
Актуальность исследований обусловлена не-
ли в PBST (трижды по 5 мин в горизонтальном
сколькими причинами: во-первых, информация
положении), окрашивали антителами к FMRF
о механизмах функционирования мускулатуры
(Immunostar, США; разведение 1 : 1000, 48 ч), го-
тела у плоских червей, большинство из которых
ризонтально, во влажной камере при 4°C. После
являются опасными паразитами человека и жи-
промывки в PBST (трижды по 5 мин) препараты
вотных, будет чрезвычайно полезна при разра-
помещали во вторичные флуоресцентно-мече-
БИОФИЗИКА том 66
№ 3
2021
ИЗУЧЕНИЕ МЕХАНИЗМОВ ДЕЙСТВИЯ FMRF-ПОДОБНЫХ ПЕПТИДОВ
557
ные иммуноглобулины на 24 ч и окончательно
KCl, 458 мM NaCl, 9.8 мM MgCl2×6H2O, 13.6 мM
промывали в PBS (трижды по 5 мин).
Na2SO4, 10 мM HEPES, 10 мM D-глюкозы и 1%-й
Мускулатуру планарий P. tenuis и G. tigrina
раствор антибиотика (GibcoBRL, Великобрита-
идентифицировали с помощью TRITC-(te-
ния), в которую добавляли 0.11 мг/мл коллагена-
tramethylrhodamine B isothiocyanate)-меченого
зы (type 1A, из Clostridium hystoliticum; Sigma,
фаллоидина (Sigma-Aldrich, США; в разведении
США), 0.15 мг/мл протеазы (type XIV, из Strepto-
1 : 200), докрашивая срезы в течение 6 ч, а тоталь-
myces griseus; Sigma, США), 0.15 мг/мл дитиотреи-
ные препараты - в течение 12-24 ч при 4°С. По-
тола (Sigma, США), после чего оставляли диспер-
сле промывки в PBS образцы заключали в 75%-й
гировать в течение 12 ч при 4°C. Полученную сус-
глицерин («Helicon», Россия) на PBS, накрывали
пензию клеток перемешивали на магнитной
покровным стеклом (Menzel-Glaser, Геpмания) и
мешалке 10 мин, аккуратно пропускали через
хранили при -20°C. Отрицательный контроль
тонкий кончик пипетки, помещали в 15-милли-
включал инкубацию образцов в растворе без пер-
литровые пробирки (типа Falcon) и центрифуги-
вичных антител и замещение иммунной антисы-
ровали при 28 g в течение 5 мин. Супернатант сли-
воротки неиммунной. Контрольные образцы по-
вали, а осадок ресуспендировали в инкубационой
казали отсутствие в ткани исследованных образ-
среде, не содержащей ферментов, в течение
цов неспецифической окраски.
15 мин (4°C). После этого полученную смесь (сус-
Микpоcкопия. Для анализа использовали по
пензию) клеток распределяли в пластиковые
пять-семь препаратов каждого вида планарий.
чашки Петри (50 мм, Falcon) по 3 мл в каждую, и
Готовые окрашенные срезы изучали c помощью
сохраняли при 4°C в течение 30-90 мин для даль-
флуоpеcцентного микpоcкопа DM6000 B (Leica
нейшего исследования.
Mycrosystems, Геpмания), оснащенного цифро-
Микроперфузионную систему, соединенную с
вой фотокамерой DC300F (Leica Mycrosystems,
инвертированным микроскопом Nikon Eclipse
Геpмания), в Секторе оптической микроскопии и
TE200 (Nikon, Япония; оборудование Королев-
спектрофотометрии ЦКП ПНЦБИ РАН (Пущи-
ского университета в г. Белфаст, Великобрита-
но, Россия). Для анализа использовали фильтры
ния), использовали для визуального наблюдения
возбуждающего света с длиной волны в 450-
процесса мышечного сокращения. Все экспери-
490 нм (I3) для флуоpоxpомов FITC и AlexaFlu-
менты проводили при комнатной температуре
or488 и длиной волны 515-560 нм (N2.1) для лока-
(21-23°C). Во всех опытах использовали только
лизации флуоpоxpома TRITC.
неподвижные - спонтанно не сокращающиеся -
Тотальные препараты планарий анализирова-
мышечные клетки. Под микроскопом с помощью
ли c помощью конфокального лазерного cка-
инжектора и тонкой стеклянной микропипетки
ниpующего микpоcкопа TCS SP5 (Leica Mycrosys-
(диаметр кончика около 5 мкм) исследуемое ве-
tems, Геpмания). Микрофотографии c конфо-
щество вводили в непосредственной близости к
кального лазерного сканиpующего микроcкопа
мембране мышечной клетки (на расстоянии око-
представлены в виде отдельных оптическиx сре-
ло 10-15 мкм). Сокращение наблюдали на экране
зов, полученыx пpи сканировании через толщину
монитора, соединенного с микроскопом. В одной
тканей в 30-60 мкм. Микрофотографии, полу-
серии использовали сто случайным образом вы-
ченные с помощью флуоресцентного и конфо-
бранных клеток, взятых по 25 клеток в каждой из
кального микроскопов, сохраняли в фоpмате
четырех чашек Петри с суспензией, приготовлен-
TIFF. Изображения анализировали с помощью
ной из тканей 25 особей планарий. Каждую клет-
программы LAS AF Lite program (версия
ку считали положительной при наблюдении ее
2.4.6384.1; Leica Microsystems CMS GmbH, Геpма-
сокращения в течение 10 с после введения тести-
ния).
руемого вещества. Опыты повторяли минимум
Физиология мышечного волокна. Объектом ис-
три раза. Исследовали влияние нейропептидов
следования служили изолированные (индивиду-
GYIRFамида (GYIRF) и YIRFамида (YIRF) (Im-
альные) мышечные клетки планарий Procerodes
munogenetics, США), для сравнения был также
littoralis (Turbellaria, Tricladida). Культуру мышеч-
использован серотонин (5-HT; Sigma, США).
ных клеток получали при энзиматическом рас-
Данные на графиках и диаграммах представлены
щеплении тканей. Метод выделения индивиду-
в виде процентной доли мышечных клеток, со-
альных мышечных волокон у паразитических и
кращающихся в ответ на введение тестируемого
свободноживущих плоских червей успешно при-
вещества. Перед применением тестируемого ве-
менялся ранее [4, 26]. Для каждого эксперимента
щества проводили аппликацию инкубационной
использовали свежеприготовленную культуру
среды (негативный контроль); после аппликации
мышечных клеток планарий. Из 25 особей дли-
тестируемых веществ в качестве положительного
ной 9-10 мм с помощью тонкого скальпеля гото-
контроля на клетки подавали среду с высоким со-
вили гомогенат тканей, помещали в инкубацион-
держанием ионов калия (15-75 мМ), которая, как
ную среду, содержащую 13.6 мM CaCl2, 13.4 мM
известно, вызывает сокращение мышечных воло-
БИОФИЗИКА том 66
№ 3
2021
558
КРЕЩЕНКО
кон [27]. Для статистической обработки результа-
тов использовали t-тест Стьюдента. Для построе-
ния графиков и диаграмм, а также статистическо-
го анализа данных использовали программу
GraphPad Prism 3.02 (США).
Для изучения механизмов мышечного сокра-
щения и роли кальция в пептид-индуцируемом
мышечном сокращении клетки предварительно
инкубировали с избранными антагонистами на-
ружных и внутренних ионных кальциевых кана-
лов: никардипином, нитрендипином, нифедипи-
ном, дилтиаземом и верапамилом, рианодином, а
также циклопиазоновой кислотой и тапсигарги-
ном (все вещества получены от компании Sigma,
США). Во всех опытах вещества в концентрациях
10 и 100 мкM добавляли в чашки Петри с диспер-
гированными мышечными клетками за 10 мин до
начала основного тестирования.
Вещества, используемые для растворения ан-
тагонистов, а именно диметилсульфоксид (Sigma,
США) и этиловый спирт, были также протести-
рованы для установления их возможного влияния
на мышечную активность. Было установлено, что
0.01%-й диметилсульфоксид (n = 11) и этанол в
концентрациях 0.1% (n = 7) и 0.5% (n = 10) при их
добавлении в культуру мышечных клеток за
10 мин до начала эксперимента не оказывали су-
щественного влияния на базовой уровень мы-
шечного сокращения, вызванного деполяризаци-
ей (30 мМ, K+) серотонином (10-5 M) и пептида-
ми (10-5 M).
Иммуноцитохимические и гистохимические
исследования по идентификации актина и FM-
RF-подобных нейропептидов в тканях планарий
G. tigrina и P. tenuis выполнены в Институте био-
физики клетки РАН (ФИЦ «Пущинский науч-
ный центр биологических исследований РАН»).
Физиологические исследования мышечного со-
кращения проводили в Королевском университе-
те г. Белфаст, Великобритания (Queen’s University
Belfast, UK). Результаты ранее были частично
опубликованы в виде тезисов докладов [28, 29].
РЕЗУЛЬТАТЫ
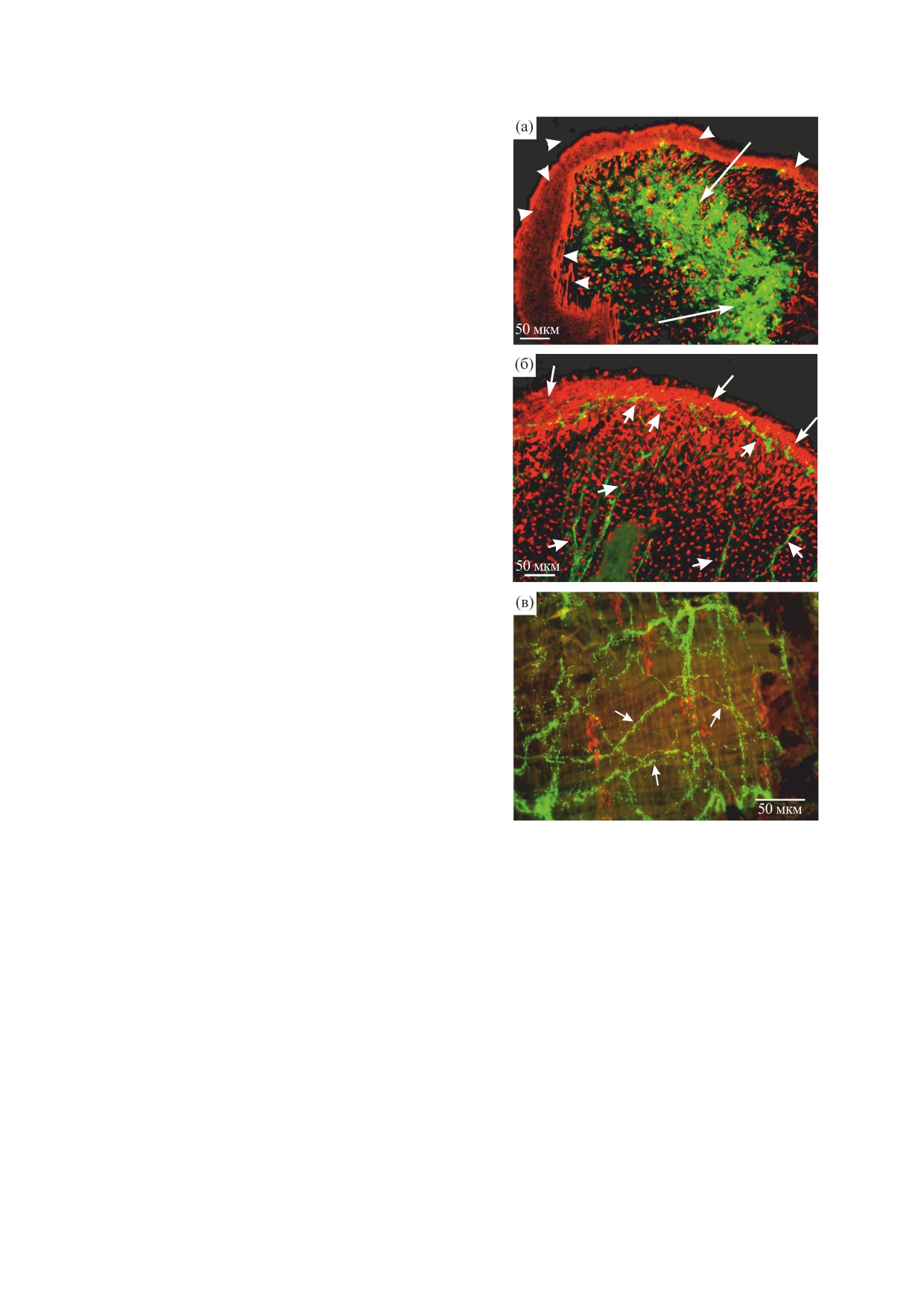
Рис.
1. Иммуноцитохимическая окраска нервных
Иннервация мускулатуры тела планарий G. tigri-
FMRF-ип-волокон (зеленое свечение) и гистохимиче-
ская окраска актиновых миофиламентов (красное све-
na и P. tenuis FMRF-иммунопозитивными нервными
чение) TRITC-меченым фаллоидином в теле планарий
элементами. У P. tenuis и G. tigrina окраска актино-
Polycelis tenuis (замороженные срезы, флуоресцентная
вых филаментов флуоресцентно-меченым фал-
микроскопия). (а) - Сагиттальный срез головного кон-
лоидином была обнаружена в мышечных волок-
ца тела планарий: головной нервный ганглий (FMRF-
ип-структуры) отмечен длинными стрелками, диаго-
нах стенки тела планарий (рис. 1а,б; 2а,г) и око-
нальные, продольные и кольцевые мышечные фила-
логлоточной зоны (рис. 1в). Мышечная стенка
менты стенки тела планарии отмечены остриями стре-
тела хорошо дифференцирована и состоит из
лок. (б) - Головной конец тела, фронтальный срез; от-
компактно упакованных кольцевых, диагональ-
мечены нервные FMRF-ип-отростки (короткие
ных и продольных мышечных волокон (рис. 1а,
толстые стрелки), простирающиеся к переднему краю
между мышечными волокнами, тонкие стрелки - коль-
острия стрелок, рис. 1б, тонкие стрелки). Немно-
цевые и продольные мышечные волокна стенки тела.
гочисленные, редко, но регулярно расположен-
(в) - Нервная FMRF-ип-сеть (короткие стрелки) в око-
ные диагональные мышечные волокна локализу-
логлоточной области тела планарий.
БИОФИЗИКА том 66
№ 3
2021
ИЗУЧЕНИЕ МЕХАНИЗМОВ ДЕЙСТВИЯ FMRF-ПОДОБНЫХ ПЕПТИДОВ
559
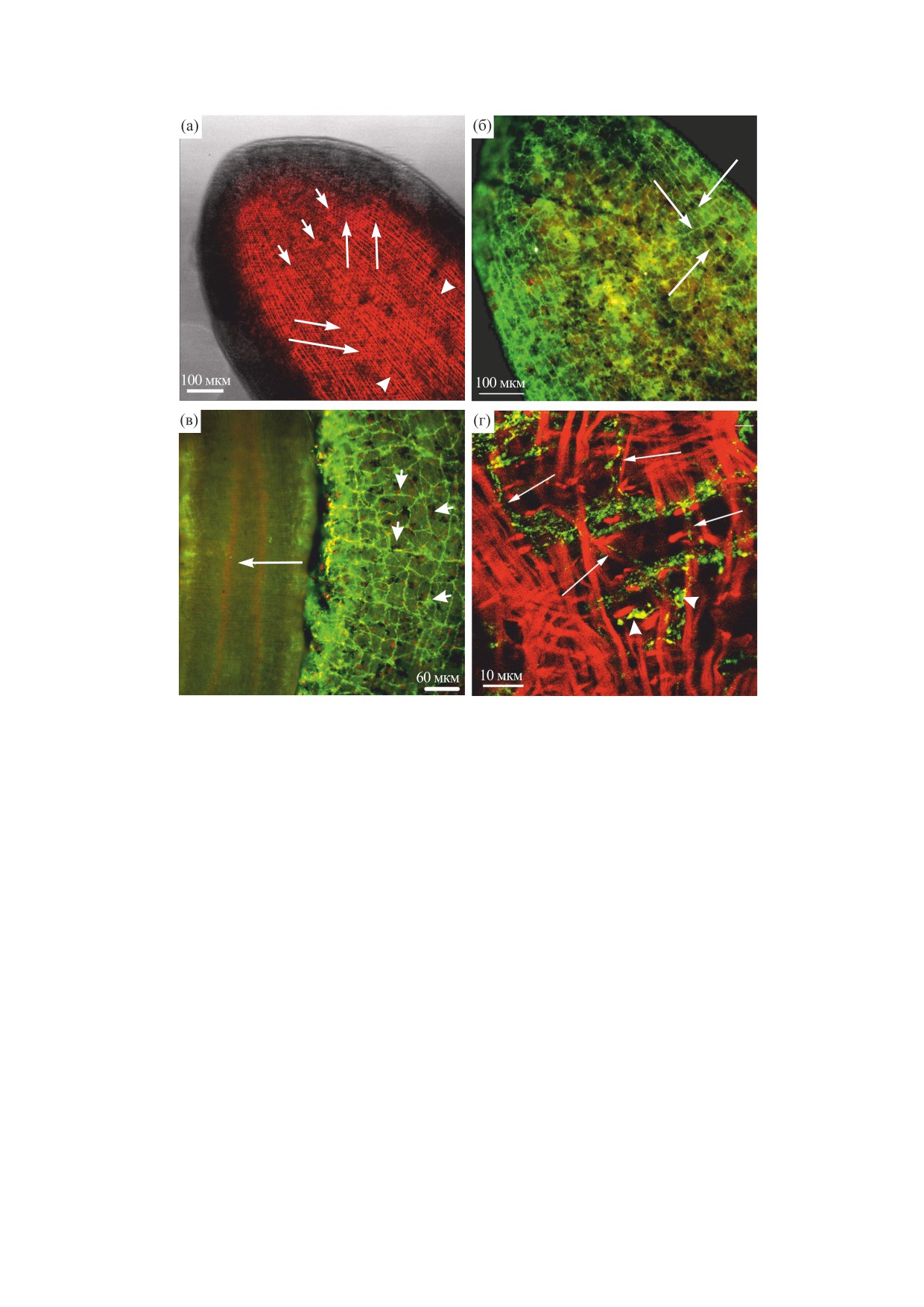
Рис. 2. Иммуноцитохимическая (зеленое свечение) окраска нервных FMRF-ип-волокон и гистохимическая окраска мы-
шечных филаментов (красное свечение) планарий Girardia tigrina, тотальные препараты, световая и конфокальная лазерная
сканирующая микроскопия (а и г), флуоресцентная микроскопия (б, в). (а) - Головной конец тела, мускулатура стенки те-
ла планарий, оптический срез, отмечены продольные (острия стрелок), диагональные (длинные тонкие стрелки) и кольце-
вые (короткие стрелки) мышечные волокна; (б) - головной конец тела с тонкими нервными FMRF-ип-волокнами нерв-
ного плексуса (тонкие длинные стрелки); (в) - глотка (длинная стрелка) и окологлоточная область тела, видна FMRF-ип-
окраска в окологлоточном нервном плексусе (короткие стрелки); (г) - нервные FMRF-ип-волокна (тонкие длинные
стрелки) и нейроны (острия стрелок), окружающие мышечные филаменты стенки тела (оптический срез), тонкие FMRF-
ип-волокна следуют на близком расстоянии вдоль единичных диагональных и кольцевых мышечных волокон (тонкие
длинные стрелки).
ются между продольными и кольцевыми слоями
мана) также наблюдали густую нервную сеть
миофибрилл. Дорзо-вентральные мышечные во-
FMRF-ип (рис. 1в, короткие стрелки).
локна расположены довольно равномерно и про-
Тотальный препарат планарий G. tigrina
низывают все тело планарий. FMRF-иммунопо-
(рис. 2а) демонстрирует мускулатуру стенки го-
зитивная (FMRF-ип) окраска отмечена в голов-
ловного отдела тела. В мышечной стенке выявле-
ном нервном ганглии планарий P. tenuis (рис. 1а,
ны продольные (рис. 2а, острия стрелок), кольце-
две длинные стрелки), от которого к переднему
вые (рис. 2а, короткие стрелки) и диагональные
краю тела простираются FMRF-ип-нервные во-
мышечные волокна (рис. 2а, длинные стрелки);
локна, располагаясь между мышечными фила-
диагональные волокна следуют в двух перпенди-
ментами и следуя вдоль них (рис. 1б, короткие
кулярных направлениях. Расположение миофи-
стрелки). FMRF-ип-окраска выявлена в нервных
ламентов в стенке тела у G. tigrina менее плотное,
волокнах, иннервирующих мускулатуру тела P. te-
по сравнению с P. tenuis, однако порядок располо-
nuis (рис. 1б, короткие стрелки). В окологлоточ-
жения мышечных cлоев не отличается от таково-
ной области тела (в стенке окологлоточного кар-
го у P. tenuis. У G. tigrina FMRF-ип-окраска выяв-
БИОФИЗИКА том 66
№ 3
2021
560
КРЕЩЕНКО
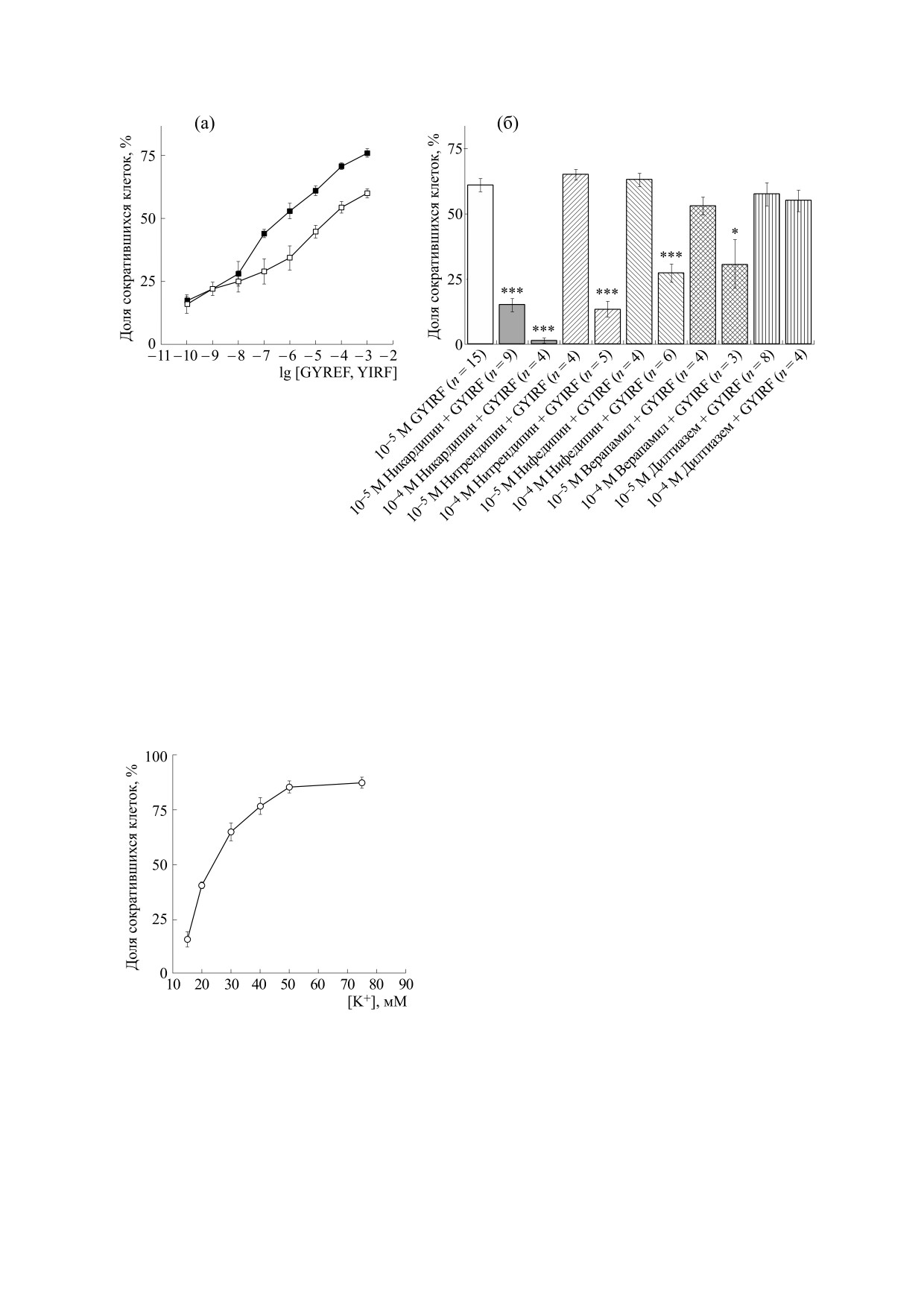
лена в тонких волокнах субмышечной нервной
как под воздействием пептида GYIRF (10-3 М)
сети (рис. 2б). Многочисленные нервные FMRF-
сокращалось до 76 ± 1.6% мышечных клеток.
ип-элементы обнаружены в окологлоточной об-
Пептиды GYIRF и YIRF (в концентрациях от
ласти тела (рис. 2в) планарий G. tigrina. Глотка
10-3 до 10-10 M) вызывали cокращение индиви-
(рис. 2в), лежащая в особом окологлоточном кар-
дуальных мышечных клеток планарий в дозоза-
мане, находится в центре туловища планарии,
висимой манере (рис. 3а).
этот карман (или окологлоточная полость) от-
крывается наружу ротовым отверстием на брюш-
Исследования показали, что предварительное
ной стороне тела. Стенка глоточного кармана
(за 10 мин до начала тестирования) добавление
(как и стенка тела планарии) состоит из продоль-
никардипина (в концентрации 10 и 100 мкМ),
ных, диагональных и кольцевых мышечных воло-
нитрендипина, нифедипина и верапамила (все -
кон. FMRF-ип-окраску наблюдали в телах ней-
в концентрации 100 мкМ) достоверно уменьшало
ронов (рис. 2г, острия стрелок) и их отростках
число мышечных клеток планарий, сокращаю-
(рис. 2г, тонкие стрелки), расположенных между
щихся в ответ на введение пептида GYIRF. Поря-
мышечными волокнами стенки тела планарий
док ингибирующей активности был следующим:
G. tigrina. По нашим наблюдениям, нервные
никардипин > нитрендипин > нифедипин > вера-
FMRF-ип-клетки периферической нервной сети
памил (рис. 3б). Дилтиазем в концентрациях 10 и
представлены преимущественно мультиполяр-
100 мкМ не оказал влияния на индуцированное
ными нейронами. Их нервные FMRF-ип-волок-
пептидом сокращение мышечных клеток.
на с расширениями (varicosities) следуют как
вдоль продольных и кольцевых мышечных воло-
В качестве положительного контроля исполь-
кон, так и вдоль диагональных миофибрилл. По
зовали среду с высоким содержанием ионов К+,
всей вероятности, нервные FMRF-ип-окончания
вызывающих деполяризацию клеточной мембра-
локализуются на продольных, кольцевых, а также
ны и сокращение мышечной клетки (рис. 4). Так,
диагональных мышечных волокнах.
в наших опытах при введении вблизи мембраны
Таким образом, проведенные у двух видов пла-
мышечной клетки среды с 20 мМ ионов калия со-
нарий иммуноцитохимические исследования
кращались около 42 ± 1.6% мышечных клеток
свидетельствуют о том, что нервные FMRF-ип-
(n = 9); при концентрации ионов калия в 30 мМ -
элементы принимают участие в иннервации му-
67 ± 2.8% клеток (n = 20), при введении 40 мМ К+ -
скулатуры стенки тела, а также мышечной стенки
79.6 ± 4.3% клеток (n = 10), использование кон-
окологлоточной полости P. tenuis и G. tigrina, ука-
центрации в 50 мМ К+ вызывало сокращение
зывая на возможную регуляторную функцию
88 ± 2.8% мышечных клеток планарий (n = 4).
FMRF-подобных нейропептидов в сокращении
мускулатуры тела планарий.
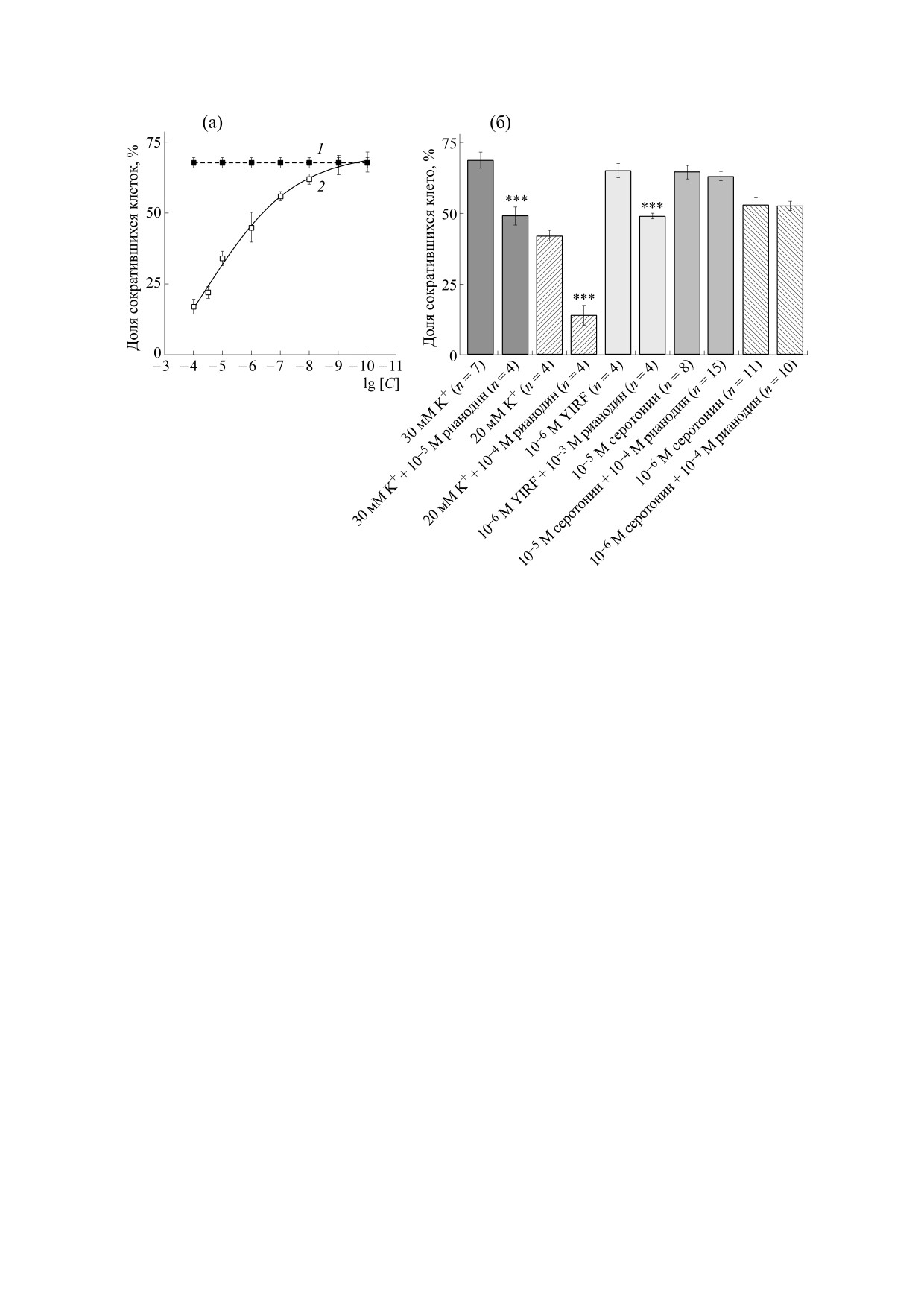
Число мышечных клеток, сокращающихся в
Физиологические исследования. Для изучения
ответ на введение пептидов YIRF и GYIRF, суще-
мышечного сокращения были проведены физио-
ственно уменьшалось после предварительной ин-
логические исследования на изолированных мы-
кубации их с рианодином (рис. 5а,б). Рианодин (в
шечных клетках планарий P. littoralis с использо-
концентрациях от 10-4 до 10-8 М) подавлял пеп-
ванием природных нейропептидов GYIRF и
тид-индуцированное мышечное сокращение в
YIRF, среды с высоким содержанием ионов K+, а
дозозависимой манере (рис. 5а). Интересно, что
также дигидропиридиновых (никардипин, нит-
рианодин (в концентрациях 10-5 и 10-6 М) бло-
рендипин, нифедипин), бензотиазепиновых (ди-
кировал также мышечное сокращение, вызывае-
лтиазем) и фенилалкиламиновых (верапамил)
мое избытком ионов калия (K+), но не оказывал
блокаторов наружных кальциевых каналов и риа-
существенного влияния на сокращение, вызыва-
нодина, блокатора внутриклеточных кальциевых
емое биогенным амином (серотонином) даже в
каналов эндоплазматического ретикулума (или
рианодиновых рецепторов). Изучали также влия-
концентрации 10-4 М (рис. 5б).
ние ингибиторов обратного захвата кальция в ка-
Тапсигаргин и циклопиазоновая кислота в
налах эндоплазматического ретикулума - цикло-
концентрациях от 10-4 до 10-8 М, при добавлении
пиазоновой кислоты и тапсигаргина - при их до-
в культуру клеток планарий за 10 мин до начала
бавлении в культуру мышечных клеток.
тестирования, уменьшали число мышечных кле-
Эксперименты на изолированных мышечных
ток, сокращающихся в ответ на введение пептида
клетках планарий показали, что введение ней-
GYIRF (10-5 М), а также в ответ на деполяриза-
ропептидов GYIRF и YIRF в непосредственной
близости к клеточной мембране вызывало со-
цию, вызванную высоким содержанием ионов K+
кращение мышечных клеток. Максимальное
(30 мМ), но не оказывали существенного влияния
число сокращений под воздействием пептида
на индуцированное серотонином (10-5 М) мы-
YIRF (10-3 M) составило 60 ± 1.8%, в то время
шечное сокращение (рис. 6а,б).
БИОФИЗИКА том 66
№ 3
2021
ИЗУЧЕНИЕ МЕХАНИЗМОВ ДЕЙСТВИЯ FMRF-ПОДОБНЫХ ПЕПТИДОВ
561
Рис. 3. (а) - Кривые пептид-индуцированного (GYIRF - темные квадраты, YIRF - светлые квадраты) сокращения
изолированных мышечных клеток планарий Procerodes littoralis. По оси ординат - доля сократившихся мышечных клеток в
процентах, по оси абсцисс - десятичный логарифм концентрации пептида. Разбросы - стандартная ошибка среднего (SE).
Число повторных опытов в каждой точке кривой n = 4-8 для GYIRF, n = 4-18 для YIRF. (б) - Доля сократившихся
изолированных мышечных клеток планарий (ось ординат, в процентах) в ответ на введение нейропептида GYIRF при
предварительном инкубировании клеток в течение 10 мин с дигидропиридиновыми блокаторами. Разбросы - стандартная
ошибка среднего (SE). Различия с контролем (10-5 М GYIRF, без инкубации) достоверны при ***p < 0.0001 и *p < 0.01 при
использовании непарного (two-tailed) t-теста Стьюдента.
ОБСУЖДЕНИЕ
Несмотря на некоторый прогресс в изучении
мускулатуры паразитических червей, сведения о
ее строении и, тем более, функционировании
ограничены для большинства видов Platyhelmin-
thes. Необходимость добычи животных в нужном
для экспериментов количестве, создания специ-
альных условий для сохранения их жизнеспособ-
ности, а также практические трудности воспроиз-
ведения в лабораторных условиях сложных и раз-
нообразных жизненных циклов паразитических
гельминтов создают объективные трудности в ра-
боте с паразитическими представителями плос-
ких червей. Преимущество свободноживущих
планарий, при использовании их в качестве
биологической модели для изучения механизмов
Рис. 4. Сокращение мышечных клеток планарий в ответ
мышечного сокращения, состоит в простоте и
на введение среды с высоким содержанием ионов К+.
удобстве манипуляций с этими организмами, в
По оси ординат - доля сократившихся мышечных
дешевизне их содержания, в возможности ис-
клеток в процентах, по оси абсцисс - концентрация
пользования большого количества животных и
ионов калия, мМ; разбросы - стандартная ошибка
постановки множественных экспериментов, удо-
среднего (SE). Число повторных измерений в каждой из
точек графика - от 4 до 20.
влетворяющих любую статистику.
БИОФИЗИКА том 66
№ 3
2021
562
КРЕЩЕНКО
Рис. 5. (а) - Число сокращений изолированных мышечных клеток планарий, индуцированных нейропептидом GYIRF
(5 ⋅ 10-5 М, n = 12, темные квадраты), после предварительного культивирования с рианодином (светлые квадраты). По оси
ординат - доля сократившихся мышечных клеток в процентах, по оси абсцисс - десятичный логарифм концентрации рас-
твора рианодина, добавленного в культуру мышечных клеток за 10 мин до начала эксперимента. Эмпирическая кривая,
описывающая ответы мышечных клеток на введение пептида (GYIRF, 5 ⋅ 10-5 М) после их инкубации с рианодином, по-
строена с помощью анализа методом Fit spline в статистической программе Prizm 3.02 (GraphPad Software Inc., США). Чис-
ло повторных опытов в каждой точке кривой - от 4 до 8. Разбросы - стандартная ошибка (SE). Достоверность отличий кри-
вой 1 (пептид) от кривой 2 (рианодин + пептид) была оценена согласно непарному t-тесту Стьюдента. (б) - Сокращение
изолированных мышечных клеток планарий, вызванное деполяризацией (высоким содержанием ионов К+), нейропепти-
дом YIRF и серотонином, до и после предварительной инкубации мышечных клеток с рианодином. По оси ординат - доля
сократившихся мышечных клеток планарий. Разбросы - стандартная ошибка среднего (SE). Различия с контролем (без
инкубации) достоверны при ***p < 0.0001 согласно непарному t-тесту Стьюдента.
Мускулатура плоских червей преимуществен-
ры плоских червей являются ацетилхолин, серо-
но гладкомышечного типа. По своему происхож-
тонин и специфические пептиды [21].
дению она относится к первичным мышечным
У празитических Platyhelminthes положитель-
тканям, развившимся из эпителиально-мышеч-
ная иммуноокраска к FMRF-подобным пепти-
ных клеток предков многоклеточных [21]. Меха-
дам обнаружена у цестод и трематод в централь-
низм сокращения клеток гладкой мускулатуры у
ной нервной системе, субэпителиальном и суб-
плоских червей, как и вообще у беспозвоночных,
мышечном нервных плексусах, в нервных
плохо изучен. Известно, что гладкомышечные
волокнах, пронизывающих прикрепительные ор-
клетки подвергаются действию нейромедиато-
ганы - ротовую и брюшную присоски, глотку, ре-
ров, высвобождающихся из варикозных утолще-
продуктивные структуры [30, 31]. FMRF-подоб-
ний нерва. Поступление сократительного стиму-
ные пептиды были также показаны иммуноцито-
ла (деполяризация мембраны, гормон или нейро-
химически у нескольких видов свободноживущих
медиатор) инициирует открытие кальциевых
планарий: B. candida [4], Microstomum lineare [32],
каналов в мембране мышечной клетки и/или эн-
Microstomum histricinum marinum [33], Planaria torva
доплазматического ретикулума. Действие нейро-
[34], Dugesia tigrina [35, 36], P. tenuis и Dendrocoelum
медиатора на сокращение клеток гладких мышц
lacteum [37], Schmidtea mediterranea [38] с исполь-
может быть возбуждающим либо тормозным.
зованием целого ряда разных антител. У плана-
Возбуждающими нейромедиаторами мускулату-
рий P. littoralis нейропептид GNFFRF был иден-
БИОФИЗИКА том 66
№ 3
2021
ИЗУЧЕНИЕ МЕХАНИЗМОВ ДЕЙСТВИЯ FMRF-ПОДОБНЫХ ПЕПТИДОВ
563
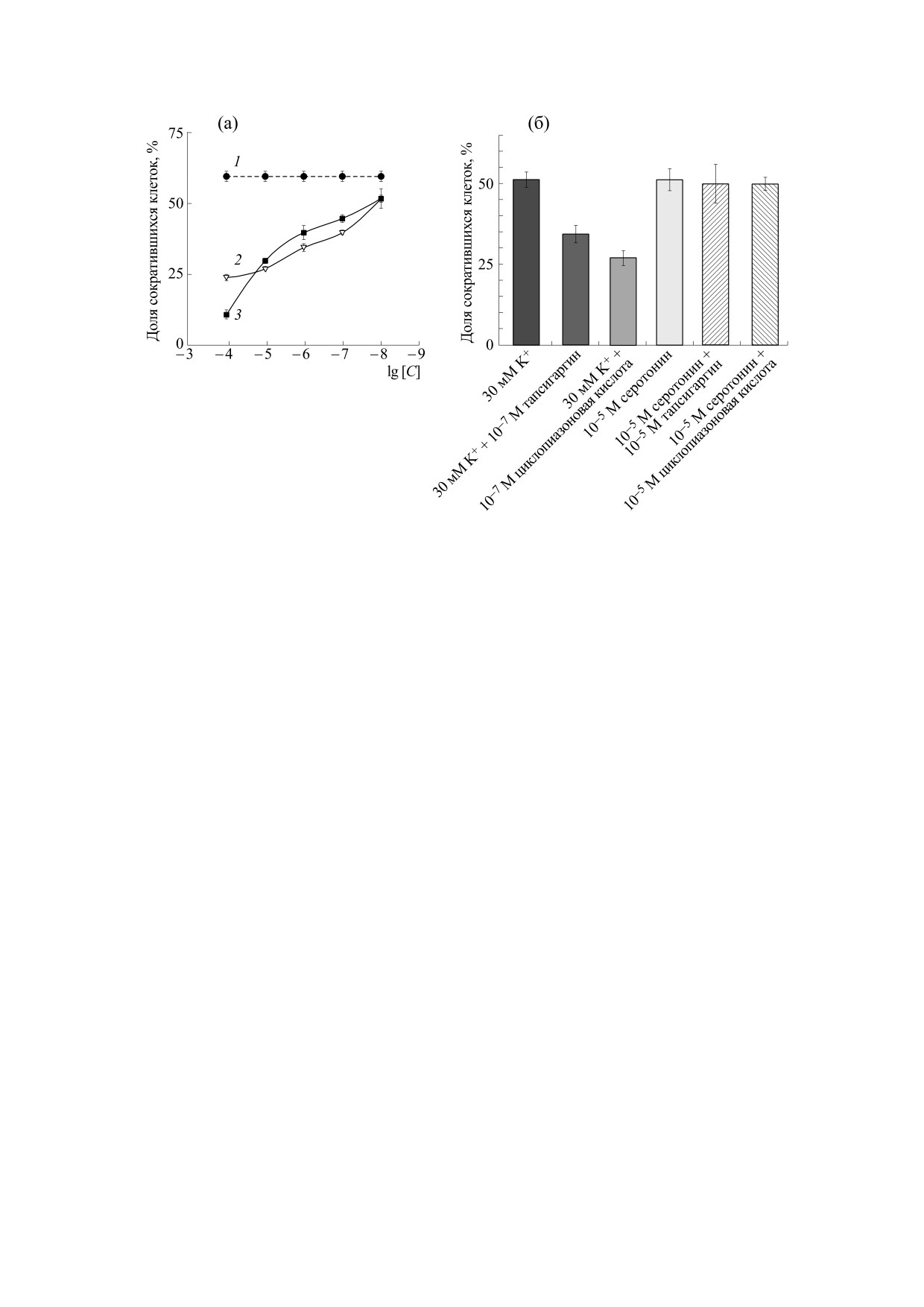
Рис. 6. (а) - Действие тапсигаргина и циклопиазоновой кислоты на сокращение изолированных мышечных клеток,
вызванное нейропептидом GYIRF. По оси ординат - доля сократившихся мышечных клеток в ответ на введение пеп-
тида (в процентах), по оси абсцисс - десятичный логарифм концентрации тапсигаргина и циклопиазоновой кислоты,
добавленных в культуру мышечных клеток планарий за 10 мин до начала эксперимента. 1 - Контроль (пептид GYIRF,
10-5 М, n = 4); эмпирические кривые, описывающие ответы мышечных клеток на введение пептида (GYIRF, 10-5 М)
после их предварительной инкубации с циклопиазоновой кислотой (2) и тапсигаргином (3), построенные с помощью
анализа методом Fit spline в статистической программе GraphPad Prizm 3.02. Число повторных опытов в каждой
точке - от 3 до 6 (тапсигаргин) и от 4 до 7 (циклопиазоновая кислота). Разбросы - стандартное отклонение (SD). (б) -
Действие тапсигаргина и циклопиазоновой кислоты на сокращение изолированных мышечных клеток, вызванное де-
поляризацией (30 мМ K+) и серотонином в концентрации 10-5 М. Число повторных подсчетов в каждой точке n = 4.
Разбросы - стандартная ошибка среднего (SE).
тифицирован в синапсах нейронов с помощью
щее действие FMRF-подобных пептидов на дви-
электронной микроскопии и иммуно-мечения
гательную активность взрослых моногеней Dicli-
золотом [39]. В большинстве этих работ взаимо-
dophora merlangi [40], личинок цестод Mesocestoides
действие пептидергических нервных окончаний с
corti [41], обнаружено сократительное влияние
мускулатурой тела не изучалось.
FMRF-подобных пептидов на мышечные препа-
раты трематод Fasсiola hepatica [42, 43].
Наши данные подтверждают полученные ра-
Успешное изолирование жизнеспособных
нее сведения о наличии FMRF-подобных пепти-
мышечных волокон стало следующим важным
дов у планарий. В настоящем исследовании про-
шагом в изучении физиологии мышечного сокра-
демонстрировано тесное пространственное взаи-
щения у плоских червей [44, 45]. В отличие от мы-
морасположение пептидергических нервных
шечных препаратов, использование отдельной
волокон и мышечных филаментов у планарий.
мышечной клетки позволяет детально изучать
Показано, что мускулатура стенки тела, а также
фармакологические свойства тестируемых пре-
структуры с сильно развитой мускулатурой, такие
паратов без влияния на них нейрональных сигна-
как окологлоточная полость, интенсивно иннер-
лов. Непосредственное участие FMRF-подобных
вируются отростками FMRF-ип-нейронов. Ин-
пептидов в индукции мышечного сокращения
нервация мускулатуры пептидергическими нерв-
удалось показать на изолированных мышечных
ными элементами свидетельствует в пользу того,
волокнах трематод Schistosoma mansoni [46], тур-
что эти молекулы могут быть вовлечены в регуля-
беллярий B. candida [4], P. littoralis [27] и D. tigrina
цию мышечной функции у плоских червей. В са-
[47].
мом деле, литературные сведения указывают на
важную роль FMRF-подобных пептидов в функ-
Результаты проведенного нами физиологиче-
ционировании мускулатуры у паразитических
ского исследования с использованием изолиро-
видов червей. Так, было выявлено стимулирую-
ванных мышечных клеток планарий, а также дан-
БИОФИЗИКА том 66
№ 3
2021
564
КРЕЩЕНКО
ные, полученные другими исследователями [27,
скулатуры плоских червей необходимо проведе-
47], свидетельствуют о том, что специфические
ние дальнейших экспериментов. Эти исследова-
FMRF-подобные нейропептиды являются мощ-
ния практически необходимы
- поскольку
ными индукторами сокращения мускулатуры у
мускулатура плоских червей является мишенью
плоских червей. Начатые нами исследования ме-
действия антипаразитарных препаратов. Выявле-
ханизмов стимулирующего влияния FMRF-по-
ние характерных физиологических свойств му-
добных пептидов на мускулатуру показали, что у
скулатуры плоских червей должно в перспективе
планарий P. littoralis сокращение зависело от по-
помочь в разработке специализированных лекар-
ственных средств, селективно действующих на
ступления ионов Ca2+ через плазматическую
мускулатуру плоских червей, большинство кото-
мембрану, поскольку подавлялось дигидропири-
рых являются возбудителями опасных заболева-
диновыми блокаторами кальциевых каналов (ни-
ний человека и животных.
кардипином, нитрендипином и нифедипином), а
также фенилалкиламиновым блокатором верапа-
милом. Это указывает на наличие в мембране мы-
ВЫВОДЫ
шечной клетки планарий медленных потенциал-
Иммуноцитохимические исследования с ис-
управляемых кальциевых ионных каналов L-ти-
пользованием специфических антител показали
па, обладающих, по крайней мере, некоторыми
тесное пространственное взаиморасположение
свойствами кальциевых каналов позвоночных
пептидергических (FMRF-подобных) нервных
животных (дигидропиридиновая чувствитель-
окончаний с мышечными волокнами стенки тела
ность). Эти предположения подтверждаются дан-
планарий.
ными, полученными также на планариях D. tigrina
[48]. Также установлено, что рианодин, антаго-
Результаты демонстрируют способность при-
нист внутренних кальциевых каналов эндоплаз-
родных нейропептидов (GYIRF и YIRF) индуци-
матического ретикулума, блокировал мышечное
ровать сокращение изолированных мышечных
сокращение, вызываемое пептидами GYIRF и
клеток, что может указывать на существование их
YIRF. Кроме того, тапсигаргин и циклопиазоно-
специфических рецепторов на мембране мышеч-
ной клетки планарий.
вая кислота, специфические ингибиторы Са2+-
Пептид-индуцированное мышечное сокраще-
АТР-азы эндоплазматического ретикулума, вы-
ние подавлялось дигидропиридиновыми блока-
зывающие пассивный выход Са2+ из внутрикле-
торами Ca2+-каналов и, таким образом, было за-
точных депо в цитозоль, также значительно
уменьшали число мышечных сокращений в ответ
висимым от поступления внеклеточного Ca2+ в
на введение пептида. Таким образом, результаты
клетку.
показали, что резерв внутриклеточного кальция
В регуляции пептид-индуцированного мы-
играет центральную роль в регуляции пептид-ин-
шечного сокращения у планарий центральную
дуцированного мышечного сокращения у плана-
роль играет внутренний резерв ионов кальция
рий. Очевидно, что в ходе пептид-индуцирован-
Ca2+, поступающего из внутриклеточного депо,
ного мышечного сокращения вход внеклеточного
вероятно через внутренние рианодиновые каль-
кальция через плазматическую мембрану вызы-
циевые каналы.
вает Ca2+-индуцированный выход ионов кальция
Ca2+ из внутриклеточного депо через внутренние
БЛАГОДАРНОСТИ
рианодиновые кальциевые каналы. Полученные
сведения в целом соответствуют представлениям
Автор выражает благодарность Д.В. Халтону
о сокращении гладкомышечной мускулатуры и
(prof. D.W. Halton) и А.Г. Молу (prof. A.G. Maule)
могут указывать на существование универсаль-
Королевского Университета г. Белфаст (Queen’s
ных механизмов, задействованных в мышечном
University of Belfast, Northern Ireland, UK) за предо-
сокращении, как у высокоорганизованных, так и
ставленную возможность работать в лаборатории
у таких простых организмов, как плоские черви,
и их чуткое руководство, а также А. Моусли
планарии. Индуцирующее влияние ряда агентов,
(dr. A. Mousley) за помощь в освоении методики
таких как нейропептиды, серотонин, деполяри-
культивирования мышечных клеток.
зация, свидетельствует о наличии множества раз-
В работе использовано оборудование Сектора
нообразных специфических рецепторов на мем-
оптической микроскопии и спектрофотометрии
бране мышечной клетки планарий. Результаты
ЦКП ПНЦБИ РАН (Пущино, Россия).
показали, что известные для позвоночных живот-
ных пути поступления внеклеточного кальция, а
ФИНАНСИРОВАНИЕ РАБОТЫ
также механизмы высвобождения кальция из
внутриклеточных депо в цитозоль присутствуют
Работа по изучению физиологии мышечного со-
также и в гладкомышечных клетках плоских чер-
кращения была поддержана стипендией Королев-
вей. Для выявления функциональных свойств му-
ского Общества Великобритании (Royal Society Fel-
БИОФИЗИКА том 66
№ 3
2021
ИЗУЧЕНИЕ МЕХАНИЗМОВ ДЕЙСТВИЯ FMRF-ПОДОБНЫХ ПЕПТИДОВ
565
lowship Program, Великобритания). Иммуноцитохи-
20.
N. D. Kreshchenko, Biophysics 62 (2), 271 (2017).
мические исследования по идентификации FMRF-
21.
D. W. Halton and A. G. Maule, Can. J. Zool. 82, 316
подобных пептидов и гистохимическое исследова-
(2004).
ние мускулатуры у планарий выполнены при фи-
22.
R. Pascolini, F. Panara, I. Di Rosa, et al., Cell. Tiss.
нансовой поддержке Российского фонда фундамен-
Res. 267, 499 (1992).
тальных исследований (грант №18-04-00349а).
23.
R. Pascolini, F. Panara, G. Gabbiani, et al., Bolletino
di
Zoologia
60
(4),
403
(1993).
DOI:
10.1080/11250009309355848
КОНФЛИКТ ИНТЕРЕСОВ
24.
M. H. Wahlberg, Cell. Tiss. Res. 291 (3), 561 (1998).
Автор заявляет об отсутствии конфликта инте-
25.
G. R. Mair, D. W. Halton, A. G. Maule, and C. Shaw,
ресов.
Parasitology Today 14, 73 (1998).
26.
K. L. Blair, T. A. Day, M. C. Lewis, et al., Parasitology
102, 251 (1991).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
27.
C. G. Moneypenny, N. Kreshchenko, T. A. Day, et al.
Настоящая работа не содержит описания ис-
Parasitology 122, 447 (2001).
следований с использованием людей и животных
28.
N. Kreshchenko, T. A. Day, D. W. Halton, and
в качестве объектов.
A. G. Maule, in Abstr. 8th Eur. Multicolloqium of Para-
sitology (Poland, Acta Parasitologica 45 (3), 2000),
p. 256.
СПИСОК ЛИТЕРАТУРЫ
29.
N. D. Kreshchenko, M. Totten, A. G. Maule, et al., in
1. C. Shaw, A. G. Maule, and D. W. Halton, Int. J. Para-
Abstr. Book of Int. Symp. “Biological motility: new
sitol. 26 (4), 335 (1996).
trends in research” (Pushchino, 2001), pp. 82-83.
2. P. McVeigh, G. R. Mair, L. Atkinson, et al., Int. J. Par-
30.
N. B. Terenina, N. D. Kreshchenko, N. V. Mochalova,
asitol. 39, 1243 (2009).
and S. O. Movsesyan, Helminthologia 55 (3), 185
(2018).
3. R. N. Johnston, C. Shaw, D. W. Halton, et al., Bio-
chem. Biophys. Res. Comm. 209, 689 (1995).
31.
O. O. Tolstenkov, V. V. Prokofiev, N. B. Terenina, and
M. K. S. Gustafsson, Parasitol. Res. 108, 1219 (2011).
4. R. N. Johnston, C. Shaw, D. W. Halton, et al., J. Neu-
DOI: 10.1007/s00436-010-2166-6
rochem. 67, 814 (1996).
32.
M. Reuter, M. K. S. Gustafsson, J. Lang, and
5. G. Maule, D. W. Halton, and L. Thim, Biochem. Bio-
C. J. P. Grimmelkuijzen, Zoomorphology
109,
303
phys. Res. Comm. 193, 1054 (1993).
(1990).
6. D. A. Price and M. J. Greenberg, Science 197 (4304),
33.
G. R. Mair, R. N. Johnston, D.W. Halton, et al., Zoo-
670 (1977).
morphology 116 (4), 213 (1996).
7. N. D. Kreshchenko, Biochemistry (Moscow). Suppl.
Ser. A: Membrane and Cell Biology 8 (1), 89 (2014).
34.
K. MÈntylÈ, D. W. Halton, M. Reuter, et al., Hydrobi-
ologia 383, 167 (1998).
8. O. O. Tolstenkov, L. Akimova, N. B. Terenina, and
35.
M. Reuter, M. K. S. Gustafsson, I. M. Sheiman, et al.,
M. K. S. Gustafsson, Parasitol. Res. 111, 1977 (2012).
Invertebrate Neurosci. 1, 133 (1995).
9. M. Almuedo-Castillo, X. Crespo, F. Seebeck, et al.,
PLoS Genetics 10 (6), e1004400 (2014).
36.
N. Kreshchenko, M. Reuter, I. Sheiman, et al., Inver-
tebrate Reproduction and Development 35 (2), 109
10. L.-Ch. Cheng, K. C. Tu, C. W. Seidel, et al., Dev. Biol.
(1999).
433, 357 (2018).
37.
M. Reuter, M. K. S. Gustafsson, K. Mäntylä, and
11. J. Bagunà, Seminars in Cell and Developmental Biolo-
C. J. P. Grimmelikhuijzen, Zoomorphology 116, 111
gy 87, 3 (2019).
(1996).
12. V. V. Novikov, I. M. Sheiman, and E. E. Fesenko, Bio-
38.
F. Cebrià, Neurosci. Res. 61, 375 (2008).
electromagnetics
29
(5),
387
(2008).
DOI:
10.1002/bem.20407
39.
K. MÈntylÈ, M. Reuter, D. W. Halton, et al., Acta Zoo-
logica (Stockholm) 79 (1), 1 (1998b).
13. P. G. Barghouth, M. Thiruvalluvan, and N. J. Oviedo,
Biochim. Biophys. Acta 1848 (10, Part B), 2629 (2015).
40.
C. G. Moneypenny, A. G. Maule, C. Shaw, et al., Par-
DOI: 10.1016/j.bbamem.2015.02.024
asitology 115, 281 (1997).
14. F. Durant, J. Bischof, Ch. Fields, et al., Biophys. J.
41.
G. Hrĉkova, S. Velebný, D. W. Halton, et al., Int. J.
116, 948 (2019).
Parasitol. 34, 83 (2004).
15. T. Nogi, D. Zhang, J. D. Chan, et al., PLoS Negl. Trop.
42.
N. J. Marks, S. Johnson, D. W. Halton, et al., Parasi-
Dis. 3 (6), e464 (2009).
tology 113, 394 (1996).
16. J. J. Collins and Ph. A. Newmark, PLoS Pathogens 9
43.
M. K. Graham, I. Fairweather, and J. G. McGeown,
(7), e1003396 (2013).
Parasitology 114, 455 (1997).
17. N. J. Wheeler, P. N. Agbedanu, M. J. Kimber, et al.,
44. K. L. Blair and P. A. V. Anderson, Parasitology 109,
Parasitol. Vectors 8, 34 (2015).
325 (1994).
18. E. I. Maciel, C. Jiang, P. G. Barghouth, et al., Devel.
45.
T. A. Day, A. G. Maule, C. Shaw, et al., Parasitology
Compar. Immunol. 93, 18 (2019).
109, 455 (1994).
19. F. Cebrià, Front. Cell Devel. Biol. 4, 8 (2016). DOI:
46.
T. A. Day, A. G. Maule, C. Shaw, and R. A. Pax, Pep-
10.3389/fcell.2016.00008
tides 18, 917 (1997).
БИОФИЗИКА том 66
№ 3
2021
566
КРЕЩЕНКО
47. T. A. Day, J. Haithcock, M. Kimber, and A. G. Maule,
48. P. Cobbett and T. A. Day, Com. Biochem. Physiol. Part
Parasitology 120, 417 (2000).
A 134, 593 (2003).
An Exploration of the Mechanisms of Action of FMRF-Like Peptides in Inducing
Muscle Contraction in Planarians (Platyhelminthes)
N.D. Kreshchenko
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
The present work focuses on the study of localization of peptidergic neurons and muscle fibers of body wall
musculature in planarians Girardia tigrina and Polycelis tenuis with the use of immunohistochemistry and im-
munocytochemistry methods, fluorescent microscopy and confocal laser scanning microscopy. A close spa-
tial relationship between FMRFamide-immunopositive nerve fibres and myofilaments is shown. Such local-
ization of peripheral peptidergic nerve fibres may suggest an important role FMRF-like neuropeptides
play in the regulation of muscle function. Physiological analysis of the muscle cells isolated from planarian
Procerodes littoralis confirmed that native flatworm FMRF-like peptides GYIRF and YIRF have the induc-
ing effect on muscle contractions in planarian. It was found that dihydropyridine calcium channel blockers,
nicardipine, nitrendipine and nifedipine, as well as ryanodine, an antagonist of the endoplasmic reticulum
calcium channels inhibited peptide-induced muscle contraction. The blockers of the intracellular calcium
ions reuptake - thapsigargin and cyclopiazonic acid decreased the number of peptide-induced muscular re-
sponses. The findings suggest that FMRF-like peptide-induced muscle contraction is dependent on calcium
ions from both extracellular pool and intracellular stores. The results demonstrate the presence of different
receptors and ion channels controlling muscle contractions in flatworms.
Keywords: planarians, confocal laser scanning microscopy, FMRF-like peptides, musculature
БИОФИЗИКА том 66
№ 3
2021