БИОФИЗИКА, 2021, том 66, № 3, с. 567-571
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
ВЛИЯНИЕ ОСТРОЙ ОДНОСТОРОННЕЙ ТРАВМАТИЧЕСКОЙ
ДЕНЕРВАЦИИ НА ПУРИНЕРГИЧЕСКУЮ СИГНАЛИЗАЦИЮ
В ХОЛИНЕРГИЧЕСКОМ СИНАПСЕ
© 2021 г. А.Е. Хайруллин, Д.В. Ефимова, В.А. Маркосян, С.Н. Гришин,
А.Ю. Теплов, А.У. Зиганшин
Казанский государственный медицинский университет, 420012, Казань, ул. Бутлерова, 49
E-mail: khajrulli@yandex.ru
Поступила в редакцию 16.02.2021 г.
После доработки 26.02.2021 г.
Принята к публикации 03.03.2021 г.
Ранее нами было установлено изменение эффективности модулирующего действия АТФ под дей-
ствием некоторых нефизиологических факторов в нервно-мышечных синапсах грызунов. Цель на-
стоящего исследования - оценить эффект АТФ на синаптическую передачу изолированной m. so-
leus крысы после травматической денервации. Показано, что семисуточная денервация привела к
увеличению силы сокращений m. soleus, вызванных электрической стимуляцией. Аппликация АТФ
усиливает сокращения интактной камбаловидной мышцы, вызванные электрической стимуляци-
ей, но не влияет на денервированную мышцу. На фоне неселективного антагониста P2-рецепторов
сурамина прекращалось действие АТФ. Мы предполагаем, что снижение модулирующей способно-
сти АТФ на денервированных мышцах, по всей видимости, вызвано снижением количества Р2-ре-
цепторов на нервной терминали, возникающем в результате нарушения антероградного транспорта
и проводящей способности нервного волокна.
Ключевые слова: денервация, ATФ, P2-рецепторы, скелетные мышцы, синапс, сурамин.
DOI: 10.31857/S0006302921030169
Травмы, оперативные вмешательства и ряд
Посттравматическое высвобождение АТФ ак-
других причин могут приводить к нарушению ин-
тивирует Р2-рецепторы. Было показано усиление
нервации конечностей, что впоследствии ведет за
экспрессии P2X7-рецепторов на соседних непо-
собой стойкое нарушение функций мышц и по-
врежденных клетках и тканях [4]. По всей види-
степенные морфологические изменения, прояв-
мости, можно предположить, что Р2-сигнализа-
ляющиеся в виде рубцовых перерождений мы-
ция являются специфическим участником в ме-
шечных волокон с утратой способности к сокра-
ханизмах тканевых травм и их последствиях.
щению.
Связывание АТФ с Р2Х7-рецептором вызыва-
Известно, что после механического поврежде-
ет в течение миллисекунд открытие канала, изби-
ния тканей из них во внеклеточное пространство
рательного для небольших катионов, на несколь-
высвобождается АТФ. Свои эффекты, например,
ко секунд приводит к открытию большой поры,
в виде модуляции синаптической передачи, она
которая позволяет проникнуть в клетку высоко-
способна оказывать через лиганд-управляемые
молекулярным соединениям.
ионные каналы (P2X-рецепторы) и метаботроп-
Дальнейшая реорганизация цитоскелета при-
ные P2Y-рецепторы [1]. В настоящее время уста-
водит к высвобождению провоспалительных ци-
новлено, что молекула АТФ может активно регу-
токинов (IL-1b) и активации каспазы-3 (триггера
лировать эффективность нервно-мышечной пе-
апоптоза), способствующего в целом осуществле-
редачи, регулируя квантовый и неквантовый
нию некротических и апоптотических эффектов:
выброс ацетилхолина [2].
набухание клетки, разрушение мембраны, даль-
Известно, что АТФ, как сигнальная молекула,
нейший лизис [5].
может частично усугублять нейрональное повре-
Установлено, что антагонисты P2X7-рецепто-
ждение, вызванное травмой или нарушением об-
ров могут уменьшать воспаление и рубцевание,
мена веществ, но при этом в той же степени мо-
возникающее в ответ на повреждения нервов, а
жет выступать в качестве активатора нейропро-
также способствовать функциональному восста-
тективных процессов [3].
новлению поврежденных тканей [3]. Считается,
567
568
ХАЙРУЛЛИН и др.
что это происходит в результате активации ней-
10 мл, наполненные раствором Кребса (состав в
ротрофических факторов, которые способствуют
мМ): NaCl - 118.0, KCl - 4.75, CaCl2 - 2.5, NaH-
процессам выживания и роста нервов. Они игра-
CO3 - 24.8, KH2PO4 - 1.18, MgSO4 ⋅ 7H2O - 1.18,
ют ключевую роль в развитии пластичности и в
глюкоза - 11, рН 7.4. Заданное значение темпера-
целом в регенерации структур как центральной,
туры (20 ± 0.5°C) поддерживали с помощью тер-
так и периферической нервной систем. Деятель-
мостата. На мышцы изначально подавали нагруз-
ность данных веществ осуществляется путем вза-
ку в 1 г, затем оставляли в покое на полчаса для
имодействия их со специальными рецепторами,
адаптации к среде.
расположенными на поверхности нейронов,
Электростимуляцию проводили с помощью
шванновских клеток, эндотелиоцитов.
«всасывающего» электрода (suction electrode).
Цель настоящего исследования - оценить эф-
Культю нерва выделенной мышцы помещали в
фект АТФ на синаптическую передачу изолиро-
«всасывающий» электрод оригинальной кон-
ванной m. soleus крысы после травматической де-
струкции. Для раздражения использовали элек-
нервации.
тростимулятор Digitimer MultiStimul D330 (Вели-
кобритания). Мышцы стимулировали в течение
2 мин прямоугольными импульсами амплитудой
МЕТОДЫ
3 В и продолжительностью 0.5 мс при частоте
Подготовительные процедуры. Исследования
0.1 Гц. Силу сокращений мышц регистрировали с
проводили на белых лабораторных крысах-сам-
помощью датчика двигательной активности Lin-
цах породы Wistar массой 130-190 г, которых со-
ton FСG-01 (Великобритания), аналоговый сиг-
держали в группах по пять особей с водой и кор-
нал преобразовывался системой сбора данных Bi-
мом ad libitum.
opack MP100МSW (США). Все полученные в те-
Животных перед началом операции наркоти-
чение двух минут ответы (12 сократительных
зировали, вводя внутрибрюшинно раствор эта-
ответов) усредняли и обрабатывали как один ре-
минала натрия в дозе 40 мг/кг. После очистки
зультат. Рассчитывали их в % относительно ис-
операционного поля на задней левой конечности
ходных результатов, полученных в начале экспе-
от шерсти фиксировали оперируемую конеч-
римента. Через полчаса после фиксирования
ность для удобства дальнейших манипуляций.
нервно-мышечной ткани проводили контроль-
Выполняли косой разрез кожи боковой поверх-
ную стимуляцию мышц дважды с интервалом в
ности бедра, после чего последовательно вскры-
пять минут, удостоверившись в стабильности со-
вали подкожно жировую клетчатку, поверхност-
кратительных ответов, начинали эксперимен-
ную фасцию и широкую фасцию бедра. Произво-
тальные процедуры.
дили отодвигание в сторону волокон длинной
Эффекты пуринергических агонистов и антаго-
головки двуглавой мышцы бедра для обнажения
нистов. В ванночку добавляли 100 мкМ АТФ и че-
сосудисто-нервного пучка (седалищный нерв, ар-
рез 10 мин оценивали механические ответы мыш-
терия и вена, сопровождающие седалищный
цы. Затем мышцу промывали раствором Кребса и
нерв). После этого проводили выделение седа-
инкубировали с раствором сурамина в концен-
лищного нерва, отделение его от сопровождаю-
трации 100 мкМ в течение 20 мин с последующим
щих кровеносных сосудов с последующей резек-
добавлением 100 мкМ АТФ и вновь регистриро-
цией нерва (удаляли участок нерва размером
вали механические ответы мышц. Для подтвер-
5 мм). Конечным этапом операции являлось за-
ждения синаптической природы эффектов АТФ в
шивание раны лавсаном 3.0, обработка операци-
экспериментах нервно-мышечную ткань инкуби-
онного поля раствором хлоргексидина и раство-
ровали с сурамином в концентрации 100 мкМ, че-
ром бриллиантового зеленого.
рез 20 мин регистрировали сократительные отве-
После проведения операции животных содер-
ты мышц, возникающие в ответ на непрямую сти-
жали в течение семи суток в одиночных клетках с
муляцию электрическим током.
водой и кормом ad libitum. После семисуточного
восстановления животных предварительно нар-
котизировали, вводя внутрибрюшинно раствор
РЕЗУЛЬТАТЫ
этаминала натрия в дозе 40 мг/кг, обескровлива-
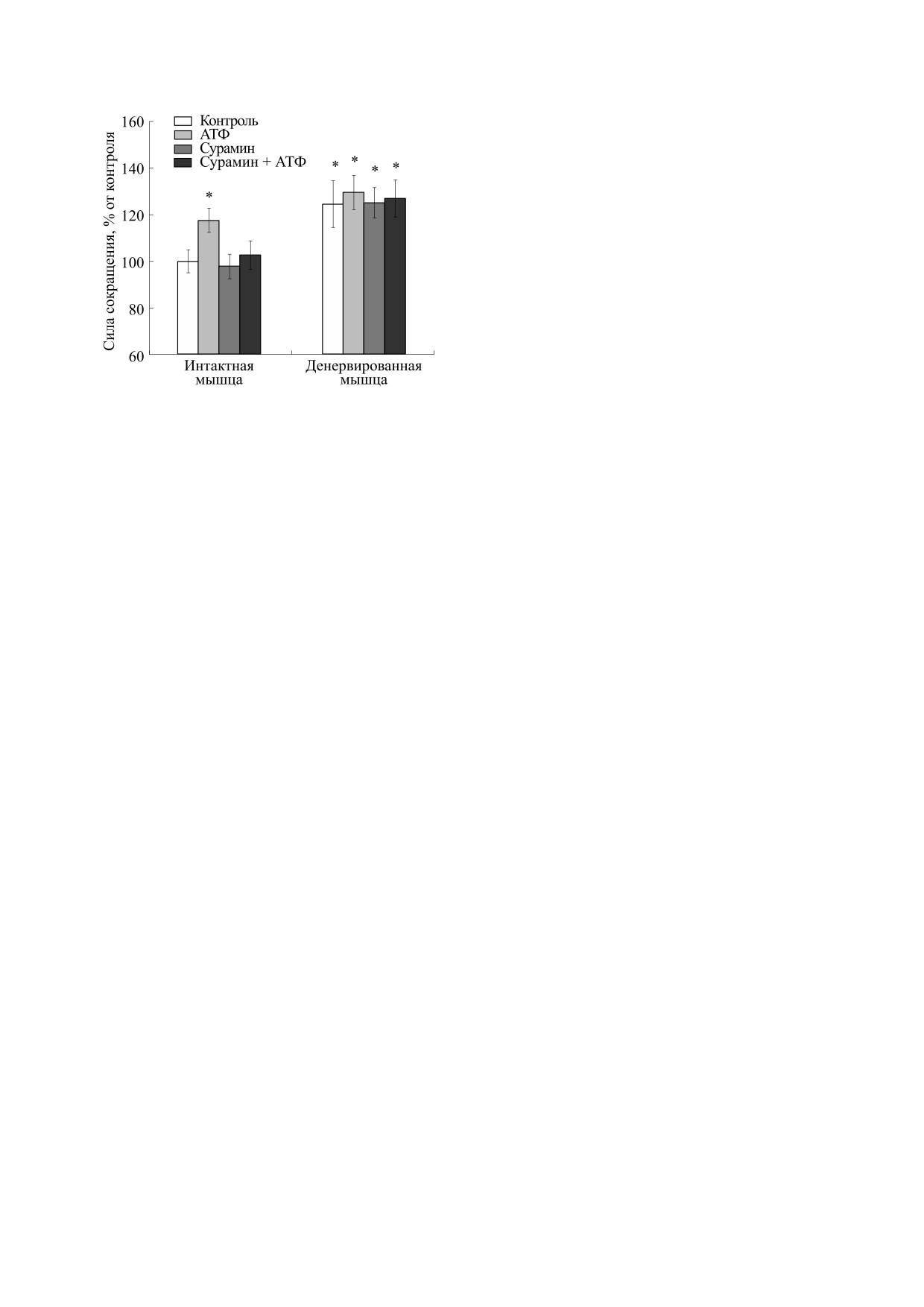
Сокращения, вызванные электрической стиму-
ли и выделяли m. soleus с культей седалищного
ляцией. Усредненная по восьми экспериментам
нерва.
сила сокращения m. soleus интактных крыс соста-
Проведение экспериментов по регистрации па-
вила 2.48 ± 0.31 г (n = 8), что было принято за
раметров сокращения. Выделенные мышцы фик-
100%. Аппликация АТФ в концентрации 100 мкМ
сировали одним сухожильным концом к непо-
усиливала сокращения интактной камбаловид-
движному штативу, второй конец прикрепляли
ной мышцы, вызванные электрической стимуля-
лигатурой к датчику двигательной активности и
цией, до 117.6 ± 5.2% (n = 8, р < 0.05) от контроля
погружали в небольшие резервуары объемом
(рис. 1). На фоне неселективного антагониста P2-
БИОФИЗИКА том 66
№ 3
2021
ВЛИЯНИЕ ОСТРОЙ ОДНОСТОРОННЕЙ ТРАВМАТИЧЕСКОЙ ДЕНЕРВАЦИИ
569
коплазматической кальциевой АТФазы (SERCA)
на длительных сроках денервации, приводящее к
снижению сократимости мышц [10]. Кроме того,
было показано изменение экспрессии митохон-
дриального транскрипционного фактора А
(Tfam), белка, который управляет транскрипцией
и репликацией митохондриальной ДНК и регу-
лируется во время состояния пониженного со-
держания органелл, вызванного неиспользовани-
ем мышц. Это приводит к снижению мышечной
массы на 13 и 38% соответственно через трое и се-
меро суток после денервации [12]. Другие авторы
указывают, что морфологические изменения в
денервированных мышцах начинаются позже [7-
10]. В одной из работ иммуногистохимически при
помощи моноклональных антител к тяжелым це-
пям быстрого миозина показано, что денервация
путем иссечения фрагмента седалищного нерва
Рис. 1. Влияние денервации на силу сокращений m.
soleus крысы, вызванных электрической стимуляци-
не изменяет относительное содержание быстрых
ей, в отсутствие и в присутствии АТФ (100 мкМ) и су-
мышечных волокон в медленной камбаловидной
рамина (100 мкМ). Результаты представлены в виде
мышце крысы [13].
M ± m в % от исходных величин, принятых за 100%;
n = 8; * - р < 0.05 от контроля интактной мышцы.
Казалось бы, все эти изменения должны при-
водить к угнетению мышечной активности. Тем
не менее в наших экспериментах семисуточная
рецепторов сурамина в концентрации 100 мкМ
денервация привела к увеличению силы сокра-
прекращалось действие АТФ.
щения.
Семисуточная денервация привела к увеличе-
Почему это могло произойти? Известно, что
нию силы сокращения мышцы до 124.6 ± 10.1%
при перерезке нерва денервированная часть кле-
(n = 8, р < 0.05) от интактного контроля (рис. 1).
ток мишеней может становиться более чувстви-
Инкубация денервированной ткани с АТФ в кон-
тельной к оставшемуся афферентному входу [14].
центрации 100 мкМ никак не повлияла на сокра-
Подобное явление известно как «закон денерва-
щения камбаловидной мышцы, вызванные элек-
ции». Денервационная суперчувствительность
трической стимуляцией. Введение в ванночку су-
может вести к увеличению рефлекторной актив-
рамина (100 мкМ) не изменило сократительной
ности [15]. В наших экспериментах, конечно,
активности денервированной мышцы.
речь идет не о рефлекторной активности, тем не
При повышении напряжения раздражающих
менее, применяемый способ стимуляции элек-
импульсов до 100 В наблюдалась прямая стимуля-
трическим полем генерализирован по своей сути
ция мышечной ткани, при этом добавление
и может затрагивать активированные денерваци-
100 мкМ АТФ не оказало эффекта на силу сокра-
ей суперчувствительные механизмы.
щения исследуемой мышцы.
Кроме того, согласуется с нашими данными и
объясняет усиление сократимости денервирован-
ОБСУЖДЕНИЕ
ных мышц в контроле работа, демонстрирующая
Статья посвящена исследованию влияния де-
снижение активности холинэстеразы после соче-
танной химической денервации [16]. Вероятнее
нервации на сократимость скелетной мышцы, а
всего, этот эффект приводит к увеличению коли-
также модулирующих эффектов АТФ на нервно-
мышечную передачу при семисуточной денерва-
чества и времени жизни основного медиатора,
ции.
ацетилхолина в синаптической щели.
Широко известно, что моторная денервация
В данной работе показано, что моторная де-
приводит к уменьшению силы, подвижности
нервация способна существенно изменять из-
мышцы и ее атрофии [6]. Семисуточный срок де-
вестный потенцирующий эффект экзогенного
нервации был выбран нами исходя из того, что на
АТФ на нервно-мышечную передачу в условиях
более длительных сроках начинаются морфоло-
стимуляции внешним электрическим полем [17-
гические изменения в мышцах, подвергнутых де-
20].
нервации или иным расстройствам [7-11], кото-
Ранее были опубликованы только данные о
рые будут маскировать изменения в синапсе.
влиянии денервации на эффект АТФ на состоя-
Морфофункциональные изменения, возника-
ние постсинаптической мембраны мышечных
ющие после денервации, описаны в литературе. В
волокон. [21] Исследования проводили на иннер-
частности, показано изменение активности сар-
вированной и денервированной m. EDL мыши.
БИОФИЗИКА том 66
№ 3
2021
570
ХАЙРУЛЛИН и др.
Рис. 2. Предположительная схема пуринергической модуляции нервно-мышечной передачи в мышце m. soleus. АТФ
и ее метаболит аденозин участвуют в отдельных механизмах отрицательной обратной связи: АТФ через P2Y-
рецепторы и аденозин - через рецепторы аденозина А1 и A2A. Показана синаптическая везикула в нервном
окончании, заполненная АТФ и ацетилхолином. Экзоцитоз содержимого везикул вызывает активацию пре- и
постсинаптических Р2-рецепторов АТФ. ACh - ацетилхолин, PLC - фосфолипаза С, АС - аденилатциклаза.
Показано, что после инкубации с АТФ сила со-
СПИСОК ЛИТЕРАТУРЫ
кращения интактной мышцы уменьшалась, а де-
1. A. U. Ziganshin, A. E. Khairullin, C. H. V. Hoyle, and
нервированной - повышалась до 120% (постси-
S. N. Grishin, Int. J. Mol. Sci. 21, 6423 (2020).
наптическое звено).
2. С. Н. Гришин и А. У. Зиганшин, Биол. мембраны
Демонстрируемое нами снижение модулирую-
30 (4), 243 (2013).
щей способности АТФ на денервированных
3. W. Peng, M. L. Cotrina, X. Han, et al., Proc. Natl.
мышцах, по всей видимости, вызвано снижением
Acad. Sci. USA 106, 12489 (2009).
количества Р2-рецепторов на нервной термина-
4. P. Majumder, C. A. Trujillo, and C. G. Lopes, Puriner-
ли, возникающим в результате нарушения анте-
gic Signal. 3 (4), 317 (2007).
роградного транспорта и проводящей способно-
сти нервного волокна (рис. 2).
5. J. G. Boyd and T. Gordon, Mol. Neurobiol. 27 (3), 277
(2003).
Изучение механизмов синаптической пла-
стичности в условиях деструкции проводящих
6. Е. В. Маркелова, Физиология: методическое пособие
путей может позволить подобраться чуть ближе к
для студентов институтов физической культуры
решению таких задач, как реабилитация пациен-
(МГУ им. адм. Г.И. Невельского, Владивосток,
тов с острыми травматическими повреждениями
2009).
и хроническим сдавливанием нервов, а также
7. H. J. Finol, D. M. Lewis, and R. Owens, J. Physiol.
нейродегенеративными, воспалительными, мета-
319, 81 (1981).
болическими и неопластическими нарушениями.
8. K. Küllmer, C. D. Reimers, P. Eysel, and U. Harland,
Ultraschall Med. 17 (5), 225 (1996).
9. M. Midrio, Eur. J. Appl. Physiol. 98 (1), 1 (2006).
КОНФЛИКТ ИНТЕРЕСОВ
10. M. Komatsu, T. Nakada, H. Kawagishi, et al., J. Mus-
cle Res. Cell Motil. 39 (5-6), 163 (2018).
Авторы заявляют об отсутствии конфликта
11. E. V. Ponomareva, E. V. Kachaeva, E. G. Altaeva, et al.,
интересов.
Biophysics 53 (6), 615 (2008).
12. L. D. Tryon, M. J. Crilly and D. A. Hood, Am. J.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Physiol. Cell Physiol. 309 (4), 228 (2015).
Проведенные эксперименты полностью соот-
13. Р. Р. Исламов, Д. С. Гусева, Ю. А. Челышев и
ветствуют действующим национальным и между-
В. В. Валиуллин, Бюл. эксперим. биологии и
народным нормам в области этики.
медицины 131 (4), 477 (2001).
БИОФИЗИКА том 66
№ 3
2021
ВЛИЯНИЕ ОСТРОЙ ОДНОСТОРОННЕЙ ТРАВМАТИЧЕСКОЙ ДЕНЕРВАЦИИ
571
14. W. B. Cannon and A. Rosenblueth, The supersensitivi-
18. A. U. Ziganshin, A. E. Khairullin, A. Y. Teplov, et al.,
tyof denervated structures: a law of denervation (Macmil-
Muscle and Nerve 59 (4), 509 (2019).
lan Co., N.Y., 1949).
19. A. E. Khairullin, A. Y. Teplov, S. N. Grishin, et al.,
15. M. Goldberger, Trends Neurosci. 3 (11), 288 (1980).
Biophysics 64, 812 (2019).
16. Т. Р. Ковригина и В. И. Филимонов, Морфология
20. A. E. Khairullin, A. U. Ziganshin, and S. N. Grishin,
146 (6), 54 (2014).
Biophysics 65, 858 (2020).
17. A. U. Ziganshin, A. E. Khairullin, B. A. Ziganshin,
21. А. М. Фархутдинов, Вестник РГМУ 3 (42), 191
et al., Muscle and Nerve 55 (3), 417 (2017).
(2005).
Effect of Acute Unilateral Denervation Injury on Purinergic Signaling
in the Cholinergic Synapse
A.E. Khairullin, D.V. Efimova, V.A. Markosyan, S.N. Grishin, A.Yu. Teplov, and A.U. Ziganshin
Kazan State Medical University, ul. Butlerova 49, Kazan, 420012 Russia
Previously, we found a change in the efficiency of the modulating action of ATP under the influence of some
non-physiological factors at neuromuscular synapses in rodents. The aim of this study was to evaluate the ef-
fect of ATP on synaptic transmission of isolated rat soleus muscles after denervation injury. It was shown that
after 7 days of denervation, rats exhibited an increase in the strength of electrical stimulation-evoked contrac-
tions of the soleus muscles. Application of ATP increased the electrically evoked but not denervated contrac-
tions of the intact soleus muscle. In the presence of the non-selective P2-receptor antagonist suramin, ATP
stopped its action. We speculate that a reduction in the ATP activity in a rat model of denervation is most like-
ly caused by a decrease in the number of P2 receptors on the nerve terminal because of impairment of antero-
grade transport and a decline in nerve fiber conduction velocity.
Keywords: denervation, ATP, P2-receptors, skeletal muscles, synapse, suramin
БИОФИЗИКА том 66
№ 3
2021