БИОФИЗИКА, 2021, том 66, № 4, с. 629-633
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛЫ ACTH-(7-10)
© 2021 г. Л.Н. Агаева*, А.А. Абдинова**, С.Р. Ахмедова***, Н.А. Ахмедов*
*Бакинский государственный университет, AZ1148, Баку, ул. Академика З. Халилова, 23, Азербайджан
**Азербайджанский государственный педагогический университет,
AZ1000, Баку, ул. Узеира Гаджибейли, 68, Азербайджан
***Азербайджанский технический университет, AZ1073, Баку, просп. Г. Джавида, 25, Азербайджан
E-mail: leylanamig@mail.ru
Поступила в редакцию 29.12.2019 г.
После доработки 29.12.2019 г.
Принята к публикации 14.04.2021 г.
Методом теоретического конформационного анализа исследована пространственная структура мо-
лекулы ACTH-(7-10) - фрагмента 7-10 адренокортикотропного гормона с аминокислотной после-
довательностью Phe-Arg-Trp-Gly. Потенциальная функция системы выбрана в виде суммы нева-
лентных, электростатических и торсионных взаимодействий и энергии водородных связей. Про-
странственная структура молекулы Phe-Arg-Trp-Gly рассчитана на основе низкоэнергетических
конформаций соответствующих аминокислотных остатков. Показано, что пространственная
структура тетрапептидной молекулы может быть представлена восемью низкоэнергетическими
формами основной цепи. Найдены низкоэнергетические конформации молекулы, значения дву-
гранных углов основных и боковых цепей аминокислотных остатков, оценена энергия внутри- и
межостаточных взаимодействий.
Ключевые слова: АСТН-(7-10), теоретический конформационный анализ, пространственная
структура, конформация.
DOI: 10.31857/S0006302921040013
В качестве пептидов, которые по своей но-
короткие пептиды часто имеют собственную био-
отропной и нейропротективной активности не
логическую активность [1-4].
уступали бы семаксу - синтетическому пептид-
Данная работа посвящена расчету простран-
ному препарату, относящемуся к классу регуля-
ственной структуры молекулы ACTH-(7-10) -
торных пептидов и оказывающему ноотропное,
Phe7-Arg8-Trp9-Gly10 - и является продолжени-
психостимулирующее, нейрозащитное, антиок-
ем наших исследований в этой области [5-11].
сидантное и антигипоксическое действие, испы-
Для нахождения пространственного строения
тывали различные фрагменты молекулы адрено-
пептидной молекулы использовали метод теоре-
кортикотропного гормона ACTH: ACTH-(7-10)-
тического конформационного анализа, позволя-
ющий рассчитывать трехмерную структуру био-
PGP, ACTH-(4-10)-PGP, ACTH-(6-10)-PGP,
молекул исходя из известной аминокислотной
ACTH-(5-7)-PGP. Эти пептиды проявляли не
последовательности.
только ноотропную и анксиолитическую актив-
ность, но также увеличивали жизнеспособность
культивируемых клеток глии, полученных из ко-
МЕТОД ИССЛЕДОВАНИЯ
ры больших полушарий мозга крыс с ишемиче-
Расчет молекулы выполнен с помощью метода
ским повреждением мозга. При исследовании
теоретического конформационного анализа. По-
влияния ACTH-(4-10)-PGP на размер некротиче-
тенциальная функция системы выбрана в виде
ского очага у крыс оказалось, что данный пептид,
суммы невалентных, электростатических и тор-
как и семакс, уменьшает размер некроза при раз-
сионных взаимодействий и энергии водородных
витии ишемического инсульта у крыс приблизи-
связей. Невалентные взаимодействия были оце-
тельно на 50%. Все эти препараты планируются
нены по потенциалу Леннарда-Джонса. Элек-
использовать в качестве лекарственных средств.
тростатические взаимодействия рассчитывались
При разных способах введения из исходных пеп-
в монопольном приближении по закону Кулона с
тидов образуется разный набор продуктов гидро-
использованием парциальных зарядов на атомах.
лиза, при этом известно, что образующиеся более
Конформационные возможности молекулы
629
630
АГАЕВА и др.
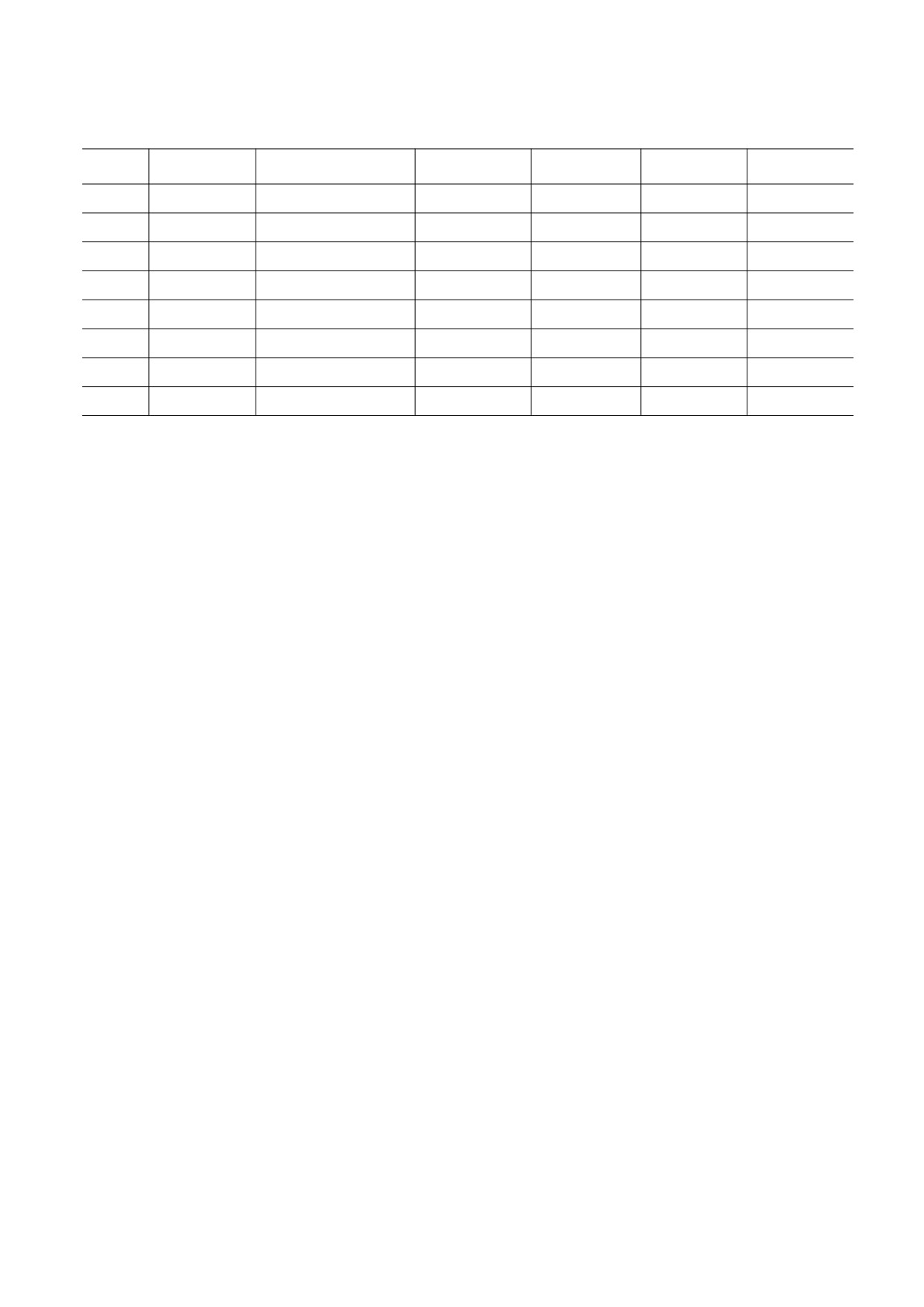
Таблица 1. Энергетические вклады разных видов взаимодействий и относительная энергия предпочтительных
конформаций молекулы ACTH-(7-10)
№
Шейп
Конформация
Uнев
Uэл
Uторс
Uотн
1
efe
B2R3122B21B
-73.9
14.3
12.2
0
2
fee
R2B33B13B
-69.7
16.0
10.9
4.2
3
eee
B2B2322B11B
-63.0
13.9
6.3
4.6
4
ffe
R2R3322B13B
-66.8
16.4
8.8
5.5
5
fef
R2B3322R31R
-67.2
18.1
8.0
6.3
6
eef
B2B2322R13P
-64.7
11.3
11.8
6.3
7
eff
B1R3122R33R
-70.1
16.8
13.9
8.0
8
fff
R2R3322R21R
-64.3
18.1
8.0
9.2
Примечание. Uнев - энергия невалентных взаимодействий, Uэл - электростатических, Uторс - торсионных; Uотн -
относительная энергия предпочтительных конформаций; величины взаимодействий приведены в кДж/моль.
ACTH-(7-10) изучены в условиях водного окру-
вана на основе низкоэнергетических конформа-
жения, в связи с чем величина диэлектрической
ций метиламида N-ацетил-L-фенилаланина, ме-
проницаемости принята равной 10. Энергию во-
тиламида N-ацетил-L-аргинина, метиламида
дородных связей оценивали с помощью потенци-
N-ацетил-L-триптофана и метиламида N-ацети-
ала Морзе.
лглицина. Результаты расчета представлны в
табл. 1-3. Относительная энергия и энергетиче-
При изложении результатов расчета использо-
вана классификация пептидных структур по кон-
ские вклады невалентных, электростатических,
торсионных взаимодействий этих конформаций
формациям, формам основной цепи и шейпам
молекулы ACTH-(7-10) представлены в табл. 1.
пептидного скелета. Конформационные состоя-
ния полностью определяются значениями дву-
Энергия внутри- и межостаточных взаимодей-
гранных углов основной и боковых цепей всех
ствий самой низкоэнергетической конформации
аминокислотных остатков, входящих в данную
каждой формы даны в табл. 2, а геометрические
молекулу. Формы основной цепи фрагмента об-
параметры этих конформаций - в табл. 3. Про-
разуются сочетаниями форм R, B и L остатков в
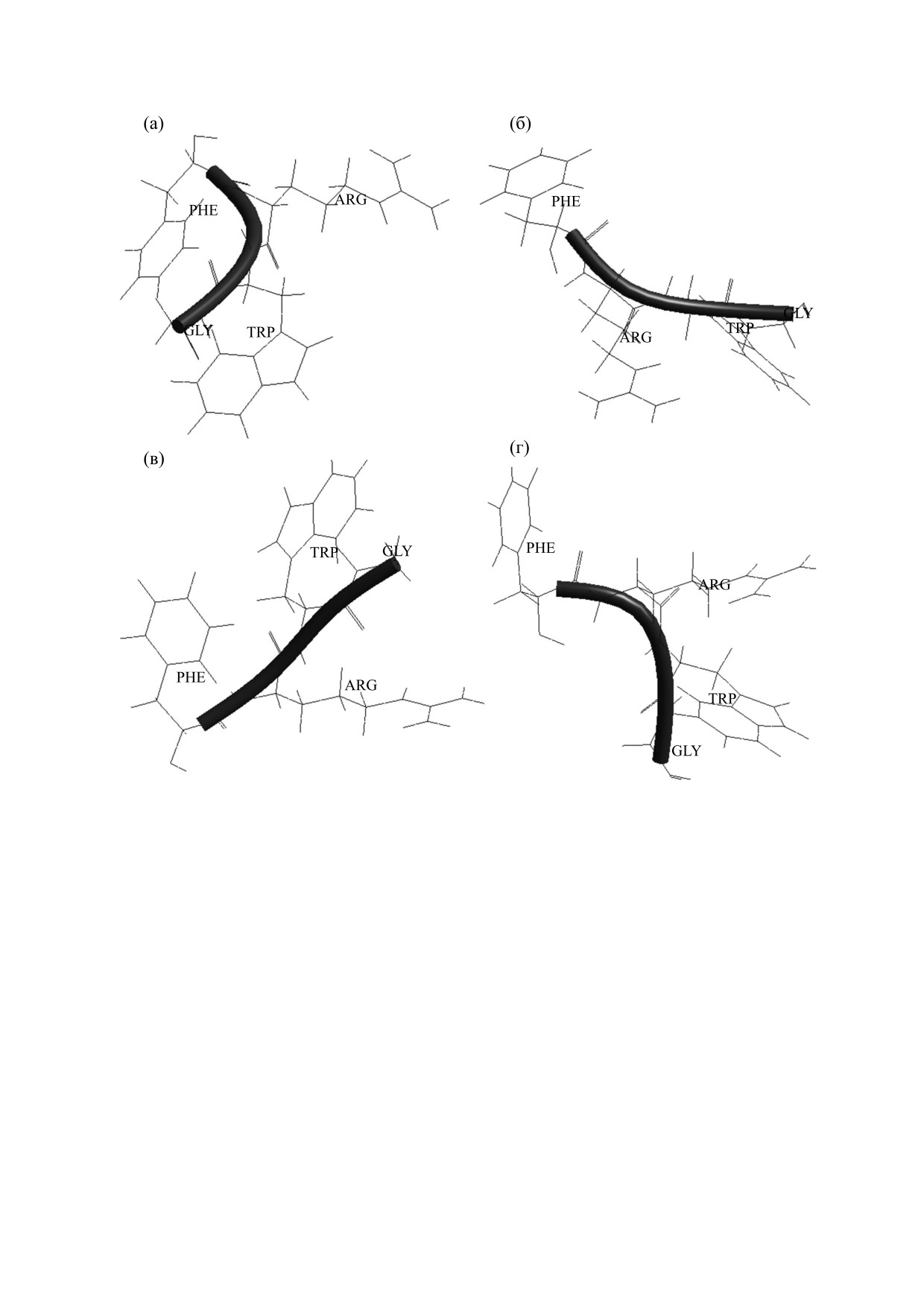
странственное расположение аминокислот в низ-
данной последовательности. Формы основной
коэнергетических конформациях B2R3122B21B,
цепи дипептида могут быть разделены на два
R2B3322B13B, B2B2322B11B и R2R3322B13B пред-
класса - свернутые (f) и развернутые (е) формы,
ставлено на рисунке.
которые названы шейпами. Все конформации
группируются по формам основной цепи, а фор-
Результаты расчета молекулы ACTH-(7-10)
мы - по шейпам. Для обозначения конформаци-
показывают, что происходит энергетическая
онных состояний остатков использованы иден-
дифференциация по конформациям и по
тификаторы типа Хij, где Х определяет низко-
формам основной цепи. В энергетический интер-
энергетические области конформационной
вал 0-10 кДж/моль попадают конформацци всех
карты ϕ-ψ: R(ϕ,ψ = -180° - 0°), B(ϕ = -180° - 0°,
возможных восьми шейпов. В этих конформаци-
ψ = 0° - 180°), L(ϕ,ψ = 0° - 180°), и P(ϕ = 0° - 180°,
ях вклады энергии невалентных взаимодействий
ψ = -180° - 0°), ij… = 11…, 12…, 13…, 21… опреде-
изменяются в энергетическом интервале
ляет положение боковой цепи (χ1,χ2…), причем
(-63.0)-(-73.9) кДж/моль, электростатических
взаимодействий - в энергетическом интервале
индекс 1 соответствует значению угла в пределах
11.3-18.1 кДж/моль, торсионных взаимодействий -
от 0 до 120°, индекс 2 - от 120° до (-120°) и
в энергетическом интервале 6.3-13.9 кДж/моль
индекс 3 - от -120° до 0°. Обозначения и отсчеты
углов вращения соответствуют номенклатуре
(табл. 1). Глобальной конформацией молекулы
IUPAC-IUB [12].
ACTH-(7-10) является B2R3122B21B (табл. 1). Та-
кая конформация одновременно выгодна по не-
валентным и электростатическим взаимодей-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ствиям. В этой структуре возникают эффектив-
Пространственная
структура
молекулы
ные взаимодействия Phe7 c Arg8, с Trp9 и Gly10,
ACTH-(7-10) - Phe7-Arg8-Trp9-Gly10 - исследо-
которые вносят вклад в общую энергию, равный
БИОФИЗИКА том 66
№ 4
2021
ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛЫ ACTH-(7-10)
631
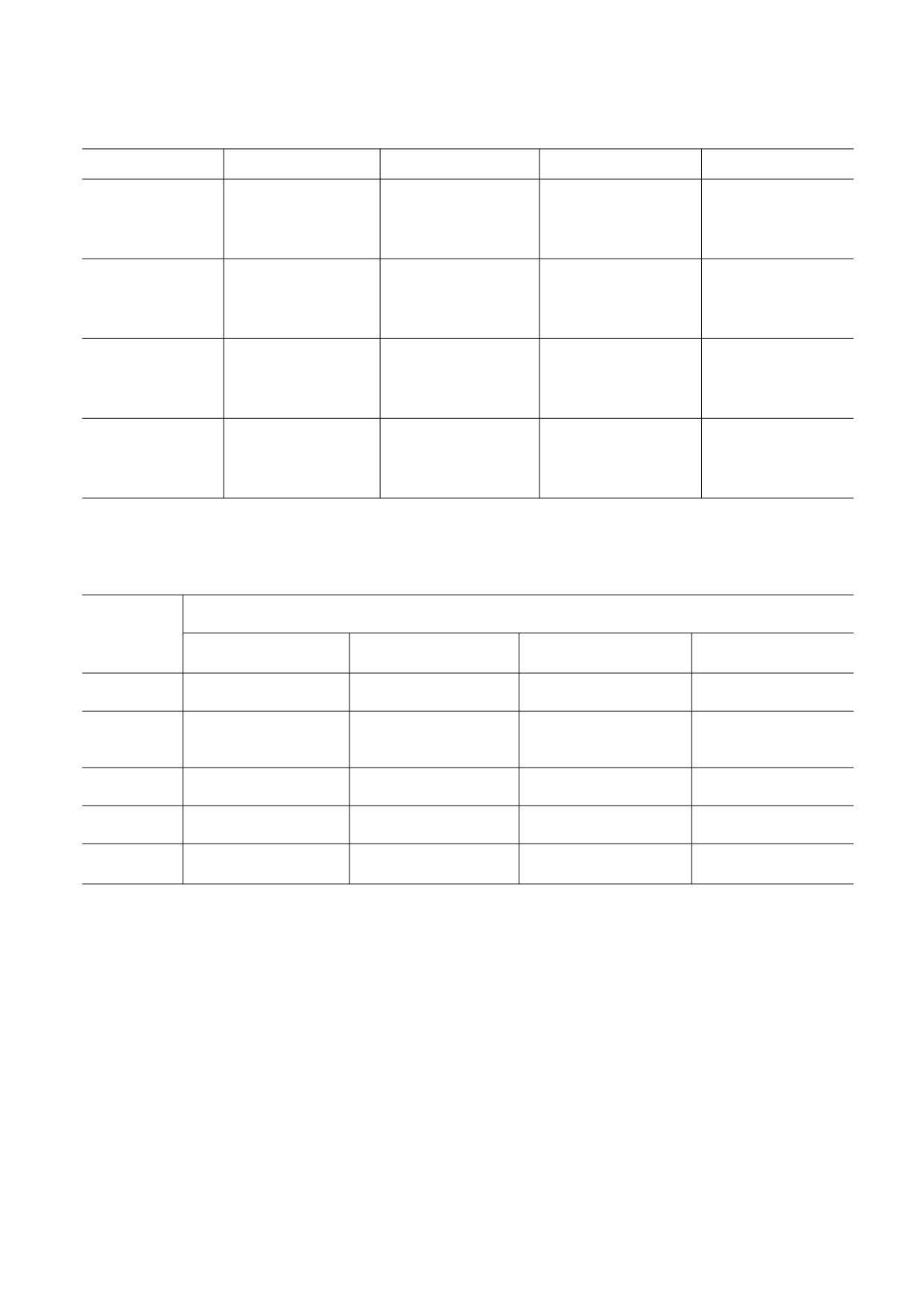
Таблица 2. Энергия внутри- и межостаточных взаимодействий (кДж/моль) для разных конформаций молекулы
ACTH-(7-10)
Phe7
Arg8
Trp9
Gly10
–0.4
-21.0
-12.2
-4.6
-1.7
-20.0
-11.8
0
Phe7
0
-11.8
-12.2
-0.4
-1.7
-18.5
-5.0
-1.3
2.1
-6.7
-2.1
0.4
-8.8
-2.1
Arg8
5.0
-17.6
-4.6
0
-10.9
-2.1
-2.1
-18.5
-3.8
-11.3
Trp9
-3.4
-10.1
-4.6
-11.8
5.5
5.5
Gly10
5.5
5.5
Примечание. Первая строка - конформация B11PRB11 (Uотн = 0 кДж/моль), вторая строка - B11BRB11 (Uотн = 15.5 кДж/моль),
третья строка - B11BLR11 (Uотн = 21.8 кДж/моль), четвертая строка - B11PLR11 (Uотн = 23.5 кДж/моль).
Таблица 3. Геометрические параметры оптимальных конформаций молекулы ACTH-(7-10)
Конформации
Остаток
B2R3122B21B
R2B33B13B
B2B2322B11B
R2R3322B13B
Phe7
-106 144 180 -179 88
-94 -44 177 -169 85
-113 149 -172 -177 83
-96 -46 178 -170 85
Arg8
-111 -68 -174 -69 81
-101 113 -179 -58
-113 134 177 178
-66
-99 -54 178 -56
171 -174
-63 -172 -178
179 -176
-62 -174 -178
Trp9
-158 149 -178 176 76
-157 152 -179 50 -86
-127 164 178 62 93
-147 150 -177 55 -87
Gly10
-85 112 180
-86 112 179
-76 112 180
-76 112 180
Uотн.
0
4.2
4.6
5.5
Примечание. Значения двугранных углов приведены в градусах и даны в последовательности φ, ψ, ω, χ1, χ2 …
-37.8 кДж/моль, Arg8
- c Trp9 и Gly10
шейпами не происходит, так как в последователь-
(-8.8 кДж/моль), Trp9 - c Gly10 (-18.8 кДж/моль)
ность молекулы входят аминокислотные остатки
(табл. 2). Конформация R2B3322B13B шейпа fee
с ароматическими и заряженными боковыми це-
пями и во всех шейпах возникают эффективные
имеет относительную энергию 4.2 кДж/моль. В
взаимодействия между атомами боковых и основ-
этой конформации взаимодействия Phe7 c Arg8, с
ных цепей (см. рисунок).
Trp9 и Gly10 вносят вклад в общую энергию, рав-
ный
-31.8 кДж/моль, Arg8 c Trp9 и Gly10
дают -10.9 кДж/моль, Trp9 c Gly10 - вклад
ВЫВОДЫ
‒11.3 кДж/моль (табл. 2). Как видно из табл. 1,
Теоретический конформационный анализ мо-
сильной энергетической дифференциации между лекулы ACTH-(7-10) показал, что пространствен-
БИОФИЗИКА том 66
№ 4
2021
632
АГАЕВА и др.
Пространственное расположение аминокислот в низкоэнергетических конформациях: (a) - B2R3122B21B, (б) -
R2B33B13B, (в) - B2B2322B11B, (г) - R2R3322B13B.
ная структура молекулы может быть представлена
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
восемью структурными типами, приводящими к
Настоящая работа не содержит описания ис-
таким структурным организациям молекулы, ко-
следований с использованием людей и животных
торые не исключают реализацию целого ряда са-
в качестве объектов.
мых разнообразных функций, требующих строго
специфических взаимодействий с различными
рецепторами.
СПИСОК ЛИТЕРАТУРЫ
1. П. Ашмарин, Р. А. Данилова и О. И. Рудько,
КОНФЛИКТ ИНТЕРЕСОВ
Биомедицина 6, 103 (2007).
Авторы заявляют об отсутствии конфликта
2. Н. Г. Левицкая и А. А. Каменский, Природа 1058
интересов.
(10), 24 (2003).
БИОФИЗИКА том 66
№ 4
2021
ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛЫ ACTH-(7-10)
633
3.
Е. А. Чеснокова, Н. Ю. Сарычева, В. А. Дубынин и
8. G. A. Akverdieva, N. A. Akhmedov, and N. M. God-
А. А. Каменский, Успехи физиол. наук 46 (1), 22
jayev, Fizika XXII (4), 6, (2017).
(2015).
9. E. M. Hasanov and N. A. Akhmedov, Int. J. Innovative
Sci. Res. Technol. 3 (3), 72 (2018).
4.
K. В. Шевченко, С. А. Дулов, Л. А. Андреева и др.,
Биоорган. химия 42 (2), 171 (2016).
10. N. A. Akhmedov, R. M. Abbasli, L. N. Agayeva, and L.
I. Ismailova, in Proc. Conf. “Modern Trends in Physics”
5.
Ш. Н. Гаджиева, Н. А. Ахмедов, Э. А. Масимов и
(2019), p. 201.
Н. М. Годжаев, Биофизика 58 (4), 587 (2013).
11. L. N. Agayeva, A. A. Abdinova, and N. F. Akhmedov,
in Proc. Conf. “Modern Trends in Physics” (2019),
6.
С. Р. Ахмедова, Л. Н. Агаева, Н. Ф. Ахмедов и
p. 157.
Н. А. Ахмедов, Sci. Pages (Чехия), 37 (2017).
12. IUPAC-IUB, Quantity, Units and Symbols in Physical
7.
Э. М. Гасанов, З. Г. Тагиев, Н. Ф Ахмедов и
Chemistry (Blackwell Scientific Publications, Oxford,
Н. А. Ахмедов, Актуальная наука, 12 (2017).
1988), V. 39.
Spatial Structure of the ACTH-(7-10) Molecule
L.N. Agayeva*, A.A. Abdinova**, S.R. Akhmedova***, and N.A. Akhmedov*
*Baku State University, ul. Z. Khalilova 23, Baku, AZ1148 Azerbaijan
**Azerbaijan State Pedagogical University, ul. Uzeyir Hajibeyli 68, Baku, AZ1148 Azerbaijan
***Azerbaijan Technical University, prosp. H. Javid 25, Baku, AZ1073 Azerbaijan
The spatial structure of the ACTH-(7-10)-PGP molecule - adrenocorticotropic hormone fragment 7-10 with
amino acid sequence Phe-Arg-Trp-Gly has been investigated using theoretical conformational analysis meth-
od. The potential function of the system is the sum of nonvalent, electrostatic and torsional interactions and
the energy of hydrogen bonds. The spatial structure of the Phe-Arg-Trp-Gly molecule was estimated based
on low-energy conformations of appropriate amino acid residues. It is shown that the spatial structure of tet-
rapeptide molecule can be represented by eight low-energy forms of the main chain. The low-energy confor-
mations of this molecule, the values of dihedral angles of the backbone and side chains of the amino acid res-
idues were found and energies of intra- and inter-residue interactions were evaluated.
Keywords: АСТН-(7-10), theoretical conformational analysis, spatial structure, conformation
БИОФИЗИКА том 66
№ 4
2021