БИОФИЗИКА, 2021, том 66, № 4, с. 634-640
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.32
АНТИТРОМБОЦИТАРНОЕ ДЕЙСТВИЕ И ХИМИЧЕСКАЯ АКТИВНОСТЬ
N6-ХЛОРАДЕНОЗИНФОСФАТА
© 2021 г. М.А. Мурина*, Д.И. Рощупкин*, **, В.И. Сергиенко*
*Федеральный научно-клинический центр физико-химической медицины ФМБА РФ,
Россия, 119435, Москва, ул. Малая Пироговская, 1а
**Российский национальный исследовательский медицинский университет им. Н.И. Пирогова МЗ РФ,
Россия, 117997, Москва, ул. Островитянова, 1а
E-mail: marina_murina@mail.ru
Поступила в редакцию 14.05.2021 г.
После доработки 14.05.2021 г.
Принята к публикации 17.05.2021 г.
Создана технология получения новых хлораминовых соединений, относящихся к производным
аденозина. Выяснены абсорбционные оптические характеристики N6-хлораденозин-5'-фосфата
(хлораминового производного АМФ). В частности, показано, что его спектр поглощения света за-
нимает диапазон длин волн 220-340 нм с максимумом и минимумом при 265 и 233 нм. Исследована
химическая модифицирующая способность N6-хлораденозинфосфата по отношению к биологиче-
ски значимым соединениям, имеющим сульфгидрильные (например, сывороточный альбумин)
или сульфидные (например, остатки метионина в фибриногене) функциональные группы. Количе-
ственным показателем этой способности служила константа скорости реакций. Спектрофотомет-
рическим методом зарегистрированы кинетические кривые убыли хлорамина АМФ после быстрого
смешивания с серосодержащими субстратами и затем рассчитаны константы скорости с использо-
ванием теоретического уравнения кинетики бимолекулярных реакций. N6-хлораденозинфосфат
очень быстро реагирует с тиольными соединениями; его константы скорости с сывороточным аль-
бумином, N-ацетилцистеином, восстановленным глутатионом и цистеином (pH 7.4) достигают со-
ответственно 24000, 58000, 240000, 1200000 М-1 с-1. Такое отличие в величинах констант обуслов-
лено в основном разницей в степени диссоциации сульфгидрильных групп. Константа скорости ре-
акции N6-хлораденозинфосфата с метионином составляет 1.40 ± 0.09 М-1с-1, с фибриногеном -
28.0 ± 1.6 М-1 с-1, с окисленным глутатионом - 0.230 ± 0.066 М-1 с-1. Таким образом, хлораминовое
производное АМФ характеризуется повышенной реакционной способностью по отношению к
сульфгидрильной группе. Установлено, что N6-хлораденозинфосфат эффективно угнетает АДФ-
индуцированную агрегацию изолированных тромбоцитов и тромбоцитов в составе обогащенной
тромбоцитами плазмы крови.
Ключевые слова: хлораминовое производное АМФ, спектрофотометрия, серосодержащие соединения,
константа скорости, тромбоцит, антиагрегант.
DOI: 10.31857/S0006302921040025
ной степени обусловлено ингибированием агре-
В крови в результате активации фагоцитирую-
гационной функции тромбоцитов. Это ингиби-
щих клеток их миелопероксидаза синтезирует
рование характеризуется избирательностью в
хлорноватистую кислоту (гипохлорит), а при ре-
сравнении с другими клетками крови [5]. Обсуж-
акции гипохлорита с аминогруппами образуются
даемые эффекты - результат ковалентной (хими-
хлораминовые производные белков, пептидов,
ческой) модификации сульфгидрильных и суль-
аминокислот и других соединений [1]. Некото-
фидных групп в молекулярных мишенях [6, 7].
рые специально синтезированные устойчивые
Активность созданных до сих пор хлораминовых
хлораминовые соединения, прежде всего N-хлор-
соединений как антиагрегантов, вероятно, опре-
таурин, N,N-дихлортаурин и их структурные ана-
деляется соотношением скорости их взаимодей-
логи, представляют биомедицинский интерес:
ствия с плазматической мембраной тромбоцитов
они оказывают выраженные противомикробный
и скорости побочных реакций, прежде всего, ре-
[2] и противотромботический [3, 4] эффекты.
акции с сывороточным альбумином.
Противотромботическое действие в значитель-
Можно полагать, что эффективность действия
Сокращениe: ОТП - обогащенная тромбоцитами плазма.
хлораминового антиагреганта резко увеличится,
634
АНТИТРОМБОЦИТАРНОЕ ДЕЙСТВИЕ И ХИМИЧЕСКАЯ АКТИВНОСТЬ
635
если он вначале специфически связывается с
изолированных тромбоцитов кровь кролика ста-
мембраной и уже в этом состоянии необратимо
билизировали раствором кислого цитрата натрия
модифицирует тромбоцит. В связи с этим пред-
(85 мМ трехзамещенного цитрата натрия, 71 мМ
положением мы обратились к аденозиновым со-
лимонной кислоты, 11 мМ D-глюкозы, pH 4.5) в
единениям. Известно, что тромбоциты имеют на
соотношении 5:1 по объему. После центрифуги-
внешней поверхности специфические рецепторы
рования к ОТП добавляли ЭДТА (1 мМ) и цен-
к аденозину, АMФ, АДФ, АТФ [8]. В некоторых
трифугировали 7 мин при 1850 g [10, 11]. Для даль-
работах приводятся данные о том, что при взаи-
нейшей работы осадок тромбоцитов ресуспенди-
модействии аденозинмонофосфата с гипохлори-
ровали в фосфатном буфере (10 мМ HEPES,
том образуется хлораминовое производное [9].
134 мМ NaCl, 5 мМ KCl, 1.0 мМ MgS04, 0.5 мМ
Однако его свойства и основные аспекты способа
Na2HPО4, 0.5 мМ D-глюкозы, рН 7.4) и хранили
получения не изучены.
при комнатной температуре.
Задачами настоящей работы было следующее:
Агрегацию тромбоцитов исследовали кинети-
(1) выяснение оптимальных условий получения
ческим турбидиметрическим методом Борна на
хлорамина АМФ в растворе и определение его оп-
анализаторе агрегации фирмы «Биола» (Россия).
тических абсорбционных характеристик; (2) ис-
В образцы клеток (в объеме 270 мкл) при интен-
следование химической модифицирующей спо-
сивном перемешивании вводили исследуемое со-
собности по отношению к биологически значи-
единение (30 мкл), смесь инкубировали 3 мин
мым соединениям, имеющим сульфгидрильные
при комнатной температуре. Перед введением
(альбумин, восстановленный глутатион, цистеин
агониста в образец изолированных тромбоцитов
и др.) или сульфидные (свободный метионин и
добавляли аутологичную плазму крови в объем-
остатки метионина в фибриногене) функцио-
ной конечной концентрации 2% и хлорид каль-
нальные группы, и оценка антиагрегантной эф-
ция (0.2 мМ). Путем добавления агониста АДФ
фективности. Работа преследовала цель выяснить
(10 мкМ) запускали процесс агрегации тромбоци-
возможность создания хлораминового ингибито-
тов, приводящий к постепенному увеличению
ра тромбоцитов повышенной эффективности,
светопропускания образца. Известно, что макси-
обусловленной первичным связыванием с клет-
мальное увеличение светопропускания характе-
ками.
ризует приближенно количество клеток, вошед-
ших в состав агрегатов. Агрегационную способ-
ность тромбоцитов оценивали следующими
МАТЕРИАЛЫ И МЕТОДЫ
турбидиметрическими количественными показа-
Использовали коммерческие препараты
телями. Один из них - отношение максимально-
АМФ, восстановленного и окисленного глутати-
го изменения светопропускания в опытных об-
она, цистеина, N-ацетилцистеина, метионина,
разцах к изменению в контроле, этот показатель
бычьего сывороточного альбумина, фибриноге-
именуют относительной максимальной степенью
на, HEPES, неорганических солей и гипохлорита
агрегации. Второй показатель - размерный угло-
натрия (все реактивы - фирмы Sigma-Aldrich,
вой коэффициент кривой светопропускания на
США). В опытах соединения растворяли в 50 мМ
начальном отрезке его увеличения, этот показа-
фосфатном буферном растворе, содержащем гид-
тель называют начальной скоростью агрегации.
рофосфат и дигидрофосфат натрия, значения рН
Данные измерения спектров поглощения, ки-
которого доводили до 7.4 или 5.4.
нетических кривых абсорбции обрабатывали с
Спектры поглощения исследуемых соедине-
помощью программы Microsoft Ехсel. В этой же
ний и кинетические кривые изменения величины
программе проводили статистическую обработку
абсорбции в ходе реакций хлорамина АМФ с
данных, результаты представлены в виде средних
тиольными и сульфидными соединениями реги-
значений со стандартными отклонениями.
стрировали на спектрофотометре Cary 50 Bio UV-
Visible фирмы Varian (Австралия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Эксперименты по изучению антиагрегацион-
ного действия исследуемых соединений проведе-
Способ получения N6-хлораденозинфосфата в
ны на изолированных тромбоцитах и тромбоци-
растворе. Хлораминовые производные биологи-
тах в составе обогащенной тромбоцитами плазмы
чески значимых соединений чаще всего получают
(ОТП) крови, которую получали из краевой вены
в реакции с гипохлоритом натрия [11] или при
уха кролика.
взаимодействии с трет-бутилгипохлоритом [12].
Кровь стабилизировали
3.8%-м раствором
Активный хлор этих соединений с высокими
трехзамещенного цитрата натрия в соотношении
константами скорости замещает атом водорода в
9:1 по объему и центрифугировали 15 мин при
свободной
функциональной аминогруппе
460 g. Супернатант, представляющий собой ОТП,
(R1-NH2) или замещенной группе (R1-NH-R2).
хранили не более 3 ч. Для получения суспензии
В случае трет-бутилгипохлорита в реакционной
БИОФИЗИКА том 66
№ 4
2021
636
МУРИНА и др.
ции N6-хлораденозинфосфата с иодидом калия.
Поглощение света при указанной длине волны
непосредственно обусловлено анионом трийоди-
да (J3)- [14].
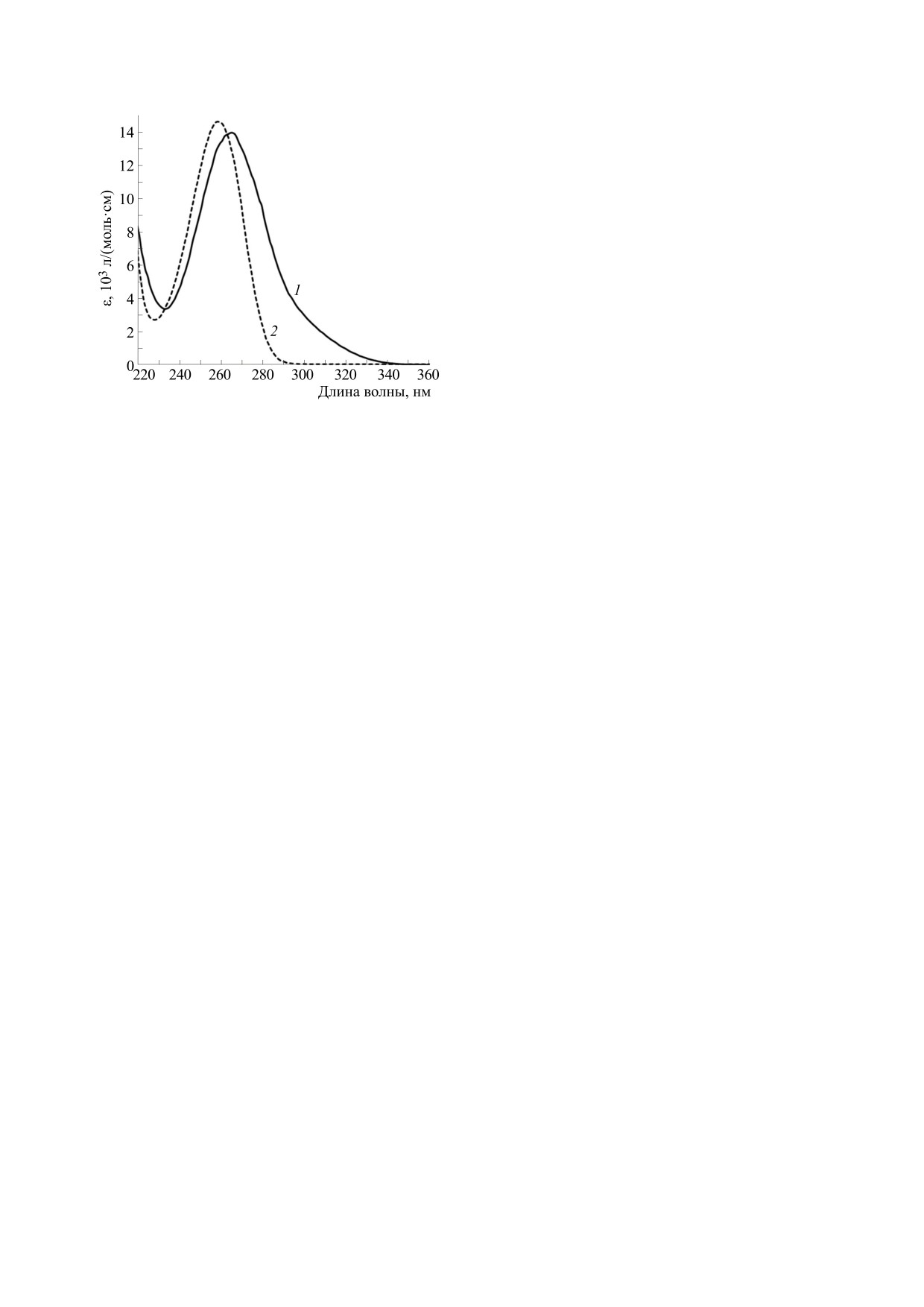
Оптический абсорбционный спектр хлорами-
на АМФ получали как разницу величин абсорб-
ции конечной смеси и абсорбции остаточного
АМФ. Спектры хлорамина АМФ и самого АМФ в
ультрафиолетовой области длин волн сильно раз-
личаются. Спектр N6-хлораденозинфосфата
сдвинут в длинноволновую область, его макси-
мум приходится на 265 нм, а минимум - на
233 нм. Кроме того, для абсорбционного спектра
хлорамина АМФ характерен «затянутый» длин-
новолновый спад (рис. 1). Важно, что на этом
спаде молярные коэффициенты поглощения до-
стигают больших значений в диапазоне длин
Рис. 1. Спектры поглощения N6-хлораденозинмоно-
волн 290-315 нм. Здесь поглощение ультрафио-
фосфата (1) и АМФ (2); ε - молярный коэффициент
летового света аминокислотами, пептидами и
поглощения.
белками слабое. Поэтому, измеряя абсорбцию в
этом диапазоне длин волн, исследовали кинети-
системе образуется продукт терт-бутанол [12]. Во
ческие превращения N6-хлораденозинфосфата в
избежание процедуры очистки от этого продукта
присутствии исследуемых серосодержащих со-
в качестве источника активного хлора мы исполь-
единений.
зовали гипохлорит натрия.
Химическая активность N6-хлораденозинфос-
Известно, что атом хлора способен присоеди-
фата по отношению к серосодержащим соединени-
няться, кроме аминогруппы, к атому углерода в
ям. Важнейшая количественная характеристика
положении 8 пуриновой части АМФ [13]. Проте-
активности N6-хлораденозинфосфата как хими-
ческого модификатора - константа скорости со-
кание такой побочной реакции мы наблюдали в
опытах при использовании АМФ и соответствен-
ответствующей реакции. В работе спектрофото-
но гипохлорита натрия в высоких концентраци-
метрическим методом измеряли кинетические
ях. Также было установлено, что выход синтеза
кривые реакций после быстрого смешивания ре-
агирующих соединений. Метод позволял реги-
хлорамина АМФ существенно зависит от pH ре-
стрировать в течение порядка десяти секунд ко-
акционной смеси. В итоге была разработана сле-
дующая процедура синтеза N6-хлораденозин-
личество оставшихся исходных соединений. В
целом процедура определения констант скоро-
фосфата. АМФ растворяли в бидистиллирован-
стей состояла в следующем. В кювете (толщиной
ной воде и доводили рН раствора до 4.3. К 5 мл
1 см) спектрофотометра быстро смешивали рав-
раствора АМФ в концентрации 3 мМ добавляли
ные объемы растворов исследуемых соединений
по каплям равный объем водного раствора гипо-
и после этого измеряли зависимость величины
хлорита натрия. Смесь непрерывно энергично
абсорбции хлорамина от времени. Измерения по-
перемешивали на магнитной мешалке. Конечная
вторяли не менее пяти раз с изменением началь-
молярная концентрация гипохлорита была на 3-
ной концентрации реагирующих соединений.
5% меньше концентрации АМФ. Поэтому в ко-
Длины волн также изменяли с расчетом зареги-
нечном образце присутствовал небольшой оста-
стрировать убыль хлорамина в области мини-
ток АМФ. При этом свободный (непрореагиро-
мального поглощения исследуемых серосодержа-
вавший) гипохлорит отсутствовал. Это следует из
щих соединений, как это показано в качестве
того, что при добавлении в образец N6-хлораде-
примера для реакции N6-хлораденозинфосфата с
нозинфосфата иодида калия реакция его окисле-
сывороточным альбумином (рис. 2) и восстанов-
ния происходила медленно (при рН 7.4 константа
ленным глутатионом (рис. 3).
скорости реакции составляла 4.6 ± 0.48 М-1 с-1),
в отличие от реакции с гипохлоритом натрия. Вы-
Отсчеты величин абсорбции проводили через
ход N6-хлораденозинфосфата, определяемый по
0.0125 с, а в случае медленных процессов - через
концентрации активного хлора, составлял 98-
1 с. Константу скорости находили путем сравне-
99%. Анализ активного хлора проводили йодо-
ния экспериментальной кинетической кривой
метрическим методом с применением спектро-
убыли абсорбции с расчетной кривой. Уравнение
фотомерии. Регистрируя абсорбцию при 352 нм,
расчетной кривой убыли хлораминов в своей ос-
определяли молекулярный йод - продукт реак-
нове представляет собой кинетическое уравнение
БИОФИЗИКА том 66
№ 4
2021
АНТИТРОМБОЦИТАРНОЕ ДЕЙСТВИЕ И ХИМИЧЕСКАЯ АКТИВНОСТЬ
637
Рис. 2. Экспериментальная (1) и расчетная (пунктир-
Рис. 3. Кинетические кривые абсорбции (A285) смеси
ная линия 2) кинетические кривые абсорбции (A310)
N6-хлораденозинмонофосфата (37 мкМ) с восста-
смеси N6-хлораденозинмонофосфата (14 мкМ) с бы-
новленным глутатионом (87 мкМ) в фосфатном бу-
чьим сывороточным альбумином (34 мкМ) в фосфат-
фере при рН 7.4 (1) и рН 5.4 (2).
ном буфере, рН 7.4.
Реакция между N6-хлораденозинфосфатом и
бимолекулярной реакции второго порядка, в ко-
большинством изучаемых тиолов протекает с вы-
торое введена величина абсорбции (A).
сокой скоростью, так что измерить кинетику его
превращения при физиологических значениях
A = A0 -A0 (exp(k(Ca - Cs)t) - 1)/
pH не удавалось. Однако она резко замедляется в
((Ca/Cs) exp(k(Ca - Cs)t) - 1).
кислой среде (рис. 3). Известно, что взаимодей-
ствие хлораминовых соединений непосредствен-
В этом уравнении A0 и A - абсорбция в началь-
но происходит с анионом сульфгидрильной груп-
ный момент (первый отсчет по окончании сме-
пы тиолов (R-S-) [15, 16]. Поэтому вначале экс-
шивания) и в данное время t; k -константа скоро-
периментально измеряли константу скорости в
сти реакции; Ca и Cs - концентрации хлорамина и
кислой среде (pH 5.4) и затем ее умножали на от-
серосодержащего соединения в начальный мо-
ношение концентрации формы R-S- при pH 7.4
мент.
к ее концентрации в кислой среде. Расчет этого
Концентрации Ca и Cs вследствие протекания
отношения проводили на основе уравнения Ген-
взаимодействия в период смешивания несколько
дерсона-Хассельбаха и литературных данных о
меньше тех, которые были до смешивания. Вели-
pKa сульфгидрильных групп [17, 18]. Полученные
чину Ca находили по значениям молярного коэф-
данные приведены в таблице. Интересно, что при
фициента поглощения и измеряемой величины
значении pH 7.4 константа скорости реакции N6-
A0 в начальный момент. Значение Cs - разность
хлораденозинфосфата с цистеином по сравнению
с восстановленным глутатионом, N-ацетилци-
концентрации до смешивания и величины, на ко-
стеином и сывороточным альбумином выше со-
торую она уменьшается в период смешивания.
ответственно в 5, 24 и 50 раз (таблица). Такое
Благодаря описанной процедуре и использова-
нию исходно низких концентраций удавалось
отличие в величинах констант обусловлено в ос-
определять сравнительно высокие константы
новном разницей в степени диссоциации сульф-
гидрильной группы этих соединений.
скорости.
Процедура нахождения реальной константы
При изучении реакций с метионином, остат-
включала расчет семейства зависимостей абсорб-
ками метионина в фибриногене, дисульфидным
ции от времени при разных значениях k. Искомой
мостиком в окисленном глутатионе константу
константой скорости считали то значение, при
скорости находили по начальной скорости убыли
котором расчетная зависимость была близка к
N6-хлораденозинфосфата. Начальный участок
экспериментальной; отличие составляло не более
снижения абсорбции (в пределах не более 5%)
нескольких процентов (рис. 2, кривая 2).
имеет линейную зависимость от времени. Угло-
БИОФИЗИКА том 66
№ 4
2021
638
МУРИНА и др.
Константы скорости реакции N6-хлораденозинмонофосфата с тиольными соединениями
Константа скорости реакции второго порядка (М-1 с-1)
N-Ацетилцистеин
Глутатион
Цистеин
*Сывороточный альбумин быка
восстановленный
(5.80 ± 0.66) ×104
(2.40 ± 0.19) ×105
(1.20 ± 0.23) ×106
(2.04 ± 0.52) ×104
Примечание. Константы получены для значения рН 7.4 (с использованием pKa тиолов, см. текст). При пересчете
использованы значения pKa тиолов (в порядке слева направо): 9.52 [17], 8.66 [18], 8.33 [17]. * - Измерения проведены в
фосфатном буфере, рН 7.4.
вой коэффициент этой зависимости равен kεCaCs.
риальное тромбообразование начинается с акти-
Отсюда, зная исходные концентрации хлорамина
вации тромбоцитов, которая в большинстве слу-
(Ca), субстрата (Cs) и молярный коэффициент по-
чаев заключается во взаимодействии молекул
коллагена поврежденной атеросклеротической
глощения (ε), получали значение константы ско-
бляшки со специфическими рецепторами. В
рости.
дальнейшем процесс активации усиливается за
Установлено, что N6-хлораденозинфосфат
счет агониста АДФ, действующего на поверх-
модифицирует дисульфид- и сульфидсодержа-
ностные пуриновые рецепторы P2Y1 и Р2Y12
щие соединения гораздо медленнее, чем тиоль-
тромбоцита. Пуриновые рецепторы - перспек-
ные. Константа скорости реакции с окисленным
тивные мишени при разработке новых антитром-
глутатионом, метионином и фибриногеном со-
ботических препаратов, блокирующих их актив-
ставляет соответственно 0.23 ± 0.066, 1.4 ± 0.09 и
ность. Мы исследовали антиагрегантное действие
27.7 ± 1.60 М-1с-1. Таким образом, хлораминовое
на тромбоциты N6-хлораденозинфосфата в срав-
производное АМФ характеризуется повышенной
нении с АМФ. В работе других авторов [19] пока-
реакционной способностью по отношению к
зано, что АМФ сам по себе (без активного хлора)
сульфгидрильной группе в биологически значи-
в высоких концентрациях (0.1-3.0 мМ) за счет ак-
мых серосодержащих соединениях.
тивации аденозинового рецептора A2a ингибиру-
Антиагрегантное действие на тромбоциты N6-
ет аллостерически функции тромбоцитов челове-
хлораденозинфосфата. Известно, что внутриарте-
ка, в том числе агрегацию. На модели тромбоза у
животных также показано, что АМФ ингибирует
образование тромбов in vivo. В наших экспери-
ментах N6-хлораденозинфосфат в сравнительно
низкой концентрации, начиная с 50 мкМ, значи-
тельно ослабляет агрегацию тромбоцитов в ОТП:
уменьшаются начальная скорость агрегации и
максимальная степень агрегации. На рис. 4 пред-
ставлены типичные кинетические кривые АДФ-
индуцированной агрегации тромбоцитов в ОТП в
контроле (кривая 1) и после введения АМФ и его
N-хлорпроизводного (кривые 2 и 3).
Мы сравнили эффективность влияния на
тромбоциты N6-хлораденозинфосфата и АМФ,
во-первых, измеряя уменьшение начальной ско-
рости агрегации. N6-Хлораденозинфосфат в кон-
центрациях 50, 150 и 250 мкМ снижал начальную
скорость с 35.0 ± 3.1 с-1 (в контроле) соответ-
ственно до 30.0 ± 1.5, 22.0 ± 3.6 и 18.0 ± 0.2 с-1. В
случае действия АМФ начальная скорость при
указанных концентрациях составляла соответ-
Рис. 4. Типичные кинетические кривые агрегации
ственно 35.0 ± 3.1, 27.0 ± 3.2, 24.0 ± 1.5 с-1. Вся со-
тромбоцитов в составе обогащенной тромбоцитами
вокупность данных свидетельствует, что хлора-
плазмы в контроле (1), при действии 100 мкм АМФ
миновое производное АМФ определенно прояв-
(2) и N6-хлораденозинмонофосфата (3). Стрелкой
указан момент введения агониста АДФ (10 мкм).
ляет более высокую ингибирующую способность
БИОФИЗИКА том 66
№ 4
2021
АНТИТРОМБОЦИТАРНОЕ ДЕЙСТВИЕ И ХИМИЧЕСКАЯ АКТИВНОСТЬ
639
(р < 0.009, парный двух выборочного t-теста для
Таким образом, разработана технология полу-
средних значений).
чения устойчивого хлораминового производного
АМФ, выяснены его оптические характеристики.
Во-вторых, мы определяли ингибирование
Установлено, что спектр поглощения N6-хлора-
максимальной агрегации тромбоцитов, индуци-
денозинфосфата сдвинут на 5 нм в длинноволно-
рованной АДФ. Под действием N6-хлораденоз-
вую область по сравнению с исходным соедине-
инфосфата в концентрации 50, 100, 150 и 300 мкМ
нием - АМФ. Определены молярные коэффици-
степень агрегации снижалась соответственно на
енты поглощения N6-хлораденозинфосфата при
25 ± 6, 48 ± 7, 51 ± 14 и 70 ± 8% от контроля; кон-
длинах волн 285, 290, 300 и 310 нм, которые соста-
центрация полумаксимального снижения степе-
вили соответственно 6889 ± 155, 5228 ± 211,
ни агрегации (IC50) составляла приблизительно
3185 ± 107 и 2020 ± 86 М-1см-1.
100 мкМ. АМФ в такой концентрации (100 мкМ)
Исследована химическая модифицирующая
вызывал снижение агрегации тромбоцитов лишь
способность N6-хлораденозинфосфата по отно-
на 25-30%, а величина IC50, согласно концентра-
шению к серосодержащим соединениям. Благо-
ционным зависимостям (данные не приведены),
даря методическому приему, который предусмат-
достигает приблизительно 300 мкМ. Этот резуль-
ривает первоначальное определение константы
тат хорошо согласуется с литературными данны-
скорости реакции в кислой среде и последующий
ми о действии АМФ на тромбоциты человека: ве-
пересчет для физиологического значения рН,
личина IC50 для АДФ-индуцированной агрегации
определены высокие константы скорости реак-
составляет 280 мкМ [19].
ции с сульфгидрильными группами ряда соеди-
нений. Способность N6-хлораденозинфосфата
Интересно, что N6-хлораденозинфосфат го-
модифицировать тиольные соединения варьиру-
раздо сильнее ингибирует тромбоциты в изоли-
ет в широких пределах: разница в величинах кон-
рованном состоянии (суспензия клеток в физио-
стант скоростей окисления сульфгидрильной
логическом растворе), чем в составе ОТП. Сте-
группы (цистеина, восстановленного глутатиона,
пень агрегации изолированных тромбоцитов в
N-ацетилцистеина) составляет более одного по-
присутствии N6-хлораденозинфосфата в концен-
рядка. Определена, в частности, константа ско-
трации 5, 10 и 25 мкМ снижалась соответственно
рости N6-хлораденозинфосфата с сульфгидриль-
на 22 ± 12, 55 ± 9 и 95.0 ± 0.1%. Таким образом, в
ной группой глутатиона, которая составляет
случае изолированных тромбоцитов концентра-
240000 М-1 с-1. Такая высокая константа может
ция полумаксимального ингибирования агрега-
ции составила приблизительно 10 мкМ. АМФ в
обеспечить эффективную модификацию рецеп-
диапазоне концентраций 10-50 мкМ не оказывал
тора в тромбоцитах, содержащего доступный сво-
бодный остаток цистеина.
антиагрегационного действия на тромбоциты.
Сильное различие действующих концентраций
Установлено, что N6-хлораденозинфосфат
N6-хлораденозинфосфата в составе ОТП и
сильно ослабляет АДФ-индуцированную агрега-
суспензии изолированных тромбоцитов, скорее
цию изолированных тромбоцитов и тромбоцитов
всего, обусловлено протеканием в ОТП дополни-
в составе ОТП. Можно полагать, что это обуслов-
тельной реакции хлорамина АМФ с сыворо-
лено не только связыванием и активацией адено-
точным альбумином, конкурирующей с взаимо-
зинового рецептора A2A, как это характерно для
действием с тромбоцитами.
АМФ, но и дополнительной химической моди-
фикацией его серосодержащих групп.
Для объяснения усиленного ингибирующего
действия N6-хлораденозинфосфата на агрегацию
тромбоцитов по сравнению с АМФ важны сведе-
ФИНАНСИРОВАНИЕ РАБОТЫ
ния о структурных особенностях аденозинового
Исследование выполнено при финансовой
рецептора А2а. Согласно данным рентгенострук-
поддержке Российского фонда фундаментальных
турного анализа [20], в этом рецепторе вблизи ме-
исследований (проект № 20-04-00532).
ста связывания агониста имеется сульфгидриль-
ная группа. Можно предполагать, что N6-хлора-
денозинфосфат не только связывается с
КОНФЛИКТ ИНТЕРЕСОВ
аденозиновым рецептором подобно АМФ, но и
Авторы заявляют об отсутствии конфликта
при этом ковалентно (химически) модифицирует
интересов.
его сульфгидрильную группу; в результате проис-
ходит структурная перестройка рецептора, стаби-
лизирующая его в определенной конфигурации
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
активного состояния. Все это обеспечивает уси-
Все применимые международные, националь-
ленное аллостерическое подавление экспрессии
ные и институциональные принципы ухода и ис-
рецептора АДФ P2Y1.
пользования животных при выполнении работы
БИОФИЗИКА том 66
№ 4
2021
640
МУРИНА и др.
были соблюдены. Исследование было одобрено
10. T. K. Bills, J. B. Smith, and M. J. Silver, J. Clin. Invest.
локальным этическим комитетом РНИМУ
60, 1 (1977).
им. Н.И. Пирогова Минздрава России.
11. M. A. Murina, E. L. Savel’eva, and D. I. Roshchupkin,
Biophysics 51 (2), 258 (2006).
СПИСОК ЛИТЕРАТУРЫ
12. С. Pastoriza, J. M. Antelo, and J. Crugeiras, J. Phys.
Org. Chem. 27, 952 (2014).
1. C. C. Winterbourn, A. J. Kettle, and M. B. Hampton,
Annu. Rev. Biochem. 85, 765 (2016).
13. M. Ikehara, Y. Ogiso, and N. Maruyma, Chem.
2. M. Gruber, I. Moser, M. Nagl, et al., Antimicrob.
Pharm. Bull. 25, 575 (1977).
Agents Chemother. 61, e02527-16 (2017).
14. P. Calvo, J. Crugerias, A. Rios, et al., J. Org. Chem.72,
3. M. A. Murina, D. I. Roshchupkin, N. N. Kravchenko,
3171 (2007).
et al., Biophysics 42, 1311 (1997).
15. M.-H. Chau and J. W. Nelson, FEBS Lett. 291, 296
4. T. W. Stief., U. Feek, and A. Ramaswamy, Thromb.
(1991).
Res. 104, 361 (2001).
16. D. I. Roshchupkin, V. L. Sorokin, G. N. Semenkova,
5. Д. И. Рощупкин, М. А. Мурина, Н. Н. Кравченко и
et al., Biophysics 64, 145 (2019).
др., Биофизика 52 (3), 527 (2007).
17. A. Altomare, G. Baron, and M. Brioschi, Antioxidants
6. A. V. Peskin and C. C. Winterbourn, Free Radic. Biol.
(Basel) 9, 367 (2020).
Med. 30, 572 (2001).
18. Y. Samunia, S. Goldstein, and O. M. Dean, Biochim.
7. D. I. Roshchupkin, K. V. Kondrashova, and M. A. Mu-
Biophys. Acta 1830, 4117 (2013).
rina, Biophysics 59, 849 (2014).
8. P. Schmidt, L Ritscher, E. N. Dong, et al., Mol. Phar-
19. E. Fuentes, L. Badimon, and J. Caballero, Thromb.
macol. 83, 256 (2013).
Haemost. 111, 491 (2014).
9. W. A. Prutz, Arch. Biochem. Biophys. 332 (1), 110
20. G. Lebon, T. Warne, P. C. Edwards, et al., Nature 474,
(1996).
521 (2011).
Antiplatelet Effect and Chemical Nature of N6-Chloroadenosine Phosphate
M.A. Murina*, D.I. Roshchupkin*, **, and V.I. Sergienko*
*Federal Research and Clinical Centre of Physical-Chemical Medicine, Federal Medical Biological Agency of the Russian
Federation, Malaya Pirogovskaya ul. 1a, Moscow, 119435 Russia
** Pirogov Russian National Research Medical University, Ministry of Health of the Russian Federation,
ul. Ostrovityanova 1a, Moscow, 117997 Russia
A technology has been developed for the preparation of novel chloramine compounds related to adenosine
derivatives. Optical absorption characteristics of N6-chloroadenosine-5'-phosphate (chloramine derivative
of AMP) have been elucidated. In particular, it was shown that this compound absorbs light with wavelengths
covering a range from 220 to 340 nm, the absorption maximum wavelength is 265 nm and the minimum ab-
sorption is at 233 nm. The ability of N6-chloroadenosine phosphate to modify biologically significant com-
pounds that contain the sulfhydryl (serum albumin) or sulfide (methionine residues in fibrinogen) functional
groups has been studied. The quantitative indicator of this ability was the reaction rate constant. Spectropho-
tometer was used for recording the kinetic curve data on chloramine consumption after rapid mixing with sul-
fur-containing substrates and the rate constants were then calculated using a theoretical kinetic equation for
bimolecular reactions. N6-chloroadenosine phosphate reacts very rapidly with thiol compounds; rate con-
stants for the reactions of N6-chloroadenosine phosphate with serum albumin, N-acetylcysteine, reduced
glutathione, cysteine (pH 7.4) reach 24000, 58000, 240000, 1200000 M-1 s-1, respectively. The difference in
the rate constant values is mainly due to the difference in the degree of dissociation of sulfhydryl groups. The
rate constants for the reactions of N6-chloroadenosine phosphate with methionine, fibrinogen, and oxidized
glutathione are 1.4 ± 0.09 M-1 s-1, 28 ± 1.6 M-1 s-1, and 0.230 ± 0.066 M-1 s-1, respectively. Thus, the chlo-
ramine derivative of АMP is characterized by increased reactivity towards the sulfhydryl group. It was found
that N6-chloroadenosine phosphate effectively inhibits АDP-induced aggregation of isolated platelets and
platelets in platelet-rich blood plasma.
Keywords: chloramine derivative of АМP, spectrophotometry, sulfur-containing compounds, rate constant, plate-
let, antiplatelet agent
БИОФИЗИКА том 66
№ 4
2021