БИОФИЗИКА, 2021, том 66, № 4, с. 641-650
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 575.224
РОЛЬ ГЕНОВ Hsp70 В КОНТРОЛЕ ЖИЗНЕСПОСОБНОСТИ Drosophila
melanogaster ПРИ ДЕЙСТВИИ МИКРОВОЛНОВОГО ИЗЛУЧЕНИЯ
© 2021 г. О.В. Горенская*, А.Б. Гаврилов*, О.Г. Зацепина**,
*, М.Б. Евгеньев**, ***
Ю.Г. Шкорбатов
*Харьковский национальный университет имени В.Н. Каразина, 61022, Харьков, пл. Свободы, 4, Украина
**Институт молекулярной биологии им. В.А. Энгельгардта РАН, 119991, Москва, ул. Вавилова, 32
***Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр
биологических исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
E-mail: misha672011@yahoo.com
Поступила в редакцию 08.04.2021 г.
После доработки 28.04.2021 г.
Принята к публикации 29.04.2021 г.
Биологические эффекты действия низкоэнергетического электромагнитного излучения часто
объясняют индукцией транскрипции генов белков теплового шока. В данном исследовании
изучили проявление комплекса адаптивно важных признаков у линий Drosophila melanogaster с
различным числом копий генов Hsp70 при действии микроволнового облучения. В экспериментах
использовались мутантные линии с делецией всех или нескольких копий Hsp70 и, в качестве
контроля, взяли линию дикого типа Canton-S, содержащую в геноме полный набор генов Hsp70. Для
облучения имаго использовали электромагнитное излучение крайне высокой частоты (мощность
10 мкВт/см2, частота 37.7 и 65.0 ГГц, длительность воздействия 5 мин). Результаты экспериментов
показали, что у линии дикого типа Canton-S с полным набором генов белков теплового шока при
действии микроволнового облучения не изменяется количество потомков на стадии куколки и
имаго, но повышается эмбриональная смертность и увеличивается медианная продолжительность
жизни. У линий с отсутствием всех копий или присутствием одной копии гена Hsp70 изменения
показателей жизнеспособности имели в основном негативный характер. В этих линиях внешнее
воздействие привело к снижению количества потомков на стадии имаго, к увеличению числа
погибших особей на стадиях куколки и раннего онтогенеза, снижению медианной и максимальной
продолжительности жизни имаго. Интересные разнонаправленные результаты при действии
микроволнового облучения наблюдали у линии, содержащей четыре копии Hsp70. В данной линии
особи демонстрируют половой диморфизм в реакции на действие внешнего воздействия: снижение
медианной и максимальной продолжительности жизни имаго самок и увеличение этих показателей
у самцов. Результаты работы показали важность наличия полного набора генов Hsp70 в геноме для
адаптации организмов к действию микроволнового облучения.
Ключевые слова: электромагнитное излучение, дрозофила, жизнеспособность, эмбриональная
смертность, длительность жизни.
DOI: 10.31857/S0006302921040037
В серии работ М. Бланка, Р. Гудман и соавто-
Электромагнитное излучение (ЭМИ) как но-
ров в экспериментах на культуре клеток человека
вый антропогенный фактор окружающей среды
показана индукция транскрипции Hsp70 в ответ
способно вызвать многообразие генетических
на действие низкоинтенсивного ЭМИ (8 мкТл,
эффектов, модифицируя адаптационные способ-
60 Гц) [1]. Кроме того, такая обработка приводи-
ности организмов. Важную роль в формировании
ла к временной активации фактора транскрип-
устойчивости к действию неблагоприятных фак-
ции 1 генов белков теплового шока (HSF-1) [2]. В
торов окружающей среды играют белки теплово-
культуре клеток человека, подвергшихся воздей-
го шока Hsp70. На сегодня неизученным остается
ствию ЭМИ в течение 3 ч (8 мкТл, 60 Гц), уровни
вопрос о их роли в формировании приспособлен-
Hsp70 увеличивались после 20 мин воздействия и
ности при действии низкоинтенсивного ЭМИ.
постепенно снижались, возвращаясь к контроль-
ным значениям, через 2 ч [3]. Воздействие ЭМИ
(8 мкТл, 60 Гц, экспозиция 20 мин) индуцировало
Сокращениe: ЭМИ - электромагнитное излучение.
641
642
ГОРЕНСКАЯ и др.
активацию и связывание с ДНК факторов тран-
Цель настоящей работы - изучить некоторые
скрипции Hsp70, таких как HIF, AP-1 и SP-1 [4].
компоненты приспособленности линий D. melan-
Полученные результаты позволили авторам вы-
ogaster, содержащих разное количество генов
двинуть концепцию специфически чувствитель-
Hsp70, при действии микроволнового облучения.
ного к электромагнитному полю домена, распо-
ложенного в промоторе Hsp70 [5, 6].
МАТЕРИАЛЫ И МЕТОДЫ
Получено много достаточно противоречивых
результатов при изучении регуляции активности
В работе использовали мутантные линии Dro-
Hsp70 различными по интенсивности электро-
sophila melanogaster, содержащие разное количе-
магнитными воздействиями на модельных объек-
ство копий Hsp70: 8841 (Hsp70-null), 8842, 1♀41♂.
тах. Так, показано, что реакция культуры клеток
У особей линии 8841 отсутствуют оба локуса, со-
на магнитное поле и микроволны обусловлена
держащими копии Hsp70 (87A и 87B). У особей
активацией гена Hsp70 [7-9]. Но изменение тран-
линии 8842 удален локус 87А, но присутствует
скрипции гена Hsp70 в клетках, подвергнутых
87B, содержащий четыре копии Hsp70
[14].
воздействию электромагнитных полей, не заре-
Трансгенная линия 1♀41♂ получена из линии
гистрировано. В работе [10] было продемонстри-
8841 с помощью метода Р-опосредованной транс-
ровано, что, хотя ЭМИ не влияет на транскрип-
формации в лаборатории М. Евгеньева [17] и со-
цию Hsp70, оно может значительно увеличивать
держит одну копию Hsp70. В качестве контроля
конститутивный уровень белка Hsp70, вероятно,
использовали линию дикого типа Canton-S, по-
за счет повышения его стабильности. С другой
скольку, как показано в работе [18], в геноме мух
стороны, синусоидальное магнитное поле с ча-
дикого типа присутствуют шесть почти идентич-
стотой 50 Гц увеличивает уровень мРНК Hsp70 в
ных копий генов, которые кодируют Hsp70.
эндотелиальных клетках аорты свиней, но не
Мух выращивали на стандартной сахарно-
влияет на количество белка Hsp70 [11].
дрожжевой среде при температуре 23.0 ± 0.5°С. В
Влияние ЭМИ на экспрессию Hsp70, показан-
экспериментах виргинных имаго в возрасте двух
ное выше, исследовали в основном на различных
суток подвергали внешнему воздействию. На тре-
линиях клеток человека и животных, очень мало
тьи сутки мух скрещивали и оценивали показате-
экспериментов было выполнено на модельных
ли, характеризующие плодовитость (эмбрио-
объектах. В экспериментах на дрозофиле оцени-
нальную смертность и количество потомков на
вали уровни экспрессии Hsp70 при действии
стадиях куколки и имаго) и длительность жизни
ЭМП. Включение меченого уридина с помощью
родительских особей.
авторадиографии выявило транскрипцию, акти-
Характеристика внешнего воздействия. Облуча-
вированную ЭМП, в 87 локусах, содержащих
ли имаго в возрасте двух суток в пробирках со вре-
шесть генов Hsp70 [12]. Излучение сотового теле-
менной средой через вату. Облучение проводили
фона также вызывало 3.6-кратное повышение
с использованием средств измерений, входящих в
уровня белка Hsp70 у личинок дрозофилы, под-
состав Вторичного эталона единиц мощности
вергавшихся воздействию в течение 60 мин два-
электромагнитных колебаний в волноводных
жды в день в течение 10 дней [13].
трактах в диапазоне частот (37.50-78.33) ГГц.
Этот эталон ежегодно проходит метрологическую
Новые возможности в изучении механизмов
аттестацию на Национальном эталоне единиц
действия ЭМИ в экспериментах на дрозофиле от-
мощности электромагнитных колебаний в волно-
крылись после того, как В. Дж. Гонг и К. Г. Голич
водных трактах (путем калибровки эталонов пе-
[14] получили линии с удаленными генами Hsp70
реносчиков единицы поглощенной мощности) в
(Hsp70-null). Было установлено, что гены Hsp70
Национальном научном центре «Институт мет-
необходимы для выживания при достаточном
рологии» (Харьков, Украина) [19].
сильном тепловом шоке, но не являются необхо-
димыми при более мягком тепловом воздей-
Возможности эталона позволяют работать с
ствии, что указывало на то, что при снижении
мощностями ЭМИ от 1⋅10-3-1⋅10-2 Вт с суммар-
копий Hsp70 сохраняется значительная степень
ной относительной погрешностью
0.2⋅10-2-
термоустойчивости. Кроме того, было продемон-
стрировано несколько плейотропных эффектов,
0.5⋅10-2. Для генерации излучений на частотах до
вызванных делецией Hsp70 [15]. Эффект теплово-
37.5 ГГц и до 78.33 ГГц применяются волноводы
го шока в экспериментах с линией Hsp70-null Dro-
прямоугольного сечения 5.2×2.6 мм и 3.6×1.8 мм
sophila melanogaster продемонстрировал актива-
соответственно. В качестве излучателя применя-
цию синтеза нескольких индуцибельных и кон-
ли открытый конец волновода, а пробирку с има-
ститутивных Hsp. Тепловой шок вызвал как
го Drosophila melanogaster размещали (надевали на
экспрессию новых паттернов генов, так и почти
волновод) таким образом, чтобы соблюдалось
полную смертность особей линии Hsp70-null [16].
условие дальней зоны.
БИОФИЗИКА том 66
№ 4
2021
РОЛЬ ГЕНОВ Hsp70 В КОНТРОЛЕ ЖИЗНЕСПОСОБНОСТИ
643
Мощность излучения на выходе из волновода
Для определения стадии гибели эмбрионов
измеряли ваттметром проходящей мощности ти-
анализировали неразвившиеся яйца дрозофилы
па М1-25. Для компенсации влияния затухания
по методу, описанному в работе [20]. Различали
ЭМИ в вате на облучаемой частоте при помощи
начальные стадии дробления и образования бла-
ваттметра поглощенной мощности типа М3-22А
стодермы (гибель особей произошла до 5.5 ч эм-
и термисторной головки методом замещения не-
брионального развития (I)); стадии гаструляции и
посредственно перед экспериментом определяли
сегментации (гибель эмбрионов от 5.5 до 17 ч раз-
коэффициент поглощения ваты (3 × 2 см), кото-
вития (II)) и стадию органогенеза (гибель от 17 до
рый на частоте 65.0 ГГц был равен 1.25, а на часто-
22 ч эмбрионального развития (III)). Всего в экс-
те 37.5 ГГц - 1.12. Значение мощности, подводи-
периментах проанализированы кладки яиц от
мой к открытому концу волновода, устанавлива-
около 1200 самок дрозофилы.
лось
для
плотности потока энергии
Для каждого варианта эксперимента при ана-
W = 10 мкВт/см2 (0.1 Вт/м2) с учетом этого коэф-
лизе количества потомков на стадии имаго рас-
фициента с использованием выражения:
считывали среднее арифметическое значение и
стандартную ошибку среднего. Результаты ана-
2
П4πr
лиза показателей гибели особей на стадии кукол-
P
и
=
,
К
ки и эмбриональной смертности представлены в
и
виде долей (%) с 95%-м доверительным интерва-
где П - плотность потока энергии ЭМП, Вт/м2;
лом. Доверительный интервал рассчитывали по
Ри - мощность излучения от источника, Вт; Кн -
Джеффрису [21]. Статистическую значимость от-
коэффициент направленного действия излучате-
личий контрольных и опытных значений оцени-
ля; r - расстояние до источника излучения, м.
вали при помощи критерия Фишера. Проверку
нулевых гипотез проводили на уровне значимо-
Итоговые параметры микроволнового воздей-
сти 0.05.
ствия на имаго: плотность потока мощности
Анализ продолжительности жизни имаго. Рас-
W = 10 мкВт/см2, частота F = 37.7 и 65.0 ГГц, дли-
считывали показатели средней и медианной про-
тельность воздействия t = 5 мин. При облучении
должительность жизни имаго Drosophila. Виргин-
в пробирке находилось 15-20 имаго. В зависимо-
ных особей, отдельно самок и самцов, содержали
сти от типа эксперимента необходимо было полу-
на временной среде в стеклянных пробирках по
чить от 70 до 200 облученных мух каждого пола
25 особей. В каждом варианте эксперимента ана-
каждой линии.
лизировалась длительность жизни 100-120 имаго
каждого пола. Подсчет погибших особей и пере-
Включение меченого
35S метионина в белки
нос мух на свежую среду проводили каждые двое
слюнных желез D. melanogaster. Личинок третьего
суток. Для сравнения различий по показателю
возраста подвергали тепловому шоку (37.5°C) в
медианной продолжительности жизни использо-
течение 30 мин. Затем слюнные железы выделяли
и инкубировали в течение 40 мин при 25°C в
вали тест Вилкоксона-Бреслоу-Гехана. Досто-
верность различий показателя максимальной
20 мкл среды Шнайдера для насекомых (Schnei-
продолжительности жизни (последние 10% по-
der’s insect medium), не содержащей метионин
гибших из выборки) оценивали с помощью теста
(Sigma, США) и дополненной 1 мкл (1 μCi) мети-
Ванг-Эллисона с поправкой Бонферрони [22].
онина, меченного 35S (GE Healthcare, Великобри-
тания). В качестве контроля использовали слюн-
ные железы личинок, содержащихся при 25°C.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Меченые слюнные железы лизировали в 20 мкл
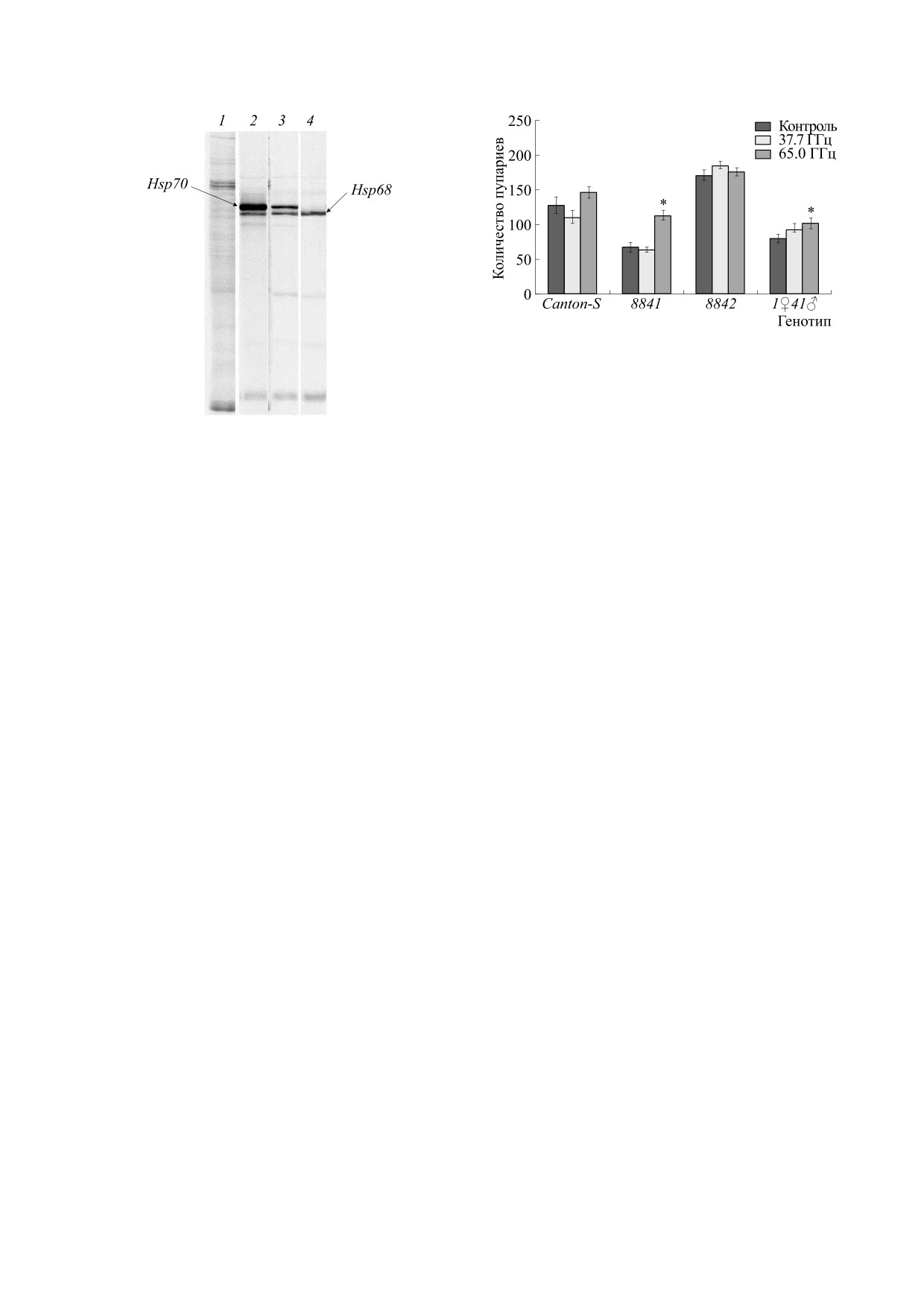
Для проверки количества копий генов белков
буфера Лэммли (Laemmli buffer). Белковые экс-
теплового шока в линиях 8841 и 1♀41♂проанали-
тракты разделяли в 10%-м SDS-полиакриламид-
ном геле. Использовали равные количества каж-
зировали включение меченого 35S метионина в
дого образца. Включение радиоактивной метки
слюнные железы личинок дрозофилы трех линий
оценивали с помощью радиоавтографии.
с различным числом копий Hsp70. Результаты до-
казали наличие одной копии (линия 1♀41♂) и от-
Учет показателей, характеризующих репродук-
сутствие генов Hsp70 в геноме особей мутантной
тивную ценность имаго. Определяли среднее коли-
линии 8841 (рис. 1).
чество потомков на стадии имаго от двух роди-
тельских пар. Для этого в пробирки, содержащие
Результаты исследований жизнеспособности
по 5 мл питательной среды, помещали на пять су-
показали, что в контроле наибольшее количество
ток по две пары трехсуточных виргинных имаго и
потомков на стадии имаго характерно для линий
учитывали всех потомков. В каждом варианте
дикого типа Canton-S и мутантной линии 8842,
эксперимента оценивали потомство от 24-30 пар
которая содержит четыре копии Hsp70 (рис. 2 и 3).
особей. Параллельно подсчитывали количество
Для линий с делецией всех копий Hsp70 (8841) и
особей, погибших на стадии куколки.
только с одной копией этого гена (1♀41♂) показа-
БИОФИЗИКА том 66
№ 4
2021
644
ГОРЕНСКАЯ и др.
Рис. 2. Количество потомков на стадии куколки у
линий дрозофилы с разным количеством Hsp после
электромагнитного воздействия.
*
- Уровень
значимости различий от контроля p < 0.05.
Рис. 1. Включение метионина S35 в слюнные железы
сти [25-27]. Различия в полученных результатах
личинок дрозофилы в нормальных условиях и после
связаны, очевидно, с различиями в методике по-
теплового шока (37°C, 30 мин): 1 - контроль (линия
становки эксперимента, параметрах (частота,
w1188, содержащая все шесть копий Hsp70), развитие
мощность, длительность воздействия) микровол-
при нормальной температуре; 2 - линия w1188 после
нового излучения, стадии онтогенеза, на которой
воздействия теплового шока;
3
- линия 1♀41♂,
происходит воздействие, и характеристиками ли-
содержащая одну копию Hsp70, после теплового
ний дрозофилы.
шока; 4 - линия 8841 с делецией всех копий Hsp70,
после теплового шока. Положение Hsp70 и Hsp68
Анализ стадий эмбриональной гибели пока-
указано стрелками.
зал, что у линии дикого типа максимальное коли-
чество погибших эмбрионов приходится на на-
чальные этапы фрагментации бластодермы (пер-
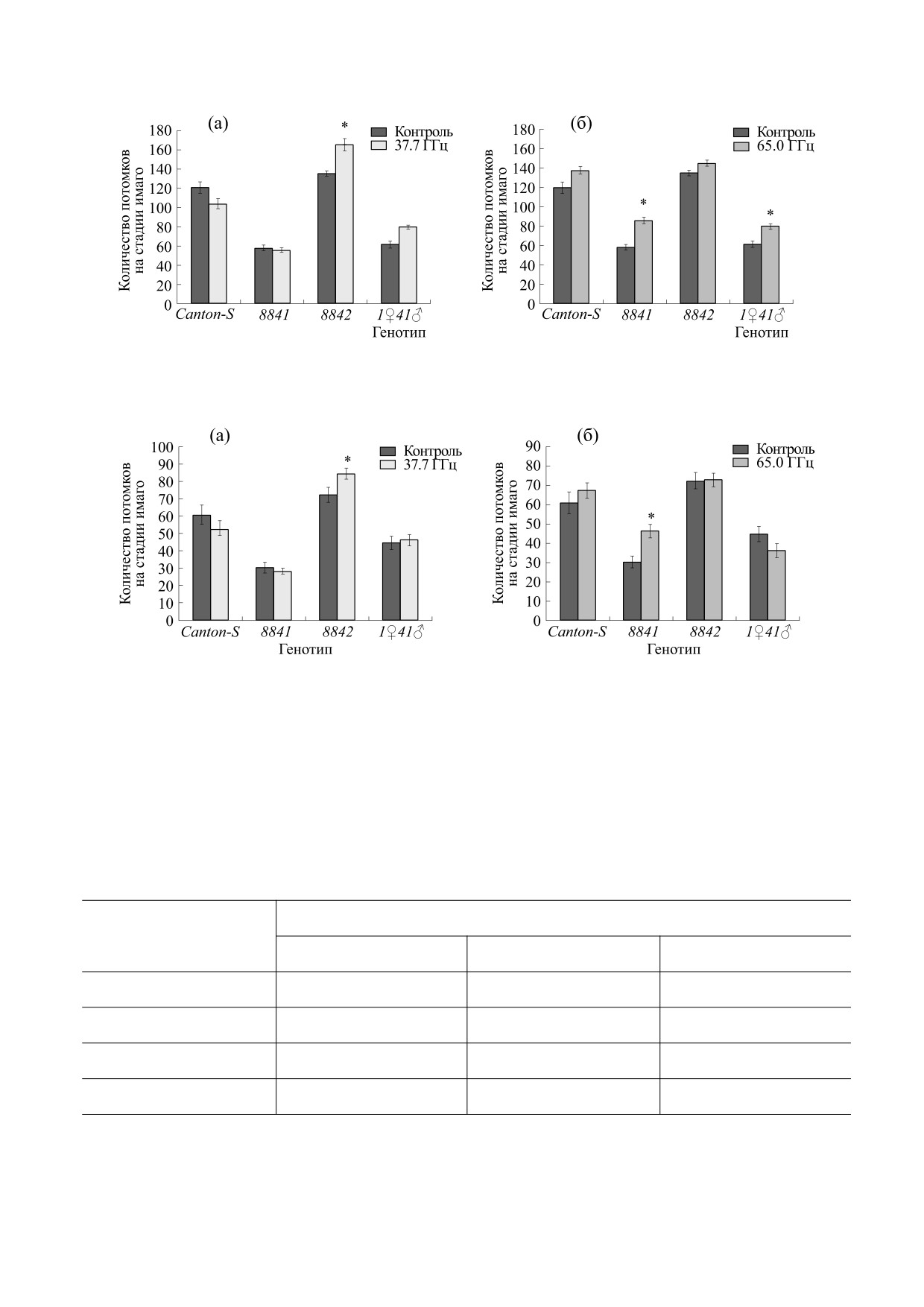
тель плодовитости оказался снижен практически
вые
5.5 ч развития) и стадию органогенеза
в два раза. Внешнее воздействие не оказало зна-
(последние 17-22 ч развития) (табл. 2). Уменьше-
чимого влияния на количество потомков на ста-
ние количество копий Hsp70 в геноме мутантных
дии имаго у линии дикого типа, но привело к уве-
линий 8841, 8842, 1♀41♂ приводит к снижению
личению плодовитости линий с разным количе-
жизнеспособности эмбрионов на стадии гастру-
ством копий Hsp70. Так, облучение с мощностью
ляции и начальных этапах сегментации (5.5-17 ч
37.7 ГГц повысило контроль на 15.84% у линии
развития).
8842 (рис. 4а и 5а), с мощностью 65 ГГц - на
48.19% и 29.59% соответственно у линий 8841 и
Микроволновое облучение негативно влияет
11♀41♂(рис. 4б и 5б).
на процессы раннего онтогенеза дрозофилы, уве-
личивая эмбриональную смертность в основном
Наблюдаемый эффект действия микроволно-
на стадиях сегментации и органогенеза. У линии
вого облучения опосредован изменениями коли-
дикого типа в 2.29 раза (р < 0.05) возросло количе-
чества потомков на стадии куколки. Так, воздей-
ство эмбрионов, погибших на стадии гаструля-
ствие на родительских особей линий с делецией
ции и начальных этапах сегментации. Аналогич-
всех копий Hsp70 (8841) и с одной копией этого
ные изменения произошли и у линии
8841
гена (1♀41♂) с частотой 65 ГГц увеличило количе-
(р < 0.05). У особей линии 1♀41♂ увеличилась
ство куколок в 1.7 и в 1.3 раза соответственно
смертность эмбрионов на начальных этапах дроб-
(рис. 2). В то же время количество особей, погиб-
ления (р < 0.05).
ших на стадии куколки, у этих же линий увеличи-
лось по сравнению с контролем в среднем в пол-
Таким образом, действие микроволн увеличи-
тора раза (табл. 1).
вает количество погибших эмбрионов у линий
8841 и 1♀41♂ в основном за счет гибели особей на
Полученные в работе результаты, показываю-
поздних этапах эмбрионального развития. Оче-
щие увеличение фертильности имаго дрозофилы
видно, что это один из факторов, приводящий к
при действии микроволнового облучения, хоро-
уменьшению числа потомков у особей этих ли-
шо согласуются с нашими предыдущими резуль-
ний после облучения.
татами [23]. Но следует отметить, что литератур-
ные данные достаточно противоречивы, есть све-
У линии дикого типа Canton-S действие мик-
дения как об увеличении эффекта [13], так и его
роволн увеличивает медианную продолжитель-
отсутствии [24], а также о снижении плодовито-
ности жизни имаго обоего пола и увеличивается
БИОФИЗИКА том 66
№ 4
2021
РОЛЬ ГЕНОВ Hsp70 В КОНТРОЛЕ ЖИЗНЕСПОСОБНОСТИ
645
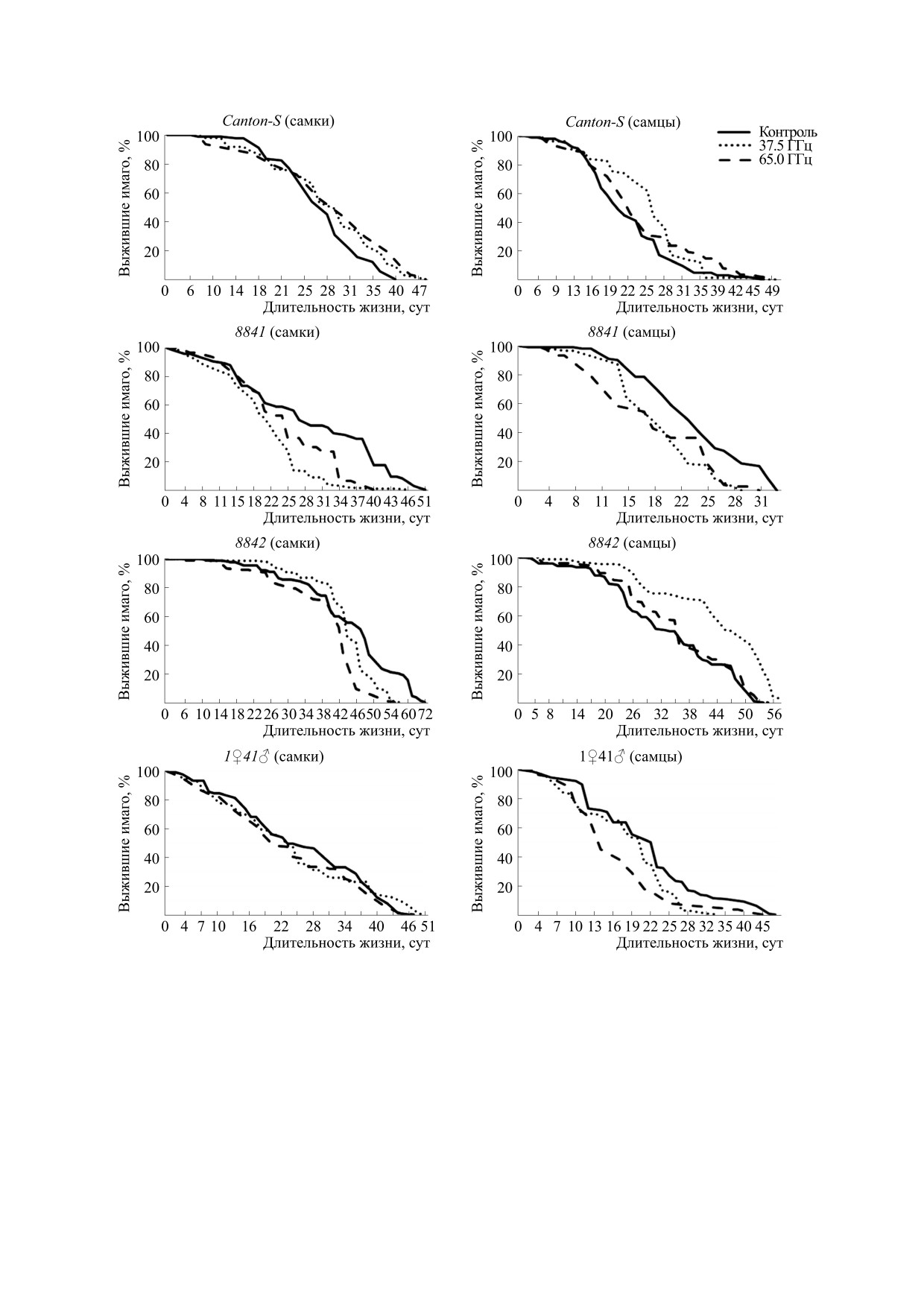
Рис. 3. Кривые дожития имаго линий дрозофилы с разным количеством Hsp в контроле и после электромагнитного
воздействия.
продолжительность жизни наиболее долгоживу-
Однако особенности этого процесса определяют-
щей части особей (рис. 3, табл. 3). У всех мутант-
ся специфическим набором генов белков тепло-
ных линий, различающихся числом копий Hsp70,
вого шока в геноме мух. Так, у линии Hsp70-null
облучение снижает продолжительность жизни.
(8841), облучение приводит к снижению как ме-
БИОФИЗИКА том 66
№ 4
2021
646
ГОРЕНСКАЯ и др.
Рис. 4. Плодовитость на стадии имаго (самки) линий дрозофилы с разным количеством Hsp после электромагнитного
воздействия: (а) - 37.7 ГГц, (б) - 65.0 ГГц. * - Уровень значимости различий от контроля р < 0.05.
Рис. 5. Плодовитость на стадии имаго (самцы) линий дрозофилы с разным количеством Hsp после электромагнитного
воздействия: (а) - 37.7 ГГц, (б) - 65.0 ГГц. * - Уровень значимости различий от контроля р < 0.05.
дианной, так и максимальной продолжительно-
только у самцов. Долгоживущая часть выборки
сти жизни имаго обоего пола во всех вариантах
(как самки, так и самцы) оказалась чувствитель-
экспериментов (р ≤ 0.05).
ной к действию микроволн, и максимальная про-
У линии с одной копией Hsp70 (1♀41♂) сниже-
должительность жизни снижалась во всех вари-
ние средней продолжительности жизни показано антах экспериментов (р ≤ 0.05).
Таблица 1. Количество погибших на стадии куколки в потомстве особей дрозофилы, подвергшихся воздействию
микроволн
Вариант эксперимента
Генотип
Контроль
37.7 ГГц
65 ГГц
Canton-S
5.9 (4.82-7.18)
6.7 (5.22-8.51)
5.9 (4.89-7.10)
8841
13.8 (11.08-17.33)
13.2 (10.30-16.57)
23.9 (21.40-26.64)*
8842
15.2 (13.73-16.83)
10.8 (9.51-12.08)
17.5 (15.90-19.28)
1♀41♂
16.9 (14.74-19.34)
16.6 (14.37-19.09)
23.5 (20.68-26.53)*
Примечание. Доверительный интервал 95%; * - уровень значимости различий от контроля, р < 0.05.
БИОФИЗИКА том 66
№ 4
2021
РОЛЬ ГЕНОВ Hsp70 В КОНТРОЛЕ ЖИЗНЕСПОСОБНОСТИ
647
Таблица 2. Эмбриональная гибель в потомстве особей дрозофилы, подвергшихся воздействию микроволнового
излучения
Эмбрионы, погибшие на разных стадиях онтогенеза, %
Вариант
(доверительный интервал 95%)
Генотип
эксперимента
І (0-5.5 ч)
ІІ (5.5-17 ч)
ІІІ (17-22 ч)
Контроль
4.2 (3.30-5.32)
3.1 (2.32-4.05)
6.8 (5.67-8.22)
Canton-S
37.7 ГГц
3.9 (1.74-7.40)
7.1 (4.06-11.57)*
3.8 (1.74-7.40)
65 ГГц
4.2 (2.76-6.13)
5.3 (3.65-7.42)
4.8 (3.20-6.78)
Контроль
2.0 (0.84-4.09)
21.7 (17.35-26.67)
1.33 (0.45-3.15)
8841
37.7 ГГц
0.8 (0.22-2.06)
36.5 (31.84-41.42)*
4.2 (2.49-6.49)
65 ГГц
2.2 (0.63-5.81)
29.6 (22.42-37.70)
4.4 (1.88-8.93)
Контроль
0.7 (0.35-1.22)
4.3 (3.38-5.48)
0.9 (0.55-1.57)
8842
37.7 ГГц
0.5 (0.23-1.13)
3.8 (2.82-5.11)
0.9 (0.47-1.62)
65 ГГц
0.3 (0.10-0.72)
3.6 (2.67-4.69)
0.3 (0.10-0.72)
Контроль
0.8 (0.23-2.14)
19.6 (15.83-23.89)
2.2 (1.02-4.02)
1♀41♂
37.7 ГГц
1.9 (0.64-4.40)
16.4 (11.92-21.85)
1.4 (0.40-3.71)
65 ГГц
4.1 (2.19-6.97)*
24.5 (19.68-29.93)
1.9 (0.71-4.03)
Примечание. Доверительный интервал 95%; * - уровень значимости различий от контроля, р < 0.05.
Таблица 3. Медианные значения длительности жизни дрозофилы в зависимости от действия микроволн
Вариант эксперимента
Генотип
Пол
Контроль
37,7 ГГц
65 ГГц
Самки
28
29
30*
Canton-S
Самцы
21
27*
23
Самки
27
22*
25
8841
Самцы
23
18*
18*
Самки
48
44
43*
8842
Самцы
34
46*
36
Самки
24
24
21
1♀41♂
Самцы
23
21*
14*
Примечание. * - Уровень значимости различий от контроля р < 0,05.
БИОФИЗИКА том 66
№ 4
2021
648
ГОРЕНСКАЯ и др.
Рассматривая микроволны как стрессовый
количества эмбрионов, погибших в основном на
фактор, снижение медианной продолжительно-
стадиях сегментации и органогенеза. Эта законо-
сти жизни самок и самцов линии 8841 в опытах
мерность не зависит от числа генов Hsp70 в гено-
можно объяснить пониженной стрессоустойчи-
ме дрозофилы. Однако наблюдается и увеличение
востью. Очевидно, что одной копии Hsp70 у сам-
количества потомков на стадии имаго у мутант-
цов линии 1♀41♂недостаточно, чтобы нейтрали-
ных линий. Очевидно, внешнее воздействие сти-
зовать эффекты крайне высоких частот. Самки
мулирует яйцекладку у линий со сниженным
же этой линии более устойчивы к стрессу, и меди-
количеством генов белков теплового шока, что
анные значения продолжительности жизни в экс-
может быть опосредовано изменениями в гормо-
перименте соответствуют контрольным (рис. 3).
нальном балансе имаго, в частности уменьшени-
Линия 8842, содержащая четыре копии Hsp70,
ем титра экдизона в гемолимфе [31].
характеризуется половым диморфизмом в ответ
Если сравнивать полученные эффекты от об-
на использование микроволн. У самок после об-
лучения имаго ЭМИ крайне высоких частот с раз-
лучения снизилась как медианная, так и макси-
ными длинами волн, то показана одинаковая тен-
мальная (р ≤ 0.05) продолжительность жизни.
денция изменений показателей жизнеспособно-
Самцы продемонстрировали противоположный
сти. Различия показаны только при анализе
эффект, и после облучения с частотой 37.7 ГГц
медианной продолжительности жизни. Так, у ли-
наблюдалось весьма значимое увеличение как
нии 8841 показатель снижается в обоих вариантах
медианной, так и максимальной (р ≤ 0.05) про-
эксперимента, но эффект выражен сильнее при
должительности жизни (рис. 3, табл. 3).
действии микроволнового облучения с длиной
Синтез белков теплового шока у дрозофилы
волны 37.7 ГГц. У линии 1♀41♂ с одной копией
является не только универсальной реакцией на
Hsp70 снижение медианной ПЖ в эксперименте
стресс, но и одним из параметров, характеризую-
сильнее при действии 65 ГГц. И для линии 8842
щих возрастные изменения метаболизма [28].
показан разнонаправленный эффект - повыше-
Так, показано влияние дозы Hsp70 на жизнеспо-
ние медианной ПЖ у самцов при действии
собность дрозофилы при старении при нормаль-
37.7 ГГц (аналогичные результаты получены и у
ной температуре [29]. В экспериментах использо-
линии дикого типа) и снижение показателя у са-
вали трансгенную линию с двенадцатью допол-
мок при действии 65 ГГц.
нительными копиями генов белков теплового
Обобщая полученные в работе результаты, мы
шока и линию с уменьшенным количеством ко-
видим, что у линии дикого типа Canton-S с нор-
пий Hsp, которая несла только остаточную кон-
мальным набором генов белков теплового шока
струкцию Р-элемента в том же самом сайте инте-
практически не изменяются показатели репро-
грации, где были встроены дополнительные
дуктивной способности при действии микровол-
Hsp70. Эксперименты, проведенные с этими ли-
нового облучения, однако возрастает медианная
ниями, показали, что увеличение количества ко-
продолжительность жизни. Линии без (8841) или
пий генов Hsp70 улучшает жизнеспособность по-
с одной (1♀41♂) копиями генов белков теплового
сле теплового шока. С другой стороны, мутантная
шока оказались восприимчивыми к микроволно-
линия, лишенный копий Hsp70, демонстрировала
вому облучению. Показанные отсроченные изме-
меньшую продолжительность жизни по сравне-
нения показателей жизнеспособности имели в
нию с исходной линией и линией с дополнитель-
основном негативный эффект. Так, внешнее воз-
ными копиями генов. Эта разница становилась
действие привело к снижению количества по-
более выраженной при повышенной температуре
томков на стадии имаго, к увеличению числа
(29°C)
[30]. Таким образом, полученные в
погибших особей на стадиях куколки и раннего
работе результаты, демонстрирующие снижение
онтогенеза (в основном на поздних этапах эмбри-
продолжительности жизни у линии Drosophila
онального развития), снижению медианной и
Hsh70-null (8841), хорошо согласуются с нашими
максимальной продолжительности жизни. Инте-
предыдущими исследованиями.
ресные разнонаправленные результаты демон-
В данном исследовании изучались отсрочен-
стрирует линия 8842. Имея четыре копии Hsp70,
ные эффекты низкоинтенсивного электромаг-
особи линии демонстрируют половой диморфизм
нитного излучения по показателям жизнеспособ-
в реакции на действие микроволнового облуче-
ности имаго дрозофилы. В работе использовали
ния: снижение медианной и максимальной про-
линии, содержащие разное количество копий ге-
должительности жизни самок и увеличение этих
нов белков теплового шока. Показано, что дей-
показателей у самцов. Безусловно, эксперимен-
ствие ЭМИ крайне высоких частот усиливает му-
тальные манипуляции с древней и высоко сба-
тационный процесс, приводящий к увеличению
лансированной системой генов Hsp70 [30] приво-
БИОФИЗИКА том 66
№ 4
2021
РОЛЬ ГЕНОВ Hsp70 В КОНТРОЛЕ ЖИЗНЕСПОСОБНОСТИ
649
дят к нарушению формирования нормального
11. C. Bernardini, A. Zannoni, M. E. Turba, et al., Bio-
стрессового ответа организма и наблюдаемым из-
electromagnetics
28
(3),
231
(2007).
DOI:
10.1002/bem.20299
менениям жизнеспособности после облучения
имаго. Планируемые протеомные и транскрип-
12. R. Goodman, D. Weisbrot, A. Uluc, and A. Hender-
томные методы позволят разобраться в механиз-
son, Bioelectromagnetics 13 (2), 111 (1992). DOI:
10.1002/bem.2250130205
мах, лежащих в основе роли Hsp70 в ответе на
микроволновое облучение.
13. D. Weisbrot, H. Lin, L. Ye, et al., J. Cell. Biochem. 89
(1), 48 (2003). DOI: 10.1002/jcb.10480
14. W. J. Gong and K. G. Golic, Genetics 168 (3), 1467
ФИНАНСИРОВАНИЕ РАБОТЫ
(2004). DOI: 10.1534/genetics.104.030874
Работа выполнена при финансовой поддержке
15. W. J. Gong and K. G. Golic, Genetics 172 (1), 275
Министерства образования и науки Украины
(2006). DOI: 10.1534/genetics.105.048793
(грант № 0119U002549, О. Горенская) и Россий-
16. B. R. Bettencourt, C. C. Hogan, M. Nimali, and
ского научного фонда (грант № 17-74-30030,
B. W. Drohan, BMC Biol. 6 (1), 5 (2008). DOI:
M. Eвгеньев).
10.1186/1741-7007-6-5
17. V. Shilova, O. G. Zatsepina, D. G. Garbuz, et al., In-
КОНФЛИКТ ИНТЕРЕСОВ
sect Mol. Biol.
27
(1),
61
(2018). DOI:
10.1111/imb.12339
Авторы заявляют об отсутствии конфликта
интересов.
18. M. E. Feder and R. A. Krebs, Amer. Zool. 38, 503
(1998). DOI: 10.1093/icb/38.3.503
19. В. П. Середній, В. І. Огар, Т. М. Голякова, та ін.,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Укр. метрологіч. журн., № 4, 50 (2009).
Настоящая работа не содержит описания ис-
20. D. L. Hill, Drosophila Information Service 19, 62
следований с использованием людей и животных
(1945).
в качестве объектов.
21. L. D. Brown, T. T. Cai, and A. DasGupta, Stat. Sci. 16
(2), 101 (2001).
СПИСОК ЛИТЕРАТУРЫ
22. S. K. Han, D. Lee, H. Lee, et al., Oncotarget 7, 56147
(2016). DOI: 10.18632/oncotarget.11269
1. R. Goodman, M. Blank, H. Lin, et al., Bioelectroch.
Bioener.
33
(2),
115
(1994). DOI: 10.1016/0302-
23. О. В. Горенская, Д. В. Рыбак, Н. В. Рыбак и др.,
4598(95)05040-X
Вісник Харківського нац. унів. ім. В. Н. Каразіна.
Сер. «Біологія» 32, 52 (2020). DOI: 10.26565/2075-
2. H. Lin, M. Opler, M. Head, et al., J. Cell. Biochem. 66
5457-2020-34-6
(4),
482,
(1997).
DOI:
10.1002/(sici)1097-
4644(19970915)66:4<482::aid-jcb7>3.0.co;2-h
24. T. L. Poy, E. C. Beyer, and C. F. Reichelderfer, J. Mi-
crowave Power
7
(2),
75
(1972).
DOI:
3. L. Han, H. Lin, M. Head, et al., J. Cell. Biochem. 71
10.1080/00222739.1972.11688836
(4),
577
(1998).
DOI:
10.1002/(sici)1097-
25. E. Atli and H. Ünlü, Turk. J. Biol. 31 (1), 1 (2007).
4644(19981215)71:4<577::aid-jcb12>3.0.co;2-v
DOI: 10.1080/09553000600798849
4. H. Lin, L. Han, M. Blank, et al., J. Cell. Biochem. 70
26. L. H. Margaritis, A. K. Manta, K. D. Kokkaliaris, et al.,
(3),
297
(1998).
DOI:
10.1002/(SICI)1097-
Electromagn. Biol. Med. 33 (3), 165 (2014). DOI:
4644(19980901)70:3<297::AID-JCB2>3.0.CO;2-I
10.3109/15368378.2013.800102
5. H. Lin, M. Blank, and R. Goodman, J. Cell. Biochem.
27. N. E. Sagioglou, A. K. Manta, I. K. Giannarakis, et al.,
75
(1),
170
(1999). DOI:
10.1002/(SICI)1097-
Electromagn. Biol. Med. 35 (1), 40 (2016). DOI:
4644(19991001)75:1<170::AID-JCB17>3.0.CO;2-5
10.3109/15368378.2014.971959
6. M. Blank and R. Goodman, Pathophysiology 16 (2-
28. R. I. Morimoto, Cold Spring Harb. Symp. 76, 91
3), 71 (2009). DOI: 10.1016/j.pathophys.2009.01.006
(2011). DOI: 10.1101/sqb.2012.76.010637
7. A. O. Rodríguez de la Fuente, J. M. Alcocer-González,
29. M. Tatar, A. A. Khazaeli, and J. W. Curtsinger, Nature.
A. J. Heredia-Rojas, et al., Cell Biol. Int. 33 (3), 419
390 (6655), 30 (1997). DOI: 10.1038/36237
(2009). DOI: 10.1016/j.cellbi.2008.09.014
30. M. B. Evgen’ev, D. G. Garbuz, and O. G. Zatsepina, in
8. A. Garip and Z. Akan, Acta Biol. Hung. 61 (2), 158
Heat shock proteins and whole body adaptation to extreme
(2010). DOI: 10.1556/ABiol.61.2010.2.4
environments,
DOI:
10.1007/978-94-017-9235-6
9. A. C. Mannerling, M. Simkó, K. H. Mild, and
(Springer; Dordrecht, Heidelberg, New York, London,
M. O. Mattsson, Radiat. Environ. Biophys. 49 (4), 731
2014), pp. 59-115.
(2010). DOI: 10.1007/s00411-010-0306-0
31. M. R. Meiselman, T. G. Kingan, and M. E. Adams,
10. R. Alfieri, M. Bonelli, G. Pedrazzi, et al., Radiat. Res.
BMC Biol. 16, 18 (2018). DOI: 10.1186/s12915-018-
165 (1), 95 (2006). DOI: 10.1667/rr3487.1
0484-9
БИОФИЗИКА том 66
№ 4
2021
650
ГОРЕНСКАЯ и др.
The Role of Hsp70 Genes in Promoting Control of Viability in Drosophila melanogaster
Subjected to Microwave Irradiation
O.V. Gorenskaya*, A.B. Gavrilov*, O.G. Zatsepina**,
Yu.G. Shckorbatov*, †, and M.B. Evgen’ev**, ***
*V.N. Karazin Kharkov National University, pl. Svobody 4, Kharkov, 61022 Ukraine
**Engelhard Institute of Molecular Biology, Russian Academy of Sciences, ul. Vavilova 32, Moscow, 119991 Russia
***Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
Biological effects produced by low-energy electromagnetic radiation were often explained by transcriptional
induction of Hsp70 gene. In this study, we investigated a series of important adaptation traits developed in
Drosophila melanogaster strains with different copy number of Hsp70 genes when subjected to microwave ir-
radiation. In our experiments, we used mutant lines with gene deletion in all or several Hsp70 copies. The
wild-type line (Canton-S containing the full set of Hsp70 genes in its genome) was used as control. For the
irradiation of adult flies (the imago), the electromagnetic radiation (power density10 mW/cm2, frequency
37.7 GHz and 65.0 GHz, exposure duration 5 min) was used. The experimental results showed that exposure
to microwave radiation produced no effect on the number of the wild-type offspring (Canton-S with the full
set of Hsp70 genes) by the pupal stage and imago but was accompanied by increased embryonic mortality and
increased median lifespan. In most cases, exposure to microwave radiation led to adverse effects on the via-
bility of lines without all copies or with the presence of one copy of Hsp70 genes. In these lines, the external
influence resulted in lower number of offspring by the imago, an increased number of dead individuals during
the pupal and early stages of development, and a decrease in the median and maximum lifespan of the imago.
Interestingly, when the strain containing four copies of Hsp70 was exposed to microwave radiation, it was
found that individuals tend to show sexual dimorphism in response to such external influence: a decrease in
the median and maximum lifespan of the female imago and an increase of the longevity of the male flies. The
results of this investigation demonstrate the importance of the presence of the full set of Hsp70 genes in the
Drosophila genome to adapt to microwave radiation.
Keywords: electromagnetic irradiation, Drosophila, viability, embryonic mortality, lifespan
БИОФИЗИКА том 66
№ 4
2021