БИОФИЗИКА, 2021, том 66, № 4, с. 651-656
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
АТФ-ЗАВИСИМЫЕ ПУТИ РЕГУЛЯЦИИ СИГНАЛЛИНГА СКЕЛЕТНЫХ
МЫШЦ И ИХ ВЗАИМОСВЯЗЬ С ГЕННОЙ ЭКСПРЕССИЕЙ
ПРИ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ:
РОЛЬ «МЕДЛЕННОГО» КАЛЬЦИЯ
© 2021 г. Т.Л. Немировская
ГНЦ РФ Институт медико-биологических проблем РАН, 123007, Москва, Хорошевское шоссе, 76а
E-mail: nemirovskaya@bk.ru
Поступила в редакцию 27.04.2021 г.
После доработки 27.05.2021 г.
Принята к публикации 28.05.2021 г.
Целью обзора является описание механизмов работы АТФ-зависимых путей регуляции сигналлин-
га скелетных мышц при их функциональной разгрузке. Особое внимание уделяется описанию роли
паннексиновых каналов, P2Y-пуринэргических рецепторов и IP3-рецепторов в активации специ-
фических транскрипционных сигнальных программ m. soleus при ее функциональной разгрузке.
Известно, что при функциональной разгрузке мышц происходит накопление макроэргических
фосфатов (АТФ, креатинфосфата) и ионов Ca в мышечных волокнах. Ранее показано, что введение
при моделировании функциональной разгрузки препарата, снижающего в мышце уровень макро-
эргических фосфатов, а также уровень кальция, предотвращает трансформацию мышечных воло-
кон в «быструю» сторону и снижает степень ее атрофии. Предлагаемый обзор описывает возможные
механизмы, с помощью которых АТФ достигает рецепторов, воспринимающих этот сигнал, а также
способ его передачи для запуска «медленного» Ca2+-сигнала, участвующего в активации специфи-
ческих транскрипционных программ в мышце при моделировании ее функциональной разгрузки.
Ключевые слова: АТФ-зависимая сигнализация, скелетные мышцы, кальциевая сигнализация, функцио-
нальная разгрузка мышц.
DOI: 10.31857/S0006302921040049
процесса необходимо выявить фундаментальные
При длительной гипокинезии, гравитацион-
механизмы (триггеры) его инициирования. При
ной разгрузке, иммобилизации конечности, а
гипокинезии снижается активность мишени ра-
также при длительном лишении человека обыч-
памицина у млекопитающих (mTOR - mammali-
ной двигательной активности скелетные мышцы
an target of rapamycin) [2, 3] и увеличивается ак-
подвергаются атрофии в результате нарушающе-
тивность убиквитин-протеасомного сигнального
гося баланса между синтезом и деградацией бел-
пути, который отвечает за существенную часть
ка. Недавно показано, что даже непродолжитель-
круговорота цитоплазматического белка, доступ-
ное нахождение крыс в клетках ограниченного
ного для протеолиза [4]. Деградация мышечных
размера вызывает атрофию «быстрых» скелетных
белков усиливается при увеличении экспрессии
мышц (и ускоренный набор веса тела) животного
убиквитинлигаз E3, определяющих интенсив-
[1]. Исследование причины этих изменений и
ность протеасомного пути белковой деградации.
разработка способов профилактики атрофии
Однако физиологические механизмы, активизи-
мышц особенно актуальны сейчас, когда в усло-
рующие эти процессы, не полностью понятны.
виях изоляции в ограниченном пространстве зна-
Известно, что при функциональной разгрузке
чительное число людей отмечали негативные из-
мышц происходит накопление макроэргических
менения в своем организме. Для разработки спо-
соба предотвращения развития атрофического
фосфатов (АТФ, креатинфосфата) и ионов Ca2+ в
мышечных волокнах [5-8]. Ранее было показано
для многих тканей, что внеклеточный АТФ явля-
Сокращения: mTOR - мишень рапамицина у млекопитаю-
щих, SERCA
- Ca2+-активируемая АТФаза P-типа, ется основным аутокринно-паракринным медиа-
фат, PnX1 - паннексин 1, PI3K - фосфатидилинозитол- тором для клеточной сигнализации, вызываемой
гормонами, факторами роста, нейротрансмитте-
4,5-бисфосфат-3-киназа, PLC - фосфолипаза C, АМПК -
АМФ-активируемая протеинкиназа.
рами, механическими стимулами и воспалением
651
652
НЕМИРОВСКАЯ
[9], поэтому мы предполагаем, что АТФ может
(IP3) пути, но не зависит от работы RyR-каналов
быть одним из центральных интеграторов стиму-
[21]. Пуринорецепторы делятся на несколько
лов, полученных для клеток скелетных мышц,
классов и обладают разной чувствительностью к
чтобы позволить и координировать события для
АТФ и продуктам его распада (АДФ, АМФ и аде-
экспрессии мышечных генов. Мы предположи-
нозину), а также к другим нуклеотидтрифосфа-
ли, что АТФ и «медленный» Са2+ могут стимули-
там и их производным [22]. Несколько лет назад
ровать запуск внутриклеточных сигнальных пу-
мы обнаружили, что метаболические изменения
тей и атрофических процессов при функциональ-
и атрофические процессы в мышце предотвраща-
ной разгрузке скелетных мышц. Под термином
ются при ингибировании DHPR или снижении
«медленный» кальций здесь понимается тот каль-
концентрации макроэргических фосфатов при
ций, повышенная концентрация которого в тече-
вывешивании крыс [8, 23] - наиболее часто ис-
ние длительного времени находится в цитоплазме
пользуемой модели для исследования функцио-
(из-за изменений в ферментах (например,
нальной разгрузки мышц [24]. Но схема работы
SERCA - Ca2+-активируемая АТФаза P-типа)) и
этого механизма была не до конца понятна. Мы
затруднения его обратного транспорта в сарко-
предположили, что АТФ и «медленный» Са2+ мо-
плазматический ретикулум. В обзоре будет про-
гут стимулировать запуск внутриклеточных сиг-
анализирован источник поступления, пути пере-
нальных путей и атрофических процессов
дачи и действия этих стимулов на генную экс-
при разгрузке мышц. Механизм этого процесса
прессию при функциональной разгрузке мышц.
может быть следующим: при функциональной
разгрузке АТФ из мышцы через паннексиновые
каналы (pannexin-1; PnX1) может выходить во
АТФ-ЗАВИСИМЫЕ ПУТИ РЕГУЛЯЦИИ
внеклеточное пространство. Эти нуклеотиды за-
КЛЕТОЧНОЙ СИГНАЛИЗАЦИИ
тем могут взаимодействовать с каналами P2Y
Для разработки способа предотвращения раз-
(G protein Y-coupled receptors), которые, в свою
вития атрофии мышц необходимо выявить меха-
очередь, активируют гамма-субъединицу фосфа-
низмы ее инициирования. В то же время именно
тидилинозитол-4,5-бисфосфат-3-киназы (PI3K)
ранние этапы развития атрофии при функцио-
(в Т-каналах - мембраны и в конечном итоге IP3-
нальной разгрузке мышц изучены хуже всего.
рецепторы, находящиеся в ядре и саркоплазмати-
Стимул, активирующий работу АТФ-зависимых
ческом ретикулуме). Активация IP3-рецепторов
путей регуляции сигналлинга скелетных мышц
(IP3R) может вызывать слабый сигнал высвобож-
при их разгрузке может быть следующий. Функ-
дения кальция, как цитозольный, так и нуклео-
циональная разгрузка мышц ведет к изменению
плазматический [25, 26], который способствует
электромиограммы, открытию дигидропириди-
(возможно, с другими сигнальными каскадами)
новых каналов (DHPR-каналы, относящиеся к
активации транскрипционных факторов, что
L-типу Са2+-зависимых каналов), которые плот-
приводит к экспрессии или репрессии генов,
но соединены с паннексиновыми каналами [10,
участвующих в фенотипе мышц. Мы проверили
11]. Паннексины были открыты в 2000 г. как но-
эту гипотезу в нашей лаборатории, применив в
вое семейство белков, способных формировать
модели функциональной разгрузки мышц крыс
каналы в мембране [12, 13]. Они были обнаруже-
(вывешивании) ингибирование паннексиновых
ны у всех хордовых животных [14]. В скелетных
каналов (PnX1), пропускающих АТФ из цито-
мышцах широко представлен паннексин
1
плазмы во внеклеточное пространство. Было об-
(48 кДа). Показано, что паннексиновые каналы
наружено, что PnX1-опосредованный транспорт
пропускают АТФ из цитоплазмы во внеклеточное
АТФ влияет на экспрессию мышечно-специфич-
пространство [15-17]. АТФ является важной сиг-
ных E3-убиквитинлигаз MuRF1 и MAFbx и регу-
нальной молекулой [18, 19]. Мы полагаем, что
лирует сигнальные пути, контролирующие про-
внеклеточный АТФ при функциональной раз-
цессы трансляции и элонгации белка.
грузке может являться одним из основных сигна-
лов в скелетных мышцах для регулирования раз-
В настоящее время существует мало информа-
личных процессов, среди которых - экспрессия
ции о сигнальных путях, активируемых конфор-
генов. Ранее было показано, что высвобождение
мационными изменениями вольт-чувствитель-
АТФ регулируется прямым взаимодействием
ных DHP-каналов в экспериментах in vivo. В экс-
паннексиновых и DHPR-каналов [10]. Обнару-
периментах на культуре мышечных клеток было
жено, что в мышечных волокнах АТФ выходит из
обнаружено новое свойство DHPR как сенсора
клетки через паннексиновые каналы и взаимо-
напряжения для сигнала, регулируемого G-бел-
действует с пуринергическими P2Y2-рецептора-
ком цитоплазматической мембраны, включаю-
ми [20] (см. рисунок). Было также показано, что
щим активацию фосфатидилинозитол-3-киназы
активация пуринэргических рецепторов экзоген-
(PI3K) и фосфолипазы C (PLC) [11]. Авторы по-
ными агонистами вызывает выход кальция, кото-
казали, что деполяризация мембраны вызывает
рый зависит от инозитол-1,4,5-трифосфатного
активацию фосфолипазы С, ведущую к последу-
БИОФИЗИКА том 66
№ 4
2021
АТФ-ЗАВИСИМЫЕ ПУТИ РЕГУЛЯЦИИ СИГНАЛЛИНГА
653
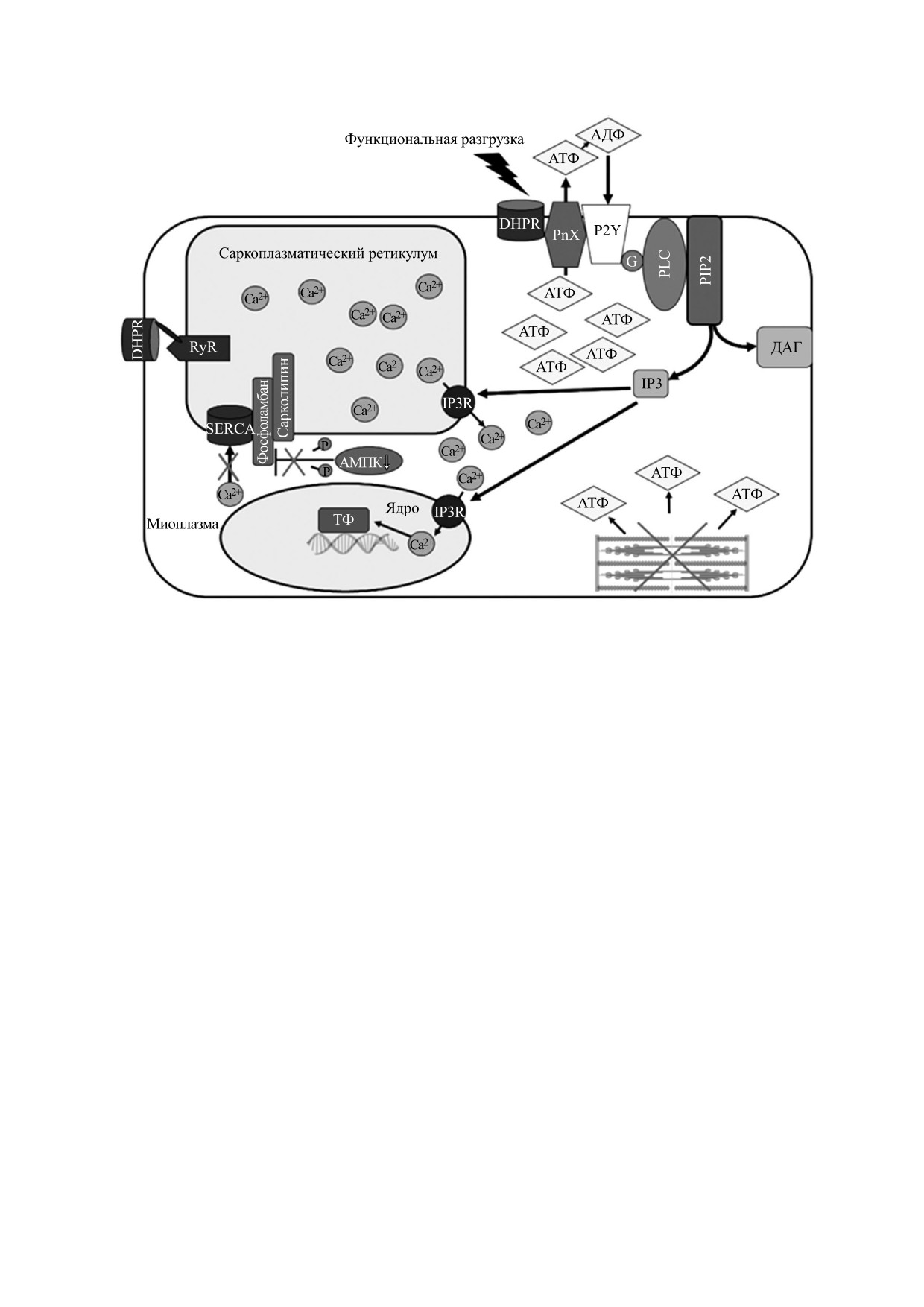
Схематическое описание АТФ-зависимого механизма передачи сигналов в скелетных мышцах. АТФ высвобождается
через паннексиновые каналы (PnX1) при функциональной разгрузке мышц; сенсором напряжения являются дигид-
ропиридиновые рецепторы (DHPR). АТФ быстро распадается на аденозиндифосфат (АДФ), аденозинмонофосфат
(АМФ) и аденозин под действием эктонуклеотидаз. АТФ и АДФ могут действовать на P2Y-рецепторы, связанные с
G-белком, которые, в свою очередь, активируют PI3-киназу в мембране Т-трубочек. PI3-киназа катализирует фосфо-
рилирование фосфатидилинозитолдифосфата (PIP2), давая PIP3 высокозаряженный остаток, который рекрутирует
фосфолипазу C (PLC) в мембрану, запуская гидролиз PIP2 на диацилглицерин (ДАГ) и инозитол-1,4,5-трифосфат
(IP3). IP3 затем связывается с рецепторами IP3 (IP3R), присутствующими как в ядерной оболочке, так и в саркоплаз-
матической сети, вызывая слабый сигнал высвобождения кальция как в цитозоле, так и нуклеоплазме, что способ-
ствует (возможно, с другими сигнальными каскадами) к активации транскрипционных факторов (ТФ), приводящих
к экспрессии или репрессии генов, вовлеченных в фенотип мышечных клеток.
трансдукции [11, 27, 29]. Показано, что конфор-
ющему высвобождению медленного Са2+, из-за
действия инозитол-1,4,5-трифосфата (IP3) (рису-
мационные изменения DHPR могут активиро-
нок). Введение агониста DHPR (Bay K 8644) при
вать гамма- и бета-субъединицы G-белка плазмо-
леммы, который активирует гамма-PI3K и затем
отсутствии внешнего Ca2+ ускоряло медленный
гамма-PLC (фосфолипазу С) (см. рисунок). Что-
кальциевый сигнал [27]. Потенциал действия в
бы дополнительно оценить, участвует ли PI3K в
качестве стимула для медленных сигналов Ca2+
активации PLC, на миотубы воздействовали ин-
был подтвержден путем блокирования тетродо-
гибиторами PI3K (LY294002 и вортманнином)
токсином потенцал-зависимых Na+-каналов
[27]. Оказалось, что они полностью блокировали
[28]. Начало медленного кальциевого сигнала,
как медленные сигналы Ca2+, так и кратковре-
вызванного тетанической стимуляцией миотуб,
менное увеличение содержания IP3, вызванное
имело 30-40-секундную задержку после оконча-
электростимуляцией (рисунок). Этот результат
ния стимуляции, откуда следует, что сигнальный
вместе с тем фактом, что PI3K гамма активирует-
путь должен быть активирован в течение этого
периода. В обзоре [11] описана связь между по-
ся G-белком (его бета- и гамма-субъединицами),
следовательно находящимися в плазмолемме
свидетельствует, что гамма-PI3K является хоро-
DHPR- и PnX1-каналами, G-белком, PLC и
шим кандидатом для регуляции продукции IP3.
PI3K. Ранее с применением ряда методов иссле-
Хотя мРНК гамма-PI3K в скелетных мышцах бы-
довали участие PI3K как части этого механизма
ла выявлена более десяти лет назад, ее физиоло-
БИОФИЗИКА том 66
№ 4
2021
654
НЕМИРОВСКАЯ
гическая роль и активирующие ее стимулы все
Авторы показали, что АТФ, которая оказывается
еще не выяснены.
во внеклеточном пространстве, вызывает отстав-
ленное медленное высвобождение кальция через
Почему IP3, IP3K и IP3R заинтересовали нас
P2Y2R-PLC-IP3 путь. Введение антагониста
в связи с исследованием АТФ-зависимых атро-
P2Y2-рецептора блокировало медленное высво-
фических процессов при функциональной раз-
бождение кальция, демонстрируя, что оно проис-
грузке скелетных мышц? Ранее было показано,
ходит из-за активации сигнального пути P2Y2R-
что IP3R-зависимые медленные сигналы Ca2+
PLC-IP3. Вполне вероятно, что регуляция этого
могут участвовать в активации специфических
пути является не уникальной для мышечных во-
транскрипционных программ фенотипа медлен-
локон, а универсальным механизмом регуляции
ных и быстрых мышечных волокон [11]. Ранее по-
генной экспрессии при различных физиологиче-
казано, что транспорт транскрипционного фак-
ских воздействиях in vivo.
тора гена медленного миозина NFATC1 в ядро
скелетно-мышечных волокон осуществляется
при участии IP3R [30]. IP3R, находящиеся как в
ВОЗМОЖНОЙ СПОСОБ РЕГУЛЯЦИИ
мембране саркоплазматического ретикулума, так
БЕЛКОВОГО МЕТАБОЛИЗМА
и ядра [25, 26, 31], активируются и IP3, и ионами
АТФ-ЗАВИСИМЫМ СИГНАЛЛИНГОМ
Ca2+ [25]. Нуклеотиды, высвобождаемые из мы-
ПРИ ФУНКЦИОНАЛЬНОЙ
шечных волокон во внеклеточную среду, вызыва-
РАЗГРУЗКЕ МЫШЦ
ют переходные процессы кальция и экспрессию
В настоящее время роль макроэргических
генов в скелетных мышцах [21]. Ранее высказыва-
фосфатов и PnX1-опосредованного транспорта
лось предположение о том, что околоядерные и
АТФ в регуляции сигнального пути P2Y2R-PLC-
внутриядерные кальциевые сигналы могут быть
IP3 и ядерного транспорта транскрипционных
мощным инструментом для клетки для регулиро-
факторов при функциональной разгрузке мышц
вания адаптивных процессов, таких как экспрес-
находится в начале своего исследования. Извест-
сия генов [26]. Вероятно, кальций при функцио-
но, что IP3K участвует в регуляции анаболиче-
нальной разгрузке мышцы выполняет роль клю-
ских и катаболических процессов в скелетных
чевого вторичного мессенджера, активирующего
мышцах [34, 35]. Например, PI3К контролирует и
кальцийзависимые транскрипционные факторы
PI3K-Akt-mTORC1/p70S6k и Akt/GSK-сигналь-
в процессе, называемом сопряжением возбужде-
ные пути [34, 36]. Мы обнаружили интересный
ния и транскрипции. Можно предположить, что
феномен. Если при длительных сроках функцио-
локализованный в цитоплазме кальциевый сиг-
нальной разгрузки мышц происходит снижение
нал запрашивается для активации и транслока-
mTORC1 сигнального пути (семь-четырнадцать
ции кальций-зависимых транскрипционных
суток), то на ранних сроках (после одних-трех су-
факторов (цитоплазматический ядерный фактор
ток гравитационной pазгpузки) наблюдается по-
активации Т-лимфоцитов-1 (NFATc1); гистоно-
вышение содержания фоcфоpилиpованной фор-
вых деацетилаз (HDACs), миогенина, FOXO3,
мы ключевой pибоcомальной киназы p70S6K
TFEB и др.)) в ядро (в том числе и, опосредован-
[37]. Аналогичное повышение уровня фосфори-
но, через процессы их фосфорилирования/де-
лирования p70S6k было впоследствии продемон-
фосфорилирования) для последующей экспрес-
стрировано в эксперименте с двенадцатичасовым
сии генов. Вполне вероятно, что IP3-рецепторы
вывешиванием задних конечностей крысы [38].
являются существенно значимым звеном для тра-
До сих пор не было выяснено, что является источ-
фика транскрипционных факторов в ядро [32].
ником такого парадоксального поведения компо-
Подтверждено также участие Ca2+, IP3 и IP3R в
нентов анаболического сигналлинга на ранних
процессах сопряжения возбуждения и тран-
сроках функциональной разгрузки мышц. Мы
скрипции в кардиомиоцитах [31]. Мы полагаем,
полагаем, что одним из механизмов может быть
что при функциональной разгрузке ряд ключевых
работа системы передачи АТФ-опосредованного
транскрипционных факторов также может про-
сигнала через PnX1/P2Y2R/IP3K-компоненты
никать в ядро через IP3-рецепторы и стимулиро-
этого пути. Ранее в эксперименте с культурой
вать экспрессию генов, изменяющих процессы
клеток человека показано, что импорт внешней
белкового синтеза и деградации.
АТФ и АМФ регулирует внутриклеточный сиг-
Итак, можно заключить, что в экспериментах
наллинг AMPK и mTORC1 [39]. В экспериментах
на миотубах и культуре мышечных клеток было
с одно-трехсуточной функциональной разгруз-
обнаружено, что в мышечных волокнах внекле-
кой мышц было показано, что к фосфорилирова-
точная АТФ активирует мембранный сигнальный
нию p70S6K имеет отношение AMPK [35]. На
каскад, который в конечном итоге, высвобождая
фосфорилирование/дефосфорилирование IP3R
«медленный» кальций, регулирует экспрессию
(регулирующих ее функцию) влияет ряд фосфатаз
генов. Аналогичный механизм активации G-бел-
и киназ [40], в том числе, возможно, и АМФ-ак-
ка был обнаружен и в сосудистых клетках [33].
тивируемая протеинкиназа (АМПК). АМПК иг-
БИОФИЗИКА том 66
№ 4
2021
АТФ-ЗАВИСИМЫЕ ПУТИ РЕГУЛЯЦИИ СИГНАЛЛИНГА
655
рает ключевую роль в регуляции сигнальных пу-
ФИНАНСИРОВАНИЕ РАБОТЫ
тей, которые контролируют метаболические,
Работа выполнена при финансовой поддержке
структурные и функциональные изменения в
Российского научного фонда (грант № 21-15-
скелетной мышце при разгрузке. Каким образом
00228) и Российсского фонда фундаментальных
АМПК может быть ассоциирована с регуляцией
исследований (грант № 20-015-00138).
кальциевого обмена при разгрузке мышц? Пока-
зано, что АМПК может фосфорилировать фос-
фоламбан и сарколипин
[41]. При разгрузке
КОНФЛИКТ ИНТЕРЕСОВ
мышц (а также некоторых мышечных заболева-
Автор заявляет об отсутствии конфликта инте-
ниях, сопровождающихся атрофией) активность
ресов.
SERCA ингибируется фосфоламбаном (PLN) и
сарколипином (SLP), в результате чего нарушает-
ся кальциевый обмен [42-44]. AMPK, фосфори-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
лируя PLN и SLP, как известно, активирует
Настоящая работа не содержит описания ис-
SERCA [41]. Потенциально, этот механизм воз-
следований с использованием людей и животных
действия на активность SERCA при разгрузке
в качестве объектов.
можно было бы использовать для снижения нега-
тивного эффекта нарушения кальциевого обмена
в мышце. Такая взаимосвязь между активностью
СПИСОК ЛИТЕРАТУРЫ
AMPK и SERCA характерна не только для скелет-
1.
С. П. Белова, С. А. Тыганов, Е. П. Мочалова и др.,
ных мышц. Например, активация АМПК мет-
Рос. физиол. журн. им. И.М. Сеченова 107 (6), 1
формином in vivo подавляет стресс эндоплазмати-
(2021).
ческого ретикулума за счет увеличения фосфори-
2.
S. C. Bodine, E. Latres, S. Baumhueter, et al., Science
лирования фосфоламбана
[41]. Фосфоламбан
294 (5547), 1704 (2001).
также регулирует запасы Ca2+ в ядре и опосредо-
3.
S. C. Bodine, J. Appl. Physiol. 129 (2), 272 (2020).
ванный IP3R его обмен (между ядром, эндоплаз-
матическим ретикулумом и саркоплазмой) [45].
4.
D. Aweida and S. Cohen, Biomolecules 11 (1), (2021).
Другие авторы также отмечали взаимосвязь меж-
5.
Y. Ohira, W. Yasui, F. Kariya, et al., Acta Astronautica
ду экспрессией SERCA2a и активностью AMP-
33, 113 (1994).
K2α в скелетной мышце [46]. Таким образом,
6.
C. P. Ingalls, G. L. Warren, and R. B. Armstrong, J.
AMPK регулирует множество процессов в мы-
Appl. Physiol. 87 (1), 386 (1999).
шечном волокне, и одним из стимулов для ее ак-
7.
C. P. Ingalls, J. C. Wenke, and R. B. Armstrong, Avia-
тивации, по-видимому, является изменение
tion, Space, and Environ. Medicine 72 (5), 471 (2001).
АТФ-зависимого сигналлинга.
8.
B. S. Shenkman and T. L. Nemirovskaya, J. Muscle
Res. Cell Motil. 29 (6-8), 221 (2008).
ЗАКЛЮЧЕНИЕ
9.
E. R. Lazarowski, R. C. Boucher, and T. K. Harden,
Итак, АТФ и кальций являются триггерами
Mol. Pharmacol. 64 (4), 785 (2003).
для активации или репрессии генов при функци-
10.
M. Casas, S. Buvinic, and E. Jaimovich, Exercise and
ональной разгрузке мышц. Механизм их дей-
Sport Sci. Rev. 42 (3), 110 (2014).
ствия может быть следующим. Функциональная
11.
L. A. Cea, M. A. Riquelme, A. A. Vargas, et al., Front.
разгрузка мышц ведет к изменению электромио-
Physiol. 5, 139 (2014).
граммы, открытию DHPR-каналов, которые
плотно соединены с паннексиновыми каналами.
12.
Y. Panchin, I. Kelmanson, M. Matz, et al., Curr. Biol.
DHPR, взаимодействуя с RYR, способствуют
10 (13), R473 (2000).
быстрому выходу ионов Ca2+ из саркоплазмати-
13.
Y. V. Panchin, J. Exp. Biol. 208 (Pt 8), 1415 (2005).
ческого ретикулума. Одновременно с этим АТФ,
14.
V. I. Shestopalov and Y. Panchin, Cell. Mol. Life Sci.
которая быстро накапливается при функцио-
65 (3), 376 (2008).
нальной разгрузке, выходит из клетки через пан-
15.
B. A. MacVicar and R. J. Thompson, Trends Neurosci.
нексиновые каналы и взаимодействует с пури-
33 (2), 93 (2010).
нергическими P2Y2-рецепторами. IP3 и Ca2+ вза-
16.
S. Penuela, R. Gehi, and D. W. Laird, Biochim. Bio-
имодействуют с IP3R, которые пропускают в
phys. Acta 1828 (1), 15 (2013).
этом состоянии Ca2+ и, возможно, транскрипци-
17.
G. Dahl, Philos. Trans. Roy. Soc. B 370 (1672), (2015).
онные факторы, регулирующие экспрессию ге-
18.
G. Burnstock, J. Theor. Biol. 62 (2), 491 (1976).
нов. Вероятно, активность SERCA и IP3R рецеп-
торов может регулировать АМПК, фосфорилируя
19.
G. Burnstock, BioEssays 34 (3), 218 (2012).
PLN и SLP и тем самым влияя на концентрацию
20.
S. Buvinic, G. Almarza, M. Bustamante, et al., J. Biol.
ионов Са2+ в волокне.
Chem. 284 (50), 34490 (2009).
БИОФИЗИКА том 66
№ 4
2021
656
НЕМИРОВСКАЯ
21. C. May, L. Weigl, A. Karel, et al., Biochem. Pharma-
34. D. J. Glass, Curr. Topics Microbiol. Immunol. 346,
col. 71 (10), 1497 (2006).
267 (2010).
22. T. L. Nemirovskaya, B. S. Shenkman, D. D. Mat-
35. S. Cohen, D. Lee, B. Zhai, et al., J. Cell Biol. 204 (5),
sievskii, et al., Doklady Biol. Sci. 370 (1-6), 10 (2000).
747 (2014).
23. V. Ralevic and G. Burnstock, Pharmacol. Rev. 50 (3),
36. N. Ito, U. T. Ruegg, and S. Takeda, Int. J. Mol. Sci. 19
413 (1998).
(9), 2804 (2018).
37. S. P. Belova, N. A. Vilchinskaya, E. P. Mochalova,
24. E. Morey-Holton, R. K. Globus, A. Kaplansky, et al.,
et al., Arch. Biochem. Biophys. 674, 108105 (2019).
Adv. Space Biol. Med. 10, 7 (2005).
38. A. V. Chibalin, B. Benziane, G. F. Zakyrjanova, et al.,
25. C. W. Taylor and S. C. Tovey, Cold Spring Harbor Per-
J. Cell. Physiol. 233 (10), 6329 (2018).
sp. Biol. 2 (12), a004010 (2010).
39. G. M. Forte, E. Davie, S. Lie, et al., J. Cell Sci. 132 (7),
26. T. Georgiev, M. Svirin, E. Jaimovich, et al., Front.
(2019).
Physiol. 6 (263 (2015).
40. V. Vanderheyden, B. Devogelaere, L. Missiaen, et al.,
27. M. Casas, R. Figueroa, G. Jorquera, et al., J. Gen.
Biochim. Biophys. Acta 1793 (6), 959 (2009).
Physiol. 136 (4), 455 (2010).
41. Q. Duan, P. Song, Y. Ding, et al., Brit. J. Pharmacol.
28. J. M. Eltit, J. Hidalgo, J. L. Liberona, et al., Biophys. J.
174 (13), 2140 (2017).
86 (5), 3042 (2004).
42. M. Komatsu, T. Nakada, H. Kawagishi, et al., J. Mus-
29. R. Araya, J. L. Liberona, J. C. Cardenas, et al., J. Gen.
cle Res. Cell Motil. 39 (5-6), 163 (2018).
Physiol. 121 (1), 3 (2003).
43. V. A. Fajardo, E. Bombardier, E. McMillan, et al., Dis-
30. 30. J. R. Crew, K. Falzari, and J. X. DiMario, Exp. Cell
ease Models & Mechanisms 8 (8), 999 (2015).
Res. 316 (6), 1039 (2010).
44. D. H. MacLennan, M. Asahi, and A. R. Tupling, Ann.
31. F. Hohendanner, S. Walther, J. T. Maxwell, et al., J.
N. Y. Acad. Sci. 986, 472 (2003).
Physiol. 593 (6), 1459 (2015).
45. M. Chen, D. Xu, A. Z. Wu, et al., J. Mol. Cell. Cardiol
32. M. A. Carrasco, E. Jaimovich, U. Kemmerling, et al.,
123, 185 (2018).
Biol. Res. 37 (4), 701 (2004).
46. M. P. Morissette, S. E. Susser, A. N. Stammers, et al.,
33. B. Liu, W. Cao, J. Li, et al., Cell Calcium 76, 62 (2018).
J. Appl. Physiol. 117 (5), 544 (2014).
ATP-Dependent Pathways Involved in the Regulation of Skeletal Muscle Signaling
and the Relationship between These Pathways and Gene Expression
during Muscle Unloading: the Role of «Slow» Calcium
T.L. Nemirovskaya
Institute of Biomedical Problems, Russian Academy of Sciences, Khoroshevskoe shosse 76a, Moscow, 123007 Russia
This review aims to describe the mechanisms by which ATP-dependent pathways involved in the regulation
of skeletal muscle signaling act during muscle unloading. Special attention is paid to the description of the
role of pannexin channels, purinergic P2Y receptors, and IP3 receptors in the activation of specific transcrip-
tional signaling programs of soleus muscle under unloading conditions. It is known that muscle unloading
causes accumulation of high-energy phosphates (ATP, PCr), and Ca ions in muscle fibers. Previously, it was
shown that the drug administered during unloading and that able to decrease the level of high-energy phos-
phates in the muscle, as well as the level of calcium, can prevent the shift of muscle fibers to fast-twitch fibers
and reduce the degree of muscle atrophy. This review describes possible mechanisms by which ATP may
reach the receptors that perceive this signal, as well as the way of signal transmission to trigger the “slow” Ca2+
signal involved in the activation of specific transcriptional programs in the muscle while simulating unloading
conditions.
Keywords: ATP-dependent signaling, skeletal muscle, calcium signaling, muscle unloading
БИОФИЗИКА том 66
№ 4
2021