БИОФИЗИКА, 2021, том 66, № 4, с. 668-683
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.61.66
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ НА ОСНОВЕ КОМПОНЕНТОВ
БАКТЕРИАЛЬНЫХ МЕМБРАН
© 2021 г. О.Д. Новикова*, Г.А. Набережных*, А.А. Сергеев**
*Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН,
690022, Владивосток, просп. 100 лет Владивостоку, 159
**Институт автоматики и процессов управления ДВО РАН 690041, Владивосток, ул. Радио, 5
E-mail: novolga_05@mail.ru
Поступила в редакцию 26.11.2020 г.
После доработки 22.04.2021 г.
Принята к публикации 26.04.2021 г.
Белковые молекулы обладают уникальным свойством передачи материала и/или информации че-
рез непроницаемый барьер, которым является липидный бислой. Эта своеобразная роль клеточных
«привратников» особенно интересна для целей нанобиотехнологии, поскольку мембранные белки
могут с успехом использоваться для связи между двумя различными средами, разделенными липид-
ным бислоем. В настоящем обзоре описаны структурные особенности и свойства трансмембранных
белков как наиболее перспективных компонентов современных биосенсорных устройств. Приведе-
ны также методы формирования липидных бислоев, прикрепленных к твердой поверхности, и спо-
собы получения жесткой белковой «арматуры», которые позволяют реконструировать и сохранять
используемые белки в функционально активной конформации по отношению к широкому спектру
определяемых аналитов. Высокая селективность и специфичность белковых молекул в распознава-
нии рецепторов или лигандов делает их незаменимыми для биомедицинского анализа и молекуляр-
ной диагностики.
Ключевые слова: наноструктурные биосенсоры, трансмембранные белки, липидный бислой.
DOI: 10.31857/S0006302921040062
Авторы многих обзоров, затрагивающих са-
вится меньше 20 нм. При таких размерах проис-
мые различные аспекты формирования, свойств
ходит существенное изменение физико-
и применения наноструктурных материалов, все-
химических свойств исходного «объемного» со-
го лишь десятилетие назад считали, что нанотех-
единения (bulkmaterial), что отражается на обу-
нологии находятся в начальной стадии развития,
словленных поведением электронов свойствах
поскольку основные открытия, предсказанные в
материала, в первую очередь оптических, магнит-
этой области, еще не были сделаны [1, 2]. Однако
ных и электрических [8]. Благодаря такому раз-
исследования, проводимые в последние несколь-
мерно-зависимому проявлению физических
ко лет, уже дали практические результаты. В на-
свойств и их нетипичности по сравнению со
стоящее время достижения передовых научных
свойствами атомов, с одной стороны, и макро-
разработок в области нанотехнологий успешно
скопических тел, с другой стороны, наночастицы
применяются к решению задач медицины, фар-
выделяют в отдельную, промежуточную область и
мацевтической промышленности и военной от-
нередко называют «искусственными атомами».
расли, что позволяет отнести их к новым и про-
грессивным технологиям современности и самым
С точки зрения биосенсорики наибольший
наукоемким отраслям промышленности [3-7].
интерес представляет еще одна отличительная
Согласно общепринятым определениям к на-
черта наночастиц от объемного материала - зна-
нотехнологиям относят области науки и техники,
чительная доля атомов на поверхности частицы
которые заняты конструированием, характери-
по отношению к объему. Нетрудно посчитать, что
стикой, производством и применением структур,
при среднем размере атома, равном 0.1 нм (1 анг-
приборов и систем, свойства которых определя-
стрем), у частицы размером 10 нм больше поло-
ются их формой и размером на нанометровом
вины атомов от их общего числа будет находиться
уровне. Наиболее интересные эффекты возника-
на поверхности. Это приводит к существенной
ют при переходе наночастиц в квантово-размер-
зависимости физико-химических свойств нано-
ное состояние, когда величина их радиуса стано-
частицы от состояния ее поверхности, что обу-
668
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ
669
словливает широкие возможности для создания
БЕЛКИ И ЛИПИДЫ - КОНСТРУКТИВНЫЕ
сенсорных систем различного рода.
ЭЛЕМЕНТЫ БИОСЕНСОРОВ
Использование белковых структур для созда-
Мембранные белки - перспективные кандидаты
ния биосенсоров несет в себе значительные пер-
для создания биологических нанопор. Белки пред-
спективы широкого применения подобных нано-
ставляют собой широко распространенный в
конструкций в жизнедеятельности человека, что
природе класс высокомолекулярных органиче-
подтверждается все возрастающим количеством
ских соединений. Они состоят из альфа-амино-
работ в данной области [9-12]. В настоящее вре-
кислот, соединенных в полипептидную цепь пеп-
мя этот класс природных биополимеров наиболее
тидной связью. Эффективность бионанотехноло-
изучен, по этой причине многие исследователи
гических разработок на основе белков
при конструировании биоматриц нанометрового
обусловлена уникальными свойствами этих при-
размера отдают предпочтение работе с белками.
родных биополимеров, которые способны к са-
При создании нанокомпозитных биосенсоров
мому сложному из известных самопроизвольно-
типа «неорганическое ядро/органическая обо-
му фолдингу, могут точно распознавать огром-
лочка» на основе белковых молекул наиболее рас-
ный круг мишеней и взаимодействовать с ними и,
пространенным способом функционализации
наконец, имеют широкий диапазон собственной
поверхности наночастиц (неорганического ядра)
каталитической активности [16]. Начало новой
является использование тиольных и карбоксиль-
эры в инженерии мембранных белков произошло
ных групп белка [13]. С одной стороны, это обес-
благодаря детальному изучению их структуры,
печивает долговременную стабильность частиц,
лучшему пониманию молекулярных механизмов
препятствуя их агрегации, а с другой - позволяет
трансмембранной диффузии, методическим и
повысить совместимость неорганических частиц с
техническим достижениям в области рефолдинга
живыми тканями и в перспективе получать in vivo
мембранных белков, а также применению усо-
биосенсоры для экспресс-анализа крови и других
вершенствованных вычислительных подходов,
биологических жидкостей. Данные исследования
разработанных для растворимых белков [17]. Ре-
очень актуальны, поскольку проблема совмести-
шающим фактором в этом процессе стало полу-
мости разрабатываемых биосенсоров с живыми
чение кристаллов различных мембранных белков
организмами до сих пор не решена [14] и боль-
и расшифровка их атомной структуры, что позво-
шинство биосенсоров типа «неорганическое яд-
лило определить в деталях механизмы передачи
ро/органическое оболочка» так и остаются на
сигналов через биологические мембраны.
стадии исследований in vitro. В этой связи в насто-
ящее время ведется активный поиск новых типов
Исследования биологических мембран дали
архитектур биосенсоров, обладающих всеми до-
новый скачок в развитии технологий получения
стоинствами in vitro сенсоров, но позволяющих
искусственных мембран или, другими словами,
проводить измерения непосредственно в живых
нанопор из природных биополимеров. В настоя-
системах [15]. В частности, в литературе имеются
щее время при создании биологических нанопор
данные о применении квантовых точек в качестве
внимание исследователей в значительной степе-
новых флуоресцентных наноматериалов для био-
ни сосредоточено на порообразующих токсинах и
медицинского зондирования и визуализации [14,
белках наружной мембраны бактерий, поскольку
15]. По мнению авторов данного обзора, наиболее
они имеют прочную β-баррельную структуру, что
перспективным кандидатом для создания сен-
делает их удобным объектом для нанотехнологии.
сорных систем такого рода является один из ос-
Белки этого класса, так называемые порины,
новных компонентов бактериальных мембран, а
имеют обширные неполярные взаимодействия с
именно трансмембранные белки. Чтобы опреде-
гидрофобным ядром бислоя благодаря тому, что
лить активность такого белка в определенных
значительная доля их полипептидной цепи по-
условиях, его нужно интегрировать в искусствен-
гружена в липидный бислой (как минимум, один
ные липидные бислои, иммобилизованные на
трансмембранный домен). Они выполняют ши-
твердой поверхности. Это достигается примене-
рокий спектр важных биологических функций,
нием методов структурирования поверхностей в
включая специфический и неспецифический
микро- и нанометровом масштабе, химической
транспорт растворенных веществ и ионов (насо-
модификации и анализа, формирования липид-
сы, транспортеры и каналы), выработку энергии
ного бислоя, экспрессии белков, очистки их и со-
(АТФ-синтазы), передачу сигнала (рецепторы),
любилизации и, что наиболее важно, интеграции
осмотическую регуляцию (порины), мембрано-
белка в сконструированные липидные бислои.
связанные биохимические процессы (киназы,
Таким образом, изготовление биосенсоров требу-
протеазы). Многие из этих функций включают
ет комплексного подхода, основанного на знани-
передачу материала и/или информации через не-
ях в области материаловедения, поверхностной и
проницаемый барьер, которым является липид-
аналитической химии, молекулярной биологии и
ный бислой. Эта уникальная роль клеточных
биотехнологии.
«привратников» особенно интересна для целей
БИОФИЗИКА том 66
№ 4
2021
670
НОВИКОВА и др.
Рис. 1. Пространственная структура OmpF порина Y. pseudotuberculosis в виде ленточной диаграммы ([21], с изменени-
ями). (а) - Мономер порина (вид сверху и вид сбоку); β-стрэнды представлены в виде лент; линиями, соединяющими
β-стрэнды показаны внешние петли и изгибы. (б) - Тример порина; двумя параллельными линиями ограничена
трансмембранная область барреля.
нанобиотехнологии, поскольку мембранные бел-
щью различных стробирующих механизмов,
ки могут с успехом использоваться для связи
представляющих собой переключение между за-
между двумя различными средами, разделенны-
крытым и открытым состоянием поры в ответ на
ми липидным бислоем [18].
специфические стимулы, такие как связывание
лиганда (ионные каналы, управляемые лиган-
Особое место среди перспективных кандида-
дом), изменение трансмембранного напряжения
тов для конструирования биологических нанопор
(управляемые напряжением ионные каналы) или
занимают каналы неспецифических порообразу-
механическая сила (механозависимые ионные
ющих белков наружной мембраны грамотрица-
каналы). Использование нанопор в биомедицин-
тельных бактерий, обеспечивающих транспорт
ской молекулярной диагностике предпочтитель-
низкомолекулярных веществ через бактериаль-
но из-за их высокой селективности и специфич-
ную мембрану [19]. Порины принадлежат к β-бар-
ности белковой молекулы в распознавании ре-
рельным интегральным мембранным белкам, об-
цептора-лиганда. Кроме того, одним из основных
разующим в нативной мембране олигомерные
преимуществ использования белковых нанопор
структуры (чаще всего тримеры). Они состоят из
является знание их точной структуры при атом-
антипараллельных амфифильных β-стрэндов (тя-
ном разрешении, что предполагает возможность
жей), гидрофобные остатки аминокислот кото-
внедрения функциональных групп на стратегиче-
рых экспонированы в липидный бислой, а гидро-
ских позициях внутри канала.
фильные - во внутреннюю часть барреля [20]. Ра-
нее методом гомологичного моделирования нами
Технологический потенциал многих мембран-
были построены теоретические модели мономера
ных белков можно исследовать только in vitro. Это
и тримера OmpF порина из наружной мембраны
требует высокой концентрации белков, что пред-
Yersinia pseudotuberculosis (рис. 1). Кристалличе-
полагает получение их при сверхэкспрессии в виде
ская структура PhoE порина из Escherichia coli бы-
рекомбинантных белков в E. coli с использованием
ла использована в качестве матрицы [21].
векторных плазмид и последующую очистку (на-
Амфифильная природа молекул поринов поз-
пример, путем введения гистидиновой метки и ис-
воляет им легко встраиваться в липидный бислой
пользования никель-аффинной хроматографии).
[22]. В присутствии фосфолипидов порины в ре-
Кроме того, учитывая достаточно высокую степень
зультате белок-белкового взаимодействия могут
гидрофобности интегральных мембранных бел-
самопроизвольно формировать наноструктуры
ков, для предотвращения их неспецифической аг-
[23]. Выбор детергента и липида имеет большое
регации при извлечении из мембраны требуется
значение для получения двумерных кристаллов
использование детергентов. Как правило, экспрес-
порообразующих белков, при этом химическая
сия рекомбинантного белка приводит к образова-
структура указанных компонентов определяет
нию нерастворимых агрегатов (телец включения) в
параметры упорядоченных белковых структур
цитоплазме, где интересующий белок в «правиль-
[24-26]. Нанопоры на основе белков ионных ка-
ной» конформации содержится в виде отдельной
налов представляют собой новую альтернативу
фракции, небольшой по содержанию. Все эти
современным аналитическим устройствам [27,
трудности обычно приводят к низкому выходу це-
28]. Они могут регулировать поток ионов с помо-
левого белка. Далее, чтобы определить активность
БИОФИЗИКА том 66
№ 4
2021
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ
671
Рис. 2. Методы, используемые для сборки липидных мембран на на твердых носителях: (a) - слияние везикул (1-3);
(б) - метод Ленгмюра-Блоджетт (1-3); (в) - наслаивание липидов из растворов или из смешанных мицелл липидов
с детергентами (1, 2) ([38], с изменениями).
полученного белка при заданных условиях, он дол-
природных фосфолипидных бислоев были опти-
жен быть интегрирован в искусственные липид-
мизированы для изучения функциональных
ные бислои, в том числе иммобилизованные на
свойств интегральных белков. Однако подобные
твердых носителях. Известно, что в протеолипосо-
мембраны часто неприменимы в технических
мах многие мембранные белки достаточно ста-
процессах из-за их высокой текучести и отсут-
бильны и их функциональная активность может
ствия долговременной стабильности [34]. За-
быть надежно зафиксирована [29]. Например, ак-
крепление липидов посредством ковалентной
тивность белка-транспортера при микроскопиче-
или квазиковалентной связи кажется привлека-
ских исследованиях может быть определена путем
тельным решением проблемы иммобилизации
измерения поглощения окрашенного транспорти-
мембраны, однако поддержание латеральной по-
руемого вещества (аналита) с помощью спектро-
движности и достаточного расстояния между
метра [30] путем количественного определения пе-
твердой подложкой и поверхностью, обращенной
реносимого в протеолипосомы красителя [31] или
к мембране, желательно, если не существенно для
с помощью электрохимических измерений [32].
функционирования липидного бислоя как мат-
Обнаружение аналита с помощью электрохимиче-
рицы для реконструкции белков. Разрешение
ских методов может быть осуществлено относи-
этого кажущегося противоречия - одна из ключе-
тельно просто и с высокой чувствительностью, а
вых задач при изготовлении мембран.
электроды могут быть легко интегрированы в дат-
Предпосылкой для правильного функциони-
чик устройства. Однако разработка практических
рования биосенсоров на основе мембранных бел-
методик приготовления планарных липидных бис-
ков является формирование прикрепленных к
лоев на поверхности остается сложной научно-ис-
подложке липидных бислоев, которые позволяют
следовательской задачей даже после более чем два-
реконструировать используемые белки в функци-
дцати лет исследований [33]. Для конструирования
онально активной конформации [35]. В зависи-
нанопор необходимы техники структурирования
мости от выбранных липидов и поддерживающих
поверхности в микро- и нанометровом масштабе,
поверхностей плоские липидные бислои на твер-
надежные способы формирования липидного бис-
дых субстратах могут быть получены самыми раз-
лоя и интеграции в них белков, а при необходимо-
нообразными способами и на различных нано-
сти химическая модификация встроенных белко-
структурированных поверхностях [36]. На рис. 2
вых молекул [33].
схематически показаны различные подходы к
Значение липидной составляющей биосенсоров.
формированию липидных бислоев, закреплен-
Закрепленные бислои. Липидные бислои являют-
ных на твердых носителях: образование бислоя
ся природными барьерами для биологических
может быть достигнуто с помощью хемосорбции,
клеток и клеточных компартментов. При этом
самосборки, метода Ленгмюра-Блоджетт [37].
окружающая среда существенно влияет на про-
При самосборке посредством слияния
странственную структуру и функцию многих
(рис. 2а) однослойные липидные везикулы раз-
трансмембранных белков. Именно это свойство
рываются при контакте с поверхностью и образу-
мембран необходимо учитывать при разработке
ют поддерживаемую липидную мембрану, по-
биосенсоров, систем доставки лекарств и нано-
крывающую поверхность раздела. На некоторых
контейнеров. В результате многочисленных ис-
гидрофильных субстратах (например, оксиде или
следований химические и физические свойства
нитриде кремния) образование плоских бислоев
БИОФИЗИКА том 66
№ 4
2021
672
НОВИКОВА и др.
происходит самопроизвольно в результате слия-
ваемых поддерживаемых планарных липидных
ния везикул. На гидрофобных поверхностях (на-
бислоев (s-BLM) на различных металлических
пример, предварительно сформированных тиол-
поверхностях, таких как платина, золото или се-
алкильных монослоях) вместо бислоев из липид-
ребро, показали, что золото идеально подходит
ных везикул образуются липидные монослои.
для формирования высокоориентированных ли-
Технология Ленгмюра-Блоджетт (рис. 2б) за-
пидных бислоев [42-45].
ключается в переносе сформированного на вод-
Прикрепленные (поддерживаемые) мембра-
ной поверхности мономолекулярного слоя амфи-
ны, сформированные на золотых поверхностях,
фильного вещества или мультимолекулярных
могут быть классифицированы в соответствии с
пленок на твердую подложку. Липидный моно-
их архитектурой: гибридные бислои, состоящие
слой удерживается при определенном натяжении
из липидного монослоя на гидрофобной подлож-
на границе раздела фаз, что обеспечивает плот-
ке и второго слоя поверх него (1); липидные бис-
ность упаковки липидов. При формировании
лои на гидрофильной или заряженной поверхно-
плоского липидного бислоя из смешанных ми-
сти (2); ковалентно заякоренные липидные бис-
целл липид-детергент (рис. 2в, 1) липидный мате-
лои на гидрофильной поверхности (3).
риал перемещается из водного раствора на твер-
Помимо золота еще одной часто используемой
дую поверхность раздела. С помощью диализа де-
поверхностью является кремний, так как этот ма-
тергент постепенно удаляется из мицелл, что
териал совместим с большинством преобразова-
приводит к разрушению мицелл и образованию
телей поверхности в биосенсорных устройствах.
бислоя на границе раздела фаз. При образовании
Так, описана подготовка поверхности оксида
бислоя на границе раздела «субстрат-водный
кремния с помощью модификации декстраном
раствор» растворенные в органическом раствори-
(слой порядка 100 нм), которая может служить
теле липиды добавляют к поверхности, находя-
основой для нанесения бислоя комбинацией двух
щейся в водной фазе. Амфифильные липиды вы-
методов - ковалентной связи с термически окис-
равниваются на границе раздела фаз, а затем при
ленной поверхностью оксида кремния путем
испарении растворителя сливаются, образуя бис-
эпоксидирования или аминосиланизации [46].
лой (рис. 2в, 2).
Для получения биомиметических мембран,
В качестве твердых субстратов, поддерживаю-
обеспечивающих естественную биологическую
щих липидный бислой, используются различные
среду для интегрированных в них мембранных
материалы. Вполне эффективными для этих це-
белков, разрабатываются и такие подходы, как
лей оказались такие носители, как слюда, стекло,
использование блок-сополимеров [12] или даже
полупроводники и диэлектрики (например, ок-
полная замена фосфолипидов на амфифильные
сиды индия, олова или кремния), а также различ-
блочные полимеры. Подобные синтетические
ные металлические поверхности (золото или пла-
мембраны обладают механической прочностью, в
тина). Следует учитывать, что свойства твердой
десять раз большей, чем фосфолипидные бислои
подложки определяют стратегию формирования
[47].
бислоев. На практике изготовление бислоев с по-
Примером может служить работа, в которой
мощью метода Ленгмюра-Блоджетт проще, а ме-
авторы использовали гибридные мембраны из со-
тоды самосборки более универсальны [37].
полимерных блоков поли(1,4-изопрен-этиленок-
В работе [39] было впервые показано, что ад-
сида), смешанных с 1,2-дифтитаноил-sn-глице-
сорбция и распределение везикул на стекле позво-
ро-3-фосфохолином [12]. Встраивая белок OmpF
ляют получать плоские липидные бислои, сохра-
наружной мембраны E. coli в эти мембраны, они
няющие латеральную подвижность липидов, и
продемонстрировали, что функциональность
формировать иммобилизованные планарные ли-
этого порина в биомиметических липополимер-
пидные бислои на полимерной основе, образован-
ных мембранах сохраняется независимо от моле-
ной 1,2-димиристоил-sn-глицеро-3-фосфоэтанол-
кулярной массы блок-сополимеров. Таким обра-
аминполиэтиленгликольтриэтоксисиланом
[40].
зом, авторы показали, что смешивание синтети-
Для получения положительно заряженных бислоев
ческих полимерных мембран с фосфолипидами,
были успешно использованы полимеры на основе
независимо от толщины полученной мембраны,
производных целлюлозы, нанесенные на поверх-
позволяет осуществлять реконструкцию транс-
ность полупроводникового материала, оксида ин-
мембранных белков с сохранением их функции.
дия-олова (indium tin oxide), функционализиро-
Таким образом, синтетические амфифильные
ванного октадецилтрихлорсиланом [41].
липиды и полимеры самоорганизуются в водном
Очевидно, что для применения электрохими-
растворе либо в плоские мембраны, либо в вези-
ческих методов необходима электропроводность
кулы. Усовершенствование методов самосборки
используемой твердой поверхности. Исследова-
липидных мембран и включения в них протеинов
ния, проведенные различными научными груп-
привели к значительному повышению стабиль-
пами по паттернизации и применению так назы-
ности мембраны и упаковки белковых молекул,
БИОФИЗИКА том 66
№ 4
2021
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ
673
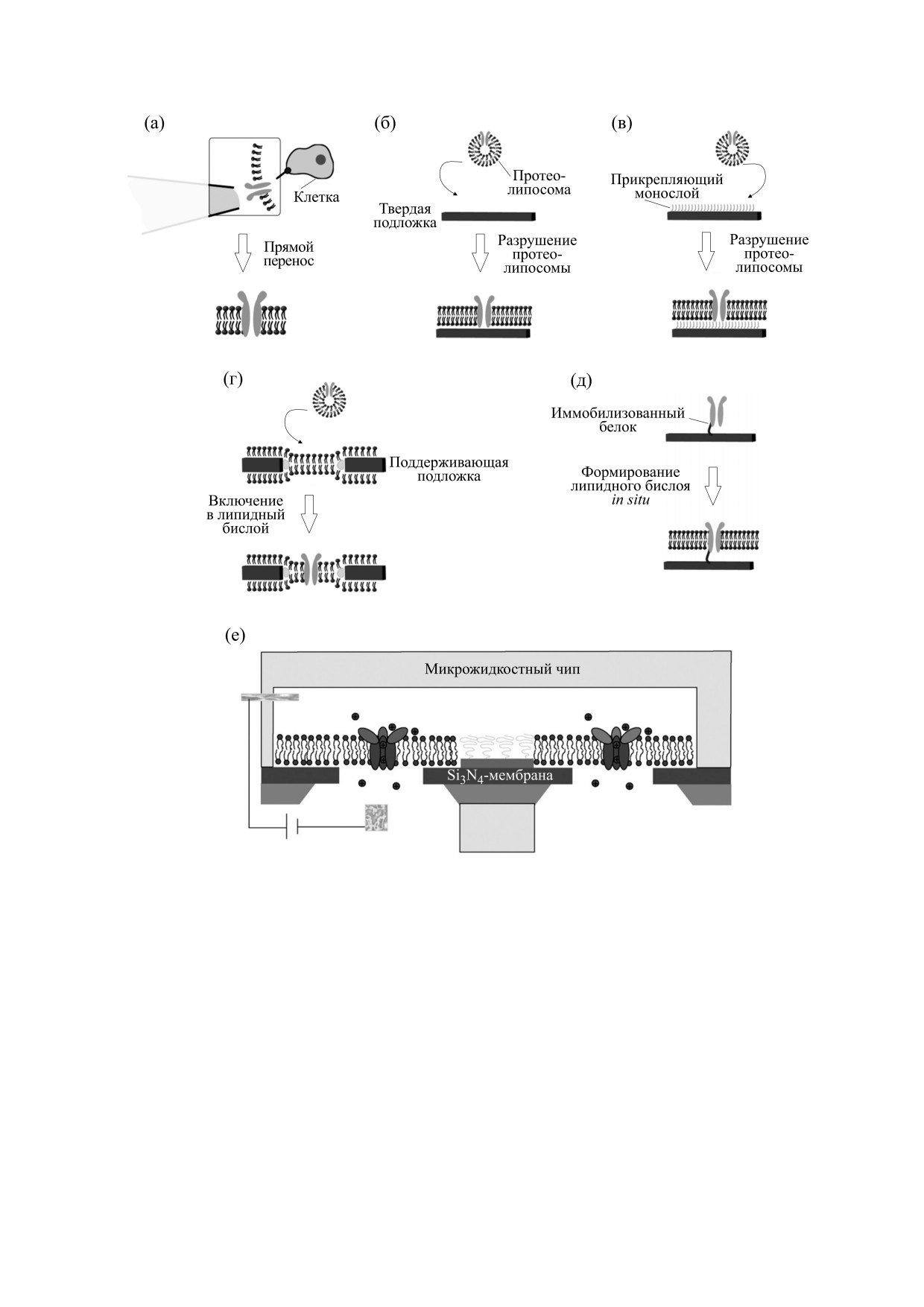
Рис. 3. Методы реконструкции трансмембранных белков в липидные бислои ([33], с изменениями). Описание
способов включения исследуемого белка приведено в тексте.
что, соответственно, способствовало улучшению
только свойства мембраны, но и взаимодействие
чувствительности измерений. Липидный бислой
с используемым интегральным белком, для кон-
в виде суспензии (известный также как свобод-
струирования биосенсора требуются экспери-
ментальные установки с различными липидными
ный липидный бислой) разделяет на платформе
композициями [48].
цис- и транс-стороны водных растворов электро-
литов и становится единственным путем для про-
Методы иммобилизации белков. Существуют
хождения молекул между двумя водными фазами,
различные способы интеграции мембранных бел-
разделенными бислоем. Иными словами, двух-
ков в предварительно сформированный липид-
слойная липидная мембрана образует мост между
ный бислой [33] (рис. 3).
встроенными белками и компонентами устрой-
Белок можно напрямую вносить в липидный
ства. Поскольку липидный состав определяет не бислой в виде участка клеточной мембраны с по-
БИОФИЗИКА том 66
№ 4
2021
674
НОВИКОВА и др.
мощью стеклянной пипетки с маленьким отвер-
не приводит к формированию достаточно протя-
стием (рис. 3а). Во многих экспериментах ис-
женных участков пориновых наночастиц. Наибо-
пользуются протеолипосомы, содержащие иссле-
лее эффективное встраивание порина в липид-
дуемый белок. При соприкосновении c твердой
ный бислой было достигнуто при использовании
подложкой протеолипосомы могут разрушаться и
белка в комплексе с пептидогликаном и липопо-
«растекаться» на чистых твердых поверхностях
лисахаридом, с которыми порин тесно связан в
(рис. 3б) или на химически модифицированных
нативной бактериальной мембране [50].
поверхностях (рис. 3в). Другим вариантом рекон-
Несмотря на преимущества белковых нано-
струкции белка в виде протеолипосом может
структур и успешные примеры их создания, од-
быть его включение в предварительно сформиро-
ним из постоянных ограничений является отсут-
ванный липидный бислой, перекрывающий пору
ствие методологии для получения жесткой белко-
(рис. 3г). Для ориентированной иммобилизации
вой
«арматуры», которая сохраняет свою
мембранного белка на поверхности используется
функциональность в широком спектре условий
His-метка, а на следующем этапе формируется
окружающей среды. Это требование может быть
липидный бислой (рис. 3д). Гигантские одно-
выполнено путем регулирования с нанометровой
слойные везикулы, если они расположены над
точностью взаимодействия реконструируемых в
порой, спонтанно разрываются, в результате чего
липидный бислой белков с твердым носителем.
образуются липидные бислои, закрывающие по-
Успешным подходом в этом контексте может
ру (рис. 3е).
стать использование структурных мотивов моле-
Как следует из вариантов реконструкции бел-
кулы белка в качестве стабильных каркасов для
ка, представленных на рис. 3, он может быть
связывания с подложкой, которые путем подхо-
включен в липидный бислой, сформированный
дящих мутаций, делеций, вставок или слияний
не только на твердой поверхности (рис. 3б, в, д),
создают белковые структуры с желаемыми новы-
но и в липидный бислой, покрывающий пору
ми функциями [51, 52].
(рис. 3а, г, е). В литературе встречается описание
Cуществуют три основных типа связывания
формирования двухслойных липидных мембран
белков с твердой подложкой:
на небольших отверстиях (диаметром 60 нм) на
- физическая адсорбция, основанная на элек-
высокоупорядоченной подложке из пористого
тростатических и гидрофобных взаимодействиях
оксида алюминия [49]. После нанесения липид-
[53, 54];
ных бислоев реконструкцию и ионопроводящие
свойства белка наружной мембраны E. coli OmpF
- ковалентное связывание, примером которо-
контролировали с помощью одноканальных за-
го может служить взаимодействие поверхности
писей. Наблюдали характерные состояния про-
золота, предварительно обработанного соответ-
водимости трех мономеров, быструю кинетику и
ствующими реагентами, с сульфгидрильными
состояния субпроводимости. Блокировка потока
или аминогруппами белка [55, 56];
ионов в результате взаимодействия просвета по-
- биоспецифическое связывание, например,
ры с антибиотиком ампициллином указывала на
такого рода, как взаимодействие ДНК-белок или
полную функциональность белкового канала
антиген-антитело [57].
в двухслойных мембранах нанометрового мас-
Физическая адсорбция белка на твердой по-
штаба.
верхности, например за счет электростатических
Авторы настоящего обзора изучили формиро-
взаимодействий, является весьма привлекатель-
вание упорядоченных наноструктур порина
ным методом из-за простоты исполнения. Такие
OmpF из наружной мембраны Yersinia pseudotu-
взаимодействия обычно обратимы, но вполне на-
berculosis двумя методами: из протеолипосом и
дежны.
прямой реконструкцией белка в фосфолипидный
Иммобилизация белков на нанопористых,
бислой, предварительно нанесенный на поверх-
толстых (8 мкм) пленках диоксида титана (TiO2)
ность слюды
[50]. Морфологию полученных
является чрезвычайно стабильной, что объясня-
структур анализировали с помощью атомно-си-
ется вторичными процессами связывания, про-
ловой микроскопии. Показано, что эффектив-
исходящими после начальной иммобилизации
ность формирования, степень однородности и
[58]. Авторы подробно изучили факторы, влияю-
размер доменов порина существенным образом
щие на адсорбцию белка на TiO2: исследовали pH
зависят от условий эксперимента. Обнаружено,
среды, ионную силу раствора, поверхностный за-
что полученные из протеолипосом единичные
ряд белка, размер белка и время иммобилизации.
домены агрегированных молекул порина имели
неравномерное распределение в бислое и боль-
Многообещающей стратегией для образова-
шой разброс в диаметре (20-100 нм). При прямой
ния гибридных биоконъюгатов является связыва-
реконструкции порина показано, что снижение
ние белковых молекул, модифицированных по-
рН солюбилизирующего буфера способствует
лигистидином, с неорганическими нанокристал-
включению большего количества белка, однако
лами за счет сродства к металлу. Метод очень
БИОФИЗИКА том 66
№ 4
2021
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ
675
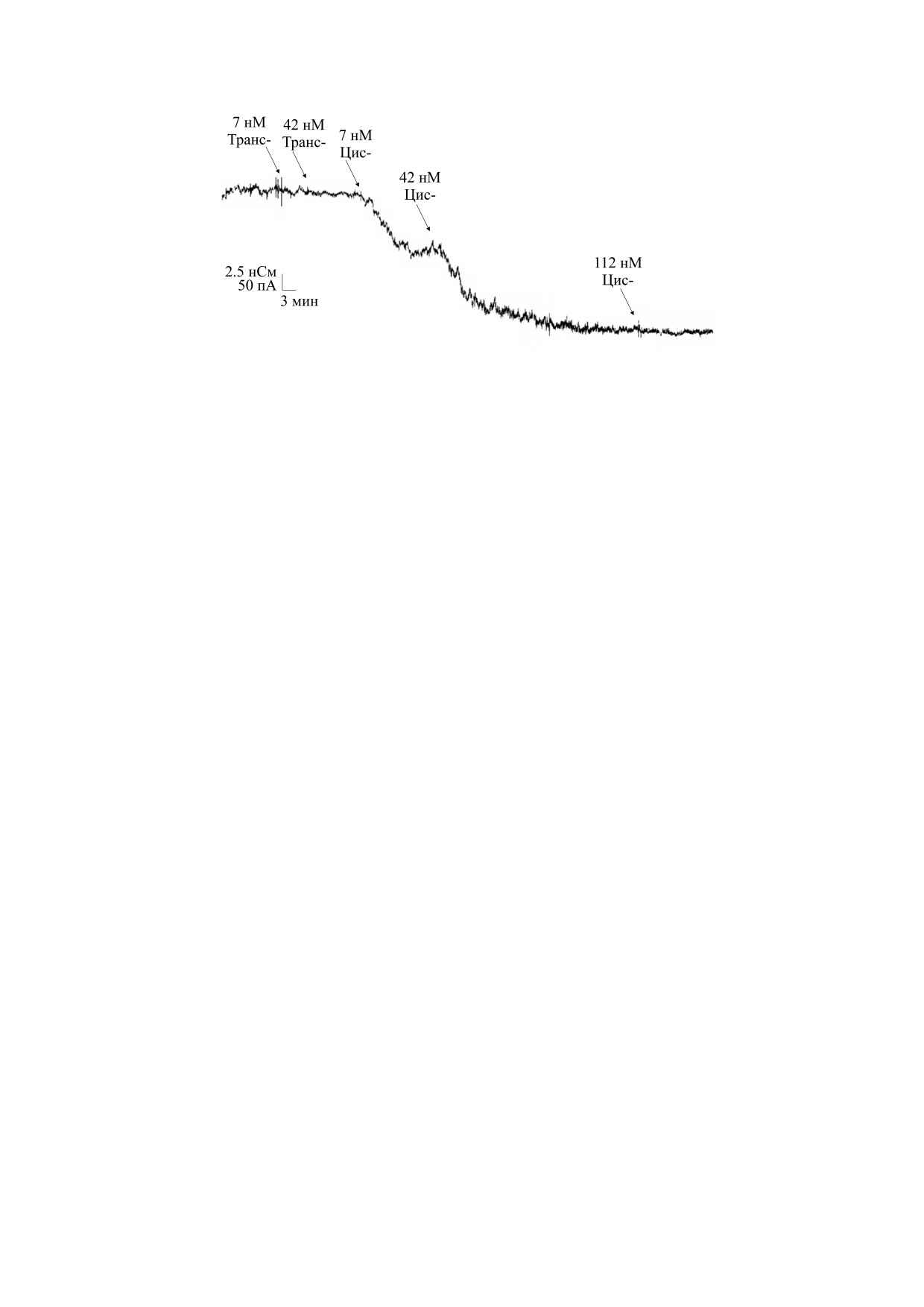
Рис. 4. Типичные записи ионного тока через тримерный трансмембранный белок мальтопорин в присутствии моди-
фицированной мальтогексозы ([61], с изменениями).
прост в реализации, поскольку белки и пептиды,
исходящие при взаимодействии с аналитом, фик-
меченные полигистидином, обычно получают с
сируются с помощью электрофизиологических
использованием хорошо известных методов мо-
методов как активация, ингибирование или мо-
лекулярной инженерии. В работе [55] сообщается
дуляция проводимости канала.
об использовании мутанта OmpF-E183C, в кото-
На примере одного из специфических пори-
рый был введен единственный цистеин на корот-
нов наружной мембраны бактерий E. coli, мальто-
ком периплазматическом витке. OmpF-E183C
порина (LamB порин), образующего канал для
связывается непосредственно с золотыми по-
поглощения мальтодекстрина, изучено его спе-
верхностями и создает белковые слои высокой
цифическое связывание с бактериофагом лямбда
плотности путем самосборки из раствора детер-
(фаг λ, Escherichia virus Lambda) [61]. Для выясне-
гента. Когда поверхность золота предварительно
ния механизма связывания авторы реконструи-
обрабатывали β-меркаптоэтанолом и добавляли
ровали мальтопорин в плоские липидные мем-
тиолипиды после стадии иммобилизации белка,
браны и исследовали его чувствительность с по-
по данным ИК-спектроскопии он сохранял свою
мощью внешнего трансмембранного потенциала.
β-структуру. В работе [56] авторы исследовали са-
Вначале авторы реконструировали около 300 ка-
мосборку двух сконструированных белков
-
налов мальтопорина в растворителе, содержащем
мальтозосвязывающего белка с присоединенным
плоский липидный бислой, и наблюдали ста-
His7 (MBP-His) и флуоресцентного белка mCher-
бильную проводимость. Введение гибридного
ry с концевым His6, осуществляемую за счет срод-
белка MBP-gpJ из бактериального вируса лямбда
ства к металлу, на золотых наночастицах (AuNP).
(в концентрации 7 и 42 нМ) в компартмент, соот-
Для тестирования самосборки AuNP-MPB-His7
ветствующей внутриклеточной стороне канала,
использовали аффинную гель-хроматографию, в
не вызвало никакого эффекта. Однако введение
то время как связывание NP-mCherry-His6 оце-
белка с противоположной стороны, соответству-
нивали с помощью измерения флуоресценции.
ющей внеклеточной стороне, вызывало значи-
Таким образом, применяя различные методы,
тельное снижение ионной проводимости (рис. 4).
разработанные на сегодняшний день, с помощью
Поскольку размеры канала не превышают не-
плоских мембран и везикул можно создать уни-
скольких ангстрем, молекулярные взаимодей-
версальные биосенсорные платформы для ряда
ствия со стенкой канала отражают связывание
инженерных приложений [38, 59, 60].
субстрата, приводящее к конформационным из-
менениям белка. С помощью этой модели авторы
смогли продемонстрировать асимметрию связы-
ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ
вания бактериального фага лямбда с его мальто-
КАНАЛООБРАЗУЮЩИХ МЕМБРАННЫХ
пориновым рецептором [61].
БЕЛКОВ В БИОСЕНСОРНЫХ
Обнаружено, что канал неспецифического по-
УСТРОЙСТВАХ
рина OmpF, предназначенный для пассивной
В литературе описан целый ряд примеров изу-
диффузии через наружную мембрану E. coli, явля-
чения функциональных свойств и создания био-
ется основным путем проникновения β-лактам-
сенсоров на основе различных белков [61-69].
ных антибиотиков. С помощью записи высокого
Конкретные изменения конформации мембран-
разрешения проводимости тока через мембрану
ного белка, существенные или небольшие, про-
авторам удалось зафиксировать продвижение от-
БИОФИЗИКА том 66
№ 4
2021
676
НОВИКОВА и др.
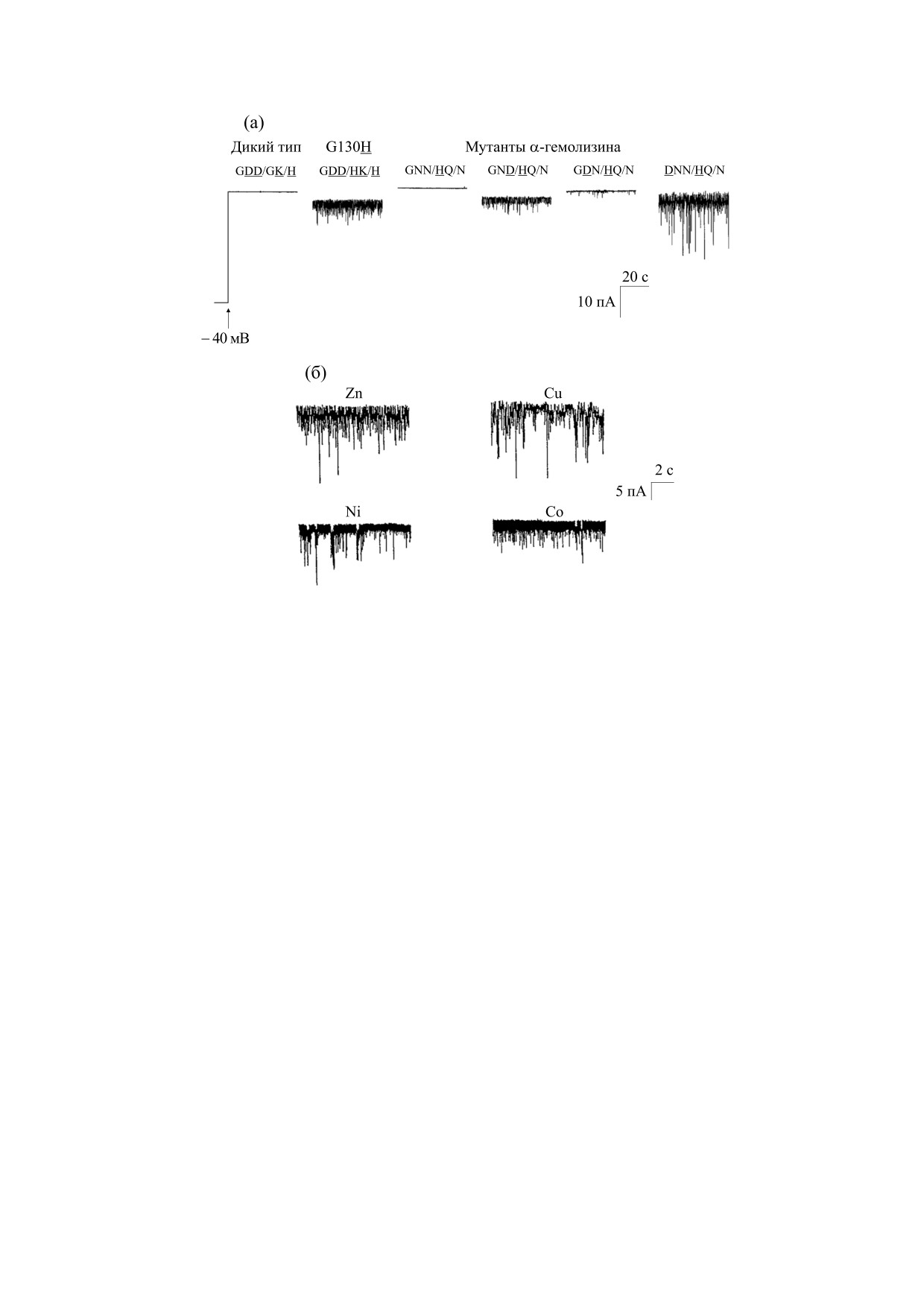
Рис. 5. Записи тока одиночного гетеромерного канала альфа-гемолизина (αHL), содержащего сайт связывания ионов
цинка (Zn (ll) ([64], с изменениями). (а) - Одноканальные записи генно-инженерных мутантов αHL. Концентрация
Zn (II) в транс-камере равна 1 мМ. (б) - Флуктуации тока одиночных каналов, образованных мутантом αHL (G130H)
в зависимости от типа двухвалентного катиона, добавляемого в транс-камеру.
дельных молекул ампициллина. Анализ распре-
исходной молекулы (включая ее структурный ди-
деления зарядов внутри канала и на молекуле ам-
зайн). В качестве примера можно привести спо-
пициллина, выполненный методом молекуляр-
соб получения гетеромерной формы альфа-гемо-
ного моделирования, показал, что ампициллин и
лизина (αHL), бактериального порообразующего
некоторые другие эффективные пенициллины и
белка стафилококка, в котором одна из семи
цефалоспорины взаимодействуют с аминокис-
субъединиц содержит сайт связывания для двух-
лотными остатками в зоне сужения канала OmpF
валентных металлов, М(II) [64]. Чтобы опреде-
[62].
лить, какие остатки составляют сайт связывания
В работе [63] описано важное свойство транс-
иона металла, авторы изучили влияние катионов
мембранного OmpF-порина как рецептора анти-
двухвалентных металлов на одноканальные токи
бактериального токсина колицина N и показана
нескольких точечных мутантов по гистидину, из-
принципиальная возможность использования
менив количество и расположение ионизируе-
его для обнаружения этого аналита. В этом случае
мых боковых цепей в выбранных местах последо-
плоский липидный бислой с помощью тиолипи-
вательности белка от 126 до 144 остатка. Таким
дов иммобилизовали на золотой подложке с гид-
образом, они определили остатки, входящие в со-
рофильными этиленгликолевыми спейсерами и
став сайта связывания двухвалентных ионов ме-
использовали в качестве электрода, что обеспечи-
талла. Ионы Zn(II) в наномолярной концентра-
вало регистрацию лиганд-стробирующей функ-
ции служили прототипом аналита, модулируя
ции канала OmpF. Связывание домена колицина
проводимость одиночного канала гетеромера в
N, наблюдаемое с помощью поверхностного
плоской бислойной мембране (рис. 5а). Обнару-
плазмонного резонанса, индуцировало блокиро-
жено, что флуктуации тока, для одиночных кана-
вание канала [63].
лов, образованных мутантом αHL G130H, зависят
Отличительной особенностью применения
от типа двухвалентного катиона, добавляемого в
белковых комплексов в биосенсорике является
транс-камеру (рис. 5б). Например, присутствие
возможность целевой химической модификации
ионов цинка вызывает множество быстрых бло-
БИОФИЗИКА том 66
№ 4
2021
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ
677
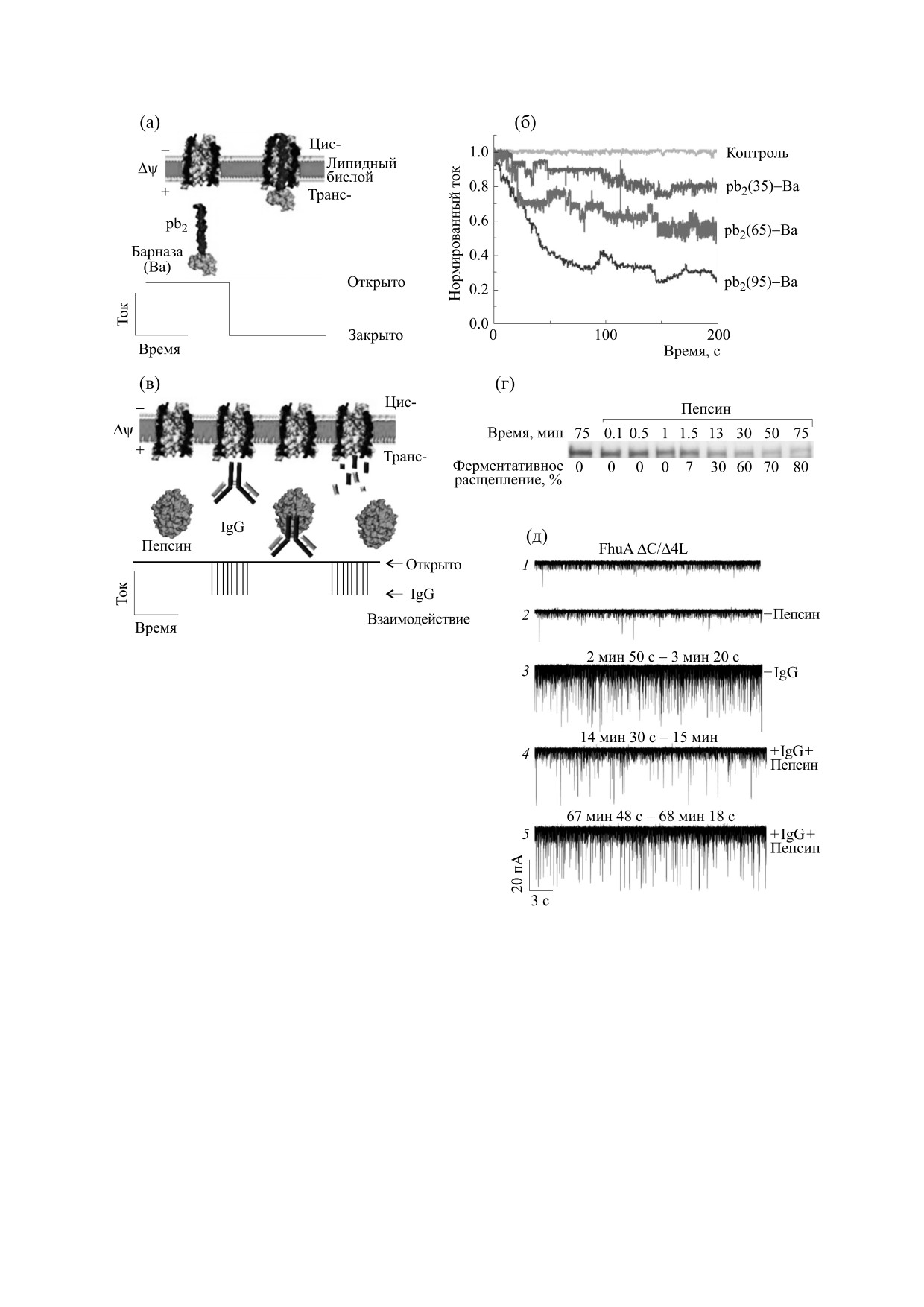
кирующих событий в единицу времени и харак-
полипептиды (pb2), представляющие собой
терный кинетический паттерн, в отличие от тех,
N-концевую часть pb2-прецитохрома. Указанные
которые вызваны другими двухвалентными кати-
полипептиды имели различную длину, но одина-
онами (например, Cu(II), Ni(II) или Co(II)) при
ковую плотность электрического заряда.
этой же концентрации. Иными словами, при та-
Во втором примере (рис. 6в-д) показано, что
кой геометрии сенсорной системы каждому иону
сконструированная нанопора FhuA ΔC/Δ4L
соответствует характерный сигнал. Благодаря
функционирует как чувствительный элемент для
этому свойству одноканальный сенсорный эле-
анализа ферментативного расщепления сыворо-
мент может быть использован для количествен-
точного иммуноглобулина (IgG) при очень кис-
ного определения более чем одного аналита.
лом pH. Активность пепсина по расщеплению
Важным условием прочных нанобелковых
IgG контролировали во времени (в оптимизиро-
конструкций является сохранение функциональ-
ванных условиях 1 М NaCl, 10 мМ фосфат-цит-
ной активности составляющих их белков в широ-
рат, pH 3.9) (рис. 6г). Добавление пепсина с
ком спектре условий обнаружения аналитов. Это
транс-стороны камеры не вызвало значительного
необходимо учитывать, поскольку превращение
изменения текущих записей (рис. 6д, кривая 2),
мембранного белка в биомиметическую поли-
предположительно из-за большого размера фер-
мерную матрицу может изменить его функцию.
мента по сравнению с диаметром нанопоры. Од-
Для сохранения функциональной активности
нако наличие IgG в канале приводило к появле-
белка, используемого для формирования биомат-
нию чередующихся блокировок тока с частотой
рицы, применяются различные генно-инженер-
событий (f = 30 ± 8 Гц) (рис. 6д, кривая 3). При-
ные подходы. Так, в результате существенной
мечательно, что добавление пепсина (t = 5 мин)
генно-инженерной реконструкции мембранный
привело к резкому снижению частоты событий
белок FhuA (который поглощает гидроксамат же-
(f = 5 ± 2 Гц, (рис. 6д, кривая 4)). Полученные в
леза), был преобразован в FhuA ΔC/Δ4L, который
результате переваривания фрагменты IgG вызы-
функционировал как надежный канал для отбора
вали многочисленные кратковременные блокады
проб, позволяя регистрировать биомолекулярные
тока с повышенной частотой (f = 10 ± 2 Гц) при
события [65] (рис. 6). Ключевым моментом в дан-
t = 70 мин (рис. 6д, кривая 5). Таким образом, ос-
ной разработке стало сочетание методов прямой
новополагающий принцип обнаружения аналита
генной инженерии с подбором условий рефол-
в данном случае заключался в том, что степень
динга для создания необычно стабильной белко-
расщепления молекулы IgG коррелировала с из-
вой нанопоры. Для того чтобы проиллюстриро-
менением тока в нанопоре FhuA ΔC/Δ4L, инду-
вать это кардинальное изменение в свойствах ис-
цированного появлением IgG-фрагментов.
следуемого белка, авторы сравнили характерные
По сравнению с мультисубъединичными бел-
электрические сигналы, называемые сигнатура-
ками мономерный порин OmpG E. coli особенно
ми (используемые для выявления особенностей
той или иной белковой нанопоры) каналов, обра-
привлекателен для формирования нанопор, по-
скольку необходимые модификации канала мо-
зуемых FhuA ΔC/Δ4L и стафилококковым αHL
гут быть легко достигнуты путем мутагенеза.
при низкой концентрации соли и в сильнокислой
Предыдущие исследования показали, что канал
среде (при низких значениях рН). Результаты
OmpG подвергается рН-зависимому, вольт-зави-
экспериментов свидетельствовали о том, что в от-
симому или самопроизвольному закрытию, что
личие от канала, образованного αHL, созданная
может мешать обнаружению аналита. Чтобы
нанопора белка FhuA ΔC/Δ4L сохраняла свое
устранить эти нежелательные явления, авторы
стабильное открытое состояние в течение дли-
определили участки OmpG, причастные к стро-
тельного периода при температуре до 65°C, а ее
бированию, применив для идентификации мето-
проводимость при всех исследуемых условиях
оставалась неизменной, т.е. блокировка тока от-
ды молекулярной динамики. Для обеспечения
стабильности открытой конформации белка бы-
сутствовала [65].
ли использованы два подхода сайт-направленно-
Возможности применения уникальных харак-
го мутагенеза. Во-первых, подвижность петли 6
теристик канала сконструированного белка FhuA
была уменьшена введением дисульфидной связи
ΔC/Δ4L авторы продемонстрировали на приме-
между внеклеточными концами 12-го и 13-го β-тя-
рах детектирования биомолекул на основе белок-
жей барреля. Во-вторых, водородная связь между
белковых и белок-нуклеиновых взаимодействий
11-м и 12-м β-тяжами была оптимизирована деле-
(рис. 6). В первом примере (рис. 6а, б) показано,
цией остатка D215. Порин OmpG с обеими стаби-
что это белковая нанопора функционирует как
лизирующими мутациями показал снижение
чувствительный элемент, позволяющий разли-
способности к закрытию канала на 95% [66].
чать похожие полипептиды, состоящие из свер-
нутого домена барназы, РНКазы, состоящей из
Одним из наиболее успешных примеров при-
110 остатков (Ва), к которому присоединены по-
менения сенсоров на основе липидных бислоев
ложительно заряженные неструктурированные
является анализ последовательности нуклеоти-
БИОФИЗИКА том 66
№ 4
2021
678
НОВИКОВА и др.
Рис. 6. Использование сконструированной (генно-инженерной) нанопоры на основе белка FhuA ΔC/Δ4L в качестве
одномолекулярного зонда для анализа свернутых белковых доменов, содержащих ведущие (лидерные) полипептиды
различной длины ((а) и (б)) и анализа ферментативного расщепления в реальном времени (в-д) ([65], с
изменениями). (а) - Схема взаимодействия белковых аналитов pb2(35)-Ba, pb2(65)-Ba и pb2(95)-Ba с ведущими
положительно заряженными последовательностями длиной 35, 65 и 95 остатков соответственно. (б) - Характерный
макроскопический спад тока в сконструированной нанопоре FhuA ΔC/Δ4L. (в)
- Схема взаимодействия
сывороточного иммуноглобулина (IgG) с пепсином; (г) - ферментативная активность пепсина; (д) - записи тока,
индуцированного в нанопоре FhuA ΔC/Δ4L появлением фрагментов IgG.
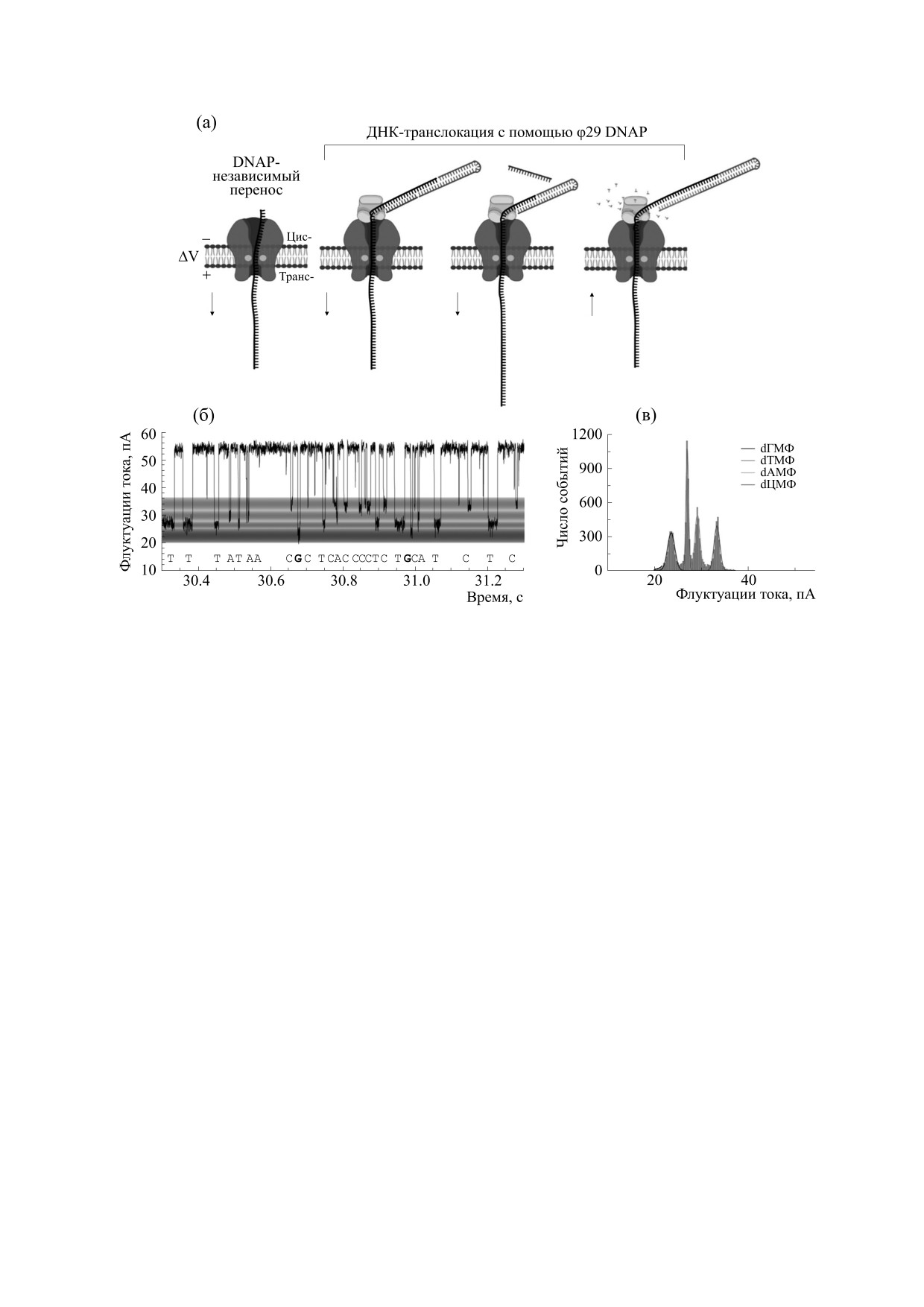
дов в нуклеиновых кислотах с помощью биологи-
использованием белковых нанопор была разра-
ческой нанопоры на основе альфа-гемолизина
ботана благодаря тому, что четыре азотистых ос-
(рис. 7). Эта технология секвенирования ДНК с
нования в цепочке целевой ДНК по-разному вза-
БИОФИЗИКА том 66
№ 4
2021
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ
679
Рис. 7. Детектирование нуклеиновых кислот на основе нанопор ([67, 68], с изменениями). (а) - Модель, иллюстриру-
ющая принцип cеквенирования нити нуклеиновой кислоты: нить нуклеиновой кислоты входит в нанопору, вызывая
резкое уменьшение ионного тока по сравнению с исходным током открытой поры; проходит через полость нанопоры,
что приводит к характерному изменению тока и длительности блокады, и в конечном итоге перемещается через пору,
позволяя ионному току вернуться в исходное состояние. (б) - Запись тока единичной поры при прохождении через
нее нити нуклеиновой кислоты. (в) - Гистограмма, демонстрирующая различные уровни блокировки тока, генериру-
емого в результате взаимодействия монофосфатов с порой.
имодействуют с просветом поры α-гемолизина,
форме на основе клеток [70]. На липидных двух-
показывая разные уровни проводимости при бло-
слойных платформах мембранные белки встрое-
кировке тока [67, 68].
ны в липидный бислой, который соединяет белок
и сенсорное устройство, а на клеточных платфор-
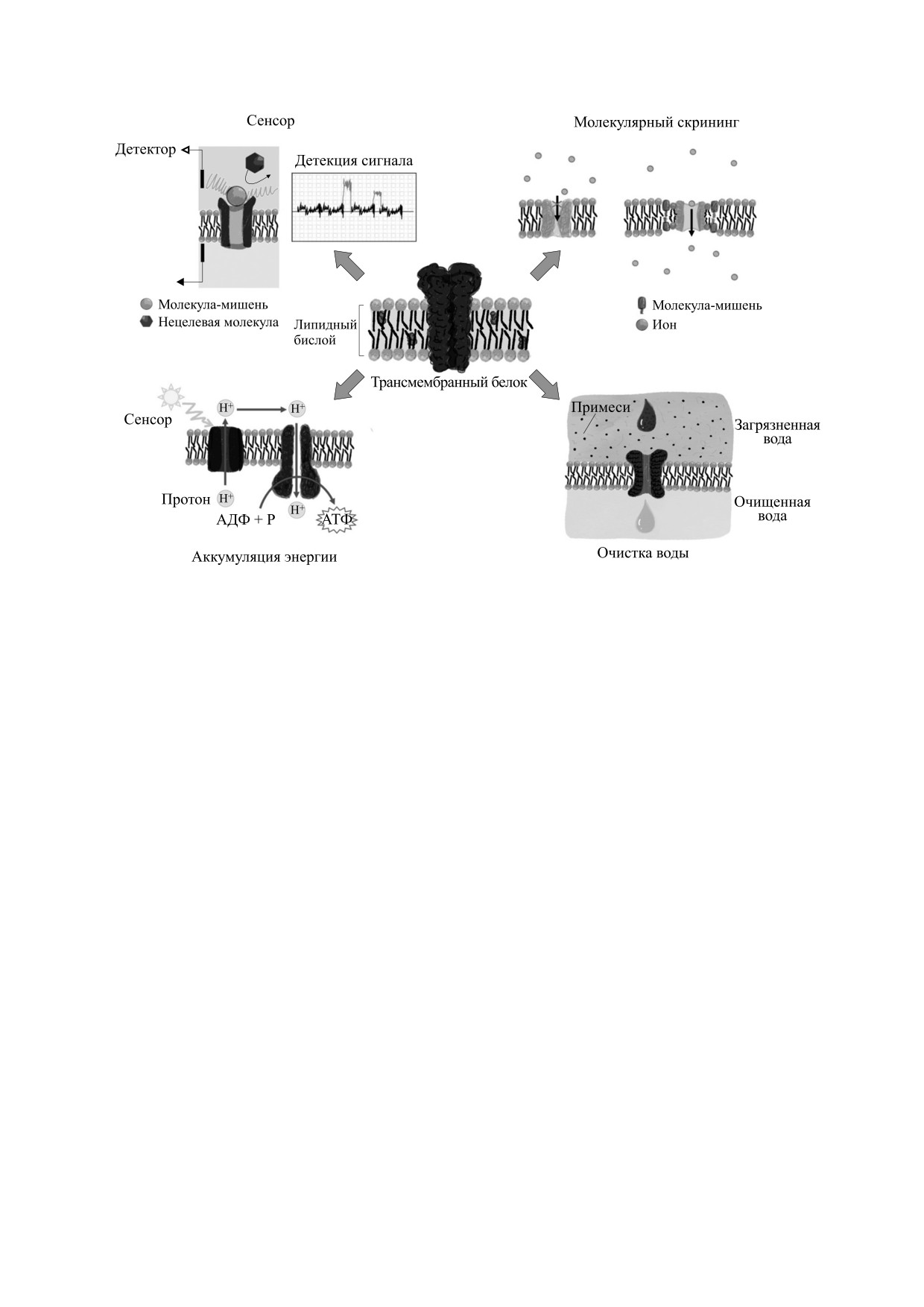
Производительность и селективность биоми-
мах мембранные белки экспрессируются в куль-
метических платформ на основе трансмембран-
тивируемой клетке, которая затем интегрируется
ных белков намного превосходят традиционные
в сенсорное устройство. Исследования, связан-
материальные платформы, но отсутствие ста-
бильности во многом ограничивает их коммерче-
ные с химическими сенсорами на основе клеток,
ское использование. К настоящему времени до-
в основном проводились с конца 1980-х годов [71,
статочно хорошо разработаны трансмембранные
72], однако наибольшим прогрессом в разработке
биомиметические платформы на основе белков
датчиков на основе клеток было ознаменовано
для четырех основных областей применения:
начало 2000-х годов [73, 74]. Принципы работы
биосенсоры, изучение молекулярных взаимодей-
соответствующих систем основаны на реакции
ствий, аккумулирование энергии и очистка воды
клеток на химические стимулы. В основном су-
[69]. Примеры использования биосенсорных си-
ществуют два типа технологий датчиков-преоб-
стем схематически представлены на рис. 8.
разователей на основе клеток, которые основаны
на детектировании электрических изменений и
С точки зрения разработки биосенсоров, ис-
пользующих функциональные свойства мем-
флуоресцентного или люминесцентного излуче-
бранных белков, можно выделить биосенсоры,
ния. Так, в последнее время значительный про-
сформированные на двух различных платформах:
гресс наметился в применении полупроводнико-
платформе на основе липидного бислоя и плат-
вых квантовых точек в качестве меток в двух важ-
БИОФИЗИКА том 66
№ 4
2021
680
НОВИКОВА и др.
Рис.
8. Потенциально возможные области применения биосенсоров на основе трансмембранных белков:
взаимодействие мембран/мембранных белков с лекарственными препаратами, генерация энергии и очистка воды
([69], с изменениями).
ных областях биологии, биовизуализации и
функциональных групп. В качестве биосистем
биосенсинга [14, 15].
микробы могут быть использованы для синтеза
новых бионаноматериалов, микроустройств и
Для дальнейшего развития этой области вме-
микро/нанороботов и т. п. [77].
сто простых наноструктур (с использованием од-
нокомпонентных наноматериалов и монотонных
по композиции) необходимы очень сложные и
ЗАКЛЮЧЕНИЕ
продуманно созданные ансамбли качественно
новых наноматериалов [75, 76]. Многие живые
Нативные или искусственно сконструирован-
биологические системы являются непревзойден-
ные биосенсоры с использованием ион-проводя-
ными «природными мастерами» в области био- и
щих каналов являются весьма перспективным
химического синтеза, они производят бионеорга-
классом наноструктур: во-первых, из-за возмож-
нические материалы, которые организованы в
ности фиксирования изменений проводимости
структуры различного уровня иерархии, от нано-
единичной поры, так называемый стохастиче-
до макромасштабов. Недавние исследования по
ский мониторинг, что повышает степень точно-
использованию микроорганизмов в синтезе на-
сти при определении аналита, и, во-вторых, из-за
ночастиц являются относительно новой и захва-
того, что фиксируемый сигнал может быть оциф-
тывающей областью исследований со значитель-
рован. Подготовка функциональных поверхно-
ным потенциалом для развития. Микробы, бла-
стей для иммобилизации желаемых биомолекул,
годаря пористой структуре их клеточной стенки,
так называемая био-нанопаттернизация поверх-
представляют собой исключительно эффектив-
ностей, - это первый шаг в процессе изготовле-
ные шаблоны, которые обеспечивают биомиме-
тический подход к получению упорядоченных
ния биодатчиков. От успешного решения мето-
нано-, микро- и мезоструктурированных матери-
дических проблем в области био-нанопаттерни-
алов, разнообразных по размерам и форме и на-
зации зависит точное моделирование биомолекул
личию на их поверхности множества химических
на поверхностях с нанометровым разрешением и,
БИОФИЗИКА том 66
№ 4
2021
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ
681
соответственно, эффективность конструируемой
КОНФЛИКТ ИНТЕРЕСОВ
впоследствии биоматрицы, поскольку основопо-
Авторы заявляют об отсутствии конфликта
лагающим условием для получения разнообраз-
интересов.
ных биоинженерных конструкций, пригодных
для создания биосенсоров, является иммобили-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
зация белков в определенном положении, непре-
менно при условии сохранения их биологической
Настоящая работа не содержит описания ка-
ких-либо исследований с использованием людей
активности [78]. За последние несколько лет тех-
и животных в качестве объектов.
нология бионанопаттернизации развивается
быстрыми темпами, разрабатываются различные
методики формирования паттерна для иммоби-
СПИСОК ЛИТЕРАТУРЫ
лизации биомолекул, таких как ДНК, пептиды,
1. Н. В. Медведева, О. М. Ипатова, Ю. Д. Иванов и
белки и вирусы в наномасштабе [79]. Диапазон
др., Биомед. химия 52 (6), 529 (2006).
аналитов, определяемых с помощью современ-
2. А. И. Арчаков, Нанобиотехнологии в медицине: На-
ных биосенсоров, достаточно широк, среди них
нодиагностика и нанолекарства (Актовая речь,
инсектициды, пестициды, гербициды, металлы,
13.04.2009).
токсины, антибиотики, микроорганизмы, гормо-
3. D. C. Kim and D. J. Kang, Appl. Sensors 8, 6605
ны и т. д. [80]. Под действием электрофоретиче-
(2008).
ской силы молекулы анализируемого вещества
4. F. Long, A. Zhu, and H. Shi, Sensors (Basel) 13 (10),
13928 (2013).
переносятся к нанопоре и нарушают протекаю-
щий ионный ток через поры. Связывание моле-
5. C. G. Palivan, R. Goers, A. Najer, et al., Chem. Soc.
Rev. 45, 377 (2015).
кулы-мишени мембранные белки спонтанно
6. I. Y. Hasan and A. Mechler, Analyst 142, 3062 (2017).
преобразуют в электрические сигналы. При этом
7. A. Krywko-Cendrowska, S. di Leone, M. Bina, et al.,
характер блокировки тока существенно меняется
Polymers (Basel) 12(5), 1003 (2020).
из-за разницы во взаимодействии между просве-
8. Y. Yamamoto and H. Hori, Rev. Adv. Mater. Sci. 12, 23
тами пор и аналитом, а также в зависимости от
(2006).
разновидностей нанопор. Соответственно, тот
9. I. Kusters, G., van den Bogaart, and A. Kedrov, Struc-
или иной аналит можно определить по динамике
ture 19, 430 (2011).
изменения ионного тока, характер этих измене-
10. K. Mahendran, R. Romero-Rui, M. Schlösinger, et al.,
ний служит своеобразным «отпечатком пальца»
Biophys. J. 102, 39 (2012).
аналита.
11. H. Wang, T.-S. Chung, Y. W. Tong, et al., Small 8, 1185
(2012).
Таким образом, создание универсальных био-
12. M. Bieligmeyer, F. Artukovic, S. Nussberger, et al.,
датчиков на основе функционально активных
Beilstein J. Nanotechnol. 7, 881 (2016).
трансмембранных белков, имитирующих клеточ-
13. V. Lesnyak, N. Gaponik, and A. Eychmüller, Chem.
ную мембрану, не только еще раз подтвердило их
Soc. Rev. 42 (7), 2905 (2013).
биологическую значимость, но и продемонстри-
14. D. Mo, L. Hu, G. Zeng, et al., Appl. Microbiol. Bio-
ровало возможность использования этих белков в
technol. 101 (7), 2713 (2017).
качестве эффективных нанотехнологических ин-
15. I. V. Martynenko, A. P. Litvin, F. Purcell-Milton, et al.,
струментов. Область применения биологических
J. Mater. Chem. B 5 (33), 6701 (2017).
пор очень широка: она простирается от сверхчув-
16. D. S. Shah, M. B. Thomas, S. Phillips, et al., Biochem.
ствительных биосенсоров различного назначе-
Soc. Trans. 35 (3), 522 (2007).
ния до целенаправленного уничтожения злокаче-
17. B. Hagan and J. Lakma, Molec. Membrane Biol. 21,
ственных клеток. К подобным структурам,
209 (2004).
применяемым в наномедицине, относятся био-
18. P. Curnow, Biochem, Soc. Trans. 37, 643 (2009).
генные наночастицы терапевтического назначе-
19. О. Д. Новикова и Т. Ф. Соловьева, Биол. мембра-
ния, искусственно сконструированные химиче-
ны 26 (1), 6 (2009).
ские и биологические сенсоры [81].
20. G. E. Schulz, Biochim. Biophys. Acta 1565,
308
(2002).
21. G. N. Likhatskaya, T. F. Solov'eva, O. D. Novikova,
ФИНАНСИРОВАНИЕ РАБОТЫ
et al., J. Biomol. Struct. Dyn. 23 (2), 163 (2005).
22. A. Wiese, G., Schroder, K. Brandenburg, et al., Bio-
Работа выполнена при финансовой поддержке
chim. Biophys. Acta 1190, 231 (1994).
Российского фонда фундаментальных исследова-
23. D. J. Muller and A. Engel, Curr. Opin. Colloid Inter-
ний (проект № 19-03-00318).
face Sci. 13 (5), 338 (2008).
БИОФИЗИКА том 66
№ 4
2021
682
НОВИКОВА и др.
24. L. Hasler, J. B. Heymann, A. Engel., et al., J. Struct.
53. K. Wadu-Mesthrige, N. A. Amro, and J. C. Garno,
Biol. 121, 162 (1998).
Biophys. J. 80 (4), 1891 (2001).
25. Б. Глик и Д. Пастернак, Молекулярная биотехноло-
54. C. Mathé, S. Devineau, J-C Aude, et al., PLoS One 8
гия: принципы и применение (Мир, М., 2002).
(11), 81346 (2013).
26. G. A. Signorell, T. Kaufmann, C. W. Kukulski, et al., J.
55. F. Aldeek, M. Safi, N. Zhan, et al., ACS Nano 7 (11),
Struct. Biol. 157, 321 (2007).
10197 (2013).
27. M. Sheereen, E. Yusko, Y. Billeh, et al., Curr. Opin.
56. Z. Jin, Y. Sugiyama, C. Zhang, et al., Chem. Mater. 32
Biotechnol. 21 (4), 439 (2010).
(17), 7469 (2020).
28. S. Howorka, Nature Nanotechnol. 12, 619 (2017).
57. D. C. Kim and D. J. Kang, Sensors 8 (10), 6605,
29. T. L. Williams, M. M. L. Vareiro, and A. T. Jenkins,
(2008).
Langmuir 22, 6473 (2006).
58. E. Topoglidis, C. J. Campbell, A. E. G. Cass, et al.,
30. P. H Lu, R. H. Liu, and F. J. Sharom, Eur. J. Biochem.
Langmuir 17 (25), 7899 (2001).
268, 1687 (2001).
59. J. L. Poulos, T-J. Damoiseaux, E. J. Gillespie, et al.,
31. A. J. Heron, J. R. Thompson, B. Cronin, et al., J. Am.
Biosens. Bioelectron. 24, 1806 (2009).
Chem. Soc. 131, 1652 (2009).
60. M. A. Czekalska, T. S. Kaminski, S. Jakiela, et al., Lab.
32. M. A. Dhoke, P. J. Ladha, F. J. Boerio, et al., Biochim.
Chip 15, 541 (2015).
Biophys. Acta 1716, 117 (2005).
61. E. Berkane., F. Orlik., A. Charbit, et al., J. Nanobio-
33. L. Tiefenauer and S. Demarche, Materials 5, 2205
technol. 3, 3 (2005).
(2012).
62. E. M. Nestorovich, C. Danelon, M. Winterhalter, et al.,
34. H. Ti Tien, S. H. Wurster, and A. L. Ottova, Bioelectro-
Proc. Natl. Acad. Sci. USA 99 (15), 9789 (2002).
chem. Bioenergetics 42 (1), 77 (1997).
63. T. Stora, J. H. Lakey, and H. Vogel, Angew. Chem. Int.
35. A. Janshoff and C. Steinem, Anal. Bioanal. Chem. 385
Ed. 38, 389 (1999).
(3), 433 (2006).
64. O. Braha, S. J. Walker, and A. Cheley, Chemistry Biol-
36. L. X. Tiefenauer and A. Studer, Biointerphases 3 (2), 74
ogy 4 (7), 497 (1997).
(2008).
65. M. M. Mohammad, R. Iyer, K. R. Howard, et al., J.
37. A. Janshoff and C. Steinem, Anal. Bioanal. Chem. 385,
Am. Chem. Soc. 134 (22), 952 (2012).
433 (2006).
66. S. Conlan, Y. Zhang, S. Cheley, et al., Biochemistry 39,
38. E. Reimhult and K. Kumar, Trends Biotechnol. 26 (2),
11845 (2000).
82 (2008).
67. J. Clarke, H.-C. Wu, L. Jayasinghe, et al., Nat. Nano-
39. A. A. Brian and H. M. McConnell, Proc. Natl. Acad.
technol. 4, 265 (2009).
Sci. USA 81, 6159 (1984).
68. A. Crnkovi ć, M. Srnko, and G. Anderluh, Life 11, 27
40. L. K. Tamm and H. M. McConnel, Biophys. J. 47 (1),
(2021).
105, (1985).
69. H. Ryu, A. Fuwad, S. Yoon, et al., Int. J. Mol. Sci. 20,
41. H. Hillebrandt, G. Wiegand, M. Tanaka, et al., Lang-
1437 (2019).
muir 15, 8451 (1999).
70. N. Misawa, T. Osaki, and S. Takeuchi, J. R. Soc. Inter-
42. A. Ottova, V. Tovarozek, and H. T. Tien, in Planar lipid
face 15, 20170952 (2018).
bilayers (BLMs) and their applications, Ed. by H. Tien
71. D. M. Rawson, A. J. Willmer, and A. P. P. Turner,
and A. Ottova-Leitmannova (Elsevier, New York,
Biosensors 4, 299 (1989).
2003), pp. 917-920.
72. L. Bousse and L. Sens, Actuators B Chem. 34, 270
43. E. T. Castellana and P. S. Cremer, Surf. Sci. Rep. 61
(1996).
(10), 429 (2006).
73. D. A. Stenger, G. W. Gross, E. W. Keefer, et al., Trends
44. G. D. Bothun, J. Nanobiotechnol. 6, 13 (2008).
Biotechnol. 19, 304 (2001).
45. A. R. Zolghadr and S. S. Moosavi, RSC Advances 9
74. J. Ko and T. H Park, J. Biol. Eng. 10, 17 (2016).
(9), 5197 (2019).
75. K. Ariga, M. Li, G. J. Richards, et al., J. Nanosci. Nan-
46. G. Elender, M. Kühner, E. Sackmann, Biosens. Bio-
otechnol. 11 (1), 1 (2011).
electronics 11, 565 (1996).
76. M. Ramanathan, K. Hong, Q. Ji, et al., J. Nanosci.
47. F. Itel, M. Chami, A. Najer, et al., Macromolecules 47,
Nanotechnol. 14 (1), 390 (2014).
21, 7588 (2014).
77. D. Mandal, M. E. Bolander, D. Mukhopadhyay, et al.,
48. E.-K. Sinner and W. Knoll, Curr. Opin. Chem. Biol. 5,
Appl. Microbiol. Biotechnol. 69 (5), 485, (2006).
705 (2001).
78. K. L. Christman, V. D. E. Rios, and H. D. Maynard,
49. K. Eva, M. Schmitt, A. Vrouenraets, et al., Biophys. J.
Soft Matter. 2, 928 (2006).
91, 2163, (2006).
79. P. M. Mendes, C. L. Yeung, and J. A. Preece, Res. Lett.
50. Г. А. Набережных, А. А Карпенко, В. А. Хоменко
2 (8), 373 (2007).
и др., Биофизика 64 (6), 1107 (2019).
80. G. P. Nikoleli, D. P. Nikolelis, and C. G. Siontorou,
51. A. Skerra, J. Mol. Recognit. 13 (4), 167 (2000).
Membranes (Basel) 8 (4), 108 (2018).
52. W. Ma, A. Saccardo, D. Roccatano, et al., Nat. Com-
81. H. Pradeep and G. K. Rajanikant, Nanobiotechnology
mun. 9, 1489 (2018).
6 (2), 63 (2012).
БИОФИЗИКА том 66
№ 4
2021
НАНОСТРУКТУРНЫЕ БИОСЕНСОРЫ
683
Nanostructural Biosensors Based on Components of Bacterial Membranes
O.D. Novikova*, G.A. Naberezhnykh*, and A.A. Sergeev**
*G.B. Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch of the Russian Academy of Sciences,
prosp. 100 Let Vladivostoku 159, Vladivostok, 690022 Russia
**Institute of Automation and Control Processes, Far Eastern Branch of the Russian Academy of Sciences,
ul. Radio 5, Vladivostok, 690041 Russia
Protein molecules have the unique property of transferring material and/or information through an impene-
trable barrier called lipid bilayer. This peculiar role of cellular “gatekeepers” is especially interesting for the
purposes of nanobiotechnology, since membrane proteins can be successfully used for communication be-
tween two different media separated by a lipid bilayer. This review describes the structural features and prop-
erties of transmembrane proteins as the most promising components of modern biosensor devices. Methods
for the formation of lipid bilayers attached to a solid surface as well as methods for obtaining a rigid protein
“armature” are also presented. With the use of these techniques it is possible to reconstruct and maintain pro-
teins in a functionally active conformation in regard to a wide range of analytes to be determined. The high
selectivity and specificity of protein molecules in recognizing receptors or ligands make them indispensable
for biomedical analysis and molecular diagnostics.
Keywords: nanostructured biosensors, transmembrane proteins, lipid bilayer
БИОФИЗИКА том 66
№ 4
2021