БИОФИЗИКА, 2021, том 66, № 4, с. 684-695
БИОФИЗИКА КЛЕТКИ
УДК 612.822.3 + 612.085.2 + 57.086.83
ВОЗМОЖНЫЙ МЕХАНИЗМ МОДУЛЯЦИИ КОРОТКИМИ ПЕПТИДАМИ
МЕДЛЕННЫХ НАТРИЕВЫХ КАНАЛОВ МЕМБРАНЫ
СЕНСОРНОГО НЕЙРОНА
© 2021 г. И.В. Рогачевский, А.Д. Калинина, В.А. Пеннияйнен, С.Г. Терехин,
С.А. Подзорова, Б.В. Крылов, В.Б. Плахова
Институт физиологии им. И.П. Павлова РАН, 199034, Санкт-Петербург, наб. Макарова, 6
E-mail: verapl@mail.ru
Поступила в редакцию 08.09.2020 г.
После доработки 10.09.2020 г.
Принята к публикации 15.04.2021 г.
Исследованы возможные механизмы лиганд-рецепторного связывания аргининсодержащих тетра-
пептидов с каналами NaV1.8 первичного сенсорного нейрона. Установлено, что тетрапептид Ac-
RERR-NH2, действующий с наружной стороны нейрональной мембраны, снижает потенциалочув-
ствительность исследуемых каналов. В отличие от этого тетрапептид Ac-REАR-NH2 не обладает та-
кой способностью. Применение конформационного анализа для объяснения механизма лиганд-ре-
цепторного связывания ряда коротких пептидов, исследованных нами в настоящей работе, позво-
лило предположить, что ключевую роль здесь играют положительно заряженные гуанидиновые
группы боковых цепей двух аргинильных остатков. Между этими остатками должен находиться еще
один аминокислотный остаток, в нашем случае - глутаминовая кислота. Расчеты показывают, что
механизм лиганд-рецепторного связывания не может быть реализован, когда указанные гуаниди-
новые группы в молекулах коротких пептидов оказываются на расстоянии, меньшем определенно-
го порогового значения. Полученные данные позволяют заключить, что тетрапептид Ac-RERR-
NH2, равно как и ряд других пептидов, способных к связыванию с каналом NaV1.8 по тому же меха-
низму, могут претендовать на роль лекарственных субстанций анальгетиков периферического ме-
ханизма действия.
Ключевые слова: короткие пептиды, каналы NaV1.8, ноцицептивный нейрон, конформационный анализ.
DOI: 10.31857/S0006302921040074
При действии гипералгезических агентов отмеча-
Медленные натриевые каналы впервые были
ется увеличение функциональной активности ка-
обнаружены в мембране сенсорного нейрона [1].
налов NaV1.8. Для получения антиноцицептивно-
Позже, когда были изучены и другие представи-
тели суперсемейства натриевых каналов, этим
го эффекта необходимо снизить функциональ-
медленным натриевым каналам было присвоено
ную активность этих каналов, что может быть
название NaV1.8. В настоящее время очевидно,
осуществлено двумя способами: или путем
уменьшения плотности каналов в мембране
что физиологическая функция каналов NaV1.8
нοцицептивного нейрона, или за счет снижения
связана с кодированием периферических ноци-
потенциалοчувствительности их активационного
цептивных сигналов [1-3].
воротного устройства [3, 6, 7]. Агенты, способные
Ноцицепторы являются полимодальными ре-
снижать возбудимость нοцицепторов посред-
цепторами, причем информацию о тактильных,
ством уменьшения потенциалочувствительности
температурных и других воздействиях несет низ-
активационного воротного устройства медлен-
кочастотная посылка нервных импульсов, а при
ных натриевых каналов NaV1.8, могут претендо-
усилении стимула до повреждающего уровня
вать на роль анальгетических лекарственных суб-
происходит повышение частоты импульсации,
станций [8].
что и является сигналом для активации ноцицеп-
тивной системы на супраспинальном уровне. Та-
При изучении низкомолекулярных белков де-
кая высокочастотная посылка нервных импуль-
фенсинов, продуцируемых нейтрофилами и клетка-
сов воспринимается как болевое ощущение [4, 5].
ми Панета [9, 10], нами было обнаружено, что де-
фенсины кролика NP-1 и NP-4, действующие в
Сокращениe: ИП - индекс площади эксплантатов.
очень низких концентрациях, снижают потенциа-
684
ВОЗМОЖНЫЙ МЕХАНИЗМ МОДУЛЯЦИИ КОРОТКИМИ ПЕПТИДАМИ
685
лочувствительность каналов NaV1.8 сенсорного ней-
рованную культуру изолированных нейронов
рона [11, 12]. Это свидетельствует о потенциальной
дорзальных ганглиев крыс линии Wistar, получен-
способности данных молекул выключать ноцицеп-
ную методом краткосрочного культивирования.
тивную компоненту сенсорного сигнала, передавае-
Дорзальные ганглии, выделенные из областей
мого в центральную нервную систему. Задача разде-
L5 - S1 спинного мозга новорожденных крысят,
ления противомикробной (антибиотической) и
помещали в раствор Хенкса. Далее осуществляли
анальгетической функций этих эндогенных моле-
ферментативную обработку в специальном рас-
кул не решена до настоящего времени. Для ее реше-
творе (см. ниже). Длительность обработки зави-
ния нами была предпринята попытка выделить из
села от возраста крыс и составляла от двух до пяти
молекул дефенсинов минимальный фрагмент, ока-
минут при 37°С [1]. Используемый раствор состо-
зывающий модулирующий эффект на каналы
ял из следующих компонентов: 1 мл раствора
NaV1.8. Выяснилось, что синтетические гексапепти-
Хенкса, 1 мл среды Игла, 1 мг/мл проназы-Е,
ды Aс-PRERRA-NH2, Aс-PRАRRA-NH2 и Aс-
2 мг/мл коллагеназы (тип 1А). В качестве буфера
применяли 10 ммоль/л HEPES-Na (pH 7.4). По
PKEKKA-NH2 снижают потенциалочувствитель-
окончании ферментативной обработки ганглии
ность каналов NaV1.8 в концентрациях, примерно
тщательно отмывали путем центрифугирования
равных 100 нмоль/л [13]. Последовательность PRE-
(1 мин, 900 об/мин) и последующей смены надо-
RRA является фрагментом нативной формы моле-
садочной жидкости. Отмывку проводили в среде
кулы дефенсина NP-1. Замена глутаминовой кисло-
Игла с добавлением глюкозы (0.6%), фетальной
ты на аланин (переход от Aс-PRERRA-NH2 к Aс-
сыворотки коровы (10%), гентамицина (40 ед/мл)
PRАRRA-NH2) не отразилась на оказываемом пеп-
и глютамина (2 ммоль/л). Далее в этой же среде
тидом эффекте. Исходя из этого, был сделан вывод,
культивировали изолированные нейроны, полу-
что присутствие в атакующей молекуле аминокис-
ченные после отмывки путем механической дис-
лотного остатка глутаминовой кислоты не является
социации при помощи пипетирования. Добавле-
необходимым условием, определяющим способ-
ние культуральной среды к получаемой клеточ-
ность пептида к связыванию с каналом [13]. Таким
ной суспензии осуществляли для достижения
образом, стало понятно, что ключевую роль в меха-
необходимой плотности нейронов в объеме чаш-
низме лиганд-рецепторного связывания молекулы
ки Петри. При этом шванновские клетки и фиб-
Aс-PRERRA-NH2 должны играть аргинильные
робласты осаждались на дне чашки Петри (90 мм)
остатки, поэтому следующей задачей стал поиск
в течение 25 мин при 37°С. В результате описан-
ных операций была получена культура клеток, со-
максимально короткого пептида, содержащего дан-
стоявшая главным образом из сенсорных нейро-
ную аминокислоту и способного эффективно сни-
нов. Затем нейроны культивировали в чашках
жать потенциалочувствительность каналов NaV1.8.
Петри (40 мм), дно которых было покрыто колла-
Все указанные молекулы объединяет присутствие
геном, полученным из хвостов крыс. Спустя
стерически доступных аргинильных остатков, кото-
один-два часа после завершения культивирова-
рые вносят основной вклад во взаимодействие с ка-
ния отбирали для проведения опытов визуально
налом NaV1.8 за счет образования межмолекуляр-
неповрежденные клетки. Записи электрической
ных ион-ионных связей [14].
активности нейрональной мембраны проводили
Задачей настоящего исследования было изуче-
на клетках, которые сохраняли жизнеспособ-
ние механизма лиганд-рецепторного связывания
ность в течение одних суток культивирования.
с каналами NaV1.8 вновь синтезированных тетра-
Для исследования токов каналов NaV1.8 ис-
пептидов Ac-RERR-NH2 и Ac-REАR-NH2, кото-
пользовали стандартные растворы. Состав вне-
рые короче изученных нами ранее гексапептидов
клеточного раствора (концентрации представле-
и, согласно нашему предположению, могут пре-
ны в ммоль/л): NaCl - 65, тетродотоксин -
тендовать на роль безопасной и эффективной
0.0001, MgCl2 - 2, CaCl2 - 2, HEPES-Na - 10,
субстанции нового анальгетика. При формирова-
нии лиганд-рецепторного комплекса указанные
Choline-Cl - 70, pH 7.4; состав внутриклеточного
тетрапептиды потенциально способны образовы-
раствора: NaCl - 10, MgCl2 - 2, CsF - 100, CsCl -
вать межмолекулярные ион-ионные связи с уча-
40, HEPES-Na - 10, pH 7.2. Изменения pH осу-
стием гуанидиновых функциональных групп ар-
ществляли с помощью CsOH и HCl. Присутствие
гинильных остатков. Проверке этого предполо-
ионов фтора во внутриклеточном растворе было
жения посвящена настоящая работа.
необходимо для блокирования кальциевых токов.
Также в составе обоих растворов отсутствовали
ионы калия, что позволило исключить все ком-
МАТЕРИАЛЫ И МЕТОДЫ
поненты калиевого тока [15, 16]. При этом добав-
Метод локальной фиксации потенциала. Для
ление тетродотоксина во внеклеточный раствор
проведения эксперимента методом локальной
блокировало все тетродотоксинчувствительные
фиксации потенциала использовали диссоции-
натриевые каналы, что делало возможным реги-
БИОФИЗИКА том 66
№ 4
2021
686
РОГАЧЕВСКИЙ и др.
стрировать ответы только каналов NaV1.8. Реак-
условий регистрации натриевых токов. Перед на-
тивы, использованные в работе, приобретали в
чалом записи ионных токов выдерживали паузу в
фирме Sigma (США).
несколько минут для осуществления внутрикле-
точной перфузии нейрона раствором, заполняю-
Исследуемые пептиды были синтезированы
щим микроэлектрод. Максимальная длитель-
фирмой ООО «НПФ Верта» (Россия) методом
ность эксперимента составляла один час.
классического пептидного синтеза, для чего при-
При проведении экспериментов постоянно
меняли реактивы и производные аминокислот
контролировали величину последовательного со-
фирм Sigma (США) и Iris Biotech GmbH (Герма-
противления (RS). Она не должна превышать 3
ния). Полученные пептиды характеризовали с
МОм, иначе стационарные и кинетические ха-
помощью аналитической высокоэффективной
рактеристики измеряемых токов будут получены
жидкостной хроматографии (чистота > 95%) и
с большими ошибками [19]. Отметим, что и зна-
масс-спектрометрии.
чение эффективного заряда активационного во-
Для регистрации ионных токов исследуемые
ротного устройства каналов NaV1.8 (Zeff) может
нейроны с помощью микропипетки переносили в
оказаться некорректным, если величина RS пре-
экспериментальную камеру, объем которой со-
ставлял 200 мкл. Полная замена наружного рас-
вышает 3 МOм.
твора в камере происходила за одну минуту под
Погрешность метода, которая также определя-
действием силы тяжести путем пассивного про-
ется величиной RS, связана с точностью фикса-
тока.
ции трансмембранной разности потенциалов. Ре-
Эксперименты осуществляли методом локаль-
альная величина трансмембранной разности по-
ной фиксации потенциала (patch-clamp method) в
тенциалов определяет положение исследуемых
конфигурации «регистрация активности целой
стационарных функций каналов NaV1.8 относи-
клетки» («whole-cell recording») [17]. Для этого ис-
тельно оси E. Стационарная ошибка фиксации
пользовали аппаратно-программный комплекс,
потенциала оценивается с помощью формулы:
состоящий из усилителя EPC 7 (patch-clamp L/M-
EPC 7), цифро-аналогового и аналого-цифрового
ΔЕ ≈ I
maxRS,
преобразователей и персонального компьютера.
max
где I
- максимальное амплитудное значе-
Пакет программ для автоматизации научных ис-
следований был создан в лаборатории физиоло-
ние натриевых токов.
гии возбудимых мембран Института физиологии
На величину ΔE должны сдвигаться вправо
им. И.П. Павлова РАН [18].
«реальные» значения потенциалозависимостей
стационарных функций натриевых каналов. Наи-
Микроэлектроды, использованные в работе,
изготавливали из мягкого стекла в две стадии в
меньшая ошибка фиксации (менее 1 мВ) бывает в
соответствии с описанием, приведенным в работе
том случае, когда ток I
max не превышает 1 нА.
[17], применяя пуллер для микропипеток P-97
Тогда ошибкой метода можно пренебречь.
(Sutter Instrument, США). Микроэлектрод запол-
Помимо величины RS в процессе эксперимен-
няли внутриклеточным раствором и с помощью
та контролировали величину емкости мембраны
микроманипулятора вводили в эксперименталь-
(Сm). Токи, текущие через емкость мембраны
ную камеру с внеклеточным раствором. При этом
в микроэлектроде создавали небольшое положи-
(IC), и токи утечки (IL) вычитали из суммарного
тельное давление для предотвращения попадания
ионного тока с помощью специальной программ-
в него наружного раствора. Далее микроэлектрод
ной процедуры.
подводили ко дну экспериментальной камеры
В диапазоне потенциалов от -60 мВ до 45 мВ
так, чтобы он прижимался к поверхности клеточ-
последовательно подавали ступеньки напряже-
ной мембраны находящегося там нейрона для со-
ния с шагом 5 мВ. Длительность каждого из те-
здания плотного (высокоомного) контакта, после
стирующих импульсов составляла
50 мс. В
чего мембранный фрагмент под микроэлектро-
ответ на каждую ступеньку напряжения реги-
дом разрушали, прикладывая отрицательное дав-
стрировали пиковые (амплитудные) значения то-
ление. При прорыве мембраны под кончиком
ков (Ipeak), что позволяло построить «пиковую»
микроэлектрода возникали высокоамплитудные
вольтамперную характеристику исследуемых на-
емкостные составляющие ионного тока, которые
триевых каналов, а также зависимость величины
сначала частично компенсировались аппаратным
«хордовой» проводимости от потенциала GNa(E):
способом, а затем полностью - программным.
Таким образом происходила реализация конфи-
GNa(E) = Iampl(E)/(E - ENa),
гурации «whole-cell». После этого микроэлектрод
где Iampl(E) - зависимость амплитудных значе-
вместе с нейроном поднимали над дном камеры,
ний натриевого тока от потенциала, ENa - вели-
что позволяло производить смену внеклеточного
раствора в ходе эксперимента без ухудшения
чина потенциала реверсии натриевого тока.
БИОФИЗИКА том 66
№ 4
2021
ВОЗМОЖНЫЙ МЕХАНИЗМ МОДУЛЯЦИИ КОРОТКИМИ ПЕПТИДАМИ
687
Следующим шагом являлось построение лога-
водимости, достигаемая при таких потенциалах,
рифмической потенциалочувствительности L(E)
когда все каналы оказываются открытыми (по ак-
с использованием метода Алмерса [20] для расче-
тивационному воротному механизму), можно по-
та Zeff каналов NaV1.8. Этот метод делает возмож-
строить функцию L(E) [20]:
ным оценить перенос заряда активационной во-
L(E) = ln(GNa_s(E)/(G
max - GNa_s(E))).
ротной системы каналов NaV1.8 на основании из-
мерения пиковой вольтамперной характеристики
Приведенная здесь функция L(E) позволяет
канала [20]. Исходя из того, что число открытых
определить «предельную логарифмическую чув-
каналов (No) пропорционально величине хордо-
ствительность» к потенциалу активационного во-
вой проводимости GNa(E), а число закрытых
ротного устройства каналов NaV1.8, поскольку
при переходе каналов из открытого в закрытое
каналов (Nc) соответствует
{Gmaax - GNa(E)}, где
состояние (при E → -∞) должно выполняться
GNamax - максимальная величина хордовой про- распределение Больцмана [20]:
lim(No/Nc) = lim{GNa(E)/[Gmaax - GNa(E)]} → C∙exp[(ZeffeE)/(kT)],
E → -∞
E → -∞
E → -∞
где С - константа, k - постоянная Больцмана,
ния). Полученные изображения анализировали с
T - абсолютная температура, Zeff - эффективный
использованием программ ImageJ и ZEN_2012.
заряд, выраженный в единицах заряда электрона.
Конформационный анализ молекул коротких
Согласно теории Алмерса, при величине E,
пептидов. Конформационный анализ молекул
стремящейся к -∞, функция С·exp[ZeffeE/kT]
тетрапептидов Ac-RERR-NH2 и Ac-REАR-NH2,
представляет собой одну экспоненту, которую в
а также молекулы трипептида Ac-RER-NH2 про-
логарифмическом масштабе можно представить с
веден методом Монте-Карло с последующей ми-
помощью регрессионной прямой, проходящей
нимизацией энергии [23] в рамках пакета про-
через три-пять начальных точек функции L(E).
грамм ZMM [24-28]. Поскольку моделировалось
Проведенный нами ранее анализ показывает, что
состояние пептидных молекул при их лиганд-ре-
именно каналы NaV1.8 позволяют применить ме-
цепторном связывании с белковой мишенью,
тод Алмерса для оценки Zeff с удовлетворитель-
значение диэлектрической проницаемости среды
ной точностью, поскольку их инактивационный
ε было принято постоянным и равным 10. Гуани-
процесс является достаточно медленным и не
диновые группы боковых цепей аргинильных
вносит дополнительной погрешности в измере-
остатков (R) считались положительно заряжен-
ния эффективного заряда, переносимого при от-
ными в связи с тем, что указанные группы оста-
крывании этих каналов [8].
ются протонированными даже в толще белка [29].
Карбоксильную группу боковой цепи остатка
Метод органотипической культуры ткани. Экс-
глутаминовой кислоты (E) рассматривали в двух
перименты проводили на эксплантатах дорзаль-
формах, отрицательно заряженной и электроней-
ных ганглиев 10-12-дневных куриных эмбрио-
тральной, так как трудно предположить одно-
нов, культивированных в чашках Петри на под-
значно, какой заряд несет указанная функцио-
ложках из коллагена в СО2-инкубаторе («Sanyo»,
нальная группа в момент образования лиганд-ре-
Япония) в течение трех суток при 36.5°С и 5%
цепторного комплекса.
СО2. Питательная среда содержала 45% раствора
Все вычисления проводили с применением
Хенкса, 40% среды Игла с добавлением инсулина
силового поля AMBER для расчета ван-дер-ва-
(0.5 ед/мл),
глюкозы
(0.6%),
глютамина
альсовых взаимодействий [30, 31]. Минимизация
(2 мкмоль/л), гентамицина (100 ед/мл) и 10% фе-
энергии молекулярной системы методом Монте-
тальной сыворотки коровы. Контрольными слу-
Карло прекращалась, когда 2000 последователь-
жили эксплантаты, культивированные только в
ных актов минимизации не приводили к сниже-
условиях питательной среды. Для количествен-
нию энергии обнаруживаемого в процессе расче-
ной оценки роста эксплантатов применяли мор-
тов глобального конформационного минимума.
фометрический метод [21, 22]. Индекс площади
Для дальнейшего анализа были отобраны все
(ИП) рассчитывали как отношение площади зо-
устойчивые конформации, обладающие энергией
ны роста эксплантата к исходной центральной
не выше 7 ккал/моль относительно наиболее низ-
площади, где находились немигрирующие клет-
коэнергетической из полученных конформаций.
ки. Контрольное значение ИП принимали за
100%. Для визуализации объектов использовали
Статистический анализ. Статистический ана-
микроскоп Axio Observer Z1 (Carl Zeiss, Герма-
лиз полученных экспериментальных данных про-
БИОФИЗИКА том 66
№ 4
2021
688
РОГАЧЕВСКИЙ и др.
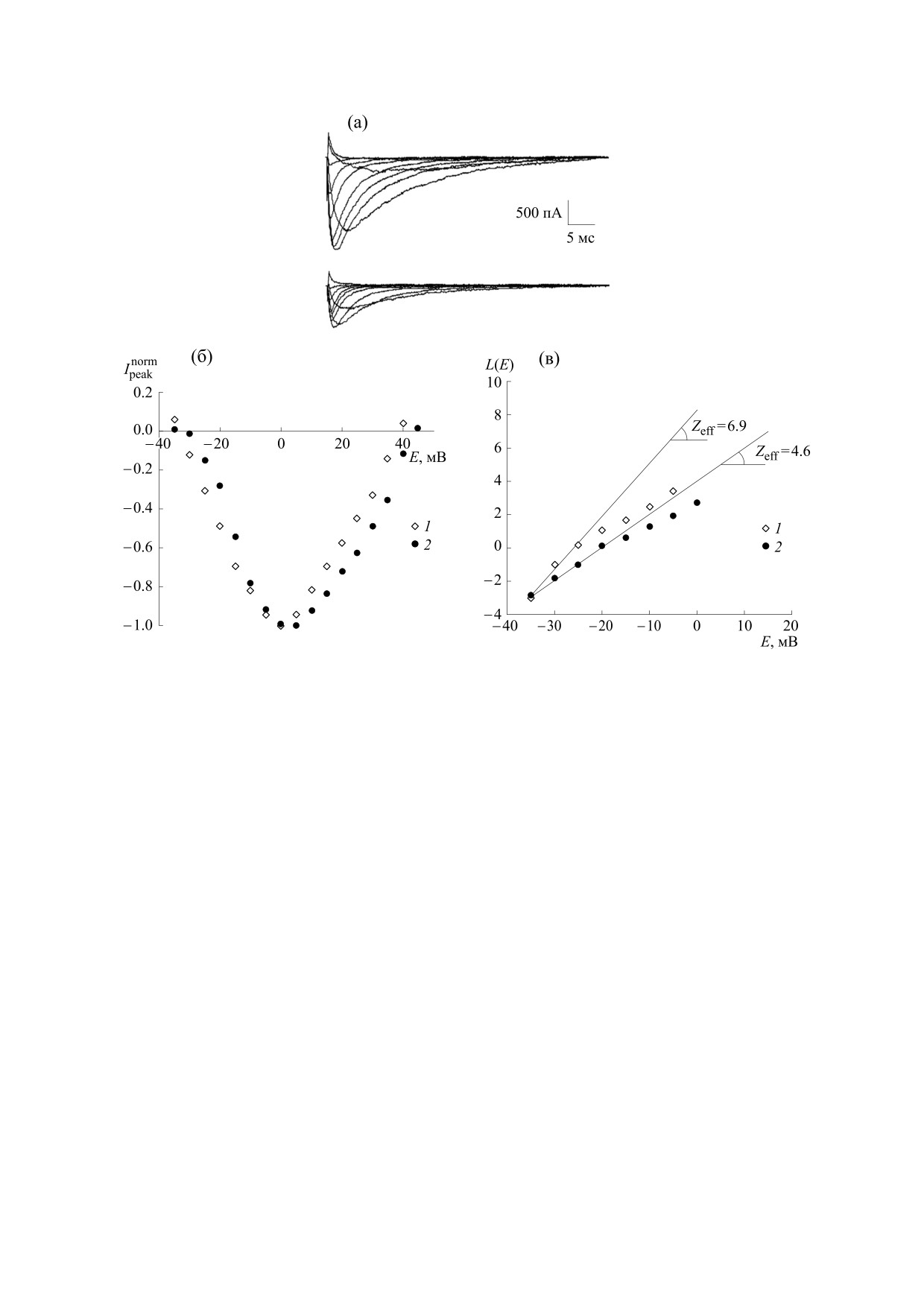
Рис. 1. Исследование влияния тетрапептида Ac-RERR-NH2 (100 нмоль/л) на функциональную активность каналов
NaV1.8. (а) - Семейства натриевых токов, полученные в контрольных условиях (сверху) и после приложения тетра-
пептида (снизу). Поддерживаемый потенциал -110 мВ, длительность 500 мс; тестирующий потенциал изменяли с ша-
гом 10 мВ. (б) - Нормированные пиковые вольтамперные характеристики медленных натриевых каналов, построен-
ные по данным контрольного эксперимента (квадраты) и после приложения тетрапептида (кружки). Поддерживае-
мый потенциал -110 мВ, длительность 500 мс; тестирующий потенциал изменяли с шагом 5 мВ. (в) -
Логарифмическая потенциалочувствительность L(E) в контрольных условиях (квадраты) и после приложения тетра-
пептида (кружки). Показано определение величин Zeff по тангенсу углов наклона регрессионных прямых.
водился с помощью программы STATISTICA 10.0
нального состояния клетки в условиях перфузии
с применением t-критерия Стьюдента (уровень
в течение эксперимента. Регистрация амплитуд-
статистической значимости различий экспери-
ных (пиковых) значений токов в ответ на каждую
ментальных и контрольных данных р < 0.05).
ступеньку напряжения позволила построить «пи-
ковую» вольтамперную характеристику Ipeak(E)
РЕЗУЛЬТАТЫ
(рис. 1б). Сравнение вольтамперных характери-
стик демонстрирует изменение крутизны левой
Результаты, полученные методом локальной
ветви указанной функции после воздействия тет-
фиксации потенциала. Семейства токов каналов
NaV1.8 в контрольных условиях и после приложе-
рапептида. Этот эффект, наблюдаемый при наи-
более отрицательных значениях мембранных по-
ния фрагмента молекулы дефенсина NP-1 (тетра-
тенциалов, при которых еще генерируются иссле-
пептид Ac-RERR-NH2, 100 нмоль/л) представле-
дуемые токи, позволяет с помощью метода
ны на рис. 1а. Небольшое снижение амплитуд то-
Алмерса количественно охарактеризовать про-
ков может быть обусловлено так называемым
«run-down» эффектом, который внутренне при-
цесс лиганд-рецепторного связывания
[20].
сущ методу локальной фиксации потенциала и
Функция L(E), описывающая «предельную лога-
заключается в постепенном снижении плотности
рифмическую чувствительность» к потенциалу
исследуемых каналов из-за ухудшения функцио-
активационного воротного устройства каналов
БИОФИЗИКА том 66
№ 4
2021
ВОЗМОЖНЫЙ МЕХАНИЗМ МОДУЛЯЦИИ КОРОТКИМИ ПЕПТИДАМИ
689
NaV1.8, представлена на рис. 1в. Тангенс угла на-
клона регрессионной прямой, построенной по
первым точкам функции L(E), позволяет опреде-
лить величину эффективного заряда (Zeff) актива-
ционного воротного устройства канала NaV1.8.
Приложение тетрапептида Ac-RERR-NH2 в кон-
центрации 100 нмоль/л снижало величину эф-
фективного заряда с контрольного значения
Zeff = 6.9 до значения 4.6 (рис. 1в).
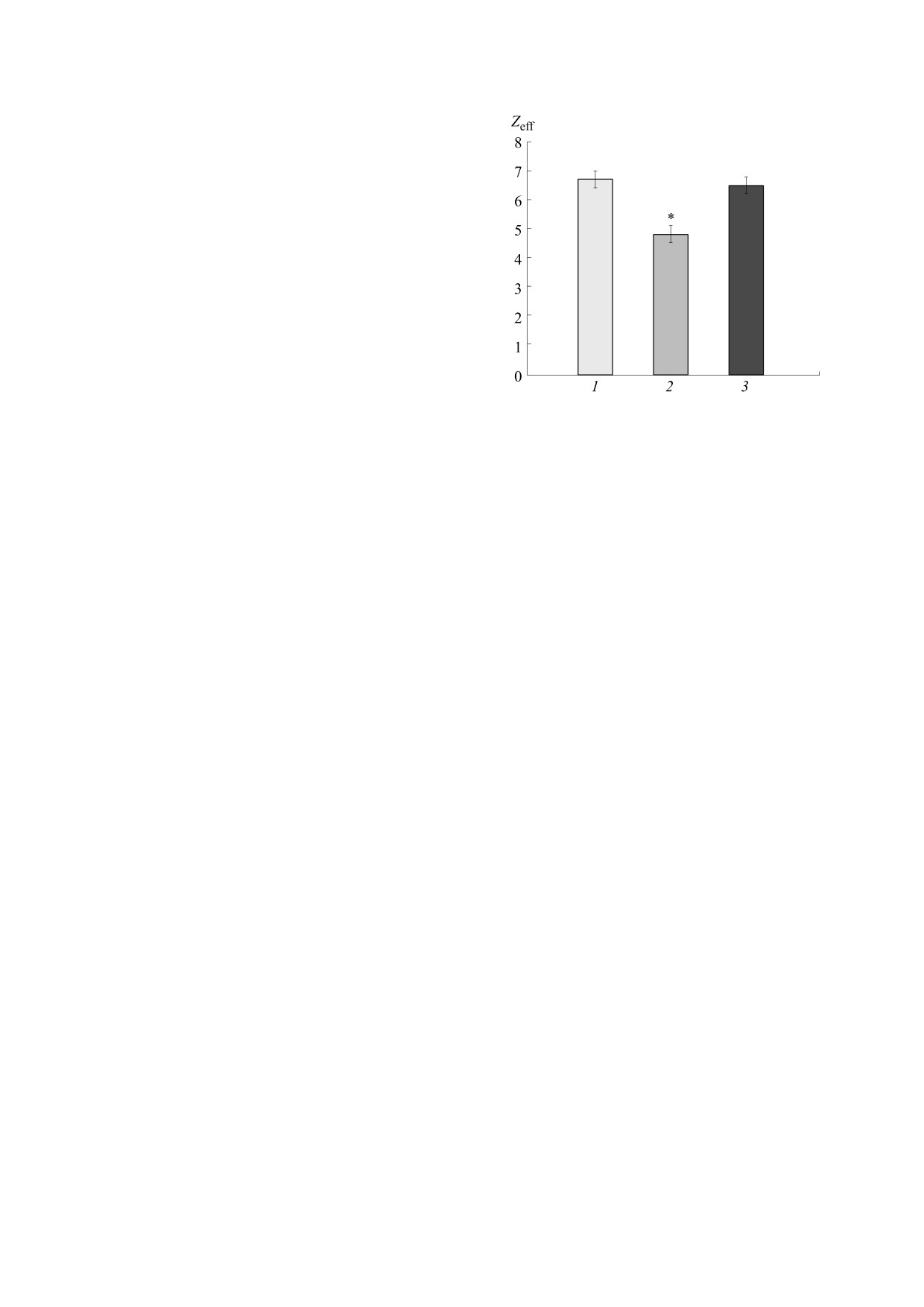
На рис. 2 представлены обобщенные данные
действия на Zeff двух исследованных тетрапепти-
дов. Эффективное связывание с каналом прояв-
ляет только тетрапептид Ac-RERR-NH2. После
его воздействия среднее значение Zeff достоверно
снижалось от 6.4 ± 0.3 (n = 17) в контрольных
условиях до 4.6 ± 0.3 (n = 23). Этот эффект полно-
Рис. 2. Значения величины эффективного заряда ак-
стью устранялся при замене одного из аргининов
тивационной воротной системы каналов NaV1.8 по-
на электронейтральный аланин: при воздействии
сле приложения тетрапептидов: 1 - контрольное зна-
тетрапептида Ac-REАR-NH2 (100 нмоль/л) вели-
чение эффективного заряда, Zeff = 6.7 ± 0.3 (n = 17);
чина Zeff не отличалась от контрольной и состави-
2 - значение эффективного заряда после приложе-
ния тетрапептида Ac-RERR-NH2
(100 нмоль/л),
ла 6.3 ± 0.3 (n = 22) (рис. 2). Полученные резуль-
Zeff = 4.6 ± 0.3 (n = 23); 3 - значение эффективного за-
таты указывают на важнейшую роль двух амино-
ряда после приложения тетрапептида Ac-REAR-NH2
кислотных остатков аргинина, которые должны
(100 нмоль/л), Zeff = 6.5 ± 0.3 (n = 22). * - Различие
находиться на определенном расстоянии друг от
между контрольными и экспериментальными дан-
друга в атакующей молекуле. Можно предполо-
ными статистически достоверно.
жить, что именно в этом случае происходит про-
цесс лиганд-рецепторного связывания атакую-
щей молекулы с молекулой канала NaV1.8. На-
женными нейритстимулирующими свойствами
сколько специфичен этот процесс или, другими
только в случае его применения в очень низкой
словами, существует ли другая мишень на мем-
концентрации (0.1 нмоль/л). Иными словами,
бране сенсорного нейрона, с которой также мо-
данный тетрапептид может запускать сигналь-
жет происходить связывание тетрапептида Ac-
ный каскад, ведущий к росту нейритов эмбрио-
RERR-NH2, было исследовано нами методом ор-
нальной нервной ткани. Мембранная мишень,
активация которой приводит к запуску этого про-
ганотипического культивирования.
цесса, остается неизвестной. Тот факт, что дей-
Результаты, полученные методом органотипиче-
ствие изучаемого тетрапептида не приводит к ин-
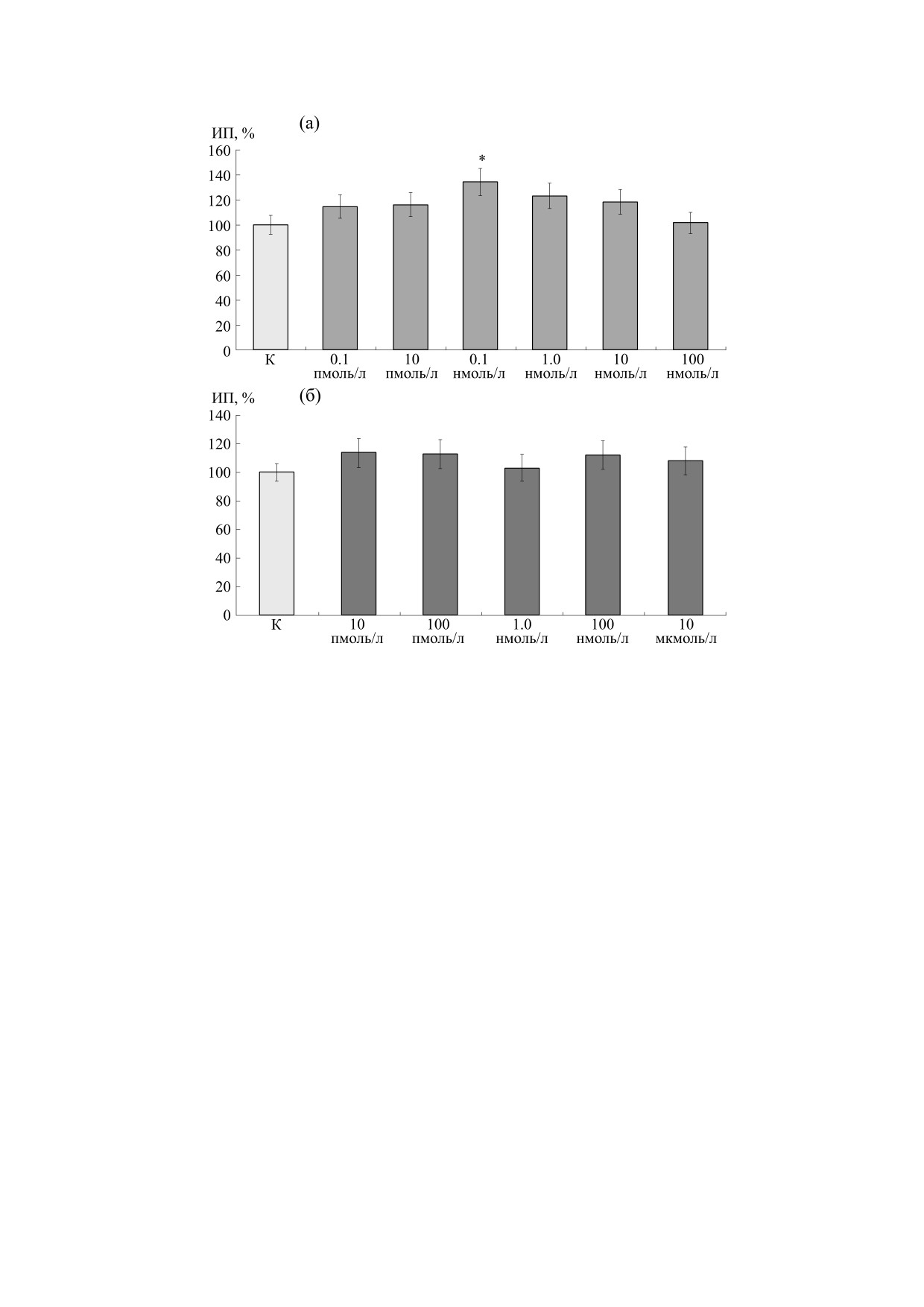
ской культуры ткани. Тетрапептид Ac-RERR-NH2
гибированию роста, свидетельствует о вероятной
был исследован в концентрациях 0.1 пмоль/л,
безопасности действия исследуемого агента.
10 пмоль/л, 0.1 нмоль/л, 1 нмоль/л, 10 нмоль/л и
Влияние тетрапептида Ac-REAR-NH2 на рост
100 нмоль/л (рис.
3а). В концентрациях
0.1 пмоль/л и 10 пмоль/л исследуемый агент
нейритов сенсорных нейронов было исследовано
практически не влиял на рост нейритов. ИП экс-
также в широком диапазоне концентраций от
плантатов дорзальных ганглиев не отличался от
10 пмоль/л до 10 мкмоль/л (рис. 3б). Введение в
контрольного значения. В концентрации
питательную среду указанного агента не влияло
0.1 нмоль/л указанный тетрапептид проявлял
на рост нейритов дорзальных ганглиев. Этот ре-
нейрит-стимулирующее действие: его введение в
зультат свидетельствует о том, что данный тетра-
питательную среду вызывало достоверную стиму-
пептид не имеет специфического действия на
ляцию роста нейритов в среднем на 34%. При до-
мембрану сенсорного нейрона.
бавлении в культуральную среду Ac-RERR-NH2 в
Результаты применения конформационного ана-
концентрации 1 нмоль/л наблюдали недостовер-
лиза для выяснения механизмов лиганд-рецептор-
ную стимуляцию роста нейритов. ИП экспери-
ного связывания исследуемых пептидов с медлен-
ментальных эксплантатов был выше на 20%.
ными натриевыми каналами. Молекулярный меха-
В концентрациях 10 нмоль/л и 100 нмоль/л Ac-
низм лиганд-рецепторного связывания коротких
RERR-NH2 также практически не влиял на рост
пептидов с медленными натриевыми каналами
нейритов дорзальных ганглиев. Таким образом,
NaV1.8 может быть объяснен образованием двух
полученные результаты свидетельствуют о том,
ион-ионных связей между положительно заря-
что тетрапептид Ac-RERR-NH2 обладает выра-
женными гуанидиновыми группами боковых
БИОФИЗИКА том 66
№ 4
2021
690
РОГАЧЕВСКИЙ и др.
Рис. 3. Влияние тетрапептидов в различных концентрациях на рост нейритов дорзальных ганглиев: (a) - значения ИП
после приложения тетрапептида Ac-RERR-NH2; (б) - значения ИП после приложения тетрапептида Ac-REAR-NH2.
Светлые столбики - контрольные значения; * - различие достоверно относительно контрольных эксплантатов,
p < 0.05.
цепей аргинильных остатков и отрицательно
мам азота. Пространственное строение наиболее
заряженными функциональными группами, вхо-
низкоэнергетических конформаций молекул Ac-
дящими в состав аминокислотной последова-
REAR-NH2, Ac-RERR-NH2 и Ac-RER-NH2
тельности канала. Дополнительным указанием на
представлено на рис. 4. Для каждой из молекул
это служит тот факт, что молекула трипептида Ac-
приведены две формы: в одной из них карбок-
RЕR-NH2, в котором присутствуют два арги-
сильная группа боковой цепи остатка глутамино-
нильных остатка, достоверно уменьшает величи-
вой кислоты несла отрицательный заряд, в другой
ну эффективного заряда активационного ворот-
данная группа считалась электронейтральной.
ного устройства каналов NaV1.8 [32].
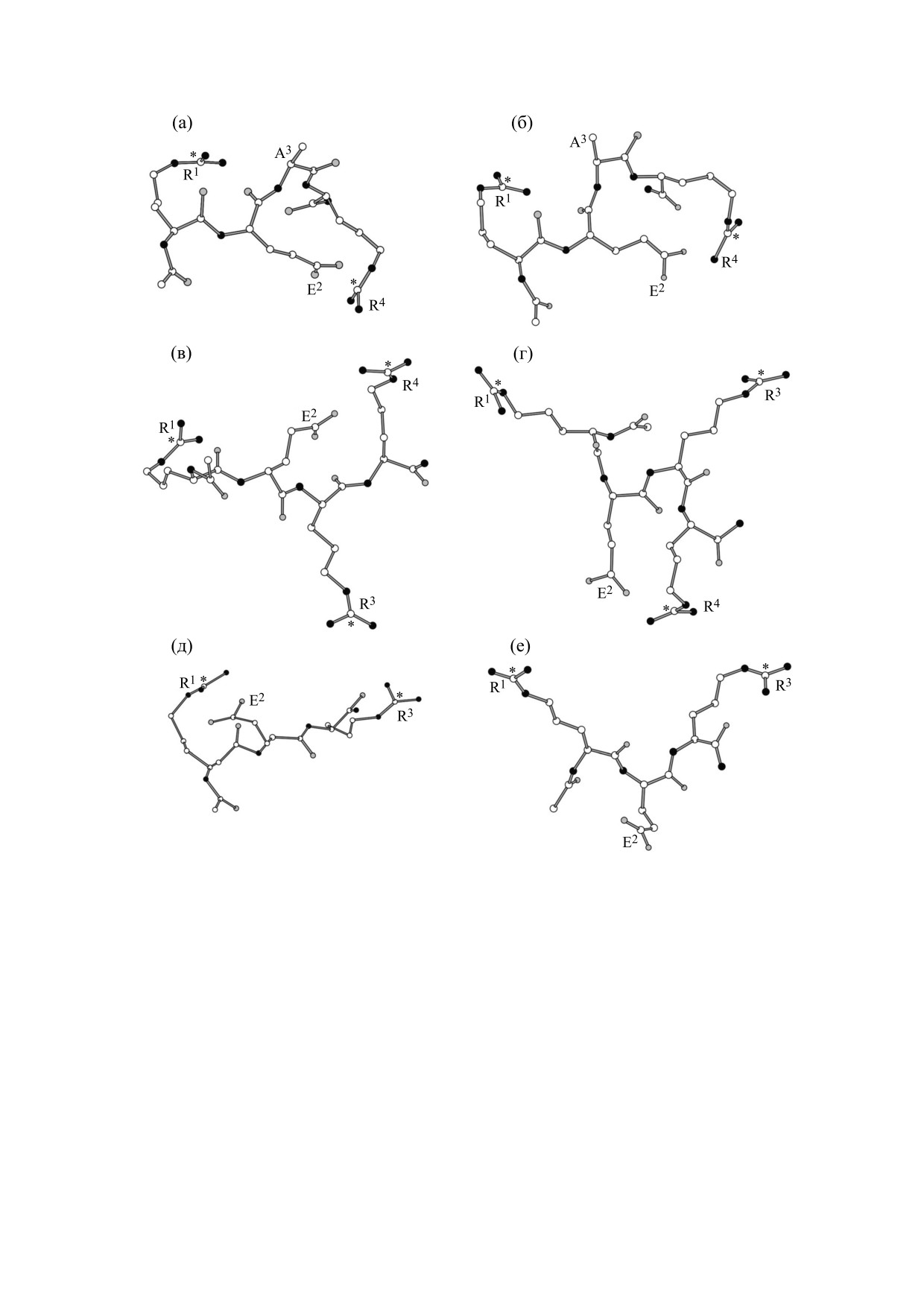
Для молекулы тетрапептида Ac-REAR-NH2 по-
Одной из задач проведения конформационно-
лучено 126 конформаций, когда боковую цепь
остатка глутаминовой кислоты рассматривали в
го анализа изучаемых пептидов являлась попытка
отрицательно заряженной форме (рис.
4а), и
определения оптимального расстояния между гу-
297 конформаций, если она была электроней-
анидиновыми группами при их связывании с мо-
тральной (рис. 4б). Средние значения расстояний
лекулярной мишенью. В качестве параметра,
описывающего расстояние между данными груп-
R1-R4 между гуанидиновыми группами по обеим
пами, было выбрано расстояние между атомами
полученным выборкам составляют 9.2 ± 1.3 и
углерода, входящими в состав гуанидиновых
10.7 ± 1.4 Å соответственно. Отметим, что в выбор-
групп, поскольку положение этих атомов при-
ках из 50 наиболее низких по энергии конформа-
мерно соответствует геометрическим центрам
ций молекулы Ac-REAR-NH2 вне зависимости от
указанных функциональных групп, положитель-
заряда глутаминовой кислоты указанные расстоя-
ный заряд которых делокализован по трем ато-
ния не превышают 10 Å в 90% случаев.
БИОФИЗИКА том 66
№ 4
2021
ВОЗМОЖНЫЙ МЕХАНИЗМ МОДУЛЯЦИИ КОРОТКИМИ ПЕПТИДАМИ
691
Рис. 4. Пространственное строение наиболее низкоэнергетических конформаций молекул Ac-REAR-NH2, Ac-RERR-
NH2 и Ac-RER-NH2: (а) - молекула Ac-REAR-NH2, карбоксильная группа боковой цепи остатка глутаминовой кис-
лоты заряжена отрицательно; (б) - молекула Ac-REAR-NH2, карбоксильная группа боковой цепи остатка глутамино-
вой кислоты электронейтральна; (в) - молекула Ac-RERR-NH2, карбоксильная группа боковой цепи остатка глута-
миновой кислоты заряжена отрицательно; (г) - молекула Ac-RERR-NH2, карбоксильная группа боковой цепи остат-
ка глутаминовой кислоты электронейтральна; (д) - молекула Ac-RER-NH2, карбоксильная группа боковой цепи
остатка глутаминовой кислоты заряжена отрицательно; (е) - молекула Ac-RER-NH2, карбоксильная группа боковой
цепи остатка глутаминовой кислоты электронейтральна. Белые кружки - атомы углерода, серые кружки - атомы кис-
лорода, черные кружки - атомы азота. Приведена нумерация аминокислотных остатков. Атомы углерода гуанидино-
вых групп боковых цепей аргинильных остатков отмечены звездочками, атомы водорода не показаны.
Когда карбоксильная группа остатка глутами-
заряда - 183 конформации (рис. 4г). Средние зна-
новой кислоты была заряжена отрицательно, для
чения расстояний между гуанидиновыми группа-
молекулы Ac-RERR-NH2 обнаружено 92 кон-
ми R1-R3, R1-R4 и R3-R4 в первом случае равны
формации (рис. 4в); когда данная группа не несла
12.2 ± 1.9, 11.8 ± 1.7 и 10.9 ± 1.6 Å соответственно,
БИОФИЗИКА том 66
№ 4
2021
692
РОГАЧЕВСКИЙ и др.
тогда как во втором - 12.9 ± 1.5, 12.4 ± 1.3 и
В подавляющем большинстве низкоэнергети-
12.2 ± 1.6 Å соответственно. При этом в выборках
ческих конформаций молекулы Ac-REAR-NH2
из 50 наиболее низкоэнергетических конформа-
расстояния между гуанидиновыми группами со-
ций молекулы Ac-RERR-NH2 все описанные
ставляют менее 10 Å, тогда как в аналогичных вы-
расстояния оказываются больше 10 Å в 80% кон-
борках конформаций молекулы Ac-RERR-NH2 в
формаций.
обеих рассмотренных формах и молекулы Ac-
Для получения дополнительных данных о воз-
RЕR-NH2 в случае, когда карбоксильная группа
можных величинах расстояний между гуаниди-
боковой цепи глутаминовой кислоты считалась
новыми группами в молекулах коротких пепти-
электронейтральной, указанные расстояния пре-
дов, способных к лиганд-рецепторному связыва-
вышают 10 Å. Можно предположить, что тетра-
нию с молекулой канала NaV1.8, нами был также
пептид Ac-RЕАR-NH2 не оказывает модулирую-
проведен конформационный анализ молекулы
щего действия на натриевые каналы NaV1.8 в силу
трипептида Ac-RER-NH2. Обнаружено 226 кон-
того, что расстояние между гуанидиновыми груп-
формаций указанной молекулы при заряженной
пами, ответственными за образование ион-ион-
форме боковой цепи глутаминовой кислоты (рис.
ных связей между атакующей молекулой и ами-
4д) и 340 конформаций, если данная группа счи-
нокислотной последовательностью канала, мень-
талась электронейтральной (рис. 4е). Средние ве-
ше порогового значения, составляющего 10 Å.
личины расстояний R1-R3 оказались равными
Также можно высказать предположение о том,
10.1 ± 1.6 и 12.7 ± 1.7 Å соответственно. В 37 из
что в момент образования лиганд-рецепторного
50 наиболее низких по энергии конформаций мо-
комплекса между молекулами изучаемых корот-
лекулы Ac-RER-NH2 эти расстояния составляют
ких пептидов и молекулой канала NaV1.8 карбок-
меньше 10 Å, если карбоксильная группа заря-
сильная группа боковой цепи остатка глутамино-
жена отрицательно, тогда как в случае ее элек-
вой кислоты является незаряженной, поскольку,
тронейтральной формы, наоборот, расстояния
несмотря на однозначно проявляемый молеку-
лой трипептида Ac-RЕR-NH2 физиологический
R1-R3 превышают 10 Å в 44 из 50 наиболее низко-
энергетических конформаций.
эффект, расстояния между гуанидиновыми груп-
пами в полностью ионизированной форме дан-
Депротонирование карбоксильной группы бо-
ной молекулы составляют менее 10 Å в большин-
ковой цепи остатка глутаминовой кислоты при-
стве ее низкоэнергетических конформаций за
водит к заметному уменьшению общего числа
счет образования внутримолекулярных ион-ион-
конформаций молекул рассматриваемых корот-
ных связей. Дополнительным аргументом в поль-
ких пептидов. Это можно объяснить образовани-
зу последнего предположения является необхо-
ем внутримолекулярных ион-ионных связей с
димость разрыва этих внутримолекулярных свя-
участием данной отрицательно заряженной груп-
зей перед образованием межмолекулярных ион-
пы и одной из положительно заряженных гуани-
ионных связей при формировании лиганд-рецеп-
диновых групп аргинильных остатков, что огра-
торного комплекса с участием тех же гуанидино-
ничивает конформационную свободу молекул
вых групп, что не требуется, если карбоксильная
пептидов. Если глутаминовая кислота является
группа глутаминовой кислоты является электро-
электронейтральной, подобные связи, очевидно,
нейтральной. Итак, в результате проведенных
не образуются.
расчетов можно сделать вывод о том, что ключе-
Замена одного из аргинильных остатков на
выми структурами при лиганд-рецепторном свя-
остаток аланина при переходе от молекулы Ac-
зывании исследованных нами аргининсодержа-
RERR-NH2 к молекуле Ac-REAR-NH2 вызывает
щих коротких пептидов являются гуанидиновые
уменьшение расстояния между гуанидиновыми
группы боковых цепей аргинильных остатков,
группами во всех рассматриваемых формах дан-
расстояние между которыми должно быть не ме-
ных молекул по двум причинам. Во-первых, мо-
нее 10 Å.
лекула Ac-RERR-NH2 содержит три положитель-
но заряженных гуанидиновых группы, которые
ОБСУЖДЕНИЕ
электростатически отталкиваются друг от друга.
Во-вторых, присутствие остатка аланина вместо
Основным результатом настоящей работы яв-
объемной боковой цепи аргинильного остатка R3
ляется обнаружение сильного влияния тетрапеп-
позволяет гуанидиновой группе аргинильного
тида Ac-RERR-NH2 на потенциалочувствитель-
остатка R4 в молекуле Ac-REAR-NH2 подходить
ность медленных натриевых каналов NaV1.8. Это
на более близкое расстояние к карбоксильной
позволило предположить, что исследуемый агент
группе боковой цепи глутаминовой кислоты Е2,
в качестве своей специфической мишени имеет
чем это возможно в молекулах тетрапептида Ac-
определенный сайт, являющийся фрагментом
RERR-NH2 и трипептида Ac-RЕR-NH2.
структуры канала NaV1.8, связывание с которым
БИОФИЗИКА том 66
№ 4
2021
ВОЗМОЖНЫЙ МЕХАНИЗМ МОДУЛЯЦИИ КОРОТКИМИ ПЕПТИДАМИ
693
приводит к снижению переноса эффективного
уменьшению общего количества конформаций
заряда активационной воротной системой ука-
пептидной молекулы за счет электростатического
занного канала. Относительно низкая концен-
отталкивания между тремя присутствующими в
трация тетрапептида (100 нмоль/л), вызывающая
молекуле Ac-RЕRR-NH2 гуанидиновыми груп-
снижение Zeff, указывает на высокую специфич-
пами, что ограничивает конформационную сво-
ность его действия на канал, что подтверждается
боду указанной молекулы по сравнению с моле-
отсутствием ингибирующего влияния данного
кулами Ac-RЕR-NH2 и Ac-RЕАR-NH2. Видимо,
агента, исследованного в широкой области кон-
это «помогает» атакующей пептидной молекуле
центраций, на рост нейритов эмбриональной
принять продуктивную конформацию для фор-
нервной ткани. Все это делает тетрапептид Ac-
мирования лиганд-рецепторного комплекса.
RERR-NH2 весьма перспективным претенден-
Основываясь на результатах проведенного
том на роль анальгетической лекарственной суб-
конформационного анализа, можно предполо-
станции. Ранее нами был обнаружен аналогич-
жить, что в образовании лиганд-рецепторного
ный эффект при изучении трипептида Ac-RER-
комплекса между молекулой тетрапептида Ac-
NH2 [32].
RЕRR-NH2 и молекулой канала NaV1.8 задей-
Известно, что ди- и трипептиды могут транс-
ствованы аргинильные остатки R1 и R3, расстоя-
портироваться в клетку с помощью переносчиков
ние между гуанидиновыми группами которых в
Pept1 и Pept2. Pept1 отличается низкой субстрат-
большинстве полученных конформаций указан-
ной специфичностью (способен транспортиро-
ного тетрапептида превышает пороговое значе-
вать 400 различных дипептидов, 8000 трипепти-
ние, равное 10 Å. Молекула тетрапептида Ac-
дов, лекарственные препараты, имитирующие
RЕАR-NH2 оказывается неспособной к лиганд-
структуру ди- и трипептидов, - антибиотики,
рецепторному связыванию как минимум в силу
противовирусные препараты) и низким срод-
того, что в большинстве низких по энергии кон-
ством к субстратам [33, 34]. Транспортер Pept2
формаций данной молекулы расстояния между
может использовать в качестве субстратов ди-,
гуанидиновыми группами меньше этого порого-
три- и тетрапептиды (предпочтительно дипепти-
вого значения. Основной вклад в энергию обра-
ды) [35, 36]. Ди- и трипептиды могут взаимодей-
зования лиганд-рецепторного комплекса, по всей
ствовать непосредственно с ДНК живой клетки
видимости, вносят высокоэнергетические ион-
благодаря своим малым размерам [37, 38]. В отли-
ионные связи между положительно заряженны-
чие от этого, данные о механизмах прямой до-
ми гуанидиновыми группами боковых цепей ар-
ставки тетрапептидов в ядро нервной клетки в ли-
гинильных остатков молекулы Ac-RERR-NH2 и
тературе отсутствуют.
отрицательно заряженными нуклеофильными
Увеличение последовательности атакующего
группами в составе молекулы канала NaV1.8. По-
пептида до четырех аминокислот посредством до-
следний вывод может быть подкреплен тем фак-
бавления еще одного аргинильного остатка вы-
том, что при замене всех аргинильных остатков в
звало сильное снижение величины Zeff до 4.6 ± 0.3
молекуле гексапептида Ac-PRЕRRA-NH2 на
(n = 23) при концентрации пептида 100 нмоль/л.
остатки лизина сохранилась способность атакую-
Подчеркнем, что данная концентрация на поря-
щей молекулы снижать величину Zeff активаци-
док ниже, чем концентрация трипептида Ac-
онного воротного устройства медленного натрие-
RЕR-NH2, способная вызвать подобный эффект.
вого канала NaV1.8 [13].
Это свидетельствует о более высокой аффинно-
Итак, применение метода локальной фикса-
сти молекулы Ac-RERR-NH2 по сравнению с мо-
ции потенциала и конформационного анализа
лекулой Ac-RЕR-NH2 к соответствующему сайту
для выяснения механизмов лиганд-рецепторного
связывания, принадлежащему аминокислотной
связывания изучаемых молекул с каналами
последовательности канала NaV1.8.
NaV1.8 позволило продемонстрировать, что удли-
Полученные результаты указывают на то, что,
нение аминокислотной последовательности ар-
во-первых, эффективность узнавания атакующей
гининсодержащих коротких пептидов не должно
молекулы может определяться ее общим положи-
с необходимостью приводить к увеличению рас-
тельным зарядом, поскольку при переходе от мо-
стояния между потенциально участвующими в
лекулы Ac-RЕR-NH2 к молекуле Ac-RЕRR-NH2
лиганд-рецепторном связывании гуанидиновы-
наблюдается снижение действующей концентра-
ми группами аргинильных остатков. Как показа-
ции агента. Во-вторых, добавление положитель-
но в настоящей работе, при переходе от молекулы
но заряженного аргинильного остатка приводит к
Ac-RER-NH2 к молекуле Ac-REAR-NH2 это рас-
БИОФИЗИКА том 66
№ 4
2021
694
РОГАЧЕВСКИЙ и др.
стояние, наоборот, уменьшается, что объясняет
11. В. Б. Плахова, И. В. Рогачевский, Б. Ф. Щеголев
и др., Сенсорные системы 19 (2), 110 (2005).
неспособность связывания последнего агента с
исследуемым каналом. Функционально активны-
12. В. Б. Плахова, Б. Ф. Щеголев, И. В. Рогачевский
и др., Российский физиологический журнал
ми оказываются пептиды, в молекулах которых
им. И. М. Сеченова 86 (11), 1471 (2000).
указанное расстояние превышает 10 Å. Предпо-
13. В. Б. Плахова, И. В. Рогачевский, Т. Н. Шелых
ложительно, оптимальным в соответствии с этим
и др., Мед. акад. журн. 13 (3), 78 (2013).
критерием является расстояние между гуаниди-
14. В. Б. Плахова, И. В. Рогачевский, Т. Н. Шелых
новыми группами аргинильных остатков R1 и R3
и др., Сенсорные системы 30 (3), 234 (2016).
в молекуле Ac-RERR-NH2, что делает данный
15. A. A. Elliott and J. R. Elliott, J. Physiol. (Lond.) 463,
тетрапептид перспективным претендентом на
39 (1993).
роль лекарственной субстанции нового анальге-
16. P. G. Kostyuk, O. A. Krishtal, and V. I. Pidoplichko,
тика.
Nature 257, 691 (1975).
17. O. P. Hamill, A. Marty, E. Neher, et al., Pflügers Arch.
ФИНАНСИРОВАНИЕ РАБОТЫ
391, 85 (1981).
Данное исследование выполнено в рамках ре-
18. Б. В. Крылов, Ю. Ю. Вилин, С. А. Подзорова и др.,
ализации Программы НЦМУ и при финансовой
Сенсорные системы 10 (4), 52 (1996).
поддержке Министерства образования и науки
19. Y. V. Osipchuk and E. N. Timin in Intracellular Perfu-
Российской Федерации (соглашение № 075-15-
sion of Excitable Cells, Ed. by P. G. Kostyuk and
O. A. Krishtal (J. Wiley & Sons, Inc., 1984), pp. 103-
2020-921 от 13.11.2020 г.).
129.
20. В. Алмерс, Мембраны: ионные каналы, под ред.
КОНФЛИКТ ИНТЕРЕСОВ
Ю. А. Чизмаджева (Мир, М., 1981), с. 129-236.
21. V. B. Plakhova, V. A. Penniyaynen, I. L. Yachnev, et al.,
Авторы заявляют об отсутствии конфликта
Can. J. Physiol. Pharmacol. 97, 400 (2019).
интересов.
22. V. A. Penniyaynen, V. B. Plakhova, I. V. Rogachevsky,
et al., Pathophysiology 26, 245 (2019).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
23. Z. Li and H. A. Scheraga, J. Mol. Struct. (THEO-
CHEM) 179, 333 (1988).
Все применимые международные, националь-
ные и институциональные принципы ухода и ис-
24. B. S. Zhorov, J. Struct. Chem. 22, 4 (1981).
пользования животных при выполнении работы
25. B. S. Zhorov, J. Struct. Chem. 23, 649 (1982).
были соблюдены.
26. B. S. Zhorov and V. S. Ananthanarayanan, J. Biomol.
Struct. Dyn. 14, 173 (1996).
СПИСОК ЛИТЕРАТУРЫ
27. B. S. Zhorov and S. X. Lin, Proteins 38, 414 (2000).
1. P. G. Kostyuk, N. S. Veselovsky, and A. Y. Tsyndrenko,
Neuroscience 6, 2423 (1981).
29. C. A. Fitch, G. Platzer, M. Okon, et al., Prot. Sci. 24,
752 (2015).
2. Н. С. Веселовский, П. Г. Костюк и А. Я. Цындрен-
ко, Докл. АН СССР 249 (60), 1466 (1979).
30. S. J. Weiner, P. A. Kollman, D. A. Case, et al., J. Am.
Chem. Soc. 106, 765 (1984).
3. M. S. Gold, D. B. Reichling, M. J. Shuster, et al., Proc.
31. S. J. Weiner, P. A. Kollman, D. T. Nguyen, and
Natl. Acad. Sci. USA 93, 1108 (1996).
D. A. Case, J. Comput. Chem. 7, 230 (1986).
4. С. В. Ревенко и И. Ю. Гаврилов, Биол. мембраны
32. Т. Н. Шелых, И. В. Рогачевский, А. Д. Ноздрачев
24 (1), 70 (2007).
и др., Докл. РАН 466 (6), 734 (2016).
5. L. V. Borovikova, D. V Borovikov, V. V. Ermishkin,
et al., Prim. Sensory Neuron 2, 65 (1997).
33. B. Spanier and F. Rohm, Compr. Physiol. 8, 843
(2018).
6. A. N. Akopian, L. Sivilotti, and J. N. Wood, Nature
379, 257 (1996).
34. F. H. Mourad and N. E. Saadé, Prog. Neurobiol. 95,
7. J. Lai, F. Porreca, J. C. Hunter, and M. S. Gold, Annu.
149 (2011).
Rev. Pharmacol. Toxicol. 44, 371 (2004).
35. X. Chen, R. F. Keep, Y. Liang, et al., Biochem. Phar-
8. B. V. Krylov, I. V. Rogachevskii, T. N. Shelykh, et al.,
macol. 131, 89 (2017).
Frontiers in pain science. Volume 1. New non-opioid an-
36. Y. J. Fei, J. C. Liu, T. Fujita, et al., Biochem. Biophys.
algesics: understanding molecular mechanisms on the ba-
Res. Commun. 246, 39 (1998).
sis of patch-clamp and quantum-chemical studies (Ben-
tham Science Publishers Ltd, Sharjah UAE, 2017).
37. V. Khavinson, N. Linkova, E. Kukanova, et al., J. Neu-
9. R. I. Lehrer and T. Ganz, Blood 76, 2169 (1990).
rol. Neurosci. 8, 1 (2016)
10. В. Н. Кокряков, Биология антибиотиков животно-
38. N. Kolchina, V. Khavinson, N. Linkova, et al., Nucl.
го происхождения (Наука, СПб., 1999).
Acids Res. 47, 10553 (2019).
БИОФИЗИКА том 66
№ 4
2021
ВОЗМОЖНЫЙ МЕХАНИЗМ МОДУЛЯЦИИ КОРОТКИМИ ПЕПТИДАМИ
695
A Possible Mechanism of Modulation of Slow Sodium Channels in the Sensory Neuron
Membrane by Short Peptides
I.V. Rogachevsky, A.D. Kalinina, V.A. Penniyaynen, S.G. Terekhin, S.A. Podzorova,
B.V. Krylov, and V.B. Plakhova
Pavlov Institute of Physiology, Russian Academy of Sciences, nab. Makarova 6, St. Petersburg, 199034 Russia
Possible mechanisms of ligand-receptor binding of arginine-containing tetrapeptides to the NaV1.8 channels
in the primary sensory neuron were investigated. The tetrapeptide Ac-RERR-NH2, acting outside the neu-
ronal membrane, was found to decrease voltage sensitivity of the channels examined. By contrast, the tetra-
peptide Ac-REАR-NH2 did not exhibit the same effect. Conformational analysis used to elucidate the
mechanisms of ligand-receptor binding of a number of short peptides investigated herein suggested that pos-
itively charged guanidinium groups at the side chains of two arginine residues play a key role in peptide bind-
ing. Another amino acid residue (glutamic acid) should be present between these two arginine residues. Our
calculations showed that the mechanism of ligand-receptor binding cannot come into effect, if the value of
the distance between the guanidinium groups in short peptides molecules is less than a defined threshold val-
ue. From the results obtained it can be concluded that the tetrapeptide Ac-RERR-NH2 and several other
peptides capable to bind to the NaV1.8 channel by the same molecular mechanism have the potential to be the
medicinal substances of novel analgesics with peripheral targets.
Keywords: short peptides, NaV1.8 channels, nociceptive neuron, conformational analysis
БИОФИЗИКА том 66
№ 4
2021