БИОФИЗИКА, 2021, том 66, № 4, с. 711-719
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ГЕНЕРАЦИЯ СУПЕРОКСИДНЫХ РАДИКАЛОВ МИТОХОНДРИЯМИ
СЕРДЦА И ДЕЙСТВИЕ ДИНИТРОЗИЛЬНЫХ
КОМПЛЕКСОВ ЖЕЛЕЗА И ФЕРРИТИНА
© 2021 г. В.А. Медведева*, **, М.В. Иванова**, К.Б. Шумаев**, ***,
А.Л. Дудылина**, Э.К. Рууге*, **
*Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
**Национальный медицинский исследовательский центр кардиологии Минздрава России,
121552, Москва, 3-я Черепковская ул., 15а
***ФИЦ «Фундаментальные основы биотехнологии» РАН, 119071, Москва, Ленинский просп., 33/2
E-mail: ruuge@mail.ru
Поступила в редакцию 16.04.2021 г.
После доработки 16.04.2021 г.
Принята к публикации 20.04.2021 г.
Одной из причин риска развития различного рода патологий считаются нарушения в функциони-
ровании митохондрий, которые могут быть обусловлены чрезмерным образованием токсичных
форм кислорода и азота в состоянии окислительного стресса. Продукция этих активных форм в жи-
вых организмах происходит постоянно в результате действия ферментных систем, а также в ходе
окислительно-восстановительных реакций, например, таких как катализируемые ионами железа
реакции Фентона и Габера-Вейса. В литературе появляется все больше данных о связи метаболизма
ферритина, активных форм кислорода, оксида азота и динитрозильных комплексов железа, а также
о важной роли динитрозильных комплексов железа в механизмах антиоксидантной защиты. С по-
мощью ЭПР-спектроскопии спиновых ловушек, спектрофотометрии и полярографии проведено
исследование прооксидантных и антиоксидантых свойств динитрозильных комплексов железа и
ферритина в супероксидгенерирующих системах: митохондриях сердца и системе «ксантин-
ксантиноксидаза». Показано, что динитрозильные комплексы железа с глутатионовыми лигандами
перехватывают реакционноспособные свободные радикалы в системах, моделирующих окисли-
тельный стресс в клетках сердечной мышцы. В этих условиях ферритин стимулировал разрушение
динитрозильных комплексов железа. Полученные данные указывают на антиоксидантное и анти-
радикальное действие динитрозильных комплексов железа и, напротив, прооксидантный эффект
ферритина.
Ключевые слова: супероксидные радикалы, динитрозильные комплексы железа, ферритин, антиокси-
данты, сердце, митохондрии, электронный парамагнитный резонанс.
DOI: 10.31857/S0006302921040104
значительные изменения редокс-потенциалов
Образование активных форм кислорода
переносчиков электронтранспортной цепи мито-
(АФК) постоянно происходит в живых организ-
хондрий, что приводит к резкому возрастанию
мах в результате побочных реакций дыхательной
скорости продукции АФК [1].
цепи митохондрий и других окислительно-вос-
становительных процессов. Основными мишеня-
Существенное значение для энергетического
ми АФК являются органы с интенсивным мета-
метаболизма и генерации свободных радикалов
кислорода в биологических системах имеют ионы
болизмом и высоким энергетическим потребле-
нием: скелетные мышцы, почки, печень и сердце.
железа, их гемовые и негемовые комплексы. Фер-
ритин - гетерополимер, состоящий из двух типов
В кардиомиоцитах при увеличении внутрикле-
субъединиц-цепей: тяжелой (H) и легкой (L) -
точной концентрации кислорода, в том числе при
является основным депо железа у большинства
реоксигенации после гипоксии, и снижении
живых организмов и может проявлять как анти-
энергетического метаболизма могут происходить
оксидантные, так и прооксидантные свойства. В
Сокращения: АФК - активные формы кислорода, ДНКЖ -
нормальных условиях поддерживается динамиче-
динитрозильные комплексы железа .
ское равновесие между выходом железа и его за-
711
712
МЕДВЕДЕВА и др.
пасанием в ферритине, что обеспечивает низкий
го альбумина. Полученную суспензию митохон-
уровень свободного железа, тем самым снижается
дрий (30-70 мг белка/мл) хранили во льду.
выход АФК. Железо высвобождается из феррити-
Определение функциональной активности мито-
на в результате восстановления Fe(III) до Fe(II)
хондрий. Скорость потребления кислорода мито-
донорами электронов, и это может происходить в
хондриальной дыхательной цепью определяли с
ходе окислительного стресса при взаимодействии
помощью электрода Кларка на полярографе YSI
ферритина и O2●- [2]. Также железо высвобожда-
53 (Yellow Spring Instruments, Inc., США). Среда
ется при протеолизе ферритина, однако эти про-
инкубации митохондрий для полярографических
цессы изучены недостаточно.
измерений содержала 250 мМ сахарозы, 20 мМ
HEPES, 1 мМ EGTA, 4 мМ KH2PO4, 3 мМ MgCl2,
Еще одним ключевым участником метаболиз-
ма железа и оксида азота, а также антиоксидант-
pH 7.4; температура 25°С; концентрация белка
ной системы клеток могут быть динитрозильные
0.4-0.7 мг/мл. В качестве субстрата дыхания ис-
комплексы железа (ДНКЖ), которые также явля-
пользовали сукцинат в концентрации 4-5 мМ.
ются одной из основных природных форм депо-
При необходимости добавляли ротенон - инги-
нирования NO в организме животных и человека
битор комплекса I дыхательной цепи, в концен-
[3]. Известно, что в образовании нитрозильных
трации 2 мкМ. Для определения дыхательного
комплексов железа способен участвовать ферри-
контроля, степени сопряженности электронного
тин [4, 5]. Включение ионов железа в ДНКЖ мо-
транспорта и окислительного фосфорилирова-
жет снижать их реактивность как инициаторов
ния добавляли АДФ в концентрации
200-
300 мкМ. Дыхательный контроль рассчитывали
реакций с O2●- и Н2О2, например, реакций
как соотношение скоростей поглощения кисло-
Габера-Вейса и Фентона, а включение NO - ин-
рода в состоянии III (+АДФ) и состоянии IV
гибировать образование OONO-.
(без АДФ).
Таким образом, представляется важным даль-
Регистрация спектров ЭПР перехватчика су-
нейшее исследование взаимодействия феррити-
пероксида TIRON и динитрозильных комплексов
на, ДНКЖ и других доноров NO в условиях, мо-
железа. Регистрацию и анализ спектров ЭПР про-
делирующих генерацию АФК в организме чело-
водили на малогабаритном автоматизированном
века и животных. В данной работе с помощью
спектрометре ESR 70-03 XD/2 УП ( «КБСТ» БГУ,
ЭПР-спектроскопии спиновых ловушек, спек-
Беларусь). Реакционную смесь вводили в газо-
трофотометрии и полярографии проведено ис-
проницаемую капиллярную трубку PTFE Sub-
следование прооксидантных и антиоксидантых
Lite-Wall (внутренний диаметр 0.635 мм, толщина
свойств ДНКЖ и ферритина в супероксидгенери-
стенки 0.051 мм) фирмы Zeus Industrial Products,
рующих системах: митохондриях сердца и систе-
Inc. (США). Эту капиллярную трубку дважды
ме «ксантин-ксантиноксидаза».
складывали и вставляли в кварцевую трубку диа-
метром ~4 мм, открытую с обоих концов, что
обеспечивало доступ воздуха (21% O2) к образцу в
МАТЕРИАЛЫ И МЕТОДЫ
резонаторе спектрометра ЭПР.
Получение изолированных митохондрий. Мито-
Генерацию супероксидных радикалов изоли-
хондрии выделяли из сердца крыс стандартным
рованными митохондриями изучали с помощью
методом дифференциального центрифугирова-
перехватчика («scavenger») супероксида TIRON
ния [6]. Все этапы выделения митохондрий про-
(4,5-диоксибензол-1,3-дисульфоната), переходя-
водили при температуре (0-4)°С. Сердце выреза-
щего при взаимодействии с O•- в семихинон-
ли после анестезии крыс линии Wistar внутри-
брюшинным введением уретана (1.8 г анестетика
ную форму [7]. Ранее нами было показано [8], что
на кг массы животного) и помещали в охлажден-
регистрация семихинона TIRON•- с помощью
ную среду выделения (~4°С). Среда выделения
ЭПР является удобным методом измерения ско-
содержала 70 мМ сахарозы, 220 мМ маннитола,
рости образования супероксида как модельными
50 мМ HEPES, 1 мМ EDTA, pH 7.40-7.42. Пред-
ферментативными системами, так и электронны-
варительно измельченные ножницами и отмытые
ми переносчиками митохондрий сердца. При
от крови кусочки сердца пропускали через сито
этом скорость генерации O•- в реакционной
из нержавеющей стали, далее гомогенизировали
смеси оказалась пропорциональной квадрату ин-
в течение двух-трех минут при соотношении
тенсивности сигнала ЭПР семихинонов
«среда : ткань», равном 8 : 1. Гомогенат центрифу-
гировали 10 мин при 700 g, супернатант, содер-
TIRON•-. При рН < 9 этот спектр представляет
жавший митохондрии, фильтровали и центрифу-
собой квартет, являющийся результатом взаимо-
гировали 10 мин при 14000 g на центрифуге K-24
действия неспаренного электрона с двумя неэк-
вивалентными протонами с константами СТВ
(ГДР). Осадок митохондрий суспендировали в
среде выделения с 3 мг/мл бычьего сывороточно-
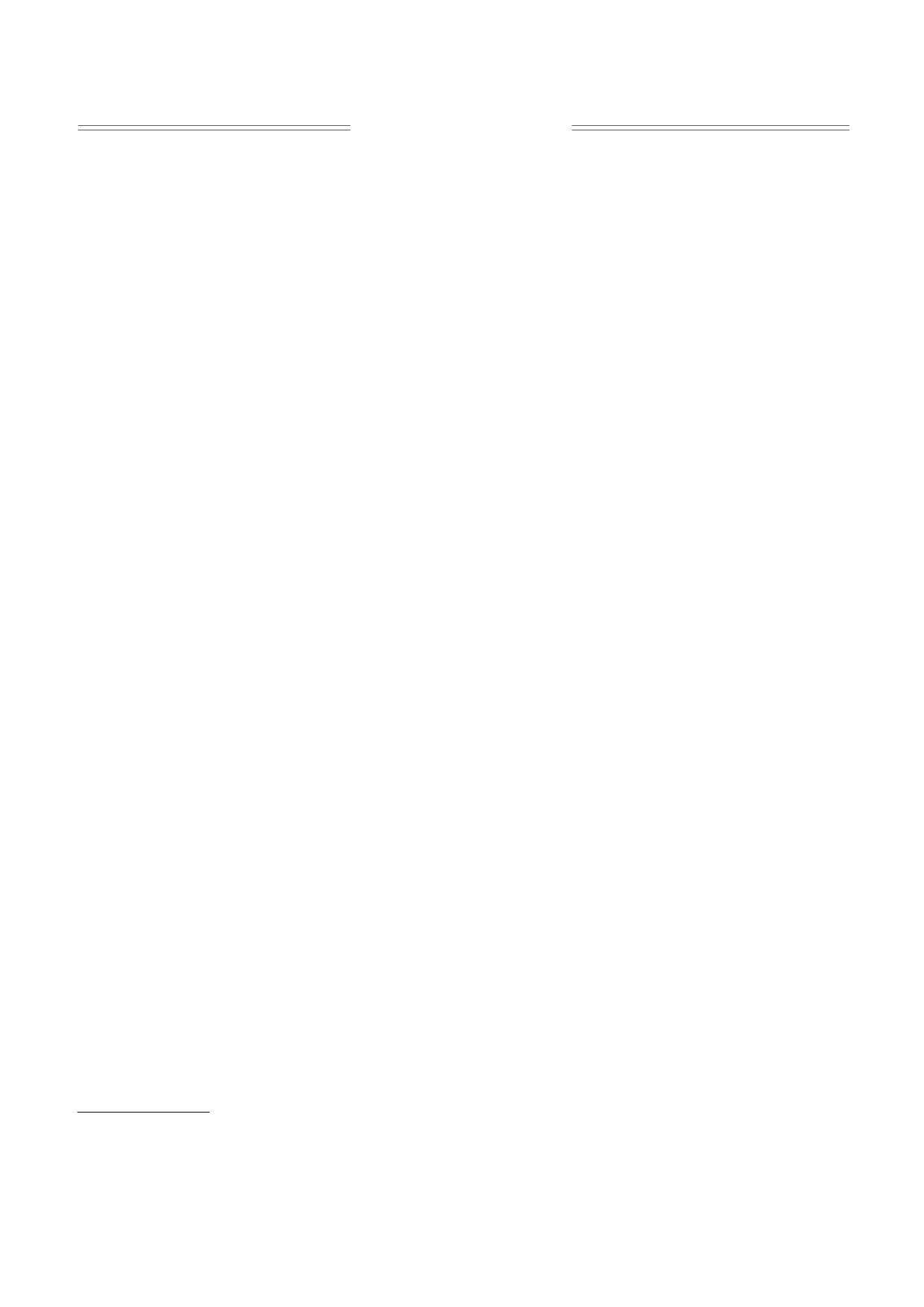
a(H2) = 0.331 мТл и a(H6) = 0.178 мТл (рис. 1а).
БИОФИЗИКА том 66
№ 4
2021
ГЕНЕРАЦИЯ СУПЕРОКСИДНЫХ РАДИКАЛОВ
713
Рис. 1. (а) - Спектр ЭПР семихинонов TIRON в супероксидгенерирующей модельной системе «ксантин-
ксантиноксидаза» в условиях, аналогичных условиям регистрации TIRON•- в митохондриальной суспензии (см.
раздел «Материалы и методы»). (б) - Сигнал ДНКЖ в среде инкубации в отсутствие генерации АФК. Среда
инкубации (в мМ): сахароза - 250, HEPES - 20, EGTA - 1, KH2PO4 - 4, MgCl2 - 3, pH 7.4; ДНКЖ - 700 мкМ.
Среда инкубации для измерений на спектро-
АФК, I - интенсивность сигнала ДНКЖ в ходе
метре ЭПР содержала 250 мМ сахарозы, 20 мМ
эксперимента. Условия записи спектров ЭПР
HEPES, 1 мМ EGTA, 4 мМ KH2PO4, 3 мМ MgCl2,
(для ДНКЖ): ослабление СВЧ-мощности 10 дБ,
8 мМ сукцината, 5 мкМ антимицина А и 10 мМ
амплитуда ВЧ-модуляции 0.2-0.4 мТл, коэффи-
TIRON; рН 7.4. Концентрация митохондрий в
циент усиления 100-1000, диапазон развертки 5-
среде инкубации составляла ~4 мг/мл. Условия
10 мТл.
записи спектров ЭПР от TIRON•-: ослабление
Определение скорости генерации супероксид-
СВЧ-мощности 5-10 дБ, амплитуда ВЧ-модуля-
ных радикалов. Скорость генерации супероксид-
ных радикалов в модельной системе «ксантин-
ции 0.05 мТл, СВ-частота ~9.32 ГГц, коэффици-
ксантиноксидаза» измеряли на спектрофотомет-
ент усиления
500-1000, диапазон развертки
ре Cary 60 (Agilent, Австралия) по реакции восста-
10 мТл. Выбор величины СВЧ-мощности и ВЧ-
модуляции определялся требованием достиже-
новления цитохрома с. Реакционная смесь содер-
ния максимальной чувствительности при неиска-
жала 250 мМ сахарозы, 20 мМ HEPES, 1 мМ
EGTA, 0,2 мМ ксантина, 0.1-200 мкг/мл ксанти-
женной форме сигнала.
ноксидазы и 27 мкМ цитохрома с; рН 7.4. Реак-
Запись спектров ДНКЖ производили при
цию запускали добавлением ксантина. В качестве
комнатной температуре (~25°C) в суспензии ми-
контрольного образца использовали раствор того
тохондрий сердца и системе «ксантин-ксанти-
же состава за исключением ксантиноксидазы. За
ноксидаза». Для получения парамагнитных мо-
восстановлением цитохрома с следили по изме-
ноядерных ДНКЖ к препарату диамагнитных би-
нению разностного оптического поглощения при
ядерных комплексов добавляли необходимое
550 и 557 нм. Молярный коэффициент экстинк-
количество цистеина (в небольшом избытке) и
ции - 21.1 103 М-1 см-1 [9]. Скорость генерации
наблюдали характерный синглетный сигнал ДН-
O•- в ксантиноксидазной системе принимали
КЖ с полушириной 0.7 мТл при giso = 2.03
равной чувствительной к SOD скорости восста-
(рис. 1б). Под действием O•- ДНКЖ разруша-
новления цитохрома c.
лись, что вызывало постепенное уменьшение ин-
Регистрацию спектров ЭПР спиновой ловуш-
тенсивности сигнала ЭПР. Величину изменения
ки TIRON в ксантиноксидазной системе прово-
сигнала ДНКЖ выражали отношением I/Io, где
дили в условиях, аналогичных условиям реги-
Io - амплитуда исходного (контрольного) сигна-
страции в митохондриальной суспензии. Реак-
ла ДНКЖ данной концентрации без генерации цию запускали добавлением ксантиноксидазы
БИОФИЗИКА том 66
№ 4
2021
714
МЕДВЕДЕВА и др.
(0.1-200 мкг/мл) в реакционную смесь, содержа-
Действительно, константа реакции между O•- и
щую 10 мМ TIRON и основные компоненты сре-
связанными с альбумином ДНКЖ составляет око-
ды спектрофотометрических исследований, за
исключением цитохрома с.
ло 107 М-1с-1 [13]. Вместе с тем аналогичная кон-
станта для восстановленного глутатиона находится
Реактивы. В работе использовали реактивы
в пределах 102-103 М-1с-1 [14]. Также в работе [5]
фирм Sigma (США), ICN (США), Serva (ФРГ),
Aldrich (США) и других. Синтез ДНКЖ происхо-
было показано, что глутатионсодержащие ДНКЖ
дил по способу, разработанному А.Ф. Ваниным
намного более эффективно защищают эритроци-
[10]. ДНКЖ с глутатионом в диамагнитной ди-
ты от гемолиза, вызванного гипохлоритом, чем
мерной форме (5-10 мМ) получали, смешивая
свободный глутатион. Таким образом, антиокси-
растворы FeSO4 и глутатиона в молярном соотно-
дантные свойства ДНКЖ полностью не могут быть
шении 1 : 2 сосуде Тунберга в атмосфере NO.
объяснены действием входящих в них тиолов.
Препараты ДНКЖ хранили при температуре
Изменения интенсивности ЭПР сигнала
жидкого азота (-196°С).
ДНКЖ в супероксидгенерирующих системах
Статистический анализ. Эксперименты с каж-
•-
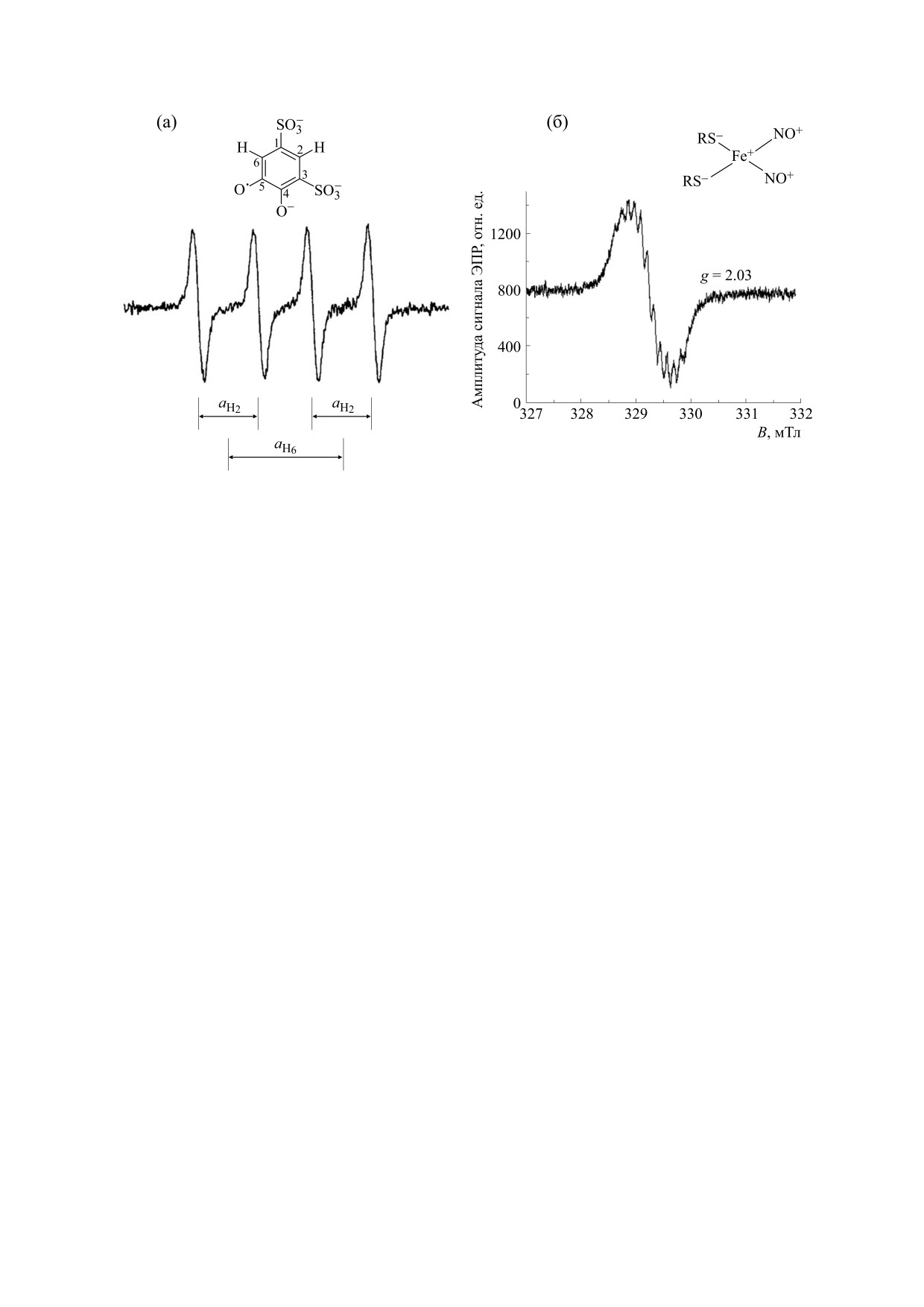
представлены на рис. 2-5. При генерации O
2
дой концентрацией исследуемых веществ прово-
как в суспензии митохондрий, так и в ксантин-
дили в трех-пяти повторах. Для эксперименталь-
ксантиноксидазной системе происходило умень-
ных групп вычисляли среднее арифметическое и
стандартное отклонение. Для сравнения средних
шение величины сигнала парамагнитных ДНКЖ
значений использовали однофакторный диспер-
(рис. 2а-в). В митохондриальной суспензии без
сионный анализ с последующим применением
добавления субстратов электронтранспортной
критерия Даннета для оценки достоверности от-
цепи глутатионовые ДНКЖ оставались стабиль-
личий между группами, различия между группа-
ными в течение 30 мин (данные не представле-
ми считали значимыми при P < 0.05.
ны). Падение сигнала этих ДНКЖ было на поря-
док больше в митохондриальной суспензии с сук-
цинатом и антимицином А, чем в отсутствие
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
последнего. Действительно, известно, что анти-
Эксперименты по исследованию действия
мицин А ингибирует третий комплекс электрон-
ДНКЖ с глутатионовыми лигандами на генерацию
транспортной цепи (Qin-центр цитохром-bc1-
O•- проводили в модельной системе «ксантин-
комплекса), что приводит к многократному уве-
ксантиноксидаза» и в суспензии изолированных
личению образования O2•- митохондриями [15].
митохондрий из сердца крыс. Условия генерации
Как видно из кинетики изменения сигнала ДН-
супероксида в ксантин-ксантиноксидазной систе-
КЖ (рис. 2в), в ходе генерации O2•- как в мито-
ме и в митохондриях были подобраны таким обра-
хондриальной, так и в ксантин-ксантиноксидаз-
зом, чтобы получить сравнимые скорости генера-
ной системах ДНКЖ разрушаются в течение 10-
ции супероксида (интенсивность ЭПР сигнала
15 мин.
TIRON в ксантин-ксантиноксидазной соответ-
ствовала ЭПР сигналу TIRON в суспензии мито-
Известно, что в митохондриях содержится ми-
хондрий) [11]. Скорость генерации O•- составля-
тохондриальный ферритин (FtMt), а O•- может
вызывать высвобождение железа из ферритина
ла ~ 0.1 нмоль/мин на 1 мг белка. Использовали
[16]. Таким образом нельзя исключить, что цито-
концентрацию ДНКЖ от 100 мкМ до 1.4 мМ. При
зольные и митохондриальная изоформы ферри-
увеличении концентрации ДНКЖ в среде инкуба-
тина могут быть источником ионов двухвалент-
ции в этих системах от 100 мкМ до 1.4 мМ наблю-
ного железа для образования ДНКЖ [4, 5]. Добав-
дали уменьшение интенсивности сигнала ЭПР
ление в реакционную среду с митохондриями
TIRON. При концентрациях ДНКЖ меньше
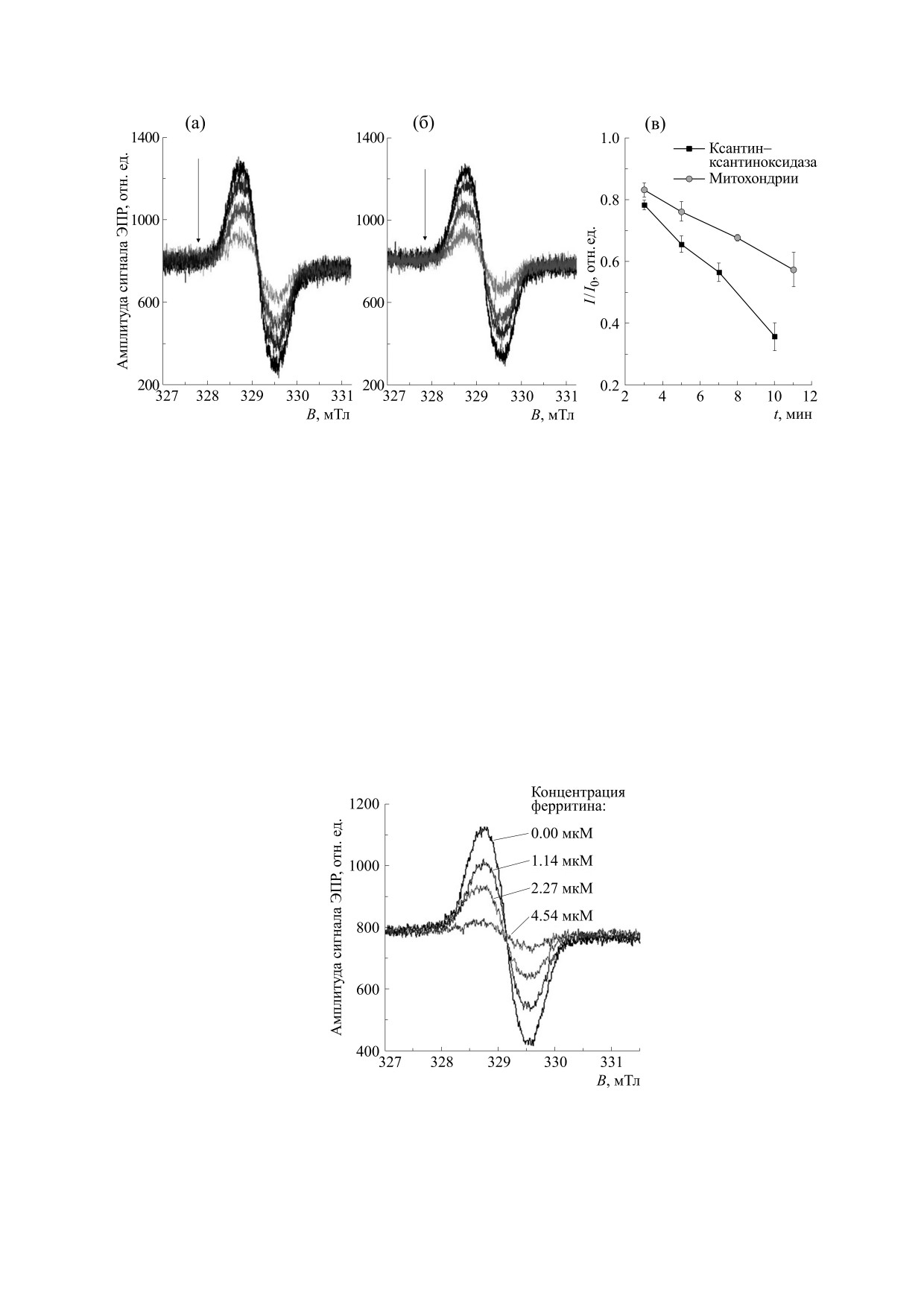
ферритина в концентрации от 1.14 до 4.54 мкМ
100 мкМ достоверного снижения сигнала
приводило к увеличению скорости падения сиг-
ЭПР TIRON не происходило. Добавление 1.4 мМ
нала ДНКЖ (рис. 3). Поскольку ширина сигнала
ДНКЖ вызывало полное исчезновение сигнала
ДНКЖ при этом оставалась постоянной, умень-
ЭПР спиновой ловушки TIRON. Константа
шение интенсивности сигнала, по-видимому,
обусловлено разрушением ДНКЖ. На диаграм-
взаимодействия TIRON с O•- составляет 106-
мах (рис. 4а,б) видно, что увеличение концентра-
107 М-1 с-1 [12]. Так как глутатионовые ДНКЖ
ции ферритина приводит к ускорению падения
эффективно конкурируют с TIRON за супероксид,
сигнала ДНКЖ. Этот эффект может быть связан с
можно предположить, что эти соединения имеют
выходом ионов Fe2+ из ферритина под действием
сопоставимую константу взаимодействия с
•-.
O2•-, что ведет к увеличению продукции АФК в
БИОФИЗИКА том 66
№ 4
2021
ГЕНЕРАЦИЯ СУПЕРОКСИДНЫХ РАДИКАЛОВ
715
Рис. 2. Сигнал ДНКЖ в двух модельных системах: (а) - митохондрии (время 3, 5, 8, 11 мин); (б) - система «ксантин-
ксантиноксидаза» (время 3, 5, 7, 10 мин). Исходная концентрация ДНКЖ - 700 мкМ, стрелкой указано изменение
спектров в ходе реакции, время записи спектров с третьей до десятой-одиннадцатой минуты от момента добавления
ксантиносидазы. (в) - Кинетика распада ДНКЖ в двух системах.
реакциях Фентона и Габера-Вейса и соответ-
зависимая от O•- деструкция ДНКЖ в присут-
ственно разрушению ДНКЖ. Распад ДНКЖ со-
ствии ферритина может носить автокаталитиче-
провождается высвобождением глутатиона и
ский характер.
ионов железа, которые также могут участвовать в
процессах свободнорадикального окисления.
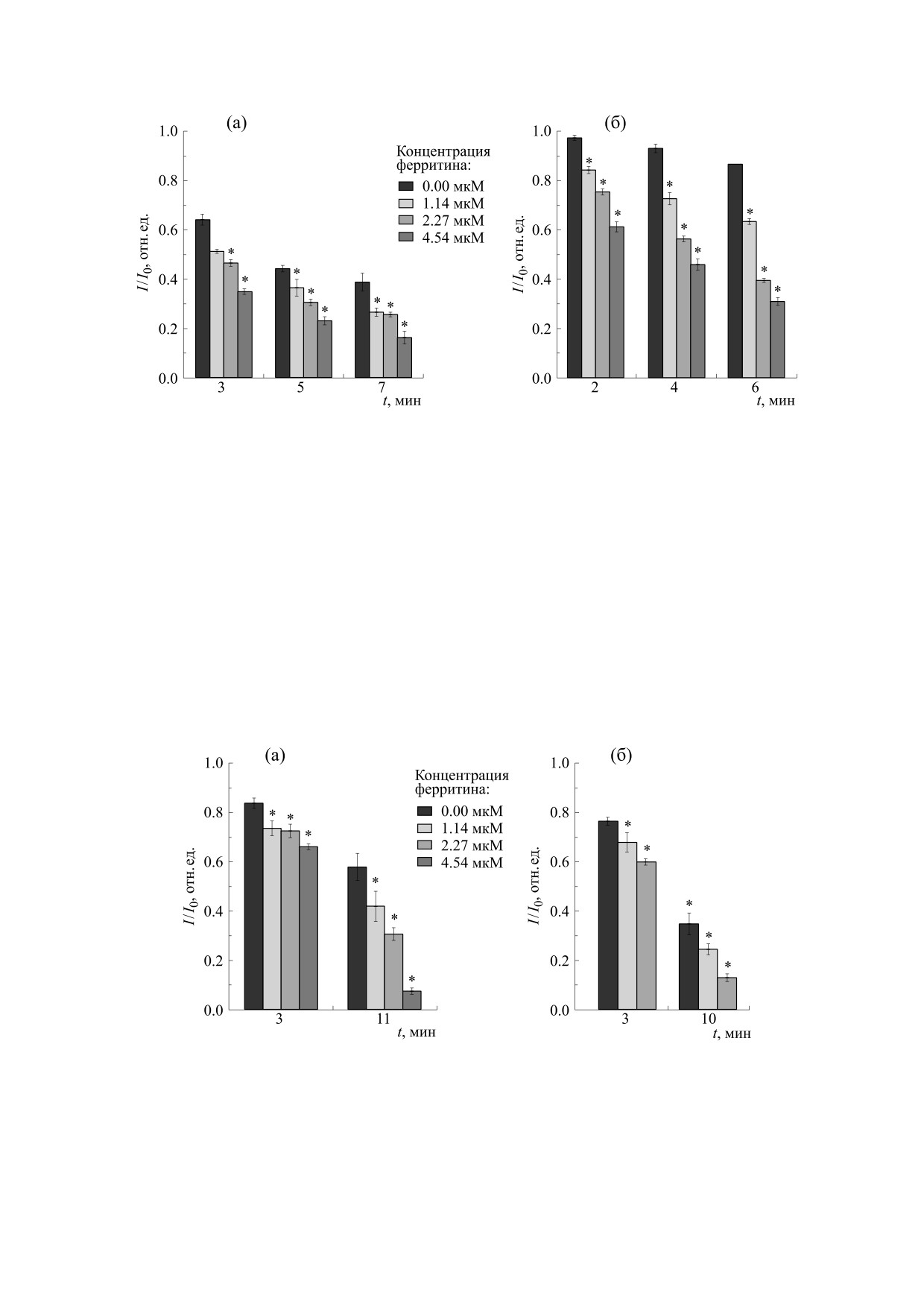
Сравнение влияние ферритина на деструкцию
ДНКЖ в суспензии митохондрий и ксантин-
Так, глутатион, восстанавливая Fe3+, может спо-
собствовать как выходу железа из ферритина, так
ксантиноксидазной системе представлено на
и стимулированию реакции Фентона. Свободный
рис. 5. Видно, что в присутствии ферритина в сус-
NO также может выделяться при распаде ДНКЖ,
пензии митохондрий скорость распада ДНКЖ
причем в реакции оксида азота с супероксидом
меньше, чем в супероксидгенерирующей систе-
образуется сильный окислитель пероксинитрит,
ме, содержащей ксантин и ксантиноксидазу.
способный разрушать ДНКЖ. Таким образом,
Аналогичный эффект, различие в скоростях рас-
Рис. 3. ЭПР-спектр ДНКЖ (концентрация 700 мкМ) в суспензии митохондрий в присутствии различных концентра-
ций ферритина. Время инкубации - 5 мин.
БИОФИЗИКА том 66
№ 4
2021
716
МЕДВЕДЕВА и др.
Рис. 4. Изменение относительной интенсивности сигнала ДНКЖ в присутствии разных концентраций ферритина:
(а) - исходная концентрация ДНКЖ 350 мкМ, (б) - исходная концентрация ДНКЖ 1.4 мМ. * - Достоверное отличие
по отношению к контролю (сигнал ДНКЖ в отсутствие ферритина).
пада ДНКЖ в этих системах, мы наблюдали без
ДНКЖ до скорости самопроизвольного распада
ферритина (рис. 2в). Можно предположить, что
ДНКЖ. Добавление суперкоксидисмутазы в эту
это замедление связано с ресинтезом ДНКЖ в
систему в присутствии ферритина вызывало сни-
митохондриях [5].
жение скорости разрушения ДНКЖ до значений,
полученных в отсутствии ферритина (данные не
Для проверки роли O•- в деструкции ДНКЖ
приведены).
были поставлены эксперименты с суперкокси-
дисмутазой. В ксантин-ксантиоксидазной систе-
Таким образом, взаимодействия между АФК,
ме добавление 500 ед./мл суперкоксидисмутазы
ДНКЖ и ферритином можно описать следую-
приводило к уменьшению скорости разрушения
щим набором реакций:
Рис. 5. Уменьшение величины сигнала ДНКЖ в присутствии различных концентраций ферритина в суспензии
митохондрий и ксантин-ксантиноксидазной системе: (а) - 4 мг/мл митохондрий, 80 мМ сукцината, 0.2 мМ
антимицина А, 700 мкМ ДНКЖ; (б) - 100 мМ ксантина, 0.1 мкМ ксантиноксидазы, 700 мкМ ДНКЖ. * - Достоверное
отличие по отношению к контролю (сигнал ДНКЖ в отсутствие ферритина).
БИОФИЗИКА том 66
№ 4
2021
ГЕНЕРАЦИЯ СУПЕРОКСИДНЫХ РАДИКАЛОВ
717
Митохондрии → O•- / Ксантин-ксантиоксидаза → O•-
(1)
O•- + ДНКЖ → NO– , NO, GSSG, Fe2+
(2)
O•- + Fe3+ (ферритин) → Fe2+
(3)
NO + O•- → ONOO-
(4)
ONOO- → NO• + OH•
(5)
Fe2+ + O2 → Fe3+ + O2•-
(6)
Fe2+ + O•- + 2H+ → Fe3+ + H2O2
(7)
Fe2+ + H2O2 → Fe3+ + OH• + OH-
(8)
Fe2+ + глутатион + NO → ДНКЖ
(9)
На основании литературных данных [17] и
Следует отметить, что в клетках NO, высво-
проведенных ранее исследований [13] можно за-
бождающийся при разрушении ДНКЖ под дей-
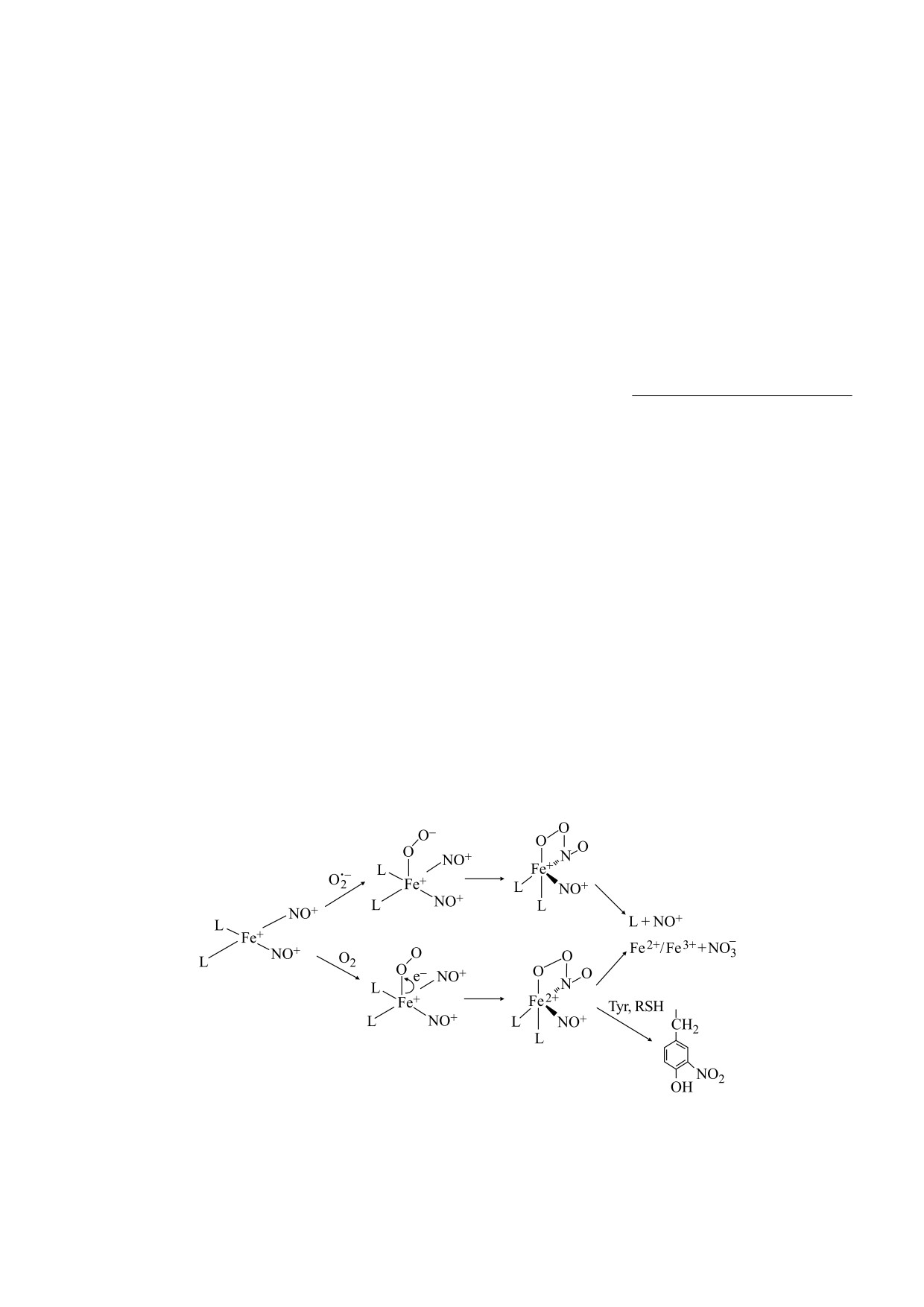
ключить, что ДНКЖ при взаимодействии с су-
ствием АФК, может снижать уровень ферритина
пероксидом превращается в комплекс, содержа-
[19]. Вместе с тем нитрозильный катион (NO+),
щий связанный пероксинитрит (рис. 6). Пред-
по данным работы [20], может стимулировать
ставляется вероятным, что координированный с
синтез ферритина в мышиных макрофагах. В свя-
железом ONOO- далее окисляет глутатионовые
зи с тем, что ДНКЖ в зависимости от редокс-
лиганды, в результате чего комплекс распадается.
условий являются донорами как NO, так и NO+,
Тем не менее нельзя исключить, что при избытке
влияние этих комплексов на уровень ферритина
свободных тиолов или других доноров электро-
и свободного или «хелатируемого» железа может
нов комплекс с пероксинитритом может регене-
быть разнонаправленным.
рироваться (восстанавливаться) до ДНКЖ.
Полученные данные о влиянии ферритина на
Действительно, как показывают предыдущие
кинетику распада ДНКЖ аналогичны описанно-
исследования, выполненные в нашей лаборато-
му нами ранее действию метмиоглобина на де-
рии [18], в присутствии избытка глутатиона и ци-
струкцию ДНКЖ в ксантин-ксантиноксидазной
стеина пероксинитрит практически не влияет на
системе [21], тогда было показано, что скорость
разрушение ДНКЖ (pH 7.4). Но высокая антира-
разрушения ДНКЖ увеличивается в присутствии
дикальная активность (взаимодействие с су-
метмиоглобина.
пероксидом) ДНКЖ позволяет предположить,
что в наших системах, по-видимому, не происхо-
В ряде работ показано, что в условиях гипо-
дит образования свободного пероксинитрита.
ксии в митохондриях происходит зависимый от
Рис. 6. Возможная схема взаимодействий динитрозильных комплексов железа с молекулярным кислородом и су-
пероксидным радикалом.
БИОФИЗИКА том 66
№ 4
2021
718
МЕДВЕДЕВА и др.
нитрита или S-нитрозотиолов синтез ДНКЖ [5,
роль в таком варианте программируемой гибели
22, 23]. Считается, что нитрит и S-нитрозотиолы
клетки, как ферроптоз.
являются источниками NO, при взаимодействии
которого с свободными ионами железа образуют-
ФИНАНСИРОВАНИЕ РАБОТЫ
ся ДНКЖ. Полагают, что с формированием ДН-
КЖ связано цитопротекторное действие нитрита
Работа выполнена при частичной финансовой
в ходе гипоксии-реоксигенации [21]. С другой
поддержке Российского фонда фундаментальных
стороны, если концентрация NO превышает со-
исследований, грант № 19-015-00444.
держание свободного (хелатируемого) железа,
наблюдается дисфункция митохондрий, обуслов-
ленная разрушением железосерного кластера
КОНФЛИКТ ИНТЕРЕСОВ
аконитазы [23]. Исходя из литературных данных
Авторы заявляют об отсутствии конфликта
и полученных нами результатов, можно предпо-
интересов.
ложить, что синтез ДНКЖ при низком парциаль-
ном давлении кислорода позволяет связать NO и
ионы железа в митохондриях. При этом поступ-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ление железа из ферритина может предотвращать
Все применимые международные, националь-
инактивацию аконитазы. Вместе с тем с началом
ные и институциональные принципы ухода и ис-
реоксигенации накопленные ДНКЖ функцио-
пользования животных при выполнении работы
нируют как антиоксиданты, перехватывая об-
были соблюдены.
разующиеся АФК. Это предположение хорошо
объясняет эффективное протекторное действие
глутатионсодержащих ДНКЖ при ишемии и по-
СПИСОК ЛИТЕРАТУРЫ
следующей реперфузии сердечной мышцы [24].
1. M. N. Hughes, Biochim. Biophys. Acta 1411 (2-3),
263 (1999).
ЗАКЛЮЧЕНИЕ
2. D. Finazzi and P. Arosio, Arch Toxicol. 88, 1787
(2014).
ДНКЖ с тиольными лигандами перехватыва-
3. A. F. Vanin, Nitric Oxide Biol. Chem. 54, 15 (2016).
ют супероксидные анион-радикалы, которые
продуцируются митохондриями и в системе ксан-
4. R. N. Watts and D. R. Richardson, Eur. J. Biochem.
тин-ксантиноксидаза.
269, 3383 (2002).
Показано, что в использованном диапазоне
5. K. B. Shumaev, A. L. Dudylina, M. V. Ivanova, et al.,
концентраций ферритин в этих моделях генери-
Biofactors 44 (3), 237 (2018).
рования O•- проявляет прооксидантные свой-
6. C. Frezza, S. Cipolat, and L. Scorrano. Nat. Protoc. 2,
ства, стимулируя разрушение ДНКЖ.
287 (2007).
7. И. В. Григолава, М. Ю. Ксензенко, А. А. Констан-
В суспензии митохондрий разрушение ДНКЖ
тинов и др., Биохимия 45, 75 (1980).
в присутствии ферритина происходит медленнее,
чем в ксантин-ксантиноксидазной системе. Этот
8. A. N. Ledenev, A. A. Konstantinov, E. Popova, et al.,
факт может объясняться тем, что в этих условиях
Biochem. Int. 13, 391 (1986).
ДНКЖ либо не разрушаются полностью, либо
9. B. Vangelder, Biochim. Biophys. Acta 58, 593 (1962).
происходит частичная регенерация комплексов.
10. A. F. Vanin, R. R. Borodulin, V. D. Mikoyan, et al.,
События, происходящие в клетке при окисли-
Nitric Oxide 66, 1 (2017).
тельном стрессе, зависят от продукции активных
11. А. Л. Дудылина, Дис. … канд. ф.-м.н. (МГУ,
форм кислорода и азота, а также от уровня других
Москва, 2019).
редокс-активных соединений, в первую очередь
ионов железа и тиолов. Полученные нами данные
12. W. Bors, Biochim. Biophys. Acta - Gen. Subj. 582 (3),
позволяют заключить, что митохондрии, тиол-
537 (1979).
содержащие ДНКЖ и ферритин являются ключе-
13. K. B. Shumaev, A. A. Gubkin, V. A. Serezhenkov, et al.,
выми элементами, регулирующими баланс этих
Nitric Oxide 18 (1), 37 (2008).
соединений. Прооксидантное действие феррити-
14. C. C. Winterbourn and D. Metodiewa, Arch. Biochem.
на в условиях генерации O•- митохондриями и в
Biophys. 314 (2), 284 (1994).
системе ксантин-ксантиноксидаза согласуется с
15. N. Dairaku, K. Kato, K. Honda, et al., J. Lab. Clin.
результатами, полученными ранее в других экс-
Med. 143 (3), 143 (2014).
периментальных моделях. Подтверждены также
16. D. W. Reif, Free Rad. Biol. Med. 12 (5), 417 (1992).
антирадикальные свойства ДНКЖ. Нельзя ис-
ключить, что свободнорадикальные реакции с
17. N. G. Tran, H. Kalyvas, K. M. Skodjet, et al., J. Am.
участием ДНКЖ и ферритина играют важную
Chem. Soc. 133, 1184 (2011).
БИОФИЗИКА том 66
№ 4
2021
ГЕНЕРАЦИЯ СУПЕРОКСИДНЫХ РАДИКАЛОВ
719
18. И. В. Заббарова, Дис. … канд. ф.-м.н. (МГУ,
22. P. Dungel, M. Perlinge, A. Weidinger, et al., Free Rad.
Москва, 2004).
Biol. Med. 89, 300 (2015).
19. D. R. Richardson, V. Neumannova, E. Nagy, et al.,
23. D. D. Thomas, C. Corey, J. Hickok, et al., Redox Biol.
Blood 86 (8), 3211 (1995).
15, 277 (2018).
20. S. Kim and P. Ponka, Blood Cells Mol. Dis. 29 (3), 400
24. O. Pisarenko, I. Studneva, A. Timoshin, et al., Pflugers
(2002).
Arch. 471 (4), 583 (2019).
21. И. В. Заббарова, К. Б. Шумаев, А. Ф. Ванин и др.,
Биофизика 49 (4), 659 (2004).
Generation of Superoxide Radicals by Heart Mitochondria and the Action
of Dinitrosyl Iron Complexes and Ferritin
V.A. Medvedeva*, **, M.V. Ivanova**, K.B. Shumaev**, ***, A.L. Dudylina**, and E.K. Ruuge*, **
**National Medical Research Centre for Cardiology, Ministry of Healthcare of the Russian Federation,
3-ya Cherepkovskaya ul. 15a, Moscow, 121552 Russia
***Federal Research Center “Fundamentals of Biotechnology”, Russian Academy of Sciences,
Leninskiy prosp. 33/2, Moscow, 119071 Russia
One of the causes of the development of a wide range of pathologies is thought to be alterations in mitochon-
drial function, that may be due to the excessive generation of toxic forms of oxygen and nitrogen cumulating
into oxidative stress. These reactive oxygen and nitrogen species in living organisms are generated continu-
ously by enzymes and via oxidation-reduction processes, such as the Fenton reaction and iron-catalyzed
Haber-Weiss reaction. In literature, there is much more data available on the relationship between the me-
tabolism of ferritin, reactive oxygen species, nitric oxide and dinitrosyl iron complexes, as well as on the im-
portant role of dinitrosyl iron complexes in the antioxidant defense mechanisms. The prooxidant and antiox-
idant properties of dinitrosyl iron complexes and ferritin in superoxide-generating systems: heart mitochon-
dria and the xanthine-xanthine oxidase system were studied using EPR spin trapping, by spectrophotometry,
and polarography. It has been shown that dinitrosyl iron complexes with glutathione ligands intercept reactive
free radicals in systems simulating oxidative stress in cardiac muscle cells. Under these conditions, ferritin
stimulated the destruction of dinitrosyl iron complexes. The data obtained indicate the antioxidant and anti-
radical effects of dinitrosyl iron complexes and, on the contrary, the prooxidant effect of ferritin.
Keywords: superoxide radicals, dinitrosyl iron complexes, ferritin, antioxidants, heart, mitochondria, electron
paramagnetic resonance
БИОФИЗИКА том 66
№ 4
2021