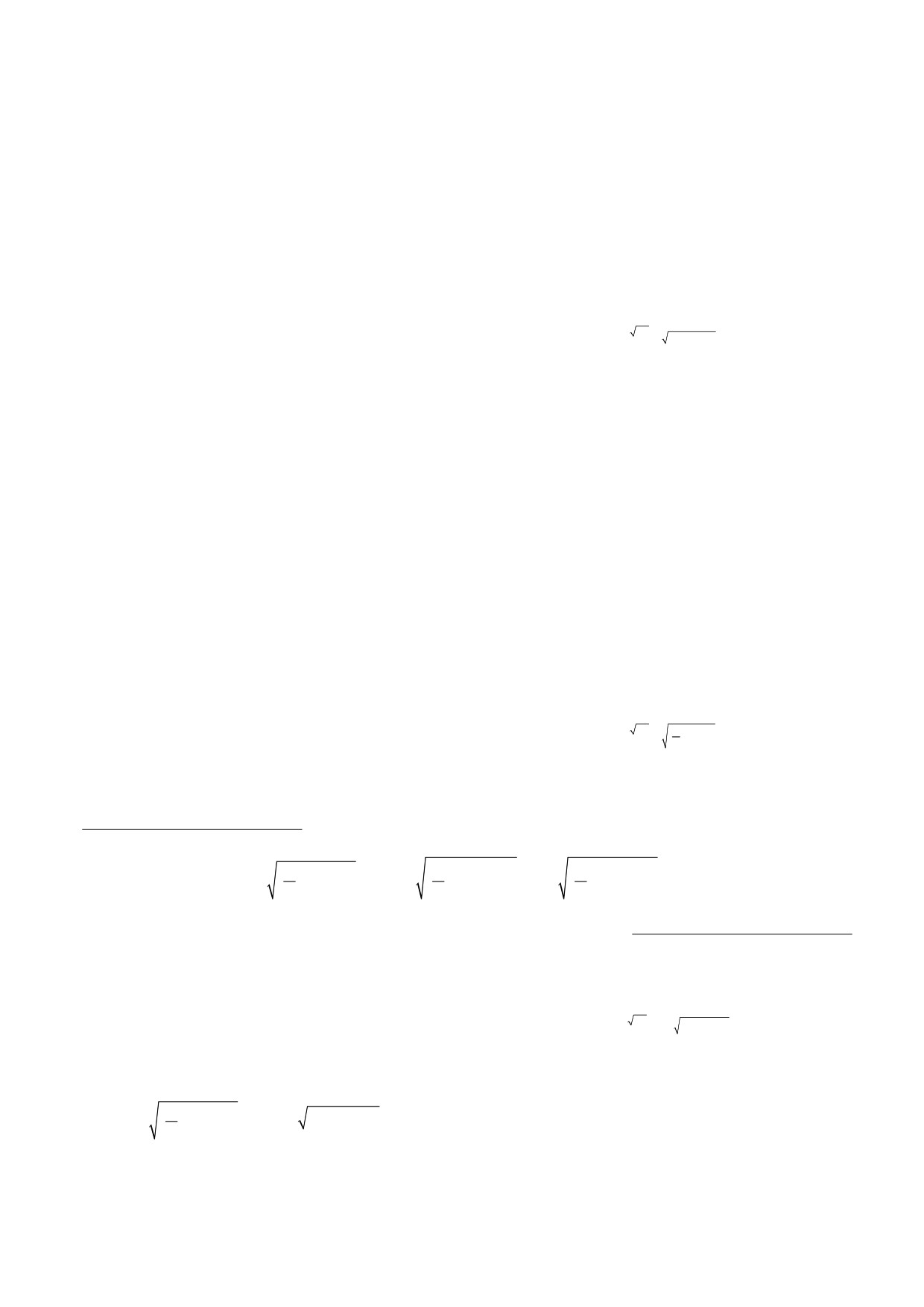БИОФИЗИКА, 2021, том 66, № 4, с. 750-755
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
РОЛЬ КВАНТОВОГО ТУННЕЛИРОВАНИЯ ИОНОВ В ПАТОГЕНЕЗЕ
СЕРДЕЧНЫХ АРИТМИЙ, ОБУСЛОВЛЕННЫХ КАНАЛОПАТИЯМИ,
ИШЕМИЕЙ И МЕХАНИЧЕСКИМ РАСТЯЖЕНИЕМ
© 2021 г. А.Б. Касвал
Медицинский факультет Иорданского университета, Амман 11942, Иордания
E-mail: qaswalabdullah@gmail.com
Поступила в редакцию 05.03.2020 г.
После доработки 06.08.2020 г.
Принята к публикации 14.08.2020 г.
Сердечные аритмии вызывают значительную заболеваемость и смертность среди пациентов. Было
выявлено, что с сердечными аритмиями связаны многие патологические нарушения. Понимание
того, как такие нарушения способствуют патогенезу сердечной аритмии, важно для улучшения те-
рапевтических результатов. В данном исследовании для изучения влияния некоторых патологиче-
ских процессов, таких как каналопатии, ишемия и механическое растяжение, на патогенез сердеч-
ных аритмий была использована модель квантового туннелирования ионов через закрытые каналы.
Было обнаружено, что в случае, когда эти патологии уменьшают пороговую свободную энергию на-
триевых потенциалзависимых каналов, происходит существенная деполяризация мембранного по-
тенциала, указывающая на значительную квантовую проводимость, обусловленную значительной
вероятностью туннелирования ионов натрия через закрытые каналы. Эта деполяризация предрас-
полагает сердечную мышцу к повышенной возбудимости и, как следствие, к аритмиям. Такая мо-
дель может быть применена к другим типам ионов, таким как ионы калия и кальция, другим типам
каналов, другим возбудимым тканям, таким как нейроны и волокна скелетных мышц, а также к
другим патологическим состояниям, которые влияют на целостность клеточной мембраны. Она
может облегчить понимание ряда расстройств, связанных с патологической возбудимостью.
Ключевые слова: квантовое туннелирование, потенциалзависимый канал, аритмия, каналопатия,
растяжение, ишемия.
DOI: 10.31857/S0006302921040153
Сердечная аритмия является серьезной про-
означает, что канал с большей вероятностью от-
блемой для здоровья, вызывающей значительную
кроется, однако это будет вероятностное откры-
заболеваемость и смертность. Многие этиологии
тие, что означает только наличие вероятности то-
вовлечены в патогенез сердечных аритмий, в
го, что канал откроется, сама же вероятность бу-
частности каналопатии [1], ишемическая болезнь
дет зависеть от многих факторов. Одним из таких
сердца [2], механическое растяжение ткани мио-
факторов, который будет рассмотрен в настоя-
карда [3], перегрузка по объему крови, вызванная
щей работе, является квантовое туннелирование
застойной сердечной недостаточностью [4], кла-
ионов через закрытые каналы [13]. Вероятность
панные болезни сердца, такие как митральный
такого туннелирования зависит от пороговой
стеноз клапана [5], а также многих другие патоло-
свободной энергии, кинетической энергии иона,
гии, при которых расширяется или растягивается
длины гидрофобного затвора и массы ионов. По
сердечная мышца [6]. Было обнаружено, что ка-
мере уменьшения пороговой свободной энергии
налопатия и механическое растяжение могут
вероятность туннелирования увеличивается.
уменьшить пороговую свободную энергию [7-
Следовательно, принимая во внимание влияние
12], необходимую для открытия закрытых кана-
патологических состояний на пороговую свобод-
лов. Ишемия также вызывает деформации и пу-
ную энергию, вероятность туннелирования
зыри в клеточной мембране, которые могут сдви-
ионов будет увеличиваться в этих условиях, по-
гать влево равновесие в натриевых каналах, влияя
скольку они уменьшают эту энергию. По мере
на пороговую свободную энергию, аналогично
увеличения вероятности туннелирования увели-
эффектам, вызываемым механически индуциро-
чивается квантовая проводимость мембраны, и,
ванными деформациями мембраны [11]. Более
следовательно, это может повлиять на мембран-
того, уменьшение пороговой свободной энергии
ный потенциал и возбудимость клетки. Кроме то-
750
РОЛЬ КВАНТОВОГО ТУННЕЛИРОВАНИЯ ИОНОВ
751
го, в настоящем исследовании основное внима-
Эта модель описывает внутриклеточные гид-
ние уделяется закрытым потенциалзависимым
рофобные ворота потенциалзависимых каналов
каналам, а не катионным каналам, активируе-
как энергетический барьер. Сам барьер представ-
мым растяжением, поскольку такие каналы в
лен как электрическое поле в пространстве па-
желудочках сердца и синоатриальном узле от-
раллельного конденсатора, такое представление
сутствуют [11]. Однако в них присутствуют по-
было сделано для отслеживания изменений энер-
тенциалзависимые каналы, и это исключает воз-
гии барьера в зависимости от положения иона
можность того, что активируемые растяжением
вдоль затвора [13].
каналы ответственны за вызванные растяжением
Вероятность туннелирования ионов через за-
аритмии в желудочках, но может быть отнесено к
крытый затвор рассчитывается по следующему
току утечки, создаваемому негерметичными за-
уравнению [13]:
крытыми электрическими каналами. В дополне-
X2
ние к этому было обнаружено, что закрытые по-
−
8m
(qEx)−KEdx
тенциалзависимые каналы реагируют на растя-
X1
T
=
e
,
(1)
жение, поэтому предположение о том, что они не
Q
подвержены механическому растяжению, мало-
где m - масса иона, ħ - приведенная постоянная
вероятно [11]. По этим причинам разумно вы-
Планка (1.05 · 10-34 Дж с), q - заряд иона, E -
брать эти закрытые каналы в качестве объекта ис-
электрическое поле в пространстве параллельно-
следования для изучения эффектов квантового
го конденсатора, которое эквивалентно внутри-
туннелирования при изменении пороговой сво-
клеточному гидрофобному затвору, x - положе-
бодной энергии.
ние иона через затвор, KE - кинетическая энер-
Таким образом, цель настоящего исследова-
гия иона, а X1-X2 - запрещенная область, в
ния состоит в том, чтобы определить влияние
которой энергия барьера (qEx) равна или превы-
уменьшения пороговой свободной энергии за-
шает кинетическую энергию иона.
крытых потенциалзависимых каналов на мем-
Электрическое поле E рассчитывается по сле-
бранный потенциал и, как следствие, на возбуди-
дующему уравнению [13]:
мость клеток и сердечный ритм. Эта цель дости-
гается за счет использования модели квантового
E = U/qL,
(2)
туннелирования ионов через закрытые каналы
где U - энергия свободного затвора (энергия, не-
[13] и интеграции квантовой проводимости в
обходимая для открытия закрытого канала), q -
уравнение Гольдмана-Ходжкина-Каца.
заряд иона, а L - длина затвора.
Путем подстановки уравнения (2) в уравнение (1)
МЕТОДЫ
получаем:
Модель квантового туннелирования ионов че-
X2
рез закрытые каналы была предложена и исполь-
-
8
m Ux
(
)
−KEdx
L
зована для объяснения выраженной боли [14],
X1
T
=
e
(3)
Q
механизма действия лития [15], функции миели-
на в ограничении гипервозбудимости [16], депо-
Интеграл в уравнении (3) может быть решен
ляризующего действия ионов магния [17].
следующим образом:
X
2
3
3
U
2L U
2L U
x
−
KEdx
=
x
−
KE
−
x
−
KE
,
(4)
(
)
(
2
)
(
1
)
L
3U L
3U L
X
1
где X1 - положение иона, при котором кинетиче-
В конечном итоге вероятность туннелирова-
ния можно рассчитать по следующему уравне-
ская энергия равна энергии барьера
U x
=
KE
,
(
1
)
нию:
L
а X2 - положение иона на конце затвора (x2 = L).
-
8m
2L
3
×
(U - KE)
Таким образом, уравнение (4) принимает следую-
3U
T
Q
=
e
(6)
щий вид:
Кинетическая энергия ионов обусловлена
мембранным потенциалом и тепловым источни-
X
2
ком температуры тела. Следовательно, внекле-
U
2L
3
x
−
KEdx
=
(U -KE)
(5)
точные катионы получают кинетическую энер-
(
)
L
3U
гию при прохождении через мембранный потен-
X
1
БИОФИЗИКА том 66
№ 4
2021
752
КАСВАЛ
циал, который отрицателен внутри мембраны по
2
q
сравнению с ее внешней стороной, пока не до-
C
Qion
=
T
Q
,
(9)
h
стигнут внутриклеточных гидрофобных ворот.
Кроме того, они получают кинетическую энер-
где q - заряд иона, h - постоянная Планка
гию от источника тепла. Однако внутриклеточ-
(6.6 · 10-34 Дж с) и TQ - вероятность туннелиро-
ные катионы попадают во внутриклеточные гид-
вания.
рофобные ворота прежде, чем пройти через мем-
Уравнение (9) вычисляет квантовую проводи-
бранный потенциал, следовательно, в этом
случае он не будет вносить вклад в их кинетиче-
мость закрытого затвора, которая представляет
скую энергию. В результате кинетическая энер-
собой полную проводимость одного закрытого
канала, в предположении, что другие части кана-
гия катионов в основном происходит от источни-
ла, такие как фильтр селективности, имеют более
ка тепла. Таким образом, кинетическая энергия
внеклеточных и внутриклеточных катионов мо-
низкое сопротивление, которое не влияет на бо-
жет быть рассчитана соответственно по следую-
лее высокое квантовое сопротивление.
щим уравнениям:
Более того, квантовую проводимость мембра-
ны CQM
можно рассчитать по следующему урав-
1
KE
= qV
+ K
T,
(7)
o
m
B
нению [13]:
2
1
(10)
KE
= K
T,
(8)
CQM = 103 · DCQion,
i
B
2
где D - плотность каналов в биологической мем-
где q - заряд иона, Vм - напряжение (потенци-
бране (число каналов/см2). Множитель 103 вво-
ал) мембраны, KB - постоянная Больцмана
дится для преобразования единицы проводимо-
(1.38
· 10-23 Дж/К), а Т - температура тела
сти мембраны из См/см2 в мСм/см2.
(310 К).
Чтобы определить влияние квантовой прово-
В результате квантовую проводимость
димости на потенциал покоя мембраны, ее необ-
одиночного канала CQion можно рассчитать
ходимо интегрировать в уравнение Гольдмана-
по следующему уравнению [13, 18, 19]:
Ходжкина-Каца следующим образом:
m
FV
RT
[
Na
]
(C
Na
+C
QM o)
)
+
[K]
(C
K
+C
QM o)
)
=e
[
Na
]
(C
Na
+C
QM i)
)
+
[
K
]
(C
K
+C
QM i)
)],
(11)
o
o
i
i
где индексом «i» обозначены внутриклеточные и ин-
калия мембраны, F
- постоянная Фарадея
дексом «о» - внеклеточные параметры, [Na] - кон-
(96485.33 Кл/моль), R - газовая постоянная (8.31
центрация натрия, CNa - натриевая проводимость
Дж/кмоль), а T - абсолютная температура тела (310 К).
вследствие утечки в каналах, CQMNa -квантовая мем-
Сосредоточившись на квантовой проводимо-
бранная натриевая проводимость, [K] - концентра-
сти натриевых каналов и пренебрегая таковой для
ция калия, CK - калиевая проводимость вследствие
калиевых каналов, подставляем уравнения (6)-
утечки в каналах, CQMK - квантовая проводимость
(10) в уравнение (11):
2
-
8
m
2L
1
3
×
(U
−(qV
m
+
K
B
T))
3
q
3U
2
[
Na
]
C
Na
+
10
D e
+
[K]
C
K
=
o
o
h
(12)
−
FV
m
2
−
8m
2
L
1
3
×
(U
−(
K
B
T))
3
q
RT
3
U
2
=
e
[
Na
]
(
C
+10
D e
+
[
K
]
C
).
i
Na
i
K
h
Мембранный потенциал Vm, который являет-
-FV
m
RT
ся отрицательным внутри по сравнению с внеш-
выражение
e
добавлен знак минус. Уравнение
ней стороной мембраны, в уравнении (12) пред-
(12) вычисляет мембранный потенциал покоя с
ставляет собой абсолютное значение, поэтому в
учетом квантовой проводимости ионов натрия.
БИОФИЗИКА том 66
№ 4
2021
РОЛЬ КВАНТОВОГО ТУННЕЛИРОВАНИЯ ИОНОВ
753
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Видим, что уменьшение пороговой свободной
энергии из-за патологических состояний сдвину-
Квантовое туннелирование ионов натрия и ка-
ло мембранный потенциал с -86 мВ до -72 мВ,
лия не влияет на мембранный потенциал на фи-
что указывает на эффект деполяризации. В ре-
зиологических уровнях, потому что они имеют
зультате деполяризованная мембрана становится
низкую вероятность туннелирования и, следова-
гипервозбудимой и с большей вероятностью ин-
тельно, низкую проводимость, которая не изме-
дуцирует потенциал действия. Соответственно,
няет мембранный потенциал [13]. Это можно до-
при напряжении на мембране -72 мВ вероят-
казать, подставив в уравнение (12) следующие
ность квантового туннелирования и квантовая
значения: 142 ммоль/л [20], 14 ммоль/л [20],
проводимость мембраны внеклеточных ионов
4 ммоль/л [20], 140 ммоль/л [20], 0.005 мСм/см2
. С
натрия составляют 1.75 · 10-11 и 0.014 мСм/см2
[20], 0.5 мСм/см2 [20], 2·1010 каналов/см2 [21],
другой стороны, вероятность квантового тунне-
1.6 · 10-19 С, 3.8 · 10-26 кг, 5.4 · 10-11 м [13],
лирования и квантовая мембранная проводи-
мость внутриклеточных ионов натрия равны
6.33 · 10-20 Дж [17] соответственно для перемен-
ных [Na]o, [Na]i, [K]o, [K]i, CNa, CK, плотность
2.13 · 10-17 и 1.65 · 10-8 мСм/см2.
каналов D, заряд иона натрия q, масса иона на-
На основании полученных значений вероятно-
трия m, длина затвора L и свободная энергия
сти квантового туннелирования и квантовой про-
стробирования U. В результате получаем следую-
водимости мембраны при мембранном потенциа-
щее уравнение:
ле, равном -86 мВ и -72 мВ, очевидно, что внекле-
точный ионы натрия имеют более высокую
3
11
−2.99
(6.12−16V
)
−37.45V
m
m
вероятность туннелирования и более высокую
2.71+1.1×10
e
=
70.07e
(13)
квантовую проводимость по сравнению с внутри-
Используя программное обеспечение MAT-
клеточными ионами натрия. Причина такого не-
LAB, получаем значение мембранного потенциа-
соответствия между внеклеточными и внутрикле-
ла Vм = 86 мВ, которое совпадает с величиной по-
точными ионами натрия заключается в неравен-
тенциала без учета квантовых эффектов ионов
стве их кинетической энергии: внеклеточные
натрия. Это указывает на то, что квантовая про-
ионы имеют более высокую кинетическую энер-
водимость незначительна в том смысле, что она
гию, как показано в уравнениях (7) и (8). В резуль-
не влияет на мембранный потенциал. Используя
тате внеклеточные ионы натрия имеют более вы-
уравнения (6)-(10), получаем вероятность кван-
сокую вероятность туннелирования и более высо-
тового туннелирования и проводимость кванто-
кую квантовую проводимость, как следует из
вой мембраны для внеклеточных ионов натрия
уравнений (6), (9) и (10). Кроме того, когда порого-
при мембранном потенциале -86 мВ, равные
вая свободная энергия уменьшается на 25%, про-
исходит деполяризация мембранного потенциала с
4.4 · 10-14 и 3.1 · 10-5 мСм/см2 соответственно. С
-86 мВ до -72 мВ. Этот деполяризующий сдвиг в
другой стороны, вероятность квантового тунне-
мембранном потенциале можно объяснить кван-
лирования и квантовая мембранная проводи-
товой проводимостью внеклеточных ионов натрия
мость для внутриклеточных ионов натрия при од-
ном и том же напряжении на мембране составля-
(0.014 мСм/см2), которая выше, чем остаточная
проводимость мембраны для ионов натрия из «ды-
ют 2.54 · 10-20 и 1.97 · 10-11 мСм/см2.
рявых» каналов (0.005 мСм/см2), и выше, чем
Однако под влиянием определенных патоло-
квантовая проводимость внутриклеточных ионов
гических состояний, таких как каналопатии,
натрия (1.65 · 10-8 мСм/см2).
ишемия и механическое растяжение, энергия,
необходимая для открытия закрытого канала
Следовательно, ишемические изменения, ка-
(энергия свободного затвора), изменяется. Чтобы
налопатии, механическое растяжение и другие
исследовать влияние такого изменения пороговой
ситуации, при которых уменьшается свободная
свободной энергии на мембранный потенциал, ис-
энергия затвора, значительно увеличивают веро-
пользуется уравнение (12), но с U = 4.75 · 10-20 Дж
ятность туннелирования ионов через закрытый
(предполагая, что эти патологические состояния
затвор, так что значительная квантовая проводи-
уменьшили пороговою свободную энергию на
мость мембраны может влиять на мембранный
25%). Соответственно получаем следующее урав-
потенциал в состоянии покоя. За счет внеклеточ-
нение:
ных ионов натрия достигается значительная
квантовая проводимость мембраны, что приво-
3
11
−3.98
(4.54−16V
m
)
−37.45V
m
дит к деполяризации мембраны и делает ее более
2.71+1.1
×
10
e
=
70.07e
(14)
возбудимой, предрасполагая сердечную ткань к
Используя программное обеспечение MAT-
аритмиям.
LAB, получаем значение мембранного потенциа-
Степень сдвига мембранного потенциала за-
ла Vм = 72 мВ.
висит от степени уменьшения пороговой свобод-
БИОФИЗИКА том 66
№ 4
2021
754
КАСВАЛ
ной энергии. По мере ее уменьшения вероятность
спектра заболеваний, включая сердечную арит-
туннелирования и, следовательно, квантовая
мию, эпилепсию и расстройства скелетных
проводимость увеличиваются, и наоборот. Пред-
мышц.
положение о 25%-м уменьшении в данной работе
было сделано только для того, чтобы показать,
ФИНАНСИРОВАНИЕ РАБОТЫ
насколько квантовая проводимость чувствитель-
на к изменению пороговой свободной энергии и
Выполненное исследование не имело финан-
как эта чувствительность наглядно проявляется в
сирования из сторонних источников.
смещении мембранного потенциала.
Значения мембранной проводимости натрия и
КОНФЛИКТ ИНТЕРЕСОВ
калия были использованы нами согласно работе
Автор заявляет об отсутствии конфликта инте-
[20], хотя эти значения относятся к нейронам, а
ресов.
не к сердечным клеткам, это не имеет значения,
потому что все возбудимые ткани имеют один и
тот же принцип формирования мембранного по-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
тенциала покоя, при котором проводимость ка-
Настоящая работа не содержит описания ис-
лия выше, чем проводимость натрия в состоянии
следований с использованием людей и животных
покоя. Кроме того, значение пороговой свобод-
в качестве объектов.
ной энергии U, использованное в этом исследова-
нии, предназначено для каналов Nav1.2, а не для
каналов Nav1.5, которые присутствуют в мембра-
СПИСОК ЛИТЕРАТУРЫ
не сердечной клетки, из-за отсутствия данных,
1. E. Marbán, Nature 415 (6868), 213 (2002).
относящихся к каналам Nav1.5. Однако основное
2. J. T. Bigger Jr, R. J. Dresdale, R. H. Heissenbuttel,
внимание в этом исследовании уделяется тому,
et al., Progr. Cardiovasc. Dis. 19 (4), 300 (1977).
чтобы показать, как такое уменьшение свободной
энергии затвора каналов может повлиять на мем-
3. M. R. Franz, R. Cima, D. Wang, et al., Circulation 86
бранный потенциал, поскольку экспоненциаль-
(3), 968 (1992).
ная функция вероятности туннелирования чув-
4. J. J. Bigger, Circulation 75 (5, Pt 2), 28 (1987).
ствительна к небольшим изменениям значений.
5. D. Horstkotte, Acta Cardiol. 47 (2), 105 (1992).
Более того, эта модель может быть применена к
6. M. Scardigli, S. Cannazzaro, R. Coppini, et al., Progr.
другим возбудимым клеткам, таким как нейроны
Biophys. Mol. Biol. 154, 21 (2020).
и клетки скелетных мышц, что делает выбор точ-
7. A. Sula, J. Booker, L. C. Ng, et al., Nature Commun. 8
ного типа каналов необязательным.
(1), 1 (2017).
8. O. Yifrach and R. MacKinnon, Cell 111 (2), 231
(2002).
ЗАКЛЮЧЕНИЕ
9. J. Huang, M. R. Estacion, P. Zhao, et al., Front. Neu-
Модель квантового туннелирования ионов на-
rosci. 13, 918 (2019).
трия через закрытые каналы использована в на-
10. A. Chamberlin, F. Qiu, S. Rebolledo, et al., Proc. Natl.
шем исследовании, чтобы показать эффект
Acad. Sci. USA 111 (2), E273 (2014).
уменьшения пороговой свободной энергии при
11. C. E. Morris, Front. Physiol. 2, 25 (2011).
значительном увеличении вероятности туннели-
12. D. Reeves, T. Ursell, P. Sens, et al., Phys. Rev. E 78 (4),
рования, так что мембрана становится деполяри-
041901 (2008).
зованной.
13. A. B. Qaswal, Quantum Rep. 1 (2), 219 (2019).
Эта модель может применяться также к ионам
14. A. B. Qaswal, NeuroQuantology, 17 (3), 43 (2019).
калия и другим ионам и под влиянием других за-
15. A. B. Qaswal, Clin. Psychopharmacol. Neurosci. 18
болеваний, которые могут повлиять на свобод-
(2), 214 (2020).
ную пороговую энергию каналов. В дополнение к
16. A. B. Qaswal, Quantum Rep. 1 (2), 287 (2019).
этому модель может быть применена к другим
17. A. B. Qaswal, Quantum Rep. 2 (1), 57 (2020).
возбудимым клеткам, таким как нейроны и клет-
18. F. Chen, J. Hihath, Z. Huang, et al., Annu. Rev. Phys.
ки скелетных мышц, чтобы исследовать влияние
Chem. 58, 535 (2007).
определенных патологических явлений на возбу-
19. R.A. Serway, C. J. Moses, and C. A. Moyer, Modern
димость этих клеток.
Physics; Thomson Learning (Boston, MA, USA, 2005).
Понимание и доказательство квантового пове-
20. J.E. Hall, Guyton and Hall Textbook of Medical Physiol-
дения ионов в биологических системах может
ogy E-Book (Elsevier, Amsterdam, The Netherlands,
предложить лучшие диагностические и прогно-
2015).
стические инструменты и, следовательно, луч-
21. A. R. Pérez-Riera, R. D. Raimundo, R. A. Watanabe,
шие терапевтические результаты для широкого
et al., J. Human Growth Devel 26 (3), 281 (2016).
БИОФИЗИКА том 66
№ 4
2021
РОЛЬ КВАНТОВОГО ТУННЕЛИРОВАНИЯ ИОНОВ
755
The Role of Quantum Tunneling of Ions in the Pathogenesis of the Cardiac Arrhythmias
due to Channelopathies, Ischemia, and Mechanical Stretch
A.B. Qaswal
School of Medicine, University of Jordan, Amman 11942, Jordan
Cardiac arrhythmias cause considerable morbidity and mortality among patients and many pathological dis-
orders have been identified to be related to the cardiac arrhythmias. Understating of how such disorders con-
tribute to the pathogenesis of the cardiac arrhythmia is important to improve the therapeutic outcomes. In
this study, the model of quantum tunneling of ions through the closed channels was used to investigate the
influence of certain pathological entities such as channelopathies, ischemia and mechanical stretch in the
pathogenesis of cardiac arrhythmias. It was found that when these pathologies decrease the free gating energy
of the sodium voltage-gated channels, significant depolarization of membrane potential occurs demonstrat-
ing significant quantum conductance made by significant tunneling probability of sodium ions through
closed channels. This depolarization predisposes cardiac muscle to hyperexcitability and consequently ar-
rhythmias. This model can be applied to other types of ions such as potassium and calcium ions, other types
of channels, other excitable tissues such as neurons and skeletal muscle fibers, and other pathological condi-
tions that affect the integrity of the cell membrane and this concept may be used to understand several patho-
logical excitability-related disorders.
Keywords: quantum tunneling, voltage-gated channel, arrhythmia, channelopathy, stretch, ischemia
БИОФИЗИКА том 66
№ 4
2021