БИОФИЗИКА, 2021, том 66, № 4, с. 756-773
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 591.543.42+577.352.5+57.086
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО
ВОЗБУЖДЕНИЯ И ЕГО ГЛИАЛЬНОЕ СОПРОВОЖДЕНИЕ
© 2021 г. Ю.С. Медникова*, Д.Н. Воронков**, Р.М. Худоерков**,
Н.В. Пасикова*, Н.М. Захарова***
*Институт высшей нервной деятельности и нейрофизиологии РАН, 117485, Москва, ул. Бутлерова, 5а
**Научный центр неврологии РАН, 125367, Москва, Волоколамское шоссе, 80
***Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр
биологических исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
*E-mail: zubkov@mi-ras.ru
Поступила в редакцию 18.04.2021 г.
После доработки 27.04.2021 г.
Принята к публикации 29.04.2021 г.
На основе литературных и собственных данных описаны механизмы возбуждения в нервной систе-
ме и нейроглиальные отношения, участвующие в этом процессе. Возбуждение в нервной системе
формируется двумя процессами - пассивным и активным. Активный тип возбуждения, требующий
энергетических затрат, связан с регулированием мембранных свойств нейронов, что приводит к
формированию изменчивой спонтанной импульсации. Порождаемая пассивным процессом спай-
ковая активность очень стабильна и является следствием трансмембранного перемещения ионов
Na+ и К+ по градиентам концентраций. Пассивный тип возбуждения обеспечивается глутаматерги-
ческими контактами, активный - диффузным выбросом ацетилхолина из холинергических ядер
мозга и блокированием К+-проницаемости. Энергетическое снабжение активного процесса воз-
буждения происходит с участием глии при непосредственной связи глиальных клеток с сосудами
мозга, аккумулировании глюкозы в виде гликогена, осуществлении первого этапа энергетического
метаболизма - гликолиза и регулирования локального мозгового кровотока, сопряженного с М-хо-
линергическим возбуждением нейронов. При устойчивом снижении скорости М-холинергическо-
го процесса (концентрационного, температурного или энергетического) происходит стремитель-
ный отток ионов К+ из нейронов, удаление которых из межклеточной среды также является функ-
цией глии.
Ключевые слова: спонтанная активность, ацетилхолин, дендриты, глиальные сателлиты, общая глия,
ионный гомеостаз.
DOI: 10.31857/S0006302921040165
чение десятков лет: например, почему нейроны
Нейроны и глия являются партнерами для
значительно более, чем клетки глии, уязвимы для
обеспечения разнообразных проявлений мозго-
травматических и гипоксических воздействий;
вой деятельности. Существует мнение, что без
какие функциональные события в нервной
выявления механизмов взаимодействия нейро-
системе требуют значительных энергетических
нальной и глиальной сетей (рис. 1) невозможно
затрат; почему в электрически невозбудимых аст-
установить основы функционирования нервной
роцитах регистрируемая с помощью флуорес-
системы и определить причины нейродегенера-
тивных отклонений [1, 2].
центного анализа Са2+ волна совпадает с повы-
шением импульсной активности в расположен-
Эта задача трудно выполнима, поскольку как
ных поблизости нейронах, если эти процессы
нейроны, так и глиальные клетки отличаются
пространственно разнесены и осуществляются
большим разнообразием, а процессы, которые в
разными механизмами.
них протекают, часто очень быстротечны и для
Возникающие вопросы обусловлены особен-
своего анализа требуют использования разных
ностями функционирования глобального меха-
методических приемов. Возникшие трудности не
низма, каждая деталь которого исполняет кон-
позволяют ответить на многие вопросы уже в те-
кретную роль при взаимодействии с остальными
Сокращениe: ВПСП - возбуждающий постсинаптический
элементами, требует своего энергетического
потенциал.
обеспечения и своей морфологической организа-
756
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
757
ции. В связи с этим мы провели анализ особенно-
сти возникновения активационных реакций от-
дельных нейронов V слоя сенсомоторной коры
мозга морских свинок и сусликов в сравнении с
локализацией глиальных элементов по отноше-
нию к нейронной сети в той же области мозга.
Картирование функциональных характеристик
нейронов и морфологического устройства гли-
альной сети одного и того же образования может
способствовать дальнейшему развитию принци-
па нейроглиальных отношений.
I. СПОСОБЫ ФОРМИРОВАНИЯ
ИМПУЛЬСНОГО ВОЗБУЖДЕНИЯ
Неравновесное содержание неорганических
ионов по обе стороны клеточных мембран у орга-
низмов разного уровня развития - от простейших
до высокоорганизованных
- по мнению
Ю.В. Наточина является обязательным условием
поддержания жизни [3]. Это касается не только
необходимых составляющих для осуществления
синтетической функции клетки, но и использует-
ся в качестве электрофизиологической основы
для формирования возбуждения в нервной систе-
ме. Так, в мозге экстраклеточное содержание
ионов К+ составляет 3.5 мМ, тогда как его внут-
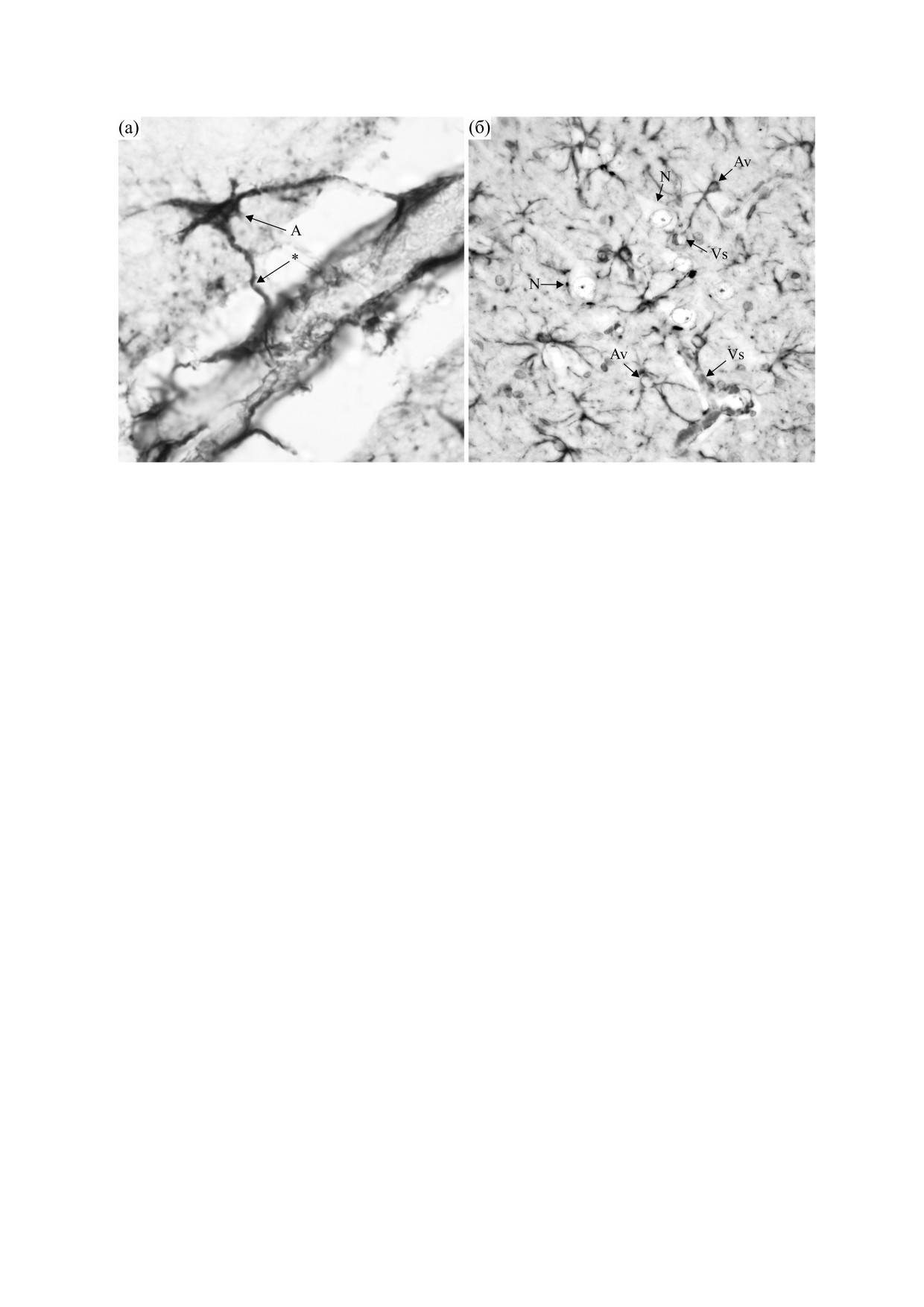
Рис. 1. Морфологическая организация глиальной и
риклеточная концентрация поддерживается на
нейрональной сети сенсомоторной области коры го-
уровне
100 мМ. Соотношение концентраций
ловного мозга. Изображения выполнены на фрон-
тальных срезах толщиной 18 мкм сенсомоторной об-
ионов Na+ имеет противоположную направлен-
ласти коры мозга суслика. (а) - Астроциты выявляли
ность [3, 4]. При наличии полупроницаемой кле-
иммуногистохимическим авидин-пероксидазным
точной мембраны такое распределение ионов
методом по локализации кислого глиофибриллярно-
могло бы сохраняться практически неизменно в
го белка. Использовали поликлональные кроличьи
течение длительного времени, но функциониро-
антитела и систему детекции EXTRA-3 KIT (Sigma,
США); в качестве хромогена применяли 3,3-диами-
вание нейронов постоянно нарушает это нерав-
нобензидин с усилением хлоридом никеля (набор
новесное состояние, переводя его в сторону тер-
SigmaFast, Sigma, США). (б) - Окраска нейронов ме-
модинамического выравнивания ионных кон-
тодом Ниссля.
центарций.
Со времен А. Ходжкина и А. Хаксли [5] хорошо
тамата из специфических сенсорных афферентов
известно, что деполяризация нервного волокна,
и в глутаматергических контактах между нейро-
приводящая к формированию возбуждающего
нами [8], а также как ответ на возбуждающие токи
постсинаптического потенциала (ВПСП) и нерв-
при распространении ВПСП и спайков по нейро-
ного импульса, осуществляется за счет раскрытия
нальным отросткам. Поскольку во всех этих слу-
Na+-каналов и возникновения Na+-тока, приво-
чаях направления Na+- и К+-токов осуществля-
дящего при достижении критического уровня де-
ются по градиентам концентраций, развитие де-
поляризации к спайковому процессу. По мере
поляризации не требует энергетического
развития деполяризации происходит нарастаю-
сопровождения, т.е. является пассивным процес-
щее раскрытие потенциалзависимых К+-каналов
сом, а само возбуждение характеризуется корот-
и выход К+ из клетки, что наряду с инактивацией
ким временем формирования (от нескольких мс)
Na+-каналов восстанавливает исходный уровень
и сопровождается падением мембранного сопро-
тивления [7, 9]. Важной характеристикой возни-
мембранного потенциала [5]. Этот тип возбужде-
кающих таким образом спайковых разрядов яв-
ния возникает при активации Н-холинорецепто-
ляется ограничение их длительности продолжи-
ров в ганглионарных нейронах вегетативной
нервной системы в ответ на выброс ацетилхолина
тельностью возбуждающих токов (рис.
2) и
из преганглионарных волокон [6, 7]; в централь-
высоким постоянством.
ной нервной системе это осуществляется посред-
Вместе с тем этот тип возбуждения нарушает
ством глутаматных рецепторов при выбросе глу-
ионный гомеостаз как внутренней, так и внешней
БИОФИЗИКА том 66
№ 4
2021
758
МЕДНИКОВА и др.
Рис. 2. Примеры активационных реакций на микроионофоретическое подведение глутамата к нейронам разных кор-
ковых областей морских свинок (Пассивное возбуждение). Нейроны зарегистрированы на переживающих срезах сен-
сомоторной и фронтальной коры. Ионофоретическое подведение глутамата к отдельным нервным клеткам осуществ-
ляли из 1 М раствора глутамата натрия (Sigma, США) из одного из каналов трехствольного стеклянного микроэлек-
трода. Сила тока электрофореза - 80 нА (отрицательный полюс внутри электрода). Второй канал электрода,
заполненный 3 М раствором NaCl, использовали для экстраклеточной регистрации импульсной активности; третий
канал - для контроля токового эффекта. Представлены примеры импульсных реакций на локальное подведение глу-
тамата к нейронам V слоя сенсомоторной и фронтальной коры. Время действия тока электрофореза отмечено чертой
под записью активности нейронов. Длительность активационного последействия в ответах нейронов сенсомоторной
коры (N = 132) достоверно короче, чем в ответах нейронов фронтальной коры (N = 110; χ2 = 86.80, α < 0.00001.
среды, поэтому должен сопровождаться его кор-
поскольку регулирование мембранных свойств
является очень энергоемким процессом.
рекцией с помощью Na+,K+-АТФазы, актив-
ность которой по мнению большинства исследо-
Дендриты как дренажная труба. Чем тоньше
вателей является основным потребителем энер-
дендритные веточки, тем выше их входное сопро-
гии при создании активного состояния в нервной
тивление (Rвх), тем больше амплитуда ВПСП,
системе [10-13]. Но дело в том, что повышение
возникающих при локальном выбросе глутамата
частоты импульсации при возбуждении в боль-
в аксо-дендритном контакте. Это обстоятельство
шинстве случаев непосредственно не связано с
дало основание постулировать, что амплитуда
приходом специфической афферентации, не яв-
ВПСП в дендритах может достигать нескольких
ляется прямым следствием быстрого доведения
десятков мВ [16]. Но на пути к соме происходит ее
мембранного потенциала до критического уров-
ослабление, что и приводит к снижению синап-
ня, а зависит от другого механизма, возникающе-
тического потока [15]. Авторы, используя мето-
го за счет изменения мембранных свойств нерв-
дику Patch-clamp при одновременной регистра-
ных клеток.
ции от дендритных локусов и от сомы, обнаружи-
В основе этого механизма лежит деполяриза-
ли, что максимальное ослабление может доходить
ция, возникающая под каждым глутаматергиче-
до 40 раз [15]. Поэтому в срезах сенсомоторной
ским (в центральной нервной системе) или холи-
коры при экстраклеточной регистрации от ней-
нергическим (в автономной нервной системе) си-
ронов V слоя примерно у 40% нервных клеток не
напсом из многих тысяч, расположенных на
обнаружено спонтанной активности [17]. Однако
дендритах. Дендритные контакты на 80% форми-
даже в срезах, почти лишенных каких-либо воз-
руются аксонными коллатералями, диаметр ко-
буждающих влияний, кроме внутрикорковых,
торых (0.1-0.3 мкм) примерно в 10 раз меньше,
возможно зарегистрировать нейроны с разным
чем диаметр аксона, от которого они отходят [14].
уровнем спонтанной активности [17]. Следова-
Следовательно, каждый продвигающийся по ак-
тельно, степень затухания амплитуды ВПСП,
сону спайк создаст в коллатерали в месте ее от-
проходящих по дендритам, различна у разных
ветвления от аксона лишь слабый локальный по-
нейронов даже в пределах небольшого мозгового
тенциал, который погаснет при распространении
образования.
по мембране довольно протяженных аксонных
В 60-х годах прошлого века были сформулиро-
коллатералей. Поэтому в аксо-дендритном си-
ваны условия, от которых зависит поведение
напсе возможен лишь один вид деятельности:
ВПСП в дендритах [18]. Его можно сравнить с по-
один раз в секунду происходит выброс одного
ведением жидкости в трубе с мелкими отверстия-
кванта медиатора стандартной величины. При
ми в стенках, через которые часть жидкости по-
постоянном срабатывании многочисленных кон-
стоянно вытекает наружу. С другого конца трубы
тактов на дендритах формируется стационарный
вытечет тем меньше жидкости, чем длиннее тру-
поток синаптических ВПСП, который можно за-
ба, чем меньше ее диаметр и чем больше плот-
регистрировать от мембраны дендритов [15]. Ре-
ность отверстий в стенках. В случае с дендритами
гулирование этого потока за счет влияния на
добавляется еще объем сомы, от которого зави-
мембранные свойства нейронов приводит к
сит, как быстро будет достигнут критический
управляемому росту частоты спонтанной им-
уровень деполяризации. Вместо отверстий в
пульсации, возникающей в соме. Так формирует-
ся основа для активного механизма возбуждения,
стенках - плотность К+-каналов на мембране,
БИОФИЗИКА том 66
№ 4
2021
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
759
которая определяет мембранное сопротивление
(Rm), вместо ширины трубы (d) - диаметр денд-
рита на каждом компатменте, где его величина
постоянна; l - длина соответствующего компат-
мента, Ri - удельное сопротивление внутренней
среды. L - электротоническая протяженность
дендрита, которая с учетом всех приведенных па-
раметров определит степень ослабления ВПСП.
Ниже приведены результирующие выражения
[19]:
Рис. 3. Сравнительные реакции нейрона сенсомотор-
ной коры на микроионофоретическое подведение
ацетилхолина к соме и к базальному дендриту. Пред-
l
j
λ = (Rm⋅d/4Ri)1/2,
L=
,
ставлены записи нейрона, зарегистрированного в пе-
λ
реживающем срезе в V cлое сенсомоторной коры
j
j
морской свинки. Ионофоретическое подведение аце-
где λ - константа длины; j - индекс, соответству-
тилхолина осуществляли из двух отдельных трехка-
ющий определенному компатменту.
нальных микропипеток, одну из которых, спаянную с
регистрирующим каналом, подводили к соме, а вто-
Обычно электротоническую протяженность
рая, предназначенная только для электрофореза, бы-
дендритов выражают числом констант длины (λ).
ла локализована в области дендритов. Подведение
Максимальная электротоническая длина для
ацетилхолина к соме и дендритам производили из
2 М раствора ацетилхолина хлорида (Sigma, США)
дендритов моторной коры кошки составила 4.9λ
током 80 нА (положительный полюс внутри электро-
[20], тогда как для мотонейронов спинного мозга
да). С помощью соматического микроэлектрода ре-
этот показатель меньше единицы [21]. Следова-
гистрировали импульсные реакции при локальном
тельно, в отличие от электротонически очень
подведении ацетилхолина как к соме, так и к дендри-
компактных дендритов мотонейронов спинного
ту (расстояние до сомы - 150 мкм). Детали указаны в
подписи к рис. 2.
мозга, корковые дендриты проводят возбуждение
с большим декрементом, что совпадает с преоб-
ладанием спонтанно неактивных нейронов в слое
Необходимо отметить, что блокирование К+-
V сенсомоторной коры морских свинок [17].
проницаемости мембраны может быть осуществ-
Нетрудно видеть, что нервные клетки во всем
лено помимо ацетилхолина другими медиатора-
их разнообразии различаются именно по тем пара-
ми (норадреналин, серотонин, дофамин), неко-
метрам, которые определяют степень ослабления
торыми гормонами и пептидами [34-36]. М-хо-
стационарного возбуждения при его распростра-
линергические рецепторы прямо не связаны с
нении по дендритам. Так, нейроны одного и того
же образования различаются размерами клеточ-
К+-каналами, эта связь опосредована вторичны-
ных тел [22, 23], протяженностью и степенью раз-
ми посредниками: через G-белки взаимодействие
ветвленности дендритов [24-27]. Они также харак-
ацетилхолина с М-холинорецепторами запускает
теризуются разными мембранными свойствами,
многоступенчатый метаболический процесс, в
котором участвуют циклические нуклеотиды,
например, разной плотностью К+-каналов на мем-
бране, измеренной либо непосредственно [28, 29],
Са2+, арахидоновая кислота; усиливается обмен
либо по установленной выраженности постакти-
фосфоинозитидов. Сложность этой реакции [34,
вационной гиперполяризации [25, 30, 31].
37, 38] обусловливает ее относительно медленное
Усилительный механизм мозга. Рост спонтан-
(несколько сотен мс) развитие и распространение
ной активности нейронов, определяемый тремя
по обширной мембранной поверхности, в каждой
перечисленными параметрами (диаметром кле-
точке которой последовательно и быстро закры-
точных тел, структурой и протяженностью денд-
ваются К+-каналы независимо от пункта воздей-
ритов; плотностью К+-каналов на мембране),
ствия ацетилхолина. Это означает, что ацетилхо-
собственно и является проявлением активного
лин, выделившийся в любом количестве в любой
типа возбуждения (рис. 3), который протекает за
точке на мембране нейрона, меняет мембранные
свойства одновременно практически по всей по-
счет блокирования К+-проницаемости специаль-
ной реакцией, требующей больших энергозатрат,
верхности (рис. 3). Поэтому глутамат, выброшен-
но не нарушающей при этом ионного гомеостаза
ный из глутаматергических контактов на дендри-
внутри и вне нейрональной мембраны. Она лишь
тах под влиянием ацетилхолина, воздействует на
выполняет разрешающую функцию - позволяет
мембрану с более высоким входным сопротивле-
пассивно возникающему возбуждению в дендри-
нием, что обеспечивает приращение амплитуды
тах трансформироваться в спайковую последова-
ВПСП в месте возникновения на небольшую ве-
тельность, регистрируемую в соме. Этой реакци-
личину (не более нескольких %), но значительно
ей является М-холинергическая реакция мозга
увеличивает (в 1.5-5.6 раза) ее при продвижении
[32, 33].
ВПСП по длинному дендриту до сомы [39]. Та-
БИОФИЗИКА том 66
№ 4
2021
760
МЕДНИКОВА и др.
ким образом, с помощью регулирования эффек-
бранное сопротивление [41]. В дальнейшем выяс-
тивности дендро-соматического проведения в
нилось, что гипоксемическая гипоксия вызывала
мозге был создан универсальный усилительный
снижение процессов внутриклеточной сигнали-
механизм. Его преимущество состоит в том, что
зации, в частности замедляла оборот фосфоино-
при изменении мембранных свойств не более чем
зитидов [42], участвующих в М-холинергическом
на 10% [40] импульсация нейронов может возрас-
регулировании ионной проницаемости нейро-
ти в десятки раз в результате трансформации си-
нальных мембран [34, 38]. Центральный анесте-
наптического дендритного потока в спайковую
тик тиопентал натрия, введенный внутривенно
последовательность.
кроликам в наркотической дозе, через минуту по-
сле начала его применения одновременно блоки-
При внутриклеточной регистрации от нейро-
ровал реакцию нейронов на ацетилхолин, элек-
нов разных структур эффект блокирования К+-
тромиографическую реакцию на электрокожное
токов ацетилхолином или его аналогом карбахо-
раздражение конечности и достоверно снижал
лом был неоднократно продемонстрирован как в
частоту спонтанной активности нейронов [43].
отношении стационарного М-тока, так и при
Таким образом, действие тиопентала, блокирую-
блокировании потенциал- и Са2+-зависимых ка-
щего энергетический метаболизм [44], свидетель-
лиевых токов, дающих вклад в постактивацион-
ствует не только о высокой энергозависимости
ную гиперполяризацию [32-34, 38]. Кроме того,
М-холинергической реакции, но также о роли
блокирование М-тока создает деполяризацию
этого процесса в организации приспособитель-
внутри клетки, так как уменьшается отток пози-
ного поведения. Полученные данные подтвер-
тивных ионов наружу [36]. Но деполяризация,
ждают широко распространенное мнение о связи
возникшая таким образом, вряд ли сможет вы-
холинергического выброса в коре с процессами,
звать импульсный ответ, так как для достижения
регулирующими сенсорное восприятие, внима-
критического уровня пришлось бы закрыть 80%
ние и память [45, 46].
М(К+)-каналов [36]. Таким образом, активация,
Холинергические структуры контролируют
возникающая при действии ацетилхолина, может
деятельность мозга повсеместно. В симпатиче-
быть объяснена только за счет повышения мем-
ских ганглиях ацетилхолин при его выбросе из
бранного сопротивления и создания условий для
преганглионарных волокон вызывает длитель-
глутаматергических ВПСП в дендритах более без-
ный активационный ответ (как на рис. 3) при вза-
декрементного продвижения к соме. Этот эффект
имодействии с М-холинорецепторами и форми-
можно зарегистрировать внутриклеточно по ро-
рует вторую фазу активации, возникающую в ган-
сту амплитуды и частоты потока миниатюрных
глионарных нейронах по активному типу. Первая
ВПСП через 1.5-4.2 с после аппликации ацетил-
фаза, за счет того же холинергического выброса
холина [33]. Тот же эффект, обнаруженный экс-
возникает посредством Н-холинергических ре-
траклеточно, демонстрирует мощный рост часто-
цепторов вследствие переноса ионов по градиен-
ты импульсации в спайковой последовательности
ту концентраций, т.е. по пассивному механизму.
в ответ на ионофоретическое подведение ацетил-
В центральной нервной системе при сенсорной
холина, причем как к соме, так и к дендриту
стимуляции также возникает двухкомпонентный
(рис. 3). Однотипность возникающего возбужде-
ответ. Только первая фаза ответа связана с выбро-
ния при воздействии ацетилхолина на разные
сом глутамата из окончаний специфических аф-
точки на мембране достигается за счет метаболи-
ферентов (как на рис. 2), а вторая - за счет диф-
ческой и очень энергоемкой внутриклеточно
фузного выброса ацетилхолина из холинергиче-
протекающей реакции [38]. Зависимость этой ре-
ских ядер мозга, центрально-детерминированной
акции от энергетического обеспечения была об-
М-холинергической реакции. На основе очень
наружена почти сразу, как только были выявлены
подробного описания холинергических структур
различия между глутаматергическим и М-холи-
[47], с тщательным подсчетом числа холинерги-
нергическим возбуждением. Применение блока-
ческих и нехолинергических нейронов в каждом
торов энергетического метаболизма при экстрак-
из них, а также содержания энзимов синтеза и
леточной регистрации от нейронов коры, а также
распада ацетилхолина [47] можно заключить, что
создание гипоксических условий при замене кис-
развитие холинергической системы мозга проис-
лорода во вдыхаемом воздухе на смесь NO2 и N2
ходило совместно с эволюционным развитием
приводило к блокированию роста импульсной
нервной системы. Самые мощные холинергиче-
ские ядра - базальные ядра переднего мозга, в
активности в ответ на микроионофоретическое
своем составе содержат до 90% холинергических
подведение ацетилхолина и к падению частоты
нейронов и иннервируют кору головного мозга -
спонтанной активности нейронов. Те же условия
его высший интегративный центр [47].
не вызывали изменений активационной реакции
на локальное воздействие глутамата [41]. При
Таким образом, структура возбуждения, фор-
внутриклеточной регистрации оказалось, что
мируемая в нервных клетках на всех уровнях моз-
применение динитрофенола резко снижает мем-
га, развертывается в соответствии с одним и тем
БИОФИЗИКА том 66
№ 4
2021
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
761
же принципом, который предполагает согласова-
ние двух компонентов - пассивного и активного.
Пассивный компонент связан с асимметрией
ионов Na+ и К+ по обе стороны полупроницае-
мой мембраны и возникает за счет возбуждения
токов, текущих по градиентам концентраций. Ак-
тивный компонент, регулируя мембранные ха-
рактеристики нейронов, управляет стационар-
ным потоком ВПСП, непрерывно возникающих
по пассивному механизму и распространяющих-
ся по дендритам.
Как пассивный, так и активный процессы при
своей реализации регулярно хотя бы частично на-
рушают установленное неравновесное содержа-
ние ионов с внутренней и внешней стороны ней-
рональных мембран. Первый - за счет хоть и
кратковременных, но регулярно протекающих
Рис. 4. Глио-нейрональная организация слоя V сен-
актов, направленных на выравнивание концен-
сомоторной коры головного мозга суслика. Окраши-
трационных градиентов при спайковой и ВПСП
вание на кислый глиофибриллярный белок и крези-
активности, а второй - в силу самого механизма
ловым фиолетовым. Обозначены: А - астроцит; N -
нейрон; О - олигодендроцит. Подробности приго-
регулирования К+-проницаемости, который в
товления препаратов срезов и их окраски указаны в
случае недостаточного энергетическогог снабже-
подписи к рис. 1.
ния, а также концентрационных и температурных
причин, влияющих на скорость М-холинергиче-
ской реакции, может привести к устойчивому на-
на на рисунке) обеспечивает иммунные процессы
коплению ионов К+ с внешней стороны мембра-
[2, 49, 50, 52, 53].
ны и, следовательно, к нарушению ионного
Астроциты представляют наиболее многочис-
гомеостаза. Таким образом, в процессе функцио-
ленную группу нейроглиальных клеток. Они име-
нирования мозга постоянно должны решаться
ют множественные и широко разветвленные
как минимум две проблемы - создание энергети-
отростки (рис. 4). Структура этих отростков поз-
ческого обеспечения активного механизма воз-
воляет им пронизывать все межклеточное про-
буждения и условий для безопасной работы нерв-
странство. Кроме того, самые тонкие веточки
ной системы. Обе эти проблемы решаются при
астроцитарных ножек контактируют с синапса-
постоянном участии глиальной сети мозга сов-
ми, обволакивая синаптические структуры и
местно с усилиями нейрональной Na+,K+-АТФа-
предотвращая распространение глутамата из си-
зы. Поэтому глия неразрывно связана с нейрона-
наптической щели [1, 53, 54]. Взаимодействие
ми (рис. 1), и, более того, наличие глии может
глии с медиатором обеспечивает его элиминацию
указать на функциональные особенности отдель-
за счет активности глутаминсинтетазы в астроци-
ных нервных клеток.
тах. Поглощая глутамат с помощью транспорте-
ров, глия превращает его в глутамин и возвращает
в нейрон, где он снова трансформируется в глута-
II. НЕЙРОГЛИАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ
мат [55]. Один астроцит может устанавливать
ПРИ ВОЗБУЖДЕНИИ
контакты с тысячами синапсов [2, 51, 56]. Такая
По количеству и массе глия и нейроны образу-
организация создает условия для постоянного
ют примерно равное процентное соотношение в
контроля за состоянием межклеточной среды и
нервной системе млекопитающих [1, 48]. Глию
предотвращения глутаматной нейротоксичности
обычно подразделяют на три функционально раз-
[10].
личные группы: астроциты, олигодендроциты и
микроглию [2, 49-53]. У них различная специа-
Энергетическая стоимость блокирования К+-
лизация и различная представленность на корко-
каналов. С помощью отростков астроциты опле-
вых срезах. На 4 продемонстрированы разные ти-
тают также кровеносные сосуды (рис. 5). Несмот-
пы глиальных элементов и их взаимная локализа-
ря на то что потребности мозга в энергии превы-
ция по отношению к нейронам. Обращает на себя
шают потребности всех других тканей организма,
внимание приуроченность астроцитов к нейро-
в том числе и потребности скелетной мускулату-
нальным телам, тогда как у олигодендроцитов бо-
ры [11], нейроны не имеют контактов с сосудами.
лее случайное расположение. Предполагается,
Основной энергетический субстрат мозга - глю-
что олигодендроциты преимущественно участву-
коза - поступает преимущественно в астроциты
ют в выработке миелина, а микроглия (не показа-
[11] с помощью транспортеров глюкозы. В астро-
БИОФИЗИКА том 66
№ 4
2021
762
МЕДНИКОВА и др.
Рис. 5. (а) - Пространственные взаимоотношения нейроглии и элементов нервной ткани: А - астроцит; * - концевые
ножки астроцита, оплетающие кровеносный сосуд. (б) - Глиоваскулярные отношения: N - тела нейронов; Vs - сосу-
ды; Av - астроцит, контактирующий с сосудом. Окрашивание на кислый глиофибриллярный белок и крезиловым фи-
олетовым. Подробности приготовления препаратов и их окраски указаны в подписи к рис. 1.
цитах происходит первый этап энергетического
нейронах, составляет 36 молекул АТФ на одну
метаболизма - анаэробный гликолиз, конечным
молекулу глюкозы, т.е. в 18 раз выше продуктив-
продуктом которого является лактат и две моле-
ности гликолиза, осуществляемого в астроцитах.
кулы АТФ. Первые данные по активному метабо-
Следовательно, основное количество энергии,
лизму глюкозы в глие были получены на ретине
производимой мозгом, потребляется в нейронах.
медоносной пчелы, где с помощью подведения
В результате глионейронального взаимодей-
глюкозы, имеющей радиоактивную метку [3H]2-
ствия энергетический метаболизм простран-
[ДГ], было обнаружено, что аккумуляция мече-
ственно разнесен на анаэробную (астроцитар-
ной глюкозы происходит почти исключительно в
ную) и аэробную (нейрональную) составляющие
глиальных клетках, там же осуществляется ее
[58-62]. Кроме того, в глие не только формирует-
фосфорилирование. В фоторецепторных нейро-
ся метаболический предшественник для энерге-
нах в тех же условиях радиоактивной метки прак-
тических процессов в нейронах, но создаются
тически не было выявлено [57, 58]. Поскольку в
условия для формирования резерва энергетиче-
глие почти отсутствуют митохондрии [58], лактат,
ского субстрата в виде гликогена - полимера глю-
производимый в результате гликолиза, выбрасы-
козы. В случае снижения импульсной активности
вается из глиальных клеток, захватывается ней-
в нейронах и, следовательно, ограничения по-
ронами, трансформируется в пируват и в нейро-
требления лактата, гликолиз в астроцитах затор-
нальных митохондриях вступает в цикл Кребса.
маживается, а поступающая из кровеносных со-
Таким образом, преимущественным субстратом
судов глюкоза полимеризуется c помощью глико-
для цикла трикарбоновых кислот в нейронах яв-
ген синтазы
[57,
60,
63]. Гликоген
- это
ляется именно лактат. Энергетический метабо-
стратегический запас энергетического субстрата
лизм в фоторецепторах исключительно аэроб-
на случай энергозависимого роста нейрональной
ный, поскольку аноксия блокирует вызванную
активности, когда в ответ на сенсорную стимуля-
светом активность через несколько секунд [58].
цию формируется неспецифический компонент
Аналогичные глио-нейрональные отношения ха-
возбуждения [64], происходит переход от сна к
рактерны и для других отделов мозга. Так, в куль-
бодрствованию [63] или возрастает длительность
туре нервной ткани, полученной из мозга грызу-
периодов бодрствования [65]. Запускаемый в этих
нов, скорость утилизации глюкозы выше для аст-
и многих аналогичных случаях гликогенолиз [66]
роцитов, чем для нейронов. Следовательно,
быстро расщепляет гликоген с образованием
астроциты осуществляют взаимодействие с глю-
глюкоза-6-фосфата и инициирует процесс анаэ-
козой в первую очередь. Продуктивность окисли-
робного гликолиза. Таким образом функциони-
тельного фосфорилирования, происходящего в
рует хорошо известный в настоящее время чел-
БИОФИЗИКА том 66
№ 4
2021
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
763
ночный (shuttle) механизм оборота лактата в моз-
которое формируется в результате аэробного
ге, в круг которого вовлечены нейроны, сосуды и
окисления глюкозы [10, 11, 13]. Но это мнение вы-
астроциты [1, 52, 54, 58]. Одним из эпизодов этого
сказывается достаточно осторожно, для чего су-
процесса является зарегистрированная связь
ществуют серьезные основания [68]. Во-первых,
между капиллярами и отростками астроцитов в V
чтобы встать со стула, нужно произвести работу
слое сенсомоторной коры (рис. 5). При постоян-
против силы тяжести, а чтобы мозг смог напра-
ной связи с капиллярами энергетический суб-
вить в мышцы команду, эквивалентную этой ра-
страт (глюкоза) поступает в астроциты непрерыв-
боте, он должен затратить энергию. Значит, что-
но, и по мере необходимости за счет гликолиза
бы встать со стула, сначала должна быть затраче-
формируется пул лактата возле ближайших ней-
на энергия для преодоления силы тяготения, а
ронов или происходит передача лактата через ще-
уже потом для восстановления мембранного по-
левые контакты между глиальными клетками
тенциала. Во вторых, несмотря на декларирова-
[66]. Содержание лактата в мозге контролируется
ние энергетического приоритета для активности
также за счет его поступления в кровь при рас-
Na+,K+-AТФазы, выясняется, что трансмем-
щеплении гликогена в печени или при интенсив-
бранное восстановление содержания ионов, про-
ных двигательных упражнениях [60, 63]. Поэтому
текающее против градиента концентраций при
пул лактата в межклеточном пространстве под-
нормальном функционировании вполне удовле-
держивается на постоянно высоком уровне, что,
творительно осуществляется за счет энергии, по-
как полагают авторы, в период мозговой активно-
лучаемой от гликолиза (5% от энергетического
сти способствует поддержанию сознания. Лактат
бюджета мозга) [11, 69]. И в-третьих, в условиях
с помощью астроцитов создает возобновляемый
энергетического дефицита, например, при работе
энергетический субстрат, который при поступле-
на переживающих срезах, значительное темпера-
нии в нейроны окисляется в цикле Кребса. Энер-
турное повышение скорости М-холинергической
гия, получаемая при аэробном окислении, со-
реакции выше 36°С сразу приводит к резкому
ставляет 95% энергетического бюджета мозга [11]
снижению амплитуды спайков регистрируемых
и является необходимым условием для обеспече-
нейронов [70]. Следовательно, М-холинергиче-
ния сознания и активного восприятия [11, 67].
ский процесс у теплокровных протекает при
Многочисленные глутаматергические контакты
энергетических затратах, значительно превыша-
- от 6 до 60 тысяч на один нейрон, несмотря на их
ющих потребности Na+,K+-АТФазы.
постоянное функционирование, не требуют для
своей активации энергетического сопровожде-
Поскольку энергетическое обеспечение ней-
ния, поскольку возбуждаемые ими ВПСП возни-
ронов непосредственно связано с глией, стано-
кают при перемещении ионов по градиенту кон-
вится понятным, почему еще одной функцией
центраций. Значит, основным потребителем
астроцитов является регулирование локального
энергии при увеличении импульсной активности
мозгового кровотока, причем синхронно с изме-
следует считать регулирование мембранных
нением уровня спонтанной активности нейронов
[1, 2, 54, 67].
свойств нейронов - блокирование К+-каналов
[32, 33] при диффузионном и не обязательно си-
Нейроны и макроглия в процессе эмбриогене-
наптическом выбросе ацетилхолина (см.
за происходят из одних и тех же предшественни-
раздел I). Этот тип возбуждения, осуществляе-
ков - радиальной глии [2, 71], из которой в
мый за счет М-холинергической реакции мозга,
первую очередь формируются нейроны. После
обеспечивает более эффективное проведение по
завершения нейрогенеза происходит глиогенети-
дендритам глутаматергического синаптического
ческое переключение, и радиальная глия начина-
потока - его трансформация в импульсную по-
ет дифференцироваться в астроциты или прекур-
следовательность и формирует сознание [45, 46].
сорные клетки для олигодендроцитов. В связи с
этим, естественно, что на мембранах нейронов и
Еще одним потребителем энергии в нейронах
астроцитов экспрессируются одни и те же ион-
является активирование Na+,K+-АТФазы, вос-
ные каналы и рецепторы [1, 52, 72]. Несмотря на
станавливающей ионный гомеостаз, нарушен-
то что глиальные клетки электрически невозбу-
ный в результате срабатывания глутаматергиче-
димы [60, 72, 73], наличие одинакового набора
ских синапсов. Какой бы ни была частота им-
ионных каналов и рецепторов позволяет нейро-
пульсации в нейронах, зарегистрированных в
нам и астроцитам осуществлять совместное реа-
мозге при его функционировании в нормальных
гирование в случае общего воздействия, каким
условиях, амплитуда спайков остается практиче-
является, например, диффузионный выброс аце-
ски неизменной. Никто из исследователей поче-
тилхолина. Блокирование К+-каналов на нейро-
му-то не сомневается, что именно восстановле-
нальной мембране при взаимодействии ацетил-
ние исходных концентраций ионов Na+ и К+ по
холина с М-холинорецепторами вызывает рост
обе стороны мембраны после активации нейро-
спонтанной активности (см. раздел I), а рядом
нов требует такого огромного количества АТФ,
расположенные астроциты за счет той же самой
БИОФИЗИКА том 66
№ 4
2021
764
МЕДНИКОВА и др.
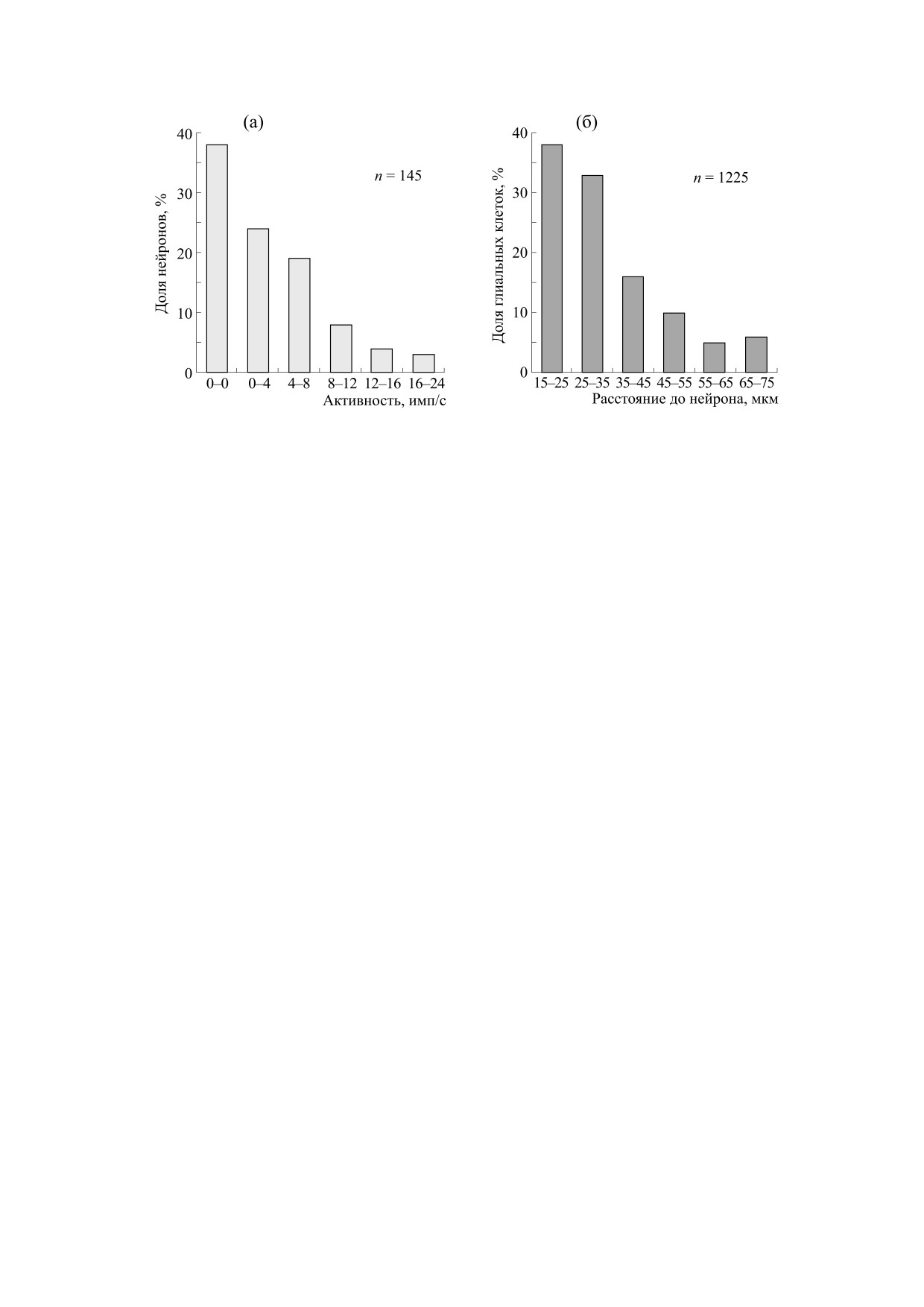
Рис. 6. Распределение нейронов V слоя сенсомоторной коры по уровню спонтанной активности в сравнении с
локализацией глии по отношению к нейронам. (а) - Распределение нейронов V слоя сенсомоторной коры мозга
морских свинок по уровню спонтанной активности (n = 145). По оси абсцисс - уровень спонтанной активности
(имп/c); по оси ординат - доля нейронов (в %) с данным уровнем активности. (б) - Распределение глиальных клеток
V слоя сенсомоторной коры по расстоянию до ближайшего нейрона (n = 1225). По оси абсцисс - расстояние до
нейрона (мкм), по оси ординат - доля глиальных клеток на данном расстоянии от нейрона (%). Морфометрический
анализ препаратов, окрашенных по методу Ниссля, выполняли на микроскопе Leica DMLB (Германия), оснащенным
камерой Leica DC 300 и системой анализа изображений Leica Qwin. На изображении, выводимом на экран монитора,
вручную при помощи графического планшета Wacon на тела нейронов центрального сечения накладывали маску,
создавая замкнутый контур по периметру клетки; маски накладывали и на все ядра глиальных клеток (астроцитов и
олигодендроцитов), видимых в поле зрения. Пространство между нейронами заполняли окраской серого тона с
непрерывным падением градиента от максимальной окраски по периметру каждого нейрона. Расстояние между
нейронами и глиоцитами определяли по интенсивности окрашивания фона.
реакции могут сформировать другой конечный
одов (от нескольких сотен миллисекунд до не-
скольких секунд).
эффект - выброс ионов Са2+ из эндоплазматиче-
ского ретикулума, известный из литературы как
Индивидуальные нейроглиальные контакты.
Са2+-волна [2, 49, 54, 74]. Возникающая при этом
Несмотря на то что глия и нейроны функциони-
реакция вазодилатации и гиперемии сосудов, как
руют совместно, расположение глии по отноше-
считают многие авторы [67, 74-76], является
нию к нейронам может иметь индивидуальные
черты, в соответствии с особенностями нервных
функцией астроцитов по регулированию мозго-
клеток. Хорошо известно, например, что нейро-
вого кровотока как ответ на Са2+-волну, которая
ны по-разному чувствительны к гипоксическим
сосредотачивается именно в астроцитарных от-
воздействиям [11, 80], а при морфометрическом
ростках [74]. Сходство процессов, происходящих
анализе обнаруживается разное сопутствующее
в нейронах и в астроцитах при выбросе ацетилхо-
глиальное сопровождение у разных нервных кле-
лина, прослеживается на биохимическом уровне:
ток, в том числе при выпадении некоторых сен-
активация в нейронах [34, 37] и Са2+-волна в аст-
сорных функций (например, при глухоте) [81].
роцитах [74, 77, 78] протекают при участии одних
Разнообразие свойств нейронов характерно не
и тех же вторичных посредников, в частности
только при сравнении разных структур мозга, но
и в пределах одного мозгового образования. Так,
Са2+ и инозитол-1,4,5-трифосфата.
на рис. 6 для V слоя сенсомоторной коры морских
Таким образом, можно сделать вывод, что аце-
свинок представлено распределение нейронов по
уровню спонтанной активности и распределение
тилхолин приводит к энергозависимому росту
числа глиальных элементов, находящихся на раз-
спонтанной активности в нейронах, а астроциты
ном расстоянии от нейронов. В V cлое среди ней-
с помощью Са2+-волны, регулирующей локаль-
ронов, зарегистрированных в срезах, преоблада-
ный мозговой кровоток, снабжают эту реакцию
ли нервные клетки, не имеющие спонтанной ак-
энергией. Поэтому рост потребления О2 при сен-
тивности
(37.2%), а глиальные клетки в
сорной стимуляции [79], гиперемия в сосудах [54]
наибольшем числе были расположены в непо-
и М-холинергическая реакция в нейронах [33]
средственной близости от нейронов
(38%)
имеют очень близкие величины латентных пери-
(рис. 6а,б). Поскольку форма распределений для
БИОФИЗИКА том 66
№ 4
2021
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
765
Рис. 7. Примеры реагирования нейронов V слоя сенсомоторной коры мозга морских свинок на микроионофоретиче-
ское подведение ацетилхолина. Представлены реакции нейронов, имеющих разный уровень спонтанной активности.
Микроионофоретическую аппликацию ацетилхолина проводили к соме нейронов из 2 М раствора ацетилхолина хло-
рида (положительный полюс внутри электрода), ток электрофореза всюду 80 нА. Длительность действия тока электро-
фореза отмечена чертой под каждой записью. Справа указаны максимальные значения приращения импульсации в
ответ на ацетилхолин у нейронов, имеющих разный уровень спонтанной активности. Детали указаны в подписи к
рис. 3.
всех зарегистрированных нейронов и подсчитан-
активности в ответ на ацетилхолин составило
ных глиоцитов одинакова, это может означать,
12 имп/c, а у самого активного в фоне нейрона -
что для спонтанно неактивных нейронов харак-
всего 5 имп/c (рис. 1, 2 и 7). Следовательно, чем
терно близкое расположение клеток глии, а для
выше исходная частота импульсации, тем меньше
высокочастотных нервных клеток наличие глии
растет активность при подведении ацетилхолина,
не так существенно.
тем меньше потребуется энергии для ее развития.
Поэтому глиальные клетки располагаются все
Уровень спонтанной активности у каждого
дальше и дальше от нейронов (рис. 6).
нейрона зависит от степени ослабления стацио-
нарного синаптического потока при его прохож-
Способность нейронов отвечать реакциями
дении по дендритам [15] и определяется морфо-
разной интенсивности на подведение ацетилхо-
лина, по-видимому, является одним из принци-
логическими и мембранными свойствами нейро-
пов работы мозга по организации приспособи-
нов (см. раздел I), из которых мембранное
сопротивление является единственным регулиру-
тельного поведения. По результатам регистрации
емым параметром. Наличие значительного числа
импульсной активности прецентральных нейро-
нов коры обезьян [82] были представлены спай-
спонтанно неактивных нейронов в V слое сенсо-
ковые последовательности у нервных клеток с
моторной коры свидетельствует, в частности, о
разным уровнем спонтанной активности в ответ
высокой плотности К+-каналов на их мембранах,
на условный световой стимул. Была выявлена та
что тестируется по малой выраженности постак-
же закономерность - чем ниже исходный уровень
тивационного последействия в ответах на глута-
импульсации, тем выше приращение активности
мат (рис. 2). Значит, если непосредственно к та-
в ответ на условный раздражитель. Динамика раз-
ким нервным клеткам подводить ацетилхолин,
вертывающегося ответа во всех нейронах соответ-
можно расчитывать на возникновение очень вы-
ствовала динамике М-холинергической реакции
сокочастотного ответа, в отличие от спонтанно
(рис. 7), а их суммарная реакция приводила к
активных нейронов. На рис. 7 представлены ре-
формированию условнорефлекторного движе-
акции нейронов сенсомоторной коры, имеющих
ния. Поскольку латентные периоды во всех акти-
разный уровень спонтанной активности в ответ
вационных нейрональных реакциях составляли
на микроионофоретическое подведение ацетил-
не менее 150-200 мс, был сделан вывод, что при-
холина. Во всех случаях ацетилхолин вызывал ти-
способительное повышение импульсной актив-
пичную активационную реакцию мускаринового
ности происходит по неспецифическому типу
типа с латентным периодом 2-4 с и длительным
[82], т.е. за счет активного типа возбуждения.
последействием. Самый значительный рост им-
пульсации зарегистрирован для спонтанно неак-
Морфометрический анализ нейроглиальных
тивного нейрона - 30 имп/c (рис. 3 и 7). У нейро-
соотношений в речедвигательной зоне у нор-
на с частотой импульсации 5 имп/c приращение
мальных и глухонемых детей четырехлетнего воз-
БИОФИЗИКА том 66
№ 4
2021
766
МЕДНИКОВА и др.
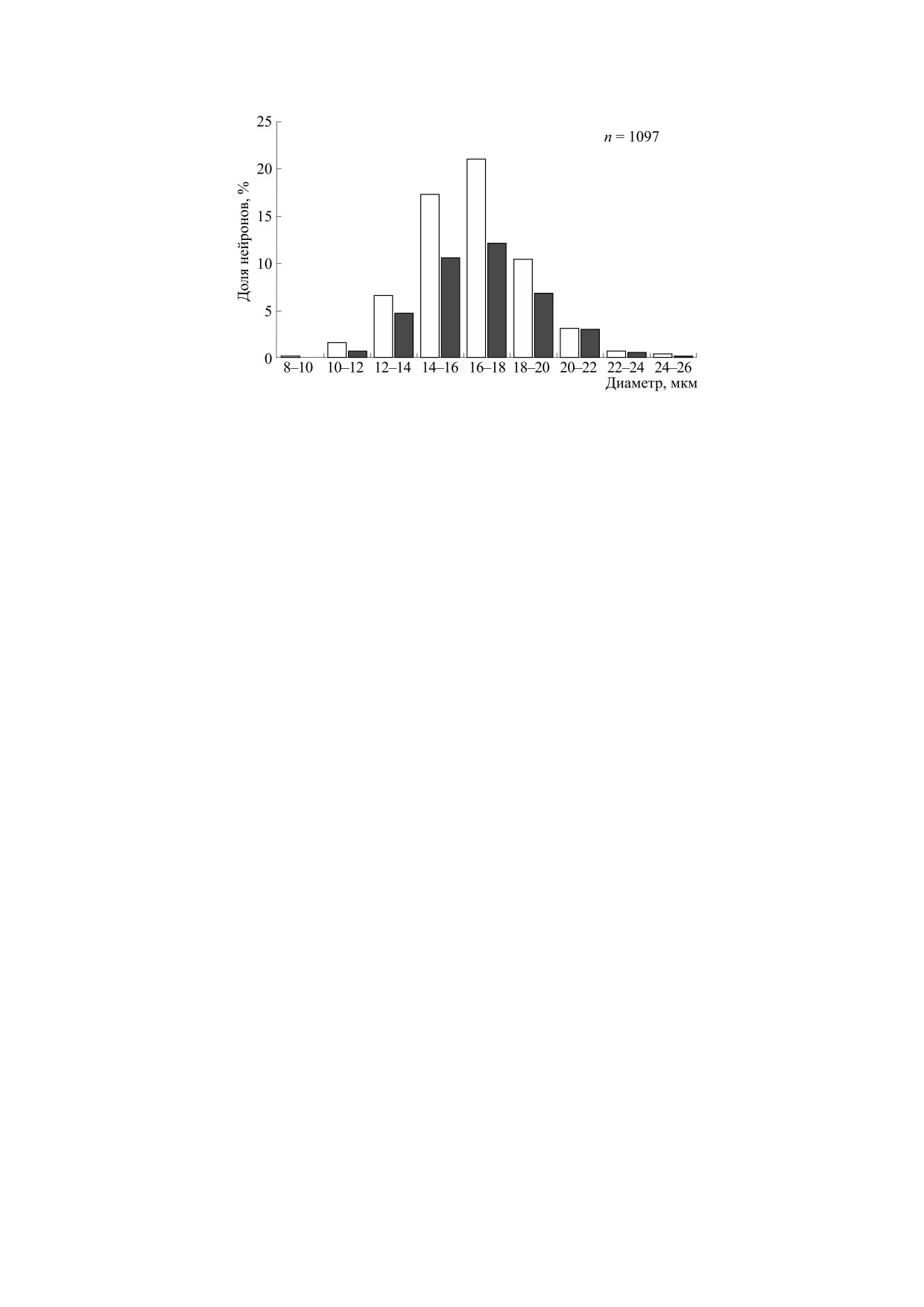
Рис. 8. Соотношение числа нейронов, имеющих и не имеющих сателлитную глию, в зависимости от размеров
клеточных тел нейронов в слое V сенсомоторной коры морских свинок. По оси абсцисс - величина эквивалентного
диаметра (мкм); по оси ординат - доля нейронов (в %) с соответствующим признаком: доля нейронов, не имеющих
глиальных сателлитов, обозначена светлыми столбиками; доля нейронов, имеющих сателлитную глию, - темными
столбиками. Сателлитные глиоциты определяли по методике, аналогичной описанной в подписи к рис. 6.
Сателлитными глиоцитами считали глию, располагающуюся на расстоянии от нейронов в пределах полутора средних
диаметров ядра глиальных клеток.
раста показал, что при слуховой патологии сни-
ных сателлитов кодирует еще один признак, кро-
жаются показатели нейроглиальных отношений:
ме размера сомы, по которому нейроны отлича-
в полтора-два раза падает плотность общей глии и
ются друг от друга. Принимая во внимание
уменьшается число нейронов, окруженных гли-
участие глии в энергетическом обслуживании
альными сателлитами [81]. Авторы полагают, что
нейронов, можно полагать, что чем больше сател-
с помощью глии при нормальном функциониро-
литов, тем выше на мембране нейрона плотность
вании удовлетворяются энергетические потреб-
К+-каналов, которые должны закрываться при
ности нейронов. Так как при выпадении функ-
работе мозга посредством энергоемкой М-холи-
ции необходимость в энергии снижается, следо-
нергической реакции. А то обстоятельство, что
вательно, падает и роль глии [81].
максимальное число глиальных сателлитов у кор-
Астроциты в разных областях мозга обладают
ковых нейронов человека значительно больше
различными генетически-детерминированными
[81], чем у морской свинки [17], может свидетель-
особенностями [56], но даже в пределах корковых
ствовать о возможности высокочастотного реаги-
структур их обычно подразделяют на свободную и
рования наших нейронов и о нашем серьезном
сателлитную глию. Сателлитная глия располага-
эволюционном преимуществе.
ется в непосредственной близости от нейронов на
расстоянии как правило не превышающем полу-
III. ЗАЩИТНАЯ ФУНКЦИЯ ГЛИИ
тора средних диаметров ядер глиальных клеток.
Ее присутствие возле нейронов видоспецифично
Функционирование нервной системы в связи
и вариабельно в пределах конкретной мозговой
с изменчивостью ионной проницаемости, ис-
структуры. Так, максимальное число глиальных
пользованием большого числа медиаторных и
сателлитов в корковых полях у человека достигает
модуляторных воздействий, сопряженных с дей-
шести глиоцитов на один нейрон [81], тогда как у
ствием температурных и энергетических факто-
морских свинок в сенсомоторной коре обнаруже-
ров регулирования, приводит к тому, что экстра-
но не больше трех сателлитов [17]. На рис. 8 пред-
нейрональная среда постоянно меняется. Транс-
ставлено распределение глиальных сателлитов в
миттерный и ионный гомеостаз обеспечивается
зависимости от диаметра нейронов в V слое сен-
работой нейрональной Na+,K+-АТФазы, но ос-
сомоторной коры морских свинок. Нейронов без
новная нагрузка приходится на глиальную сеть с
перинейрональной глии в каждой группе с кон-
использованием множественных механизмов:
кретным нейрональным диаметром было больше,
чем окруженных глиальными сателлитами (свет-
глиальной изоформы Na+,K+-АТФазы, активно-
лые столбики - 60% и темные столбики - 40% на
го удаления трансмиттеров из околосинаптиче-
рис. 8). Хорошая повторяемость этих соотноше-
ского пространства, восстановления ионного со-
ний свидетельствует о том, что наличие глиаль-
става среды, перераспределения продуктов энер-
БИОФИЗИКА том 66
№ 4
2021
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
767
гетического обмена, синтеза нейроактивных и
по мозговой ткани, так же как и причина распро-
трофических факторов. Специализированная
странения пенумбры вокруг ядерной зоны мозго-
функция нейропротекции, выполняемая глией,
вого инсульта.
обеспечивает поддержание адаптивных физиоло-
В экспериментах, проведенных in vivo, в обла-
гических процессов, нарушение которых приво-
сти СА1 гиппокампа крыс с использованием спе-
дит к патологическим отклонениям в деятельно-
циализированного для глии яда флуороцитрата
сти мозга.
было обнаружено, что, начиная с двухчасового
микродиализного применения флуороцитрата,
Глиальный контроль за состоянием экстракле-
точной среды. Глия по отношению к нейронам за-
наружная концентрация К+ постепенно повыша-
нимает подчиненное положение. Глиальная сеть
лась, достигая 10-15 мМ через 4-6 ч [84]. При
формируется уже после того, как выстроен нейро-
умеренном микродиализном применении KCl (50
нальный каркас [2, 71], и ее элементы устанавлива-
мM), моделирующем эффект распространяю-
ются в соответствии с функциональными особен-
щейся депрессии, в контрольных условиях не бы-
ностями индивидуальных нейронов (рис. 8) или
ло выявлено роста [К+]о, тогда как на фоне воз-
сформированных мозговых структур [1].
действия глиотоксина флуороцитрата уже через 2
Типичный астроцит состоит из сомы, четы-
часа замечено еще более значительное повыше-
рех-десяти крупных ветвей и тысяч веточек и ли-
ние наружного содержания калия в ответ на рас-
сточков, которые формируют около 90-95% по-
пространяющуюся депрессию с последующим
верхности астроцита [48]. Богатое ветвление аст-
его суммарным подъемом до 20-25 мМ [84]. Ви-
роцитарных отростков, направление которых не
димо, значительному росту концентрации калия
повторяет ход нейрональных дендритов, где аст-
в межклеточном пространстве препятствует глия,
роциты контактируют с синаптическими образо-
устраняющая его избыток при наступлении экс-
ваниями [1, 49, 53], а формируют похожую на об-
тремальных условий.
лако структуру, позволяет считать одной из ос-
Ионы К+попадают в астроциты либо пассивно
новных функций астроцитов взаимодействие с
через калиевые каналы, с высокой плотностью
межклеточным пространством и установление
представленные на мембране глиальных клеток
связей друг с другом с помощью щелевых контак-
тов [1, 49, 54]. Исследования, проведенные с ис-
[72], либо с помощью астроцитарной Na+,K+-
АТФазы, активность которой выше, чем у ее ней-
пользованием прижизненной визуализации, по-
рональной изоформы [4, 49]. Выпрямляющие
казали, что свободные окончания астроцитарных
ножек могут быть подвижны [48, 71], как бы осу-
К+ir-каналы, представленные на глиальных мем-
ществляя «сканирование» ближайших областей
бранах, имеют особенность увеличивать прони-
окружающего пространства. Это позволяет пред-
цаемость в квадратичной зависимости с ростом
полагать, что кроме создания фиксированных
[K+]o [4, 49, 83]. Калий, поглощенный астроцита-
контактов с сосудами (рис. 5) и глиальных чехлов
ми, в дальнейшем перетекает через щелевые кон-
для синапсов с целью поглощения выделяемого
такты в те области астроцитарного синцитиума,
глутамата [52, 54, 55] большое количество астро-
где его концентрация ниже, или через филоподии
цитарных отростков свободно локализованы в
попадает в сосуды [4]. Существуют данные, со-
межклеточном пространстве. Возможно, что для
контроля за состоянием окружающей среды и
гласно которым высокая концентрация К+ в
удаления глутамата из возбуждающих контактов
межклеточной среде запускает Са2+-ответ в аст-
существуют разные типы глиальных элементов [1,
роцитах [85], что может способствовать регулиро-
48, 56, 77].
ванию сосудистого русла для более эффективного
глио-васкулярного взаимодействия [1, 2, 67, 75,
В нервной системе возникает ряд состояний,
76].
связанных с устойчивым повышением наружного
Глия более устойчива к повреждающим фак-
содержания ионов К+. И если выброс К+ из ней-
торам, чем нейроны [1, 53]. Общей чертой и опре-
ронов при возникновении спайковой активности
деляющим признаком различных нарушений в
в ответ на сенсорную стимуляцию составляет все-
центральной нервной системе является реактив-
го 1.0-1.7 мМ дополнительно к исходному уров-
ный глиолиз - гиперэкспрессия кислого глио-
ню в 3.5 мМ [83], он может быть возвращен обрат-
фибриллярного белка, в результате чего происхо-
но в результате активности нейрональной
дит набухание отростков и клеточных тел астро-
Na+,K+-ATФазы [84]. Но в случае распространя-
цитов [1, 48, 86]. Назначение этой глиальной
ющейся депрессии подъем [К+]o может составить
реакции до сих пор еще недостаточно определе-
30-45 мМ и выше [4, 84]. Невозможность быстро-
но, но известно, что она обратима, и форма и
го удаления такого большого количества калия из
функция астроцитов могут быть восстановлены,
межклеточного пространства собственно и явля-
если неблагоприятное воздействие прекращается
ется причиной распространения этого явления
[1, 84]. Иное дело нейроны - под влиянием не-
БИОФИЗИКА том 66
№ 4
2021
768
МЕДНИКОВА и др.
скольких волн распростаняющейся депрессии
недифференцированными предшественниками
даже кратковременное отключение глиального
макроглии [48, 51, 91]. Их существование создает
обеспечения приводит к гибели нервных клеток
возможности для формирования дополнитель-
[84]. Кроме контроля за параметрами, обеспечи-
ных глиальных клеток в случае их травматиче-
вающими функциональную среду для нейронов,
ской потери или наступления патологических со-
глия синтезирует нейроактивные вещества пеп-
стояний.
тидной природы: трофические факторы и факто-
Цитоархитектонические исследования, прове-
ры роста (цитокины, TNFα, BDNF, TSP-1 и др.),
денные в разных областях коры мозга (речедвига-
при выбросе которых нервные клетки приобрета-
тельная и верхнетеменная), у людей разных воз-
ют способность к дополнительному синаптогене-
растных групп показали, что по мере старения
зу возбуждающих контактов и устойчивость к по-
происходит рост общей глии: у женщин в старче-
вреждающим факторам [1, 2, 48, 53, 56].
ском возрасте (свыше 80 лет) в III слое речедвига-
тельной области этот показатель увеличился в
Основным неблагоприятным воздействием, с
разных полушариях на 9.5-16.0% по сравнению с
которым наиболее часто сталкивается нервная
женщинами зрелого возраста; у пожилых жен-
система в процессе функционирования, является
щин (65-75 лет) увеличение составило 2.4-4.7%.
недостаток энергетического снабжения в связи с
Аналогичная возрастная динамика была харак-
полным отсутствием в мозге запасов энергетиче-
терна также для верхнетеменной области и рас-
ского субстрата [68]. Существует мнение, что лю-
пространялась на людей обоего пола [91]. Прини-
бое патологическое состояние связано прямо или
мая во внимание меньшую уязвимость глии по
косвенно с нарушением кислородного гомеостаза
сравнению с нейронами при существовании в ги-
организма [87]. По мере старения, начиная с 50-
поксических условиях, можно полагать, что по-
летнего возраста, проблема отягощается суще-
всеместный рост плотности общей глии в коре
ственными изменениями сосудов головного моз-
мозга при старении означает ее дополнительную
га. В пожилом возрасте стенки сосудов обычно
дифференциацию из полидендроцитов для устра-
утолщены и менее эластичны [88, 89]. Это являет-
нения неизбежного роста содержания экстракле-
ся причиной нарушения транспортной функции
точного калия при функционировании в услови-
гемато-энцефалического барьера. Поэтому сосу-
ях старческой гипоксии. Вряд ли без этой глиаль-
дистые изменения с возрастом очень часто при-
ной реакции человеческая жизнь была бы
водят к недостаточности мозгового кровоснабже-
возможна старше 55-60 лет
ния и к гипоксии мозга [89]. Стойкие гипоксиче-
ские явления сопряжены с нарушением
Но потеря нейронов все равно происходит при
продукции энергии как на этапе гликолиза, так и
старении и в основном за счет нервных клеток,
вследствие нарушения окислительного фосфори-
имеющих сателлитную глию [91]. Глиальные са-
лирования. Борьба за выживание нервной систе-
теллиты исчезают вместе с нейронами, которые
мы в этом, казалось бы, безнадежном случае ве-
они окружают. Из-за отсутствия необходимого
дется сразу по нескольким направлениям. Так,
энергетического субстрата активность глиальных
снижаются энергетические потребности мозга за
сателлитов неспособна обеспечить выживае-
счет ослабления активного механизма возбужде-
мость нейронов одновременно с удовлетворени-
ния: регулирование мембранных свойств дендри-
ем высоких энергетических требований, необхо-
тов падает в результате замедления синтеза аце-
димых для выполнения функции. Из этого следу-
тилхолина и его выделения из холинергических
ет общий вывод, что в условиях глобального
ядер мозга [90]. Но это помогает лишь частично,
энергетического дефицита гибнут прежде всего те
нейроны, которые требуют максимальных энер-
поскольку приводит к раскрытию К+-каналов
гетических затрат для своей деятельности.
нейрональных мембран и постепенному накоп-
лению калия во внеклеточной среде. То же самое
Из представленных на рис. 7 трех нервных кле-
происходит за счет гипоксического ограничения
ток, реагирующих на ацетилхолин, максимальное
приращение частоты импульсации в ответе пока-
активности Na+,K+-АТФазы. Таким образом, в
зано для нейрона 3. Реакция активного возбужде-
результате постоянной возрастной гипоксии ка-
лиевое внутриклеточное содержимое постепенно
ния, связанная с блокированием К+-каналов на
перетекает из нейронов по градиенту концентра-
мембране [32, 33], именно для этого нейрона ока-
ций в межклеточную среду, создавая предпосыл-
жется энергетически самой затратной. Трудно
ки для устранения неравновесного распределе-
сказать, как глиоциты находят нейроны, с кото-
ния ионов по обе стороны мембраны, стойкой де-
рыми требуется создать тесное энергетическое
поляризации и последующей гибели нейронов.
сотрудничество, но они не ошибаются (рис. 8).
Глиальная защита при недостаточности актив-
В нервной ткани кроме трех основных глиаль-
ного типа возбуждения. Стойкое повышение на-
ных клеток: астроцитов, олигодендрицитов и
микроглиальных элементов существует четвер-
ружного содержания ионов К+ сопровождает все
тый тип - полидендроциты, которые являются
случаи снижения скорости М-холинергической
БИОФИЗИКА том 66
№ 4
2021
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
769
реакции и в большинстве случаев приводит к се-
рьезным неврологическим нарушениям. По-
скольку холинергический процесс является мета-
болической реакцией, зависимой от энергетиче-
ского обеспечения и температуры, поддержание
температурного и энергетического гомеостаза яв-
ляется обязательным условием выживания теп-
локровного организма. Кроме того, снижение
скорости холинергической реакции происходит в
мозге на стадии медленноволнового сна. С помо-
щью микродиализных измерений в коре мозга
кошек было обнаружено, что в период спокойно-
го бодрствования содержание ацетилхолина бо-
лее чем в два раза больше, чем во время глубокого
сна [92]. Это создает опасность накопления [K+]o
в периоды сна, поэтому глубина сна изменчива и
каждые полтора часа глубокий сон перемежается
краткими эпизодами с более значительным вы-
бросом ацетилхолина [92], а глиальным клеткам
постоянно приходится откачивать экстраклеточ-
но собравшийся во сне калий, чтобы не допустить
нарушения ионного гомеостаза.
У М-холинергической реакции мозга су-
ществуют две температурные точки, где возника-
Рис. 9. Индуцируемое гипотермией возникновение
ет рост скорости, с которой происходит ограниче-
импульсации у исходно неактивного нейрона и даль-
ние К+-проницаемости нейрональных мембран -
нейший ее рост при восстановлении температуры.
Представлен нейрон V слоя сенсомоторной коры сус-
при 28ºС и 36ºС [93]. Это означает, что ниже 28ºС
лика. (а) - Фрагменты записи активности нейрона
наступает максимальное температурное раскры-
при охлаждении от 33.4 до 25°С и при восстановлении
температуры от 32.2°С до 33.9°С. (б) - Взаимосвязь
тие К+-каналов. При работе со срезами корковых
между уровнем спонтанной активности и амплитудой
нейронов можно заметить, как ниже этой темпе-
спайков в период гипотермии и при дальнейшем вос-
ратуры разворачиваются явления, обусловлен-
становлении температуры. Черные кружки обознача-
ные массовым выбросом ионов К+ из нервных
ют последовательные измерения в интервале темпе-
ратур 29.2-22.5°С и 22.5-29°С; светлые кружки - в
клеток. На рис. 9 представлен нейрон V слоя сен-
интервале 29.2-34.8°С.
сомоторной коры суслика, который при 33.4ºС не
имел спонтанной активности. Рисунок демон-
стрирует, как при температуре ниже 28ºС появля-
Пассивный рост спонтанной активности при
ется и растет фоновая импульсация (рис. 9а, 1-3),
охлаждении аналогичен ее активному регулиро-
что сопровождается снижением амплитуды спай-
ванию и происходит по механизму ограничения
ков. Рост спонтанной активности при охлажде-
К+-проницаемости мембран, но без участия
нии не может быть связан с ее активным регули-
внутриклеточного активного процесса, каким яв-
рованием, так как ниже 28ºС скорость М-холи-
ляется М-холинергическая реакция, а в силу кон-
нергической реакции падает. А снижение
амплитуды спайков свидетельствует о том, что
центрационного ограничения перемещения К+-
начинает развиваться патологический процесс и
ионов. В данном случае это означает, что гипо-
также ниже 28ºС, т.е. именно тогда, когда калий
термическое снижение скорости М-холинерги-
стремительно накапливается с внешней стороны
ческой реакции происходит не так стремительно,
мембраны. Этот же патологический процесс при-
как быстрота накопления калия с наружной сто-
водит к пассивному росту спонтанной активно-
роны мембраны, вызванное раскрытием К+-ка-
сти, так как концентрационное соотношение
налов ниже 28ºС. Высокая плотность К+-каналов
ионов К+ по обе стороны мембраны снижается,
на мембране может способствовать такому тече-
падает калиевый М-ток, растет мембранное со-
нию событий именно у спонтанно неактивных
противление, что и обеспечивает более эффек-
нейронов.
тивное продвижение по дендритам стационарно-
го потока глутаматергических ВПСП. Поэтому
Восстановление температуры к исходным зна-
спонтанная активность при охлаждении быстро
чениям (32-34ºС) не только не восстанавливает
растет и преимущественно у спонтанно неактив-
первоначальное отсутствие импульсной активно-
ных нейронов (рис. 9а, 1-3) [94].
сти (рис. 9а, 1), но усугубляет процесс, вызван-
БИОФИЗИКА том 66
№ 4
2021
770
МЕДНИКОВА и др.
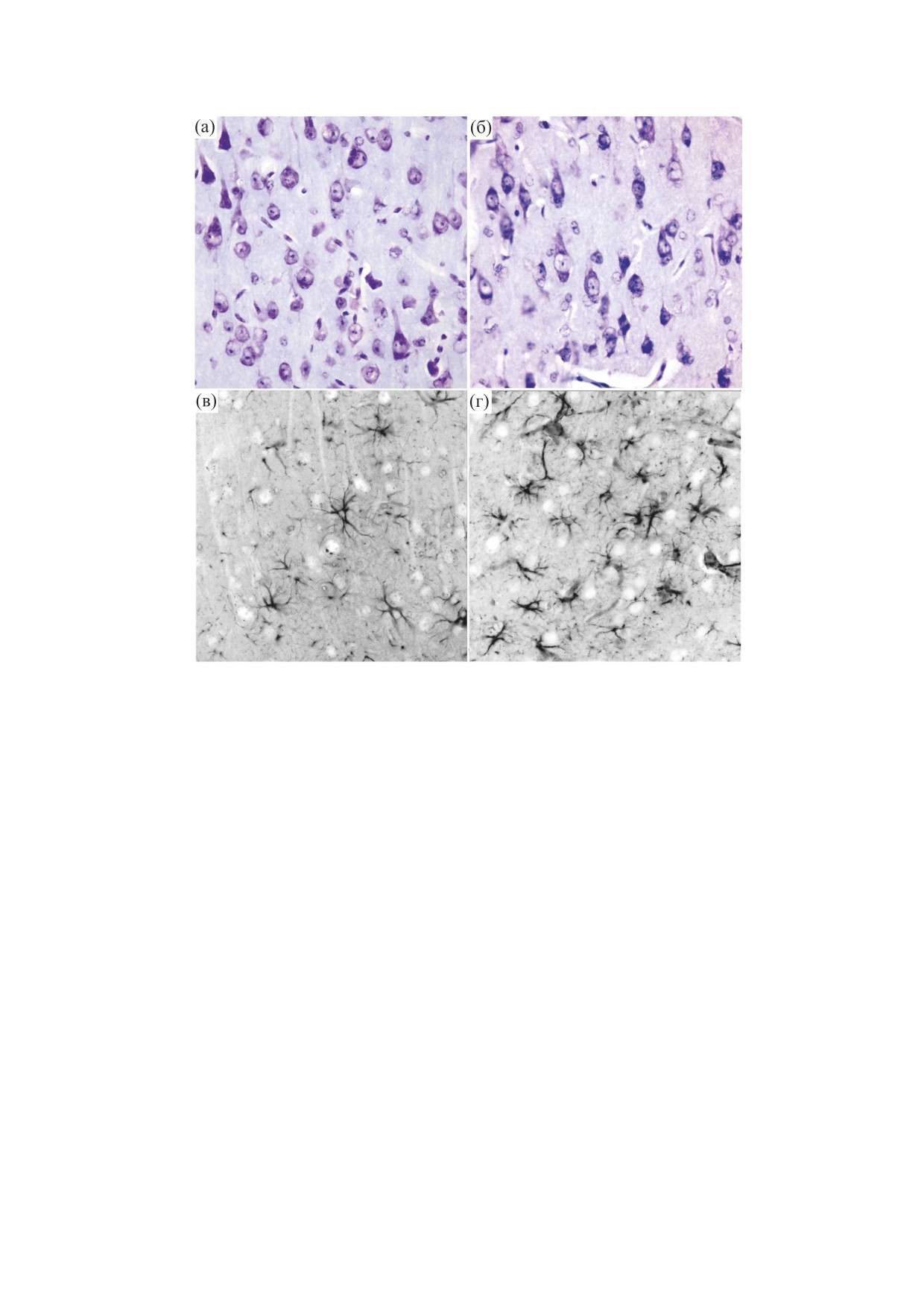
Рис. 10. Глионейрональная организация слоя V cенсомоторной коры мозга морских свинок и сусликов: (а) и (в) - сре-
зы мозга морских свинок; (б) и (г) - срезы мозга сусликов. На (а) и (б) - окрашивание нейронов методом Ниссля (чис-
ло нейронов в поле зрения (на (а) - 15.7 ± 0.11, на (б) - 15.3 ± 0.6); на (в) и (г) - иммуногистохимическое выявление
астроглии по реакции на кислый глиофибриллярный белок. Плотность глиоцитов в поле зрения: на (в) - 11.87 ± 0.11,
на (г) - 38.3 ± 0.8.
ный гипотермией, что характеризуется дальней-
нет - начало его развития представлено на рис. 9а
шим ростом спонтанной активности и падением
(4 и 5) и рис. 9б, а для его предотвращения суще-
амплитуды спайков (рис. 9а, 4 и 5). Смысл этого
ствует глиальная сеть, освобождающая экстрак-
явления связан с высоким и устойчивым повы-
леточную среду от избыточного содержания
шением наружного содержания калия, что сме-
ионов калия.
щает мембранный потенциал в сторону деполя-
Суслики - это гибернирующие животные,
значительную часть жизни проводящие при тем-
ризации. В ответ на это потенциалзависимые К+-
пературе всего на несколько градусов превышаю-
каналы открываются на длительное время, в тече-
щей нулевую отметку. Нахождение в таких усло-
ние которого ионы К+ продолжают вытекать из
виях невозможно для облигатных теплокровных.
клетки, обеспечивая еще большее увеличение его
Но у сусликов плотность глии в V слое сенсомо-
наружного содержания и еще большее падение
торной коры в три раза выше аналогичного пока-
мембранного потенциала. Возникает самопод-
зателя для морских свинок (рис. 10), т.е. исполь-
держивающийся процесс очень продолжительно-
зуется тот же протекторный механизм, как и для
го сохранения все нарастающего нарушения ка-
стареющего мозга. И если для защиты ионного
лиевого гомеостаза - процесс возвращения не-
гомеостаза в условиях старческой гипоксии плот-
равновесного распределения неорганических
ность глии растет на несколько десятков процен-
ионов к его равновесному состоянию Если этот
тов по сравнению с условиями для зрелого воз-
процесс не остановить, клетка неминуемо погиб-
раста [91], то у сусликов высокая плотность глии
БИОФИЗИКА том 66
№ 4
2021
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
771
в мозге существует постоянно, превышая ее ко-
10. В. П. Реутов, Н. В. Самосудова и Е. Г. Сорокина,
личество у морских свинок более чем на 200%.
Биофизика 64 (2), 316 (2019).
Таким образом, мозг сусликов защищен генети-
11. A. Ames III, Brain Res. Rev. 34, 42 (2000).
чески от периодического, но очень значительно-
12. S. B. Laughlin and D. Attwell, in Brain Energetics and
го выброса калия из нервных клеток, когда ско-
Neuronal Activity: Applications to fMRI and Medicine,
рость М-холинергической реакции падает из-за
Ed. by R. G. Shulman and D. L. Rothman (John Wiley
ее температурного ограничения в периоды гибер-
& Sons, Ltd., Chichester, 2004), pp. 111-124.
нации, что является причиной значительного
13. M. T. T. Wong-Riley, Trends Neurosci. 12, 94 (1989).
раскрытия К+-каналов на мембране нейронов.
Это означает, что механизм защиты ионного го-
14. Дж. Экклс, Физиология синапсов (Мир, М., 1966).
меостаза нейронов универсален - он связан с
15. S. R. Williams and G. J. Stuart, Science 295, 1907
функционированием глиальной сети мозга и
(2002).
обеспечивает постоянство мембранного потен-
16. R. J. MacGregor, Biophys. J. 8 (3), 305 (1968).
циала нейронов. Поэтому представление
Ю.В. Наточина [3] справедливо - даже очень не-
17. H. B. Пасикова, Ю. С. Медникова, Д. Н. Воронков
и др., Морфология 141 (1), 33 (2012)
большое, но устойчивое снижение мембранного
потенциала создает предпосылки для выравнива-
18. W. Rall, in Excitatory Synaptic Mechanisms, Ed. by
ния концентраций неорганических ионов с обеих
P. Andersen and J. K. S. Jansen (Universitetsforlaget,
сторон нейрональной мембраны, что несовме-
Oslo-Bergen-Tronso, 1970), pp. 175-187.
стимо с поддержанием жизни. Сохранение их не-
19. W. Rall, R. E. Burke, W.R. Holmes et al. Physiol. Rev.
равновесного состояния зависит от функции
72(Suppl), S159 (1992).
глии.
20. B. B. Шульговский, A. A. Москвитин и Б. И. Кот-
ляр, Нейрофизиология 7 (5), 468 (1975).
ФИНАНСИРОВАНИЕ РАБОТЫ
21. R. Iansek and S.J. Redman, J. Physiol. 234, 665 (1973).
Исследование проведено при многолетней
22. Ю. С. Медникова, Н. М. Захарова, Н. В. Пасикова
финансовой поддержке Российской Академии
и др., Журн. эволюц. биохимии и физиологии 33
Наук.
(4), 295 (2017).
23. E. Henneman, Science 126, 1345 (1957).
КОНФЛИКТ ИНТЕРЕСОВ
24. J. Bastian and J. Nguyenkim, J. Neurophysiol. 85, 10
(2001).
Авторы заявляют об отсутствии конфликта
интересов.
25. A. M. Hattox and S. B. Nelson, J. Neurophysiol. 98,
3300 (2007).
26. Ya. Kawaguchi, J. Neurophysiol. 69 (2), 416 (1993).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
27. P. Medini, Neuroscience 190, 112 (2011).
Настоящая работа не содержит описания ка-
ких-либо исследований с использованием людей
28. J. Kang, J. R. Huguenard, and D. A. Price, J. Neuro-
и животных в качестве объектов.
physiol. 76, 188 (1996).
29. K.-R. Kim, S. Y. Lee, S. H. Yoon, et al., J. Neurosci. 40
(11), 2200 (2020).
СПИСОК ЛИТЕРАТУРЫ
30. R. M. Leao, L. Shuang, B. Doiron, et al., J. Neurophy-
1. B. A. Barres, Neuron 60 (6), 430 (2008).
siol. 107, 3008 (2012).
2. J. B. Zuchero and B. A. Barres, Development 142, 3805
31. D. A. McCormick, B. W. Connors, W. Lighthall, et al.,
(2015).
J. Neurophysiol. 54 (4), 782 (1985).
3. Ю. В. Наточин, Вестн. РАН 77 (11), 999 (2007).
32. K. Krnjević, R. Pumain, and L. Renaud, J. Physiol.
4. P. Kofuji and E. A. Newman, Neuroscience 129, 1045
215 (1), 247 (1971).
(2004).
33. D. A. McCormick and D. A. Prince, J. Physiol. 375,
5. A. L. Hodgkin and A. F. Huxley, J. Physiol. 117 (3),
169 (1986).
500 (1952).
34. Э. В. Зеймаль и С. А. Шелковников, Мускариновые
6. D. A. Brown, Trends Neurosci. 6 (8), 302 (1983).
холинорецепторы (Наука, Л.,1989).
7. F. F. Weight, J. A. Schulman, P. A. Smith, et al., Fed.
35. P. R. Adams, D. A. Brown, and A Constanti, J. Physiol.
Proc. 38 (7), 2084 (1979).
332, 223 (1982).
8. L. Kaczmarek, M. Kossut, and J. Skangiel-Kramska,
36. D. A. Brown, in Fast and Slow Chemical Signaling in the
Physiol. Rev. 77 (1), 217 (1997).
Nervous System, Ed. by L. L. Iversen and E. Goodman
9. N. Hori, T. Galeno, and D. O. Carpenter, Cell. Mol.
(Oxford Univ. Press, Oxford, New York, Tokio, 1986),
Neurobiol. 7 (1), 73 (1987).
pp. 130-150.
БИОФИЗИКА том 66
№ 4
2021
772
МЕДНИКОВА и др.
37. М. О. Самойлов, Журн. эволюц.биохимии и фи-
65. J. Kong, P. N. Shepel, C. P. Holden et al., J. Neurosci.
зиологии 28 (2), 156 (1992).
22 (13), 5581 (2002).
38. D. A. Brown, F. C Abogadie, T. G. J. Allen, et al., Life
66. G. A. Dienel, Neurosci.Letters 637, 18 (2017).
Sci. 60 (13-14), 1137 (1997).
67. P. G. Haydon and G. Carmignoto, Physiol. Rev. 86 (3),
1009 (2006).
39. 39. Б. В. Чернышев, В. И. Майоров и А. А. Москви-
тин, Журн. высш. нерв. деятельности 48 (1), 99
68. K. П. Иванов, Основы энергетики организма. Теоре-
(1998).
тические и практические аспекты. Т.4. Энергоре-
сурсы организма и физиология выживания (Нау-
40. J. M. H. ffrench-Mullen, N. Hori, H. Nakanishi, et al.,
ка, С.-Пб., 2004).
Cell. Mol. Neurobiol. 3 (2), 163 (1983).
69. R. Jolivet, P. J. Magistretti, and B. Weber, Front. Neu-
41. J. M. Godfraind, H. Kawamura, K. Krnjević, et al., J.
roenergetics 1, Art. 4 (2009).
Physiol. 215, 199 (1971).
70. Ю. С. Медникова, Н. В. Пасикова, А. В. Исакова
42. T. G. Borda, A. M. Genaro, and G. Мremaschi, Cell.
и др., Нейрохимия 25 (1-2), 132 (2008).
Mol. Neurobiol. 20 (3), 255 (2000).
71. M. Sild, M. R. Van Horn, A. Schohl, et al., J. Neurosci.
43. Y. S. Mednikova, M. K. Kozlov, and A. N. Makarenko,
36 (19), 5279 (2016).
J. Behav. Brain Sci. 9, 33 (2019).
72. A. Verkhratsky and Ch. Steinhäuser, Brain Res. Rev.
44. L. Sokoloff, in Brain Energetics and Neuronal Activity.
32, 380 (2000).
Applications to FMRI and Medicine, Ed. by R. G. Shul-
man and D. L. Rothman (J. Wiley & Sons, Ltd., Chich-
73. G. Perea and A. Araque, Brain Res. Rev. 63, 93 (2010).
ester, 2004), pp. 11-30.
74. Yu-Wei Wu, S. Gordleeva, X. Tang, et al., Glia 67, 246
45. Г. Мэгун, Бодрствующий мозг (Иностранная лите-
(2019).
ратура, M., 1961).
75. N. Bazargani and D. Attwell, Nature Neurosci. 19, 182
46. P. Bentley, J. Driver, and R. Dolan, Progr. Neurobiol.
(2016).
94 (4), 360 (2011).
76. I. Patrushev, N. Gavrilov, V. Turlapov, et al., Cell Cal-
47. M.-M. Mesulam, E. J. Mufson, B. H. Wainer, et al.,
cium 54, 343 (2013).
Neuroscience 10 (4), 1185 (1983).
48. О. А. Гомазков, Астроциты - звезды, которые
77. J. W. Deitmer, K. Singaravelu and Ch. Lohr, in Astro-
управляют мозгом (ИКАР, М., 2018).
cytes in(Patho)Physiology of the Nervous System, Ed. by
V. Parpura and P. G. Haydon (Springer Science+Busi-
49. В. Н. Мац, Нейроглиальные соотношения в нейро-
ness Media, LLC, 2009), Chapt. 8, pp. 201-224.
кортексе при обучении (Наука, М., 1994).
50. М. Hanani and D. C. Spray, Nature Rev. 21, 485
78. G. Dupont and A. Goldbeter, Cell Calcium 14, 311
(2020).
(1993).
51. K. Meyer and B. K. Kaspar, Brain Res. 1656, 27 (2017).
79. I. Vansetta and A. Grinvald, Science 286, 1555 (1999).
52. . N. Rouach and C. Giaume, Prog. Brain Res. 132, 203
80. P. Lipton, Physiol. Rev. 79, 1431 (1999).
(2001).
81. И. Н. Боголепова и Л. И. Малофеева, Структурная
53. A. Verkhratsky, J. J. Rodriguez, and V. Parpura, Future
асимметрия корковых формаций мозга человека
Neurol. 8 (2), 149 (2013).
(Изд-во РУДН, М., 2003).
54. E. E. Benarroch, Mayo Clin. Proc. 80 (10), 1326
82. Ed. V. Evarts, J. Neurophysiol. 29 (6), 1011 (1966).
(2005).
55. A. Rodriguez and A. Ortega, Am. J. Neurosci. 3 (3), 32
83. P. Kofuji and E. A. Newman, in Astrocytes
(2012).
in(Patho)Physiology of the Nervous System, Ed. by
V. Parpura and P. G. Haydon (Springer Science+Busi-
56. A. S. Buosi, I. Matias, A. P. B. Araujo, et al., Mol. Neu-
ness Media, LLC, 2009), p. 151.
robiol. 55 (1), 751 (2018).
57. M. Tsacopoulos, J. A. Coles, and G. Van der Werve, J.
84. C. Largo, P. Cuevas, G. G. Somjen, et al., J. Neurosci.
Physiol. (Paris) 82, 279 (1987).
16 (3), 1219 (1996).
58. M. Tsacopoulos and P. F. Magistretti, J. Neurosci. 16
85. S. Duffy and B. A. MacVicar, Neuroscience 61 (1), 51
(3), 877 (1996).
(1994).
59. L. H. Bergersen, Neuroscience 145, 11 (2007).
86. E. Dossi, F. Vasile, and N. Rouach, Brain Res. Bull.
60. A. Falkowska, I. Gutowska, M. Goschorska, et al., Int.
136, 139 (2018).
J. Mol.Sci. 16, 25959 (2015).
87. Л. Д. Лукьянова, Сигнальные механизмы гипоксии
61. K. A. Kasischke, H. D. Vishwasrao, P. J. Fisher, et al.,
(РАН, М., 2019).
Science 305, 99 (2004).
88. В. Ф. Фокин и Н. В. Пономарева, Энергетическая
62. L. Pellerin and P. J. Magistretti, Science 305 (5680), 50
физиология мозга (Антидор, М., 2003).
(2004).
89. Дж. Шаде и Д. Форд, Основы неврологии (Мир, М.,
63. G. A. Dienel and N. F. Cruz, Metab. Brain Dis. 30 (1),
281 (2015).
1976).
64. R. A. Swanson, M. M. Morton, S. R. Sagar et al., Neu-
90. J. T. Coyle, D. L. Price, and M. R. Delong, Science 219
roscience 51 (2), 451 (1992).
(4589), 1184 (1983).
БИОФИЗИКА том 66
№ 4
2021
АКТИВНАЯ И ПАССИВНАЯ СОСТАВЛЯЮЩИЕ НЕЙРОНАЛЬНОГО ВОЗБУЖДЕНИЯ
773
91. И. Н. Боголепова, Л. И. Малофеева и П. А. Агапов,
93. Ю. С. Медникова и Н. В. Пасикова, Росс. физиол.
Старение мозга мужчин и женщин (РАН, М., 2019).
журн. 90 (2), 193 (2004).
92. F. Marrozu, Ch. Portas, M. S. Mascia, et al., Brain Res.
94. Ю. С. Медникова, Н. В. Пасикова, Н. М. Захарова
671 (2), 329 (1995).
и др., Росс. физиол. журн. 100 (9), 1008 (2014).
Active and Passive Components of Neuronal Excitation and Its Glial Support
Yu.S. Mednikova*, D.N. Voronkov**, R.M. Khudoerkov**, N.V. Pasikova*, and N.M. Zakharova***
*Institute of Higher Nervous Activity and Neurophysiology, Russian Academy of Sciences,
ul. Butlerova 5a, Moscow, 117485 Russia
**Research Center of Neurology, Russian Academy of Sciences, Volokolamskoye shosse 80, Moscow, 125367 Russia
***Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
Based on publications of different authors and results of own investigations the object of this article is to de-
scribe the excitation mechanisms in the nervous system and neuron-glial interactions involved in this process.
Excitation in the nervous system is formed by two processes: passive and active. The active type of excitation,
requiring energy support, is associated with the regulation of the membrane properties of neurons, which
leads to the formation of altered spontaneous impulses. The spike activity generated by the passive process is
very stable and is a consequence of the transmembrane movement of Na+ and K+ ions towards concentration
gradients. The passive type of excitation is developed due to glutamatergic contacts; the active type of exci-
tation is a diffuse release of acetylcholine from the cholinergic nuclei of the brain and attenuation of K+ mem-
brane permeability. The energetic supply of the active process of excitation occurs with the participation of
glia via the direct interaction of glial cells with the brain vessels, accumulation of glucose as a glycogen, real-
ization of the first stage of energetic metabolism - glycolysis, and regulation of local cerebral blood flow, cou-
pled to M-cholinergic excitation of neurons. With a steady decrease in the rate of the M-cholinergic process:
concentration, temperature or energetic, there is a rapid outflow of K+ ions from neurons, the removal of
which from the intercellular environment is also a function of glia.
Keywords: spontaneous activity, acetylcholine, dendrites, glial satellites, total glia, ion homeostasis
БИОФИЗИКА том 66
№ 4
2021