БИОФИЗИКА, 2021, том 66, № 5, с. 856-864
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.22/577.29
ИССЛЕДОВАНИЯ СПЕКТРАЛЬНЫХ ХАРАКТЕРИСТИК L-ЛИЗИНА
И L-АРГИНИНА С ПОМОЩЬЮ АДСОРБЦИОННОЙ, СТАЦИОНАРНОЙ
И СИНХРОННОЙ ФЛУОРЕСЦЕНТНОЙ СПЕКТРОСКОПИИ
© 2021 г. Е.Л. Терпугов*, С.Н. Удальцов**, О.В. Дегтярева*
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, ул. Институтская, 3
**Институт физико-химических и биологических проблем почвоведения РАН - обособленное подразделение ФИЦ
«Пущинский научный центр биологических исследований РАН»,
142290, Пущино Московской области, ул. Институтская, 2/2
E-mail: olga_degt@mail.ru
Поступила в редакцию 10.06.2021 г.
После доработки 24.06.2021 г.
Принята к публикации 29.06.2021 г.
Недавно обнаруженные люминесцентные свойства неароматических аминокислот с зависимой от
возбуждения фотолюминесценцией в отсутствие конъюгации внутри отдельных молекул вызвали
большой интерес. Хотя существование явления внутренней люминесценции больше не вызывает
сомнений, механизм, участвующий в этом процессе, остается неясным. В работе на примере изуче-
ния спектрально-люминесцентных свойств L-лизина и L-аргинина авторы попытались продви-
нуться в понимании этих процессов с помощью адсорбционной спектроскопии в ультрафиолето-
вом и видимом диапазонах, а также спектроскопии стационарной и синхронной флуоресцентной
спектроскопии.
Ключевые слова: моногидрохлорид L-лизина, моногидрохлорид L-аргинина, возбуждающая фотолюми-
несценция, синхронная флуоресценция, УФ/видимая спектроскопия.
DOI: 10.31857/S0006302921050033
для изучения конформационных переходов,
К важнейшим биологически активным веще-
прочности водородных связей, связанных реак-
ствам относятся аминокислоты - основные стро-
ций и других биохимических процессов [1-4].
ительные блоки белков и биополимеров, выпол-
Как правило, считается, что флуоресценция бел-
няющие самые разнообразные функции в орга-
ка происходит от аминокислот с циклическими
низмах. Критически важное для жизни значение
группами, такими как триптофан, тирозин и фе-
аминокислот обеспечивает устойчивый интерес к
их биологическим и физико-химическим свой-
нилаланин, поглощающих и излучающих эмисс-
сию в ближней ультрафиолетовой (УФ) области.
ствам. Для объяснения свойств аминокислот, а
Между тем в последнее время стало известно, что
также для выявления общих структурных законо-
триптофаноподобной флуоресценцией обладают
мерностей, характерных для аминокислот и бел-
также неароматические аминокислоты, не имею-
ков, важно знание строения и внутренней дина-
мики отдельных молекул аминокислот, а также
щие в своей структуре системы с сопряженными
двойными связями. Этот новый феномен наблю-
знание их возможных межмолекулярных взаимо-
дали не только у свободных аминокислот [5-8],
действий в конденсированном состоянии. По-
но также в полипептидах и белках, которые не со-
следняя область очень важна в направлении по-
держали в своем составе ароматические остатки
нимания физики и внутреннего механизма функ-
[9-12]. Такие свойства были обнаружены в бел-
ционирования живой системы.
ках с относительно высоким содержанием бета-
Собственная люминесценция природных бел-
сшивок в их структуре, что, как оказалось, харак-
ков дает значительную информацию об их струк-
терно для амилоидной формы белков. Явление
туре и динамике и поэтому часто используется
внутренней флуоресценции было приписано де-
локализации электронов через образование водо-
Сокращения: УФ - ультрафиолетовый, L-Lys⋅HCl - моно-
гидрохлорид L-лизина, L-Arg⋅HCl - моногидрохлорид L-
родных связей в структуре бета-сшивки, которая
аргинина.
дает возможность электронных переходов с более
856
ИССЛЕДОВАНИЯ СПЕКТРАЛЬНЫХ ХАРАКТЕРИСТИК L-ЛИЗИНА И L-АРГИНИНА
857
низкой энергией [9, 10]. Было показано, что ами-
для многокомпонентного анализа и использовался
лоидные фибриллы из различных полипептид-
для повышения селективности анализа сложных
ных последовательностей при агрегации приоб-
химических и биологических систем [13, 14]. На-
ретают собственную характерную флуоресцен-
сколько известно авторам, синхронная флуорес-
цию в видимом диапазоне. Хотя существование
ценция еще не использовалась для изучения али-
автолюминесценции как феномена у неаромати-
фатических аминокислот.
ческих аминокислот и белков, не имеющих в сво-
ем составе ароматических остатков, в настоящее
время твердо установлено, механизм, вовлечен-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ный в этот процесс, остается все еще не до конца
Химически чистые образцы L-лизина моно-
изученным.
гидрохлорида (L-Lys⋅HCl) и L-аргинина моно-
В противоположность ароматическим амино-
гидрохлорида (L-Arg⋅HCl) производства фирмы
кислотам, анализ спектров возбужденных элек-
«Реанал» (Венгрия) использовали для приготов-
тронных состояний которых удается проводить
ления растворов на основе деионизованной воды
лишь в случае растворов с низкой концентрацией,
(рН ~ 6.8) при 293 К. Чистота воды подтверждена
заметная люминесценция у неароматических ами-
величиной проводимости в 18 MΩ. Дополнитель-
нокислот была обнаружена в концентрированном
но для устранения нерастворенных твердых ча-
состоянии и практически не выявлялась в разбав-
стиц готовые приготовленные растворы пропус-
ленных растворах. Первоначально это новое свой-
кали через фильтр Millex CV с размером пор
ство было обнаружено в растворе моногидрохло-
0.22 мкм. Концентрации аминокислот составля-
рида L-лизина [5]; было сделано предположение о
ли 1.00-0.01 М для L-Lys⋅HCl и 0.5-0.01 М для
его уникальности в случае агрегации лизина, что
L-Arg⋅HCl.
подтвердили последующие эксперименты с поли-
Спектрофотометрические измерения в УФ- и
лизином [6]. Однако позже появились экспери-
видимой области были выполнены на спектрофо-
ментальные свидетельства автолюминесценции в
тометре модели UV/VIS Evolution 600 (Thermo
сильно концентрированных растворах не только
Scientific, США), люминесцентная спектроско-
лизина, но и других неароматических аминокис-
пия проведена с использованием спектрофлуори-
лот, которая могла возбуждаться не только ультра-
метра Lumina Fluorescence (Thermo Scientific,
фиолетовым, но и видимым светом [7, 8, 11, 12].
США). Были сняты спектры возбуждения и излу-
Открытие нового свойства у алифатических ами-
чения стационарной люминесценции. Во все
нокислот переворачивает представление о флуо-
спектры вносились поправки на изменения ин-
ресценции биомолекул как обусловленной исклю-
тенсивности возбуждающего света и чувствитель-
чительно присутствием «ароматики» в их структу-
ность детектора к длине волны по всему спектру.
ре. В большинстве своем исследователи полагают,
Спектры излучения флуоресценции были полу-
что автолюминесценция неароматических амино-
чены при разных длинах волн возбуждения: 280,
кислот может быть хорошо объяснена с помощью
310, 340, 355, 370 и 410 и 436 нм. Для сравнения
механизма эмиссии, инициируемой кластеризаци-
между собой все спектры изучаемых аминокислот
ей мономеров, а именно кластеризацией нетради-
впоследствии были нормированы на единицу.
ционных хромофорных (амино-, карбокси- и
Была также выполнена коррекция всех спектров
гидроксильной) групп, обусловливающей пере-
на фоновые рассеяние и люминесценцию путем
крывание электронных облаков и увеличение
вычитания спектров деионизированной воды,
делокализации электронов с одновременным уси-
полученных в идентичных условиях. Образцы
лением ригидности конформации. В действитель-
всегда были свежеприготовленными, все измере-
ности задействованные в этом новом феномене
ния проводили при комнатной температуре в
механизмы являются более сложными, чем
кварцевой кювете с длиной оптического пути
представлялось ранее. Чтобы получить больше ин-
10 мм.
формации об излучении неароматических амино-
кислот и выявить общие закономерности в люми-
Синхронные спектры флуоресценции измеря-
несценции нетрадиционных люминофоров, в
ли путем сканирования интенсивности флуорес-
настоящей работе с помощью обычной и синхрон-
ценции в диапазоне длин волн возбуждения
ной флуоресцентной спектроскопии мы изучали
(λвозб = 200-650 нм) и излучения (λизл = 200-
спектральные характеристики диаминокарбоно-
650 нм) для создания трехмерных графиков
вых аминокислот аргинина и лизина, а также их
интенсивности-возбуждения-эмиссии, которые
изменение в связи с эффектом разведения. Иссле-
обеспечивают более полное многомерное обна-
дование методом синхронной флуоресценции поз-
ружение флуоресценции. 3D-спектры регистри-
воляет выявить флуорофоры, которые слабо разре-
ровали с интервалом длин волн Δλ = 10 нм,
шимы в обычном спектре излучения флуоресцен-
скорость сканирования составляла 600 нм/с, а
ции, измеренном при фиксированной длине
напряжение ФЭУ - 700-800 В. Ширина эмисси-
волны возбуждения. Этот метод был разработан
онной щели и щели при возбуждении равнялась
БИОФИЗИКА том 66
№ 5
2021
858
ТЕРПУГОВ и др.
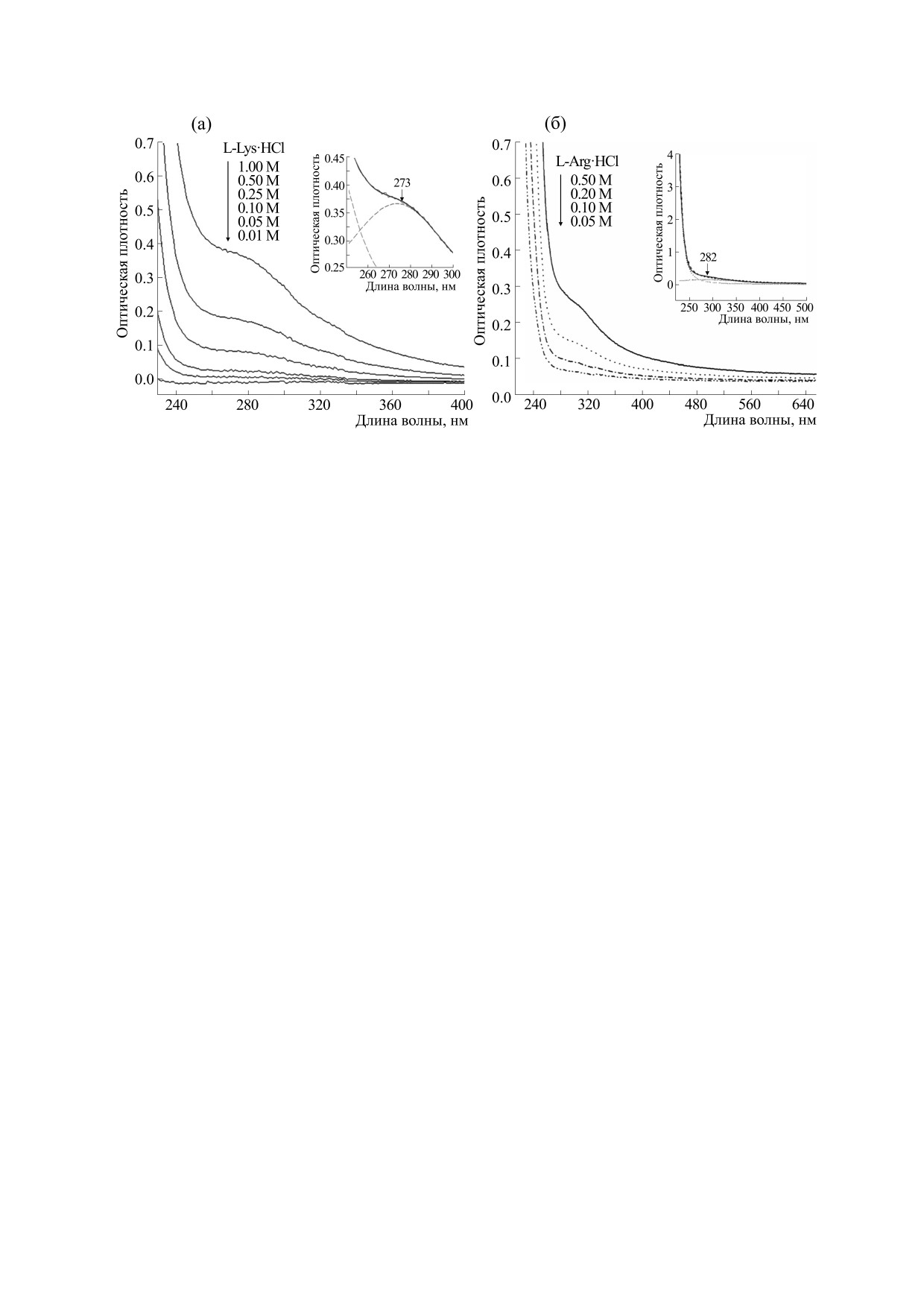
Рис. 1. (а) - Спектры поглощения L-Lys⋅HCl в концентрациях 1.0-0.01 М; на врезке - кривая поглощения L-Lys⋅HCl
и ее аппроксимация разложением на компоненты с помощью гауссовых кривых 230 и 273 нм. (б) - Спектры
поглощения L-Arg⋅HCl в концентрациях 0.5-0.05 М; на врезке - кривая поглощения L-Arg⋅HCl и ее аппроксимация
разложением на компоненты с помощью гауссовых кривых 224 и 282 нм.
5 нм. Источником возбуждения служила ксено-
он, цвиттерион, анион) и их концентрации в воде
новая лампа мощностью 100 Вт. Для измерения
может присутствовать водородная связь, которая
использовали прямоугольную геометрию. Спектр
может дать спектр, смещенный относительно
сканирования синхронной флуоресценции в
главного на определенный небольшой интервал
каждом интервале длин волн измеряли с шагом
частот. Боковые цепи этих аминокислот полярны
10 нм.
и поэтому гидрофильны. Лизин имеет первичную
аминогруппу на конце боковой цепи, аргинин -
Полученные данные обрабатывали с помощью
гуанидиновую группу. Обе концевые группы за-
программы Origin (версия 8.0).
ряжены положительно при нейтральных значе-
ниях pH. Вода как растворитель содержит ОН-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
группу, которая способна вступать в водородную
связь с концевыми имино-, амино- и карбониль-
На рис. 1 представлены электронные спектры
ными группами аминокислот, образуя различные
поглощения водных растворов L-Lys⋅HCl и
по составу и ориентации межмолекулярные со-
L-Arg⋅HCl в области 220-400 нм.
единения. Из наблюдаемых спектров было уста-
Видно, что в спектре сильно разбавленных
новлено, что с ростом концентрации аминокис-
растворов аргинина и лизина отсутствует погло-
лот происходит гигантское «красное» смещение
щение за пределами УФ-области 220 нм, что со-
нижней границы полосы и распространение ее в
ответствует представлению о светопоглощении
ближнюю УФ- и даже видимую область (выше
неароматических аминокислот в изолированном
400 нм). Одновременно с этим отмечено повыше-
состоянии. Известно, что все аминокислоты об-
ние коэффициента поглощения. Кроме того, на-
ладают одним общим свойством - отсутствием
чиная с концентрации 0.20 М, в спектрах обоих
поглощения излучения во всей видимой области
образцов выявлено появление дополнительного
спектра [15, 16]. L-лизин и L-аргинин являются
пика в области ~ 270-280 нм. Хотя подобные осо-
основными аминокислотами с боковыми цепя-
бенности спектрального поведения неароматиче-
ми, состоящими соответственно из трех и четы-
ских аминокислот были уже отмечены в первой
рех (-СН2)-групп, которые не могут поглощать в
работе по автолюминесценции лизина [5], моле-
ближней УФ-области в своей мономерной фор-
кулярный механизм этого феномена остается все
ме. Поглощение в дальней УФ-области обуслов-
еще неизученным.
лено присутствием в структуре аминокислот про-
стой хромофорной (С=О)-группы. Электронные
Спектральные свойства растворенных амино-
переходы π → π* и n → π* в карбоксильной группе
кислот в возбужденном состоянии могут отли-
происходят по ненасыщенным связям «углерод-
чаться от таковых в основном состоянии, что по-
кислород» и наблюдаются при 190-220 нм [17-
казало исследование спектральных характери-
19]. В зависимости от ионного состояния (кати-
стик возбуждаемой люминесценции L-Lys⋅HCl и
БИОФИЗИКА том 66
№ 5
2021
ИССЛЕДОВАНИЯ СПЕКТРАЛЬНЫХ ХАРАКТЕРИСТИК L-ЛИЗИНА И L-АРГИНИНА
859
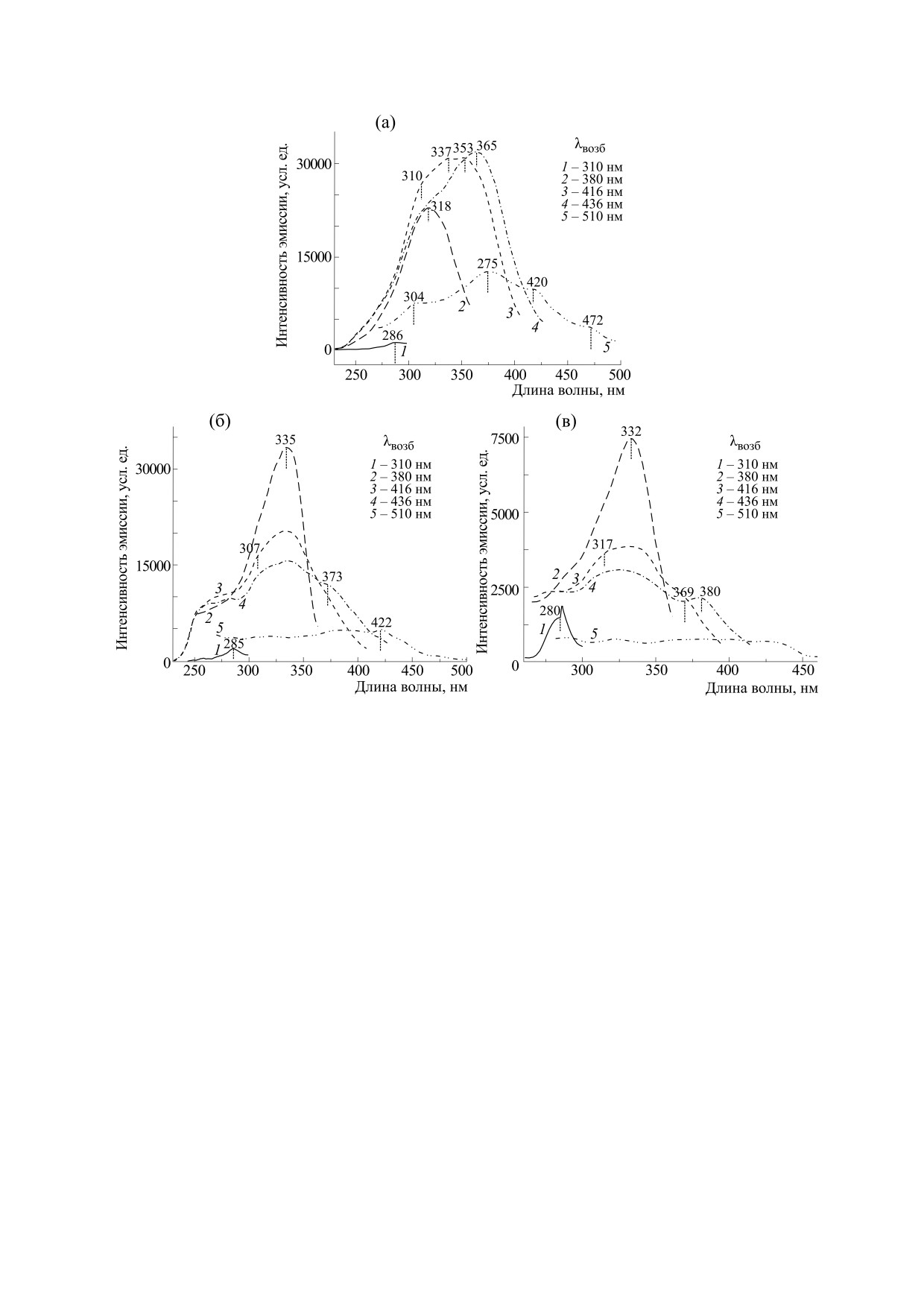
Рис. 2. Спектры возбуждения 1.0 М водного раствора L-Lys⋅HCl (а); L-Arg⋅HCl при концентрациях 0.5 М (б) и 0.05 М (в).
Спектры 1-5 записаны при длине волны возбуждения λвозб = 310, 380, 416, 436 и 510 нм соответственно.
L-Arg⋅HCl при комнатной температуре. При
который, проходя через пороговое значение, спа-
определенном в сходстве в спектральном поведе-
дал почти до уровня сигнала при длине волны
нии дикарбоновых аминокислот было также от-
возбуждения 310 нм. Максимальный уровень сиг-
мечено различие в их свойствах в возбужденном
нала в спектре возбуждения аргинина наблюдали
состоянии, что иллюстрирует рис. 2а,б, где пред-
на длине волны 370 нм, в то время как в спектре
ставлены спектры возбуждения концентрирован-
лизина - на длине волны 436 нм. Как можно ви-
ных растворов лизина и аргинина, записанные
деть на рис. 1, в этих условиях поглощение обеих
при разных длинах волн возбуждения (310, 380,
исследуемых аминокислот крайне низкое (ниже
416, 436 и 510 нм). При использовании короткой
10% от максимума), а сами спектры представляют
длины волны (310 нм) в обоих образцах была вы-
собой гладкую кривую без выраженных максиму-
явлена довольно слабая одиночная полоса с мак-
мов. Таким образом, полученные нами данные
симумом возле ~280 нм. Положение максимума
показывают, что спектры возбуждения раство-
этой полосы совпадало с локализацией пика в со-
ренных в воде аминокислот лизина и аргинина не
ответствующих спектрах поглощения, что тем са-
совпадают с их спектром поглощения и демон-
мым подтверждало присутствие в используемых
стрируют зависимость от длины волны возбужде-
растворах новой поглощающей структуры. Одна-
ния, что не характерно для спектров возбуждения
ко слабая интенсивность этой полосы свидетель-
одиночных мономеров [15]. Зависимость спек-
ствовала о крайне низкой эффективности погло-
тров возбуждения дикарбоновых кислот от длины
щения у нового образования. Интересно, что при
волны эмиссии свидетельствует прежде всего о
использовании более длинных волн возбуждения
неоднородности растворенных аминокислот и
мы наблюдали значительное усиление сигнала,
многообразии флуоресцирующих объектов, ко-
БИОФИЗИКА том 66
№ 5
2021
860
ТЕРПУГОВ и др.
торые могут возникать в результате различных
сигнала продемонстрировала зависимость спек-
взаимодействий (полярных, гидрофобных) меж-
тров возбуждения от длины волны наблюдения
ду заряженными частицами, какими являются
аналогично той, что наблюдали в исходном со-
цвиттерионы, преобладающие в жидкости при
стоянии (рис. 2в). Таким образом, в этом случае
нейтральном значении рН. Также появлению
особенности спектрального поведения раство-
этих новых образований, как мы полагаем, может
ренных аминокислот нельзя объяснить исключи-
способствовать присутствие света, который влия-
тельно агрегацией молекул. Очевидно, что свет
ет на электронную структуру цвиттерионов и из-
меняет свойства растворенных в воде аминокис-
меняет взаимодействие аминокислот между со-
лот, способствуя кластеризации изолированных
бой и с молекулами воды. Это происходит пото-
видов молекул и создавая в них локальные воз-
му, что помимо способности фотонов вызывать
бужденные состояния.
электронное возбуждение в хромофорах, свет ин-
В работе помимо спектров возбуждения были
дуцирует в среде осциллирующее электрическое
исследованы и спектры эмиссии. Как и ожида-
поле, которое может влиять на частоту колебаний
лось, наблюдаемая выше изменчивость спектров
связанных электронов, изменять внутренние ха-
возбуждения в полной мере отразилась в их спек-
рактеристики диполей в результате смещения
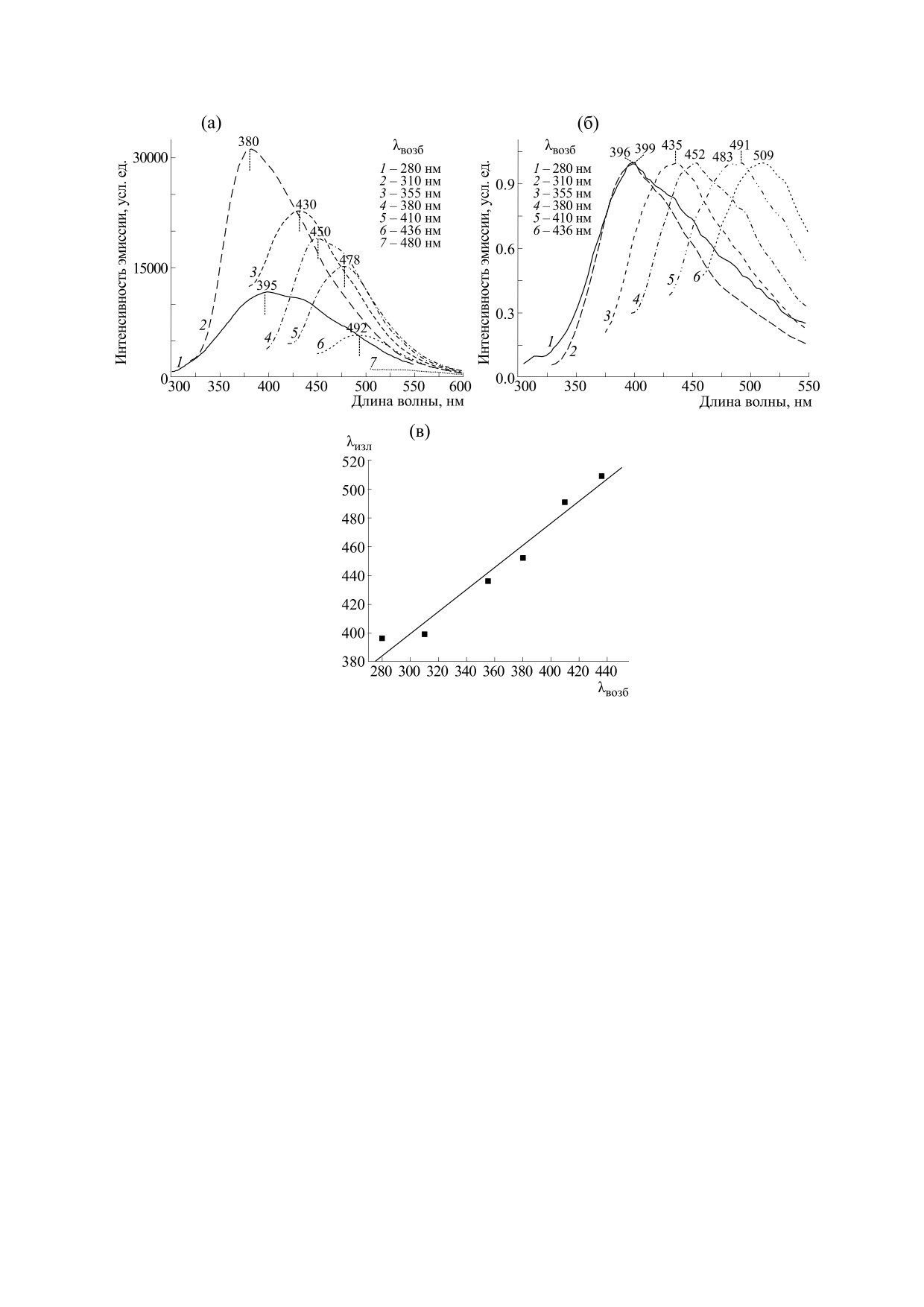
трах излучения. На рис. 3 представлены спектры
связанных зарядов и производить дипольные пе-
эмиссии 500 мМ L-Arg⋅HCl и 1М L-Lys⋅HCl, за-
реходы [20, 21]. Аминокислоты, как известно, об-
писанные при разных длинах волн возбуждения
ладают помимо постоянного наведенным ди-
(λвозб = 280, 310, 355, 380, 410, 436 и 480 нм). Как
польным моментом, т. е. под действием света ди-
видно, эмиссионные спектры сильно зависят от
польный момент возбужденного состояния
длины волны возбуждения, которая влияет не
больше, чем дипольный момент основного их со-
только на интенсивность, но и на форму спек-
стояния [22-26]. Следовательно, для стабилиза-
тральных кривых и положение главного макси-
ции системы в окружении возбужденного иона
мума. При переходе от короткой к более длинной
лизина или аргинина должна произойти соответ-
длине волны возбуждения наблюдался рост сиг-
ствующая перестройка. Ранее на примере глици-
нала, который, достигнув порога, спадал до нуле-
на было показано, что на локальном уровне элек-
вого уровня. При этом отмечалось сужение спек-
трическое поле электромагнитного излучения
тра и сдвиг главного максимума в красную об-
способно изменять дополнительный потенциал
ласть, от 381/398 к 493/504 нм для длин волн
взаимодействия, приводя к увеличению концен-
возбуждения от 310 до 435 нм соответственно для
трации и образованию молекулярных ассоциатов
аргинина и лизина. Чтобы исследовать зависи-
и даже зародышей кристаллов [27-29]. Таким об-
мость излучения от возбуждения более подробно,
разом, свет, помимо эффектов поляризации, мо-
мы построили графики длин волн пиков излуче-
жет вызывать специфические взаимодействия
ния в зависимости от длины волны возбуждения.
аминокислот между собой и/или c молекулами
Как можно видеть на рис. 3в, данные демонстри-
воды, приводящие к образованию водородных
связей и кластерных структур. И то, и другое мо-
руют четкую линейную зависимость (R2 = 0.981 и
жет влиять на их спектральные характеристики в
0.976) с крутизной 0.77 и 0.49 между длинами волн
возбужденном состоянии [19].
излучения и возбуждения для L-Lys⋅HСl и
L-Arg⋅HCl соответственно. Наклон, определяе-
Поскольку спектры возбуждения особенно
мый как изменение длины волны пикового излу-
чувствительны к взаимодействию с микроокру-
чения при изменении длины волны возбуждения,
жением, мы исследовали влияние концентрации
т.е. Δλэм/Δλвозб, остается практически постоян-
растворов исследуемых аминокислот на спек-
ным до 440 нм. Эти данные подтверждают более
тральный отклик при разбавлении растворов (в
ранние наблюдения, показывающие, что каждо-
десять и более раз), полагая, что при низких кон-
му спектру флуоресценции соответствует своя
центрациях растворенных веществ каждая моле-
длина волны возбуждения. Таким образом, при-
кула аминокислоты полностью окружена молеку-
меняя несколько длин волн возбуждения в УФ- и
лами воды, и поэтому взаимодействие между мо-
видимом спектральном диапазоне, удалось обна-
номерами экранировано молекулами воды, о чем
ружить присутствие в растворе целого ряда эндо-
свидетельствуют данные теоретических [30] и
генных флуорофоров, которые вносят вклад в на-
экспериментальных [31] работ. Следовательно,
блюдаемый флуоресцентных сигнал.
из-за недостаточной коньюгации мономеры бу-
дет трудно возбудить. В действительности же ока-
Флуоресценция как в лизине, так и в аргинине
залось, что при разбавлении растворов в десять и
наблюдалась при возбуждении как УФ-, так и ви-
более раз мы могли наблюдать хотя и слабую, но
димым светом. Хотя флуоресценция при возбуж-
вполне регистрируемую фотолюминесценцию.
дении видимым светом при 480 нм была довольно
Более того, мы не обнаружили существенного
слабая (кривая 5 на рис. 3а), чувствительность
влияния подобного разведения на спектральное
прибора позволяла достаточно надежно реги-
поведение системы, которая при меньшем уровне
стрировать ее сигнал.
БИОФИЗИКА том 66
№ 5
2021
ИССЛЕДОВАНИЯ СПЕКТРАЛЬНЫХ ХАРАКТЕРИСТИК L-ЛИЗИНА И L-АРГИНИНА
861
Рис. 3. Иллюстрация зависимоcти флуоресценции дикарбоновых аминокислот от длины волны накачки: (а) - реальные
спектры 500 мМ водного раствора L-Arg⋅HCl; (б) - нормированные спектры 1 М водного раствора L-Lys⋅HCl, записанные
при различных длинах волн возбуждения (λвозб = 280, 310, 355, 380, 410, 436 и 480 нм); (в) - линейная зависимость
максимума длины волны излучения лизина от длины волны возбуждения.
Для оценки всех присутствующих в жидкости
На полученных спектральных картах выявля-
эндогенных флуорофоров, которые вносят вклад
ются определенные «островки» интенсивности
в наблюдаемый флуоресцентный сигнал, можно
флуоресценции, которые соответствуют опреде-
использовать метод синхронной флуоресцентной
ленному флуорофору с определенным максиму-
спектроскопии, когда возбуждение и излучение
мом возбуждения и испускания, что тем самым
сканируются одновременно. Спектр излучения
подтверждает присутствие в двухкомпонентной
регистрируется для всех длин волн возбуждения
среде не одного, а целого ряда эндогенных флуо-
образца. В этом случае оба монохроматора воз-
рофоров, включая и те, которые могут возбуж-
буждения и эмиссии сканируются одновременно,
даться видимым светом, а это практически не на-
сохраняя фиксированный интервал длин волн
блюдается у ароматических аминокислот. При
между ними. Синхронное сканирование флуо-
этом отметим, что длинноволновая полоса излу-
ресценции приводит к сужению регистрируемых
чения может возникать как из длинноволнового
максимумов излучения и в целом улучшает разре-
спектра возбуждения, так и при коротковолно-
шение излучающих состояний [13, 14]. Результи-
вом возбуждении. Это означает, что испускание
рующие синхронные спектры возбуждения-ис-
пускания представлены на рис. 4 в виде трехмер-
света может быть обусловлено как структурами,
ного графика, где интенсивность испускания
которые непосредственно возбуждаются при по-
отображена в виде контурной диаграммы как
глощении света, так и другими структурами, ко-
функция длин волн возбуждения и испускания.
торые сенсибилизируются за счет безизлучатель-
БИОФИЗИКА том 66
№ 5
2021
862
ТЕРПУГОВ и др.
Рис. 4. Трехмерная контурная диаграмма возбуждения-эмиссии лизина (а) и аргинина (б) в концентрации 1 М и 0.05 М
соответственно.
ной передачи энергии возбуждения или в резуль-
структуру и динамику лизина и аргинина в воз-
тате переноса заряда.
бужденном состоянии.
Как видно на рис. 4, топографический график
На основе полученных данных можно заклю-
лизина отличается от такового для аргинина по
чить, что аминокислоты в растворе демонстриру-
распределению максимальной интенсивности
ют фотофизические свойства, подобные тем, что
флуоресценции и профилю контурных кривых,
наблюдаются у органических хромофоров, у ко-
что отражает специфику их структуры и динами-
торых эти свойства связаны с явлением двойной
ки в возбужденном состоянии.
флуоресценции [32-36]. Механизм, ответствен-
ный за двойную флуоресценцию, по своей сути
В работе этим методом был также проанализи-
противоречит хорошо установленным теориям,
рован спектральный отклик при разбавлении
таким как, например, правило Вавилова-Каши
растворов. Результирующие спектры представле-
[14, 19], согласно которому независимо от длины
ны на рис. 5. Согласно полученным данным, не-
волны возбуждения излучение флуоресценции в
однородность популяции излучающих видов обо-
молекуле красителя происходит всегда с самого
их образцов сохраняется также и в разбавленном
нижнего синглетного уровня, поэтому для одного
состоянии (рис. 5). Однако топографические гра-
типа молекул полоса возбуждения одного перехо-
фики разбавленных растворов несколько отлича-
да приводит к одной полосе излучения и спектр
ются от приведенных выше для концентрирован-
излучения одного перехода не показывает зави-
ных растворов, что может быть результатом раз-
симости от длины волны. В то же время показано,
личного влияния среды на электронную
что явлению двойной флуоресценции способ-
Рис. 5. Трехмерная контурная диаграмма возбуждения-эмиссии лизина (а) и аргинина (б) в концентрации 0.1 М и 0.005 М
соответственно.
БИОФИЗИКА том 66
№ 5
2021
ИССЛЕДОВАНИЯ СПЕКТРАЛЬНЫХ ХАРАКТЕРИСТИК L-ЛИЗИНА И L-АРГИНИНА
863
ствует образование водородных связей и возник-
11. A. Shukla, S. Mukherjee, S. Sharma, et al., Arch. Bio-
новение состояний с переносом заряда [32-36].
chem. Biophys. 428, 144 (2004).
12. S. Prasad, I. Mandal, S. Singh, et al., Chem. Sci. 8,
5416 (2017).
ЗАКЛЮЧЕНИЕ
13. T. Vo-Dinh, Appl. Spectrosc. 36, 576 (1982).
Таким образом, исследование аминокислот и
14. J. Lakowicz, Principles of Fluorescence Spectroscopy
их хромофорных групп является одним из наибо-
(Springer, Boston, MA, 2006).
лее интересных направлений, которое может
15. V. M. Parkin, Absorption spectroscopy of organic mole-
пролить света на дальнейшее понимание эндо-
cules (Addison-Wesley Publ. Comp., Lond., 1974).
генной люминесценции биомолекул и механиз-
16. Д. Браун, А. Флойд и М. Сейнбери, Спектроскопия
мов функционирования биологических систем на
органических веществ (Мир, М., 1992).
молекулярном уровне. Это также представляется
важным с точки зрения разработки новых диа-
17. T. Goto and A. Ikehata, in Far and Deep-Ultraviolet
гностических средств в ближней УФ- и видимой
Spectroscopy, Ed. by Yu. Ozaki and S. Kawata (Springer
области.
Japan, Tokyo, 2015), pp. 67-69.
18. J. S. McConnell, R. M. McConnel, and L. R. Hossner,
Proc. Arkansas Acad. Sci. 47, 73 (1993).
БЛАГОДАРНОСТИ
19. А. Н. Теренин, Фотоника молекул красителей и
Авторы выражают свою благодарность за по-
родственных органических соединений (Наука, Л.,
мощь в работе сотрудникам Н.К. Призовой и
1967).
Л.М. Хайбулаевой. Работа была выполнена с ис-
20. М. Борн и Э. М. Вольф, Основы оптики (Наука,
пользованием оборудования Сектора оптической
М., 1973).
микроскопии и спектрофотометрии ЦКП
21. C. Z. Tan, Physica B 269, 373 (1999).
22. D. V. Bent and E. Hayon, J. Am. Chem. Soc. 97, 2612
(1975).
КОНФЛИКТ ИНТЕРЕСОВ
23. D. V. Bent and E. Hayon, J.Am. Chem. Soc. 97, 2599
Авторы заявляют об отсутствии конфликта
(1975).
интересов.
24. D. V. Bent and E. Hayon, J. Am. Chem. Soc. 97, 2606
(1975).
25. G. Khanariam and W. J. Moore, Austr. J. Chem. 33,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
1727 (1980).
Настоящая работа не содержит описания ис-
26. 26. F. Hausen, L. Jensen, P.-O. Astrand, et al., J.
следований с использованием людей и животных
Chem. Theory Comput. 1, 626 (2005).
в качестве объектов.
27. B. A. Garetz, J. Matic, and A. S. Myerson, Phys. Rev.
Lett. 89, 175501 (2002).
СПИСОК ЛИТЕРАТУРЫ
28. О. В. Дегтярева, В. Н. Афанасьев, Н. Н. Хечина-
швили и Е. Л. Терпугов, Современные проблемы
1. E. A. Permyakov, Luminescent Spectroscopy of Proteins
науки и образования, № 4, 10010 (2013).
(CRC Press, Taylor and Francis Group, Boca Raton,
1993).
29. E. L. Terpugov, M. S. Kondratyev, and O. V. Degtyare-
va, J. Biomol. Struct. Dyn. 39 (1), 108 (2020). DOI:
2. C. A. Royer, Chem. Rev. 106, 1769 (2006).
10.1080/07391102.2020.1717628
3. D. Zhong, in Advances in Chemical Physics, Ed. by
30. А. Panuszko, B. Adamczak, J. Czub, et al., Amino Ac-
S. A. Rice (J. Wiley & Sons Inc., Hoboken, NJ, USA,
ids 47, 2265, (2015).
2009), pp. 83-149.
4. P. R. Callis, J. Mol. Struct. 1077, 22 (2014).
31. М. В. Агупова, О. В. Бобрешова и С. И. Карпов,
Сорбционные и хроматографические процессы 8
5. L. Homchaudhuri and R. Swaminathan, Chem. Lett.
(1), 117 (2008).
30, 844 (2001).
32. K.-M. Lee, W.-Y. Cheng, Ch.-Yu. Chen, et al., Nature
6. L. Homchaudhuri and R. Swaminathan, Bull. Chem.
Commun. 4, 1544 (2013).
Soc. Jpn. 77, 765 (2004).
7. B.-H. Chai, J.-m. Zheng, Q. Zhao, and G. H. Pollack,
33. 33. C. J. Jödicke and H. P. Lüthi, J. Am. Chem. Soc.
J. Phys. Chem. A, 112, 2242 (2008).
125 (1), 252 (2003).
8. C. Niyangoda, T. Miti, L. Breydo, et al., PLoS One 12
34. P. T. Chou, M. L. Martinez, and J. H. Clements, J.
(5), e0176983 (2017).
Phys. Chem. 97 (11), 2618 (1993).
9. X. Chen, W. Luo, H. Ma, et al., Sci. China Chen 61,
35. A. D. Gorse and M. Pesquer, J. Phys. Chem. 99 (12),
351 (2018).
4039 (1995).
10. P. Guptasarma, Arch. Biochem. Biophys. 478, 127
36. T. Chatterjee, M. Mandal, A. Das, et al., J. Phys.
(2008).
Chem. B 120, 3503 (2016).
БИОФИЗИКА том 66
№ 5
2021
864
ТЕРПУГОВ и др.
Study of Spectral Characteristics of L-Lysine and L-Arginine Using UV-VIS
Spectroscopy, Steady-State Fluorescence Spectroscopy
and Synchronous Fluorescence Spectroscopy
E.L. Terpugov*, S.N. Udaltsov**, and O.V. Degtyareva*
*Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Institute of Physicochemical and Biological Problems in Soil Science, Russian Academy of Sciences,
Institutskaya ul. 2/2, Pushchino, Moscow Region, 142290 Russia
Recently discovered luminescence properties of non-aromatic amino acids, with excitation-dependent pho-
toluminescence in the absence of conjugation within individual molecules, have attracted a great deal of in-
terest. There is no doubt that intrinsic luminescence phenomenon is a reality, but so far the mechanism
involved in this process is not yet defined. In this study, spectral-luminescence properties of L-lysine and
L-arginine were investigated to provide an in-depth understanding of these processes by using UV-VIS spec-
troscopy, steady-state fluorescence spectroscopy and synchronous fluorescence spectroscopy.
Keywords: L-lysine monohydrochloride, L-arginine monohydrochloride, excitation-dependent photolumines-
cence, synchronous fluorescence, UV-VIS spectroscopy
БИОФИЗИКА том 66
№ 5
2021